הבדלים בין גרסאות בדף "קרטן סולפט - Keratan sulfate"
| שורה 55: | שורה 55: | ||
==הביוסינתזה של KS== | ==הביוסינתזה של KS== | ||
| − | אנזימים ביוסינתטיים: KS מתארך על ידי הפעילות של גליקוזיל-טרנספראזות המוסיפים לסירוגין galactose ו-GlcNAc לפולימר ההולך וגדל. פעילות gal-transferase בתאי הקרנית דומה לזו של האנזים β-1,4-galactosyltransferase (הידוע גם כ-β4Gal-T1) הפעיל בנסיוב ובחלב (Christner וחב' ב-Arch Biochem Biophys משנת 1979). | + | '''אנזימים ביוסינתטיים''': KS מתארך על ידי הפעילות של גליקוזיל-טרנספראזות המוסיפים לסירוגין galactose ו-GlcNAc לפולימר ההולך וגדל. פעילות gal-transferase בתאי הקרנית דומה לזו של האנזים β-1,4-galactosyltransferase (הידוע גם כ-β4Gal-T1) הפעיל בנסיוב ובחלב (Christner וחב' ב-Arch Biochem Biophys משנת 1979). זוהתה משפחה של לפחות 7 גנים של β4Gal-T (Amado וחב' ב-Biochim Biophys Acta משנת 1999). במהלך התפתחות עוברי אפרוחים נרשמה בקרנית הגברה של ריכוז עותקי β4Gal-T במקביל לסינתזה של KS בקרנית. הפעילות של אנזים זה נותרה גבוהה במיוחד בתאי הקרנית הבוגרים (Cai וחב' ב- Exp. Eye Res משנת 1996). השוואה עם רצפים ידועים של cDNA מראה ש- β4Gal-T זהה ל-β4Gal-T1. פעילות β4Gal-T1 ממשיכה להיות מוגברת בתאי קרנית בתרבית שאבדו את היכולת לסנתז KS. למרות ש-β4Gal-T1 מצטייר כאנזים הקשור לסינתזה של KS בקרנית , אנזים ספציפי זה לא נכרך עם ביוסינתזה של KS ברקמות אחרות. |
| − | האנזים הספציפי N-acetylglucosaminyltransferase (או GnT) האחראי לסינתזה של KS לא זוהה עדיין. ידועים מספר אנזימי GnT, ששניים מהם נראים מועמדים סבירים. האנזים המאוד נפוץ iGnT נמצא משתתף בסינתזה של ה-polylactosamine הלינארי הידוע כ- | + | |
| + | האנזים הספציפי N-acetylglucosaminyltransferase (או GnT) האחראי לסינתזה של KS לא זוהה עדיין. ידועים מספר אנזימי GnT, ששניים מהם נראים מועמדים סבירים. האנזים המאוד נפוץ iGnT נמצא משתתף בסינתזה של ה-polylactosamine הלינארי הידוע כ-i"-antigen" {{כ}}(Sasaki וחב' ב-Proc Natl Acad Sci USA משנת 1997). עותקי RNA של אנזים זה נמצאו מועשרים במוח, רקמה בה KS מסונתז באופן פעיל. זוהה אנזים GnT שני (β3GnT) הפעיל בסינתזה של polylactosamine לינארי, והוא אף שובט (Zhou וחב' ב-Proc Natl Acad Sci USA משנת 1999). אך אין כל הוכחה הכורכת GnT ספציפי עם סינתזה של KS. | ||
| + | |||
הסולפציה של KS בקרנית מסתייעת על ידי לפחות 2 אנזימים מסוג sulfotransferase (Ruter ו-Kresse ב- Keratan Sulphate. Chemistry, Biology, Chemical Pathology. The Biochemical Society, London משנת 1984). שני אנזימים זוהו ושובטו, כאלה המוסיפים סולפאט ל-KS (Habuchi וחב' ב-Glycobiology משנת 1996, ו-Fukuta וחב' ב-J Biol Chem משנת 1997). אחד מ-2 אנזימים אלה מוסיף סולפאט לשיירי GalNAc של chondroitin sulfate וכן לשייר galactose של KS. האנזים השני גם כן מוסיף סולפאט ל-galactose של KS אך אינו פועל על chondroitin sulfate. כן נמצא ש-mRNA של sulfotransferase ספציפי ל-KS מבוטא באופן בולט במוח ובקרנית. נראה אם כן סביר ש- sulfotransferaseזה מייצג אנזים הקשור לביוסינתזה של KS. | הסולפציה של KS בקרנית מסתייעת על ידי לפחות 2 אנזימים מסוג sulfotransferase (Ruter ו-Kresse ב- Keratan Sulphate. Chemistry, Biology, Chemical Pathology. The Biochemical Society, London משנת 1984). שני אנזימים זוהו ושובטו, כאלה המוסיפים סולפאט ל-KS (Habuchi וחב' ב-Glycobiology משנת 1996, ו-Fukuta וחב' ב-J Biol Chem משנת 1997). אחד מ-2 אנזימים אלה מוסיף סולפאט לשיירי GalNAc של chondroitin sulfate וכן לשייר galactose של KS. האנזים השני גם כן מוסיף סולפאט ל-galactose של KS אך אינו פועל על chondroitin sulfate. כן נמצא ש-mRNA של sulfotransferase ספציפי ל-KS מבוטא באופן בולט במוח ובקרנית. נראה אם כן סביר ש- sulfotransferaseזה מייצג אנזים הקשור לביוסינתזה של KS. | ||
| − | KS מכיל סולפאט גם על שיירי GlcNAc וסביר שאנזים ספציפי אחראי לפעילות זו. נמצא שפעילות האנזים GlcNAc-6-sulfotransferase (או Gn6ST) בתמצית תאים קרטוציטים גורמת לסולפציה ספציפית של הקצה הלא-מחזר GlcNAc(β1–3)Gal-R (Nakazawa וחב' ב- Arch Biochem Biophysמשנת 1998). ה-cDNAs של 2 אנזימי Gn6ST עם ספציפיות לקצה הלא-מחזר GlcNAc זוהו ושובטו (Uchimura וחב' ב-J Biol Chem משנת 1998, ו-Lee וחב' ב- Biochem Biophys Res | + | |
| + | KS מכיל סולפאט גם על שיירי GlcNAc וסביר שאנזים ספציפי אחראי לפעילות זו. נמצא שפעילות האנזים GlcNAc-6-sulfotransferase (או Gn6ST) בתמצית תאים קרטוציטים גורמת לסולפציה ספציפית של הקצה הלא-מחזר GlcNAc(β1–3)Gal-R (Nakazawa וחב' ב- Arch Biochem Biophysמשנת 1998). ה-cDNAs של 2 אנזימי Gn6ST עם ספציפיות לקצה הלא-מחזר GlcNAc זוהו ושובטו (Uchimura וחב' ב-J Biol Chem משנת 1998, ו-Lee וחב' ב- Biochem Biophys Res Commun משנת 1999). עם זאת השאלה נותרת פתוחה האם אחד מאנזימים אלה משתתף בסינתזה של KS. מטופלים עם macular corneal dystrophy, מחלה בה KS חסר סולפציה של GlcNAc בגוף כולו, הם בעלי רמות פעילות של אנזים זה בנסיוב (Hasegawa וחב' ב-J Biochem משנת 1999). משמעות ממצאים אלה היא שאנזים עם ספציפות דומה ויקום רקמתי מוגדר עשוי להיות קשור לסינתזה של KS. הספציפיות של האנזים Gn6ST מרמזת לכל שהסולפציה של KS GlcNAc, יכולה להתרחש באופן סימולטני רק בשיירי קצה של השרשרת המתארכת (Degroote ב-J Biol Chem משנת 1997, ו-Uchimura וחב' ב-Glycobiology משנת 1998). | ||
==חלבונים אליהם קשור KS== | ==חלבונים אליהם קשור KS== | ||
גרסה מ־16:58, 26 בספטמבר 2017
| מדריך בדיקות מעבדה | |
| קרטן סולפט | |
|---|---|
| Keratan sulfate | |
| שמות אחרים | MPS IVA, N-acetylgalactosamine-6-sulfate sulfatase |
| מעבדה | כימיה בשתן |
| תחום | אחד ה-glycosaminoglycans (GAG) במחלת אגירה ממשפחת המוקופוליסכרידוזות (MPS) |
| טווח ערכים תקין | 0-12 months: < or =2.50 mg/mmol creatinine; 13-24 months: < or =2.00 mg/mmol creatinine; 25 months-4 years: < or =1.50 mg/mmol creatinine; 5-10 years: < or =1.00 mg/mmol creatinine; -18 years: < or =0.80 mg/mmol creatinine11; >18 years: < or = 0.50 mg/mmol creatinine |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
ניטור של ההשפעות הפרמאקו-דינמיות של תוספי האנזים החסר במחלת Morquio A (MPS IVA) .
מידע קליני
המוקופוליסכריזודות (MPS) היא קבוצה של מפגעים הנגרמים כתוצאה מפגם באחד מהאנזימים המשתתפים בפירוק של ה-GAGs הבאים: dermatan sulfate, heparan sulfate, keratan sulfate או chondroitin sulfate. GAGs שאינם מתפרקים או שהם מפורקים באופן חלקי בלבד, נאגרים בליזוזומים ומופרשים בשתן. אגירה של GASGs בליזוזומים מפריעה לתפקוד התקין של תאים, רקמות ואיברים, מה שגורם לתסמינים קליניים המאפיינים את מפגעי MPS. ידוע על 11 חסרים אנזימטיים העלולים לגרום ל-MPS.
תסמונת Morquio או mucopolysaccharidosis IV נגרמת על ידי פגיעה בפירוק של keratan sulfate בגין החסר של האנזים N-acetylgalactosamine 6-sulfatase ב-MPS IVA, או בגין חסר שלβ-galactosidase ב-MPS.IVB Keratan sulfate , וכן chondroitin-6-sulfate במקרה של MPS IVA, מצטברים בתאים והעודף מופרש בשתן. מאפיינים קליניים של Morquio A ו-B, כוללים גמדוּת, דיספלזיה של השלד (spondyloepiphyseal) השונה מזו שמוצאים ב-MPS אחרים, קרנית עכורה, פגיעה בשיניים, נגעים לבביים, hepatomegaly, ועם זאת אינטליגנציה תקינה. דרגת החומרה מגוונת מאוד ב-2 סוגי המחלה, וכללית חומרת התסמינים מתונה יותר ב-Morquio B. השכיחות של תסמונות MPS IVA ו- MPS IVB נעה בין מקרה אחד לכל 200,000-300,000 לידות-חי. תרפיה על ידי מתן האנזים החסר (enzyme replacement therapy) זמינה במקרים של Morquio A, אם כי במקרים של Morquio B יעילותה מוגבלת. טיפול אנזימטי זה נמצא מפחית את רמת keratan sulfate בשתן של המטופלים עם Morquio A, אך היעילות הקלינית שנויה במחלוקת.
שבעה עשורים של keratin sulfate
Keratan sulfate (להלן KS) זוהה לראשונה בשנת 1939 על ידי Suzuki בתמצית של קרנית העין מה שדווח ב-J Biochem באותה שנה. בשנות ה-50 היו אלה Karl Meyer ואחרים שאפיינו את התרכובת כפולימר ליניארי של lactosamine (3Galβ1–4GlcNAcβ1) שעבר סולפציה בעמדה C6 של שתי מולקולות ה-hexose (Meyer וחב' ב-J Biol Chem משנת 1953). במרוצת העשורים שחלפו העניין ב-KS הלך והתגבר, ומספר הפרסומים עליו גדל פי-5 משנות ה-70 ועד סוף שנות ה-90. בין המאמרים המכוננים על המבנה והביוסינתזה של KS נזכיר את אלה של Hascall ב- Prog. Clin. Biol. Res משנת 1982, Nieduszynski וחב' ב- Biochem. Soc. Trans משנת 1990, ו-Funderburgh וחב' ב- Biochem. Soc. Trans. משנת 1991.
סוגי KS
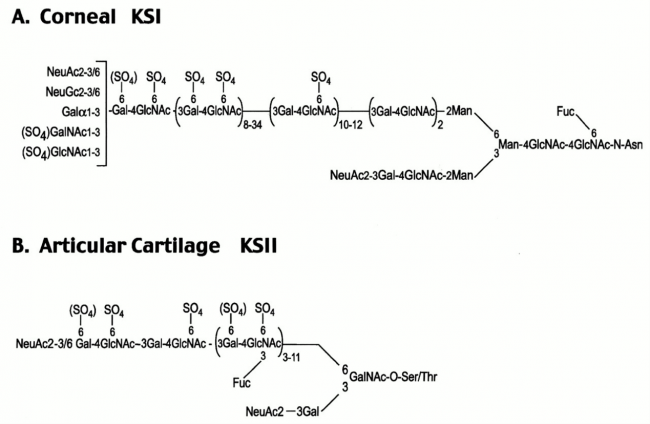
במקור ההגדרות של KSI ו-KSII היו מבוססות על ההבדלים בין KS ממקור קרנית העין ו-KS ממקור סחוס. KS בקרנית קשור בקשר N לשייר aspargine בחלבון הליבה, בעוד ש-KS בסחוס קשור בקשר O לשיירי serine או threonine. שני קשרים אלה אינם ספציפיים לרקמה זו או אחרת מבחינת מיקומם. ההגדרות הנמצאות בשימוש הן KSI הכולל את כל מולקולות KS הקשורות לאספרגין, ו-KSII מתייחס לכל מולקולות KS הקשורות לחלבון בקשר GalNAc-O-Ser/Thr. סוג שלישי של קשר KS זוהה אף הוא כאשר הסוכר mannose קשור ל-serine בקשר O - גליקוזידי, והוא מוגדר כ-KSIII (Krusius וחב' ב-J Biol Chem משנת 1986).
KSI של קרנית העין
סוג זה של KS בקרנית העין הוא הפרוטוטיפ של KSI והוא גם הסוג הנחקר ביותר. כמות ה-KS בקרנית גדולה פי-10 ויותר מכמות KS בסחוס, והיא גדולה ב-2-4 סדרי גודל מאשר כמותו ברקמות אחרות (Funderburgh וחב' ב-J Biol Chem משנת 1987). הקשר בין KSI לחלבון בקרנית העין הוא מורכב, בו האוליגוסכריד במבנה biantennary קשור בקשר N לאספרגין בחלבון הליבה (Oeben וחב' ב-Biochem J משנת 1987 כפי שמודגם בתמונה למטה).
דיווחים אחדים מראים שהסתעפות C3 בקשר האוליגוסכרידי יכולה להיות ארוכה יותר בדומה להסתעפות C6. אכן אנליזה מבנית של KS מקרנית של קופים לא מצאה כל הוכחה לכך שהסתעפות היא קצרה ומסתיימת כמקובל על ידי חומצה סיאלית טרמינאלית (Nilsson וחב' ב-J Biol Chem משנת 1983).
ראיות להארכה של מזלג דו-שרשרתי (biantennary) של הקשר האוליגוסכרידי, מגיעות גם בהשוואת המשקל המולקולארי של KS ממקור בקר המשתחרר על ידי האנזים N-glycanase לזה של השרשרת המלאה של KS (על פי Tai וחב' ב-J Biol Chem משנת 1996). בנוסף, הסינתזה KS ממקור קרנית או זו של KS על fibromodulin (שהוא פרוטאוגליקן ממקור סחוס בו KS קשור בקשר N-type 1), לא נחסמה באופן מלא על ידי swainsonine, שהוא מעכב של העיבוד של זרוע C6 של הקודמן (precursor) של האוליגוסכריד, מה שמצביע על כך ש-KS חייב להתארך על זרוע C3 של הליבה המכילה mannose (על פי Ziegler ו-Mersmann ב-Biochim Biophys Acta משנת 1984, ו-Plaas ו-Wong-Palms ב-J Biol Chem משנת 1993).
ההוכחה להתארכות biantennary של הקשר של KSI מגיעה מניסויים בהם פרוטאוגליקן קשור ל-KS ממקור קרנית בקר, שטופל על ידי endo-beta-galactosidase, סומן בשייר GlcNAc שנבקע, וכן סומן בשיירי חומצה סיאלית בטיפול מתון של periodate (על פי Funderburgh וחב' ב-J Biol Chem משנת 1991). פפטידים תוצרי ביקוע טריפטי מחלבונים מסומנים אלה זוהו בהם הסימון הופיע כצפוי ב-KS ובשיירי חומצה סיאלית. מחקרים אלה מראים שההתארכות המונו- והבי-אנטנרי עשויה להופיע ב-KSI, ומיקום הקשר על פני החלבון עשוי להשפיע על סוג ההתארכות. הטרוגניות מוצאים גם באזור הקשר של המבנה הסוכרי לחלבון ZP3, המופיע ב-zona pellucida בו הקשר הוא מסוג N. ב-ZP3, ה-KS יכול לשנות את C3, או את C6 או את 2 הזרועות של המבנה האוליגו-סכרידי הבי-אנטנרי (Noguchi ו-Naakno ב-Eur J Biochem משנת 1992).
Oeben וחב' ב-Biochem J משנת 1987, גילו שהסולפציה של KS ממקור קרנית של חזיר, מופיעה באתרים מוגדרים ולא אקראיים. דיסכרידים הקרובים ביותר לקצה המחזר של החלבון לא הכילו שיירי סולפאט, ומרוחקים מהם מוצאים דיסכרידים עם שיירי סולפאט רק על הסוכר GlcNAc. הקצה הלא מזר של שרשרות KS מקרנית חזיר, הכילו מקטעים באורכים שונים (8-34 יחידות) של דיסכרידים שעברו סולפציה. יש גם השערה שה-N-sulfation של GlcN, יכולה להתרחש במקטעים עשירים בסולפאט של KS מהקרנית (Tang וחב' ב-Eur J Biochem משנת 1986). ב-KS מקרנית בקר בערך 70% מהשרשרות מסתיימות עם חומצה סיאלית, אשר השרשרות החרות מסתיימות עם alfagal או עם betaGalNAc (על פי Tai וחב' ב-J Biol Chem מהשנים 1996 ו-1997).
KSI שלא ממקור קרנית העין
Fibromodulin, וכן PRELP ו-osteoadherin הם חלבונים בסחוס ובעצם, בהם גם כן מוצאים שרשרות KS בקשר N עם שינויים קלים (Antonsson וחב' ב-J Biol Chem Urine משנת 1991, Bengtsson וחב' ב-J Biol Chem משנת 1995 ו-Sommarin וחב' ב-J Biol Chem משנת 1998). מספר חלבונים בשכבת ה-Zona pellucida בשחלה (כגון הגליקופרוטאין PZP3) נושאים סכרידים הנחשבים כ-KS (Noguchi ו-Nakano ב-European J Biochem משנת 1992). גם הפרוטאו-גליקן הסחוסי הידוע כ-aggrecan מכיל שרשרות KS הקשורות בקשר N 2-3 , בנוסף ל-20 או יותר חלבונים של הקשר הוא מסוג O (Barry וחב' ב-J Biol Chem משנת 1995). KS עם קשרי N בודד מהדרמיס של דגי mackerel (Ito וחב' ב-Histochem J משנת 1996). בנוסף לדוגמאות אלה של KSI שלא ממקור קרנית, sulfated lactosamine הוא מרכיב שכיח של פני תאים ושל גליקופרוטאינים חוץ-תאיים. אחדים מתוצרי סולפציה זו, כוללים מבנים מסוג O-linked Lewis x, השונים מ-KS בכך שהסולפציה בהם מתרחשת רק בנקודות הקצה הלא מחזרות של השרשרת הסכרידית, ולעומת זאת מחובר בהם שייר fucose ל- GlcNAc הטרמינלי (Hemmerich וחב' ב-J Biol Chem משנת 1995 ו-Capon וחב' ב-J Biol Chem משנת 1997).
למרות שהקשרים של החלקים הסכרידיים לחלבון הליבה ב-KSI אינם ספציפיים לרקמות מסוימות, מאפיינים אחרים של KS ברקמות השונות מקרנית העין, נובעים מהמודל של הקרנית. שרשרות ה-KS ב-fibromodulin וב-osteoadherin קצרות יחסית (מכילות 8-9 דיסכרידים) והן מכילות שיירי סולפאט רבים יותר מאשר KS בקרנית (Lauder וחב' ב-Proc Natl Acad Sci USA משנת 1997). KS ב-fibromodulin בדומה ל-KS מהקרנית, מכיל שיירי galactose מעטים יותר שעברו סולפציה ליד קצות השרשרת הסוכרית. כללית, KS של fibromodulin דומה יותר לזה של הסחוס בהשוואה לה של הקרנית.
KSII
המבנה של KS מהסחוס הארטיקולארי בבקר, מתואר בחלק 1B של התרשים. השרשרות קצרות מאלו של KS בקרנית (5-11 דיסכרידים). KSII עבר סולפציה ניכרת, ומורכב באופן כמעט מלא ממונומרים עם 2 שיירי סולפאט, ומדי פעם מופיע ב-KS זה מונומר עם שייר סולפאט יחיד של יחידת לקטוזאמין. הקישור לחלבון הוא דרך serine או threonine ומערב גם פוליסכריד מסוג mucin הידוע כ-Core 2 oligosacchride. הסיאלילציה של ה-galactose הקשור ל-C-3 של חיבור ה-GlcNAc היא רק חלקית.
השרשרות של KS מכילות חומצה סיאלית כסוכר קצה בעמדות C3 ו-C6 של ה-GlcNAc הטרמינאלי. סוכר fucose קשור בקשר α מופיע גם הוא בעמדה C3 של GlcNAc שעבר סולפציה לאורך כל השרשרת הסוכרית אך לא ב-4 שיירי hexose בקצה הלא מחזר (Brown וחב' ב-Biochem J משנת 1996). תכונה זו מבדילה את מולקולות KS מהאנטיגן Lewis X שמכיל שיירי fucose על סוכר GlcNAc בעמדת penultimate בקצה הלא-מחזר. גליקופורמים דמויי KS אלה מופיעים על פני תאי אנדותל ומשמשים כליגנדים של selectin (על פי Tangemann וחב' ב-J Exp Med משנת 1999). בצינור הנשימה, ה-KS אינו עובר fucosylaion של GlcNAc פנימי, ונושא רק חומצה סיאלית בקשר 2 →3 בעמדת הקצה של השרשרת הסוכרית (Nieduszynski וחב' ב-Biochem J משנת 1990, ו-Dickenson וחב' ב-Biochem J משנת 1991).
KSIII-בו השרשרת הסוכרית קשורה חלבון הליבה דרך הסוכר mannose בקשר O
סוג שלישי של קשר בין KS לחלבון תואר בפרוטאוגליקאנים מהמוח (Krusius ו-Ruoslahti ב-Proc Natl Acad Sci USA משנת 1986). שרשרות KS אלו קשורות ל-serine או ל-threonine בחלבון הליבה דרך mannose בקשר KS-Man-O-Ser. קשר זה כנראה נמצא ב-phosphocan-KS, אם כי האפיון המלא של החלבונים בהם קיים קשר KS-Man-O-Ser, עדיין תלוי ועומד.
הביוסינתזה של KS
אנזימים ביוסינתטיים: KS מתארך על ידי הפעילות של גליקוזיל-טרנספראזות המוסיפים לסירוגין galactose ו-GlcNAc לפולימר ההולך וגדל. פעילות gal-transferase בתאי הקרנית דומה לזו של האנזים β-1,4-galactosyltransferase (הידוע גם כ-β4Gal-T1) הפעיל בנסיוב ובחלב (Christner וחב' ב-Arch Biochem Biophys משנת 1979). זוהתה משפחה של לפחות 7 גנים של β4Gal-T (Amado וחב' ב-Biochim Biophys Acta משנת 1999). במהלך התפתחות עוברי אפרוחים נרשמה בקרנית הגברה של ריכוז עותקי β4Gal-T במקביל לסינתזה של KS בקרנית. הפעילות של אנזים זה נותרה גבוהה במיוחד בתאי הקרנית הבוגרים (Cai וחב' ב- Exp. Eye Res משנת 1996). השוואה עם רצפים ידועים של cDNA מראה ש- β4Gal-T זהה ל-β4Gal-T1. פעילות β4Gal-T1 ממשיכה להיות מוגברת בתאי קרנית בתרבית שאבדו את היכולת לסנתז KS. למרות ש-β4Gal-T1 מצטייר כאנזים הקשור לסינתזה של KS בקרנית , אנזים ספציפי זה לא נכרך עם ביוסינתזה של KS ברקמות אחרות.
האנזים הספציפי N-acetylglucosaminyltransferase (או GnT) האחראי לסינתזה של KS לא זוהה עדיין. ידועים מספר אנזימי GnT, ששניים מהם נראים מועמדים סבירים. האנזים המאוד נפוץ iGnT נמצא משתתף בסינתזה של ה-polylactosamine הלינארי הידוע כ-i"-antigen" (Sasaki וחב' ב-Proc Natl Acad Sci USA משנת 1997). עותקי RNA של אנזים זה נמצאו מועשרים במוח, רקמה בה KS מסונתז באופן פעיל. זוהה אנזים GnT שני (β3GnT) הפעיל בסינתזה של polylactosamine לינארי, והוא אף שובט (Zhou וחב' ב-Proc Natl Acad Sci USA משנת 1999). אך אין כל הוכחה הכורכת GnT ספציפי עם סינתזה של KS.
הסולפציה של KS בקרנית מסתייעת על ידי לפחות 2 אנזימים מסוג sulfotransferase (Ruter ו-Kresse ב- Keratan Sulphate. Chemistry, Biology, Chemical Pathology. The Biochemical Society, London משנת 1984). שני אנזימים זוהו ושובטו, כאלה המוסיפים סולפאט ל-KS (Habuchi וחב' ב-Glycobiology משנת 1996, ו-Fukuta וחב' ב-J Biol Chem משנת 1997). אחד מ-2 אנזימים אלה מוסיף סולפאט לשיירי GalNAc של chondroitin sulfate וכן לשייר galactose של KS. האנזים השני גם כן מוסיף סולפאט ל-galactose של KS אך אינו פועל על chondroitin sulfate. כן נמצא ש-mRNA של sulfotransferase ספציפי ל-KS מבוטא באופן בולט במוח ובקרנית. נראה אם כן סביר ש- sulfotransferaseזה מייצג אנזים הקשור לביוסינתזה של KS.
KS מכיל סולפאט גם על שיירי GlcNAc וסביר שאנזים ספציפי אחראי לפעילות זו. נמצא שפעילות האנזים GlcNAc-6-sulfotransferase (או Gn6ST) בתמצית תאים קרטוציטים גורמת לסולפציה ספציפית של הקצה הלא-מחזר GlcNAc(β1–3)Gal-R (Nakazawa וחב' ב- Arch Biochem Biophysמשנת 1998). ה-cDNAs של 2 אנזימי Gn6ST עם ספציפיות לקצה הלא-מחזר GlcNAc זוהו ושובטו (Uchimura וחב' ב-J Biol Chem משנת 1998, ו-Lee וחב' ב- Biochem Biophys Res Commun משנת 1999). עם זאת השאלה נותרת פתוחה האם אחד מאנזימים אלה משתתף בסינתזה של KS. מטופלים עם macular corneal dystrophy, מחלה בה KS חסר סולפציה של GlcNAc בגוף כולו, הם בעלי רמות פעילות של אנזים זה בנסיוב (Hasegawa וחב' ב-J Biochem משנת 1999). משמעות ממצאים אלה היא שאנזים עם ספציפות דומה ויקום רקמתי מוגדר עשוי להיות קשור לסינתזה של KS. הספציפיות של האנזים Gn6ST מרמזת לכל שהסולפציה של KS GlcNAc, יכולה להתרחש באופן סימולטני רק בשיירי קצה של השרשרת המתארכת (Degroote ב-J Biol Chem משנת 1997, ו-Uchimura וחב' ב-Glycobiology משנת 1998).


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק