הבדלים בין גרסאות בדף "פוליציטמיה ורה - Polycythemia Vera"
| שורה 12: | שורה 12: | ||
}} | }} | ||
{{הרחבה|פוליציטמיה}} | {{הרחבה|פוליציטמיה}} | ||
| − | '''פוליציטמיה ראשונית''' או '''פוליציטמיה ורה''' ( | + | ==הקדמה== |
| + | '''פוליציטמיה ראשונית''' או '''פוליציטמיה ורה''' (polycythemia vera, PV) שייכת לקבוצת המחלות המיאלופרוליפרטיביות (myeloproliferative neoplasms, MPN). ה-MPNs הן ממאירויות המטולוגיות בעלות מהלך כרוני ממושך ביותר והישרדות ארוכת-שנים בדרך כלל, המתאפיינות בשגשוג חריג של תאי דם צעירים שמקורם בתאי גזע המטופואטיים (hematopoietic stem cells, HSCs) במח העצם, תסמינים ייחודיים, וסיבוכים כגון הגדלת טחול וסיכון גבוה לאירועי [[קרישיות יתר]], הקשורים בין השאר לשגשוג החריג ולמצב דלקתי כללי שנלווה לכך. בפוליציטמיה ורה נוצרים במח העצם יותר מידי תאי דם אדומים, תאי דם לבנים ומגהקריוצטים, ולעיתים קרובות היא מתבררת סביב הופעה של ספירות דם גבוהות. | ||
| − | + | ==הבנת הבסיס המולקולרי של PV והמחלות המיאלופרוליפרטיביות: עד שנת 2005, ומאז== | |
| + | המחלות המיאלופרוליפרטיביות תוארו לראשונה בשנות ה-50 של המאה ה-20 על ידי ההמטולוג האמריקאי וויליאם דמשק, שהבחין בשגשוג חריג של תאי דם אדומים כביטוי לפעילות לא מבוקרת של תאים צעירים בלתי ממויינים במח העצם. בעשורים שחלפו מאז, הובן שתאי דם אדומים של חולים עם PV מסוגלים לשגשג וליצור מושבות בתרבית תאים במעבדה ללא גירוי של ההורמון [[אריתרופואטין]] (erythropoietin, EPO) הנחוץ במצב רגיל לשגשוגם. בנוסף, נמצאו הפרעות במבנה הכרומוזומים (בדיקת קריוטיפ) שהן אופייניות ל-PV ול-MPN בכלל. בין ההפרעות האלו, נמצא שבחולים רבים עם PV ישנם שינויים בזרוע הקצרה של כרומוזום 9 (זרוע 9p), אך למשך מספר שנים לא נמצא הסבר ל'מוקד' כרומוזומלי זה. בשנת 2005, התגלתה מוטציה בגן janus kinase (JAK)-2 שנמצא בזרוע הקצרה של כרומוזום 9, המוטציה JAK2-V617F, ב-97% מהחולים עם PV, וב55 עד 60% מהחולים עם סוגי ה-MPN האחרים, תרומבוציטוזיס ראשונית (ET) ו[[מיאלופיברוזיס]] (MF). תגלית זו היוותה פריצת דרך דרמטית בהבנה של ה-MPN, ביכולת האבחנתית, ובהמשך גם בטיפול, ותרמה להמשך הבנת הבסיסי המולקולרי של ה-MPN בשנים לאחר מכן. הגן JAK2 מקודד לחלבון קטן מסוג טירוזין קינאז, הנקשר לחלק התוך-תאי בקולטנים ל-EPO ולתרומבופואטין (TPO) בתאים צעירים במח העצם, והוא חיוני להפעלת שרשרת העברת סיגנלים הדוחפת לחלוקת התאים. במצב רגיל, קשירה של מולקולת EPO או TPO (סיגנל מחוץ לתא, או ליגנד) לרצפטור, גורמת לקשירה של JAK2 לחלק התוך תאי של הרצפטור והפעלת שרשרת העברת הסיגנלים. המוטציה JAK2-V617F גורמת לקשירת הטירוזין קינאז JAK2 לרצפטורים גם ללא גירוי חיצוני, והפעלה רצופה של שרשרת העברת הסיגנלים לחלוקת התא. בשיעור קטן של חולים עם PV (כ-3%) ללא המוטציה JAK2-V617F, ניתן לאתר מוטציות אחרות באקסון 12 של הגן. לחולים עם מוטציות באקסון 12 יש נטיה לייצור מוגבר בעיקר של השורה האדומה, וגיל מוקדם יותר באבחנה, אך מהלך המחלה והפרוגנוזה דומות לאלו עם המוטציה השכיחה. בבדיקות מולקולריות שונות ניתן לחשב את העומס האלל (allele burden) או שיעור הופעת המוטציה (variant allele frequency), מונחים נרדפים המתארים את שיעור תאי הדם המגורענים הנושאים את המוטציה, בהשוואה לאלו שאינם נושאים. נמצא קשר בין עומס המוטציה להופעת גרד, לסיכוי יותר גבוה להתקדמות המחלה למיאלוםיברוזיס, אך לא נמצא קשר להישרדות. באשר לסיכון לאירועי קרישיות ישנו מידע סותר. | ||
| + | [[קובץ:פוליציטמיה1.jpg|ממוזער|מרכז|550 פיקסלים|טבלה 1. קריטריונים של ארגון הבריאות העולמי (2008) לאבחון של פוליציטימיה ורה{{ש}} המוגלובין מעל לאחוזון 99; או מעל 17 גרם(גר')/דציליטר(דל') בגברים, ו-15 גר'/דל' בנשים אם מלווה בעלייה קבועה בלפחות 2 גר'/דל' מערך הבסיס ולא משני לתיקון של חסר ברזל; או עלייה בנפח כדוריות דם אדומות מעל 25 אחוזים מהערך הממוצע המצופה]] | ||
| + | |||
| + | ==ביטויי המחלה== | ||
| + | חולים עם PV עשויים לסבול ממגוון רחב של תסמינים, אך עשויים בהחלט להיות גם א-תסמיניים (או אסימפטומטיים, asymptomatic) וישנו מנעד רחב בין מטופלים שאינם חווים תסמינים כלל לאלו הסובלים מעומס תסמיני (symptom burden) גדול ופגיעה קשה באיכות החיים. ניתן להבדיל בין 3 קבוצות או מקבצים (clusters) של תסמינים: | ||
| + | #תסמינים סיסטמיים או כלליים (systemic or constitutional symptoms) כוללים [[חום]] גבוה, הזעות, [[ירידה במשקל]], [[עייפות]] או [[חולשה כללית]] ו[[גרד]]. תסמינים אלו קשורים לרמות גבוהות של חלבונים מתווכי-דלקת (ציטוקינים) כגון IL1, IL6, IL8 בפלזמה של חולים, כביטוי למצב דלקתי כרוני. גרד הוא תסמין ייחודי ובולט ב-PV, שעשוי לגרום לסבל ועוגמת נפש קשה למטופלים. בביטויו הקלאסי זהו גרד שמחמיר במגע עם מים (aquagenic pruritus) לכן מופיע לאחר מקלחת ובייחוד מקלחת עם מים חמים. | ||
| + | #תסמינים מיקרו-וסקולריים, מיקרו-איסמכיים (microvascular symptoms) או וזו-מוטוריים (vasomotor) כוללים בין השאר כאבי ראש, מיגרנות, הפרעות ראייה, תחושת כבדות של הראש או טישטוש, טינטון (צילצולים או רעשים באזניים), סומק, נפיחות ואודם באצבעות הידיים. תסמינים אלו יוחסו באופן היסטורי לספירות הגבוהות ובייחוד השורה האדומה, ולמצמיגיות-יתר (hyperviscosity) של הדם כתוצאה מכך. תיאוריה זו הודגמה ואומתה, מצד אחד, במודלים מעבדתיים שהדגימו תופעות כמו האטות בזרימה בכלי דם קטנים או "דחיקה" של טסיות בצמוד לדופן כלי הדם על ידי הנפח המוגבר של תאי הדם האדומים. מצד שני, הובן שהסיבות התורמות לתסמינים אלו כוללות גם תכונות נוספות של תאי הדם האדומים, הטסיות, וכן תאי האנדותל בדופן כלי הדם, שאינן קשורות לספירה הגבוהה אלא לשינויים מולקולרים הנגרמים בהשפעת המוטציה JAK2-V617F. גילויים אלו מסבירים מדוע גם מטופלים ללא המוגלובין/מטוקריט גבוהים עשויים לסבול גם כן מתסמינים וסקולריים וכן מאירועי קרישיות-יתר | ||
| + | # תסמינים הקשורים לטחול המוגדל (spleen-related symptoms) כגון מלאות או תחושת אי נוחות בבטן, כאבי בטן ובעיקר בבטן השמאלית העליונה (left upper quadrant, LUQ pain), שינויים בהרגלי פעולות מעיים כגון [[שלשול]] או [[עצירות]]. התסמין הקלאסי הקשור להגדלת טחול הוא שובע מוקדם, הקשור מלחץ מקומי של הטחול הגדול על הקיבה, המגביל את מילוי הקיבה | ||
| + | |||
| + | ==נטיה לקרישיות יתר ודימומים== | ||
| + | מצביים ייחודיים ב-PV: קרישיות יתר בורידי הכבד והבטן, PV והיריון: יתווספו בסוף הסקירה. | ||
| − | + | ==אבחנה ודירוג פרוגנוסט== | |
| + | אבחנה של PV עודכנה בשנת 2016 במסגרת קריטריונים חדשים שפירסם ארגון הבריאות העולמי לאבחנה וסיווג של כלל הממאירויות ההמטולוגיות של השורה המאילואידית (myeloid malignancies). האבחנה דורשת את קיומם של שלושה קריטריונים מג'וריים (major) או שני קריטריונים מג'וריים וקריטריון מינורי. הקריטריונים המג'וריים הם ערכי המוגלובין ו/או המטוקריט גבוהים, עדות לשגשוג יתר אופייני בבדיקת פתולוגיה של מח העצם, וזיהוי המוטציה JAK2-V617F או מרקר קלונלי אחר (כגון מוטציה באקסון 12, מוטציה אפיינית אחרת, או הפרעות כרומוזומליות אופייניות) בבדיקות מולקולריות. הקריטריון המינורי הוא רמת אריתרופואטין נמוכה, והוא תורם לביסוס האבחנה במצבים בהם לא ניתן למצוא מוטציה ב-JAK2 או לא ניתן לבצע בדיקת מח עצם. המונח masked PV מתייחס לחולים עם מוטציה ב-JAK2 ומאפייני במח העצם המתאימים ל-PV, למרות ערך המוגלובין נמוך יותר. ערך המוגלובין של 16.5 גרם/דציליטר בגברים ו-15-16.5 גרם/דציליטר בנשים נקבע כערך הסף לאבחנה בין חולים עם masked PV לחולים עם ET. | ||
| − | + | גורמי סיכון המשפיעים על הישרדות והתקדמות למיאלופיברוזיס או לוקמיה: מחקר שפורסם הדגים חציון הישרדות של 14 שנים בחולים עם PV, ובחולים צעירים מתחת לגיל 60, חציון ההישרדות הוא 24 שנים. הסיכוי לטרנספורמציה ללוקמיה חריפה במעקב של 20 שנים הוא פחות מ-10 אחוזים, הסיכוי לטרנספורמציה למיילופיברוזיס מעט גבוה יותר{{הערה|שם=הערה3|Mesa RA, Niblack J, Wadleigh M, et al. The burden of fatigue and quality of life in myeloproliferative disorders (MPDs): an international Internet-based survey of 1179 MPD patients. Cancer 2007;109:68-76. | |
| − | + | *This study provided a large cohort-based appreciation of the symptom burden and effect on quality of life of the MPNs, and led to the development of standardized tools to measure symptom burden, and their subsequent inclusion in clinical trial outcomes. Reflects the magnitude of pruritus in MPNs.}}. גורמי הסיכון המשפיעים על ההישרדות כוללים גיל מבוגר, ספירה לבנה גבוהה (Leukocytosis) ואירוע טרומבוטי (פקקת, Thrombosis) קודם{{הערה|שם=הערה4|1. Marchioli R, Finazzi G, Specchia G, et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Eng J Med 2013;368:22-33.}}. גורמי הסיכון המשפיעים על הסיכון לטרנספורמציה ללוקמיה כוללים גיל מבוגר, ספירה לבנה גבוהה וקריוטיפ (Karyotype) לא תקין{{הערה|שם=הערה4}}. | |
| − | |||
| − | + | גורמי סיכון לטרומבוזיס ודימום: חולים בסיכון גבוה לטרומבוזיס הם חולים בגיל 60 ומעלה או חולים שחוו אירוע טרומבוטי (עורקי או ורידי) בעברם. טסיות דם מעל מיליון הם סיכון מוגבר לדמם. | |
| − | חולים בסיכון גבוה לטרומבוזיס הם חולים בגיל 60 ומעלה או חולים שחוו אירוע טרומבוטי (עורקי או ורידי) בעברם. | ||
==טיפול== | ==טיפול== | ||
| שורה 62: | שורה 73: | ||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
<blockquote> | <blockquote> | ||
| − | + | {{הערות שוליים|יישור=שמאל}} | |
| − | |||
| − | {{הערות שוליים}} | ||
| − | |||
| − | |||
</blockquote> | </blockquote> | ||
גרסה מ־08:33, 15 בינואר 2023
| פוליציטמיה ראשונית – טיפול | ||
|---|---|---|
| Primary polycythemia– Treatment | ||
| ||
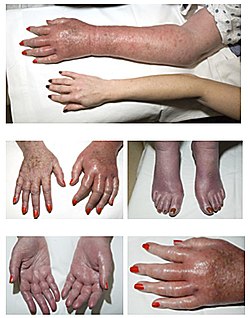
אריתרומללגיה היא תסמין של PV, מוצגת אריתרומללגיה בחולה עם פוליציטמיה ורה ארוכת שנים. שימו לב לגפיים אדמדמות ונפיחות.
| ||
| שמות נוספים | PV, פוליציטמיה ורה – טיפול - Polycythemia vera – Treatment | |
| ICD-10 | Chapter D 45. | |
| ICD-9 | 238.4 | |
| MeSH | D011087 | |
| יוצר הערך | ד"ר ערן זימרן על בסיס ערך שכתבה ד"ר נועה לביא. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – פוליציטמיה
הקדמה
פוליציטמיה ראשונית או פוליציטמיה ורה (polycythemia vera, PV) שייכת לקבוצת המחלות המיאלופרוליפרטיביות (myeloproliferative neoplasms, MPN). ה-MPNs הן ממאירויות המטולוגיות בעלות מהלך כרוני ממושך ביותר והישרדות ארוכת-שנים בדרך כלל, המתאפיינות בשגשוג חריג של תאי דם צעירים שמקורם בתאי גזע המטופואטיים (hematopoietic stem cells, HSCs) במח העצם, תסמינים ייחודיים, וסיבוכים כגון הגדלת טחול וסיכון גבוה לאירועי קרישיות יתר, הקשורים בין השאר לשגשוג החריג ולמצב דלקתי כללי שנלווה לכך. בפוליציטמיה ורה נוצרים במח העצם יותר מידי תאי דם אדומים, תאי דם לבנים ומגהקריוצטים, ולעיתים קרובות היא מתבררת סביב הופעה של ספירות דם גבוהות.
הבנת הבסיס המולקולרי של PV והמחלות המיאלופרוליפרטיביות: עד שנת 2005, ומאז
המחלות המיאלופרוליפרטיביות תוארו לראשונה בשנות ה-50 של המאה ה-20 על ידי ההמטולוג האמריקאי וויליאם דמשק, שהבחין בשגשוג חריג של תאי דם אדומים כביטוי לפעילות לא מבוקרת של תאים צעירים בלתי ממויינים במח העצם. בעשורים שחלפו מאז, הובן שתאי דם אדומים של חולים עם PV מסוגלים לשגשג וליצור מושבות בתרבית תאים במעבדה ללא גירוי של ההורמון אריתרופואטין (erythropoietin, EPO) הנחוץ במצב רגיל לשגשוגם. בנוסף, נמצאו הפרעות במבנה הכרומוזומים (בדיקת קריוטיפ) שהן אופייניות ל-PV ול-MPN בכלל. בין ההפרעות האלו, נמצא שבחולים רבים עם PV ישנם שינויים בזרוע הקצרה של כרומוזום 9 (זרוע 9p), אך למשך מספר שנים לא נמצא הסבר ל'מוקד' כרומוזומלי זה. בשנת 2005, התגלתה מוטציה בגן janus kinase (JAK)-2 שנמצא בזרוע הקצרה של כרומוזום 9, המוטציה JAK2-V617F, ב-97% מהחולים עם PV, וב55 עד 60% מהחולים עם סוגי ה-MPN האחרים, תרומבוציטוזיס ראשונית (ET) ומיאלופיברוזיס (MF). תגלית זו היוותה פריצת דרך דרמטית בהבנה של ה-MPN, ביכולת האבחנתית, ובהמשך גם בטיפול, ותרמה להמשך הבנת הבסיסי המולקולרי של ה-MPN בשנים לאחר מכן. הגן JAK2 מקודד לחלבון קטן מסוג טירוזין קינאז, הנקשר לחלק התוך-תאי בקולטנים ל-EPO ולתרומבופואטין (TPO) בתאים צעירים במח העצם, והוא חיוני להפעלת שרשרת העברת סיגנלים הדוחפת לחלוקת התאים. במצב רגיל, קשירה של מולקולת EPO או TPO (סיגנל מחוץ לתא, או ליגנד) לרצפטור, גורמת לקשירה של JAK2 לחלק התוך תאי של הרצפטור והפעלת שרשרת העברת הסיגנלים. המוטציה JAK2-V617F גורמת לקשירת הטירוזין קינאז JAK2 לרצפטורים גם ללא גירוי חיצוני, והפעלה רצופה של שרשרת העברת הסיגנלים לחלוקת התא. בשיעור קטן של חולים עם PV (כ-3%) ללא המוטציה JAK2-V617F, ניתן לאתר מוטציות אחרות באקסון 12 של הגן. לחולים עם מוטציות באקסון 12 יש נטיה לייצור מוגבר בעיקר של השורה האדומה, וגיל מוקדם יותר באבחנה, אך מהלך המחלה והפרוגנוזה דומות לאלו עם המוטציה השכיחה. בבדיקות מולקולריות שונות ניתן לחשב את העומס האלל (allele burden) או שיעור הופעת המוטציה (variant allele frequency), מונחים נרדפים המתארים את שיעור תאי הדם המגורענים הנושאים את המוטציה, בהשוואה לאלו שאינם נושאים. נמצא קשר בין עומס המוטציה להופעת גרד, לסיכוי יותר גבוה להתקדמות המחלה למיאלוםיברוזיס, אך לא נמצא קשר להישרדות. באשר לסיכון לאירועי קרישיות ישנו מידע סותר.

המוגלובין מעל לאחוזון 99; או מעל 17 גרם(גר')/דציליטר(דל') בגברים, ו-15 גר'/דל' בנשים אם מלווה בעלייה קבועה בלפחות 2 גר'/דל' מערך הבסיס ולא משני לתיקון של חסר ברזל; או עלייה בנפח כדוריות דם אדומות מעל 25 אחוזים מהערך הממוצע המצופה
ביטויי המחלה
חולים עם PV עשויים לסבול ממגוון רחב של תסמינים, אך עשויים בהחלט להיות גם א-תסמיניים (או אסימפטומטיים, asymptomatic) וישנו מנעד רחב בין מטופלים שאינם חווים תסמינים כלל לאלו הסובלים מעומס תסמיני (symptom burden) גדול ופגיעה קשה באיכות החיים. ניתן להבדיל בין 3 קבוצות או מקבצים (clusters) של תסמינים:
- תסמינים סיסטמיים או כלליים (systemic or constitutional symptoms) כוללים חום גבוה, הזעות, ירידה במשקל, עייפות או חולשה כללית וגרד. תסמינים אלו קשורים לרמות גבוהות של חלבונים מתווכי-דלקת (ציטוקינים) כגון IL1, IL6, IL8 בפלזמה של חולים, כביטוי למצב דלקתי כרוני. גרד הוא תסמין ייחודי ובולט ב-PV, שעשוי לגרום לסבל ועוגמת נפש קשה למטופלים. בביטויו הקלאסי זהו גרד שמחמיר במגע עם מים (aquagenic pruritus) לכן מופיע לאחר מקלחת ובייחוד מקלחת עם מים חמים.
- תסמינים מיקרו-וסקולריים, מיקרו-איסמכיים (microvascular symptoms) או וזו-מוטוריים (vasomotor) כוללים בין השאר כאבי ראש, מיגרנות, הפרעות ראייה, תחושת כבדות של הראש או טישטוש, טינטון (צילצולים או רעשים באזניים), סומק, נפיחות ואודם באצבעות הידיים. תסמינים אלו יוחסו באופן היסטורי לספירות הגבוהות ובייחוד השורה האדומה, ולמצמיגיות-יתר (hyperviscosity) של הדם כתוצאה מכך. תיאוריה זו הודגמה ואומתה, מצד אחד, במודלים מעבדתיים שהדגימו תופעות כמו האטות בזרימה בכלי דם קטנים או "דחיקה" של טסיות בצמוד לדופן כלי הדם על ידי הנפח המוגבר של תאי הדם האדומים. מצד שני, הובן שהסיבות התורמות לתסמינים אלו כוללות גם תכונות נוספות של תאי הדם האדומים, הטסיות, וכן תאי האנדותל בדופן כלי הדם, שאינן קשורות לספירה הגבוהה אלא לשינויים מולקולרים הנגרמים בהשפעת המוטציה JAK2-V617F. גילויים אלו מסבירים מדוע גם מטופלים ללא המוגלובין/מטוקריט גבוהים עשויים לסבול גם כן מתסמינים וסקולריים וכן מאירועי קרישיות-יתר
- תסמינים הקשורים לטחול המוגדל (spleen-related symptoms) כגון מלאות או תחושת אי נוחות בבטן, כאבי בטן ובעיקר בבטן השמאלית העליונה (left upper quadrant, LUQ pain), שינויים בהרגלי פעולות מעיים כגון שלשול או עצירות. התסמין הקלאסי הקשור להגדלת טחול הוא שובע מוקדם, הקשור מלחץ מקומי של הטחול הגדול על הקיבה, המגביל את מילוי הקיבה
נטיה לקרישיות יתר ודימומים
מצביים ייחודיים ב-PV: קרישיות יתר בורידי הכבד והבטן, PV והיריון: יתווספו בסוף הסקירה.
אבחנה ודירוג פרוגנוסט
אבחנה של PV עודכנה בשנת 2016 במסגרת קריטריונים חדשים שפירסם ארגון הבריאות העולמי לאבחנה וסיווג של כלל הממאירויות ההמטולוגיות של השורה המאילואידית (myeloid malignancies). האבחנה דורשת את קיומם של שלושה קריטריונים מג'וריים (major) או שני קריטריונים מג'וריים וקריטריון מינורי. הקריטריונים המג'וריים הם ערכי המוגלובין ו/או המטוקריט גבוהים, עדות לשגשוג יתר אופייני בבדיקת פתולוגיה של מח העצם, וזיהוי המוטציה JAK2-V617F או מרקר קלונלי אחר (כגון מוטציה באקסון 12, מוטציה אפיינית אחרת, או הפרעות כרומוזומליות אופייניות) בבדיקות מולקולריות. הקריטריון המינורי הוא רמת אריתרופואטין נמוכה, והוא תורם לביסוס האבחנה במצבים בהם לא ניתן למצוא מוטציה ב-JAK2 או לא ניתן לבצע בדיקת מח עצם. המונח masked PV מתייחס לחולים עם מוטציה ב-JAK2 ומאפייני במח העצם המתאימים ל-PV, למרות ערך המוגלובין נמוך יותר. ערך המוגלובין של 16.5 גרם/דציליטר בגברים ו-15-16.5 גרם/דציליטר בנשים נקבע כערך הסף לאבחנה בין חולים עם masked PV לחולים עם ET.
גורמי סיכון המשפיעים על הישרדות והתקדמות למיאלופיברוזיס או לוקמיה: מחקר שפורסם הדגים חציון הישרדות של 14 שנים בחולים עם PV, ובחולים צעירים מתחת לגיל 60, חציון ההישרדות הוא 24 שנים. הסיכוי לטרנספורמציה ללוקמיה חריפה במעקב של 20 שנים הוא פחות מ-10 אחוזים, הסיכוי לטרנספורמציה למיילופיברוזיס מעט גבוה יותר[1]. גורמי הסיכון המשפיעים על ההישרדות כוללים גיל מבוגר, ספירה לבנה גבוהה (Leukocytosis) ואירוע טרומבוטי (פקקת, Thrombosis) קודם[2]. גורמי הסיכון המשפיעים על הסיכון לטרנספורמציה ללוקמיה כוללים גיל מבוגר, ספירה לבנה גבוהה וקריוטיפ (Karyotype) לא תקין[2].
גורמי סיכון לטרומבוזיס ודימום: חולים בסיכון גבוה לטרומבוזיס הם חולים בגיל 60 ומעלה או חולים שחוו אירוע טרומבוטי (עורקי או ורידי) בעברם. טסיות דם מעל מיליון הם סיכון מוגבר לדמם.
טיפול
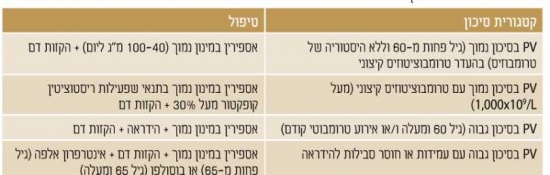
מאחר ושיעורי ההישרדות גבוהים והסכנה לטרנספורמציה ללוקמיה או למיילופיברוזיס נמוכים מאד. כיום לא מומלץ לטפל (בכל טיפול) באופן שגרתי על מנת להשפיע על המהלך הטבעי של המחלה. מאידך, הסכנה לאירוע טרומבוטי עולה על 20 אחוזים וחלק לא מבוטל מהחולים סובל מהפרעות וזומוטוריות (Vasomotor); כאבי ראש, סחרחורת, עקצוצים בקצות האצבעות, Erythromelalgia - התקפי כאב ואודם בקצות האצבעות, כאבים לא טיפוסיים בחזה וגרד. בחולים עם מספר טסיות מעל מיליון עשויה להיות נטייה לדמם. לכן, מטרת הטיפול העיקרית היא למנוע סיבוכים טרומבוטיים או דמם, ומטרת הטיפול השניונית היא לווסת את התסמינים המיקרווסקולריים (טבלה 2)[3].
טיפול בחולים בסיכון נמוך, בהעדר רמת טסיות קיצונית
במחקר המבוקר ה-ECLAP study (European Collaboration study on Low-dose Aspirin in Polycythemia) הוכחה יעילות הטיפול באספירין במינון נמוך למניעה אירועים טרומבוטים בחולי PV בכל דרגות הסיכון[4]. מחקרים הראו גם את היעילות של הקזות דם (Phlebotomy) בכל חולי ה- PV, כאשר מחקר CYTO-PV (CYTOreductive therapy in Polycythemia Vera)[5] הראה כי חולים ששמרו על המטוקריט מטרה של פחות מ-45 אחוזים היו פחות אירועים טרומבוטים ותמותה קרדיווסקולרית נמוכה יותר לעומת חולים עם המטוקריט 50-45 אחוזים ולכן המטרה הטיפולית היא לשמור על המטוקריט של פחות מ-45 אחוזים.
גם אספירין במינון נמוך מפחית סימפטומים וזומוטורים. אם אין השפעה תחת טיפול באספירין במינון נמוך ניתן להעלות את מינון האספירין לפעמיים ביום או לטפל ב-Plavix (Clopidogrel) או בשילוב של שתי התרופות יחד. במקרים מסויימים אספירין הניתן פעמיים ביום יעיל יותר מאשר פעם ביום ולכן, שוקלים לעיתים גישה טיפולית זו בחולים עמידים לטיפול באספירין פעם ביום או לאלו עם יותר גורמי סיכון לטרומבוזיס עורקי.
גרד מופיע ברוב החולים עם PV ולרוב מוחמר על ידי מים חמים. יש להתחיל טיפול באמצעים לא תרופתיים כגון הימנעות מגורמים מחמירים (הימנעות מעור יבש, טמפרטורות קיצוניות ורחצה במים חמים). תיתכן תגובה לאנטי-היסטמינים (Antihistamines). תוארה תגובה של מעל 50 אחוזים לגרד על ידי שימוש ב-Paroxetine (Seroxat, Paxxet), תרופה נוגדת דיכאון ממשפחת SSRI (Selective Serotonin Reuptake Inhibitors). טיפולים אחרים יעילים לגרד כוללים טיפול ב-Interferon, מעכבי JAK ופוטותרפיה (Phototherapy).
טיפול בחולים בסיכון נמוך עם רמת טסיות קיצונית או נטייה לדמם
תסמונת וון-וילברנד נרכשת (Acquired Von Willebrand Syndrome, AvWS), שכיחה בחולי PV ומתאפיינת באיבוד מולטימרים גדולים של פקטור Von-Willebrand, בשל פירוק מוגבר על ידי ADAMTS13 התלוי בחומרת הטרומבוציטוזיס. AvWS מביאה להפרעה תפקודית משמעותית יותר מאשר נראה כאשר בודקים את אנטיגן Von-Willebrand ורמות פקטור VIII ולכן יש צורך בתבחינים המעריכים את תפקוד פקטור Von-Willebrand כגון פעילות Ristocetin Cofactor (RCo). כשרמת הטסיות מעל 1000x109/liter יש למדוד את פעילות RCo ולשקול הימנעות מאספירין אם הפעילות פחות מ-30 אחוזים, מחשש לדמם. מצד שני, טרומבוציטוזיס קיצונית לא מגבירה סיכון לטרומבוזיס ואינה מהווה התוויה לטיפול ציטורדוקטיבי.
טיפול בחולי PV בסיכון גבוה
בנוסף לאספירין והקזות דם, חולים בסיכון גבוה (גיל 60 ומעלה או אירוע טרומבוטי קודם) צריכים לקבל גם טיפול ציטורדוקטיבי ב-Hydroxyurea (Hydrea) על מנת להפחית סכנה לטרומבוזיס, בחולים עם אירוע טרומבוטי ורידי מומלץ לטפל בנוגדי קרישה ולשקול טיפול באספירין. טרנספורמציה לוקמית הוכחה כקשורה לטיפול ב- Pipobroman ו-P32 שאינם בשימוש כיום, אך אינה קשורה לטיפול ב-Hydrea.
טיפול בחולי PV בסיכון גבוה עם עמידות או חוסר סבילות ל-Hydrea
עמידות או חוסר סבילות ל-Hydrea (טבלה 3) [6] יכולה להתפתח ב-25-20 אחוזים מהחולים עם PV[7]. עמידות קשורה לסיכון מוגבר לטרנספורמציה ללוקמיה ומיילופיברוזיס וירידה בהישרדות. ההישרדות הממוצעת בחולים עמידים ל-Hydrea היא 1.2 שנים בלבד. חוסר סבילות ל-Hydrea לא משפיע על הפרוגנוזה (Prognosis).
חולים אלו יכולים להיות מטופלים בצורה יעילה על ידי Interferon או Busulphan. מחקרים קליניים הדגימו שיעור גבוה של הפוגה המטולוגית עם טיפול ב-Peginterferon ואף ירידה ב-JAK2(V617F) Allele burden. אולם, הטיפול ב- Interferon כרוך בתופעות לוואי קשות ורבים מהחולים לא סובלים טיפול זה. מנגד, קיים חשש שטיפול ב-Busulphan מגביר סיכוי לטרנספורמציה ללוקמיה ולכן מעדיפים להימנע מהשימוש בו בחולים צעירים.
קבוצת החולים עם PV עם חוסר סבילות או עמידות לטיפול ב-Hydrea ואלו הממשיכים להיות סימפטומטיים למרות טיפול ב-Hydrea מהווים קבוצה של חולים עם צרכים שלרוב אין להם פיתרון עם הטיפולים הקיימים. חשוב לזכור גם שטרנספורמציה ללוקמיה מ-PV בדרך כלל מופיע בתאים שהם שליליים למוטציה (JAK2(V617F ולכן ירידה ב-Allele burden של (JAK2(V617F על ידי תרופות לא בהכרח מתורגמת ליתרון ארוך טווח.
מחקרים קליניים ב-PV שמים כעת דגש על קבוצות חולים אלו. מבין התרופות הנחקרות, מעכבי JAK עשויים להיות בעלי ערך טיפולי בחולים עם עמידות/חוסר סבילות ל-Hydrea.
ביבליוגרפיה
- ↑ Mesa RA, Niblack J, Wadleigh M, et al. The burden of fatigue and quality of life in myeloproliferative disorders (MPDs): an international Internet-based survey of 1179 MPD patients. Cancer 2007;109:68-76.
- This study provided a large cohort-based appreciation of the symptom burden and effect on quality of life of the MPNs, and led to the development of standardized tools to measure symptom burden, and their subsequent inclusion in clinical trial outcomes. Reflects the magnitude of pruritus in MPNs.
- ↑ 2.0 2.1 1. Marchioli R, Finazzi G, Specchia G, et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Eng J Med 2013;368:22-33.
- ↑ Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2015 update on diagnosis, risk stratification and management American Journal of Hematology, 2015
- ↑ Landolfi R, Marchioli R, Kutti J, et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med. 2004
- ↑ 7Marchioli R, Finazzi G, Specchia G, etal. Cardiovas¬cular events and intensity of treatment in polycythe-mia vera. N EnglJ Med 2013
- ↑ Barosi G,Birgegard G, Finazzi G, et al. A unified definition of clinical resistance and intolerance to hydroxycarbamide in polycythaemia vera and primary myelofibrosis; results of a European LeukemiaNet (ELN) consensus process. BrJHaematol 2010
- ↑ Sever M, Newberry K, Verstovsek S.Therapeutic options for patients with polycythemia vera and essential thrombocythemia refractory/resistant to hydroxyurea. Leukemia & Lymphoma Dec 2014
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר נועה לביא. המכון ההמטולוגי, הקריה הרפואית רמב"ם, חיפה, עודכן בשנת 2023 על ידי ד"ר ערן זימרן, המחלקה ההמטולוגית ויחידת הקרישה במרכז הרפואי הדסה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק