הבדלים בין גרסאות בדף "דלקת אאוזינופילית בוושט - Eosinophilic esophagitis"
(מחיקת קובץ) |
|||
| (3 גרסאות ביניים של משתמש אחר אחד אינן מוצגות) | |||
| שורה 8: | שורה 8: | ||
|ICD-9= | |ICD-9= | ||
|MeSH= | |MeSH= | ||
| − | |יוצר הערך=ד"ר מיגל שטיין, ד"ר מנחם רתם{{ש}} | + | |יוצר הערך=ד"ר מיגל שטיין, ד"ר מנחם רתם{{ש}} {{ש}}וכן ד"ר אורית קרני רחקוביץ' |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| שורה 106: | שורה 106: | ||
===הטיפול בגלוקוקורטיקואידים=== | ===הטיפול בגלוקוקורטיקואידים=== | ||
| − | |||
הטיפול ב[[גלוקוקורטיקואידים]] הוא בשימוש רב בחולי דלקת אאוזינופילית בוושט{{הערה|שם=הערה11}}. הטיפול בסטרואידים מערכתיים ניתן בזמן התלקחות המחלה ולזמן קצר עד שהמחלה מתייצבת. טיפול מקומי (Topical) הוא לשימוש לטווח ארוך ולשמירת המחלה ברגיעה. טיפול סטרואידלי טופיקלי, כגון ב-[[Fluticasone]]{{כ}} (בבליעה ולא בשאיפה) מביא לריפוי בכ-50–70 אחוזים מהחולים{{הערה|שם=הערה10}}{{הערה|שם=הערה11}}. תכשירים המכילים [[Budesonide]] בבליעה (במדינות שקיים בהן) הם חלופה טובה{{הערה|שם=הערה31|https://www.ema.europa.eu/en/documents/product-information/jorveza-epar-product-information_en.pdf, https://pdf.hres.ca/dpd_pm/00053852.PDF}}. חולים אטופיים (Atopic) הגיבו פחות לטיפול מאלו שאצלם לא נמצא גורם אלרגי, דבר המצביע שהחולים האלרגים ממשיכים להיחשף לאלרגנים הנשאפים או במזון, והטיפול הסטרואידלי, על כן, הוא יעיל פחות. כמו כן, אנשים עם גובה או משקל נמוכים, כגון ילדים, הגיבו טוב יותר לטיפול המקומי. תצפית זו מצביעה על הצורך להעלות את הסטרואידים הניתנים באופן מקומי בחולים שלא הגיבו. קיימת גם אפשרות שחלק מהחולים אינם מגיבים עקב התפתחות תנגודת לסטרואידים. | הטיפול ב[[גלוקוקורטיקואידים]] הוא בשימוש רב בחולי דלקת אאוזינופילית בוושט{{הערה|שם=הערה11}}. הטיפול בסטרואידים מערכתיים ניתן בזמן התלקחות המחלה ולזמן קצר עד שהמחלה מתייצבת. טיפול מקומי (Topical) הוא לשימוש לטווח ארוך ולשמירת המחלה ברגיעה. טיפול סטרואידלי טופיקלי, כגון ב-[[Fluticasone]]{{כ}} (בבליעה ולא בשאיפה) מביא לריפוי בכ-50–70 אחוזים מהחולים{{הערה|שם=הערה10}}{{הערה|שם=הערה11}}. תכשירים המכילים [[Budesonide]] בבליעה (במדינות שקיים בהן) הם חלופה טובה{{הערה|שם=הערה31|https://www.ema.europa.eu/en/documents/product-information/jorveza-epar-product-information_en.pdf, https://pdf.hres.ca/dpd_pm/00053852.PDF}}. חולים אטופיים (Atopic) הגיבו פחות לטיפול מאלו שאצלם לא נמצא גורם אלרגי, דבר המצביע שהחולים האלרגים ממשיכים להיחשף לאלרגנים הנשאפים או במזון, והטיפול הסטרואידלי, על כן, הוא יעיל פחות. כמו כן, אנשים עם גובה או משקל נמוכים, כגון ילדים, הגיבו טוב יותר לטיפול המקומי. תצפית זו מצביעה על הצורך להעלות את הסטרואידים הניתנים באופן מקומי בחולים שלא הגיבו. קיימת גם אפשרות שחלק מהחולים אינם מגיבים עקב התפתחות תנגודת לסטרואידים. | ||
| שורה 158: | שורה 157: | ||
</div> | </div> | ||
{{שש}} | {{שש}} | ||
| − | {{ייחוס|ד"ר מיגל שטיין, המכון למחלות ריאה ואלרגיה ואימונולוגיה קלינית, המרכז הרפואי אסף הרופא, צריפין; ד"ר מנחם רתם, השירות לאלרגיה אסתמה ואימונולוגיה, מרכז רפואי עמק, עפולה}} | + | {{ייחוס|ד"ר מיגל שטיין, המכון למחלות ריאה ואלרגיה ואימונולוגיה קלינית, המרכז הרפואי אסף הרופא, צריפין; ד"ר מנחם רתם, השירות לאלרגיה אסתמה ואימונולוגיה, מרכז רפואי עמק, עפולה{{ש}}עריכה כללית והוספת פרק הטיפול ד"ר אורית קרני רחקוביץ' (ביולי 2022)}} |
{{שש}} | {{שש}} | ||
<center>'''פורסם בכתב העת Israeli Journal of Pediatrics, דצמבר 2009, גיליון מס' 70, מדיקל מדיה'''</center> | <center>'''פורסם בכתב העת Israeli Journal of Pediatrics, דצמבר 2009, גיליון מס' 70, מדיקל מדיה'''</center> | ||
גרסה אחרונה מ־11:54, 9 בינואר 2024
| דלקת אאוזינופילית בוושט | ||
|---|---|---|
| Eosinophilic esophagitis | ||
| יוצר הערך | ד"ר מיגל שטיין, ד"ר מנחם רתם וכן ד"ר אורית קרני רחקוביץ' |
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – דלקת, הפרעות אאוזינופיליות של מערכת העיכול
הפרעות ראשוניות של מערכת העיכול מתסנין של תאים אאוזינופיליים (או EGID - Eosinophilic Gastrointestinal Disorders) מוגדרות כהפרעות שמשפיעות באופן בררני על מערכת העיכול ומלוות בדלקת עם אאוזינופילים בהיעדר סיבה ברורה לאאוזינופיליה (כגון: תגובה לתרופות, זיהומים ומחלות ממאירות)[1].
המחלות מתחלקות לפי האזורים שבהם נמצאים האאוזינופילים וגורמים לתהליך הדלקתי:
- בוושט - Eosinophilic esophagitis
- בקיבה - Eosinophilic gastritis
- בקיבה ובמעי הדק - Eosinophilic gastroenteritis
- במעי הדק לבדו - Eosinophilic enteritis
- במעי הגס - Eosinophilic colitis
יכולים להיות תסנינים גם ביותר מאזור אחד. שכיחות המחלות גדלה, וקיים ויכוח האם העלייה בהפרעות ראשוניות של מערכת העיכול מתסנין של תאים אאוזינופיליים ובמיוחד בדלקת אאוזינופילית בוושט היא עלייה אמיתית או שהיא ביטוי של עירנות ואבחון טוב יותר[2][3].
יש גורמים גנטיים וסביבתיים להתפתחות המחלה. הפרעות אאוזינופיליות של מערכת העיכול הן פוליגנטיות (Polygenic) ומנגנוני ההתפתחות אינם ברורים, אך קשורים למנגנונים של מחלות אלרגיות (IgE mediated), מנגנונים לא קשורים לרגישות אטופית (Non-IgE mediated) ומנגנונים של שפעול תאי לימפוציטים מסוג TH2 (Delayed Th2 Type Response) [1][4][5]. ידוע כי לכ־10 אחוזים מהחולים הסובלים מהפרעות אאוזינופיליות של מערכת העיכול יש קרובי משפחה הסובלים מאותה מחלה. ישנם גורמים אלרגיים במחלה, עובדה הבאה לידי ביטוי בכך ש- 75 אחוזים מהחולים הסובלים מהפרעות אאוזינופיליות של מערכת העיכול הם אטופים (סובלים גם מגנחת הסימפונות, נזלת אלרגית, דלקת עור אטופית). מחקרים שבוצעו הן בעכברים והן בבני אדם הראו קשר סביבתי של אלרגנים נשאפים עם דלקת אאוזינופילית של הוושט מלווה בעלייה בתסמינים בעונות המעבר ובעיקר באביב ועם אבחון מוגבר באותה תקופה של השנה[6][7]. כמו כן, נמצא קשר לאלרגנים של מזון[8], כך שהימנעות מהגורם האלרגני במזון יכולה להביא לריפוי המצב הפתולוגי והקליני[9]. מעניינת העובדה שלמרות הימצאות של IgE ספציפי למזון, רוב החולים אינם מפתחים תגובה מיידית (אנפילקטית) למזון הרלוונטי[2]. מכאן שהפרעות אאוזינופיליות של מערכת העיכול קשורות למנגנון שהוא בין תגובה מיידית ל-IgE לתגובה של רגישות יתר מאוחרת הפועלת במנגנון תאי (T cell mediated hypersensitivity) ובדומה למחלת הכרסת (Celiac, רגישות לגלוטן). חולים עם הפרעות אאוזינופיליות של מערכת העיכול סובלים מקשיי גדילה, כאבי בטן, הקאות, שלשולים, אי שקט וקשיי בליעה (Dysphagia)[2][10].
אפידמיולוגיה
דיווחים על דלקת אאוזינופילית של הוושט מוכרים בכל היבשות חוץ מאפריקה, אבל השכיחות המדויקת של המחלה לא ידועה[10][11]. בארצות הברית דווח על דלקת אאוזינופילית בוושט ב־10 אחוזים מילדים עם מחלת ההחזר הוושטי שלא הגיבו לטיפול בנוגדי חומצה (PPI), או ב־6 אחוזים מהחולים עם דלקת בוושט (Esophagitis). השכיחות של דלקת אאוזינופילית של הוושט באוסטרליה היא 1:70,000 במבוגרים, בשווייצריה דווחה שכיחות של 1:4,000 במבוגרים[12], ובשוודיה בסביבות ה-0.4 האחוז. השכיחות בילדים, כפי שנמצא במרכז בסינסינטי, מוערכת ב־0.1 האחוז במעקב של 9 שנים[4]. ההערכה היא של 1:10,000 מקרים חדשים בשנה (Incidence) ושכיחות (Prevalence) של כ־4-8:10,000 חולים בדלקת אאוזינופילית של הוושט באוכלוסיית הילדים. המחקרים האפידמיולוגיים מראים שדלקת אאוזינופילית בוושט פחות שכיחה מכרסת, אבל שכיחה כמו מחלות מעי דלקתיות (IBD), ואפילו יותר ממחלת קרון[1]. ערנות וחשד קליני לדלקת אאוזינופילית בוושט מביאים לאבחון טוב יותר, עקב כך המחלה מאובחנת יותר. בדיקה רטרוספקטיבית שנעשתה של ביופסיות של חולים שאובחנו כסובלים מדלקת כרונית בוושט (Esophagitis) או ממחלת ההחזר הוושטי בשנות ה-90, הראתה שעל פי הקריטריונים הנוכחיים, כ־30 אחוזים מהן מתאימות לקריטריונים של דלקת אאוזינופילית בוושט[13].
בישראל טרם בוצע סקר או מחקר על שכיחות המחלה, אבל ההערכה שהשכיחות דומה לשכיחות שבארצות הברית. הערכה זו מתאימה ל־700 חולי דלקת אאוזינופילית בוושט חדשים בשנה ולכך שקיימים בישראל כ־5,000 חולים הסובלים מדלקת אאוזינופילית בוושט.
מקבוצת ההפרעות האאוזינופיליות של מערכת העיכול דלקת אאוזינופילית בוושט היא השכיחה ביותר.
אטיולוגיה
דלקת אאוזינופילית בוושט היא מחלה ראשונית של הוושט, עם מאפיינים קליניים ופתולוגיים ספציפיים, הבאים לידי ביטוי בתסמינים של מערכת העיכול העליונה, עם הימצאות של אאוזינופילים ברירית הוושט בכמות העולה על 15 אאוזינופילים בשדה הגדלה של 400 X (High-power field, HPF)[11].
שלא כמו בחלקים אחרים של מערכת העיכול, ברירית הוושט אין באופן תקין תאים אאוזינופיליים. הימצאות של תאי אאוזינופילים בוושט מצביעה על פתולוגיה. פתולגיה זו אינה ספציפית למחלה מסוימת, וניתן לראות אאוזינופילים ברירית הוושט הן במצבים של דלקת אאוזינופילית בוושט, בדלקת קיבה אאוזינופילית (Eosinophilic gastroenteritis), או כשילוב של מחלות מסוג הפרעות אאוזינופיליות של מערכת העיכול[1], והן במצבים רבים כולל מחלת ההחזר הוושטי (Gastroesophageal reflux disease - GERD), דלקת כרונית של הוושט, זיהומים על ידי טפילים, נגיפים (כגון: הרפס) ופיטריות (כגון: קנדידה), מחלות ממאירות, מחלות דלקתיות של מערכת העיכול (מחלות מעי דלקתיות, מחלת קרון), תסמונת היפראאוזינופילית, סקלרודרמה, מצבים המשניים לתרופות או יטרוגנים, כגון: נזק על ידי סודה קאוסטית או מדיכוי של המערכת החיסונית לאחר השתלות[1][10][11].
בפתוגנזה של EE מעורבים גורמים אטופיים, כגון: אלרגנים למזון ואלרגנים נשאפים, בשילוב גורמים גנטיים, כגון ביטוי יתר של Eotaxin-3 שהוא כימוקין (Chemokine) שמושך את תאי האאוזינופילים לוושט[5][14]. יש מחקרים הקושרים את התהליך הדלקתי בוושט עם תהליך דלקתי בריאות. קשר זה מתבסס על מודלי עכבר שבהם אלרגנים נשאפים (כגון: אספרגילוס) [15] או גירוי בקנה עם אינטרלאוקין 13 (IL13) הגורם לעכברים לפתח דלקת אאוזינופילית בוושט[16].
מודלים של דלקת אאוזינופילית בוושט בעכברים יוצרו תוך חשיפה לאלרגנים נשאפים או תוך שימוש בעכברים טרנסגניים עם ביטוי יתר של ציטוקינים המופרשים מתאי לימפוציטים מסוג Th2. בדוגמה של אספרגילוס (Aspergillus fumigatus) החשיפה המתמשכת באף\קנה של העכברים גורמת להם לפתח דלקת אאוזינופילית בריאות ובוושט בלבד ולא בחלקים אחרים של מערכת העיכול.
עכברים טרנסגניים לאינטרלאוקין 5 (IL5, הציטוקין מסוג Th2 שמשפיע במיוחד על אאוזינופילים) מפתחים דלקת אאוזינופילית בוושט, וחסימה של הציטוקין IL5 (עם נוגדן נגד IL5) מונעת את התפתחות הדלקת בוושט במודלים אלו וגם במודלים של IL13 [16]. במודל שבו החדרת IL13 (גם הוא ציטוקין מסוג Th2) בקנה של עכברים, גורמת לתסנין אאוזינופילי להתפתח בוושט (תסנין דמוי דלקת אאוזינופילית בוושט), התסנין גדל באופן ישיר עם המינון העולה של IL13. גם כאן התהליך ניתן לחסימה עם נוגדן שחוסם את הפעילות של IL13 [17]. באנשים הסובלים מהמחלה, המנגנון האלרגי בא לידי ביטוי בכך שחולי דלקת אאוזינופילית של הוושט יכולים להבריא, כשמונעים מהם את החשיפה לאלרגנים של מזון או כשמטפלים בהם בנוגדן נגד IL5 (Mepolizumab). דבר זה המצביע על המנגנונים הרלוונטיים[18].
מעניין, כי למרות הרגישות הגבוה לאלרגנים תזונתיים רוב החולים אינם מפתחים תגובות אנפילקטיות[2]. יתר על כך, יש חולים המדווחים על שינוי בתסמינים בעונות המעבר, דבר המצביע אולי על קשר לאלרגנים נשאפים המשפיעים על האאוזינופילים בוושט[6][7]. נוסף על כך, גם חשיפה של אלרגנים דרך העור (Epicutaneous allergen sensitization) מגבירה את תגובת אלרגנים הנשאפים לפתח דלקת אאוזינופילית בוושט במודלים של דלקת אאוזינופילית בוושט בעכברים[19].
חולי דלקת אאוזינופילית בוושט מראים מבנה גנטי שבו גנים שעוברים ביטוי יתר, כגון Eotaxin-3, וגנים שעוברים דיכוי או ביטוי מופחת, כגון הגן פילגרין (Filaggrin)[14], שהוא גן הקשור למבנה העור המאפשר תפקוד יעיל של העור (Structural barrier protein). ביטוי ירוד של פילגרין ירוד גורם לליקוי בעור כחיץ בין הגוף לסביבתו (Barrier dysfunction), כפי שנמצא בחלק גדול של המצבים של דלקת עור אטופית. IL13 עלול לגרום להפחתת הביטוי של פילגרין בקרטינוציטים, כך שאלרגנים למזון יכולים לגרום לתגובה דלקתית מסוג Th2 ולהחמיר בכך את חוסר התפקוד ההגנתי של דופן הרירית בוושט[5][14]. מצב זה גורם לכך שכמות גדולה יותר של אלרגן תוכל לחדור עקב ספיגת יתר מקומית. בחולי דלקת אאוזינופילית בוושט רואים קשר משפחתי ברור, כך שנוסף על גנטיקה, למצב אלרגי (אטופי) גם הגורם הגנטי הוא בעל תפקיד חשוב. הנתונים מראים כי כ־10 אחוזים מהורים של חולי דלקת אאוזינופילית בוושט סבלו מעצירויות בוושט ובכ־8 אחוזים מההורים נמצאו גם אבחנות פתולוגיות של דלקת אאוזינופילית בוושט. כמו כן, יש עלייה בסיכוי לפתח דלקת אאוזינופילית בוושט באחים של חולים עם דלקת אאוזינופילית בוושט[4][20][21].
קליניקה
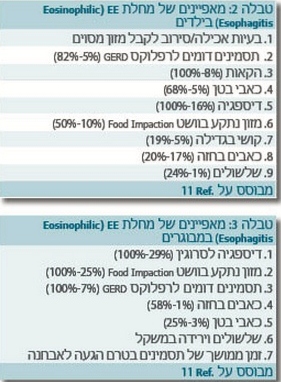
דלקת אאוזינופילית בוושט יכולה להופיע בילדים ובמבוגרים מגיל חצי שנה ועד גיל 89 שנים[11]. הגיל הממוצע בילדים הוא 8.6 ובמבוגרים 38 שנים, והמחלה נראית בגברים (70 אחוזים) יותר מאשר בנשים.
מחלת המחלה יכולה לבוא לידי ביטוי בצורות שונות. לחולים יש בדרך כלל קושי באכילה, קושי בגדילה, בחילה והקאה חוזרת, כאב בטן ו\או כאב בבית החזה, קושי בבליעה וקושי בהעברת המזון לקיבה (Food impaction). תסמינים אלו באים לידי ביטוי בצורה מתקדמת מהיילוד למבוגר[2][4][11]. חולים מבוגרים יכולים להגיע למיון עם כאב בחזה לאחר אכילה והרגשה שהאוכל נתקע בוושט (Food impaction). חולים אלו טופלו במקרים רבים בטיפול נגד מחלת ההחזר הוושטי ללא שינוי במצבם. חולים עם דלקת אאוזינופילית בוושט הם בדרך כלל צעירים, גברים, עם שכיחות יתרה של מחלות אלרגיות אטופיות עם בדיקת חומציות בוושט שהיא תקינה לעומת חולים במחלת ההחזר הוושטי.
אף על פי שדלקת אאוזינופילית בוושט אובחנה לראשונה בילדים, המחלה נמצאת גם במבוגרים עם מאפיינים דומים (כולל רגישות אטופית). המחלה היא מחלה כרונית שלא חולפת עצמונית. חלק מהחולים מראים, כאמור, שינויים עונתיים של התסמינים, ייתכן שבהקשר של חשיפה לאלרגנים סביבתיים. טבלאות 2 ו-3 מסכמות את המאפיינים הקליניים בילדים ובמבוגרים[11].
אבחנה
האבחנה של דלקת אאוזינופילית בוושט נעשית על בסיס החשד הקליני, אבל חייבת ביסוס בעזרת ביופסיה. מכיוון שהמחלה מפוזרת ולא הומוגנית, נדרשים לפחות 3 דגימות מאזורים שונים של הוושט (אזור עליון, אמצעי ותחתון) כדי להגיע לרגישות אבחנתית של 84–97 אחוזים[11][22][23]. הפענוח של התשובה הפתולוגית צריך להיות בהתאמה עם ההסתמנות הקלינית. לדוגמה, ביופסיה עם 6 אאוזינופילים בשדה מיקרוסקופי בשדה הגדלה של 400 X (HPF) מצביעה על מחלת ההחזר הוושטי, אך ממצא של יותר מ-20–24 אאוזינופילים בשדה מיקרוסקופי בשדה הגדלה של 400 X מצביע על דלקת אאוזינופילית בוושט, במיוחד כשהחולה אינו מגיב לטיפול נגד מחלת ההחזר הוושטי. קבוצת מומחים לדלקת אאוזינופילית של הוושט הגיעו בשנת 2007 להסכמה (קונצנזוס) על האבחנה של דלקת אאוזינופילית של הוושט כמחלה שבה החולים סובלים מקושי בבליעה, קושי בהעברת המזון לקיבה (Food impaction - הבולוס התזונתי ניתקע בוושט ואינו יורד לקיבה, שכיח יותר במבוגרים), בעיות אכילה (Feeding Intolerance) ורפלוקס (שכיח יותר בילדים) וממצא בביופסיה של יותר מ־15 אאוזינופילים בשדה הגדלה של 400 X ברירית של הוושט ולאחר שנשללו גורמים אחרים לאאוזינופיליה בוושט[11]. הימצאות אאוזינופילים בוושט העליון והתחתון תומך יותר באבחנה של דלקת אאוזינופילית בוושט ולא של מחלת ההחזר הוושטי. כמו כן, קיימים קריטריונים נוספים בבדיקה הפתולוגית שהם לא ספציפיים, אבל עשויים לסייע ולתמוך באבחנה בדלקת אאוזינופילית בוושט בהקשר הכללי. ממצאים אלו כוללים: היפרפלזיה של השכבה הבזלית (Basal layer hyperplasia), הרחבה של הפפילות (Papillary lengthening), מיקרו-אבצסים של אאוזינופילים (קבוצות ריכוז של 4 או יותר אאוזינופילים Eosinophilic microabscesses), דגרנולציה של הגרנולות של האאוזינופילים, עלייה במספר התאים הדנדריטיים, תאי הפיטום (Mast cells) ולימפוציטים.
בביופסיות שבהן ניתן למצוא גם למינה פרופריה (Lamina propria), אפשר גם לראות ריבוי קולגן כביטוי של התחלת תהליך פיברוטי (Esophageal remodeling)[21].
בדיקות מעבדה
בדיקת ספירת דם לאאוזינופילים
10 עד 50 אחוזים מהחולים המבוגרים ו-20 עד 100 אחוזים מהילדים עם דלקת אאוזינופילית של הוושט מראים אאוזינופיליה בדם הפריפרי, אבל במידה קלה (פחות מפי 2 מהנורמה)[11]. מספר מאמרים הראו קשר ישיר בין חומרת האאוזינופיליה לבין הקושי בבליעה וחומרת המחלה. חשוב לעקוב אחר רמת האאוזינופיליה בדם בשלבי אבחנה ובתגובה לטיפול התרופתי והתזונתי במהלך המעקב של המחלה.
בדיקת סך IgE בדם
69-60 אחוזים מהחולים המבוגרים ו-71–78 אחוזים מהילדים עם דלקת אאוזינופילית בוושט מראים עלייה ברמת ה- IgE בדם. עקב השכיחות הגבוהה של מחלות אטופיות בחולי דלקת אאוזינופילית בוושט, בדיקת Total Ige אינה מומלצת עקב חוסר המתאם הספציפי למחלה[11].
בדיקת ציטוקינים וכימוקינים בדם וברקמות
במעט מחקרים שחקרו את רמת הציטוקינים בסרום של חולי דלקת אאוזינופילית בוושט, נמצאו רמות מוגברות של אינטרלאוקין (IL) 31 בכ־50 אחוזים מהחולים בדלקת אאוזינופילית בוושט מבוגרים ללא שינוי ברמת ה-IL5 או ברמת האינטרפרון גמה (IFN-γ). התגלו בפלזמה של חולי דלקת אאוזינופילית בוושט מבוגרים וילדים רמות כפולות של הכימוקין Eotaxin-3, ללא שינוי ב-Eotaxin-2 או ב-Eotaxin-1, כך שנבחנת האפשרות להשתמש ב- Eotaxin-3 בדם כמסמן עזרה אבחנתית לדלקת אאוזינופילית בוושט. כמו כן, הביטוי הגנטי של Eotaxin-3 בביופסיות הוושט נמצא מוגבר פי 50–100 בחולים עם דלקת אאוזינופילית בוושט, בהשוואה לחולים עם דלקת כרונית בוושט לא אאוזינופילית או לבריאים[5][10][14]. יש דיווחים על רמות מוגברות של IL5 ו-TNF-α ברקמות ביופסיות של חולי דלקת אאוזינופילית בוושט. לא נמצאה רמה מוגברת של ציסטיניל לויקוטריאנים (Cysteinyl leukotriene expression) כך שהשימוש בSingulair (Montelukast) אינו מומלץ[11].
בדיקות הדמיה ואנדוסקופיה
בבדיקה אנדוסקופית של הוושט ניתן לראות היצרויות, טבעות ברירית (כולל טבעת על שם Schatzki), כיבים, הפרשות לבנות פפולריות, בצקת ברירית, רירית עם פסים ארוכים (Longitudinal furrowing) ורירית בצורת "נייר קרפ" (Crepe paper mucosa). למרות זאת, עד 30 אחוזים מהחולים יכולים להיות עם אנדוסקופיה תקינה, דבר המחזק את החשיבות לביצוע ביופסיות לאבחנת המחלה[24][25].
ביצוע צילומי הדמיה (כגון: בליעת בריום) עוזר לשלול סיבות אחרות להקאה החוזרת, ולפעמים לאבחן היצרויות שיעזרו בהחלטה אם לבצע טיפול בהרחבות אנדוסקופיות. בדיקות ההדמיה אינן יכולות עם זאת להחליף את האנדוסקופיה והביופסיה שהן הכרחיות לאבחנה.
הערכה אלרגית
- תבחיני עור
לביצוע הערכה אלרגית כולל תבחיני עור חשיבות רבה להערכה ולבירור של גורמים אלרגניים כגורם אטיולוגי של המחלה[1][2][3][4][5][6][7][8][9][10][11]. העובדה ש- 70 אחוזים מהחולים הם אטופיים (חולים עם דלקת אאוזינופילית בוושט הסובלים גם מדלקת עור אטופית, נזלת אלרגית ו\או גנחת הסימפונות) ושהימנעות מחשיפה לאלרגנים הרלוונטיים בתזונה (Allergen-free diets) יכול להביא לריפוי קליני ופתולוגי של המחלה מצדיקים לעשות כל מאמץ כדי להגיע לאטיולוגיה אפשרית ולהימנעות מהגורמים האלרגנים[9][11][25][26][27]. בתבחיני העור מסוג Skin prick test (SPT) נבדקת רגישות ספציפית אלרגית מיידית מסוג IgE לאלרגנים נשאפים ולאלרגנים למזון.
מכיוון שבמנגנון הפתופיזיולוגי של המחלה יש הפעלה של תאי לימפוציטים מסוג Th2 המפרישים ציטוקינים IL4 ,IL5 ו-IL13, שגורמים להפעלה ולשמירה ברקמות של אאוזינופילים ותאי פיטום, חשוב גם לבצע בירור של תגובות מאוחרות[5] (Delayed type hypersensitivity). בירור תגובות מאוחרות למזון שלא כמו במגנון המיידי של IgE (המתבצע בבדיקת ה- SPT), מתבצעות בשיטת תבחיני מטלית או Patch test. בבדיקת מטלית למזון (Atopy patch test) שבו נבדקים מזונות רבים לאחר חשיפה למגע ישיר עם העור של החולה במשך 48 שעות. תגובה חיובית גורמת לדלקת מקומית שחשוב להבדילה מתגובה לא ספציפית (Irritant). בדיקת תבחיני העור בשיטת המטלית היא בדיקה מוכרת ומאושרת לגורמים כימיים רבים. הבעיה בתבחיני מטלית למזון, שלא כמו ב- SPT היא, שהבדיקה טרם עברה סטנדרדיזציה, כך שעדיין אין הסכמה על אופן הביצוע ותוצאותיו[11][28].
תוצאות חיוביות של SPT למזון (2/3 מהחולים) שיעורן בממוצע 2–6 (4±) אלרגנים שונים לחולה. האלרגנים השכיחים הנמצאים בבדיקת SPT בארצות הברית הם לבוטנים, לביצה, לסויה, לחלב פרה ולחיטה. כמו כן, בשכיחות נמוכה יותר לשעועית, לשיבולת שועל ולבשר. ה-SPT הוא שלילי בשליש מהחולים. בישראל קיימת גם שכיחות גבוהה יחסית של רגישות אלרגית לשומשום.
בדיקת ה-Atopy patch test מגלה שכיחות לאלרגנים של חלב, ביצה, סויה, עוף וחיטה.
הימנעות מהמאכלים שהתגלו בתבחינים אלו בחולים הרגישים, מביאה ל־77 אחוזים שיפור קליני ופתולוגי בביופסיה, וניתן להגיע לשיפור של כ־98 אחוזים בדיאטה בסיסית (Elemental diet) המתבססת רק על חומצות אמינו, היות שלא כל האלרגנים ניתנים לגילוי בתבחינים העוריים[25][26][27].
אבחנה מבדלת עם מחלת ההחזר הוושטי
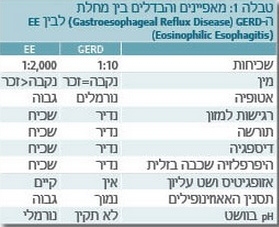
כאמור האבחנה של דלקת אאוזינופילית של הוושט צריכה להתבצע לאחר שלילת כל הגורמים האחרים לאאוזינופיליה, ובמיוחד מחלת ההחזר הוושטי. התסמינים של דלקת אאוזינופילית בוושט דומים לתסמינים של רפלוקס, אבל המחלות שונות בהיסטופתולוגיה, בגנטיקה ותורשה, בתגובה לטיפול ובקשר למחלות אלרגיות. בדרך כלל ניתן לבדל את הדלקת אאוזינופילית בוושט ממחלת ההחזר הוושטי כי האאוזינופיליה נמשכת לאחר טיפול אינטנסיבי בנוגדי חומצה מסוג מעכבי משאבות פרוטונים (Proton pump inhibitors), טיפול שעוזר במחלת ההחזר הוושטי ולא בדלקת אאוזינופילית בוושט. טבלה 1 מסכמת את ההבדלים בין דלקת אאוזינופילית בוושט לבין מחלת ההחזר הוושטי.
טיפול
המהלך הטבעי של המחלה ללא טיפול אינו ברור. הילדים מתחילים לסבול מקשיי אכילה, חוסר גדילה והקאה חוזרת עם מחלת ההחזר הוושטי הנמשך גם בגילאי בית הספר. בגיל בית הספר המחלה מתאפיינת יותר בכאב בטן מלווה בהקאה ובגיל ההתבגרות ולאחריו - בקשיי בליעה וקושי בהעברת המזון לקיבה [4][11]. עם זאת, עדיין לא ברור אם מדובר במהלך הטבעי של התפתחות המחלה או בביטויים פנוטיפיים שונים של דלקת אאוזינופילית בוושט. התסמינים יכולים להיות אקראיים ולהופיע לסירוגין בתקופות קשות או קלות יותר. חולים ללא תלונות יכולים להיות עם פתולוגיה ואאוזינופיליה קשה בוושט[22][23]. דלקת אאוזינופילית בוושט בילדים יכולה להיות מחלה כרונית יציבה או פרוגרסיבית שמתפתחת, ולא ידוע על חולים שהבריאו או עברו רגיעה (רמיסיה) ללא טיפול. כמו כן, היסטולוגית וגם קלינית המחלה חוזרת כשמפסיקים את הטיפולים בדיאטה או בסטרואידים[2][9][10][28][25].
חשוב לטפל במחלה בילדים עם ביטויים קליניים, כי ילדים שטופלו לא פיתחו קשי בליעה או פיברוזיס. עם זאת, כשמדובר בחולים ללא תסמינים, קיימים חילוקי דעות לגבי התחלת טיפול[11]. במבוגרים דלקת אאוזינופילית בוושט היא מחלה כרונית מתמדת שפירה, ואין דיווחים שמראים על התפתחות למחלה ממארת. עם זאת, המחלה משפיעה באופן משמעותי על איכות החיים. דלקת אאוזינופילית בוושט יכולה להישאר יציבה וללא שינוי עם השנים, אך כמחלה כרונית היא עלולה להיות מלווה בהתפתחות פיברוזיס והיצרויות קשות בוושט. כמו כן, קיים גם סיכון להתנקבות הוושט לאחר הקאות רבות במאמץ[10].
הטיפול בדלקת אאוזינופילית בוושט מתבסס על הימנעות מאלרגנים בדיאטה, בטיפולים נוגדי דלקת ובהרחבות מכניות של הוושט כטיפול בהיצרויות קשות[11]. הטיפול הראשוני הוא טיפול נגד רפלוקס ובמיוחד נוגדי חומצה (PPI) גם כתהליך אבחנתי אך גם מכיוון שחומצה גורמת לגירוי ברירית המודלקת בוושט. הטיפול המניעתי בדיאטה מתבסס על התוצאות של תבחיני עור לאלרגיה (אם נמצאו אלרגנים ספציפיים)[2][25][26][28] או הימנעות אמפירית של מזונות אלרגניים שכיחים (Restricted diet)[27] או בתזונה בסיסית (המתבסס בפורמולות של חומצות אמינו). במצב שבו נמצאים אלרגנים קיימת עדות לרגישות יתר לרוב המזונות[9][25]. הוצאת האנטיגנים שבמזון יכולה להביא לריפוי של 98 אחוזים מהחולים. הבעיה העיקרית היא שדיאטות בסיסיות הן קשות לביצוע משלוש סיבות: החולה מתקשה לקבל את הכמות התזונתית דרך הפה, ולפעמים הדבר דורש הכנסת זונדה או הכנסת צינור לאכילה בגסטרוסטומיה, הטעם של חלק מהפורמולות והמחיר היקר יחסית.
הטיפול בגלוקוקורטיקואידים
הטיפול בגלוקוקורטיקואידים הוא בשימוש רב בחולי דלקת אאוזינופילית בוושט[11]. הטיפול בסטרואידים מערכתיים ניתן בזמן התלקחות המחלה ולזמן קצר עד שהמחלה מתייצבת. טיפול מקומי (Topical) הוא לשימוש לטווח ארוך ולשמירת המחלה ברגיעה. טיפול סטרואידלי טופיקלי, כגון ב-Fluticasone (בבליעה ולא בשאיפה) מביא לריפוי בכ-50–70 אחוזים מהחולים[10][11]. תכשירים המכילים Budesonide בבליעה (במדינות שקיים בהן) הם חלופה טובה[29]. חולים אטופיים (Atopic) הגיבו פחות לטיפול מאלו שאצלם לא נמצא גורם אלרגי, דבר המצביע שהחולים האלרגים ממשיכים להיחשף לאלרגנים הנשאפים או במזון, והטיפול הסטרואידלי, על כן, הוא יעיל פחות. כמו כן, אנשים עם גובה או משקל נמוכים, כגון ילדים, הגיבו טוב יותר לטיפול המקומי. תצפית זו מצביעה על הצורך להעלות את הסטרואידים הניתנים באופן מקומי בחולים שלא הגיבו. קיימת גם אפשרות שחלק מהחולים אינם מגיבים עקב התפתחות תנגודת לסטרואידים.
הטיפול נסבל היטב, אך יש להיות עירניים להחמרה בקושי בבליעה במהלך הטיפול היכולה להיות משנית לקנדידה (Candidiasis) וושטית.
טיפולים ביולוגיים
Dupilumab (Dupixent) - מעכב אלפא (Alpha antagonist) לקולטן Interleukin-4 (IL) ניתן למטופלים שלא מגיבים לטיפול סטרואידלי. הטיפול אושר לשימוש בארצות הברית לטיפול בדלקת אאוזינופילית של הוושט במבוגרים ובילדים מגיל 12 שנים ומעלה ובמשקל של 40 קילוגרמים ויותר[30][31], Dupilumab שיפר את הקושי בבליעה. תופעות לוואי של התרופה היו תגובה מקומית באזור ההזרקה, זיהום של דרכי נשימה עליונות, כאבי מפרקים וזיהומים של נגיף ה-Herpes. המינון הניתן הוא 300 מיליגרמים, תת-עורית, אחת לשבוע[32]. אין צורך בניטור מעבדתי.
הטיפול ב-Dupilumab יקר, ולכן מיועד לטיפול במחלה רפרקטורית (Refractory) או לאלו שלא מעוניינים באפשרויות אחרות. כן, מטופלים הסובלים משילוב של דלקת אאוזינופילית של הוושט ומצבים אטופיים (לדוגמה - אסתמה קשה, אקזמה ועוד) יכולים להיות מועמדים לטיפול ב-Dupilumab בשל הרווח בטיפול אחד לשני המצבים הרפואיים.
הרחבת הוושט
הרחבת היצירויות של הוושט יעילה להקלה על הקושי בבליעה, אך אינה משפיעה על הדלקת[33][34],
טיפולים נסיוניים
תרופות ביולוגיות
נוגדנים חד-שבטיים כנגד IL-13 - שנמצא ציטוקין המעורב בפתולוגיה של הדלקת.
Mepolizumab - נוגדן חד-שבטי כנגד IL-5, אשר לו תפקיד מרכזי בגיוס האאוזינופילים[15][16]. טיפול דרך הווריד, במהלך 3 חודשים (מחזורים של 750 מיליגרמים פעם בחודש). הטיפול שיפר את מצבם הקליני, האנדוסקופי וההיסטולוגי של החולים, עם שיפור באיכות החיים[18]. Mepolizumab הורידה את האאוזינופיליה ברקמות ובדם הפריפרי ברמה משמעותית (פי 10 מהרמה מלפני הטיפול), ורמת האאוזינופילים בדם נשארה נמוכה 3 חודשים לאחר הפסקת הטיפול. הטיפול לא רק הוריד את מספר האאוזינופילים, הוא גם הוריד את תפקודם ופעילותם לגירוי ב-Eotaxins[35].
טיפול בנוגדי IL-5 יכול לשמש להפחתת השימוש בסטרואידים (Steroid sparing) כפי שהוכח בחולים עם תסמונת היפר-אאוזינופילית[36]. בשלב זה מתבצעים מחקרים קליניים רבי משתתפים הבודקים את יעילות ובטיחות השימוש באנטי IL5.
Reslizumab - נוגדן המנטרל IL-5 - נמצא כעת במחקרים קליניים.
נוגדני קולטנים של פרוסטגלנדינים (Prostaglandins) D2 - הקולטן CRTH2 (Chemoattractant receptor-homologous molecule on Th2 cells) מבוטא על ידי תאי ה-T Helper 2, אאוזינופילים ותאי דלקת אחרים אשר מתווכים את ה-Chemotaxis של התאים הללו כתגובה לפרוסטגלנדינים D2.
Montelukast (Singulair) - חוסם קולטן הלויקוטריאנים (Leukotriene Receptor Antagonist).
מעכב Leukotriene שהיה בשימוש בגסטרואנטריטיס אאוזינופילית, אינו מוריד את רמת האאוזינופיליה בוושט[11], אך יכול לעזור בהפחתת התסמינים בחולי דלקת אאוזינופילית של הוושט, אך עם תוצאות לא חד משמעותיות[37],[38][39][40][41],[42].
טיפולים המדכאים את מערכת החיסון
טיפולים ב-Azathioprine וב-Mercaptopurine הדגימו תוצאות שונות[10]. כמו כן, ישנו תיאור מקרה של תגובה היסטולוגית וקלינית ל-Azathioprine או 6-Mercaptopurine בשלושה מבוגרים תלויי סטרואידים[43].
הצוות המטפל
דלקת אאוזינופילית של הוושט היא מחלה רב מערכתית שמאובחנת ומוכרת יותר בעשור האחרון, הדורשת צוות של אנשים שמטפלים וחוקרים את המחלה. להצלחת הטיפול החולים צריכים להיות מטופלים במרכז שבו צוות העובד יחד בשיתוף פעולה כולל רופא הילדים או המשפחה, רופאים מומחים בגסטרואנטרולוגיה, אלרגיה ופתולוגיה, ושירותי ייעוץ בתזונה ובתמיכה נפשית.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Rothenberg ME. Eosinophilic gastrointestinal disorders (EGID). J Allergy Clin Immunol 2004;113:11-28
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Assa’ad AH, Putnam PE, Collins MH, et al. Pediatric patients with eosinophilic esophagitis: an 8-year follow-up. J Allergy Clin Immunol 2007;119:731-738
- ↑ 3.0 3.1 Vanderheyden AD, Petras RE, DeYoung BR, et al. Emerging eosinophilic (allergic) esophagitis: increased incidence or increased recognition? Arch Pathol Lab Med 2007;131:777-779
- ↑ 4.0 4.1 4.2 4.3 4.4 4.5 Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. NEJM 2004;351:940-941
- ↑ 5.0 5.1 5.2 5.3 5.4 5.5 Blanchard C, Wang N, Rothenberg ME. Eosinophilic esophagitis: pathogenesis, genetics and therapy. J Allergy Clin Immunol 2006;118:1054-1059
- ↑ 6.0 6.1 6.2 Wang FY, Gupta SK, Fitzgerald JF. Is there a seasonal variation in the incidence or intensity of allergic eosinophilic esophagitis in newly diagnosed children? J Clin Gastroenterol 2007;41:451-453
- ↑ 7.0 7.1 7.2 Almansa C, Krishna M, Buchner AM, et al. Seasonal distribution in newly diagnosed cases of eosinophilic esophagitis in adults. Am J Gastroenterol 2009;104:828-833
- ↑ 8.0 8.1 Spergel JM. Eosinophilic esophagitis in adults and children: evidence for a food allergy component in many patients. Curr Opin Allergy Clin Immunol 2007;7:274-278
- ↑ 9.0 9.1 9.2 9.3 9.4 Markowitz JE, Spergel JM, Ruchelli E, et al. Elemental diet is an effective treatment for eosinophilic esophagitis in children and adolescents. Am J Gastroenterol 2003;98:777-782
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 10.7 10.8 Rothenberg ME. Biology and treatment of eosinophilic esophagitis. Gastroenterology 2009;137:1238-1249
- ↑ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 11.11 11.12 11.13 11.14 11.15 11.16 11.17 11.18 11.19 Furuta GT, Liacouras CA, Collins MH, et al. Eosinophilic esophagitis in children and adults: a systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology 2007;133:1342-1363
- ↑ Straumann A, Simon HU. Eosinophilic esophagitis: escalating epidemiology? J Allergy Clin Immunol 2005;115:418-419
- ↑ Whitney-Miller CL, Katzka D, et al. Eosinophilic esophagitis: a retrospective review of esophageal biopsy specimens from 1992 to 2004 at an adult academic medical center. Am J Clin Pathol 2009;131:788-792
- ↑ 14.0 14.1 14.2 14.3 Blanchard C, Wang N, Stringer KF, et al. Eotaxin-3 and a uniquely conserved gene-expression profile in eosinophilic esophagitis. J Clin Invest 2006;116:536-547
- ↑ 15.0 15.1 Mishra A, Hogan SP, Brandt EB, et al. An etiological role for aeroallergens and eosinophils in experimental esophagitis. J Clin Invest 2001;107:83-90
- ↑ 16.0 16.1 16.2 Mishra A, Rothenberg ME. Intratracheal IL-13 induces eosinophilic esophagitis by an IL-5, eotaxins-1 and STAT6-dependent mechanism. Gastroenterology 2003;125:1419-1427
- ↑ Blanchard C, Mishra A, Saito-Akei H, et al. Inhibition of human interleukin-13-induced respiratory and oesophageal inflammation by anti-human-interleukin-13 antibody (CAT-354). Clin Exp Allergy 2005;35:1096-1103
- ↑ 18.0 18.1 Stein ML, Collins MH, Villanueva JM, et al. Anti-IL-5 (mepolizumab) therapy for eosinophilic esophagitis. J Allergy Clin Immunol 2006;118:1312-1319
- ↑ Akei HS, Mishra A, Blanchard C, et al. Epicutaneous antigen exposure primes for experimental eosinophilic esophagitis in mice. Gastroenterology 2005;129:985-994
- ↑ Patel SM, Falchuk KR. Three brothers with dysphagia caused by eosinophilic esophagitis. Gastrointest Endosc 2005;61:165-167
- ↑ 21.0 21.1 Collins MH, Blanchard C, Abonia JP, et al. Clinical, pathologic, and molecular characterization of familial eosinophilic esophagitis compared with sporadic cases. Clin Gastroenterol Hepatol 2008;6:621-629
- ↑ 22.0 22.1 Collins MH. Histopathologic features of eosinophilic esophagitis. Gastrointest Endosc Clin North Am 2008;18:59-71
- ↑ 23.0 23.1 Shah A, Kagalwalla AF, Gonsalves N, et al. Histopathologic variability in children with eosinophilic esophagitis. Am J Gastroenterol 2009;104:716-721
- ↑ Dahshan A, Rabah R. Correlation of endoscopy and histology in the gastroesophageal mucosa in children: are routine biopsies justified? J Clin Gastroenterol 2000;31:213-216
- ↑ 25.0 25.1 25.2 25.3 25.4 25.5 Liacouras CA, Spergel JM, Ruchelli E, et al. Eosinophilic esophagitis: a 10-year experience in 381 children. Clin Gastroenterol Hepatol 2005;3:1198-1206
- ↑ 26.0 26.1 26.2 Spergel JM, Andrews T, Brown-Whitehorn TF, et al. Treatment of eosinophilic esophagitis with specific food elimination diet directed by a combination of skin prick and patch test. Ann Allergy Asthma Immunol 2005;95:336-343
- ↑ 27.0 27.1 27.2 Kagalwalla AF, Sentongo TA, Ritz S, et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis. Clin Gastroenterol Hepatol 2006;4:1097-1102
- ↑ 28.0 28.1 28.2 Assa’ad A. Detection of causative foods by skin prick and atopy patch tests in patients with eosinophilic esophagitis: things are not what they seem. Ann Allergy Asthma Immunol 2005;95:309-311
- ↑ https://www.ema.europa.eu/en/documents/product-information/jorveza-epar-product-information_en.pdf, https://pdf.hres.ca/dpd_pm/00053852.PDF
- ↑ Hirano I, Dellon ES, Hamilton JD, Collins MH, Peterson K, Chehade M, Schoepfer AM, Safroneeva E, Rothenberg ME, Falk GW, Assouline-Dayan Y, Zhao Q, Chen Z, Swanson BN, Pirozzi G, Mannent L, Graham NMH, Akinlade B, Stahl N, Yancopoulos GD, Radin A. Gastroenterology. 2020;158(1):111. Epub 2019 Oct 5
- ↑ Dupilumab. US Food & Drug Administration (FDA) approved product information. US Food & Drug Administration. Revised May, 2022. https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/761055s040lbl.pdf
- ↑ Dupilumab. US Food & Drug Administration (FDA) approved product information. US Food & Drug Administration. Revised May, 2022. Available online.https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/761055s040lbl.pdf
- ↑ Schoepfer AM, Gonsalves N, Bussmann C, Conus S, Simon HU, Straumann A, Hirano I. Esophageal dilation in eosinophilic esophagitis: effectiveness, safety, and impact on the underlying inflammation. Am J Gastroenterol. 2010;105(5):1062
- ↑ Robles-Medranda C, Villard F, le Gall C, Lukashok H, Rivet C, Bouvier R, Dumortier J, Lachaux A. Severe dysphagia in children with eosinophilic esophagitis and esophageal stricture: an indication for balloon dilation? J Pediatr Gastroenterol Nutr. 2010;50(5):516
- ↑ Stein ML, Villanueva JM, Buckmeier BK, et al. Anti-IL-5 (mepolizumab) therapy reduces eosinophil activation ex vivo and increases IL-5 and IL-5 receptor levels. J Allergy Clin Immunol 2008;121:1473-1483
- ↑ Rothenberg ME, Klion AD, Roufosse FE, et al. Treatment of patients with the hypereosinophilic syndrome with Mepolizumab. NEJM 2008;358:1215-1228
- ↑ Attwood SE, Lewis CJ, Bronder CS, Morris CD, Armstrong GR, Whittam J. Eosinophilic oesophagitis: a novel treatment using Montelukast. Gut. 2003;52(2):181
- ↑ Stumphy J, Al-Zubeidi D, Guerin L, Mitros F, Rahhal R. Observations on use of montelukast in pediatric eosinophilic esophagitis: insights for the future. Dis Esophagus. 2011;24(4):229. Epub 2010 Nov 12
- ↑ Vanderhoof JA, Young RJ, Hanner TL, Kettlehut B. Montelukast: use in pediatric patients with eosinophilic gastrointestinal disease. J Pediatr Gastroenterol Nutr. 2003 Feb;36(2):293-4
- ↑ Daikh BE, Ryan CK, Schwartz RH. Montelukast reduces peripheral blood eosinophilia but not tissue eosinophilia or symptoms in a patient with eosinophilic gastroenteritis and esophageal stricture. Ann Allergy Asthma Immunol. 2003;90(1):23
- ↑ Lucendo AJ, De Rezende LC, Jiménez-Contreras S, Yagüe-Compadre JL, González-Cervera J, Mota-Huertas T, Guagnozzi D, Angueira T, González-Castillo S, Arias A. Montelukast was inefficient in maintaining steroid-induced remission in adult eosinophilic esophagitis. Dig Dis Sci. 2011;56(12):3551. Epub 2011 Jun 15
- ↑ Alexander JA, Ravi K, Enders FT, Geno DM, Kryzer LA, Mara KC, Smyrk TC, Katzka DA. Montelukast Does not Maintain Symptom Remission After Topical Steroid Therapy for Eosinophilic Esophagitis. Clin Gastroenterol Hepatol. 2017;15(2):214. Epub 2016 Sep 17
- ↑ Netzer P, Gschossmann JM, Straumann A, Sendensky A, Weimann R, Schoepfer AM. Corticosteroid-dependent eosinophilic oesophagitis: azathioprine and 6-mercaptopurine can induce and maintain long-term remission.. Eur J Gastroenterol Hepatol. 2007;19(10):865
קישורים חיצוניים
- Peter A L Bonis, MD Sandeep K Gupta, MD Treatment of eosinophilic esophagitis (EoE)
המידע שבדף זה נכתב על ידי ד"ר מיגל שטיין, המכון למחלות ריאה ואלרגיה ואימונולוגיה קלינית, המרכז הרפואי אסף הרופא, צריפין; ד"ר מנחם רתם, השירות לאלרגיה אסתמה ואימונולוגיה, מרכז רפואי עמק, עפולה
עריכה כללית והוספת פרק הטיפול ד"ר אורית קרני רחקוביץ' (ביולי 2022)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק