הבדלים בין גרסאות בדף "פורפירינים - Porphyrins"
| שורה 51: | שורה 51: | ||
<center> | <center> | ||
{| style="float: center;" | {| style="float: center;" | ||
| − | | [[קובץ:פורפירינים2.jpg| | + | | [[קובץ:פורפירינים2.jpg|270px]] |
| − | | [[קובץ:פורפירינים3.jpg| | + | | [[קובץ:פורפירינים3.jpg|270px]] |
|} | |} | ||
</center> | </center> | ||
| שורה 62: | שורה 62: | ||
| − | [[קובץ:פורפירינים4.jpg|מרכז|מוזער| | + | [[קובץ:פורפירינים4.jpg|מרכז|מוזער|600px]] |
| שורה 68: | שורה 68: | ||
| − | [[קובץ:פורפירינים5.jpg|מרכז|מוזער| | + | [[קובץ:פורפירינים5.jpg|מרכז|מוזער|600px|מסלול יצירת heme המתרחש בחלקו בציטופלזמה של התא ובחלקו במיטוכונדריה.]] |
===פתולוגיה של פורפיריות=== | ===פתולוגיה של פורפיריות=== | ||
גרסה מ־12:15, 12 בדצמבר 2012
| מדריך בדיקות מעבדה | |
| פורפירינים | |
|---|---|
| Porphyrins | |
| מעבדה | כימיה בדם, בשתן ובצואה |
| תחום | אבחון פורפיריות |
| יחידות מדידה | בדם - מיקרוגרם בדציליטר; בשתן - מיקרוגרם לאיסוף 24 שעות; בצואה - מיקרוגרם לגרם משקל יבש. |
| טווח ערכים תקין | בדם מלא (גברים, נשים וילדים) - בשתן - בצואה - צורת חישוב אחרת של הפרשת פורפירינים בצואה - דלתא-ALA בשתן: 1.5-7.5 מיליגרם ליום. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
מדידת רמת פורפירינים בנוזלי הגוף או בצואה נועדה לסייע באבחון ובניטור מפגעי פורפיריות. כיוון שתסמיני פורפיריות שונות יכולים להופיע גם במפגעים נוירולוגיים, פסיכיאטריים או עוריים, מדידת רמת פורפירינים משמשת ברוב המקרים לשלילת פורפיריות יותר מאשר לאישוש המפגעים האחרונים. מדידת פורפירינים יכולה להידרש במקרים של חשד להרעלת עופרת.
מדידות של פורפובילינוגן (PBG) ופורפירינים בדגימות שתן אקראיות יכולות להידרש כאשר ישנם תסמינים של התקפי פורפיריה חריפה, כגון כאבי בטן, בחילה, עצירות, אך גם תסמינים של נירופתיה היקפית כגון עקצוץ, קיהיון, או כאבים בגפיים, חולשת שרירים, אצירת שתן, תחושת בלבול או הזיות. כאשר התוצאות הראשוניות המתקבלות אינן סדירות, יש לחזור על הבדיקות באיסוף שתן של 24 שעות, על מנת לקבוע את מידת ההפרשה של PBG ושל δ-ALA וכן של פורפירינים. בדיקת פורפירינים בצואה יכולה להידרש לסיוע לאבחנה מבדלת בין VP או variegate porphyria לבין HCP או hereditary coproporphyria.
בתלות בגיל הנבדק ותסמיניו, תיתכן דרישה למדיד פורפירינים בשתן כמו גם מדידת פרוטופורפירינים בכדוריות דם אדומות, אם מופיעים מפגעים עוריים כשלפוחיות, הצטלקויות, אודם, גרד, התנפחות, תחושת בערה או היפר-פיגמנטציה באזורי עור חשופים לשמש. מדידה אנזימטית של porphobilinogen deaminase בכדוריות הדם יכולה להידרש כדי לאבחן תרחיש של acute intermittent porphyria (להלן פורפיריה סירוגית חריפה). בדיקה אנזימטית זו עשויה להידרש כדי לגלות בני משפחה של מאובחן עם פורפיריה שהם א-תסמיניים.
בסיס פיזיולוגי
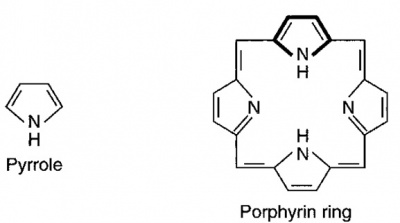
הפורפירינים היא משפחה של מולקולות בעלות מבנה מרכזי טבעתי מאקרוציקלי, המורכב מ-4 יחידות pyrrole המחוברות ביניהן על ידי קשרים מֶתֶניליים (-CH=). המבנה הטבעתי בו יש שחלוף מתמיד של קשרים כפולים וקשרים בודדים, מקנה לפורפירינים את התכונה של ספיגת אור נראה, בדומה למה שגורם לצבע האדום של מולקולת המוגלובין, שאף היא בעלת מבנה פורפיריני. פורפירינים זורחים בצבע ורדרד-סגול בהארתם באור אולטרה-סגול (UV), תכונה מאוד שימושית לגילוי פורפירינים ולמדידת ריכוזם בנוזלי גוף. הארגון של 4 אטומי חנקן במרכז הטבעת המבנית של פורפירינים, מאפשר להם לקשור אטומי מתכת, כאשר במערכות ביולוגית ברזל היא המתכת החשובה ביותר הכרוכה בפורפירינים. כל תרכובות פורפירין בולעות אור בחוזקה באורך גל 410 ננומטר.
ההבדלים במבנה הפורפירינים השונים תלויים בסוג ובמיקום של השרשרת הצדדית המזדקרת מפינות הטבעות הפירוליות. בבני אדם, ישנם שלושה פורפירינים עיקריים: uroporphyrin (להלן URO), וכן coproporphyrin (להלן COPRO) ו-protoporphyrin (להלן PROTO). ל-URO יש 4 שיירי חומצה פרופיונית ו-4 שיירי אצטאט, ואילו COPRO מכיל 4 שרשראות צדדיות של חומצה פרופיונית ו-4 שיירי מתיל. שיירים אלה יכולים להיות מסודרים ב-4 קונפיגורציות מבניות, כאשר באופן נורמאלי מיוצר איזומר מסוג III. ל-PROTO יש 2 שיירים של חומצה פרופיונית, 2 שיירי vinyl ו-4 שיירי מתיל שיכולים להיות מסודרים ב-15 קונפיגורציות שונות, כאשר באופן מעשי רק איזומר מסוג IX נוצר בגוף.
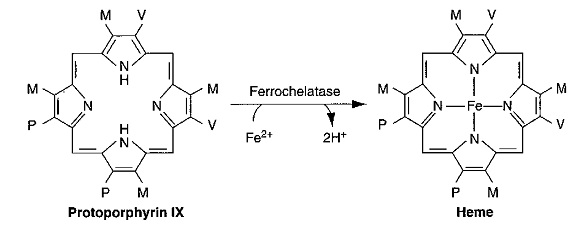
פורפירינים חופשיים הם תוצרי ביניים של מסלול הסינתזה של heme, ואין להם כל תפקיד פיזיולוגי כשלעצמם. מבנה ה-heme המכיל ברזל של פרוטופורפירין IX, היא למעשה קבוצה פרוסטתית של חלבונים ואנזימים רבים הכרוכים במטבוליזם של חמצן ובריאקציות טרנספר של אלקטרונים. ה-hemeמהווה חלק מהכלורופיל, המייצר סוכרים ממים ופחמן דו-חמצני בתהליך הפוטוסינתזה, ובבעלי חיים הוא מהווה חלק מההֵמוֹגְלוֹבִּין נשא החמצן, המשתתף בהעברת פחמן דו-חמצני מהרקמות אל דרכי הנשימה, וכן חלק מהאנזים catalase המחיש שבירה של פראוסידים דמויי מי חמצן. Heme מהווה חלק מציטוֹכרוֹמים הפועלים להעברת חמצן או אלקטרון בתהליכי החמצון והחיזור בתוך התא, ובשל חשיבותו מיוצר ה-heme בכול תאי הגוף, ובעיקר בכבד ובמח העצם. ניתן למצוא באופן תקין גם כמויות קורט של פרוטופורפירין המכיל אבץ במקום ברזל, אך אין למולקולה זו תפקוד פיזיולוגי ידוע.
מסלול הסינתזה של heme
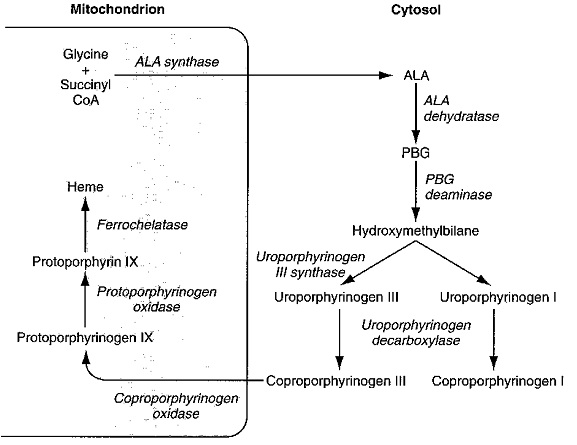
מסלול זה מתחיל בריאקצית דחיסה של סוקציניל-קואנזים A וגליצין, ליצירה של ALA או delta-aminolevulinic acid. ריאקציה זו מסתייעת על ידי האנזים ALA synthase הפועל במיטוכונדריה של התאים ומקודד על גן הממוקם על כרומוזום 3. שתי מולקולות ALA הנוצרות נדחסות ליצירה של פורפובילינוגן (PBG), שהוא פירול עם שיירים צדדיים בפינותיו של חומצה פרופיונית ושל אצטאט. האנזים המסייע לריאקציה זו הוא ALA-dehydratase הפועל בציטופלזמת התאים ומקודד על ידי גן הממוקם על כרומוזום 9.
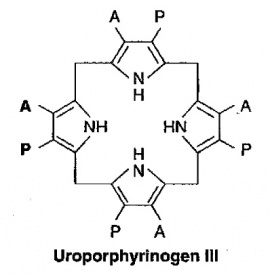
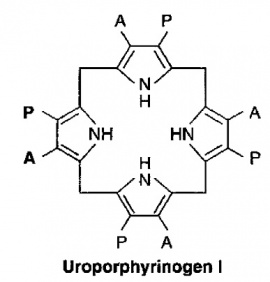
בשלב השלישי, 4 מולקולות של PBG מתחברות ביניהן "ראש לזנב" ליצירת מבנה טטרה-פירולי לינארי הידוע כ-hydroxymethylbilane. האנזים האחראי לשלב זה הוא פורפובילינוגן דאמינאזה הפועל בציטופלמה ומקודד על ידי גן המוקם על כרומוזום 11. תוצר ריאקציה זו, hydroxymethylbilane, אינו יציב, והוא יכול להמשיך בשני מסלולים: הוא יכול באופן ספונטאני לעבור ציקליזציה ולהפוך לתוצר uroporphyrinogen I, או שהוא יכול להפוך ל-uroporphyrinogen III, זאת בעזרת האנזים uroporphyrinogen III synthase, הפועל בציטופלזמה ומקודד על ידי גן הממוקם על כרומוזום 10. אנזים זה מחליף את מיקומם של שיירי אצטאט ופרופיונאט על אחת מהיחידות הפירוליות.
|
|
בנקודה זו נוצר המבנה הטבעתי הבסיסי ה-uroporphyrinogen, ומכאן ואילך מתחילה סדרת מודיפיקציות של השיירים הצדדיים של טבעות הפירול, ובשלב ראשון חלה דה-קרבוקסילציה של כל 4 שיירי האצטאט על ידי האנזים uroporphyrinogen III decarboxylase הפועל בציטופלזמה ומקודד על ידי גן הממוקם על כרומוזום 1. תוצר הריאקציה של אנזים זה הוא coproporphyrinogen III. בהמשך נכנס לפעולה האנזים הפועל במיטוכונדריה coproporphyrinogen oxidase המקודד על ידי גן הממוקם על כרומוזום 3, ופעולתו גורמת לדה-קרבוקסילציה ולדה-הידרוגנציה של שני שיירי פרופיונאט והפיכתם לשיירי vinyl, והתוצר של ריאקציה זו הוא protoporphyrinogen IX.
בשלב הבא, נכנס לפעולה האנזים המיטוכונדריאלי protoporphyrinogen oxidase המקודד על ידי גן הממוקם על כרומוזום 1, והמחמצן שיירי מֶתילֶן (-2-CH) לשיירי מֶתֶניל (-HC=) ליצירת protoporphyrin IX. בשלב השמיני והאחרון במסלול זה, נכנס לפעולה אנזים מיטוכונדריאלי נוסף, ferrochelatase, המקודד על ידי גן הממוקם על כרומוזום 18, והמשבץ מולקולת ברזל לפרוטופורפירין IX לקבלת מולקולת ה-heme.
מסלול הסינתזה של מולקולת heme מבוקר בעיקר על ידי שינויים בפעילות האנזים הראשון במסלול זה ALA synthase, המהווה גם צוואר הבקבוק של מסלול זה. בתאי כבד ניתן למצוא כמויות קטנות שלheme חופשי, כאשר הגדלה בריכוז ה-heme במאגר התאי, מעכבת את פעילות האנזים ALA synthase, בעוד שירידה במאגר ה-heme בתאים מגביר פעילות אנזים זה. סינתזת heme בתאי דם אדומים מווסתת באופן אחר והוא נקבע על ידי הזמינות של ברזל.
פתולוגיה של פורפיריות
פגם באחד האנזימים במסלול יצירת ה-heme יביא ליצירה לא מספקת של heme, אם כי זו לא הסיבה להופעת פורפיריות, שכן גם יצירה חלקית של heme מספקת לצרכי הגוף. הבעיה המרכזית בחסרים אנזימטיים אלה היא בהצטברות של פורפירינים שהם הקודמנים של ה-heme, שעלולים להיות רעילים לגוף בריכוזים גבוהים, בין אם על ידי השריית רגישות לאור הבאה לביטוי על פני העור, או שנגרמת פורפיריה הפאטית עם שיבוש בתאי כבד, או פורפיריה אריתרופוייטית עם שיבוש במוח העצם ובתאי הדם האדומים.
מסתבר שתוצרי הביניים במסלול יצירת ה-heme רעילים כיוון שהטבעת הבסיסית השטוחה שאינה מכילה עדיין את אטום המתכת, עלולה להזיק לסביבתה כשהיא נחשפת לאור. פורפירינים חסרי מתכת, וכן פורפירינים בהם המתכות אינן קשורות בטבעת הפורפירינית, בולעים אור באורכי גל שיכולים לגרום להם לעבור עירור אלקטרוני. אנרגיית העירור יכולה להיות מועברת למולקולות אחרות בעלות קשרים מתאימים, כגון חמצן, כאשר עירור מולקולת החמצן יוצרת צורה פעילה במיוחד של "חמצן סינגלטי", או מולקולות נגזרות חמצן פעילות והרסניות אחרות, רדיקלים חופשיים. דהיינו, הפורפירינים אינם הגורמים לנזק אלא מתווכים להיווצרותו.
רוב הפורפיריות עוברות בהורשה אוטוזומאלית שולטנית, כאשר בהטרוזיגוטים נמצא בהם 50% מהפעילות האנזימטית, מה שאינו מביא לחסר ב-heme או להופעת אנמיה. ההפרשה של עודף פורפירינים בתרחיש של אי היכולת שלהם להשלים את מסלול יצירת ה-heme, היא הבסיס לאבחון מצבי פורפיריה שונים. דרך ההפרשה היא פועל יוצא של מסיסותם של הפורפירינים השונים: URO בעל 3 שיירים קרבוקסיליים הוא המסיס ביותר במים ולכן מופרש כמעט בשלמותו בשתן. PROTO עם שני שיירי קרבוקסיל בלבד, מופרש באופן בלעדי בצואה, ואילו COPRO שהוא בעל 4 שיירים קרבוקסיליים, יכול להיות מופרש בשתן ובצואה. שני הקודמנים של פורפירינים, ALA ו-PBG, שניהם מסיסים במים, ומופרשים בהתאם בשתן.
רקע היסטורי ומיון הפורפיריות
השם "פורפיריה" התייחס ניתן לצבע השתן של הלוקים במפגע בגוונים של סגול, ארגמן או אדמדם כתוצאה מנוכחות מוגברת של פורפירינים בשתן אם כי לא כל החולים מטילים שתן בגוונים אלה. השם פורפירין מקורו ביוונית, porphyrus דהיינו סגול, והוא הוטבע במקור על ידי הגרמני Schultz בשנת 1874 בתיאור מקרה של לכאורה פורפיריה. בשנת 1929 היה זה Hans Fisher שסייע לפיענוח מבנה של פורפירינים ואף סנתז לראשונה פורפירין, מה שזיכה אותו ב-1930 בפרס נובל. בשנות ה-60 זוהו לראשונה חומרי המוצא של heme, δ-ALA ו-PBG.
בעבר, נהגו למיין פורפיריות לכבדיות (hepatic) כאשר מקור השיבוש היה בכבד, או לאריתרופויאטית (erythropoeitic) כשמקור השיבוש במוח העצמות במהלך יצירת תאי דם אדומים, זאת למרות שהשיבוש במרבית המקרים מתרחש בשני האתרים בעת ובעונה אחת. נהוגה חלוקה נוספת של פורפיריות הנמצאת עדיין בשימוש נפוץ, היא לפי מקום הופעת התסמינים והנזק של תוצרי הביניים של יצירת heme: פורפיריות נירולוגיות, פורפיריות עוריות ופורפיריות מעורבות (נירולוגיות וגם עוריות).
כיום, הנטייה היא לחלק את הפורפיריות לשלושה סוגים: פורפיריות חריפות-כבדיות (בדרך כלל עם התקפים נוירולוגים חריפים וחולפים כפרכוסים, פסיכוזה, כאבי גב או בטן חריפים ופולינירופתיה עם פגיעות בעור או בלעדיהן), פורפיריות עוריות (אריתרופויאטיות) לא חריפות וכרוניות כשהפגיעה מוגבלת לעור, ופורפיריות אחרות. דוגמא לפורפיריה מסוג אחר הוא harderoporphyria (עם 12 מקרים מתועדים בעולם) המתאפיינת באנמיה המוליטית קשה, כבד וטחול מוגדלים, עור רגיש לאור, אך ללא כאבי בטן או הפרעות נירולוגיות. ב-harderoporphyria יש הפרשה מרובה של קופרופורפירין בשתן ובצואה, אלא רוב הפורפירין המופרש בצואה הוא harderoporphyrin בו שייר vinyl משחלף שייר propionate על טבעת A pyrrole.
סוגי פורפיריות
שיבוש בייצור יכול לחול בשלבים שונים של ייצור ה-heme4 וכך להביא לצורות שונות של המחלה. הפורפיריות הנפוצות הן: פורפיריה סירוגית חריפה: Acute Intermittent Porphyria; פורפיריה אריתרופוייטית מולדת: Congenital Erythropoietic Porphyria; פורפיריה עורית מאוחרת: Porphyria Cutanea Tarda; קופרופורפיריה תורשתית: Hereditary Coproporphyria; פורפיריה מגוונת: Variagate Porphyria; פרוטופורפיריה אריתרופוייטית: Erythropoietic Protoporphyria.
ברקע גנטי בדרך כלל איו די כדי לגרום להתקפים חריפים, המושרים בדרך כלל על ידי נטילת תרופות דוגמת אופטלגין, אריטרומיצין, וולטרן וואליום ועוד, שתיית אלכוהול, מצבי רעב, דיאטות הרזיה, או שינויים הורמונאליים כמו אלה החלים במחזור החודשי, בהריון ובלידה. זיהומים ומצבי לחץ נפשי עלולים אף הם לגרום להופעת התקפים, המופיעים בדרך כלל החל משנות העשרה המאוחרות עד שנות הארבעים, אך נדירים בילדים לפני גיל ההתבגרות. רוב החולים הסובלים מהתקפים חווים התקף אחד או התקפים בודדים במהלך חייהם. מעטים סובלים מהתקפים חוזרים ונשנים בתדירות גבוהה. למרות שההתקף עלול להיות קשה ביותר, במיוחד אם הושרה ע"י תרופה או אלכוהול, נדירים כיום המקרים של מוות כתוצאה ממנו. רוב האנשים שעברו בחייהם התקף אחד או שניים, מחלימים מתוצאות ההתקף, אך עליהם להיזהר ולהימנע מחשיפה לגורמים המשרים. תכיפות ההתקפים יורדת בדרך כלל כשמתבגרים, במיוחד מעל גיל ארבעים.
שכיחויות של פורפיריות: כללית מדובר במחלה לא שכיחה, כאשר היחס בין המינים הוא מקרה אחד בין הגברים לכל 1.8 מקרים בין הנשים. השכיחות בארה"ב היא 1-5 לכל מאה אלף תושבים, ובמדינות אירופה 1-2 לכל מאה אלף תושבים, שרובם חולים בפרופיריה סירוגית חריפה, יוצא דופן הוא בנורבגיה שם שישים עד מאה לכל מאה אלף תושבים חולים בפרופיריה סירוגית חריפה. בישראל מאובחנים מספר מאות מקרים חולים שמאובחנים כחולי פורפיריה, אם כי ההערכה היא שמספר דומה של מקרים אינם מאובחנים. בקרב חולים פסיכיאטריים מאושפזים השכיחות היא 1 לכל 300 חולים.
פורפיריות נירולוגיות
ארבע פורפיריות מתאפיינות על ידי התקפים של כאבי בטן חריפים, מפגעים ותסמינים נירולוגיים ו/או הפרעות פסיכיאטריות. התקפים חריפים שעלולים להימשך מימים אחדים ועד מספר שבועות, מלווים על ידי הפרשה של PBG ו-ALA בשתן. הבסיס הביוכימי להתקפים עדיין לא ברור, אם כי הוצעו מספר תיאוריות להבהרתם. תסמינים נירולוגיים האופייניים לפורפיריות נירולוגיות, מתחילים בדרך כלל בשנות הבחרות או בשנות העשרים המוקדמות, והם משפיעים על נשים לעתים יותר תכופות מאשר על גברים. כאבי בטן, שהוא הממצא השכיח ביותר מלווה בדרך כלל על ידי עצירות, בחילה, והקאות. בכל ארבעת הפורפיריות הנירולוגיות יש התבטאות של המפגע בכבד.
אי תפקוד סנסורי ומוטורי של מערכת העצבים ההיקפית יכולה לבוא לביטוי בכאבים באברי קצה, בחזה, בראש, בצוואר, וכן בחולשת שרירים עד כדי שיתוק. טאכיקרדיה ויתר לחץ-דם הם ממצאים שכיחים , ופרכוסים עלולים להופיע במיעוטם של מקרים. למטופלים אחדים יש רקע של עצבנות, דאגנות, פרנויה, שינויים במצבי רוח ותעתועי דמיון המרמזים למחלה פסיכיאטרית ראשונית. מעבר למספר תרופות שעלולות לגרות או להחמיר התקף של פורפיריה נירולוגית, לעתים צום, אלכוהוליזם, הדבקה בפתוגן, וגורמים נוספים שעלולים להחמיר את ההתקף. בין התקפים, בדרך כלל תסמיני הפורפיריה הנירולוגית מתפוגגים.
פירוט ארבעת הפורפיריות הנירולוגיות ומאפייניהן המעבדתיים
1. פורפיריה סירוגית חדה (acute intermittent porphyria, להלן AIP): המפגע השכיח ביותר בין הפורפריות הנירולוגיות (1 עד 10 מקרים ל-100,000), כאשר הסובלים ממפגע זה מראים חסר של 50% באנזים פורפובילינוגן דאמינאזה. פגם זה גורם ל-ALA ול-PBG להצטבר, ולהפרעה חלקית במסלול המשרה את הפעילות של ALA synthase. כתוצאה מכך יש הפרשה גדולה בשתן של ALA ו-PBG בשעת התקפים. כיוון שבפגם זה לא מעורב חלק הפורפירינוגן של המסלול, אין יצירה של פורפירינים בעודף, ולכן אין במפגע זה רגישות לאור.
הממצא המעבדתי העיקרי הוא כאמור הצטברות רבה של ALA ו-PBG בשתן בעת התקפים חדים, אם כי בין התקפים רמת שני אלה יכולה להיות תקינה או מוגברת אך במעט. כאשר PBG נמצא בשתן ברמות גבוהות, הוא עובר דחיסה עצמונית וציקליזציה ליצירת uroporphyrinogen (איזומר type I) שיכול להתחמצן לאורופורפירין. ניתן למדוד את פעילות האנזים porphobilinogen deaminase באריתרוציטים והיא מתקבלת בדרך כלל נמוכה ב-50% מערכי הנורמה שלו, הן בצורה החדה של המפגע או בצורתו הכמוסה (לטנטית). כיוון שהתסמין השכיח ביותר הוא התקף כאבי בטן חריפים המלווים עצירות, לעתים קרובות יש אבחנה מוטעית של דלקת התוספתן או של כרכת (ileus).
80% מהנשאים של פורפיריה סירוגית חריפה הם ללא סימנים קליניים. בין 10% עד 20% מהנשאים מפרישים רמה עודפת של תוצרי ביניים, ורק אחוז אחד עד שני אחוזים מהנשאים מגלים תסמינים חיצוניים. הפורפיריה מתפרצת בדרך כלל בין גיל 15 לגיל 35 או לפי הערכה אחרת בגיל שבין בין 18 לגיל 40. התפרצות AIP נדירה לפני גיל ההתבגרות ואחרי גיל 40.
2. פורפיריה מגוונת (variegate porphyria, להלן VP): הלוקים במפגע זה יכולים לסבול מהתקפים נירולוגיים חדים, ומרגישות העור לשמש ולטראומה מכאנית, או לשניהם. הפגם האנזימטי הוא בחסר חלקי של פרוטופורפירינוגן אוקסידאזה, מה שגורם להצטברות פרוטופורפירין וקופרופורפירין, ולרגישות לאור כמו גם למפגעי עור. המחלה שכיחה במיוחד בקרב לבנים בדרום אפריקה, כתוצאה ישירה מהגירת זוג הולנדי נשאי המפגע בשנת 1688, אם כי בארצות אחרות המפגע נדיר בהרבה. ברביטורטים ותרופות סולפה הם לעתים קרובות גורם מעורר התקף. הממצא של ALA ו-PBG מוגברים בשתן בעת התקף חד מאששים את המפגע של פורפיריה נירולוגית. VP ניתנת להבדלה מפורפיריות נירולוגיות אחרות, על ידי ההפרשה המוגברת של פרוטופופירינים וקופרופורפירינים בצואה. גם בין התקפים או במקרים סמויים ניתן לאבחן את ההפרעה על ידי בדיקות צואה.
3. קופרופורפיריה תורשתית (hereditary coproporphyria, להלן HCP): מפגע נדיר ביותר (1 לחצי מיליון), בו חסר חלקי של האנזים קופרופורפירינוגן אוקסידאזה, מביא להצטברות קופרפורפירינים ופורפובילינוגן. בנוסף להתקפים חדים, יכולה להופיע רגישות לאור ומפגעי עור, אם כי בתדירות נמוכה יותר מזו שב-VP. בשתן ניתן למצוא בשעת התקפים כמות מוגברת של ALA ו-PBG, אך המדד האבחוני בעיקרי הוא הפרשה מוגברת של קופרורפירין III בצואה.
4. חסר ב-ALA dehydratase: מפגע נדיר, כמותו תוארו עד כה מקרים בודדים ביותר, עם חסר כמעט מוחלט של האנזים. להומוזיגוטים יש תסמינים נירולוגיים אך ללא רגישות לאור, כאשר ההטרוזיגוטים הם חסרי תסמינים. הממצא המעבדתי העיקרי היא הפרשה מוגברת בשתן של ALA ושל קופרופורפירינים.
פורפיריות עוריות (אריתרופויאטיות)
שלושת הפורפיריות העוריות המוכרות מתאפיינות במשותף בעודף פורפירינים ברקמות הגוף, אך התבטאותן בעיקר בעור. כיוון שפורפירינים בולעים אור סביב אורך גל 410 ננימטר, נוצר עירור אלקטרוני, ושחרור אנרגיה המייצרת מולקולות חמצן משופעלות המגיבות עם ממברנות ומרכיבי תא שונים. התהליך כרוך בשחרור אנזימים פרוטאוליטים מליזוזומים פגועים, שפעול המשלים (complement activation),ושחרור של תווכי דלקת, כאשר כל אלה אחראיים כנראה לרגישות לעור ולמפגעי העור כפוטודרמטיטיס, שלפוחיות, נמק מוגבל של העור והחניכיים, נפיחות וגרד, ושעירות-יתר לדוגמה באזור המצח. מה שמאפיין את שלושת הפורפיריות העוריות היא כאמור רגישות בחשיפה לאור, אך חיסר כאבי בטן או תסמינים נירולוגיים.
1. פורפיריית עור מאוחרת (porphyria cutana tarda, להלן PCD): מפגע עורי שבדרך כלל אינו מופיע עד לגיל ההתבגרות, ונחשב לפורפיריה השכיחה ביותר. המפגע נגרם מחסר חלקי של האנזים אורופורפירינוגן דקרבוקסילאזה, ושכיחותו 1-2 מקרים ל-25,000. ב-20% מהמקרים אחדים הם על בסיס תורשתי, אך ב-80% המקרים הם על רקע משני על רקע איבוד נרכש של האנזים הכבדי. התסמינים השכיחים הם עור שברירי, הופעת בעבוע עורי, ארגמנת (erythema), גרב (eczema), שעירות, היפר- או היפופיגמנטציה והיפרטריכוסיס, או הצטלקויות באזורים החשופים לאור. המפגע נותר רדום עד להופעת תרחיש של פגיעה בתפקודי כבד, כתוצאה מהצטברות יתר-ברזל בכבד, הפאטיטיס C, או במחלת כבד אלכוהולית. גם טיפול באסטרוגנים עלול לשפעל מפגעי עור. במצב ההומוזיגוטי הנדיר יותר של המפגע, הידוע כ-hepato-erythrocyric porphyria, הרגישות לאור חמורה יותר, והיא מופיעה בגיל הרך.
חסר האנזים ב-PCD גורם להפרשה מוגברת בשתן של אורופורפירינים כמו פורפירינים עם שיירים קרבוקסילים בעמדות 5 ,6 ו-7. הפרשה מוגברת של ALA ו-PBG אינה ממצא קבוע בפורפיריה זו. בצואה ניתן למצוא הפרשה מוגברת של בצורה מתונה של קופרו- ופרוטופורפירינים, אך ההופעה של iso-coproporphyrin שהוא איזומר של קופרופופירין היא אבחנתית במפגע זה. מקרים סמויים ניתן לגלות על ידי הפרשה מוגברת של קופרופורפירין בצואה ובשתן, ואורופורפירין בשתן.
מקרה יוצא דופן של "מגיפת" PCD על רקע הרעלה בקוטל פטריות hexachlorobenzene, תועד באנטוליה-טורקיה, בין השנים 1955-59. באותו איזור רוססו אז שדות החיטה עם קוטל פטריות זה, וכ-4,000 לקו שם בתסמינים קשים של PCT.
2. פרוטופורפיריה (protoporphyria): במטופלים עם פרוטופורפיריה לא חריפה (שפעם הייתה קרויה erythropoietic protoporphyria או EPP), יש חסר חלקי של האנזים ferrochelatase, שהוא האנזים האחרון ברצף הריאקציות המובילות ליצירת heme. חסר אנזימטי זה מביא להצטברות פרוטפורפירינים וכתוצאה מכך לרגישות לאור שמתחילה בילדות. בחשיפה לשמש, הלוקים במפגע זה מפתחים כוויות, גרד, נפיחות ואדמומיות בעור, ואנמיה קלה. אין הופעת הצטלקויות. מיעוטם של החולים (5-10%) מפתחים מחלת כבד קשה, או אבני מרה המכילים פרוטופורפירינים, כיוון שהכבד צריך להפריש כמויות גדולות שלהם. האבחנה המשמעותית ביותר היא עליה גדולה בריכוז פרוטופורפירינים חופשיים בכדוריות הדם האדומות, וכן בפלזמה. רמת פרוטפורפירינים בצואה מוגברת גם כן, אם כי רמת מוגברות זו שונה בנבדקים שונים.
3. פורפיריה אריתרופויאטית מולדת (congenital erythropoietic porphyria, להלן CEP): מפגע נדיר זה הידוע גם כמחלת Gunther, נגרם על ידי חסר חלקי של האנזיםuroporphyrinogen III synthase . אמנם יש כמות מספקת של uroporphyrinogen III מסונתז כך שאין חסר מטבולי שלו, אלא שכמויות גדולות של איזומר type I שנוצרות גם כן, והוא מתחמצן ליצירה של uroporphyrin I ושל coprpporphyrin I. המפגע בדרך כלל בא לביטוי בגיל צעיר ביתר כבר בילדות, עם רגישות מאוד חזקה לאור השמש. האזורים על פני העור הנחשפים לשמש מצטלקים, ועם ההתבגרות הצטלקות זו מחמירה ויכולה להופיע פגיעה קשה באצבעות הידיים, באף או באוזניים. מצב ייחודי ידוע כאריתרודונטיה, או גוון אדום-חום של השיניים, הנגרם על ידי שקיעה של אורופורפירינים. המאובחנים עם CEP סובלים גם מאנמיה המוליטית ומטחול מוגדל. זו נחשבת הפורפיריה עם הפרוגנוזה הגרועה ביותר. לשתן במקרים אלה גוון אדום, כתוצאה מכמויות הגדולות של אורו- וקופרופורפירינים, כאשר רמת הראשונים גדולה מבין השניים. גם בצואה יש הפרשה מוגברת של פורפירינים.
ממצאי המעבדה המתקבלים בסוגי הפורפיריה השונים
טבלה!
מפגעים שניוניים של מטבוליזם של פורפירינים
שינויים במטבוליזם של פורפירינים בהם הפרשה מוגברת שלהם יכולים להופיע בתרחישים שאינם בהכרח פורפיריות. להלן מספר דוגמאות אופייניות למצבים אחרונים אלה:
- הרעלת עופרת
באכילה או בשתייה של פריטים המכילים עופרת, או יותר מכך בצריכה של מותגי בריאות אלטרנטיבית בעיקר מדרום-מזרח אסיה, ובחשיפה תעסוקתית לעופרת ניתן להגיע לרמות עופרת רעילות בגוף. תסמינים אופייניים הם כאבי בטן ואי-סדירות נירולוגית, העולים לדמות מאוד להתקפים חדים של פורפיריה. עופרת מעכבת 2 אנזימים במסלול הפורפירינים: ALA dehydratase ו-ferrochelatase. כתוצאה מכך יש הגברה בהפרשת ALA (אך לא PBG) בשתן, והגברת רמת zinc-protoporphyrin באריתרוציטים. כמו כן יש הרשה מוגברת של קופרופורפירין בשתן. למרות שממצאים אלה אופייניים להרעלת עופרת, האבחון הסופי המבדיל בין זו לבין פורפיריות הוא במדידת רמת עופרת בדם מלא.
בהרעלת כספית או ארסן יכולה פורפיריה להיות מושרית ובשתן יימצאו ריכוזים מוגברים של אורופורפירין I ו-III, וכן רמות מוגברות של קופרופורפירין I ו-III.
- חסר ברזל
במטופלים עם חסר ברזל, מתקיים חוסר איזון בין פרוטופורפירין הממשיך להיווצר בכמויות נורמאליות, לבין הכמות החסרה של ברזל הזמין לסינתזת heme. לכן מצטבר באריתרוציטים Zn-protporphyrin לרמות שמעל לנורמה. כיוון שחסר ברזל הוא תרחיש מאוד שכיח, אמנם חסר ברזל היא הסיבה השכיחה ביותר לרמה מוגברת של פורפירינים באריתרוציטים. מצבים פיזיולוגיים המפחיתים את זמינות הברזל, כגון דלקת כרונית או חריפה, גם כן נוטים להגביר רמת פורפירינים באריתרוציטים. מדידת רמת zn-protoporphyrin היא שיטת סקר טובה להערכת חסר ברזל, אך האבחנה הסופית חייבת להיות מאוששת על ידי מדידת רמת ברזל בנסיוב, TIBC ו-פריטין.
- קופרופורפינוריה
עליה ברמת קופרופורפירינים היא התוצאה הלא תקינה השכיחה ביותר שמוצאים בשתן בבדיקת סקירה לפורפירינים. למרות שממצא כזה יכול להצביע על פורפיריה, הוא מופיע לעתים תכופות יותר כתוצאה מבעיות שאינן קשורות כלל לסינתזה של heme, כמו מחלת כבד, תחלואה חריפה, או חשיפה לתרופות רעילות.
השינויים באנליטים הרלוונטים בעת התקף
ההערכה במעבדה קלינית לאבחון פורפיריה חשודה, תלויה רבות בתסמינים הקליניים. לגבי נבדק עם תסמינים נירולוגיים, דגימת שתן אקראית צריכה להילקח בשעת ההתקף, ולהימדד לרמת PBG ופורפירינים. כאשר יש תסמיים עוריים יש למדוד רמת פורפירינים בדגימת שתן אקראית, או במקרה של חשד לפרוטופורפיריה, יש למדוד פרוטופורפירין חופשי באריתרוציטים. תוצאות סריקה שליליות במקרים אלה אינם מחייבים כל אנליזה נוספת, אך לעומתם תוצאות חיוביות מאוששות על ידי מדידות כמותיות באיסופי שתן של 24 שעות, כמו גם על ידי זיהוי של הפורפירינים המוגברים. אנליזה של רמות ALAבשתן, רמת פורפירינים בצואה, וכן את פעילות האנזים porphobilinogen deaminase שהופכת להיות שימושית ביותר באבחנה מבדלת בין הפורפיריות הנירולוגיות, אך אלה הם מדידות של הקו השני.
הפענוח של תוצאות עלול להסתבך על ידי הפרשת פורפירינים והקודמנים (precursors) בכמויות משתנות, בבריאות מלאה כמו גם במצבי מחלה. רמת פורפירינים בשתן, בצואה ובכדוריות אדומות מוגברת באופן אופייני פי-5 או אף יותר בנבדקים עם פורפיריה. הדבר נכון גם לגבי PBG ו-ALA בפאזה חריפה של פורפיריות נירולוגיות. יחד עם זאת, כמה מהאנליטים הנמדדים יכולים להיות מושפעים על ידי מחלה עכשווית, באופן שהערכים הנמדדים יכולים להראות שונות גדולה.
הגברה מבודדת ולא בולטת של פורפירינים בשתן (עד פי-2 מהנורמה), או בצואה (פחות מפי-3 מהנורמה), או באריתרוציטים (פחות מפי-5 מהנורמה) יכולים להופיע בנבדקים ללא פורפיריה. מסיבה זו אבחנה חייבת להיות מבוססת על שילוב של מידע קליני, ואינטרפרטציה זהירה של נתוני המעבדה.
פורפובילינוגן (PBG)
רמת PBG בשתן מוגברת במיוחד בעת התקפים בתרחישים של פורפיריות נירולוגיות כמו פורפיריה סירוגית חדה (AIP), פורפיריה מגוונת (VP) וקופרופורפיריה תןרשתית (HCP). רמת PBG יכולה להיות מוגברת מעט (3-15 מיליגרם ל-24 שעות) גם ב-פורפיריית עור מאוחרת (PCT). בדיקת PBG בשתן מתקבלת חיובית בשעת התקפים אך יכולה להתקבל שלילית או מוגברת באופן שולי בין התקפים. תוצאה שלילית בדגימת שתן שנלקחה באופן תקין, שוללת מכל בכול פורפיריה נירולוגית. אישוש נעשה על ידי אנליזה כמותית של PBG בדגימת איסוף שתן של 24 שעות. בקבלת תוצאה לא תקינה של PBG כדאי לבצע מדידת uroporphyrin ו-coproporphyrin בשתן כדי לסייע בזיהוי של הפורפיריה הנירולוגית.
חומצה דלתא אמינו-לבולינית (ALA)
ערכי ALA בשתן מוגברים בכל ארבע הפורפיריות הנירולוגיות. גם בהרעלת עופרת ובטירוזנמיה תורשתית נמצא הפרשה מוגברת של ALA בשתן, לכו מדד ALA פחות ספציפי לפורפיריות מאשר מדד PBG. יוצא דופן הוא התרחיש המאוד נדיר של חסר באנזים ALA dehydratase, בו מוגברת רמת ALA בשתן אך לא זו של PBG. נהוג לבצע מדידת ALA בשתן באיסוף של 24 שעות.
פורפירינים בשתן: מדידת פורפירינים בשתן מתקבלת בדרך מוגברת בכל הפורפיריות פרט לפרוטופורפיריה ולפאזה הסמויה של פורפיריה סירוגית חדה (AIP). קבלת תוצאות חיוביות בדגימת תן נקודתית, צריכה להיות מלווה על ידי מדידה כמותית של סך הפורפירינים בדגימת איסוף 24 שעות, וזיהוי של אותו פורפירין ספציפי שעלה באופן בולט. עליה קלה עד מתונה ברמת קופרופורפירין בשתן, מתקבלת במחלת כבד, בהרעלת עופרת, בשתייה מרוב של אלכוהול, או במגוון מחלות קשות. עלייה ניכרת יותר של קופרו- או אורופורפירינים בשתן הם מדד סביר יותר לפורפיריה. המפגע השכיח ביותר הכרוך בכמות גדולה של פורפירינים בשתן הוא פורפיריית עור מאוחרת (PCD) כאשר תרחיש זה מתאפיין בעיקר בכמות גדולה של אורופורפירין בשתן והופעת ייחודית של נגזרת 7carboxyl של פורפירין.
פורפירינים בצואה: פורפירינים בצואה מורכבים בעיקר מ-coproporphyrin ו-protpporphyrin וכן ממספר פורפירינים דו-קרבוקסיליים (mesoporphyrin, deutroporphyrin ו-pemptoporphyrin). כמות הפורפירינים המופרשת בצואה היא פועל יוצא דיאטה והפלורה האנארובית במעי הגס. הגברה בהפרשת פורפירינים בצואה בכמות שאינה עולה על פי-3 מרמת הפורפירינים המופרשת בצואה באופן תקין, אינה בהכרח משקפת תרחישי פורפיריה. פורפירינים בצואה מוגברים בדרך כלל בכל הפורפיריות פרט לפורפיריה סירוגית חדה (AIP). החשיבות הבולטת ביותר של מדידת פורפירינים בצואה, היא להבדיל בין פורפיריה מגוונת (VP) בה פרוטו- וקופרופורפירינים מוגברים, לבין קופרופורפיריה תורשתית (HCP) בה רק קופרופורפירין מוגבר.
פורפירינים באריתרוציטים: כמות פורפירינים בכדוריות הדם האדומות מוגברת מאוד בפרוטופורפיריה בה מוצאים כמות ניכרת של פרוטופורפירין, ובפורפיריה אריתרופויאטית מולדת (CEP) בה מופיעה כמות גדולה של אורופורפירין וקופרופורפירין. בכל שאר הפורפיריות רמת פורפירינים באריתרוציטים תקינה. אין צורך באפיון ספציפי של הפורפירינים באריתרוציטים , שכן שניתן להבדיל בין שני המפגעים האמורים על ידי מדידת פורפירינים בשתן, וכן על ידי המאפיינים הקליניים. כמו שכבר הוזכר, רמת פרוטוהפורפירין חופשי באריתרוציטים מוגברת גם במצבי חסר ברזל או בהרעלת עופרת.
מדידות אנזימטיות: רק אנזים אחד מתוך 8 האנזימים במסלול הסינתזה של ה-heme, והוא porphobilinogen deaminase, משמש באופן שגרתי במעבדות הקליניות. פעילות אנזים זה פוחתת למחצית הפעילות התקינה שלו בכדוריות הדם, בתרחיש של פורפריה סירוגית חדה (AIP), בין אם הבדיקה מתבצעת בעת התקף או שהיא נלקחת בפאזה הסמויה של המחלה. אך השימושיות של מדידת האנזים פוחתת בגלל 2 גורמים: 1. יש חפיפה של ערכי פעילות האנזים בין נבדקים עם המפגע האמור לבין אנשים בריאים בטווח התחתון של פעילות האנזים. 2. יש תת-קבוצה קטנה של מטופלים עם המפגע האמור, להם יש פעילות תקינה של האנזים באריתרוציטים. יחד עם זאת, מדידת פורפובילינוגן דאמינאזה היא המבדק היחיד שעשוי לזהות מטופלים א-תסמיניים הנושאים את הגן ל-AIP.
הערכה איכותית של פורפירינים בפלזמה בשיטה פלואורימטרית
סריקה פלואורימטרית של דגימות פלזמה לגילוי קומפלס של פרוטופורפירין וחלבון, עשויה לסייע באבחנה מבדלת של פורפיריה סירוגית (VP) מפורפיריות אחרות. ב-VP ערור באורך גל 405 ננומטר מביא לאמיסיה של שיא באורך גל 626 ננומטר. פלואורסצנציה של פלזמה שמתקבלת בפורפיריית עור מאוחרת (PCT), בפורפיריה סירוגית חדה (AIP) ובקופרופופיריה תורשתית (HCP), מתאפיינת על ידי ערור באורך גל 398 ננומטר המביאה לאמיסיה באורך גל 619 ננומטר. פלואורסצנציה של פלזמה בפרוטופורפיריה מתאפיינת על ידי ערור ב-409 ננומטר הנותנת אמיסיה באורך גל 634 ננומטר.
מאפיינים של הפגמים האנזימטיים בפורפיריות
פגמים בשבעה מתוך שמונה האנזימים עלולים לגרום לסוגי הפורפיריה השונים. כך לדוגמה פגם באנזים השלישי במסלול זה PBG deaminase בא לביטוי ב-acute imtermittent porphyria, פגם באנזים uroporphyrinogen III synthase הרביעי ברצף הסינתזה של heme, יגרום ל-congenital erythropoietic porphyria. פגם באנזים החמישי ברצף זה, uroporphyrinogen III decarboxylase, כרוך במפגע porphyria cutanea tarda, ואילו פגם באנזים הבא ברצף coproporphyrinogen III oxidase, גורם ל-coproporphyria. פגם באנזים ה-7 במסלול סינתזת ה-heme, הלא הוא protoporphyrinogen oxidase מוליך ל-variegate porphyria, כאשר פגם באנזים האחרון - ferrochelatase - הוא הסיבה להתרחשות erythropoietic protoporphyria.
- פגם באנזים ALA synthase נמצא בתאחיזה לכרומוזום X, גורם לאנמיה סידרובלסטית שהוא מפגע אריתרופויאטי.
- פגם באנזים ALA dehydratase גורם ל-Doss porphyria, שהיא פורפיריה הפאטית המועברת בהורשת אוטוזומאלית רצסיבית, עם כאבי בטן ותסמינים נירופתיים. מצב נדיר ביותר שעד כה תוארו רק 12 מקרים כאלה בספרות.
- חסר באנזים PBG deaminase גורם ל-acute intermittent porphyria, שהיא פורפיריה הפאטית המועברת בהורשה אוטוזומאלית שולטנית, עם כאבי בטן תקופתיים, נירופתיה היקפית, מפגעים פסיכיאטריים, וטאכיקרדיה. שכיחות המפגע 1 לכל 10,000-20,000 פרטים באוכלוסיה.
- חסר באנזים URO synthase גורם ל-congenital erythropoietic porphyria, שהיא פורפיריה אריתרופויאטית המועברת בהורשה אוטוזומאלית רצסיבית, עם רגישות חמורה לאור והופעת אריתמה, התפחות עורית ושלפוחיות, כמו גם אנמיה המוליטית וטחול מוגדל. נדירה ביותר: מקרה 1 למיליון.
- חסר באנזים URO decarboxylase גורם ל-porphyria cutanea tarda שהיא פורפיריה הפאטית, המועברת בהורשת אוטוזומאלית שולטנית, עם בועיות ונגעים נוזליים מתחת לעור (bullae), ןשכיחות של 1 ל-10,000.
- חסר באנזים COPRO oxidase גורם ל-hereditary coproporphyria שהיא מפגע הפאטי נדיר (1 ל-500,000) המועבר בהורשה אוטוזומאלית שולטנית, וגורם לרגישות לאור, תסמינים נירולוגיים וקדדת (כאבי בטן קוליקים בתינוקות).
- חסר באנזים PROTO oxidase גורם ל-variegate porphyria וכן mixed porphyria שהיא פורפיריה הפאטית ואריתרופויאטית מעורבת, מועברת בהורשה אוטוזומטלית שולטנית, הגורמת לרגישות לעור, תסמינים נירולוגיים חריפים ועיכוב התפתחותי. בדרום אפריקה היא מופיע ב-1 ל300 פרטים באוכלוסיה ואילו בפינלנד מקרה אחד ל-75,000.
- חסר באנזים ferrochelatase גורם ל-erythropoietic protoporphyria המועברת בהורשה אוטוזומאלית שולטנית וגורמת לרגישות לאור עם מפגעי עור, יצירת אבני מרה ופגיעה מתונה בתפקוד הכבד. שכיחותה 1 ל-75,000-200,000 פרטים באוכלוסיה.
פרוטוקול מומלץ של רצף בירורים ובדיקות להערכת חשד לפורפיריה
א. הנבדק סובל מכאבי בטן (עם או ללא מפגעי עור): הבדיקה הראשונה היא בדיקה איכותית לאפשרות של PBG מוגבר בשתן. אם התוצאה שלילית נשללת אפשרות של של פורפיריה חדה כגורם לכאבי הבטן. יחד עם זאת, אם יש חשד שהנבדק נמצא בפאזה שבין התקפים, יש לבצע בדיקה כמותית של PBG ו-ALA בשתן. אם מתקבלת תוצאה מוגברת, יש להתקדם כמקובל במקרים בהם הבדיקה האיכותית הראשונית ל-PBG מקבלת חיובית (ראה בהמשך). אם לעומת זאת הבדיקה הכמותית מתקבלת תקינה, יש למדוד רמת פורפירינים בצואה כדי לשלול VP או HC. אם עדיין יש חשד ל-AIP מומלץ לבדוק רמת האנזים PBG deaminase באריתרוציטים. אם בדיקת הסקר האיכותית של PBG ו-ALA בשתן מתקבלת חיובית, יש לאשש אותה על ידי מדידה כמותית של PBG ו-ALA בשתן. אם התמונה הקלינית מצביעה על AIP, ניתן לעצור כאן את רצף הבדיקות. אם התמונה הקלינית אינה מעידה על AIP, יש למדוד רמת האנזים PBG deaminase באריתרוציטים, כמו גם רמת קופרופורפירין ופרוטופורפירין בצואה כדי לשלול AIP, ולבצע אבחנה מבדלת בין VP ו-HC.
ב. אם לנבדק מפגעי עור בנוסח של חרלת (urticaria) או אריתמה: הבדיקה הראשונה היא מדידת ריכוז פרוטופורפירין באריתרוציטים. אם התוצאה מתקבלת תקינה, הדבר שולל פרוטופורפיריה. אם יש חשד קליני חזק , יש לשלול פורפיריות עוריות אחרות על ידי מדידת פורפירינים בשתן ובצואה. אם לעומת זאת, מתקבלת תוצאה מוגברת של פרוטופורפירין באריתרוציטים, יש לאשש פרוטופורפיריה על ידי שלילת מציאות zn-protoporphyrin באריתרוציטים.
ג. אם לנבדק יש מפגעי עור בנוסח של שעירות יתר, פיגמנטציה ארוזיות ובועיות (bullae), בבדיקה הראשונה היא מדידת פורפירינים בשתן. אם התוצאה מתקבלת שלילית, יש לבחון צואה ואריתרוציטים לעודף פורפירינים: אם התוצאה תקינה, אין סבירות לפורפיריה. אם התוצאה לעומת זאת חיובית, יש לקבוע פרופיל פורפירינים בשתן ובצואה, לאבחנה מבדלת בין PCT, VP ו-HC. יש למדוד רמת פורפירינים באריתרוציטים אם יש חשד ל-CEP.
התקפים חריפים עלולים של פורפיריה להופיע גם כתוצאה משימוש במגוון תרופות. להלן רשימת תרופות מקובלות שעלולות להשרות או להחמיר התקפי פורפיריה לכול סוגיה:
אריתרומיצין, אנדרוגנים, אסטרוגנים, אתנול, amitriptyline, ברביטוראטים, butylscopolamine ,buspirone ,clorazepate ,carbamazepine carbromal ,chloral hydrate, כלורמפניקול, carmustine ,chlorpropamide ,chloroquine ,chlormezanone ,chlordiazepoxide ,daspone diclofenac ,diazepam ,diphenylhydramine ,enalapril, תרכובות ארגוטfurosemide ,grisepfulvin ,halothane ,hydralazine ,hydantoin , hydroxyzine ,hydrochlorothiazide ,hydroxychloroquine ,imipramine ,ketoconazole ,lynestrenol ,levonorgestol ,meprobamate metoclopramide ,metamizole ,medroxyprogesterone ,nitrofurantoin ,nifedipine ,nalidixic acid ,orphenadrine ,oxyphenbutazone phenytoin, פרוגסטרון, פרוקרדיה, phenylbutazone ,pyrazinamide, סולפונאמיד, סולפוניל-אוריאה, ספירונולקטון, tamoxifen, תרכובות סולפה, tramadol, verapamil ,valproic acid.
הוראות לביצוע הבדיקה
יש צורך בצום של 12-14 שעות לפני הבדיקה. תיתכן דרישה להפסקת נטילת תרופות שעלולות להשפיע על התוצאות, והתרופות הללו כוללות חומצה אמינוסליצילית, גלולות למניעת הריון, ברביטוראטים, chloral hydrate, אתנול, griseofulvin, מורפין, chlorpropamide, סולפונאמידים, procaine ו-phenazopyridine. טיפול ב-cisplastin יכול להפחית באופן פיזיולוגי את ריכוז הפורפירינים הנמדדים בשתן. יש לציין שדגימות לגילוי פורפירנים חייבות להילקח במועד מתאים ולהיות מטופלות באופן זהיר ומוקפד. הדגימות צריכות להילקח רק במהלך של מתקף חריף של תסמינים החשודים לפורפיריה, שאם לא כן עלולה להתקבל תוצאה תקינה כזובה. הדגימות חייבות להיות מוגנות היטב מפני חשיפה לאור, הן חייבות להיות מקוררות או להכיל חומרים משמרים כפי שיפורט.
כשמדובר באיסוף שתן של 24 שעות, יש להקפיד שמיכל האיסוף יהיה מיכל כהה או כזה העטוף בנייר אלומיניום להגנה מפני אור. למיכל יש צורך להוסיף 5 גרם של נתרן קרבונאט לפני תחילת האיסוף אם הכוונה למדוד PBG ופורפירינים. לעומת זאת, אם הכוונה למדוד בשתן רמת ALA לבחינת אפשרות של הרעלת עופרת, מומלץ להוסיף 5 מ"ל של חומצת מלח מרוכזת לפני תחילת האיסוף, כיוון ש-ALA יציב יותר בתנאים חומציים. יחד עם זאת, יש להדגיש ש-PBG אינו יציב בתנאים חומציים, ונדיר שמודדים רק רמת ALA, לכן עדיף להוסיף נתרן קרבונאט ולא חומצה. PBG בשתן יציב למשך 1-2 שבועות במקרר, ולמספר חודשים בהקפאה.
גם דגימות צואה מוצקה (5-10 גרם) הנלקחות חייבות להיות מוגנות מאור על ידי כיסוי נאות עם נייר אלומיניום ושמירה במקרר. דגימת הצואה יציבה לצורך בדיקת פורפירינים עד 36 שעות בטמפרטורת החדר, או מספר חודשים בהקפאה.
באשר לדגימת דם ניתן להשתמש במבחנת כימיה (פקק אדום או צהוב), מבחנת ספירת-דם עם EDTA (פקק סגלגל) או מבחנת הפארין (פקק ירוק), אך חיוני שדגימת הנסיוב או הפלזמה לא תהיה המוליטית, שכן ריכוז הפורפירינים בתוך כדוריות הדם גבוה לאין ערוך מהריכוז בנוזל הדם, לכן יש צורך על סרכוז והפרדה מהירה בין התאים ונוזל הדם. הדגימה יציבה בקירור למשך 5 ימים.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק