הבדלים בין גרסאות בדף "בדיקת HER2"
| (29 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
{{בדיקת מעבדה | {{בדיקת מעבדה | ||
| − | |שם עברי= | + | |שם עברי={{רווח קשיח|2}} |
| − | |שם לועזי= | + | |שם לועזי=Human Epidermal Growth Factor Receptor 2 |
|קיצור=C-erbB-2 ;CD340 ;HER-2/neu ;MLN 19 ;neu ;NGL TKR1 ;p185erbB2 | |קיצור=C-erbB-2 ;CD340 ;HER-2/neu ;MLN 19 ;neu ;NGL TKR1 ;p185erbB2 | ||
|תמונה= | |תמונה= | ||
|כיתוב תמונה= | |כיתוב תמונה= | ||
| − | |מעבדה= | + | |מעבדה=[[פתולוגיה]], אונקולוגית-מולקולארית |
|תחום=הערכת הסטאטוס של תאי סרטן שד לאונקוגן HER2 | |תחום=הערכת הסטאטוס של תאי סרטן שד לאונקוגן HER2 | ||
|יחידות מדידה= | |יחידות מדידה= | ||
| שורה 12: | שורה 12: | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | + | {{הרחבה|HER2}} | |
==בסיס פיזיולוגי== | ==בסיס פיזיולוגי== | ||
| − | |||
אחת מתוך שמונה עד תשע נשים עלולה לחלות במהלך חייה ב[[סרטן השד]], שהיא המחלה הממארת השכיחה ביותר בקרב נשים בעולם המערבי ובישראל, בה נפוצה המחלה במיוחד בקרב ילידות ישראל ללא הבדל אתני, וכן היא שכיחה בנשים ממוצא אירופאי וצפון אמריקני. מדי שנה מאובחנים בעולם 1.4 מיליון מקרים חדשים של סרטן השד, ו-450,000 נשים מתות בעולם מדי שנה מהמחלה. מדי שנה מאובחנות בישראל כ-4000 חולות חדשות בסרטן השד, ו-900 מתוכן לא תשרודנה את המחלה. | אחת מתוך שמונה עד תשע נשים עלולה לחלות במהלך חייה ב[[סרטן השד]], שהיא המחלה הממארת השכיחה ביותר בקרב נשים בעולם המערבי ובישראל, בה נפוצה המחלה במיוחד בקרב ילידות ישראל ללא הבדל אתני, וכן היא שכיחה בנשים ממוצא אירופאי וצפון אמריקני. מדי שנה מאובחנים בעולם 1.4 מיליון מקרים חדשים של סרטן השד, ו-450,000 נשים מתות בעולם מדי שנה מהמחלה. מדי שנה מאובחנות בישראל כ-4000 חולות חדשות בסרטן השד, ו-900 מתוכן לא תשרודנה את המחלה. | ||
| − | סרטן השד היא הממאירות השכיחה ביותר בקרב נשים, וכמו בסוגי סרטן רבים אחרים, סיבותיה עדיין עלומות. כמקובל, סבורים שגורמים גנטיים אך גם סביבתיים כרוכים בהיווצרות המחלה, כאשר מוטציות בגנים אחדים כמו HER2 ,BRCA1 ,BRCA2 ו-p53 נכרכו עם סרטן השד. כיוון שהחלבון HER2 מתבטא ביתר ב-20% עד 30% ממקרי סרטן זה, הוא הפך ליעד תרפיה ביולוגית תוך שימוש בנוגדן חד-שבטי ספציפי לקולטן של חלבון זה. נוגדן כזה-trastuzumab (שם מותג Herceptin), שיכול להיקשר לקולטן התאי של HER2, ולנטרל אותו, הפך להיות אחד התכשירים המקובלים ביותר בתחום הטיפולים של סרטן השד, כאשר תכשירים אחרים המיועדים לנטרולו של HER2 כוללים את lapatinib (שם מותג Tykerb) ו-pertuzumab (הידוע גם כ- | + | סרטן השד היא הממאירות השכיחה ביותר בקרב נשים, וכמו בסוגי סרטן רבים אחרים, סיבותיה עדיין עלומות. כמקובל, סבורים שגורמים גנטיים אך גם סביבתיים כרוכים בהיווצרות המחלה, כאשר מוטציות בגנים אחדים כמו HER2 ,BRCA1 ,BRCA2 ו-p53 נכרכו עם סרטן השד. כיוון שהחלבון HER2 מתבטא ביתר ב-20% עד 30% ממקרי סרטן זה, הוא הפך ליעד תרפיה ביולוגית תוך שימוש בנוגדן חד-שבטי ספציפי לקולטן של חלבון זה. נוגדן כזה-trastuzumab (שם מותג Herceptin), שיכול להיקשר לקולטן התאי של HER2, ולנטרל אותו, הפך להיות אחד התכשירים המקובלים ביותר בתחום הטיפולים של סרטן השד, כאשר תכשירים אחרים המיועדים לנטרולו של HER2 כוללים את lapatinib (שם מותג Tykerb) ו-pertuzumab (שם מותג פרג'טה הידוע גם כ-C42). התכשיר lapatinib היא מולקולה קטנה המעכבת את האנזים טירוזין קינאזה שהוא חלק מ-2 קולטנים מקבוצת ה-Erb: הקולטן ל-EGF המכונה גם ERbB1 וכן HER1 והקולטן ל-HER2 או ErbB2. התכשיר lapatinib חודר לתוך התא ומעכב את התהליך הסרטני בו על ידי נטרול טירוזין קינאזה. הנוגדן pertuzumab נקשר לחלק החיצוני של הקולטן ל-HER2, אלא שמיקום קשירתו שונה מזה של [[הרצפטין]]. |
סרטן השד הפך להיות הסוג הראשון של סרטן סולידי שניתן היה לטפל בו בהצלחה על ידי גישה של תרפיה ממוקדת-מטרה. מאז אישורה בשנת 1998 לטיפול בסרטן השד, הפכה התרופה הרצפטין מודל לטיפולים ביולוגיים ממוקדי-מטרה. ראוי אם כן לבחון את הדרך הארוכה והמפותלת מאז גילוי מולקולת היעד בתאים סרטניים עד לפיתוח התרופה המכוונת ליעד התאי הזה. | סרטן השד הפך להיות הסוג הראשון של סרטן סולידי שניתן היה לטפל בו בהצלחה על ידי גישה של תרפיה ממוקדת-מטרה. מאז אישורה בשנת 1998 לטיפול בסרטן השד, הפכה התרופה הרצפטין מודל לטיפולים ביולוגיים ממוקדי-מטרה. ראוי אם כן לבחון את הדרך הארוכה והמפותלת מאז גילוי מולקולת היעד בתאים סרטניים עד לפיתוח התרופה המכוונת ליעד התאי הזה. | ||
| שורה 23: | שורה 22: | ||
===אבני דרך בגילוי של הפרוטו-אונקוגן HER2 והנוגדן החד-שבטי הנקשר לקולטן שלו trastuzumab (הרצפטין)=== | ===אבני דרך בגילוי של הפרוטו-אונקוגן HER2 והנוגדן החד-שבטי הנקשר לקולטן שלו trastuzumab (הרצפטין)=== | ||
| − | בשנת 1978 פרסם Stanley Cohen וחב' באוניברסיטת Vanderbilt ב-Nature על גילוי הקולטן ל-Epidermal growth factor, שכינויו EGFR או גם ErbB*-1 וכן גם HER1. היה זה הקולטן הראשון אליו קשור האנזים tyrosine kinase המעודד זִרחוּן של מרכיב תוך-תאי להפעלת רצף גורמים ופעילות מטבולית חיונית. הכינוי ErbB מקורו בגן Erb-b שמופיע בנגיף avian erythroblastosis virus. בין השנים 1982-1984 התגלה האונקוגן neu על ידי Robert Weinberg וחב' ב-M.I.T (בפרסומים ב-Cell בשנת 1982 וב-Nature ב-1984) ומייד אחריו על ידי קבוצות מחקר באוניברסיטאות Rockefeller ו-Harvard: האונקוגן neu הידוע גם כ-HER2 ,ErbB2 וכן p185 (בהיותו מקודד לחלבון מזוּרחן במשקל מולקולארי 185,000 דלטון), נתגלה במחקר על שורת תאים של ממקור סרטן העצבי (גליובלסטומה) בחולדות. | + | בשנת 1978 פרסם סטנלי כהן (Stanley Cohen) וחב' באוניברסיטת Vanderbilt ב-Nature על גילוי הקולטן ל-Epidermal growth factor, שכינויו EGFR או גם ErbB*-1 וכן גם HER1. היה זה הקולטן הראשון אליו קשור האנזים tyrosine kinase המעודד זִרחוּן של מרכיב תוך-תאי להפעלת רצף גורמים ופעילות מטבולית חיונית. הכינוי ErbB מקורו בגן Erb-b שמופיע בנגיף avian erythroblastosis virus. בין השנים 1982-1984 התגלה האונקוגן neu על ידי Robert Weinberg וחב' ב-M.I.T (בפרסומים ב-Cell בשנת 1982 וב-Nature ב-1984) ומייד אחריו על ידי קבוצות מחקר באוניברסיטאות Rockefeller ו-Harvard: האונקוגן neu הידוע גם כ-HER2 ,ErbB2 וכן p185 (בהיותו מקודד לחלבון מזוּרחן במשקל מולקולארי 185,000 דלטון), נתגלה במחקר על שורת תאים של ממקור סרטן העצבי (גליובלסטומה) בחולדות. |
| − | בשנים 1984-1986 היו מספר הישגים מחקריים הקשורים ל-HER2: קבוצת המחקר של Axel Ullrich ב-Genentech, במאמר ב-Nature ב-1984, ו-Yamamoto וחב' ביפאן במאמר ב-1986 ב-Nature, שִבטוּ את ה-cDNA של הגן המקודד ל-HER2 או Erb-2. השם HER2 נובע מהדמיון המבני ל-HER1, כשהשם נגזר מ- Human Epidermal growth factor Receptor 2. השם ErbB-2 ניתן ל-neu, כיוון שהוא למעשה גרסת הגן המופיע ביונקים, של אותו גן ERBB2 או ERBB שנמצא בנגיפים. החלבון המקודד על ידי הגרסה האנושית של הגן ERBB2, זהה למעשה ל-EGFR האנושי, ומכאן הכינוי HER2. הגנים neu ו-HER2 נקראים היום במשותף HER/neu. | + | בשנים 1984-1986 היו מספר הישגים מחקריים הקשורים ל-HER2: קבוצת המחקר של אקסל אולריך (Axel Ullrich) ב-Genentech, במאמר ב-Nature ב-1984, ו-Yamamoto וחב' ביפאן במאמר ב-1986 ב-Nature, שִבטוּ את ה-cDNA של הגן המקודד ל-HER2 או Erb-2. השם HER2 נובע מהדמיון המבני ל-HER1, כשהשם נגזר מ- Human Epidermal growth factor Receptor 2. השם ErbB-2 ניתן ל-neu, כיוון שהוא למעשה גרסת הגן המופיע ביונקים, של אותו גן ERBB2 או ERBB שנמצא בנגיפים. החלבון המקודד על ידי הגרסה האנושית של הגן ERBB2, זהה למעשה ל-EGFR האנושי, ומכאן הכינוי HER2. הגנים neu ו-HER2 נקראים היום במשותף HER/neu. |
בהמשך, הראו Weinberg וצוותי מחקר ב-M.I.T וב-Harvard בשני מאמרים ב-nature ב-1984 וב-Cell ב-1985, שהם הפיקו נוגדנים חד-שבטיים בניסיון לזהות אנטיגנים על פני התאים הקשורים עם השפעול של האונקוגן התאי. הם גילו שנוגדנים אלה נקשרים וגורמים ל-immune precipitationשל החלבון p185 בתאי נוירובלסטומה של חולדה. אותה קבוצת חוקרים הראתה בשנת 1986 ב-Proc Natl Acad Sci, שנוגדן החד-שבטי כנגד p185, גורם לתאי עכבר מסוג 3T3 מותמרים על ידי neu, להפוך ל-revertants, דהינו להפוך לפנוטיפ שאינו מותמר, כפי שהתברר מקצב חלוקת התאים שהואט ומצורת הגידול הסדירה של התאים בתרבית רקמה, כאשר הם עוברים עיכוב-על-ידי-מגע (contact inhibition) בבואם במגע עם תאים סמוכים. החוקרים הראו כמו כן שנוגדנים חד-שבטיים המכוונים כנגד p185, יכולים לעכב גידולים סרטניים בעכברים, ולהאריך את משך חייהם של עכברים נטולי מערכת חיסון מזן (Balb/C nude (nu/nu, לתוכם הוזרקו תאי הסרטן. | בהמשך, הראו Weinberg וצוותי מחקר ב-M.I.T וב-Harvard בשני מאמרים ב-nature ב-1984 וב-Cell ב-1985, שהם הפיקו נוגדנים חד-שבטיים בניסיון לזהות אנטיגנים על פני התאים הקשורים עם השפעול של האונקוגן התאי. הם גילו שנוגדנים אלה נקשרים וגורמים ל-immune precipitationשל החלבון p185 בתאי נוירובלסטומה של חולדה. אותה קבוצת חוקרים הראתה בשנת 1986 ב-Proc Natl Acad Sci, שנוגדן החד-שבטי כנגד p185, גורם לתאי עכבר מסוג 3T3 מותמרים על ידי neu, להפוך ל-revertants, דהינו להפוך לפנוטיפ שאינו מותמר, כפי שהתברר מקצב חלוקת התאים שהואט ומצורת הגידול הסדירה של התאים בתרבית רקמה, כאשר הם עוברים עיכוב-על-ידי-מגע (contact inhibition) בבואם במגע עם תאים סמוכים. החוקרים הראו כמו כן שנוגדנים חד-שבטיים המכוונים כנגד p185, יכולים לעכב גידולים סרטניים בעכברים, ולהאריך את משך חייהם של עכברים נטולי מערכת חיסון מזן (Balb/C nude (nu/nu, לתוכם הוזרקו תאי הסרטן. | ||
| שורה 33: | שורה 32: | ||
עוד בשנת 1985 פרסם Stuart Aaronson ממכון הסרטן הלאומי (NCI) ב-Nucleic Acids Res את הממצא שגן הקשור ל-v-erB, עובר אמפליפיקציה בערך ב-10% מתאי סרטן שד בתרבית. שנה לאחר מכן פרסמו Yamamoto וחב' ב-Mol Cell Biol, שאותו גן עליו דיווח Aaronson, אינו אלא C-erbB-2, הממוקם על כרומוזום 17, ואת העובדה שהוא עובר אמפליפיקציה בשורת תאים שמקורה מסרטן הקיבה באדם. אותו גן, שהיו שהעדיפו לכנותו neu, שובט, רוצף ומוּקם בכרומוזום 17 גם על ידי Weinberg וחב' במאמרם ב-Nature בשנת 1986, ואילו Coussens וחב' פרסמו ב-Nature כבר ב-1985 שהגן המקודד לקולטן טירוזין קינאזה שהוא בעל הומולוגיה ניכרת לקולטן של EGF, הוא בעל מיקום כרומוזומאלי זהה לגן המקודד ל-neu. | עוד בשנת 1985 פרסם Stuart Aaronson ממכון הסרטן הלאומי (NCI) ב-Nucleic Acids Res את הממצא שגן הקשור ל-v-erB, עובר אמפליפיקציה בערך ב-10% מתאי סרטן שד בתרבית. שנה לאחר מכן פרסמו Yamamoto וחב' ב-Mol Cell Biol, שאותו גן עליו דיווח Aaronson, אינו אלא C-erbB-2, הממוקם על כרומוזום 17, ואת העובדה שהוא עובר אמפליפיקציה בשורת תאים שמקורה מסרטן הקיבה באדם. אותו גן, שהיו שהעדיפו לכנותו neu, שובט, רוצף ומוּקם בכרומוזום 17 גם על ידי Weinberg וחב' במאמרם ב-Nature בשנת 1986, ואילו Coussens וחב' פרסמו ב-Nature כבר ב-1985 שהגן המקודד לקולטן טירוזין קינאזה שהוא בעל הומולוגיה ניכרת לקולטן של EGF, הוא בעל מיקום כרומוזומאלי זהה לגן המקודד ל-neu. | ||
| − | בשנת 1987 התפרסם ב-Science מאמרם של Ullrich ב-Genentech ששיתף פעולה עם Dennis Slamon מ-UCLA ועם האונקולוג William McGuire מסן-אנטוניו, בו הם הראו שאמפליפיקציה של האונקוגן HER-2/neu בסרטן שד, כרוכה במשכי זמן קצרים יותר החולפים מההפוגה (remission) עד להתפרצות החוזרת של המחלה (relapse), ובשיעור הישרדות | + | בשנת 1987 התפרסם ב-Science מאמרם של Ullrich ב-Genentech ששיתף פעולה עם Dennis Slamon מ-UCLA ועם האונקולוג William McGuire מסן-אנטוניו, בו הם הראו שאמפליפיקציה של האונקוגן HER-2/neu בסרטן שד, כרוכה במשכי זמן קצרים יותר החולפים מההפוגה (remission) עד להתפרצות החוזרת של המחלה (relapse), ובשיעור הישרדות נמוך יותר של נשים עם סרטן זה. |
| − | כהמשך טבעי להתפתחויות אלה, תיארו Phil Leder ו-William Muller מ-Harvard וממכון Howard Hughes במאמר משנת 1988 ב-Cell, שהחדרת אונקוגן פעיל של neu לעכברים, גרמה לביטוי של החומר הגנטי המוחדר באופן שגרם בהם להתפתחות סרטן השד. הרחבה מרתקת של היריעה התבררה במאמרם של Slamon ו-Ullrich בשנת 1989 ב-Science, ממנו התחוור שחלק מהנתונים לגבי אמפליפיקציה של | + | כהמשך טבעי להתפתחויות אלה, תיארו Phil Leder ו-William Muller מ-Harvard וממכון Howard Hughes במאמר משנת 1988 ב-Cell, שהחדרת אונקוגן פעיל של neu לעכברים, גרמה לביטוי של החומר הגנטי המוחדר באופן שגרם בהם להתפתחות סרטן השד. הרחבה מרתקת של היריעה התבררה במאמרם של Slamon ו-Ullrich בשנת 1989 ב-Science, ממנו התחוור שחלק מהנתונים לגבי אמפליפיקציה של האונקוגן HER-2/neu, נכון גם לגבי סרטן השחלה. באותה שנה פרסמו Wright וחב' מהיחידה לחקר הסרטן באוניברסיטת אוקספורד, שביטוי-יתר של האונקופרוטאין erbB-2, יכול בהחלט לשמש מדד פרוגנוסטי של מהלך סרטן השד. |
קבוצתו של Ullrich ב-Genetech המשיכה לגלות יוזמה ודומיננטיות בנושא, ובשנת 1989 דיווחה ב-Mol Cell Biol על כך שנוגדן חד שבטי שהיה מכוון כנגד המקטע החוץ-תאי של p185/HER2, מעכב באופן ספציפי את שגשוגם בתרבית של תאים שמקורם בגידול שד המבטא באופן מוגבר את תוצר האונקוגן HER2/c-erbB-2. חוקרי Genentech הראו כמו כן שאותו נוגדן חד שבטי, הגביר את הרגישות של תאי סרטן השד לציטוקין TNF-α. | קבוצתו של Ullrich ב-Genetech המשיכה לגלות יוזמה ודומיננטיות בנושא, ובשנת 1989 דיווחה ב-Mol Cell Biol על כך שנוגדן חד שבטי שהיה מכוון כנגד המקטע החוץ-תאי של p185/HER2, מעכב באופן ספציפי את שגשוגם בתרבית של תאים שמקורם בגידול שד המבטא באופן מוגבר את תוצר האונקוגן HER2/c-erbB-2. חוקרי Genentech הראו כמו כן שאותו נוגדן חד שבטי, הגביר את הרגישות של תאי סרטן השד לציטוקין TNF-α. | ||
| שורה 41: | שורה 40: | ||
באותה עת (שנים 1989-1990) הייתה פעילה במיוחד קבוצת המחקר של Greene בפילדלפיה, שהראתה במאמרים שפורסמו ב-Cell ב-1989 וב-1990, וכן ב-Oncogene ב-1989, על אינטראקציה תוך-תאית בין החלבון p185/neu לבין הקולטן של גורם הגדילה האפידרמאלי (EGFR), ליצירת הומו-דימרים של neu. יצירת דימרים אלה מביאים להתמרה סרטנית של פיברובלסטים של מכרסמים, באופן שקיימת תאחיזה בין פעילות האנזים טירוזין קינאזה לבין יכולת ההתמרה הסרטנית של האונקו-פרוטאין p185/neu. | באותה עת (שנים 1989-1990) הייתה פעילה במיוחד קבוצת המחקר של Greene בפילדלפיה, שהראתה במאמרים שפורסמו ב-Cell ב-1989 וב-1990, וכן ב-Oncogene ב-1989, על אינטראקציה תוך-תאית בין החלבון p185/neu לבין הקולטן של גורם הגדילה האפידרמאלי (EGFR), ליצירת הומו-דימרים של neu. יצירת דימרים אלה מביאים להתמרה סרטנית של פיברובלסטים של מכרסמים, באופן שקיימת תאחיזה בין פעילות האנזים טירוזין קינאזה לבין יכולת ההתמרה הסרטנית של האונקו-פרוטאין p185/neu. | ||
| − | החל משנת 1990 התחזקה המגמה של חברות ביוטכנולוגיה ובראשן Genetech, לנצל את הידע הקיים, בעיקר בתחום יצירת נוגדנים חד שבטיים שיהיו מכוונים כנגד אותם אונקו-חלבונים ממשפחת ה-EGF או הקולטנים שלהם, במטרה להפר את מעורבות מרכיבים אלה בתהליך הסרטני. באותה שנה פרסם Ullrich וקבוצתו ב-Cancer Res על האִפיוּן של נוגדנים חד-שבטיים המגיבים או עם הקולטן של EGF או עם האונקו-פרוטאין HER2/neu. התוצר הנוגדני הראשון, | + | החל משנת 1990 התחזקה המגמה של חברות ביוטכנולוגיה ובראשן Genetech, לנצל את הידע הקיים, בעיקר בתחום יצירת נוגדנים חד שבטיים שיהיו מכוונים כנגד אותם אונקו-חלבונים ממשפחת ה-EGF או הקולטנים שלהם, במטרה להפר את מעורבות מרכיבים אלה בתהליך הסרטני. באותה שנה פרסם Ullrich וקבוצתו ב-Cancer Res על האִפיוּן של נוגדנים חד-שבטיים המגיבים או עם הקולטן של EGF או עם האונקו-פרוטאין HER2/neu. התוצר הנוגדני הראשון, Herceptin, נוצר ב-1991 דווקא בתאי CHO (תאי שחלה של chinese hamster) , אם כי לצורך שימוש תרופתי בנשים עם סרטן שד, היה כמובן חיוני להשתמש בנוגדנים חד שבטיים שמקורם בתאי אדם, כדי להימנע מנטרול של הנוגדן על ידי תגובה של מערכת החיסון האנושית. |
| − | אכן, Paul Carter, אף הוא מאנשי Genetech וחב', פרסמו ב-1992 ב- Proc Natl Acad Sci, על יצירת גרסה הומאנית (humanized Ab) של נוגדן חד-שבטי כנגד HER2, תוך שימוש באסטרטגיה של gene conversion mutagenesis, בה ניתן היה להפיק באופן מהיר וסימולטאני האנשה של אזורי השרשרת הכבדה (VH) והשרשרת הקלה (VL) של הנוגדן החד-שבטי mumAb4D5 שמוכר כיום כהרצפטין בגרסה ההומאנית שלו, נוגדן המכוון כנגד המקטע החוץ תאי של p185/neu. בשנת 1992 החלו ניסויי phase I עם הרצפטין בעיקר בבחינת מינונים שונים של התכשיר, | + | אכן, Paul Carter, אף הוא מאנשי Genetech וחב', פרסמו ב-1992 ב- Proc Natl Acad Sci, על יצירת גרסה הומאנית (humanized Ab) של נוגדן חד-שבטי כנגד HER2, תוך שימוש באסטרטגיה של gene conversion mutagenesis, בה ניתן היה להפיק באופן מהיר וסימולטאני האנשה של אזורי השרשרת הכבדה (VH) והשרשרת הקלה (VL) של הנוגדן החד-שבטי mumAb4D5 שמוכר כיום כהרצפטין בגרסה ההומאנית שלו, נוגדן המכוון כנגד המקטע החוץ תאי של p185/neu. בשנת 1992 החלו ניסויי phase I עם הרצפטין בעיקר בבחינת מינונים שונים של התכשיר, לאִפיוּן הפרופיל הפארמקוֹ-קינטי שלו. בשנת 1993 החלו ניסויי phase II ב-54 מרכזים רפואיים בצפון אמריקה, אירופה, ובאוסטריה וניו-זילנד, והסתיימו בשנת 1994. |
| − | בשנת 1995 החלו ניסויי phase III עם הרצפטין, כאשר ניסוי CARE או Chemotherapy & Antibody Response Evaluation, היה ניסוי רב-לאומי, אקראי של בחינת הרצפטין בשילוב עם כימותרפיה בנשים עם סרטן שד גרורתי וביטוי-יתר של HER2, שלא קבלו בעברן טיפול כימותרפי ציטוטוקסי. הגיוס של משתתפות לניסוי זה החל ב-12 ביוני 1995 והיה מתוכנן להסתיים ב-7 | + | בשנת 1995 החלו ניסויי phase III עם הרצפטין, כאשר ניסוי CARE או Chemotherapy & Antibody Response Evaluation, היה ניסוי רב-לאומי, אקראי של בחינת הרצפטין בשילוב עם כימותרפיה בנשים עם סרטן שד גרורתי וביטוי-יתר של HER2, שלא קבלו בעברן טיפול כימותרפי ציטוטוקסי. הגיוס של משתתפות לניסוי זה החל ב-12 ביוני 1995 והיה מתוכנן להסתיים ב-7 במרץ 1997. ב-1997 החל שיתוף פעולה בין חברת Genentech וחברת DAKO הדנית, באשר לערכת הבדיקה HerceptestTM, להערכה חצי כמותית של רמת HER2 בתאי סרטן השד, ערכה המקבלת את אישור ה-FDA בספטמבר 1998, ואת אישור ה-European Conformity בשנת 2003, ומשמשת נכון לשנת 2014 כערכה מובילה בתחום זה. בשנת 2005 מקבלת הערכה המולקולארית לבחינת רמת HER2, הידועה כ-HER2 FISH pharmDX KitTM, את אישור ה-FDA כבדיקה להערכת הטיפול בהרצפטין בחולות עם סרטן שד. |
שנת 1998 הייתה שנה מכוננת בתחום של הרצפטין, כאשר ה-FDA העניק ל-Genentech אור ירוק במסלול העדפה מקוצר (Fast-track designation), לטיפול בחולות עם סרטן שד מפושט. באותה שנה מאשר ה-FDA שימוש בהרצפטין אם במשולב עם paclitaxel (שם מותג Taxol), כטיפול קו-ראשון של סרטן שד מפושט חיובי ל-HER2, או לשימוש יחידני באותן חולות (כטיפול קו שני או שלישי). בכך הפך הרצפטין לתכשיר של נוגדן מכוון-המטרה הראשון כנגד מולקולה ספציפית בתא הסרטני, שמקבל את אישור ה-FDA. באותה שנה מתפרסמות המלצות האגודה האמריקנית לאונקולוגיה קלינית (ASCO), לפיהן מבדק HER2 חיוני בכל מקרי סרטן השד, הנחיות המתפרסמות לאחר מכן ב-(J Clin Oncol, 17, 1080-2 ,(1999. | שנת 1998 הייתה שנה מכוננת בתחום של הרצפטין, כאשר ה-FDA העניק ל-Genentech אור ירוק במסלול העדפה מקוצר (Fast-track designation), לטיפול בחולות עם סרטן שד מפושט. באותה שנה מאשר ה-FDA שימוש בהרצפטין אם במשולב עם paclitaxel (שם מותג Taxol), כטיפול קו-ראשון של סרטן שד מפושט חיובי ל-HER2, או לשימוש יחידני באותן חולות (כטיפול קו שני או שלישי). בכך הפך הרצפטין לתכשיר של נוגדן מכוון-המטרה הראשון כנגד מולקולה ספציפית בתא הסרטני, שמקבל את אישור ה-FDA. באותה שנה מתפרסמות המלצות האגודה האמריקנית לאונקולוגיה קלינית (ASCO), לפיהן מבדק HER2 חיוני בכל מקרי סרטן השד, הנחיות המתפרסמות לאחר מכן ב-(J Clin Oncol, 17, 1080-2 ,(1999. | ||
| שורה 51: | שורה 50: | ||
בשנת 2002 מאשר ה-FDA את הכללתה של בדיקת FISH לבחינת אמפליפיקציה של HER2, כחלק מתוויות ההנחיה באריזת הרצפטין. באותה שנה Garrett וחב' ממכון Aliza & Walter Hall באוסטרליה, מפענחים את המבנה הגבישי של המקטע החוץ-תאי של EGFR קשור ל-TGF-α, בדרגת רזולוציה של 2.5Å, ומדווחים על כך ב-Cell. במקביל מופיע באותו כתב-עת מאמרם של Yokoyama וחב' ממרכז RIKEN ללימודים גנומיים ביפאן, בו הם מדווחים על פּענוח המבנה הגבישי של קומפלקס (2:2) של EGF אנושי עם המקטע החוץ-תאי של הקולטן ל-EGF, ברמת רזולוציה של 3.3Å. | בשנת 2002 מאשר ה-FDA את הכללתה של בדיקת FISH לבחינת אמפליפיקציה של HER2, כחלק מתוויות ההנחיה באריזת הרצפטין. באותה שנה Garrett וחב' ממכון Aliza & Walter Hall באוסטרליה, מפענחים את המבנה הגבישי של המקטע החוץ-תאי של EGFR קשור ל-TGF-α, בדרגת רזולוציה של 2.5Å, ומדווחים על כך ב-Cell. במקביל מופיע באותו כתב-עת מאמרם של Yokoyama וחב' ממרכז RIKEN ללימודים גנומיים ביפאן, בו הם מדווחים על פּענוח המבנה הגבישי של קומפלקס (2:2) של EGF אנושי עם המקטע החוץ-תאי של הקולטן ל-EGF, ברמת רזולוציה של 3.3Å. | ||
| − | בשנת 2006 מאשר ה-FDA את הטיפול בהרצפטין כחלק ממערך טיפולי הכולל בנוסף ל-doxorubicin, ציקלופוספאמיד וטקסול כטיפול adjuvant במטופלות עם HER2 חיובי, ועם ממצא של גרורות לבלוטות הלימפה. שנה לאחר מכן מתפרסמות ב-J Oncol Practice, כרך 3, עמ' 48-50, הנחיות משותפות של ASCO ושל ה-College of American Pathologists) CAP), על המלצה למדידת HER2 בהערכה כוללנית של סרטן השד הגרורתי או | + | בשנת 2006 מאשר ה-FDA את הטיפול בהרצפטין כחלק ממערך טיפולי הכולל בנוסף ל-doxorubicin, ציקלופוספאמיד וטקסול כטיפול adjuvant במטופלות עם HER2 חיובי, ועם ממצא של גרורות לבלוטות הלימפה. שנה לאחר מכן מתפרסמות ב-J Oncol Practice, כרך 3, עמ' 48-50, הנחיות משותפות של ASCO ושל ה-College of American Pathologists) CAP), על המלצה למדידת HER2 בהערכה כוללנית של סרטן השד הגרורתי, מחלה מוקדמת או מחלה חוזרת. |
בשנת 2008 מאשר ה-FDA את הטיפול בהרצפטין כטיפול adjuvant יחידני במטופלות עם ביטוי-יתר של HER2, אך ללא קולטנים לאסטרוגן ולפרוגסטרון (ER/PR negative). עם או ללא מעורבות של בלוטות לימפה, שכבר עברו טיפול מבוסס על אנתרציקלינים דוגמת doxorubicin. באותה שנה, מתגלה בדיווח של O'Shaughnessy וחב' ב-J Clin Oncol, ההשפעה הסינרגיסטית של lapatinib ביחד עם הרצפטין במטופלות עם סרטן שד גרורתי חיוביות ל-HER2, בהן טיפול קודם בהרצפטין בלבד לא הביא לתגובה הרצויה. | בשנת 2008 מאשר ה-FDA את הטיפול בהרצפטין כטיפול adjuvant יחידני במטופלות עם ביטוי-יתר של HER2, אך ללא קולטנים לאסטרוגן ולפרוגסטרון (ER/PR negative). עם או ללא מעורבות של בלוטות לימפה, שכבר עברו טיפול מבוסס על אנתרציקלינים דוגמת doxorubicin. באותה שנה, מתגלה בדיווח של O'Shaughnessy וחב' ב-J Clin Oncol, ההשפעה הסינרגיסטית של lapatinib ביחד עם הרצפטין במטופלות עם סרטן שד גרורתי חיוביות ל-HER2, בהן טיפול קודם בהרצפטין בלבד לא הביא לתגובה הרצויה. | ||
===סרטן שד חיובי ל-HER2=== | ===סרטן שד חיובי ל-HER2=== | ||
| − | |||
במהלך חיי אדם מתרחשות מוטציות בגנים שונים בתאים של רקמה מסוימת בגופו, כאשר השינויים המכונים "מוטציות סומאטיות" אינם עוברים בהורשה. מוטציות סומאטיות כאלה מתרחשות לעתים כאשר DNA עובר רפליקציה כהכנה לחלוקת התא, כאשר "שגיאות" בתהליכי רפליקציה אלה, עלולות לגרום להופעת מספר גדול של עותקים של גן מסוים על פני הכרומוזום, מה שידוע כ-gene amplification. תופעה זו יכולה לעמוד בבסיס היצירה והשגשוג של תאי סרטן בתלות בזהותו של הגן שאמנם עובר אמפליפיקציה. עותקים עודפים של גן כזה (ERBB2) מייצרים עודף גדול של חלבון הקולטן של ErbB2 בתאי סרטן השד באותם 25% לערך מכלל סרטני השד. אגב, אמפליפיקציה של הגן ERBB2 מדווחת גם בסוגים אחרים של סרטן כגון סרטן השחלה, המוח, הקיבה, הריאות ושלפוחית השתן. הגן ERBB2 ממוקם על הזרוע הארוכה (q) של כרומוזום 17 בעמדה 17q11.2-21 . ליתר דיוק מיקום גן זה הוא בין base pair 39,688,139 לבין base pair 39,728,661 על כרומוזום 17. גן זה עובר רוב הזמן אמפליפיקציה ביחד עם הגן GRB7, שהוא הפרוטו-אונקוגן הכרוך עם גידולים סרטניים של השד, הקיבה הלוע ושל תאי נבט באשכים. | במהלך חיי אדם מתרחשות מוטציות בגנים שונים בתאים של רקמה מסוימת בגופו, כאשר השינויים המכונים "מוטציות סומאטיות" אינם עוברים בהורשה. מוטציות סומאטיות כאלה מתרחשות לעתים כאשר DNA עובר רפליקציה כהכנה לחלוקת התא, כאשר "שגיאות" בתהליכי רפליקציה אלה, עלולות לגרום להופעת מספר גדול של עותקים של גן מסוים על פני הכרומוזום, מה שידוע כ-gene amplification. תופעה זו יכולה לעמוד בבסיס היצירה והשגשוג של תאי סרטן בתלות בזהותו של הגן שאמנם עובר אמפליפיקציה. עותקים עודפים של גן כזה (ERBB2) מייצרים עודף גדול של חלבון הקולטן של ErbB2 בתאי סרטן השד באותם 25% לערך מכלל סרטני השד. אגב, אמפליפיקציה של הגן ERBB2 מדווחת גם בסוגים אחרים של סרטן כגון סרטן השחלה, המוח, הקיבה, הריאות ושלפוחית השתן. הגן ERBB2 ממוקם על הזרוע הארוכה (q) של כרומוזום 17 בעמדה 17q11.2-21 . ליתר דיוק מיקום גן זה הוא בין base pair 39,688,139 לבין base pair 39,728,661 על כרומוזום 17. גן זה עובר רוב הזמן אמפליפיקציה ביחד עם הגן GRB7, שהוא הפרוטו-אונקוגן הכרוך עם גידולים סרטניים של השד, הקיבה הלוע ושל תאי נבט באשכים. | ||
| שורה 77: | שורה 75: | ||
===תכשירים כנגד HER2=== | ===תכשירים כנגד HER2=== | ||
| − | הנוגדן trastuzumab יעיל רק כאשר יש ביטוי-יתר של HER2, וכאשר הנוגדן נקשר ל-HER2, יש עליה ניכרת ברמת החלבון p27, העוצר את חלוקת התאים. במקביל לעלייה ברמת p27, יש ירידה ברמת cyclin D1 כמו גם ברמת הפעילות של 2 cyclin-dependent kinase. נראה שהנוגדן הרצפטין אינו מסוגל לעודד פעילות משמעותית של אפופטוזיס, אלא פועל בסינרגיה עם תכשירים כימותרפיים אחרים כפי שהשתמע מניסויים קדם-קליניים. סינרגיה כזו באה לביטוי לדוגמה על ידי עיכוב מסלול האיתות של PI3k/Akt שבאופן נורמאלי מעודד הישרדותם של תאים והוא מנוגד לתהליך האפופטוטי, כפי שהדגימו Slamon וחב' בשנת 2004 ב-J Natl Cancer Inst. אך הרצפטין עשוי להביא למותם שתאי סרטן שד המבטאים HER2 ביתר, על ידי מנגנון אדפטיבי בעזרת תאי חיסון מסוג T ציטוטקסיים, דרך שפעול של הקולטן Fc, במה שמוכר כ-ADCC או antibody-dependent cell-mediated cytotoxicity, כפי שמדווחים Park וחב' ב-Cancer Cell בשנת 2010. | + | הנוגדן trastuzumab (שם מותג הרצפטין)יעיל רק כאשר יש ביטוי-יתר של HER2, וכאשר הנוגדן נקשר ל-HER2, יש עליה ניכרת ברמת החלבון p27, העוצר את חלוקת התאים. במקביל לעלייה ברמת p27, יש ירידה ברמת cyclin D1 כמו גם ברמת הפעילות של 2 cyclin-dependent kinase. נראה שהנוגדן הרצפטין אינו מסוגל לעודד פעילות משמעותית של אפופטוזיס, אלא פועל בסינרגיה עם תכשירים כימותרפיים אחרים כפי שהשתמע מניסויים קדם-קליניים. סינרגיה כזו באה לביטוי לדוגמה על ידי עיכוב מסלול האיתות של PI3k/Akt שבאופן נורמאלי מעודד הישרדותם של תאים והוא מנוגד לתהליך האפופטוטי, כפי שהדגימו Slamon וחב' בשנת 2004 ב-J Natl Cancer Inst. אך הרצפטין עשוי להביא למותם שתאי סרטן שד המבטאים HER2 ביתר, על ידי מנגנון אדפטיבי בעזרת תאי חיסון מסוג T ציטוטקסיים, דרך שפעול של הקולטן Fc, במה שמוכר כ-ADCC או antibody-dependent cell-mediated cytotoxicity, כפי שמדווחים Park וחב' ב-Cancer Cell בשנת 2010. |
| + | |||
| + | הרצפטין משווקת בארה"ב על ידי Genetech, ביפאן על ידי Chugai, וברחבי העולם על ידי ROCHE. מאז 1999 הרצפטין שימש לטיפול בלמעלה מ-1.5 מיליון נשים עם מחלה חיובית ל-HER2 ברחבי העולם. בחודש יוני 2006 נרשמה התרופה בישראל לטיפול בסרטן שד מוקדם מסוג HER2 חיובי ומייד לאחר מכן הוכללה בסל הבריאות. | ||
| + | |||
| + | תרופה נוספת שיעילותה הוכחה במחקרים קליניים, היא lapatinib (שם מותג Tykerb) שהוכנסה ב-2008 בארה"ב לטיפול בסרטן שד, בהתוויה של טיפול בסרטן שד גרורתי וביטוי-יתר של HER2, לאחר טיפול קודם בכימותרפיה סטנדרטית ובהרצפטין. Lapatinib היא מולקולה קטנה הפועלת בתוך התא ממשפחת מעכבי טירוזין קינאזה, המעכבת בפעילותה את erbB1 ו-erbB2, ונראה שיש יתרון בעיכוב הכפול של המסלולים הללו. | ||
| + | |||
| + | התכשיר lapatinib נמצא יעיל בטיפול משולב עם התכשיר הציטוטוקסי capecitabine, במקרים של סרטן שד גרורתי שהוא חיובי ל-HER2, אחרי שזה ממשיך להתפשט למרות טיפול קודם בהרצפטין. בדצמבר 2006 התפרסם ב-N Eng J Med מחקר רב לאומי (ארה"ב, בריטניה, פולין, אירלנד, אוסטרליה, ישראל) בראשו עמד Charles Geyer מפיטסבורג. במחקר זה הושוותה יעילות הטיפול המשולב האמור, לעומת טיפול יחידני עם capcitabine, ב-320 נשים המוגדרות +HER2, עם מחלה מפושטת מקומית או עם מחלה גרורתית, שהתפשטה לאחר טיפולים שכללו תכשירים אנטרציקליניים או טקסניים מקובלים, וכן טיפול בהרצפטין. | ||
| + | |||
| + | מחקר זה הופסק טרם-עת, לאחר שהערכת ביניים מצאה שהטיפול המשולב (lapatinib פלוס capecitabine) הביא להארכה מרשימה בפרק הזמן הממוצע עד להתקדמות המחלה (8.4 לעומת 4.4 חודשים), ללא תופעות לוואי משמעותיות או אירועי לב, אם כי נרשמו תגובות של פריחה עורית ושלשולים. גם שיעורי התגובה היו משמעותית גבוהים יותר בטיפול המשולב עם lapatinib, כאשר בזרוע הטיפול המשולב נרשמו במהלך הניסוי המקוצר 49 אירועים, לעומת 72 אירועים בטיפול היחידני ב-capacitabine (שם מותג Xeloda). ניתן לטפל ב-lapatinib גם במשולב עם מעכבי aromatase כגון letrozole (שם מותג Femara) בנשים בגיל המעבר. טיפול של 5 טבליות ליום של lapatinib, יכול לגרום לתופעות לוואי מתונות כשלשולים, פריחה עורית ועייפות, אם כי יש גם דיווחים על מקרים של אירועי אי-ספיקת לב. | ||
| + | |||
| + | תכשיר חד-שבטי נוסף המעכב דימריזציה של הקולטנים של HER2 ו-HER3, הוא pertuzumab (שם מותג Perjeta), שאושר לשימוש על ידי ה-FDA ביוני 2012, בשילוב עם הרצפטין. ניסוי CLEOPPATRA בחן מטופלות עם מחלה מפושטת ו-HER2 חיובי, שקיבלו trastuzumab פלוס docetaxel (קבוצת ביקורת) לעומת מטופלות שקיבלו pertuzumab בתוספת ל-trastuzumab ול-docetaxel. על פי Baselga וחב' במאמרם משנת 2011 ב-NEJM. משך הזמן החציוני ללא התקדמות מחלה היה ארוך יותר בקבוצת pertuzumab. כיום מאושר pertuzumab ומוכלל בסל הבריאות כתרופת קו-ראשון במחלה מפושטת חיובית ל-HER2, בשילוב עם docetaxel ו-trastuzumab. | ||
| + | |||
| + | פרג'טה Perjeta® (Pertuzumab) | ||
| + | |||
| + | פרג'טה היא תרופה ביולוגית התוקפת באופן ממוקד את התאים הממאירים בעלי ביטוי היתר של חלבון HER2. חלבון זה HER2-גורם לשליחת אותות תוך-תאיים המובילים לצמיחת והתרבות התאים הממאירים. אחד המנגנונים לשליחת אותות אלה הוא היצמדות של חלבון זה לחלבונים אחרים מאותה קבוצה, תהליך המכונה "דימריזציה". פרג'טה הינה נוגדן חד-שבטי כנגד חלבון ה-HER2, הפועל במנגנון חדשני שלHER2 dimerization inhibition. פרג'טה נקשרת לחלבון ה-HER2 באתר שונה מזה של הרספטין ומונעת את הצמדות ה-HER2 לחלבוני HER אחרים, וכך מעכבת העברת סיגנלים תוך תאיים הגורמים לשגשוג התאים הממאירים, מעכבת את צמיחתם וגורמת לאפופטוזיס שלהם. | ||
| + | |||
| + | בנוסף, היקשרות פרג'טה לתאי הגידול משפעלת את מערכת החיסון להשמידם באמצעות (ADCC Antibody dependent cell cytotoxicity). מנגנון הפעולה של פרג'טה משלים לזה של הרספטין, והטיפול המשולב של שתי התרופות )הניתנות ביחד עם כמותרפיה( מביא לחסימה מקיפה יותר של פעילות חלבון ה HER2-וכתוצאה מכך לדיכוי יעיל יותר של צמיחת והתפשטות הגידול הסרטני. | ||
| + | |||
| + | יעילות הטיפול בסרטן שד מוקדם: | ||
| + | |||
| + | פרג'טה בשילוב עם הרספטין וכמותרפיה: במחקר הפאזה ה-II NEOSPHERE הושוותה היעילות של פרג'טה בשילוב עם הרספטין וכמותרפיה מסוג טקסוטר, לטיפול סטנדרטי של הרספטין וטקסוטר בקרב 417 חולות סרטן שד מוקדםHER2 חיובי. התוצאות הדגימו שהוספת פרג'טה לטיפול הטרום ניתוחי (נאואדג'ובנטי) המקובל מביאה לשיפור משמעותי בהשגת תגובה פתולוגית מלאה ((pCR - pathologic complete response - 39.3% לעומת 21.5%, כפי שדיווחו Gianni וחב' ב-Lancet Oncol בשנת 2011. | ||
| − | + | במחקר הפאזה ה-II TRYPHAENA הטיפול עם פרג'טה בשילוב עם הרספטין וכמותרפיה שכללה אנטרציקלינים השיג שיעורי pCR גבוהים של 54.6-63.6% (עפ"י Schneeweiss וחב' ב-Annal Oncol משנת 2013). בשני המחקרים, הוספת פרג'טה למִשלב הטיפולי המקובל שיפרה את יעילות הטיפול ללא פגיעה בפרופיל הבטיחות. | |
| − | + | בהנחיות המעודכנות של ה- National Comprehensive Cancer Network לטיפול בסרטן שד, פרג'טה בשילוב עם הרספטין וכמותרפיה מומלצת כאופציה הטיפולית הנאואדג'ובנטית המועדפת בחולות עם סרטן שד HER2 חיובי. | |
| − | + | יעילות הטיפול בסרטן שד גרורתי: | |
| − | + | פרג'טה בשילוב עם הרספטין וכמותרפיה: במחקר הפאזה ה-III CLEOPATRA הושוותה היעילות של פרג'טה בשילוב עם הרספטין וכמותרפיה מסוג טקסוטר, לטיפול סטנדרטי של הרספטין וטקסוטר בקרב 808 חולות סרטן שד גרורתיHER2 חיובי. התוצאות הדגימו שהוספת פרג'טה לטיפול המקובל מביאה לשיפור משמעותי בהישרדות הכוללת של המטופלות (OS), תוך הפחתה של %34 בסיכון לתמותה (HR=0.66, P=0.0008). הוספת פרג'טה האריכה את חיי המטופלות ב-15.7 חודשים עם נתוני OS חציוני של 56.5 חודשים (Kim וחב' בכינוסSABCS בסן-אנטוניו בדצמבר 2012). כמו כן, הוספת פרג'טה דחתה ב-6 חודשים את התקדמות המחלה, מ- 12.4 ל-18.5 חודשים (עפ"י Baselga וחב' ב-N Eng J Med משנת 2012). בקבוצת החולות שטופלו עם פרג'טה אף הודגם שיפור מובהק בשיעור התגובה לטיפול ובאיכות החיים של המטופלות בהשוואה לטיפול המקובל (Baselga וחב' בכינוס ASCO בשיקאגו בשנת 2012).על בסיס נתונים אלו, פרג'טה בשילוב הרספטין וכמותרפיה, כקו טיפולי ראשון במחלה הגרורתית, מהווה את הסטנדרט הטיפולי החדש לחולות HER2 חיובי וכיום הינו המענה הטיפולי הטוב ביותר עבורן. | |
| − | |||
| − | תכשיר אחר trastuzumab emtansine תוצרת Genetech (בארה"ב מכונה ado-trastuzumab emtansine, ושם מותג Kadcyla), הוא למעשה תצמיד (conjugate) המורכב מהרצפטין הקשור לתכשיר הציטוטוקסי mertansune (הידוע גם כ-DM1), החודר לתאים ומשמיד אותם על ידי שהוא נקשר ל-tubulin ומונע חלוקת תאים. כיוון שהרצפטין נקשר ל-HER2 המבוטא-ביתר בתאי סרטן, התצמיד מעביר את החומר הטוקסי באופן ספציפי לתאי סרטן. הכינוי המקוצר של התצמיד הוא T-DM1. בניסוי | + | תכשיר אחר trastuzumab emtansine תוצרת Genetech (בארה"ב מכונה ado-trastuzumab emtansine, ושם מותג Kadcyla), הוא למעשה תצמיד (conjugate) המורכב מהרצפטין הקשור לתכשיר הציטוטוקסי mertansune (הידוע גם כ-DM1), החודר לתאים ומשמיד אותם על ידי שהוא נקשר ל-tubulin ומונע חלוקת תאים. כיוון שהרצפטין נקשר ל-HER2 המבוטא-ביתר בתאי סרטן, התצמיד מעביר את החומר הטוקסי באופן ספציפי לתאי סרטן, תוך צמצום החשיפההסיסטמית של הרקמות הבריאות, וכך מושגת יעילות גבוהה , לצד בטיחות וסבילות טובה ושיפור איכות החיים של המטופלות. הכינוי המקוצר של התצמיד הוא T-DM1. בניסוי הפאזה EMILIA-III, השתתפו 991 נשים עם סרטן שד מתקדם מסוג +HER2, שגילו עמידות לטיפול קודם בהרצפטין ובטקסן. נמצא שתכשיר מצומד זה, האריך את הישרדותן ב-5.8 חודשים (30.9 חודשים לעומת 25.1 חודשים, HR=0.68 ומובהקות של p<0.001), בהשוואה לטיפול משולב ב-lapatinib ו-capecitabine. |
| + | |||
| + | לאחר שנתיים נמצא ש-64.7% מהמטופלות שקיבלו Kadcyla נותרו בחיים, לעומת 51.8% בלבד בקבוצת הביקורת. בנוסף, Kadcyla הביאה להארכת משך הזמן החציוני עד להתקדמות המחלה ב-50%, בהשוואה לקבוצת הביקורת (9.6 חודשים לעומת 6.4 חודשים, HR=0.65 ומובהקות של p<0.0006). בקבוצת החולות שטופלה ב-Kadcyla הודגם שיפור בשיעור התגובה הכללי לטיפול: 43.6% לעומת 30.8%, במובהקות סטטיסטית של p<0.001, וכן הארכת משך התגובה החציוני ב-6.1 חודשים בהשוואה לקבוצת הביקורת, מ-6.5 ל-12.6 חודשים. בהתבסס על תוצאות ניסוי EMILIA III, אישר ה-FDA את השיווק והטיפול עם Kadcyla ב-22 בפברואר 2013, וגופים מקצועיים בינלאומיים ממליצים על תכשיר זה כטיפול קו שני המועדף לחולות סרטן שד גרורתי HER2 חיובי . | ||
תכשיר נוסף, NeuVax, תוצרת Galena Biopharma, מבוסס על אימונותרפיה על ידי פפטיד המכוון את תאי T-killer לפגוע ולהשמיד תאי סרטן המבטאים HER2. תכשיר זה נמצא בשלהי ניסויים קליניים ב-phase III. | תכשיר נוסף, NeuVax, תוצרת Galena Biopharma, מבוסס על אימונותרפיה על ידי פפטיד המכוון את תאי T-killer לפגוע ולהשמיד תאי סרטן המבטאים HER2. תכשיר זה נמצא בשלהי ניסויים קליניים ב-phase III. | ||
| שורה 95: | שורה 114: | ||
===מנגנון פעולת הרצפטין=== | ===מנגנון פעולת הרצפטין=== | ||
| − | הנוגדן החד-שבטי trastuzumab הוא נוגדן רקומביננטי המורכב מ-2 אתרי קישור, הנצמדים באופן סלקטיבי לחלק החוץ-תאי של HER2, ובכך הוא מונע את | + | הנוגדן החד-שבטי trastuzumab הוא נוגדן רקומביננטי המורכב מ-2 אתרי קישור, הנצמדים באופן סלקטיבי לחלק החוץ-תאי של HER2, ובכך הוא מונע את דימריזציה של HER2 ובכך את הפעלת הקולטן. מספר מנגנונים מוצעים דרכם יכול trastuzumab לפעול להפחתת האיתות התוך תאי: |
# Trastuzumab מונע את הביקוע של החלק החוץ-תאי של HER2, האמור להותיר חלבון p95 במצב מזורחן, שמסוגל להפעיל מסלולי איתות תוך-תאיים. התקשרות trastuzumab למקטע של HER2 הסמוך לממברנה גורמת להפחתה של שחרור החלק החוץ-תאי המבוקע של הקולטן, ומקטינה את ההצטברות של השייר p95. | # Trastuzumab מונע את הביקוע של החלק החוץ-תאי של HER2, האמור להותיר חלבון p95 במצב מזורחן, שמסוגל להפעיל מסלולי איתות תוך-תאיים. התקשרות trastuzumab למקטע של HER2 הסמוך לממברנה גורמת להפחתה של שחרור החלק החוץ-תאי המבוקע של הקולטן, ומקטינה את ההצטברות של השייר p95. | ||
# הנוגדן trastuzumab עשוי למנוע פיזית את ההומודימריזציה או ההטרודימריזציה הקריטיים לשפעול הקולטן, ובכך להפחית את האיתות התוך-תאי בו מעורב HER2. | # הנוגדן trastuzumab עשוי למנוע פיזית את ההומודימריזציה או ההטרודימריזציה הקריטיים לשפעול הקולטן, ובכך להפחית את האיתות התוך-תאי בו מעורב HER2. | ||
# trastuzumab מעודד אנדוציטוזה ופירוק של הקולטנים של HER2, ובכך מסוגל להפחית את כמות HER2 הבאה לביטוי על פני ממברנת התאים הסרטניים. | # trastuzumab מעודד אנדוציטוזה ופירוק של הקולטנים של HER2, ובכך מסוגל להפחית את כמות HER2 הבאה לביטוי על פני ממברנת התאים הסרטניים. | ||
| − | # תאי מערכת החיסון האדפטיבית יכולים להיות מגויסים על ידי חשיפתם למקטע Fc של הנוגדן trastuzumab, באופן בו לימפוציטים מסוג T המזהים את מקטע ה-Fc יופעלו, ויפרישו חומרים טוקסיים שיגרמו לפגיעה בתאים הסרטניים המבטאים ביתר את HER2. | + | # תאי מערכת החיסון האדפטיבית יכולים להיות מגויסים על ידי חשיפתם למקטע Fc של הנוגדן trastuzumab, באופן בו לימפוציטים מסוג T המזהים את מקטע ה-Fc יופעלו, ויפרישו חומרים טוקסיים שיגרמו לפגיעה בתאים הסרטניים המבטאים ביתר את HER2. |
| + | # הרצפטין משפיע במידה מועטה על אנגיגנזה-מפחית קוטר כלי-דם קיימים ומפחית יצירת כלי-דם חדשים. | ||
===יחסי הגומלין בין HER2 לבין הקולטנים להורמונים=== | ===יחסי הגומלין בין HER2 לבין הקולטנים להורמונים=== | ||
| − | גידולי סרטן השד המכילים כמות גדולה של קולטנים לאסטרוגן (ER) או לפרוגסטרון (PR) הם בדרך כלל פחות אלימים ומגיבים היטב לטיפול הורמונאלי. כ-70% מתאי סרטן השד מכילים קולטנים אלה. תאים שהם חיוביים ל-HER2 מכילים בדרך כלל פחות קולטנים של הורמונים, אך חלקם מגיבים אף על פי כן לטיפול הורמונאלי כגון טיפול בטמוקסיפן, ב-letrozole, ב-anastrozole (שם מותג Arimidex) או ב-exemestane (שם מותג | + | גידולי סרטן השד המכילים כמות גדולה של קולטנים לאסטרוגן (ER) או לפרוגסטרון (PR) הם בדרך כלל פחות אלימים ומגיבים היטב לטיפול הורמונאלי. כ-70% מתאי סרטן השד מכילים קולטנים אלה. תאים שהם חיוביים ל-HER2 מכילים בדרך כלל פחות קולטנים של הורמונים, אך חלקם מגיבים אף על פי כן לטיפול הורמונאלי כגון טיפול בטמוקסיפן, ב-letrozole, ב-anastrozole (שם מותג Arimidex) או ב-exemestane (שם מותג Aromasin). |
דווח על כך שמטופלות שתאי סרטן השד שלהן מכילים קולטנים לאסטרוגן והם גם חיוביים ל-HER2, מגיבות טוב יותר לתכשירים המעכבים של המסלול התוך תאי של PI3K/AKt, בהשוואה לאלו שתאי סרטן השד שלהן אינם מכילים קולטנים לאסטרוגן אך הם חיוביים ל-HER2. | דווח על כך שמטופלות שתאי סרטן השד שלהן מכילים קולטנים לאסטרוגן והם גם חיוביים ל-HER2, מגיבות טוב יותר לתכשירים המעכבים של המסלול התוך תאי של PI3K/AKt, בהשוואה לאלו שתאי סרטן השד שלהן אינם מכילים קולטנים לאסטרוגן אך הם חיוביים ל-HER2. | ||
| שורה 113: | שורה 133: | ||
כ-75% מכלל סרטני השד הם +ER. הם משגשגים בתגובה לאסטרוגן הנקשר אליהם, ומתוך אלה כ-65% הם גם +PR, דהינו גם פרוגסטרון נקשר אליהם, ובהתאם משגשגים בהיקשר אליהם פרוגסטרון. תאי סרטן שד שהם +ER/PR, הם בעלי סיכוי של 60% להגיב לתרפיה אנדוקרינית. לעומתם, תאי סרטן השד שהם שליליים לשני הורמונים אלה, הם בעלי סיכוי של 5-10% להגיב לתרפיה זו. טיפול אנדוקריני בסרטן השד ניתן בדרך כלל לאחר הניתוח להסרת הגידול, או לאחר הטיפולים הנלווים הכימותרפי או ההקרנה הסתיימו, ותפקידו לסייע במניעת חזרת המחלה, על ידי חסימה של השפעת האסטרוגנים.Tamoxifen - היא התרופה האנטי-סרטנית הממוקדת הראשונה הפועלת כאנטגוניסט של הרצפטור לאסטרוגן, ועשויה לעכב התפתחות של סרטן שד המבטא רצפטורים לאסטרוגן, בנשים עם סיכון גבוה. | כ-75% מכלל סרטני השד הם +ER. הם משגשגים בתגובה לאסטרוגן הנקשר אליהם, ומתוך אלה כ-65% הם גם +PR, דהינו גם פרוגסטרון נקשר אליהם, ובהתאם משגשגים בהיקשר אליהם פרוגסטרון. תאי סרטן שד שהם +ER/PR, הם בעלי סיכוי של 60% להגיב לתרפיה אנדוקרינית. לעומתם, תאי סרטן השד שהם שליליים לשני הורמונים אלה, הם בעלי סיכוי של 5-10% להגיב לתרפיה זו. טיפול אנדוקריני בסרטן השד ניתן בדרך כלל לאחר הניתוח להסרת הגידול, או לאחר הטיפולים הנלווים הכימותרפי או ההקרנה הסתיימו, ותפקידו לסייע במניעת חזרת המחלה, על ידי חסימה של השפעת האסטרוגנים.Tamoxifen - היא התרופה האנטי-סרטנית הממוקדת הראשונה הפועלת כאנטגוניסט של הרצפטור לאסטרוגן, ועשויה לעכב התפתחות של סרטן שד המבטא רצפטורים לאסטרוגן, בנשים עם סיכון גבוה. | ||
| − | טמוקסיפן ניתן כטיפול בחלק מהנשים לפרק זמן של עד 5 שנים, מתחילת הטיפול בסרטן השד. תכשירים ממשפחת מעכבי האנזים aromatase, | + | טמוקסיפן ניתן כטיפול בחלק מהנשים לפרק זמן של עד 5 שנים, מתחילת הטיפול בסרטן השד. תכשירים ממשפחת מעכבי האנזים aromatase, גורמים להפסקת הסינתזה של אסטרוגן בנשים בגיל המעבר, אך אינם מורשים לנשים בגיל הפוריות. סרטן שד Triple negative, מופיע ב-20-25% מכלל המקרים 1, מגיב בדרך כלל היטב לטיפול כימותרפי, אך זהו סרטן השד האלים ביותר, עם הפרוגנוזה הגרועה ביותר בהשוואה לסוגי סרטן השד האחרים. |
===טיפול אנטי-סרטני מכוון=== | ===טיפול אנטי-סרטני מכוון=== | ||
| − | כאשר סרטן שד מתגלה, למרות טיפולים כגון ניתוח להסרת הגידול, כימותרפיה והקרנות, קיים סיכון לחזרתו של הגידול, כאשר ב-50% מקרי חזרת המחלה יתרחשו במהלך 5 השנים הראשונות לאחר ההחלמה, ואף בשנים שלאחר מכן קיים עדיין סיכון לחזרת המחלה ב-2-5% מדי שנה. סיכון זה קשור | + | כאשר סרטן שד מתגלה, למרות טיפולים כגון ניתוח להסרת הגידול, כימותרפיה והקרנות, קיים סיכון לחזרתו של הגידול, כאשר ב-50% מקרי חזרת המחלה יתרחשו במהלך 5 השנים הראשונות לאחר ההחלמה, ואף בשנים שלאחר מכן קיים עדיין סיכון לחזרת המחלה ב-2-5% מדי שנה. סיכון זה קשור בין היתר למאפיינים ביולוגיים של סרטן השד, כגון מציאות קולטנים להורמונים כאסטרוגן ופרוגסטרון, דרגת ההתמיינות של תאי הגידול, וקולטנים מסוג HER2. |
העיקרון העומד מאחורי טיפולים סרטניים ממוקדים הוא השימוש בחומרים בעלי פעולה ספציפית ובלעדית לתאים הסרטניים. טיפולים אלה מנצלים תופעה ביולוגית אופיינית לתאי הגידול, ויכולה לכן להוות מטרה לטיפול שהוא סלקטיבי לתאי הגידול, ללא פגיעה משמעותית ברקמה הבריאה. | העיקרון העומד מאחורי טיפולים סרטניים ממוקדים הוא השימוש בחומרים בעלי פעולה ספציפית ובלעדית לתאים הסרטניים. טיפולים אלה מנצלים תופעה ביולוגית אופיינית לתאי הגידול, ויכולה לכן להוות מטרה לטיפול שהוא סלקטיבי לתאי הגידול, ללא פגיעה משמעותית ברקמה הבריאה. | ||
השיטה לחלוקת תאי סרטן שד על פי תכנות ביולוגיות היא היתר לסווג אותם על פי הקולטנים שעל פניהם: | השיטה לחלוקת תאי סרטן שד על פי תכנות ביולוגיות היא היתר לסווג אותם על פי הקולטנים שעל פניהם: | ||
| − | # נוכחות של קולטנים לאסטרוגנים או לפרוגסטרון (ER/PR positive); | + | # נוכחות מוגברת של קולטנים לאסטרוגנים או לפרוגסטרון (ER/PR positive); |
# HER2 positive; | # HER2 positive; | ||
# Triple negative, דהינו חסר של קולטנים לאסטרוגן, לפרוגסטרון ול-HER2; | # Triple negative, דהינו חסר של קולטנים לאסטרוגן, לפרוגסטרון ול-HER2; | ||
| − | # Triple positive, כאשר קולטנים לאסטרוגן, פרוגסטרון ו-HER2 מצויים. | + | # Triple positive, כאשר קולטנים לאסטרוגן, פרוגסטרון ו-HER2 מצויים ביתר. |
===טיפולים בהרצפטין=== | ===טיפולים בהרצפטין=== | ||
| − | בנשים עם ביטוי-יתר של HER2, שמחלתן גרורתית, הביא הטיפול בהרצפטין למפנה משמעותי בהתקדמות המחלה, וממילא האריך את תוחלת חייהן. כבר בשנת 2001 קבע Slamon במאמר ב-N Eng J Med, שהרצפטין במשולב עם כימותרפיה יעיל בשיפור מדדים קליניים של נשים עם סרטן שד גרורתי, | + | בנשים עם ביטוי-יתר של HER2, שמחלתן גרורתית, הביא הטיפול בהרצפטין למפנה משמעותי בהתקדמות בהתמודדות עם המחלה, וממילא האריך את תוחלת חייהן. כבר בשנת 2001 קבע Slamon במאמר ב-N Eng J Med, שהרצפטין במשולב עם כימותרפיה יעיל בשיפור מדדים קליניים של נשים עם סרטן שד גרורתי, מעבר להארכת חיים, שיפור שיעורי התגובה ומשך הזמן ללא התקדמות המחלה. אותו חוקר אישש ממצא זה במאמר משנת 2004 ב-J Natl Cancer Inst. בשנת 2010 התפרסמו ב-J Clin Oncol תוצאות מחקר HERCULES על ידי Untch וחב', בו נמצא שטיפול משולב של הרצפטין עם כימותרפיה (epirubicine וציקלופוספאמיד) האריך את פרק הזמן שעבר עד התקדמות המחלה. ב-2005 התפרסם בכתב העת האחרון מחקר M77001, על ידי Marty וחב', בו נמצא שתוספת הרצפטין לטיפול ב-docetaxel, האריך את משך הישרדות ואת משך הזמן ללא התקדמות המחלה, כאשר שילוב של מתן סימולטאני של 2 תרופות אלו בניסוי HERTAX שדווח על ידי Hamberg וחב' ב-2011 ב-Clin Breast Cancer, נמצא יעיל יותר בהארכת הזמן הנדרש להתקדמות המחלה, בהשוואה למתן קודם של הרצפטין כאשר רק אחריו ניתן טיפול ב-docetaxel. |
| − | באוקטובר 2005 התפרסמו צמודים זה לזה ב-N Eng J Med שני מחקרים רחבי-היקף שדנו במשמעות הטיפול בהרצפטין בנשים עם סרטן שד המבטא HER2. המאמר הראשון מבין השניים של Piccart-Gebhart ואחרים, | + | באוקטובר 2005 התפרסמו צמודים זה לזה ב-N Eng J Med שני מחקרים רחבי-היקף שדנו במשמעות הטיפול בהרצפטין בנשים עם סרטן שד המבטא HER2. המאמר הראשון מבין השניים של Piccart-Gebhart ואחרים, בו תואר מחקר HERA שהיה מחקר אקראי בינלאומי ורב-מוסדי, שהִשווה תוצאות טיפול אחת ל-3 שבועות ב-trastuzumab למשך שנה, שניתן לנשים עם סרטן שד חיובי ל-HER2, עם או בלי מעורבות קשרי לימפה, שכבר עברו ניתוח להסרת הגידול ולפחות 4 מחזורי טיפול כימותרפי. |
| − | בניסוי זה, 1,694 נשים יועדו לטיפול בן שנתיים בהרצפטין, 1,694 נשים יועדו לטיפול של שנה אחת בתרופה, וקבוצת ביקורת כללה 1,693 נשים שלא טופלו. במאמר זה דווחו רק תוצאות הטיפול עם trastuzumab בהשוואה לקבוצת הביקורת הבלתי מטופלת: בפרק זמן של שנה אובחנו 347 אירועים (הישנות המחלה, הופעת מחלה בשד | + | בניסוי זה, 1,694 נשים יועדו לטיפול בן שנתיים בהרצפטין, 1,694 נשים יועדו לטיפול של שנה אחת בתרופה, וקבוצת ביקורת כללה 1,693 נשים שלא טופלו. במאמר זה דווחו רק תוצאות הטיפול עם trastuzumab למשך שנה, בהשוואה לקבוצת הביקורת הבלתי מטופלת: בפרק זמן של שנה אובחנו 347 אירועים (הישנות המחלה, הופעת מחלה בשד הנגדי, מחלה סרטנית ממאירה שנייה שלא ממקור שד, או מוות). מתוך אירועים אלה, 127 אירועים התרחשו בקבוצת המטופלות ב-trastuzumab, לעומת 220 אירועים בקבוצת הביקורת. יחס הסיכון (HR) הבלתי מתואם לאירוע בקבוצת המטופלות בתרופה היה 0.54בהשוואה לקבוצת הבלתי מטופלות (0.0001p<) מה שמבטא יתרון בולט במושגים של תקופת הישרדות ללא-מחלה. למרות שבקבוצת המטופלות ב-trastuzumabנרשמו בתום שנה אחת 29 מקרי מוות, לעומת 37 פטירות בקבוצת הביקורת, לא השיג הפרש זה בפטירות משמעות סטטיסטית. רק ב-0.5% מבין הנשים המטופלות עם trastuzumab, נמצאה השפעה טוקסית משמעותית ללב. יש להוסיף שרק במשך מעקב חציוני של שנה (One year mFU)לא נצפה הבדל סטטיסטי מובהק בהישרדות הכוללת, אך במשך מעקב חציוני של שנתיים, ההבדל היה מובהק סטטיסטית. |
| − | מאמר שני באותו כתב עת של Romond ואחרים, דווח במרוכז על תוצאות 2 ניסויים שנערכו בארה"ב בהשתתפות של כ-3,000 נשים, שהִשוו תוצאות טיפולים כימותרפיים עם או ללא שילוב של trastuzumab, בנשים עם סרטן שד לאחר ניתוח להרחקתו, ותאי סרטן חיוביים ל-HER2. בניסוי הראשון (The National Surgical Adjuvant Breast and Bowel Project trial, B-31) הִשוו טיפולים ב-doxorubicine וציקלופוספאמיד מלווה עם טיפול ב-paclitaxel אחת ל-3 שבועות, לטיפול זהה בכימותרפיה בתוספת 52 שבועות של טיפול ב-trastuzumab. בניסוי השני ( The North Central Cancer Treatment Group trial N9831) הִשוו 3 סוגי טיפול: קבוצת אחת טופלה ב-doxorubicine וציקלופוספאמיד, מלווה ב-paclitaxel אחת ל-3 שבועות, קבוצה שנייה טופלה באותו תפריט כימותרפי בתוספת 52 שבועות של trastuzumab שהחל לאחר הטיפול ב-paclitaxel, וקבוצה שלישית עם פירוט תכשירים זהה לזה שניתן בקבוצה השנייה, אלא שכאן הטיפול ב-trastuzumab ניתן ביחד עם הטיפול ב-paclitaxel. | + | מאמר שני באותו כתב עת של Romond ואחרים, דווח במרוכז על תוצאות 2 ניסויים שנערכו בארה"ב בהשתתפות של כ-3,000 נשים, שהִשוו תוצאות טיפולים כימותרפיים עם או ללא שילוב של trastuzumab, בנשים עם סרטן שד לאחר ניתוח להרחקתו, ותאי סרטן חיוביים ל-HER2. בניסוי הראשון (The National Surgical Adjuvant Breast and Bowel Project trial, B-31) הִשוו טיפולים ב-doxorubicine וציקלופוספאמיד מלווה עם טיפול ב-paclitaxel אחת ל-3 שבועות, לטיפול זהה בכימותרפיה בתוספת 52 שבועות של טיפול ב-trastuzumab. בניסוי השני ( The North Central Cancer Treatment Group trial N9831) הִשוו 3 סוגי טיפול: קבוצת אחת טופלה ב-doxorubicine וציקלופוספאמיד, מלווה ב-paclitaxel אחת ל-3 שבועות, קבוצה שנייה טופלה באותו תפריט כימותרפי בתוספת 52 שבועות של trastuzumab שהחל לאחר הטיפול ב-paclitaxel, וקבוצה שלישית עם פירוט תכשירים זהה לזה שניתן בקבוצה השנייה, אלא שכאן הטיפול ב-trastuzumab ניתן ביחד עם הטיפול ב-paclitaxel. ממחקר זה נלמד שעדיף ככל הנראה לטפל בהרצפטין סימולטאנית עם הכימותרפיה ולא לאחריה. |
| − | + | בתאריך 15 במרץ 2005 כבר נרשמו במהלך הניסויים 394 אירועים (הישנות המחלה, הופעת גידול שד ראשוני במיקום אחר, או מוות לפני הישנות המחלה), מה שהביא להערכת ביניים של הממצאים. מבין האירועים הללו, 133 נרשמו בקבוצת ה-trastuzumab, ואילו 261 אירועים נרשמו בקבוצת הביקורת, עם יחס סיכון בקבוצת trastuzumab של 0.48 עם p<0.0001, דהינו הפחתה של 52% בהישנות המחלה. ההבדל המוחלט בהישרדות ללא-מחלה בין קבוצת הטיפולים ב-trastuzumab פלוס כימותרפיה, בהשוואה לקבוצת הכימותרפיה בלבד, היה של 12% מקץ 3 שנים. תוספת trastuzumab לכימותרפיה, מאפשרת הפחתה של 33% בסיכון למוות (p=0.015), ואילו ההתרחשות של אירועי אי-ספיקת לב (class III or IV) או מוות מסיבה לבבית, הייתה של 4.1% בניסוי B-31, ו-2.9% בניסוי N9831. | |
| − | ניסוי נוסף (BCIRG 006) שתוצאותיו דווחו על ידי Slamon ב-2011 ב-N Eng J Med, הראה שטיפול משך 52 שבועות ב-trastuzumab בשילוב עם כימותרפיה, נמצא יעיל בהארכת פרק הזמן | + | ניסוי נוסף (BCIRG 006) שתוצאותיו דווחו על ידי Slamon ב-2011 ב-N Eng J Med, הראה שטיפול משך 52 שבועות ב-trastuzumab בשילוב עם כימותרפיה, נמצא יעיל בהארכת פרק הזמן ללא מחלה וכן בהארכת ההישרדות בכלל במטופלות עם שלבי מחלה מוקדמים ותאי סרטן שד חיוביים ל-HER2. תוצאה זו התקבלה כאשר הכימותרפיה התבססה הן על anthracyline או על טיפול לא-אנטרציקליני. |
===ניסוי HERA=== | ===ניסוי HERA=== | ||
| שורה 144: | שורה 164: | ||
בשנת 2012 התפרסמו ב-Lancet Oncology על ידי Gianni ואחרים ממצאי ניסוי HERA או HERceptin Adjuvant, שבחן יעילות של טיפולים כימיים והקרנות לאחר ניתוח, עם וללא טיפול המשך בהרצפטין, למשך שנה או שנתיים, בנשים עם שלבים מוקדמים של המחלה, ותאים חיוביים ל-HER2. ניסוי זה נועד למעקב של 4 שנים. ניסוי HERA נחשב לניסוי רחב ההיקף בתחום סרטן השד בעולם, ניסוי Phase III בינלאומי שהקיף 39 מדינות, רב-מוסדי (480 מרכזים רפואיים כולל 16 מרכזים בישראל), וכלל 5,102 נשים חולקו באופן אקראי ל-3 קבוצות בגודל שווה כאשר קבוצה אחת טופלה שנתיים באופן יחידני בהרצפטין, קבוצה שנייה טופלה שנה אחת באופן יחידני בהרצפטין, וקבוצה שלישית לא טופלה בתרופה. הטיפול ניתן בעירוי תוך-ורידי אחת ל-3 שבועות. כל משתתפות הניסוי אובחנו עם סרטן שד בשלב מוקדם, חיובי ל-HER2, שכבר טופלו בכימותרפיה והקרנות, והיו לפני או אחרי ניתוח להרחקת הגידול. ניסוי HERA לא הגביל את סוג הטיפולים הכימותרפיים, וגויסו אליו נשים עם ממצאים חיוביים או שליליים בבלוטות הלימפה. | בשנת 2012 התפרסמו ב-Lancet Oncology על ידי Gianni ואחרים ממצאי ניסוי HERA או HERceptin Adjuvant, שבחן יעילות של טיפולים כימיים והקרנות לאחר ניתוח, עם וללא טיפול המשך בהרצפטין, למשך שנה או שנתיים, בנשים עם שלבים מוקדמים של המחלה, ותאים חיוביים ל-HER2. ניסוי זה נועד למעקב של 4 שנים. ניסוי HERA נחשב לניסוי רחב ההיקף בתחום סרטן השד בעולם, ניסוי Phase III בינלאומי שהקיף 39 מדינות, רב-מוסדי (480 מרכזים רפואיים כולל 16 מרכזים בישראל), וכלל 5,102 נשים חולקו באופן אקראי ל-3 קבוצות בגודל שווה כאשר קבוצה אחת טופלה שנתיים באופן יחידני בהרצפטין, קבוצה שנייה טופלה שנה אחת באופן יחידני בהרצפטין, וקבוצה שלישית לא טופלה בתרופה. הטיפול ניתן בעירוי תוך-ורידי אחת ל-3 שבועות. כל משתתפות הניסוי אובחנו עם סרטן שד בשלב מוקדם, חיובי ל-HER2, שכבר טופלו בכימותרפיה והקרנות, והיו לפני או אחרי ניתוח להרחקת הגידול. ניסוי HERA לא הגביל את סוג הטיפולים הכימותרפיים, וגויסו אליו נשים עם ממצאים חיוביים או שליליים בבלוטות הלימפה. | ||
| − | נקודות יעד (endpoints) של מבחן HERA כללו את משך זמן ההישרדות הכולל (overall survival), את משך הזמן של חיים ללא מחלה חוזרת (relapse-free survival), ופרק הזמן ללא הופעת מחלה | + | נקודות יעד (endpoints) של מבחן HERA כללו את משך זמן ההישרדות הכולל (overall survival), את משך הזמן של חיים ללא מחלה חוזרת (relapse-free survival), ופרק הזמן ללא הופעת מחלה מרוחקת מהשד (distant disease free survival) ופרק הזמן שחלף עד להישנות המחלה (disease recurrence). כמו כן נבחן הפרופיל הבטיחותי של הטיפול בהרצפטין. |
====הפרופיל הבטיחותי בניסוי HERA==== | ====הפרופיל הבטיחותי בניסוי HERA==== | ||
| שורה 152: | שורה 172: | ||
====תוצאות ניסוי HERA==== | ====תוצאות ניסוי HERA==== | ||
| − | מסתבר שטיפול בהרצפטין למשך שנה נותר הטיפול המומלץ לנשים עם מחלה מוקדמת חיוביות ל-HER2. תוצאות המחקר גם מצביעות על כך, שלאחר תקופת מעקב חציונית של 8 שנים, השיפור בתקופת ההישרדות ללא מחלה, כמו גם משך ההישרדות הכללי בנשים שטופלו בהרצפטין היה ארוך משמעותית | + | בבחינת משכי הטיפול שנבחנו, מסתבר שטיפול בהרצפטין למשך שנה נותר הטיפול המומלץ לנשים עם מחלה מוקדמת חיוביות ל-HER2. תוצאות המחקר גם מצביעות על כך, שלאחר תקופת מעקב חציונית של 8 שנים, השיפור בתקופת ההישרדות ללא מחלה, כמו גם משך ההישרדות הכללי בנשים שטופלו בהרצפטין היה ארוך משמעותית בשני פרקי-זמן אלה בנשים חולות עם מאפייני מחלה דומים, אך ללא טיפול בהרצפטין. |
בקטגוריה של משך זמן ללא מחלה נרשמה ירידה של 24% למחלה חוזרת במטופלות בהרצפטין למשך שנה אחת, בהשוואה ללא-מטופלות (p<0.0001). לא היה כל הבדל בקריטריון זה בין טיפול בהרצפטין למשך שנה אחת או למשך שנתיים (HR=0.99; p=0.86). בקטגוריה של משך תקופת ההישרדות הכללי, נמצאה גם כן ירידה בסיכון לתמותה של 24% בקבוצת המטופלות בהרצפטין משך שנה אחת, בהשוואה לקבוצת הביקורת של לא-מטופלות בתרופה זו (p<0.0005). לא היה הבדל סטטיסטי משמעותי בקריטריון זה בין המטופלות בהרצפטין למשך שנה, לבין מטופלות בתרופה זו משך שנתיים (HR=1.05; p=0.63). | בקטגוריה של משך זמן ללא מחלה נרשמה ירידה של 24% למחלה חוזרת במטופלות בהרצפטין למשך שנה אחת, בהשוואה ללא-מטופלות (p<0.0001). לא היה כל הבדל בקריטריון זה בין טיפול בהרצפטין למשך שנה אחת או למשך שנתיים (HR=0.99; p=0.86). בקטגוריה של משך תקופת ההישרדות הכללי, נמצאה גם כן ירידה בסיכון לתמותה של 24% בקבוצת המטופלות בהרצפטין משך שנה אחת, בהשוואה לקבוצת הביקורת של לא-מטופלות בתרופה זו (p<0.0005). לא היה הבדל סטטיסטי משמעותי בקריטריון זה בין המטופלות בהרצפטין למשך שנה, לבין מטופלות בתרופה זו משך שנתיים (HR=1.05; p=0.63). | ||
| − | יצוין, ששנה מתחילת ניסוי HERA וקבלת הממצאים הראשונה, ביקשו כ-50% מהנשים המשתתפות בניסוי, שנכללו במקור בקבוצת הביקורת הבלתי מטופלת בהרצפטין, "לחצות את הקווים" | + | יצוין, ששנה מתחילת ניסוי HERA וקבלת הממצאים הראשונה, ביקשו כ-50% מהנשים המשתתפות בניסוי, שנכללו במקור בקבוצת הביקורת הבלתי מטופלת בהרצפטין, "לחצות את הקווים" ולאפשר קבלת טיפול של שנה בהרצפטין. גם לגבי נשים אלה, בהן הוחל הטיפול באיחור של שנה, נמצאו משכי הישרדות משופרים. |
| − | ממצאי ביניים של ניסוי HERA דווחו באופן מקורי כבר ב-2005, כאשר נקבע בניתוח ביניים של התוצאות שהטיפול בהרצפטין תאם את נקודת הציון העיקרית שלו בהארכת פרק הזמן | + | ממצאי ביניים של ניסוי HERA דווחו באופן מקורי כבר ב-2005, כאשר נקבע בניתוח ביניים של התוצאות שהטיפול בהרצפטין תאם את נקודת הציון העיקרית שלו בהארכת פרק הזמן ללא ממחלה (HR=0.54; p<0.0001) בנשים מטופלות משך שנה בהשוואה לקבוצת הביקורת של לא-מטופלות. בהתבסס על נתוני ניסוי HERA וכן שלושת הניסויים האחרים שהוזכרו, NSABP B-31, וכן NCCTG N9831 ו-BCIRG 006, בהם נכללו במקובץ למעלה מ-13,000 נשים, אושר טיפול בן שנה אחת בהרצפטין על ידי גופים רפואיים מובילים, לנשים עם סרטן שד חיובי ל-HER2, בשלביו המוקדמים. |
| − | בתאריך 1 באוקטובר 2012 פרסמו בבאזל חברת ROCHE ו-BIG או Breast International Group, מסמך לסיכום ניסוי HERA. הדגש לגבי מסקנות ניסוי HERA הוא בקביעה שטיפול בהרצפטין למשך שנה הוא פרק הזמן האופטימאלי לטיפול בתרופה זו, וכמובן הסיכוי הממשי להארכת חיי המטופלות, זאת על פי Hal Baron, המנהל הרפואי של ROCHE. גם Martine Piccart, היו"רית של BIG, והנשיאה של הארגון האירופי לטיפול בסרטן (EORTC), מדגישה במסמך זה את החיוניות שבקביעת משך הטיפול האופטימאלי בהרצפטין. | + | בתאריך 1 באוקטובר 2012 פרסמו בבאזל חברת ROCHE ו-BIG או Breast International Group, מסמך לסיכום ניסוי HERA. הדגש לגבי מסקנות ניסוי HERA הוא בקביעה שטיפול בהרצפטין למשך שנה הוא פרק הזמן האופטימאלי לטיפול בתרופה זו, וכמובן הסיכוי הממשי להארכת חיי המטופלות, זאת על פי Hal Baron, המנהל הרפואי של ROCHE. גם Martine Piccart, היו"רית של BIG, והנשיאה של הארגון האירופי לטיפול בסרטן (EORTC), מדגישה במסמך זה את החיוניות שבקביעת משך הטיפול האופטימאלי בהרצפטין. ניסויים לבחינת משך טיפול קצר יותר כגון PHARE או FINHER או HORG לא הצליחו להוכיח יתרון או non-inferiority מול טיפול של שנה. |
===ניסויים קליניים מאוחרים עם הרצפטין=== | ===ניסויים קליניים מאוחרים עם הרצפטין=== | ||
| שורה 168: | שורה 188: | ||
בתת הקבוצה של מטופלות עם הרצפטין, נמצא שיפור משמעותי לגבי מדד DDFS או distant disease–free survival, ולא פחות משמעותי הממצא שהמטופלות בהרצפטין לא הביא לשינוי במקטע הפליטה של החדר השמאלי לאחר תקופת מעקב של 5 שנים, כאשר רק מטופלת אחת עם הרצפטין אכן אובחנה עם אי ספיקת לב. | בתת הקבוצה של מטופלות עם הרצפטין, נמצא שיפור משמעותי לגבי מדד DDFS או distant disease–free survival, ולא פחות משמעותי הממצא שהמטופלות בהרצפטין לא הביא לשינוי במקטע הפליטה של החדר השמאלי לאחר תקופת מעקב של 5 שנים, כאשר רק מטופלת אחת עם הרצפטין אכן אובחנה עם אי ספיקת לב. | ||
| − | בשנת 2011 התפרסמו ב-J Clin Oncol על ידי Andersson וחב' ממצאי ניסוי HERNATA, שגם הם מצביעים על כך שטיפול משולב של הרצפטין עם | + | בשנת 2011 התפרסמו ב-J Clin Oncol על ידי Andersson וחב' ממצאי ניסוי HERNATA, שגם הם מצביעים על כך שטיפול משולב של הרצפטין עם vinoralbine או עם docetaxel כטיפול קו-ראשון במחלה גרורתית חיובית ל-HER2 משפר את משך ההישרדות הכולל, ואת פרק הזמן החציוני הנדרש להתקדמות המחלה. באותו כתב-עת פרסמו Valero וחב' בשנת 2011, את ממצאי ניסוי BCIRG 007, בו נמצא שטיפולים משולבים של הרצפטין עם docetaxel, או הרצפטין עם docetaxel פלוס carboplatin, יעילים מאוד בהארכת משך הזמן להתקדמות המחלה, כמו גם זמן ההישרדות הכללי, וכן קבילים מבחינה בטיחותית. יצוין, ש-Vogel וחב' פרסמו באותו כתב עת כבר ב-2002 שהרצפטין בעצמו יעיל כטיפול קו-ראשון במחלה מפושטת חיובית ל-HER2. |
===טיפול בהרצפטין בשילוב עם טיפול הורמונאלי=== | ===טיפול בהרצפטין בשילוב עם טיפול הורמונאלי=== | ||
| שורה 179: | שורה 199: | ||
===טיפול מקדים עם הרצפטין כ-neoadjuvant=== | ===טיפול מקדים עם הרצפטין כ-neoadjuvant=== | ||
| + | הטיפול ב[[הרצפטין]] כתוספת לטיפול כימותרפי מקובל נמצא יעיל גם בשלב הקדם-ניתוחי במדד pCR של היעלמות המחלה . מעקב אחר תוצאות של ניסוי GeparQuattro, מצא שתגובה קלינית טובה יותר לעומת [[לפטיניב]] (מחקר ג'אפר קווינטו) הושגה כאשר [[trastuzumab]] הוסף לכימותרפיה במסגרת טיפול נאו-אג'ובנטי הן כאשר כימותרפיה הייתה על בסיס אנתרציקלינים או שהייתה על בסיס taxane, על פי Untch וחב' במאמרם משנת 2010 ב-J Clin Oncol. ממצא זה אושש במחקרים נוספים בהם הושגה הפוגה ממושכת יותר בטיפול נאו-אג'ובנטי עם הרצפטין. מחקרים אלה כוללים את הניסוי של Buzdar וחב' שפורסם ב-2005 ב-J Clin Oncol, בו השתתפו 164 נשים עם סרטן שד הניתן לניתוח מסוג +HER2, אשר חולקו ל-2 קבוצות: קבוצה אחת טופלה קדם-ניתוחית עם [[paclitaxel]] ו-[[epirubicin]], כאשר הקבוצה השנייה טופלה אחת לשבוע תוספת של trastuzumab למשך 24 שבועות, לטיפול הכימותרפי הקדם-ניתוחי. | ||
| − | + | במהלך הניסוי נבחנו תוצאות הביניים של המטופלות, ונמצאה נסיגה פתולוגית מלאה בשיעור של 25% בקרב המטופלות טיפול כימותרפי בלבד, לעומת נסיגה דומה במהלך המחלה בקבוצת המטופלות עם תוספת של trastuzumab לטיפול הכימותרפי. ממצאי ביניים אלה, הביאו להחלטה להפסיק את הניסוי במתכונת המקורית, ולטפל בכל המשתתפות בו על פי הפרוטוקול הכולל תוספת trastuzumab. תוצאות דומות התקבלו בניסוי של Limentani וחב' שהופיע ב-2007 ב-J Clin Oncol, לגבי שילוב נאו-אג'ובנטי של [[docetaxel]] ו-[[vinorelbin]] להם הוסף trastuzumab טרם הניתוח, וכן בניסוי רב-מוסדי של Pierga וחב' שהופיע בשנת 2010 ב-Breast Cancer Res Treatment, בו טופלו נשים עם סרטן שד מקומי-מתקדם באופן ראשוני על ידי שילובים של epirubicin/cyclophosphamide מלווים בטיפול ב-docetaxel עם או ללא celecoxib ו-trastuzumab. | |
| − | |||
| − | במהלך הניסוי נבחנו תוצאות הביניים של המטופלות, ונמצאה נסיגה פתולוגית מלאה בשיעור של 25% בקרב המטופלות טיפול כימותרפי בלבד, לעומת נסיגה דומה במהלך המחלה בקבוצת המטופלות עם תוספת של trastuzumab לטיפול הכימותרפי. ממצאי ביניים אלה, הביאו להחלטה להפסיק את הניסוי במתכונת המקורית, ולטפל בכל המשתתפות בו על פי הפרוטוקול הכולל תוספת trastuzumab. תוצאות דומות התקבלו בניסוי של Limentani וחב' שהופיע ב-2007 ב-J Clin Oncol, לגבי שילוב נאו-אג'ובנטי של docetaxel ו-vinorelbin להם הוסף trastuzumab טרם הניתוח, וכן בניסוי רב-מוסדי של Pierga וחב' שהופיע בשנת 2010 ב-Breast Cancer Res Treatment, בו טופלו נשים עם סרטן שד מקומי- | ||
| − | גם ניסוי NOAH שתוצאותיו דווחו על ידי Gianni וחב' ב-Lancet בשנת 2010, בחן את השפעת הוספה של trastuzumab לכימותרפיה כ-neoadjuvant, שנמצאה יעילה בהארכת פרק הזמן של הישרדות ללא-אירועים במקרים של סרטן שד גרורתי-מקומי, חיובי ל-HER2. | + | גם ניסוי NOAH שתוצאותיו דווחו על ידי Gianni וחב' ב-Lancet בשנת 2010, בחן את השפעת הוספה של trastuzumab לכימותרפיה כ-neoadjuvant, שנמצאה יעילה בהארכת פרק הזמן של הישרדות ללא-אירועים וגם בהישרדות הכוללת במקרים של סרטן שד גרורתי-מקומי, חיובי ל-HER2. |
| − | === | + | ===פרופיל הפגיעה הלבבית של trastuzumab === |
מאז ומתמיד הייתה מוכרת הטוקסיות הקרדיאלית של טיפולים כימותרפיים מבוססים על אנתרציקלינים. המנגנון של הפגיעה הטוקסית של doxorubicin כרוך בנזק ישיר למיוציטים הקרדיאלים, על ידי הגברת הריכוז של רדיקאלים חופשיים, ומכאן עקה חמצונית הקרדיו-טוקסיות של doxorubicin שהיא בעיקרה בלתי הפיכה, שגורמת קלינית לירידה במקטע הפליטה (ejection fraction) של חדר הלב השמאלי, כשלב מקדים לתסמינים של CHF. | מאז ומתמיד הייתה מוכרת הטוקסיות הקרדיאלית של טיפולים כימותרפיים מבוססים על אנתרציקלינים. המנגנון של הפגיעה הטוקסית של doxorubicin כרוך בנזק ישיר למיוציטים הקרדיאלים, על ידי הגברת הריכוז של רדיקאלים חופשיים, ומכאן עקה חמצונית הקרדיו-טוקסיות של doxorubicin שהיא בעיקרה בלתי הפיכה, שגורמת קלינית לירידה במקטע הפליטה (ejection fraction) של חדר הלב השמאלי, כשלב מקדים לתסמינים של CHF. | ||
| שורה 193: | שורה 212: | ||
בנוסף, מחקרים הראו שחסימת הקולטן של HER2 על ידי trastuzumab, מגדילה את היחס בין חלבונים תומכי-אפופטוזיס לבין חלבונים נוגדי-אפופטוזיס, מה שגורם לתהליכי אפופטוזיס ולקיצור משך חיי התא כפי שסבורים Grazette וחב' במאמרם משנת 2004 ב-J Am Coll Cardiol. אך תיאוריה זו אינה מסבירה את ההבדל בהשפעה הקרדיו-טוקסית של trastuzumab ושל doxorubicin. על פי Robert וחב' במאמר משנת 2005 ב-J Clin Oncol, טיפול משולב של כימותרפיה בתכשירים ממשפחת ה-taxanes ו-trastuzumab, גורמת לנזק טוסי מופחת לרקמת הלב, מאשר בטיפול יחידני ב-taxanes. במאמר ב-Clin Breast Cancer ב-2007 מונים Ewer וחב' את גורמי הסיכון הכרוכים בהגברת הנזק הטוקסי של Trastuzumab לרקמת הלב. מדובר בגיל מטופלות שמעל 50 שנה, שימוש סימולטאני באנתרציקלינים, יתר לחץ-דם, ורמת מקטע פליטה של החדר השמאלי שבין 50-54%. | בנוסף, מחקרים הראו שחסימת הקולטן של HER2 על ידי trastuzumab, מגדילה את היחס בין חלבונים תומכי-אפופטוזיס לבין חלבונים נוגדי-אפופטוזיס, מה שגורם לתהליכי אפופטוזיס ולקיצור משך חיי התא כפי שסבורים Grazette וחב' במאמרם משנת 2004 ב-J Am Coll Cardiol. אך תיאוריה זו אינה מסבירה את ההבדל בהשפעה הקרדיו-טוקסית של trastuzumab ושל doxorubicin. על פי Robert וחב' במאמר משנת 2005 ב-J Clin Oncol, טיפול משולב של כימותרפיה בתכשירים ממשפחת ה-taxanes ו-trastuzumab, גורמת לנזק טוסי מופחת לרקמת הלב, מאשר בטיפול יחידני ב-taxanes. במאמר ב-Clin Breast Cancer ב-2007 מונים Ewer וחב' את גורמי הסיכון הכרוכים בהגברת הנזק הטוקסי של Trastuzumab לרקמת הלב. מדובר בגיל מטופלות שמעל 50 שנה, שימוש סימולטאני באנתרציקלינים, יתר לחץ-דם, ורמת מקטע פליטה של החדר השמאלי שבין 50-54%. | ||
| + | |||
| + | בסך הכול, הפגיעה הלבבית בעקבות טיפול בהרצפטין היא באחוזים נמוכים, גם במשכי מעקב ארוכים. קיים אלגוריתם למעקב התפקוד הלבבי, על ידי בדיקת אקו לב או MUGA, עאשר מטרתה לאתר פגיעה לבבית עוד בשלב המעבדתי שלה (ירידה ב-LVEF) למנוע הופעת מצב סימפטומטי. | ||
===עמידות ל-trastuzumab=== | ===עמידות ל-trastuzumab=== | ||
| − | + | מאז שהתגבר השימוש ב-trastuzumab במקרי סרטן שד חיובי ל-HER2, לא ניתן היה להתעלם מהמקרים בהם התגובה לטיפול זה הייתה חלקית או חסרה לחלוטין. נראה שבתת-קבוצה של מטופלות קיימת עמידות לתרופה זו, אם כי אטיולוגיה ברורה לעמידות זו לא זוהתה. עלו מספר השערות, כמו זו של Scaltriti וחב' משנת 2007 ב-J Natl Cancr Inst, לפיה באותם מקרים של עמידות יתכן שמדובר בקולטנים קטומים (truncated) ל-trastuzumab, בהם החלק החיצוני של הקולטן חסר, וממילא אין מתאפשרת התקשרותו של trastuzumab לקולטן זה. אותם תאים עם הקולטן "הפגום" כן הגיבו לטיפול ב-lapatinib שהוא מעכב את פעילות טירוזין קינאזה בשני הקולטנים, HER2 ו-EGFR. אמנם, Konecny וחב' במאמר משנת 2006 ב-Cancer Res, הדגימו ש-lapatinib היה יעיל קלינית בטיפול במקרים של סרטן שד שהראו עמידות להרצפטין. יש לציין שבמאמר זה ההדגמה של יעילות לפטיניב היתה על שורות תאים ולא קלינית במטופלים. | |
| − | מאז שהתגבר השימוש ב-trastuzumab במקרי סרטן שד חיובי ל-HER2, לא ניתן היה להתעלם מהמקרים בהם התגובה לטיפול זה הייתה חלקית או חסרה לחלוטין. נראה שבתת-קבוצה של מטופלות קיימת עמידות לתרופה זו, אם כי אטיולוגיה ברורה לעמידות זו לא זוהתה. עלו מספר השערות, כמו זו של Scaltriti וחב' משנת 2007 ב-J Natl Cancr Inst, לפיה באותם מקרים של עמידות יתכן שמדובר בקולטנים קטומים (truncated) ל-trastuzumab, בהם החלק החיצוני של הקולטן חסר, וממילא אין מתאפשרת התקשרותו של trastuzumab לקולטן זה. | ||
===בדיקת HER2=== | ===בדיקת HER2=== | ||
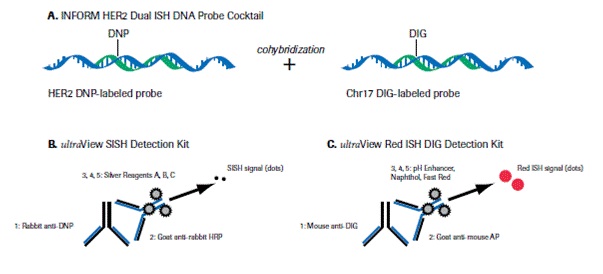
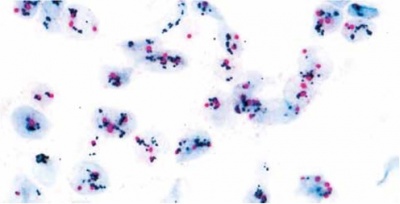
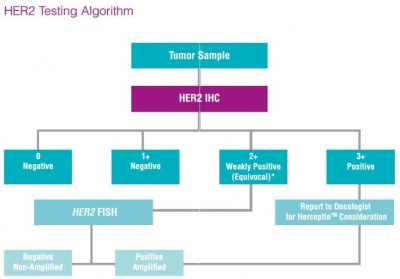
| − | + | בדיקות של HER2 נערכות לחולות סרטן שד כדי להעריך פרוגנוזה והתאמה לטיפול בתרופות הממוקדות ל-HER2, המוגבל רק לחולות שיש להן HER2 חיובי. לרוב נעשות הבדיקות על סמך דגימות רקמה הנלקחות באמצעות ביופסיית שאיבת מחט (core-needle biopsy), ביופסיית מחט (FNA), ביופסיית ואקום או במסגרת הסרה ניתוחית של הגידול. הערכה כמותית של הימצאות החלבון HER2 נעשית באמצעות אימונוהיסטוכימיה (IHC) בעזרתה מודדים את רמת החלבון HER2 בדגימה. שיטה אחרת היא FISH (Fluorescence in situ hybridization), ומאפשרת באמצעות סמנים פלואורסצנטיים לאמוד בדגימה את מספר העותקים של הגן. | |
| − | בדיקות של HER2 נערכות לחולות סרטן שד כדי להעריך פרוגנוזה והתאמה לטיפול | ||
| − | תוצאות בדיקת IHC יכולות להופיע כ-: 0 (תוצאה שלילית); +1 (נחשבת אף היא שלילית); +2 (תוצאה גבולית); +3 (תוצאה חיובית המבטאת ביטוי-יתר של HER2). אם מתקבלת תוצאה גבולית של +2, מומלץ לבצע בדיקה ברמת דיוק גבוהה יותר כמו בדיקת FISH, או בדיקות SPoT-Light HER2 CISH או בדיקת Inform HER2 Dual ISH , להקל בזיהוי מטופלות עם רמת HER2 גבולית שיכולות להפיק תועלת מטיפול בהרצפטין. | + | תוצאות בדיקת IHC יכולות להופיע כ-: 0 (תוצאה שלילית); +1 (נחשבת אף היא שלילית); +2 (תוצאה גבולית); +3 (תוצאה חיובית המבטאת ביטוי-יתר של HER2). אם מתקבלת תוצאה גבולית של +2, מומלץ לבצע בדיקה ברמת דיוק גבוהה יותר כמו בדיקת FISH, או בדיקות SPoT-Light HER2 CISH או בדיקת Inform HER2 Dual ISH , להקל בזיהוי מטופלות עם רמת HER2 גבולית שיכולות להפיק תועלת מטיפול בהרצפטין. כ-20-25% מבדיקות HER2 הממשיכות ל-FISH, נמצאות חיוביות ומעידות על התאמה לטיפול בהרצפטין. |
שיטת FISH משמשת לאבחון וגילוי מקטעי DNA או RNA בחתך של רקמה נבדקת. בשיטה זו נעשה שימוש בגלאים (probes) פלואורסנטים הנקשרים באופן ספציפי למקטעי ה- DNA או ה- RNA אותם מבקשים לאבחן או לגלות. ניתן באמצעות שיטה זו לאבחן הגברה של גן מסוים או לאבחן טרנסלוקציה (שחלוף) של מקטעי DNA בין כרומוזומים שונים. האנליזה בשיטה זו מתבצעת תחת מיקרוסקופ פלואורסנטי. | שיטת FISH משמשת לאבחון וגילוי מקטעי DNA או RNA בחתך של רקמה נבדקת. בשיטה זו נעשה שימוש בגלאים (probes) פלואורסנטים הנקשרים באופן ספציפי למקטעי ה- DNA או ה- RNA אותם מבקשים לאבחן או לגלות. ניתן באמצעות שיטה זו לאבחן הגברה של גן מסוים או לאבחן טרנסלוקציה (שחלוף) של מקטעי DNA בין כרומוזומים שונים. האנליזה בשיטה זו מתבצעת תחת מיקרוסקופ פלואורסנטי. | ||
| שורה 211: | שורה 230: | ||
===מדידה של HER2 בנסיוב=== | ===מדידה של HER2 בנסיוב=== | ||
| − | + | הקצה החוץ-תאי של החלבון HER2 המשתרבב אל מחוץ לתא מהממברנה, עובר ביקוע ומשתחרר מתאי הסרטניים ומגיע לצירקולציה. ניתן למדוד את השייר של HER2 הזולג לדם בשיטת ELISA, באופן שאינו מצריך גישה פולשנית להשגת ביופסיה של הגידול מרקמת השד. תוצאות של מחקרים עד כה מצביעים על כך ששינויים ברמת HER2 הנמדד בנסיוב עשויים להיות שימושיים בניבוי התגובה לטיפול בהרצפטין. יחד עם זאת אין תמונה ברורה ומלאה ביחס ליכולת של בדיקת ELISA להחליט מי שראויה להיות מטופלת בהרצפטין. אם רמת HER2 בנסיוב גבוהה מעל 15 ננוגרם/מ"ל לפני תחילת הטיפול, ניתן להשתמש במדידת מולקולה זו בנסיוב להחליט האם יש ירידה ברמתה במשך הטיפול. מדידת HER2 בנסיוב יכולה להידרש כאשר אין מספיק חומר של רקמת גידול, שיאפשר מבדקים ישירים ברקמה לנוכחות HER2. יחד עם זאת יש לציין שלא קיימות הוכחות פרוספקטיביות המורות על שימוש בשיטת בדיקה זו להערכת תגובה או לחיזוי תגובה. | |
| − | הקצה החוץ-תאי של החלבון HER2 המשתרבב אל מחוץ לתא מהממברנה, עובר ביקוע ומשתחרר מתאי הסרטניים ומגיע לצירקולציה. ניתן למדוד את השייר של HER2 הזולג לדם בשיטת ELISA, באופן שאינו מצריך גישה פולשנית להשגת ביופסיה של הגידול מרקמת השד. תוצאות של מחקרים עד כה מצביעים על כך ששינויים ברמת HER2 הנמדד בנסיוב עשויים להיות שימושיים בניבוי התגובה לטיפול בהרצפטין. יחד עם זאת אין תמונה ברורה ומלאה ביחס ליכולת של בדיקת ELISA להחליט מי שראויה להיות מטופלת בהרצפטין. אם רמת HER2 בנסיוב גבוהה מעל 15 ננוגרם/מ"ל לפני תחילת הטיפול, ניתן להשתמש במדידת מולקולה זו בנסיוב להחליט האם יש ירידה ברמתה במשך הטיפול. מדידת HER2 בנסיוב יכולה להידרש כאשר אין מספיק חומר של רקמת גידול, שיאפשר מבדקים ישירים ברקמה לנוכחות HER2. | ||
===המלצות ASCO לגבי בדיקת HER2=== | ===המלצות ASCO לגבי בדיקת HER2=== | ||
| − | + | # במקרה של אבחון של סרטן שד גרורתי, יש לבצע בדיקת סטאטוס של HER2 בחומר ממקור ביופסיה כדי לסייע בהחלטה האם טיפול ממוקד-HER2 היא חלופה נאותה. בנוסף, אם התהליך הסרטני התפשט לאזורי גוף אחרים, או אם המחלה חזרה לאחר טיפולים קודמים, בחינת הסטאטוס של HER2 מתחייבת אם בגידול ה"חדש" או באזורים אליהם המחלה התפשטה | |
| − | # במקרה של אבחון של סרטן שד גרורתי, יש לבצע בדיקת סטאטוס של HER2 בחומר ממקור ביופסיה כדי לסייע בהחלטה האם טיפול ממוקד-HER2 היא חלופה נאותה. בנוסף, אם התהליך הסרטני התפשט לאזורי גוף אחרים, או אם המחלה חזרה לאחר טיפולים קודמים, בחינת הסטאטוס של HER2 מתחייבת אם בגידול ה"חדש" או באזורים אליהם המחלה התפשטה | + | # ניתן לבצע מבדק IHC או FISH, אם לבדיקות אלה יש תיקוף (validation), והן מתבצעות על ידי איש מעבדה מנוסה, כאשר המעבדה הפתולוגית נוהגת באופן עקבי על פי הנחיות מאושרות של בדיקה זו וכן באופן הדיר לפיו מטופלות בה דגימות ביופסיה |
| − | # ניתן לבצע מבדק IHC או FISH, אם לבדיקות אלה יש תיקוף (validation), והן מתבצעות על ידי איש מעבדה מנוסה, כאשר המעבדה הפתולוגית נוהגת באופן עקבי על פי הנחיות מאושרות של בדיקה זו וכן באופן הדיר לפיו מטופלות בה דגימות ביופסיה | + | # אם תוצאת מבדק HERS מתקבלת גבולית, יש לחזור עליה או על דגימה חדשה מהגידול, או בשיטת זיהוי אחרת |
| − | # אם תוצאת מבדק HERS מתקבלת גבולית, יש לחזור עליה או על דגימה חדשה מהגידול, או בשיטת זיהוי אחרת | + | # אם המבדק ל-HER2 מתקבל חיובי, מומלץ הטיפול בהרצפטין, lapatinib או כל תכשיר ממוקד HER2 אחר. אם המבדק ל-HER2 מתקבל שלילי הטיפול בתכשיר ממוקד HER2 אינו חלופה מתאימה |
| − | # אם המבדק ל-HER2 מתקבל חיובי, מומלץ הטיפול בהרצפטין, lapatinib או כל תכשיר ממוקד HER2 אחר. אם המבדק ל-HER2 מתקבל שלילי הטיפול בתכשיר ממוקד HER2 אינו חלופה מתאימה | + | חובה לבצע בדיקת סטאטוס של HER2 במקביל לבדיקת הסטאטוס של קולטנים לאסטרוגנים ולפרוגסטרון |
| − | |||
ביוני 2011 קבלה חברת ROCHE את אישור ה-FDA לשימוש ב-INFORM HER2 Dual ISH DNA Probe cocktail, שפותח על ידי Ventana Medical Systems. הבדיקה מיועדת לקבוע אם יש עותקים רבים מדי של הגן ל-HER2, ותוצאת מבדק זה יכולה להתקבל חיובית (אמפליפיקציה של הגן ל-HER2) או שלילית (חסר אמפליפיקציה). בדיקה זו זמינה כיום בערכה שניתנת לביצוע אוטומאטי, כאשר התוצאה מתקבלת תוך 12 שעות. | ביוני 2011 קבלה חברת ROCHE את אישור ה-FDA לשימוש ב-INFORM HER2 Dual ISH DNA Probe cocktail, שפותח על ידי Ventana Medical Systems. הבדיקה מיועדת לקבוע אם יש עותקים רבים מדי של הגן ל-HER2, ותוצאת מבדק זה יכולה להתקבל חיובית (אמפליפיקציה של הגן ל-HER2) או שלילית (חסר אמפליפיקציה). בדיקה זו זמינה כיום בערכה שניתנת לביצוע אוטומאטי, כאשר התוצאה מתקבלת תוך 12 שעות. | ||
| שורה 263: | שורה 280: | ||
===בדיקת HER2 אינה מתבצעת בשכיחות הרצויה=== | ===בדיקת HER2 אינה מתבצעת בשכיחות הרצויה=== | ||
| − | |||
אחת מ-5 נשים החולות בסרטן שד נמצאות בקטגוריה של סרטן שד מסוג HER2, שהוא אגרסיבי יותר, ואבחונו נעשה בשלב הביופסיה הנלקחת מהגידול. לאבחון השפעה מכרעת על סוג הטיפול שיינתן, על הישרדות החולות ועל איכות חייהן. אולם בדיקה זו עדיין אינה נעשית כשגרה, ונקבעת על פי שיקול דעת הרופא המטפל והפרוטוקולים באותו מרכז רפואי. | אחת מ-5 נשים החולות בסרטן שד נמצאות בקטגוריה של סרטן שד מסוג HER2, שהוא אגרסיבי יותר, ואבחונו נעשה בשלב הביופסיה הנלקחת מהגידול. לאבחון השפעה מכרעת על סוג הטיפול שיינתן, על הישרדות החולות ועל איכות חייהן. אולם בדיקה זו עדיין אינה נעשית כשגרה, ונקבעת על פי שיקול דעת הרופא המטפל והפרוטוקולים באותו מרכז רפואי. | ||
| שורה 270: | שורה 286: | ||
בין המחקרים שנסקרו שהעריכו את אחוז הנשים שעברו בדיקת HER2, מחקר אחד דיווח כי רק 52% מהחולות עם סרטן שד גרורתי עברו את הבדיקה בשנים 1999-2000. מחקר אחר דיווח כי רק 32% מהמשתתפות שסבלו מסרטן שד שאובחן לאחרונה, עברו את הבדיקה בשנת 2005 , כאשר בקרב נשים אלו, 93% עברו רק בדיקת IHC, ואילו 0.3% נבדקו רק באמצעות FISH, ו-6% מהנשים עברו את 2 הבדיקות. מחקר אחר בסקר זה מצא שימוש לא הולם בהרצפטין: כ-12-20%מהמשתתפות שקיבלו הרצפטין במחקר זה, לא עברו בדיקת HER2 או שלא נמצאו עדויות בתיק לבדיקה חיובית. ב-8% מהנשים שטופלו בהרצפטין במחקר נמצא תת-ביטוי של HER2, ו-4% לא נבדקו כלל. לפי מחקר זה סקירת הנחיות של ה- ASCO/CAP מצאה כי 20% מבדיקות ה-IHC שנערכו במעבדות בקהילה היו שגויות. נראה לאור תוצאות סקירה זו בדיקת HER2 היא דוגמה לבדיקה שהיא חיונית מבחינה קלינית, אך עומדת עדיין בפני קשיי איכות ויישום. | בין המחקרים שנסקרו שהעריכו את אחוז הנשים שעברו בדיקת HER2, מחקר אחד דיווח כי רק 52% מהחולות עם סרטן שד גרורתי עברו את הבדיקה בשנים 1999-2000. מחקר אחר דיווח כי רק 32% מהמשתתפות שסבלו מסרטן שד שאובחן לאחרונה, עברו את הבדיקה בשנת 2005 , כאשר בקרב נשים אלו, 93% עברו רק בדיקת IHC, ואילו 0.3% נבדקו רק באמצעות FISH, ו-6% מהנשים עברו את 2 הבדיקות. מחקר אחר בסקר זה מצא שימוש לא הולם בהרצפטין: כ-12-20%מהמשתתפות שקיבלו הרצפטין במחקר זה, לא עברו בדיקת HER2 או שלא נמצאו עדויות בתיק לבדיקה חיובית. ב-8% מהנשים שטופלו בהרצפטין במחקר נמצא תת-ביטוי של HER2, ו-4% לא נבדקו כלל. לפי מחקר זה סקירת הנחיות של ה- ASCO/CAP מצאה כי 20% מבדיקות ה-IHC שנערכו במעבדות בקהילה היו שגויות. נראה לאור תוצאות סקירה זו בדיקת HER2 היא דוגמה לבדיקה שהיא חיונית מבחינה קלינית, אך עומדת עדיין בפני קשיי איכות ויישום. | ||
| + | [[קובץ:HER4.jpg|ממוזער|400px|מרכז|אלגוריתם של מדידת HER2 בדגימות של רקמת סרטן השד]] | ||
| + | |||
| + | ==ראו גם== | ||
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[סמנים סרטניים|בדיקות מעבדה - סמנים סרטניים]] | ||
| − | |||
| + | {{ייחוס בן עמי}} | ||
| − | |||
| − | [[קטגוריה:בדיקות מעבדה]] | + | [[קטגוריה:בדיקות מעבדה - סמנים סרטניים]] |
| + | [[קטגוריה:בדיקות מעבדה: פתולוגיה]] | ||
גרסה אחרונה מ־08:47, 28 בדצמבר 2021
| מדריך בדיקות מעבדה | |
| Human Epidermal Growth Factor Receptor 2 | |
|---|---|
| שמות אחרים | C-erbB-2 ;CD340 ;HER-2/neu ;MLN 19 ;neu ;NGL TKR1 ;p185erbB2 |
| מעבדה | פתולוגיה, אונקולוגית-מולקולארית |
| תחום | הערכת הסטאטוס של תאי סרטן שד לאונקוגן HER2 |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – HER2
בסיס פיזיולוגי
אחת מתוך שמונה עד תשע נשים עלולה לחלות במהלך חייה בסרטן השד, שהיא המחלה הממארת השכיחה ביותר בקרב נשים בעולם המערבי ובישראל, בה נפוצה המחלה במיוחד בקרב ילידות ישראל ללא הבדל אתני, וכן היא שכיחה בנשים ממוצא אירופאי וצפון אמריקני. מדי שנה מאובחנים בעולם 1.4 מיליון מקרים חדשים של סרטן השד, ו-450,000 נשים מתות בעולם מדי שנה מהמחלה. מדי שנה מאובחנות בישראל כ-4000 חולות חדשות בסרטן השד, ו-900 מתוכן לא תשרודנה את המחלה.
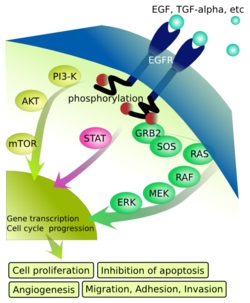
סרטן השד היא הממאירות השכיחה ביותר בקרב נשים, וכמו בסוגי סרטן רבים אחרים, סיבותיה עדיין עלומות. כמקובל, סבורים שגורמים גנטיים אך גם סביבתיים כרוכים בהיווצרות המחלה, כאשר מוטציות בגנים אחדים כמו HER2 ,BRCA1 ,BRCA2 ו-p53 נכרכו עם סרטן השד. כיוון שהחלבון HER2 מתבטא ביתר ב-20% עד 30% ממקרי סרטן זה, הוא הפך ליעד תרפיה ביולוגית תוך שימוש בנוגדן חד-שבטי ספציפי לקולטן של חלבון זה. נוגדן כזה-trastuzumab (שם מותג Herceptin), שיכול להיקשר לקולטן התאי של HER2, ולנטרל אותו, הפך להיות אחד התכשירים המקובלים ביותר בתחום הטיפולים של סרטן השד, כאשר תכשירים אחרים המיועדים לנטרולו של HER2 כוללים את lapatinib (שם מותג Tykerb) ו-pertuzumab (שם מותג פרג'טה הידוע גם כ-C42). התכשיר lapatinib היא מולקולה קטנה המעכבת את האנזים טירוזין קינאזה שהוא חלק מ-2 קולטנים מקבוצת ה-Erb: הקולטן ל-EGF המכונה גם ERbB1 וכן HER1 והקולטן ל-HER2 או ErbB2. התכשיר lapatinib חודר לתוך התא ומעכב את התהליך הסרטני בו על ידי נטרול טירוזין קינאזה. הנוגדן pertuzumab נקשר לחלק החיצוני של הקולטן ל-HER2, אלא שמיקום קשירתו שונה מזה של הרצפטין.
סרטן השד הפך להיות הסוג הראשון של סרטן סולידי שניתן היה לטפל בו בהצלחה על ידי גישה של תרפיה ממוקדת-מטרה. מאז אישורה בשנת 1998 לטיפול בסרטן השד, הפכה התרופה הרצפטין מודל לטיפולים ביולוגיים ממוקדי-מטרה. ראוי אם כן לבחון את הדרך הארוכה והמפותלת מאז גילוי מולקולת היעד בתאים סרטניים עד לפיתוח התרופה המכוונת ליעד התאי הזה.
אבני דרך בגילוי של הפרוטו-אונקוגן HER2 והנוגדן החד-שבטי הנקשר לקולטן שלו trastuzumab (הרצפטין)
בשנת 1978 פרסם סטנלי כהן (Stanley Cohen) וחב' באוניברסיטת Vanderbilt ב-Nature על גילוי הקולטן ל-Epidermal growth factor, שכינויו EGFR או גם ErbB*-1 וכן גם HER1. היה זה הקולטן הראשון אליו קשור האנזים tyrosine kinase המעודד זִרחוּן של מרכיב תוך-תאי להפעלת רצף גורמים ופעילות מטבולית חיונית. הכינוי ErbB מקורו בגן Erb-b שמופיע בנגיף avian erythroblastosis virus. בין השנים 1982-1984 התגלה האונקוגן neu על ידי Robert Weinberg וחב' ב-M.I.T (בפרסומים ב-Cell בשנת 1982 וב-Nature ב-1984) ומייד אחריו על ידי קבוצות מחקר באוניברסיטאות Rockefeller ו-Harvard: האונקוגן neu הידוע גם כ-HER2 ,ErbB2 וכן p185 (בהיותו מקודד לחלבון מזוּרחן במשקל מולקולארי 185,000 דלטון), נתגלה במחקר על שורת תאים של ממקור סרטן העצבי (גליובלסטומה) בחולדות.
בשנים 1984-1986 היו מספר הישגים מחקריים הקשורים ל-HER2: קבוצת המחקר של אקסל אולריך (Axel Ullrich) ב-Genentech, במאמר ב-Nature ב-1984, ו-Yamamoto וחב' ביפאן במאמר ב-1986 ב-Nature, שִבטוּ את ה-cDNA של הגן המקודד ל-HER2 או Erb-2. השם HER2 נובע מהדמיון המבני ל-HER1, כשהשם נגזר מ- Human Epidermal growth factor Receptor 2. השם ErbB-2 ניתן ל-neu, כיוון שהוא למעשה גרסת הגן המופיע ביונקים, של אותו גן ERBB2 או ERBB שנמצא בנגיפים. החלבון המקודד על ידי הגרסה האנושית של הגן ERBB2, זהה למעשה ל-EGFR האנושי, ומכאן הכינוי HER2. הגנים neu ו-HER2 נקראים היום במשותף HER/neu.
בהמשך, הראו Weinberg וצוותי מחקר ב-M.I.T וב-Harvard בשני מאמרים ב-nature ב-1984 וב-Cell ב-1985, שהם הפיקו נוגדנים חד-שבטיים בניסיון לזהות אנטיגנים על פני התאים הקשורים עם השפעול של האונקוגן התאי. הם גילו שנוגדנים אלה נקשרים וגורמים ל-immune precipitationשל החלבון p185 בתאי נוירובלסטומה של חולדה. אותה קבוצת חוקרים הראתה בשנת 1986 ב-Proc Natl Acad Sci, שנוגדן החד-שבטי כנגד p185, גורם לתאי עכבר מסוג 3T3 מותמרים על ידי neu, להפוך ל-revertants, דהינו להפוך לפנוטיפ שאינו מותמר, כפי שהתברר מקצב חלוקת התאים שהואט ומצורת הגידול הסדירה של התאים בתרבית רקמה, כאשר הם עוברים עיכוב-על-ידי-מגע (contact inhibition) בבואם במגע עם תאים סמוכים. החוקרים הראו כמו כן שנוגדנים חד-שבטיים המכוונים כנגד p185, יכולים לעכב גידולים סרטניים בעכברים, ולהאריך את משך חייהם של עכברים נטולי מערכת חיסון מזן (Balb/C nude (nu/nu, לתוכם הוזרקו תאי הסרטן.
באמצע שנות ה-80 החל מתברר תפקידם של אונקוגנים בתהליך הסרטני. דיווח של Seeger וחב' ב-1985 ב-N Eng J Med, גילה שהאונקוגן N-myc מופיע בעותקים אחדים במספר גידולים אנושיים מסוג נוירובלסטומה, ושאמפליפיקציה של N-myc נמצאת במִתאם עם התקדמות התהליך הסרטני. באותה שנה פרסמו John Minna וחב' ב-Nature את ממצאיהם על כך שאמפליפיקציה של האונקוגן c-myc בסרטן ריאות, גורמת להישרדות של החולים שהיא רק שליש עד מחצית ממשך ההישרדות של חולים בסרטן ריאות, בהם לא מתרחשת בגידול הסרטני אמפליפיקציה כזו.
עוד בשנת 1985 פרסם Stuart Aaronson ממכון הסרטן הלאומי (NCI) ב-Nucleic Acids Res את הממצא שגן הקשור ל-v-erB, עובר אמפליפיקציה בערך ב-10% מתאי סרטן שד בתרבית. שנה לאחר מכן פרסמו Yamamoto וחב' ב-Mol Cell Biol, שאותו גן עליו דיווח Aaronson, אינו אלא C-erbB-2, הממוקם על כרומוזום 17, ואת העובדה שהוא עובר אמפליפיקציה בשורת תאים שמקורה מסרטן הקיבה באדם. אותו גן, שהיו שהעדיפו לכנותו neu, שובט, רוצף ומוּקם בכרומוזום 17 גם על ידי Weinberg וחב' במאמרם ב-Nature בשנת 1986, ואילו Coussens וחב' פרסמו ב-Nature כבר ב-1985 שהגן המקודד לקולטן טירוזין קינאזה שהוא בעל הומולוגיה ניכרת לקולטן של EGF, הוא בעל מיקום כרומוזומאלי זהה לגן המקודד ל-neu.
בשנת 1987 התפרסם ב-Science מאמרם של Ullrich ב-Genentech ששיתף פעולה עם Dennis Slamon מ-UCLA ועם האונקולוג William McGuire מסן-אנטוניו, בו הם הראו שאמפליפיקציה של האונקוגן HER-2/neu בסרטן שד, כרוכה במשכי זמן קצרים יותר החולפים מההפוגה (remission) עד להתפרצות החוזרת של המחלה (relapse), ובשיעור הישרדות נמוך יותר של נשים עם סרטן זה.
כהמשך טבעי להתפתחויות אלה, תיארו Phil Leder ו-William Muller מ-Harvard וממכון Howard Hughes במאמר משנת 1988 ב-Cell, שהחדרת אונקוגן פעיל של neu לעכברים, גרמה לביטוי של החומר הגנטי המוחדר באופן שגרם בהם להתפתחות סרטן השד. הרחבה מרתקת של היריעה התבררה במאמרם של Slamon ו-Ullrich בשנת 1989 ב-Science, ממנו התחוור שחלק מהנתונים לגבי אמפליפיקציה של האונקוגן HER-2/neu, נכון גם לגבי סרטן השחלה. באותה שנה פרסמו Wright וחב' מהיחידה לחקר הסרטן באוניברסיטת אוקספורד, שביטוי-יתר של האונקופרוטאין erbB-2, יכול בהחלט לשמש מדד פרוגנוסטי של מהלך סרטן השד.
קבוצתו של Ullrich ב-Genetech המשיכה לגלות יוזמה ודומיננטיות בנושא, ובשנת 1989 דיווחה ב-Mol Cell Biol על כך שנוגדן חד שבטי שהיה מכוון כנגד המקטע החוץ-תאי של p185/HER2, מעכב באופן ספציפי את שגשוגם בתרבית של תאים שמקורם בגידול שד המבטא באופן מוגבר את תוצר האונקוגן HER2/c-erbB-2. חוקרי Genentech הראו כמו כן שאותו נוגדן חד שבטי, הגביר את הרגישות של תאי סרטן השד לציטוקין TNF-α.
באותה עת (שנים 1989-1990) הייתה פעילה במיוחד קבוצת המחקר של Greene בפילדלפיה, שהראתה במאמרים שפורסמו ב-Cell ב-1989 וב-1990, וכן ב-Oncogene ב-1989, על אינטראקציה תוך-תאית בין החלבון p185/neu לבין הקולטן של גורם הגדילה האפידרמאלי (EGFR), ליצירת הומו-דימרים של neu. יצירת דימרים אלה מביאים להתמרה סרטנית של פיברובלסטים של מכרסמים, באופן שקיימת תאחיזה בין פעילות האנזים טירוזין קינאזה לבין יכולת ההתמרה הסרטנית של האונקו-פרוטאין p185/neu.
החל משנת 1990 התחזקה המגמה של חברות ביוטכנולוגיה ובראשן Genetech, לנצל את הידע הקיים, בעיקר בתחום יצירת נוגדנים חד שבטיים שיהיו מכוונים כנגד אותם אונקו-חלבונים ממשפחת ה-EGF או הקולטנים שלהם, במטרה להפר את מעורבות מרכיבים אלה בתהליך הסרטני. באותה שנה פרסם Ullrich וקבוצתו ב-Cancer Res על האִפיוּן של נוגדנים חד-שבטיים המגיבים או עם הקולטן של EGF או עם האונקו-פרוטאין HER2/neu. התוצר הנוגדני הראשון, Herceptin, נוצר ב-1991 דווקא בתאי CHO (תאי שחלה של chinese hamster) , אם כי לצורך שימוש תרופתי בנשים עם סרטן שד, היה כמובן חיוני להשתמש בנוגדנים חד שבטיים שמקורם בתאי אדם, כדי להימנע מנטרול של הנוגדן על ידי תגובה של מערכת החיסון האנושית.
אכן, Paul Carter, אף הוא מאנשי Genetech וחב', פרסמו ב-1992 ב- Proc Natl Acad Sci, על יצירת גרסה הומאנית (humanized Ab) של נוגדן חד-שבטי כנגד HER2, תוך שימוש באסטרטגיה של gene conversion mutagenesis, בה ניתן היה להפיק באופן מהיר וסימולטאני האנשה של אזורי השרשרת הכבדה (VH) והשרשרת הקלה (VL) של הנוגדן החד-שבטי mumAb4D5 שמוכר כיום כהרצפטין בגרסה ההומאנית שלו, נוגדן המכוון כנגד המקטע החוץ תאי של p185/neu. בשנת 1992 החלו ניסויי phase I עם הרצפטין בעיקר בבחינת מינונים שונים של התכשיר, לאִפיוּן הפרופיל הפארמקוֹ-קינטי שלו. בשנת 1993 החלו ניסויי phase II ב-54 מרכזים רפואיים בצפון אמריקה, אירופה, ובאוסטריה וניו-זילנד, והסתיימו בשנת 1994.
בשנת 1995 החלו ניסויי phase III עם הרצפטין, כאשר ניסוי CARE או Chemotherapy & Antibody Response Evaluation, היה ניסוי רב-לאומי, אקראי של בחינת הרצפטין בשילוב עם כימותרפיה בנשים עם סרטן שד גרורתי וביטוי-יתר של HER2, שלא קבלו בעברן טיפול כימותרפי ציטוטוקסי. הגיוס של משתתפות לניסוי זה החל ב-12 ביוני 1995 והיה מתוכנן להסתיים ב-7 במרץ 1997. ב-1997 החל שיתוף פעולה בין חברת Genentech וחברת DAKO הדנית, באשר לערכת הבדיקה HerceptestTM, להערכה חצי כמותית של רמת HER2 בתאי סרטן השד, ערכה המקבלת את אישור ה-FDA בספטמבר 1998, ואת אישור ה-European Conformity בשנת 2003, ומשמשת נכון לשנת 2014 כערכה מובילה בתחום זה. בשנת 2005 מקבלת הערכה המולקולארית לבחינת רמת HER2, הידועה כ-HER2 FISH pharmDX KitTM, את אישור ה-FDA כבדיקה להערכת הטיפול בהרצפטין בחולות עם סרטן שד.
שנת 1998 הייתה שנה מכוננת בתחום של הרצפטין, כאשר ה-FDA העניק ל-Genentech אור ירוק במסלול העדפה מקוצר (Fast-track designation), לטיפול בחולות עם סרטן שד מפושט. באותה שנה מאשר ה-FDA שימוש בהרצפטין אם במשולב עם paclitaxel (שם מותג Taxol), כטיפול קו-ראשון של סרטן שד מפושט חיובי ל-HER2, או לשימוש יחידני באותן חולות (כטיפול קו שני או שלישי). בכך הפך הרצפטין לתכשיר של נוגדן מכוון-המטרה הראשון כנגד מולקולה ספציפית בתא הסרטני, שמקבל את אישור ה-FDA. באותה שנה מתפרסמות המלצות האגודה האמריקנית לאונקולוגיה קלינית (ASCO), לפיהן מבדק HER2 חיוני בכל מקרי סרטן השד, הנחיות המתפרסמות לאחר מכן ב-(J Clin Oncol, 17, 1080-2 ,(1999.
בשנת 2002 מאשר ה-FDA את הכללתה של בדיקת FISH לבחינת אמפליפיקציה של HER2, כחלק מתוויות ההנחיה באריזת הרצפטין. באותה שנה Garrett וחב' ממכון Aliza & Walter Hall באוסטרליה, מפענחים את המבנה הגבישי של המקטע החוץ-תאי של EGFR קשור ל-TGF-α, בדרגת רזולוציה של 2.5Å, ומדווחים על כך ב-Cell. במקביל מופיע באותו כתב-עת מאמרם של Yokoyama וחב' ממרכז RIKEN ללימודים גנומיים ביפאן, בו הם מדווחים על פּענוח המבנה הגבישי של קומפלקס (2:2) של EGF אנושי עם המקטע החוץ-תאי של הקולטן ל-EGF, ברמת רזולוציה של 3.3Å.
בשנת 2006 מאשר ה-FDA את הטיפול בהרצפטין כחלק ממערך טיפולי הכולל בנוסף ל-doxorubicin, ציקלופוספאמיד וטקסול כטיפול adjuvant במטופלות עם HER2 חיובי, ועם ממצא של גרורות לבלוטות הלימפה. שנה לאחר מכן מתפרסמות ב-J Oncol Practice, כרך 3, עמ' 48-50, הנחיות משותפות של ASCO ושל ה-College of American Pathologists) CAP), על המלצה למדידת HER2 בהערכה כוללנית של סרטן השד הגרורתי, מחלה מוקדמת או מחלה חוזרת.
בשנת 2008 מאשר ה-FDA את הטיפול בהרצפטין כטיפול adjuvant יחידני במטופלות עם ביטוי-יתר של HER2, אך ללא קולטנים לאסטרוגן ולפרוגסטרון (ER/PR negative). עם או ללא מעורבות של בלוטות לימפה, שכבר עברו טיפול מבוסס על אנתרציקלינים דוגמת doxorubicin. באותה שנה, מתגלה בדיווח של O'Shaughnessy וחב' ב-J Clin Oncol, ההשפעה הסינרגיסטית של lapatinib ביחד עם הרצפטין במטופלות עם סרטן שד גרורתי חיוביות ל-HER2, בהן טיפול קודם בהרצפטין בלבד לא הביא לתגובה הרצויה.
סרטן שד חיובי ל-HER2
במהלך חיי אדם מתרחשות מוטציות בגנים שונים בתאים של רקמה מסוימת בגופו, כאשר השינויים המכונים "מוטציות סומאטיות" אינם עוברים בהורשה. מוטציות סומאטיות כאלה מתרחשות לעתים כאשר DNA עובר רפליקציה כהכנה לחלוקת התא, כאשר "שגיאות" בתהליכי רפליקציה אלה, עלולות לגרום להופעת מספר גדול של עותקים של גן מסוים על פני הכרומוזום, מה שידוע כ-gene amplification. תופעה זו יכולה לעמוד בבסיס היצירה והשגשוג של תאי סרטן בתלות בזהותו של הגן שאמנם עובר אמפליפיקציה. עותקים עודפים של גן כזה (ERBB2) מייצרים עודף גדול של חלבון הקולטן של ErbB2 בתאי סרטן השד באותם 25% לערך מכלל סרטני השד. אגב, אמפליפיקציה של הגן ERBB2 מדווחת גם בסוגים אחרים של סרטן כגון סרטן השחלה, המוח, הקיבה, הריאות ושלפוחית השתן. הגן ERBB2 ממוקם על הזרוע הארוכה (q) של כרומוזום 17 בעמדה 17q11.2-21 . ליתר דיוק מיקום גן זה הוא בין base pair 39,688,139 לבין base pair 39,728,661 על כרומוזום 17. גן זה עובר רוב הזמן אמפליפיקציה ביחד עם הגן GRB7, שהוא הפרוטו-אונקוגן הכרוך עם גידולים סרטניים של השד, הקיבה הלוע ושל תאי נבט באשכים.
עותקים מרובים של הגן ERBB2 (פי-10 ועד פי-100 מהנורמאלי) גורמים ליצירה עודפת של חלבון ה-HER2 על פני התאים, שיביא להסתברות גבוהה יותר ליצירת דימרים, עליה בקישור הליגנד והגברת האיתות התוך-תאי, שיביא בסופו של תהליך לשגשוג והתרבות מוגברת של תאי סרטן השד מסוג HER2.
החלבון HER2
הפרוטו-אונקוגן-חלבון HER2 שייך למשפחת חלבוני ErbB, שהם קולטני טירוזין קינאז המהווים חלק ממברנת התא. במשפחה זו 4 חלבונים, שלכולם משותף מקטע (domain) מחוץ לתא, בנוסף למקטע טרנס-ממברנאלי החוצה את הממברנה, ומקטע תוך-תאי המסוגל להיקשר למגוון של חלבוני איתות תוך-תאיים. אך בניגוד ליתר חלבוני משפחה זו, EPGR הידוע גם כ-HER1 וכ-erbB1; ובנוסף HER3 המכונה גם erbB3 (הידוע כ-neuroregulin-binder והוא חסר פעילות של טירוזין קינאזה), וכן HER4 המוכר גם כ-erbB4, שלכל אחד מהם מתקשר ליגנד ספציפי, שעם התקשרותו הם יוצרים הומו-דימרים או הטרו-דימרים, הרי ש-HER2 נחשב קולטן "יתום", ללא ליגנד מזוהה הנקשר אליו. יחד עם זאת, HER2 יכול להיקשר ליצירת הטרו-דימרים עם חלבוני המשפחה האחרים, והוא אף נחשב למרכיב מועדף ליצירת דימרים. השילוב הפעיל ביותר המעודד את התהליך הסרטני, הוא ביצירת הטרו-דימר HER2/HER3, כפי שהראו Ullrich וחב' בשנת 1995 ב-EMBO J. לחלבון HER2 יש הומולוגיה עם EGFR (הידוע גם כ-HER1 וכן כ-c-erbB-1) אך אין הוא זהה לו.
יוסף ירדן וקבוצתו במכון וויצמן דיווחו ב-1996 ב-EMBO J, על כך שחקר תפקידו של HER2 בהעברת איתותים תאיים, העלה בין השאר שחלבון זה מסוגל ליצור הטרו-דימרים הן עם HER1 הקולטן ל-EGF וכן עם HER3 ו-HER4, הקולטנים של NDF או Neural Differentiation Factor.
כאשר דימר כזה משופעל על ידי ליגנד כמו EGF או TGF-α, חלה דימריזציה של קולטנים, ואנזים ציטופלזמי גורם לזרחון של טירוזין הממוקם במקטע התוך-תאי של הקולטן, מה שמעורר רצף מסלולי של העברת איתותים בתא (signal transduction), ומסלול זה אחראי על בקרת גנים החיוניים לתהליכים של חלוקת התא, כמו גם תהליכי תיקון תאיים. בין המרכיבים הציטופלזמטיים המשתתפים במסלולי איתותים אלה ניתן להזכיר את MAPK או Mitogen-Activated Protein Kinase, את STAT או Signal Transduction And transcription, את האנזים protein kinase C, את γ phospholipase C, ואת phosphoinositide 3-kinase או PI3k/Akt.
תאי שד תקינים מכילים 2 עותקים של הגן HER2, המסייע לבקרה על שגשוג התאים, חלוקתם, ומנגנוני תיקון בהם. אך כאשר מספר עותקים אלה גדל, מה שיגרום לריבוי קולטני HER2 על פני התא, הדבר עלול לסייע בהפיכת תא שד נורמאלי לסרטני, וכן לקבוע את דרגת האגרסיביות של תא סרטני זה. במצב של ריבוי קולטני HER2 המתרחש ב20% עד 25% מכלל מקרי סרטן השד (מה שידוע כ-gene amplification), יתגברו האותות התוך תאיים, כאשר קישור ליגנדים לקולטנים ודימריזציה, עלול לעודד את התא לשגשוג מהיר ובלתי מבוקר, ולתהליכים אנטי-אפופטוטיים שמשמעותם תהליך סרטני בלתי מרוסן.
תכשירים כנגד HER2
הנוגדן trastuzumab (שם מותג הרצפטין)יעיל רק כאשר יש ביטוי-יתר של HER2, וכאשר הנוגדן נקשר ל-HER2, יש עליה ניכרת ברמת החלבון p27, העוצר את חלוקת התאים. במקביל לעלייה ברמת p27, יש ירידה ברמת cyclin D1 כמו גם ברמת הפעילות של 2 cyclin-dependent kinase. נראה שהנוגדן הרצפטין אינו מסוגל לעודד פעילות משמעותית של אפופטוזיס, אלא פועל בסינרגיה עם תכשירים כימותרפיים אחרים כפי שהשתמע מניסויים קדם-קליניים. סינרגיה כזו באה לביטוי לדוגמה על ידי עיכוב מסלול האיתות של PI3k/Akt שבאופן נורמאלי מעודד הישרדותם של תאים והוא מנוגד לתהליך האפופטוטי, כפי שהדגימו Slamon וחב' בשנת 2004 ב-J Natl Cancer Inst. אך הרצפטין עשוי להביא למותם שתאי סרטן שד המבטאים HER2 ביתר, על ידי מנגנון אדפטיבי בעזרת תאי חיסון מסוג T ציטוטקסיים, דרך שפעול של הקולטן Fc, במה שמוכר כ-ADCC או antibody-dependent cell-mediated cytotoxicity, כפי שמדווחים Park וחב' ב-Cancer Cell בשנת 2010.
הרצפטין משווקת בארה"ב על ידי Genetech, ביפאן על ידי Chugai, וברחבי העולם על ידי ROCHE. מאז 1999 הרצפטין שימש לטיפול בלמעלה מ-1.5 מיליון נשים עם מחלה חיובית ל-HER2 ברחבי העולם. בחודש יוני 2006 נרשמה התרופה בישראל לטיפול בסרטן שד מוקדם מסוג HER2 חיובי ומייד לאחר מכן הוכללה בסל הבריאות.
תרופה נוספת שיעילותה הוכחה במחקרים קליניים, היא lapatinib (שם מותג Tykerb) שהוכנסה ב-2008 בארה"ב לטיפול בסרטן שד, בהתוויה של טיפול בסרטן שד גרורתי וביטוי-יתר של HER2, לאחר טיפול קודם בכימותרפיה סטנדרטית ובהרצפטין. Lapatinib היא מולקולה קטנה הפועלת בתוך התא ממשפחת מעכבי טירוזין קינאזה, המעכבת בפעילותה את erbB1 ו-erbB2, ונראה שיש יתרון בעיכוב הכפול של המסלולים הללו.
התכשיר lapatinib נמצא יעיל בטיפול משולב עם התכשיר הציטוטוקסי capecitabine, במקרים של סרטן שד גרורתי שהוא חיובי ל-HER2, אחרי שזה ממשיך להתפשט למרות טיפול קודם בהרצפטין. בדצמבר 2006 התפרסם ב-N Eng J Med מחקר רב לאומי (ארה"ב, בריטניה, פולין, אירלנד, אוסטרליה, ישראל) בראשו עמד Charles Geyer מפיטסבורג. במחקר זה הושוותה יעילות הטיפול המשולב האמור, לעומת טיפול יחידני עם capcitabine, ב-320 נשים המוגדרות +HER2, עם מחלה מפושטת מקומית או עם מחלה גרורתית, שהתפשטה לאחר טיפולים שכללו תכשירים אנטרציקליניים או טקסניים מקובלים, וכן טיפול בהרצפטין.
מחקר זה הופסק טרם-עת, לאחר שהערכת ביניים מצאה שהטיפול המשולב (lapatinib פלוס capecitabine) הביא להארכה מרשימה בפרק הזמן הממוצע עד להתקדמות המחלה (8.4 לעומת 4.4 חודשים), ללא תופעות לוואי משמעותיות או אירועי לב, אם כי נרשמו תגובות של פריחה עורית ושלשולים. גם שיעורי התגובה היו משמעותית גבוהים יותר בטיפול המשולב עם lapatinib, כאשר בזרוע הטיפול המשולב נרשמו במהלך הניסוי המקוצר 49 אירועים, לעומת 72 אירועים בטיפול היחידני ב-capacitabine (שם מותג Xeloda). ניתן לטפל ב-lapatinib גם במשולב עם מעכבי aromatase כגון letrozole (שם מותג Femara) בנשים בגיל המעבר. טיפול של 5 טבליות ליום של lapatinib, יכול לגרום לתופעות לוואי מתונות כשלשולים, פריחה עורית ועייפות, אם כי יש גם דיווחים על מקרים של אירועי אי-ספיקת לב.
תכשיר חד-שבטי נוסף המעכב דימריזציה של הקולטנים של HER2 ו-HER3, הוא pertuzumab (שם מותג Perjeta), שאושר לשימוש על ידי ה-FDA ביוני 2012, בשילוב עם הרצפטין. ניסוי CLEOPPATRA בחן מטופלות עם מחלה מפושטת ו-HER2 חיובי, שקיבלו trastuzumab פלוס docetaxel (קבוצת ביקורת) לעומת מטופלות שקיבלו pertuzumab בתוספת ל-trastuzumab ול-docetaxel. על פי Baselga וחב' במאמרם משנת 2011 ב-NEJM. משך הזמן החציוני ללא התקדמות מחלה היה ארוך יותר בקבוצת pertuzumab. כיום מאושר pertuzumab ומוכלל בסל הבריאות כתרופת קו-ראשון במחלה מפושטת חיובית ל-HER2, בשילוב עם docetaxel ו-trastuzumab.
פרג'טה Perjeta® (Pertuzumab)
פרג'טה היא תרופה ביולוגית התוקפת באופן ממוקד את התאים הממאירים בעלי ביטוי היתר של חלבון HER2. חלבון זה HER2-גורם לשליחת אותות תוך-תאיים המובילים לצמיחת והתרבות התאים הממאירים. אחד המנגנונים לשליחת אותות אלה הוא היצמדות של חלבון זה לחלבונים אחרים מאותה קבוצה, תהליך המכונה "דימריזציה". פרג'טה הינה נוגדן חד-שבטי כנגד חלבון ה-HER2, הפועל במנגנון חדשני שלHER2 dimerization inhibition. פרג'טה נקשרת לחלבון ה-HER2 באתר שונה מזה של הרספטין ומונעת את הצמדות ה-HER2 לחלבוני HER אחרים, וכך מעכבת העברת סיגנלים תוך תאיים הגורמים לשגשוג התאים הממאירים, מעכבת את צמיחתם וגורמת לאפופטוזיס שלהם.
בנוסף, היקשרות פרג'טה לתאי הגידול משפעלת את מערכת החיסון להשמידם באמצעות (ADCC Antibody dependent cell cytotoxicity). מנגנון הפעולה של פרג'טה משלים לזה של הרספטין, והטיפול המשולב של שתי התרופות )הניתנות ביחד עם כמותרפיה( מביא לחסימה מקיפה יותר של פעילות חלבון ה HER2-וכתוצאה מכך לדיכוי יעיל יותר של צמיחת והתפשטות הגידול הסרטני.
יעילות הטיפול בסרטן שד מוקדם:
פרג'טה בשילוב עם הרספטין וכמותרפיה: במחקר הפאזה ה-II NEOSPHERE הושוותה היעילות של פרג'טה בשילוב עם הרספטין וכמותרפיה מסוג טקסוטר, לטיפול סטנדרטי של הרספטין וטקסוטר בקרב 417 חולות סרטן שד מוקדםHER2 חיובי. התוצאות הדגימו שהוספת פרג'טה לטיפול הטרום ניתוחי (נאואדג'ובנטי) המקובל מביאה לשיפור משמעותי בהשגת תגובה פתולוגית מלאה ((pCR - pathologic complete response - 39.3% לעומת 21.5%, כפי שדיווחו Gianni וחב' ב-Lancet Oncol בשנת 2011.
במחקר הפאזה ה-II TRYPHAENA הטיפול עם פרג'טה בשילוב עם הרספטין וכמותרפיה שכללה אנטרציקלינים השיג שיעורי pCR גבוהים של 54.6-63.6% (עפ"י Schneeweiss וחב' ב-Annal Oncol משנת 2013). בשני המחקרים, הוספת פרג'טה למִשלב הטיפולי המקובל שיפרה את יעילות הטיפול ללא פגיעה בפרופיל הבטיחות.
בהנחיות המעודכנות של ה- National Comprehensive Cancer Network לטיפול בסרטן שד, פרג'טה בשילוב עם הרספטין וכמותרפיה מומלצת כאופציה הטיפולית הנאואדג'ובנטית המועדפת בחולות עם סרטן שד HER2 חיובי.
יעילות הטיפול בסרטן שד גרורתי:
פרג'טה בשילוב עם הרספטין וכמותרפיה: במחקר הפאזה ה-III CLEOPATRA הושוותה היעילות של פרג'טה בשילוב עם הרספטין וכמותרפיה מסוג טקסוטר, לטיפול סטנדרטי של הרספטין וטקסוטר בקרב 808 חולות סרטן שד גרורתיHER2 חיובי. התוצאות הדגימו שהוספת פרג'טה לטיפול המקובל מביאה לשיפור משמעותי בהישרדות הכוללת של המטופלות (OS), תוך הפחתה של %34 בסיכון לתמותה (HR=0.66, P=0.0008). הוספת פרג'טה האריכה את חיי המטופלות ב-15.7 חודשים עם נתוני OS חציוני של 56.5 חודשים (Kim וחב' בכינוסSABCS בסן-אנטוניו בדצמבר 2012). כמו כן, הוספת פרג'טה דחתה ב-6 חודשים את התקדמות המחלה, מ- 12.4 ל-18.5 חודשים (עפ"י Baselga וחב' ב-N Eng J Med משנת 2012). בקבוצת החולות שטופלו עם פרג'טה אף הודגם שיפור מובהק בשיעור התגובה לטיפול ובאיכות החיים של המטופלות בהשוואה לטיפול המקובל (Baselga וחב' בכינוס ASCO בשיקאגו בשנת 2012).על בסיס נתונים אלו, פרג'טה בשילוב הרספטין וכמותרפיה, כקו טיפולי ראשון במחלה הגרורתית, מהווה את הסטנדרט הטיפולי החדש לחולות HER2 חיובי וכיום הינו המענה הטיפולי הטוב ביותר עבורן.
תכשיר אחר trastuzumab emtansine תוצרת Genetech (בארה"ב מכונה ado-trastuzumab emtansine, ושם מותג Kadcyla), הוא למעשה תצמיד (conjugate) המורכב מהרצפטין הקשור לתכשיר הציטוטוקסי mertansune (הידוע גם כ-DM1), החודר לתאים ומשמיד אותם על ידי שהוא נקשר ל-tubulin ומונע חלוקת תאים. כיוון שהרצפטין נקשר ל-HER2 המבוטא-ביתר בתאי סרטן, התצמיד מעביר את החומר הטוקסי באופן ספציפי לתאי סרטן, תוך צמצום החשיפההסיסטמית של הרקמות הבריאות, וכך מושגת יעילות גבוהה , לצד בטיחות וסבילות טובה ושיפור איכות החיים של המטופלות. הכינוי המקוצר של התצמיד הוא T-DM1. בניסוי הפאזה EMILIA-III, השתתפו 991 נשים עם סרטן שד מתקדם מסוג +HER2, שגילו עמידות לטיפול קודם בהרצפטין ובטקסן. נמצא שתכשיר מצומד זה, האריך את הישרדותן ב-5.8 חודשים (30.9 חודשים לעומת 25.1 חודשים, HR=0.68 ומובהקות של p<0.001), בהשוואה לטיפול משולב ב-lapatinib ו-capecitabine.
לאחר שנתיים נמצא ש-64.7% מהמטופלות שקיבלו Kadcyla נותרו בחיים, לעומת 51.8% בלבד בקבוצת הביקורת. בנוסף, Kadcyla הביאה להארכת משך הזמן החציוני עד להתקדמות המחלה ב-50%, בהשוואה לקבוצת הביקורת (9.6 חודשים לעומת 6.4 חודשים, HR=0.65 ומובהקות של p<0.0006). בקבוצת החולות שטופלה ב-Kadcyla הודגם שיפור בשיעור התגובה הכללי לטיפול: 43.6% לעומת 30.8%, במובהקות סטטיסטית של p<0.001, וכן הארכת משך התגובה החציוני ב-6.1 חודשים בהשוואה לקבוצת הביקורת, מ-6.5 ל-12.6 חודשים. בהתבסס על תוצאות ניסוי EMILIA III, אישר ה-FDA את השיווק והטיפול עם Kadcyla ב-22 בפברואר 2013, וגופים מקצועיים בינלאומיים ממליצים על תכשיר זה כטיפול קו שני המועדף לחולות סרטן שד גרורתי HER2 חיובי .
תכשיר נוסף, NeuVax, תוצרת Galena Biopharma, מבוסס על אימונותרפיה על ידי פפטיד המכוון את תאי T-killer לפגוע ולהשמיד תאי סרטן המבטאים HER2. תכשיר זה נמצא בשלהי ניסויים קליניים ב-phase III.
מנגנון פעולת הרצפטין
הנוגדן החד-שבטי trastuzumab הוא נוגדן רקומביננטי המורכב מ-2 אתרי קישור, הנצמדים באופן סלקטיבי לחלק החוץ-תאי של HER2, ובכך הוא מונע את דימריזציה של HER2 ובכך את הפעלת הקולטן. מספר מנגנונים מוצעים דרכם יכול trastuzumab לפעול להפחתת האיתות התוך תאי:
- Trastuzumab מונע את הביקוע של החלק החוץ-תאי של HER2, האמור להותיר חלבון p95 במצב מזורחן, שמסוגל להפעיל מסלולי איתות תוך-תאיים. התקשרות trastuzumab למקטע של HER2 הסמוך לממברנה גורמת להפחתה של שחרור החלק החוץ-תאי המבוקע של הקולטן, ומקטינה את ההצטברות של השייר p95.
- הנוגדן trastuzumab עשוי למנוע פיזית את ההומודימריזציה או ההטרודימריזציה הקריטיים לשפעול הקולטן, ובכך להפחית את האיתות התוך-תאי בו מעורב HER2.
- trastuzumab מעודד אנדוציטוזה ופירוק של הקולטנים של HER2, ובכך מסוגל להפחית את כמות HER2 הבאה לביטוי על פני ממברנת התאים הסרטניים.
- תאי מערכת החיסון האדפטיבית יכולים להיות מגויסים על ידי חשיפתם למקטע Fc של הנוגדן trastuzumab, באופן בו לימפוציטים מסוג T המזהים את מקטע ה-Fc יופעלו, ויפרישו חומרים טוקסיים שיגרמו לפגיעה בתאים הסרטניים המבטאים ביתר את HER2.
- הרצפטין משפיע במידה מועטה על אנגיגנזה-מפחית קוטר כלי-דם קיימים ומפחית יצירת כלי-דם חדשים.
יחסי הגומלין בין HER2 לבין הקולטנים להורמונים
גידולי סרטן השד המכילים כמות גדולה של קולטנים לאסטרוגן (ER) או לפרוגסטרון (PR) הם בדרך כלל פחות אלימים ומגיבים היטב לטיפול הורמונאלי. כ-70% מתאי סרטן השד מכילים קולטנים אלה. תאים שהם חיוביים ל-HER2 מכילים בדרך כלל פחות קולטנים של הורמונים, אך חלקם מגיבים אף על פי כן לטיפול הורמונאלי כגון טיפול בטמוקסיפן, ב-letrozole, ב-anastrozole (שם מותג Arimidex) או ב-exemestane (שם מותג Aromasin).
דווח על כך שמטופלות שתאי סרטן השד שלהן מכילים קולטנים לאסטרוגן והם גם חיוביים ל-HER2, מגיבות טוב יותר לתכשירים המעכבים של המסלול התוך תאי של PI3K/AKt, בהשוואה לאלו שתאי סרטן השד שלהן אינם מכילים קולטנים לאסטרוגן אך הם חיוביים ל-HER2.
הביטוי של HER2 מווסת על ידי איתות המועבר דרך הקולטנים לאסטרוגן. באופן נורמאלי, estradiol ו-tamoxifen הפועלים דרך הקולטנים לאסטרוגן, גורמים לשיכוך (down regulation) של ביטוי HER2. יחד עם זאת, כאשר עולה היחס בין ה-AIB-3 coactivator לבין PAX2 corepressor, עולה הביטוי של HER2 בתאים בנוכחות טמוקסיפן, מה שמביא לעמידות של התאים לטיפול בטמוקסיפן. ראיות עדכניות כורכות איתות של HER2 בעמידות תאי הסרטן לנוגדן החד שבטי cetuximab, המכוון כנגד ה-EGFR.
סוגי סרטן שד שהם +ER, המכילים קולטנים לאסטרוגן ולפרוגסטרון
כ-75% מכלל סרטני השד הם +ER. הם משגשגים בתגובה לאסטרוגן הנקשר אליהם, ומתוך אלה כ-65% הם גם +PR, דהינו גם פרוגסטרון נקשר אליהם, ובהתאם משגשגים בהיקשר אליהם פרוגסטרון. תאי סרטן שד שהם +ER/PR, הם בעלי סיכוי של 60% להגיב לתרפיה אנדוקרינית. לעומתם, תאי סרטן השד שהם שליליים לשני הורמונים אלה, הם בעלי סיכוי של 5-10% להגיב לתרפיה זו. טיפול אנדוקריני בסרטן השד ניתן בדרך כלל לאחר הניתוח להסרת הגידול, או לאחר הטיפולים הנלווים הכימותרפי או ההקרנה הסתיימו, ותפקידו לסייע במניעת חזרת המחלה, על ידי חסימה של השפעת האסטרוגנים.Tamoxifen - היא התרופה האנטי-סרטנית הממוקדת הראשונה הפועלת כאנטגוניסט של הרצפטור לאסטרוגן, ועשויה לעכב התפתחות של סרטן שד המבטא רצפטורים לאסטרוגן, בנשים עם סיכון גבוה.
טמוקסיפן ניתן כטיפול בחלק מהנשים לפרק זמן של עד 5 שנים, מתחילת הטיפול בסרטן השד. תכשירים ממשפחת מעכבי האנזים aromatase, גורמים להפסקת הסינתזה של אסטרוגן בנשים בגיל המעבר, אך אינם מורשים לנשים בגיל הפוריות. סרטן שד Triple negative, מופיע ב-20-25% מכלל המקרים 1, מגיב בדרך כלל היטב לטיפול כימותרפי, אך זהו סרטן השד האלים ביותר, עם הפרוגנוזה הגרועה ביותר בהשוואה לסוגי סרטן השד האחרים.
טיפול אנטי-סרטני מכוון
כאשר סרטן שד מתגלה, למרות טיפולים כגון ניתוח להסרת הגידול, כימותרפיה והקרנות, קיים סיכון לחזרתו של הגידול, כאשר ב-50% מקרי חזרת המחלה יתרחשו במהלך 5 השנים הראשונות לאחר ההחלמה, ואף בשנים שלאחר מכן קיים עדיין סיכון לחזרת המחלה ב-2-5% מדי שנה. סיכון זה קשור בין היתר למאפיינים ביולוגיים של סרטן השד, כגון מציאות קולטנים להורמונים כאסטרוגן ופרוגסטרון, דרגת ההתמיינות של תאי הגידול, וקולטנים מסוג HER2.
העיקרון העומד מאחורי טיפולים סרטניים ממוקדים הוא השימוש בחומרים בעלי פעולה ספציפית ובלעדית לתאים הסרטניים. טיפולים אלה מנצלים תופעה ביולוגית אופיינית לתאי הגידול, ויכולה לכן להוות מטרה לטיפול שהוא סלקטיבי לתאי הגידול, ללא פגיעה משמעותית ברקמה הבריאה. השיטה לחלוקת תאי סרטן שד על פי תכנות ביולוגיות היא היתר לסווג אותם על פי הקולטנים שעל פניהם:
- נוכחות מוגברת של קולטנים לאסטרוגנים או לפרוגסטרון (ER/PR positive);
- HER2 positive;
- Triple negative, דהינו חסר של קולטנים לאסטרוגן, לפרוגסטרון ול-HER2;
- Triple positive, כאשר קולטנים לאסטרוגן, פרוגסטרון ו-HER2 מצויים ביתר.
טיפולים בהרצפטין
בנשים עם ביטוי-יתר של HER2, שמחלתן גרורתית, הביא הטיפול בהרצפטין למפנה משמעותי בהתקדמות בהתמודדות עם המחלה, וממילא האריך את תוחלת חייהן. כבר בשנת 2001 קבע Slamon במאמר ב-N Eng J Med, שהרצפטין במשולב עם כימותרפיה יעיל בשיפור מדדים קליניים של נשים עם סרטן שד גרורתי, מעבר להארכת חיים, שיפור שיעורי התגובה ומשך הזמן ללא התקדמות המחלה. אותו חוקר אישש ממצא זה במאמר משנת 2004 ב-J Natl Cancer Inst. בשנת 2010 התפרסמו ב-J Clin Oncol תוצאות מחקר HERCULES על ידי Untch וחב', בו נמצא שטיפול משולב של הרצפטין עם כימותרפיה (epirubicine וציקלופוספאמיד) האריך את פרק הזמן שעבר עד התקדמות המחלה. ב-2005 התפרסם בכתב העת האחרון מחקר M77001, על ידי Marty וחב', בו נמצא שתוספת הרצפטין לטיפול ב-docetaxel, האריך את משך הישרדות ואת משך הזמן ללא התקדמות המחלה, כאשר שילוב של מתן סימולטאני של 2 תרופות אלו בניסוי HERTAX שדווח על ידי Hamberg וחב' ב-2011 ב-Clin Breast Cancer, נמצא יעיל יותר בהארכת הזמן הנדרש להתקדמות המחלה, בהשוואה למתן קודם של הרצפטין כאשר רק אחריו ניתן טיפול ב-docetaxel.
באוקטובר 2005 התפרסמו צמודים זה לזה ב-N Eng J Med שני מחקרים רחבי-היקף שדנו במשמעות הטיפול בהרצפטין בנשים עם סרטן שד המבטא HER2. המאמר הראשון מבין השניים של Piccart-Gebhart ואחרים, בו תואר מחקר HERA שהיה מחקר אקראי בינלאומי ורב-מוסדי, שהִשווה תוצאות טיפול אחת ל-3 שבועות ב-trastuzumab למשך שנה, שניתן לנשים עם סרטן שד חיובי ל-HER2, עם או בלי מעורבות קשרי לימפה, שכבר עברו ניתוח להסרת הגידול ולפחות 4 מחזורי טיפול כימותרפי.
בניסוי זה, 1,694 נשים יועדו לטיפול בן שנתיים בהרצפטין, 1,694 נשים יועדו לטיפול של שנה אחת בתרופה, וקבוצת ביקורת כללה 1,693 נשים שלא טופלו. במאמר זה דווחו רק תוצאות הטיפול עם trastuzumab למשך שנה, בהשוואה לקבוצת הביקורת הבלתי מטופלת: בפרק זמן של שנה אובחנו 347 אירועים (הישנות המחלה, הופעת מחלה בשד הנגדי, מחלה סרטנית ממאירה שנייה שלא ממקור שד, או מוות). מתוך אירועים אלה, 127 אירועים התרחשו בקבוצת המטופלות ב-trastuzumab, לעומת 220 אירועים בקבוצת הביקורת. יחס הסיכון (HR) הבלתי מתואם לאירוע בקבוצת המטופלות בתרופה היה 0.54בהשוואה לקבוצת הבלתי מטופלות (0.0001p<) מה שמבטא יתרון בולט במושגים של תקופת הישרדות ללא-מחלה. למרות שבקבוצת המטופלות ב-trastuzumabנרשמו בתום שנה אחת 29 מקרי מוות, לעומת 37 פטירות בקבוצת הביקורת, לא השיג הפרש זה בפטירות משמעות סטטיסטית. רק ב-0.5% מבין הנשים המטופלות עם trastuzumab, נמצאה השפעה טוקסית משמעותית ללב. יש להוסיף שרק במשך מעקב חציוני של שנה (One year mFU)לא נצפה הבדל סטטיסטי מובהק בהישרדות הכוללת, אך במשך מעקב חציוני של שנתיים, ההבדל היה מובהק סטטיסטית.
מאמר שני באותו כתב עת של Romond ואחרים, דווח במרוכז על תוצאות 2 ניסויים שנערכו בארה"ב בהשתתפות של כ-3,000 נשים, שהִשוו תוצאות טיפולים כימותרפיים עם או ללא שילוב של trastuzumab, בנשים עם סרטן שד לאחר ניתוח להרחקתו, ותאי סרטן חיוביים ל-HER2. בניסוי הראשון (The National Surgical Adjuvant Breast and Bowel Project trial, B-31) הִשוו טיפולים ב-doxorubicine וציקלופוספאמיד מלווה עם טיפול ב-paclitaxel אחת ל-3 שבועות, לטיפול זהה בכימותרפיה בתוספת 52 שבועות של טיפול ב-trastuzumab. בניסוי השני ( The North Central Cancer Treatment Group trial N9831) הִשוו 3 סוגי טיפול: קבוצת אחת טופלה ב-doxorubicine וציקלופוספאמיד, מלווה ב-paclitaxel אחת ל-3 שבועות, קבוצה שנייה טופלה באותו תפריט כימותרפי בתוספת 52 שבועות של trastuzumab שהחל לאחר הטיפול ב-paclitaxel, וקבוצה שלישית עם פירוט תכשירים זהה לזה שניתן בקבוצה השנייה, אלא שכאן הטיפול ב-trastuzumab ניתן ביחד עם הטיפול ב-paclitaxel. ממחקר זה נלמד שעדיף ככל הנראה לטפל בהרצפטין סימולטאנית עם הכימותרפיה ולא לאחריה.
בתאריך 15 במרץ 2005 כבר נרשמו במהלך הניסויים 394 אירועים (הישנות המחלה, הופעת גידול שד ראשוני במיקום אחר, או מוות לפני הישנות המחלה), מה שהביא להערכת ביניים של הממצאים. מבין האירועים הללו, 133 נרשמו בקבוצת ה-trastuzumab, ואילו 261 אירועים נרשמו בקבוצת הביקורת, עם יחס סיכון בקבוצת trastuzumab של 0.48 עם p<0.0001, דהינו הפחתה של 52% בהישנות המחלה. ההבדל המוחלט בהישרדות ללא-מחלה בין קבוצת הטיפולים ב-trastuzumab פלוס כימותרפיה, בהשוואה לקבוצת הכימותרפיה בלבד, היה של 12% מקץ 3 שנים. תוספת trastuzumab לכימותרפיה, מאפשרת הפחתה של 33% בסיכון למוות (p=0.015), ואילו ההתרחשות של אירועי אי-ספיקת לב (class III or IV) או מוות מסיבה לבבית, הייתה של 4.1% בניסוי B-31, ו-2.9% בניסוי N9831.
ניסוי נוסף (BCIRG 006) שתוצאותיו דווחו על ידי Slamon ב-2011 ב-N Eng J Med, הראה שטיפול משך 52 שבועות ב-trastuzumab בשילוב עם כימותרפיה, נמצא יעיל בהארכת פרק הזמן ללא מחלה וכן בהארכת ההישרדות בכלל במטופלות עם שלבי מחלה מוקדמים ותאי סרטן שד חיוביים ל-HER2. תוצאה זו התקבלה כאשר הכימותרפיה התבססה הן על anthracyline או על טיפול לא-אנטרציקליני.
ניסוי HERA
בשנת 2012 התפרסמו ב-Lancet Oncology על ידי Gianni ואחרים ממצאי ניסוי HERA או HERceptin Adjuvant, שבחן יעילות של טיפולים כימיים והקרנות לאחר ניתוח, עם וללא טיפול המשך בהרצפטין, למשך שנה או שנתיים, בנשים עם שלבים מוקדמים של המחלה, ותאים חיוביים ל-HER2. ניסוי זה נועד למעקב של 4 שנים. ניסוי HERA נחשב לניסוי רחב ההיקף בתחום סרטן השד בעולם, ניסוי Phase III בינלאומי שהקיף 39 מדינות, רב-מוסדי (480 מרכזים רפואיים כולל 16 מרכזים בישראל), וכלל 5,102 נשים חולקו באופן אקראי ל-3 קבוצות בגודל שווה כאשר קבוצה אחת טופלה שנתיים באופן יחידני בהרצפטין, קבוצה שנייה טופלה שנה אחת באופן יחידני בהרצפטין, וקבוצה שלישית לא טופלה בתרופה. הטיפול ניתן בעירוי תוך-ורידי אחת ל-3 שבועות. כל משתתפות הניסוי אובחנו עם סרטן שד בשלב מוקדם, חיובי ל-HER2, שכבר טופלו בכימותרפיה והקרנות, והיו לפני או אחרי ניתוח להרחקת הגידול. ניסוי HERA לא הגביל את סוג הטיפולים הכימותרפיים, וגויסו אליו נשים עם ממצאים חיוביים או שליליים בבלוטות הלימפה.
נקודות יעד (endpoints) של מבחן HERA כללו את משך זמן ההישרדות הכולל (overall survival), את משך הזמן של חיים ללא מחלה חוזרת (relapse-free survival), ופרק הזמן ללא הופעת מחלה מרוחקת מהשד (distant disease free survival) ופרק הזמן שחלף עד להישנות המחלה (disease recurrence). כמו כן נבחן הפרופיל הבטיחותי של הטיפול בהרצפטין.
הפרופיל הבטיחותי בניסוי HERA
לא נרשמו במהלך ניסו HERA ממצאים טוקסיים יוצאי דופן. באופן כללי, שכיחות האירועים של פגיעה בתפקוד הלב הייתה נמוכה בכל המטופלות. שיעור המקרים של אי-ספיקת לב תסמינית שיכולה לבוא לביטוי בקוצר נשימה היה פחות מ-1%. בנוסף, כצפוי מספר תופעות הלוואי היה גדול יותר בקרב נשים שטופלו בהרצפטין משך שנתיים בהשוואה לטיפול בן שנה אחת. הירידה במקטע הפליטה (ejection fraction) של חדר הלב השמאלי, הייתה בשיעור של 7.2% במטופלות בהרצפטין משך שנתיים, 4.1% במטופלות בתרופה שנה אחת, ו-0.9% בקבוצת הביקורת של הלא-מטופלות.
תוצאות ניסוי HERA
בבחינת משכי הטיפול שנבחנו, מסתבר שטיפול בהרצפטין למשך שנה נותר הטיפול המומלץ לנשים עם מחלה מוקדמת חיוביות ל-HER2. תוצאות המחקר גם מצביעות על כך, שלאחר תקופת מעקב חציונית של 8 שנים, השיפור בתקופת ההישרדות ללא מחלה, כמו גם משך ההישרדות הכללי בנשים שטופלו בהרצפטין היה ארוך משמעותית בשני פרקי-זמן אלה בנשים חולות עם מאפייני מחלה דומים, אך ללא טיפול בהרצפטין.
בקטגוריה של משך זמן ללא מחלה נרשמה ירידה של 24% למחלה חוזרת במטופלות בהרצפטין למשך שנה אחת, בהשוואה ללא-מטופלות (p<0.0001). לא היה כל הבדל בקריטריון זה בין טיפול בהרצפטין למשך שנה אחת או למשך שנתיים (HR=0.99; p=0.86). בקטגוריה של משך תקופת ההישרדות הכללי, נמצאה גם כן ירידה בסיכון לתמותה של 24% בקבוצת המטופלות בהרצפטין משך שנה אחת, בהשוואה לקבוצת הביקורת של לא-מטופלות בתרופה זו (p<0.0005). לא היה הבדל סטטיסטי משמעותי בקריטריון זה בין המטופלות בהרצפטין למשך שנה, לבין מטופלות בתרופה זו משך שנתיים (HR=1.05; p=0.63).
יצוין, ששנה מתחילת ניסוי HERA וקבלת הממצאים הראשונה, ביקשו כ-50% מהנשים המשתתפות בניסוי, שנכללו במקור בקבוצת הביקורת הבלתי מטופלת בהרצפטין, "לחצות את הקווים" ולאפשר קבלת טיפול של שנה בהרצפטין. גם לגבי נשים אלה, בהן הוחל הטיפול באיחור של שנה, נמצאו משכי הישרדות משופרים.
ממצאי ביניים של ניסוי HERA דווחו באופן מקורי כבר ב-2005, כאשר נקבע בניתוח ביניים של התוצאות שהטיפול בהרצפטין תאם את נקודת הציון העיקרית שלו בהארכת פרק הזמן ללא ממחלה (HR=0.54; p<0.0001) בנשים מטופלות משך שנה בהשוואה לקבוצת הביקורת של לא-מטופלות. בהתבסס על נתוני ניסוי HERA וכן שלושת הניסויים האחרים שהוזכרו, NSABP B-31, וכן NCCTG N9831 ו-BCIRG 006, בהם נכללו במקובץ למעלה מ-13,000 נשים, אושר טיפול בן שנה אחת בהרצפטין על ידי גופים רפואיים מובילים, לנשים עם סרטן שד חיובי ל-HER2, בשלביו המוקדמים.
בתאריך 1 באוקטובר 2012 פרסמו בבאזל חברת ROCHE ו-BIG או Breast International Group, מסמך לסיכום ניסוי HERA. הדגש לגבי מסקנות ניסוי HERA הוא בקביעה שטיפול בהרצפטין למשך שנה הוא פרק הזמן האופטימאלי לטיפול בתרופה זו, וכמובן הסיכוי הממשי להארכת חיי המטופלות, זאת על פי Hal Baron, המנהל הרפואי של ROCHE. גם Martine Piccart, היו"רית של BIG, והנשיאה של הארגון האירופי לטיפול בסרטן (EORTC), מדגישה במסמך זה את החיוניות שבקביעת משך הטיפול האופטימאלי בהרצפטין. ניסויים לבחינת משך טיפול קצר יותר כגון PHARE או FINHER או HORG לא הצליחו להוכיח יתרון או non-inferiority מול טיפול של שנה.
ניסויים קליניים מאוחרים עם הרצפטין
כדאי לציין ניסויים נוספים שבחנו את יעילות הטיפול בהרצפטין: בשנת 2009 התפרסמו ב-J Clin Oncol תוצאות מחקר FinHer על ידי Joensuu וחב', ניסוי שנערך בקרב 1010 נשים בפינלנד, מאובחנות עם סרטן שד עם או בלי נגיעוּת של בלוטת הלימפה בבית השחי. נשים אלה עברו שלושה מחזורי טיפול ב-doxetaxel או ב-vinorelnine, כאשר שתי קבוצות טיפול אלה עברו בהמשך 3 מחזורי טיפול ב-fluorouracil, epirubicin וציקלופוספאמיד. מתוך מדגם זה, 232 מטופלות עם סרטן חיובי ל-HER2, חולקו ל-2 קבוצות: כאלה שטופלו משך 9 שבועות עם הרצפטין וכאלה שלא טופלו בתרופה זו.
בתת הקבוצה של מטופלות עם הרצפטין, נמצא שיפור משמעותי לגבי מדד DDFS או distant disease–free survival, ולא פחות משמעותי הממצא שהמטופלות בהרצפטין לא הביא לשינוי במקטע הפליטה של החדר השמאלי לאחר תקופת מעקב של 5 שנים, כאשר רק מטופלת אחת עם הרצפטין אכן אובחנה עם אי ספיקת לב.
בשנת 2011 התפרסמו ב-J Clin Oncol על ידי Andersson וחב' ממצאי ניסוי HERNATA, שגם הם מצביעים על כך שטיפול משולב של הרצפטין עם vinoralbine או עם docetaxel כטיפול קו-ראשון במחלה גרורתית חיובית ל-HER2 משפר את משך ההישרדות הכולל, ואת פרק הזמן החציוני הנדרש להתקדמות המחלה. באותו כתב-עת פרסמו Valero וחב' בשנת 2011, את ממצאי ניסוי BCIRG 007, בו נמצא שטיפולים משולבים של הרצפטין עם docetaxel, או הרצפטין עם docetaxel פלוס carboplatin, יעילים מאוד בהארכת משך הזמן להתקדמות המחלה, כמו גם זמן ההישרדות הכללי, וכן קבילים מבחינה בטיחותית. יצוין, ש-Vogel וחב' פרסמו באותו כתב עת כבר ב-2002 שהרצפטין בעצמו יעיל כטיפול קו-ראשון במחלה מפושטת חיובית ל-HER2.
טיפול בהרצפטין בשילוב עם טיפול הורמונאלי
בשנת 2009 פרסמו בלה קאופמן מהמכון האונקולוגי במרכז הרפואי שיבא, וחוקרים מקנדה, גרמניה, הודו, אנגליה, רוסיה ואנשי Hoffmann-La-Roche בבאזל, את תוצאות ניסוי, בו הושווה טיפול משולב של הרצפטין עם התכשיר מעכב האנזים ארומטאזה, anastrozole, עם טיפול יחידני ב-anastrozole, בנשים בגיל המעבר עם סרטן שד מפושט חיובי ל-HER2, וחיובי לקולטנים לאסטרוגנים. ניסוי phase III אקראי זה תחת השם TAnDEM, הוא ראשון מסוגו בו ניתן הרצפטין במשולב עם תכשיר מעכב סינתזת אסטרוגנים, ללא כימותרפיה.
לניסוי TAnDEM גויסו 207 נשים בגיל המעבר שחולקו אקראית ל-2 קבוצות: 104 מהן קבלו הרצפטין ואנסטרוזול, ואילו 103 קבלו אנסטרוזול בלבד. הטיפולים כללו מתן פומי יומי של אנסטרוזול, עם או ללא הרצפטין בעירוי תוך-ורידי של 4 מיליגרם/ק"ג ביום הראשון, מלווה על ידי עירוי של 2 מיליגרם/ק"ג אחת לשבוע, עד לנקודה של התקדמות המחלה, שהייתה נקודת הייחוס הראשונית (progression free survival).
תוצאות ניסוי זה הראו בנשים בזרוע הטיפול המשולב שיפור משמעותי ב-PFS, בהשוואה לאלו שקבלו אנסטרוזול בלבד. ה-HR שנקבע היה 0.63 עם PFS ממוצע של 4.8 חודשים לעומת 2.4 חודשים בטיפול היחידני (p=0.0016). השכיחות של תופעות לוואי בדרגה 3 ו-4 הייתה 23% ו-5%, בהתאמה, בזרוע של הטיפול המשולב, ואילו בטיפול היחידני באנסטרוזול, שכיחות תופעות הלוואי בדרגה 3 ו-4, הייתה 15% ו-1%, בהתאמה. מטופלת אחת בזרוע הטיפול המשולב חוותה אי ספיקת לב (CHF) בדרגה של NYHA class II.
טיפול מקדים עם הרצפטין כ-neoadjuvant
הטיפול בהרצפטין כתוספת לטיפול כימותרפי מקובל נמצא יעיל גם בשלב הקדם-ניתוחי במדד pCR של היעלמות המחלה . מעקב אחר תוצאות של ניסוי GeparQuattro, מצא שתגובה קלינית טובה יותר לעומת לפטיניב (מחקר ג'אפר קווינטו) הושגה כאשר trastuzumab הוסף לכימותרפיה במסגרת טיפול נאו-אג'ובנטי הן כאשר כימותרפיה הייתה על בסיס אנתרציקלינים או שהייתה על בסיס taxane, על פי Untch וחב' במאמרם משנת 2010 ב-J Clin Oncol. ממצא זה אושש במחקרים נוספים בהם הושגה הפוגה ממושכת יותר בטיפול נאו-אג'ובנטי עם הרצפטין. מחקרים אלה כוללים את הניסוי של Buzdar וחב' שפורסם ב-2005 ב-J Clin Oncol, בו השתתפו 164 נשים עם סרטן שד הניתן לניתוח מסוג +HER2, אשר חולקו ל-2 קבוצות: קבוצה אחת טופלה קדם-ניתוחית עם paclitaxel ו-epirubicin, כאשר הקבוצה השנייה טופלה אחת לשבוע תוספת של trastuzumab למשך 24 שבועות, לטיפול הכימותרפי הקדם-ניתוחי.
במהלך הניסוי נבחנו תוצאות הביניים של המטופלות, ונמצאה נסיגה פתולוגית מלאה בשיעור של 25% בקרב המטופלות טיפול כימותרפי בלבד, לעומת נסיגה דומה במהלך המחלה בקבוצת המטופלות עם תוספת של trastuzumab לטיפול הכימותרפי. ממצאי ביניים אלה, הביאו להחלטה להפסיק את הניסוי במתכונת המקורית, ולטפל בכל המשתתפות בו על פי הפרוטוקול הכולל תוספת trastuzumab. תוצאות דומות התקבלו בניסוי של Limentani וחב' שהופיע ב-2007 ב-J Clin Oncol, לגבי שילוב נאו-אג'ובנטי של docetaxel ו-vinorelbin להם הוסף trastuzumab טרם הניתוח, וכן בניסוי רב-מוסדי של Pierga וחב' שהופיע בשנת 2010 ב-Breast Cancer Res Treatment, בו טופלו נשים עם סרטן שד מקומי-מתקדם באופן ראשוני על ידי שילובים של epirubicin/cyclophosphamide מלווים בטיפול ב-docetaxel עם או ללא celecoxib ו-trastuzumab.
גם ניסוי NOAH שתוצאותיו דווחו על ידי Gianni וחב' ב-Lancet בשנת 2010, בחן את השפעת הוספה של trastuzumab לכימותרפיה כ-neoadjuvant, שנמצאה יעילה בהארכת פרק הזמן של הישרדות ללא-אירועים וגם בהישרדות הכוללת במקרים של סרטן שד גרורתי-מקומי, חיובי ל-HER2.
פרופיל הפגיעה הלבבית של trastuzumab
מאז ומתמיד הייתה מוכרת הטוקסיות הקרדיאלית של טיפולים כימותרפיים מבוססים על אנתרציקלינים. המנגנון של הפגיעה הטוקסית של doxorubicin כרוך בנזק ישיר למיוציטים הקרדיאלים, על ידי הגברת הריכוז של רדיקאלים חופשיים, ומכאן עקה חמצונית הקרדיו-טוקסיות של doxorubicin שהיא בעיקרה בלתי הפיכה, שגורמת קלינית לירידה במקטע הפליטה (ejection fraction) של חדר הלב השמאלי, כשלב מקדים לתסמינים של CHF.
בניגוד ל-doxorubicin, הטיפול ב-trastuzumab גורם לנזק הפיך למיוציטים הקרדיאלים, וזאת כיון שתרופה זו אינה גורמת לנזק מבני למיוקרדיום, מה שמשתמע ממחקרם של Ewer וחב' שהתפרסם ב-2005 ב-J Clin Oncol. המנגנונים על פיהם גורם trastuzumab נזק לרקמת הלב, עדיין אינם ברורים במלואם. יש הערכה שמדובר בשילוב של עקה חמצונית מוגברת, ביחד עם עיכוב של תהליכים אנטי-אפופטוטיים בתאים כפי שמעריכים Zeglinski וחב' במאמרם משנת 2011 ב-Exp Clin Cardiol. ההגברה של העקה החמצונית נובעת כנראה מעיכוב פעילות האנזים NADPH oxidase.
בנוסף, מחקרים הראו שחסימת הקולטן של HER2 על ידי trastuzumab, מגדילה את היחס בין חלבונים תומכי-אפופטוזיס לבין חלבונים נוגדי-אפופטוזיס, מה שגורם לתהליכי אפופטוזיס ולקיצור משך חיי התא כפי שסבורים Grazette וחב' במאמרם משנת 2004 ב-J Am Coll Cardiol. אך תיאוריה זו אינה מסבירה את ההבדל בהשפעה הקרדיו-טוקסית של trastuzumab ושל doxorubicin. על פי Robert וחב' במאמר משנת 2005 ב-J Clin Oncol, טיפול משולב של כימותרפיה בתכשירים ממשפחת ה-taxanes ו-trastuzumab, גורמת לנזק טוסי מופחת לרקמת הלב, מאשר בטיפול יחידני ב-taxanes. במאמר ב-Clin Breast Cancer ב-2007 מונים Ewer וחב' את גורמי הסיכון הכרוכים בהגברת הנזק הטוקסי של Trastuzumab לרקמת הלב. מדובר בגיל מטופלות שמעל 50 שנה, שימוש סימולטאני באנתרציקלינים, יתר לחץ-דם, ורמת מקטע פליטה של החדר השמאלי שבין 50-54%.
בסך הכול, הפגיעה הלבבית בעקבות טיפול בהרצפטין היא באחוזים נמוכים, גם במשכי מעקב ארוכים. קיים אלגוריתם למעקב התפקוד הלבבי, על ידי בדיקת אקו לב או MUGA, עאשר מטרתה לאתר פגיעה לבבית עוד בשלב המעבדתי שלה (ירידה ב-LVEF) למנוע הופעת מצב סימפטומטי.
עמידות ל-trastuzumab
מאז שהתגבר השימוש ב-trastuzumab במקרי סרטן שד חיובי ל-HER2, לא ניתן היה להתעלם מהמקרים בהם התגובה לטיפול זה הייתה חלקית או חסרה לחלוטין. נראה שבתת-קבוצה של מטופלות קיימת עמידות לתרופה זו, אם כי אטיולוגיה ברורה לעמידות זו לא זוהתה. עלו מספר השערות, כמו זו של Scaltriti וחב' משנת 2007 ב-J Natl Cancr Inst, לפיה באותם מקרים של עמידות יתכן שמדובר בקולטנים קטומים (truncated) ל-trastuzumab, בהם החלק החיצוני של הקולטן חסר, וממילא אין מתאפשרת התקשרותו של trastuzumab לקולטן זה. אותם תאים עם הקולטן "הפגום" כן הגיבו לטיפול ב-lapatinib שהוא מעכב את פעילות טירוזין קינאזה בשני הקולטנים, HER2 ו-EGFR. אמנם, Konecny וחב' במאמר משנת 2006 ב-Cancer Res, הדגימו ש-lapatinib היה יעיל קלינית בטיפול במקרים של סרטן שד שהראו עמידות להרצפטין. יש לציין שבמאמר זה ההדגמה של יעילות לפטיניב היתה על שורות תאים ולא קלינית במטופלים.
בדיקת HER2
בדיקות של HER2 נערכות לחולות סרטן שד כדי להעריך פרוגנוזה והתאמה לטיפול בתרופות הממוקדות ל-HER2, המוגבל רק לחולות שיש להן HER2 חיובי. לרוב נעשות הבדיקות על סמך דגימות רקמה הנלקחות באמצעות ביופסיית שאיבת מחט (core-needle biopsy), ביופסיית מחט (FNA), ביופסיית ואקום או במסגרת הסרה ניתוחית של הגידול. הערכה כמותית של הימצאות החלבון HER2 נעשית באמצעות אימונוהיסטוכימיה (IHC) בעזרתה מודדים את רמת החלבון HER2 בדגימה. שיטה אחרת היא FISH (Fluorescence in situ hybridization), ומאפשרת באמצעות סמנים פלואורסצנטיים לאמוד בדגימה את מספר העותקים של הגן.
תוצאות בדיקת IHC יכולות להופיע כ-: 0 (תוצאה שלילית); +1 (נחשבת אף היא שלילית); +2 (תוצאה גבולית); +3 (תוצאה חיובית המבטאת ביטוי-יתר של HER2). אם מתקבלת תוצאה גבולית של +2, מומלץ לבצע בדיקה ברמת דיוק גבוהה יותר כמו בדיקת FISH, או בדיקות SPoT-Light HER2 CISH או בדיקת Inform HER2 Dual ISH , להקל בזיהוי מטופלות עם רמת HER2 גבולית שיכולות להפיק תועלת מטיפול בהרצפטין. כ-20-25% מבדיקות HER2 הממשיכות ל-FISH, נמצאות חיוביות ומעידות על התאמה לטיפול בהרצפטין.
שיטת FISH משמשת לאבחון וגילוי מקטעי DNA או RNA בחתך של רקמה נבדקת. בשיטה זו נעשה שימוש בגלאים (probes) פלואורסנטים הנקשרים באופן ספציפי למקטעי ה- DNA או ה- RNA אותם מבקשים לאבחן או לגלות. ניתן באמצעות שיטה זו לאבחן הגברה של גן מסוים או לאבחן טרנסלוקציה (שחלוף) של מקטעי DNA בין כרומוזומים שונים. האנליזה בשיטה זו מתבצעת תחת מיקרוסקופ פלואורסנטי.
בדיקת FISH עשויה לסייע למצוא מקרים בהם מספר עותקים גדול מדי של הגן ל-HER2 מופיע בתאי סרטן השד. ככל שמספר העותקים של HER2 גדול יותר, כן יהיה גדול יותר מספר הקולטנים ל-HER2 על פני תאי סרטן השד, והתאם יגדל מספר האותות (signals) שתאים אלה מקבלים מליגנדים הנקשרים אליהם ומעודדים את השגשוג של תאי הסרטן. תוצאת מבחן FISH יכולה להתקבל "חיובית" (HER2 gene amplification) או שלילית (no amplificatuion). אם ישנה כמות כפולה של עותקים לתא בהשוואה לתאי שד תקינים, התוצאה התקבלת היא "חיובי ל-HER2".
כללית, מבחן FISH אינו זמין במעבדות רבות, כאשר בדיקת IHC רווחת יותר, אם כי בדיקת FISH נחשבת מדויקת יותר מבין השתיים. במקרים רבים, המעבדה תבצע בתחילה מבחן IHC, ותבצע בהמשך בדיקת FISH, אם תוצאות מבדק IHC אינן נותנות תשובה החלטית האם מדובר בתאים חיוביים או שליליים ל-HER2.
מדידה של HER2 בנסיוב
הקצה החוץ-תאי של החלבון HER2 המשתרבב אל מחוץ לתא מהממברנה, עובר ביקוע ומשתחרר מתאי הסרטניים ומגיע לצירקולציה. ניתן למדוד את השייר של HER2 הזולג לדם בשיטת ELISA, באופן שאינו מצריך גישה פולשנית להשגת ביופסיה של הגידול מרקמת השד. תוצאות של מחקרים עד כה מצביעים על כך ששינויים ברמת HER2 הנמדד בנסיוב עשויים להיות שימושיים בניבוי התגובה לטיפול בהרצפטין. יחד עם זאת אין תמונה ברורה ומלאה ביחס ליכולת של בדיקת ELISA להחליט מי שראויה להיות מטופלת בהרצפטין. אם רמת HER2 בנסיוב גבוהה מעל 15 ננוגרם/מ"ל לפני תחילת הטיפול, ניתן להשתמש במדידת מולקולה זו בנסיוב להחליט האם יש ירידה ברמתה במשך הטיפול. מדידת HER2 בנסיוב יכולה להידרש כאשר אין מספיק חומר של רקמת גידול, שיאפשר מבדקים ישירים ברקמה לנוכחות HER2. יחד עם זאת יש לציין שלא קיימות הוכחות פרוספקטיביות המורות על שימוש בשיטת בדיקה זו להערכת תגובה או לחיזוי תגובה.
המלצות ASCO לגבי בדיקת HER2
- במקרה של אבחון של סרטן שד גרורתי, יש לבצע בדיקת סטאטוס של HER2 בחומר ממקור ביופסיה כדי לסייע בהחלטה האם טיפול ממוקד-HER2 היא חלופה נאותה. בנוסף, אם התהליך הסרטני התפשט לאזורי גוף אחרים, או אם המחלה חזרה לאחר טיפולים קודמים, בחינת הסטאטוס של HER2 מתחייבת אם בגידול ה"חדש" או באזורים אליהם המחלה התפשטה
- ניתן לבצע מבדק IHC או FISH, אם לבדיקות אלה יש תיקוף (validation), והן מתבצעות על ידי איש מעבדה מנוסה, כאשר המעבדה הפתולוגית נוהגת באופן עקבי על פי הנחיות מאושרות של בדיקה זו וכן באופן הדיר לפיו מטופלות בה דגימות ביופסיה
- אם תוצאת מבדק HERS מתקבלת גבולית, יש לחזור עליה או על דגימה חדשה מהגידול, או בשיטת זיהוי אחרת
- אם המבדק ל-HER2 מתקבל חיובי, מומלץ הטיפול בהרצפטין, lapatinib או כל תכשיר ממוקד HER2 אחר. אם המבדק ל-HER2 מתקבל שלילי הטיפול בתכשיר ממוקד HER2 אינו חלופה מתאימה
חובה לבצע בדיקת סטאטוס של HER2 במקביל לבדיקת הסטאטוס של קולטנים לאסטרוגנים ולפרוגסטרון
ביוני 2011 קבלה חברת ROCHE את אישור ה-FDA לשימוש ב-INFORM HER2 Dual ISH DNA Probe cocktail, שפותח על ידי Ventana Medical Systems. הבדיקה מיועדת לקבוע אם יש עותקים רבים מדי של הגן ל-HER2, ותוצאת מבדק זה יכולה להתקבל חיובית (אמפליפיקציה של הגן ל-HER2) או שלילית (חסר אמפליפיקציה). בדיקה זו זמינה כיום בערכה שניתנת לביצוע אוטומאטי, כאשר התוצאה מתקבלת תוך 12 שעות.
בדיקת SPoT-Light HER2 CISH או Subtraction Probe Technology Chromogenic In Situ Hybridization, מיועדת לבחון האם אין יותר מדי עותקים של הגן ל-HER2 בתאי סרטן השד. תוצאת מבדק זה יכולה להתקבל חיובית (אמפליפיקציה של הגן ל-HER2) או שלילית (חסר אמפליפיקציה של גן זה).
מבחן SPoT-Light HER2 CISH, אושר על ידי ה-FDA בשנת 2008, והוא נועד לקבוע באופן כמותי אמפליפיקציה של הגן ל-HER2 ברקמת שד שעברה פיקסציה בפורמלין, וקיבוע (embedding) בפרפין או ברקמה טרייה, אך לא ברקמה שהוקפאה, תוך שימוש במיקרוסקופ אור. ההוצאה העיקרית הכרוכה בטכניקת CISH, היא ברכישה של הערכות המאושרות על ידי ה-FDA, אך כיוון שזו אינה שיטה פלואורסצנטית, היא אינה כרוכה בשימוש במיקרוסקופ פלואורסצנטי, וזכוכיות הנושא ניתנות לבחינה ושימוש חוזר ותדיר. בחינה השוואתית של שיטות CISH ו-FISH, מראה התאמה מצוינת בין 2 השיטות. אי-זמינות של probe נפרד של כרומוזום 17 באותו חתך, עולה כנקודת ביקורת כלפי שיטת CISH.
עיקרון השיטה ומהלך הבדיקה
נעשה שימוש בגלאי (probe) של DNA מסומן ב-dogoxigenin, ספציפיים למיקום של הגן ל-HER2 על כרומוזום 17, באופן שגלאי זה עובר היברידיזציה עם חומצת גרעין משלימה (complemetary) המופיעה בדגימה סרטן השד. טכניקת CISH מאפשרת להעריך חריגות גנטיות במיקרוסקופיית "שדה בהיר" על ידי גילוי של כרומוגן בהגדלה X40. לאחר תהליך של דה-פרפיניזציה הדגימה מטופלת בחימום ולאחריו עיכול אנזימטי. לאחר שלב של דה-הידרציה, מוסיפים את ה-probe של HER2 לדגימה הנבדקת, ומכסים בזכוכית נושא. לאחר דה-נטורציה והיברידיזציה הנמשכת 10-18 שעות, נשטפת הדגימה כדי להרחיק probe שלא עבר היברידיציה, מתקבל אות מיקרוסקופי באופן כרומוגני על ידי הוספה דו-שלבית של נוגדן כנגד digoxigenin אליו קשור האנזים horseradish peroxidase. הצבע מתפתח עם הוספת המצע לאנזים כגון diaminobenzidine ומי חמצן.
בשלב הסופי נצבעת הדגימה עם Mayer’s hematoxylin לזיהוי מורפולוגי של הרקמה. האות של הגן ל-HER2 המתקבל במיקרוסקופ כנקודה חומה-כהה כאשר רמת גן זה נמוכה, או כצברים (clusters) של ניקוד חום-כהה כאשר ישנם עותקים רבים של הגן.
קיימת התאמה טובה בין תוצאות מבחן CISH לבין תוצאות מבחן FISH: ההתאמה במקרה של תוצאות חיוביות היא של 94.4%, וההתאמה במקרה של תוצאות שליליות היא של 100%. יש גם התאמה טובה של מבחן CISH לבין מבחן IHC: ההתאמה במקרה של תוצאות חיוביות היא של 84.2%, והתאמה במקרה של תוצאות שליליות היא של 97.6%.
קוקטייל ה-DDISH או Dual-chromagen/Dual hapten In-Situ hybridization), עושה שימוש ב-probes הן של HER2 של כרומוזום 17, לקבלת תמונה כרומגנית, על אותו פלח (section) של רקמת הגידול. יכולת הגילוי מושגת תוך שימוש בקומבינציה של ultraView SISH ו-UltraView Red ISH או משקע של חלקיקים כרומגניים נבדלים באזורי הצביעה של DNP או של DIG.
הגן HER2 מתגלה על ידי probe A צבוע עם DNP או dinitrophenyl ומשתקף בצבע שחור על ידי probe B שהוא SISH או silver ISH DNP. הצנטרומר של כרומוזום 17 נקשר על ידי probe A צבוע עם DIG או digoxigenin ומתגלה על ידי probe C Red ISH DIG. צביעה כפולה שניתנת להתבוננות במיקרוסקופ אור, בה הגן HER2 מופיעה כנקודות שחורות, וכרומוזום 17 נצבע אדום (ראו תמונה). בשיטה זו אין הצביעה דוהה לאורך זמן. הבדיקה ניתנת לביצוע בדגימות ביופסיה שקובעו ושומרו בשיטות שונות. הניסיון שהצטבר מראה ששיטה זו נותנת תוצאות אמינות יותר מאלה שהושגו בשיטת צביעה היסטוכימית, וכמו כן שיטה זו זולה יותר לביצוע ואינה מצריכה מיקרוסקופ פלואורסצנטי יקר שאינו זמין תמיד כמו זה הנדרש בבדיקת FISH-HER2.
מחקר הראה שבמקרים מסוימים סרטני-שד שהוגדרו בתחילה כחיוביים ל-HER2, הפכו שליליים ל-HER2 במרוצת הזמן. וכן היפוכו של דבר: סרטני-שד שליליים ל-HER2 הפכו עם הזמן לחיוביים לHER2. במקרים של מחלה חוזרת ומפושטת, יש לשקול ביצוע ביופסיה נוספת ובחינה מחודשת של הסטאטוס של HER2. יש כמובן לקחת בחשבון שקביעת הסטאטוס של HER2 במקור או בבדיקה חוזרת הייתה שגויה, או כיוון שהתוצאות היו גבוליות, או כיוון שלעתים נטילת ביופסיה מאזור אחד של הגידול הסרטני יכולה לתת בבדיקה תוצאה חיובית ל-HER2, ואילו ביופסיה מאזור אחר של הגידול יכולה להתקבל כשלילית לגבי HER2. בכל מקרה בו חלה התפשטות של התהליך הסרטני לאזורי גוף מרוחקים, בחינת הסטאטוס של HER2 חיונית כמו גם זו של הקולטנים לאסטרוגנים באותם תאים סרטניים מפושטים במידת האפשר. זאת כיוון שב-20-30% מהמקרים חלו שינויים בתכונות האמורות של תאי סרטן השד המפושטים, בהשוואה לממצאים בגידול המקורי.
בשגרה המעבדתית הנהוגה כיום ברוב המעבדות הקליניות בחינת ביטוי-יתר של HER2 נעשית על ידי שיטות אימונוהיסטוכימיות (IHC), או על ידי שיטות היברידיזציה in situ, כגון SISH או silver in-situ hybridization, או CISH שהיא שיטת היברידיזציה כרומוגנית, או FISH שהיא שיטת ההיברידיזציה הפלואורסצנטית. האמפליפיקציה של HER2 יכולה להתגלות גם ברקמת סרטן מקובעת בפרפין, בשיטה של virtual karyotyping, שיש לה ערך מוסף בכך שניתן למנות את השינויים במספר העותקים לאורך הגנום, בנוסף לגילוי האמפליפיקציה של HER2. בספרות תוארו גם מספר שיטות PCR.
ה-FDA אישר שתי ערכות מסחריות של HER2 IHC, זו של DAKO הידועה כ-HercepTest וזו הידועה כ-Ventana Pathway. שתי ערכות אלו שעברו סטנדרטיזציה ברמה גבוהה, הם שיטות חצי-כמותיות שמבטאות את רמת HER2 על פי 4 רמות:
- 0 או פחות מ-20,000 קולטנים לתא, שלא ניתן לזהותן בשיטה מיקרוסקופית;
- +1 או כ-100,000 קולטנים לתא המאפשרים צביעה חלקית של הממברנה, כאשר פחות מ-10% מהתאים מבטאים בעודף את HER2;
- +2 או בערך 500,000 קולטנים לתא, מה שמאפשר צביעה קלה עד מתונה של הממברנה, כאשר יותר מ-10% מהתאים מבטאים בעודף HER2;
- +3 או בערך 2,000,000 קולטנים לתא מה שמתבטא בצביעה חזקה ושלמה של הממברנה, כאשר יותר מ-10% מהתאים מבטאים בעודף HER2.
אין מתחשבים בשיטה זו בנוכחות של צביעה ציטופלזמית. הטיפול ב-trastuzumab מומלץ כאשר דרגת הצביעה של HER2 היא +3. יש לציין ששיטת IHC היא בעלת מספר מגבלות, טכניות ואף קשיים באינטרפרטציה של התוצאות, שיש להן השפעה על ההדירות והדיוק של התוצאות, בעיקר כאשר משווים שיטה זו עם שיטות ISH. אך זה נכון שמספר דיווחים מציינים ששיטת IHC מבטאת מתאם מצוין בין מספר העותקים של הגן לבין הביטוי של HER2 על פני התא. שיטת FISH מצטיירת כטכניקת ה-"gold standard" לזיהוי מטופלות שתפקנה תועלת מרבית מ-trastuzumab, אך זו שיטה יקרה המחייבת זמינות של מיקרוסקופ פלואורסצנטי באיכות גבוהה, ומערכת נלווית של image capture.
נכון להיום, השיטות המומלצות הן קומבינציה של IHC ו-FISH, כאשר קביעות של 0 או +1 בשיטת IHC נחשבות שליליות ואין לטפל במקרים אלה ב-trastuzumab, קביעת +3 נחשבת חיובית ומתאימה לטיפול ב-trastuzumab, וקביעה של +2 היא מקרה גבולי שמפנים לבדיקת FISH להערכה יותר מוחלטת ומדויקת. בשנים האחרונות הולך וגדל השימוש במכשור אוטומאטי של Tissue Image Systems לעיבוד אוטומאטי של הדגימות שקיבל את אישור ה-FDA, מה שמעלה את הדיוק וההדירות של ההערכה המעבדתית, ומה שמבטיח יעילות מרבית של הטיפול ב-trastuzumab.
בדיקת HER2 אינה מתבצעת בשכיחות הרצויה
אחת מ-5 נשים החולות בסרטן שד נמצאות בקטגוריה של סרטן שד מסוג HER2, שהוא אגרסיבי יותר, ואבחונו נעשה בשלב הביופסיה הנלקחת מהגידול. לאבחון השפעה מכרעת על סוג הטיפול שיינתן, על הישרדות החולות ועל איכות חייהן. אולם בדיקה זו עדיין אינה נעשית כשגרה, ונקבעת על פי שיקול דעת הרופא המטפל והפרוטוקולים באותו מרכז רפואי.
בסקירה ספרותית שפורסמה בספטמבר 2009 ב-Cancer, קובעת Kathryn Phillips מ-UCAL בסן-פרנסיסקו, כי משתמע מנתונים של בתי חולים בארה"ב שייתכן שהבדיקה לזיהוי הגן ל-HER2 אינה מבוצעת בשכיחות גבוהה דיה. בהתאם, אחוז גבוה מהנשים עם סרטן שד שהיו אמורות להפיק תועלת מטיפול בהרצפטין, אינן מקבלות את הטיפול. נתוני סקר זה העלו שב-66% מהנשים הזכאיות לבדיקת HER2 לא נמצא תיעוד לבדיקה, ויתרה מכך ש-20% מהנשים שטופלו בהרצפטין לא נבדקו או שלא נמצא בתיק הרפואי שלהן תיעוד לתוצאה חיובית בבדיקה. נראה מתוצאות סקר זה, שקיימים פערי מידע משמעותיים בנוגע לשימוש בפועל בבדיקת ה-HER2 והטיפול בהרצפטין. מתוצאות הסקירה עולה, כי קיימים מעט נתונים על השימוש בבדיקת HER2 בקליניקה. החוקרים מדווחים כי הראיות המוגבלות שנמצאו, רומזות כי קיימת שונות משמעותית בנהלי הבדיקה.
בין המחקרים שנסקרו שהעריכו את אחוז הנשים שעברו בדיקת HER2, מחקר אחד דיווח כי רק 52% מהחולות עם סרטן שד גרורתי עברו את הבדיקה בשנים 1999-2000. מחקר אחר דיווח כי רק 32% מהמשתתפות שסבלו מסרטן שד שאובחן לאחרונה, עברו את הבדיקה בשנת 2005 , כאשר בקרב נשים אלו, 93% עברו רק בדיקת IHC, ואילו 0.3% נבדקו רק באמצעות FISH, ו-6% מהנשים עברו את 2 הבדיקות. מחקר אחר בסקר זה מצא שימוש לא הולם בהרצפטין: כ-12-20%מהמשתתפות שקיבלו הרצפטין במחקר זה, לא עברו בדיקת HER2 או שלא נמצאו עדויות בתיק לבדיקה חיובית. ב-8% מהנשים שטופלו בהרצפטין במחקר נמצא תת-ביטוי של HER2, ו-4% לא נבדקו כלל. לפי מחקר זה סקירת הנחיות של ה- ASCO/CAP מצאה כי 20% מבדיקות ה-IHC שנערכו במעבדות בקהילה היו שגויות. נראה לאור תוצאות סקירה זו בדיקת HER2 היא דוגמה לבדיקה שהיא חיונית מבחינה קלינית, אך עומדת עדיין בפני קשיי איכות ויישום.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק