הבדלים בין גרסאות בדף "אריתרופויאטין - Erythropoietin"
(←ראו גם) |
|||
| (גרסת ביניים אחת של אותו משתמש אינה מוצגת) | |||
| שורה 68: | שורה 68: | ||
===וויסות יצירת EPO במצבי היפוקסיה=== | ===וויסות יצירת EPO במצבי היפוקסיה=== | ||
| + | |||
| + | רמות EPO בדם בדרך כלל נמוכות בהעדר אנמיה, ובממוצע 10mU/ml. אלא שבמצבי עקה היפוקסית רמת EPO בדם יכולה אף לעלות פי אלף ולהגיע לערכים של 10,000mU/ml. מוליקולת EPO מסונתזת בעיקר בקורטקס הכלייתי בתאי פיברובלסטים אינטרסטיציאליים בכליה הנמצאים בקשר קרוב עם תאים סב-אבוביים (peritubular) קפילאריים, ותאי אפיתל אבוביים בדרגת התמחות גבוהה. חלק קטן של EPO (כ-10-12%) מיוצר בכבד בתאים סב-סינוסואידאליים. יצירת EPO בכבד מתרחשת בעיקר בעובר ובתקופה הפרינטאלית בעוד שיצירת EPO בכליות מתרחשת בעיקר בבגרות. מיקום ייצורו של EPO בתאי כליה או בכבד התאפשר על ידי שיטות היברידיזציהin situ להדגמת התאים המכילים EPOmRNA. מעניינת במיוחד ההדגמה על ידי Loya וחב', שהשתמשו בעכברים טרנסגניים עם היפוקסיה, בהם ניתן היה לאתר באופן בולט יצירת EPO בתאים אפיתליאליים בכליה. וויסות יצירת EPO מושפע ממנגנוני משוב הפועלים בהתאם לרמת החמצון של תאי הדם. קיימים גורמי שעתוק ל-EPO, הידועים כ-HIFs או hypoxia-inducible factors, שעוברים הידרוקסילציה ומעוכלים בפרוטאוזומים התאיים בנוכחות רמת חמצן גבוהה. | ||
| − | + | אחד הממצאים החשובים בקשר בין HIF והשריית פעילות EPO הוא הגילוי של תת יחידה [[HIF-1α]], המפקחת על ביטוי הגן ל-EPO. תאים שאינם במצב היפוקסיה אינם מכילים כמות ניתנת לגילוי של HIF-1α, וכאשר תאים אלה נכנסים למצב של היפוקסיה מתבטא בהם HIF-1α תוך 30 דקות. מספר מודלים הוצעו התומכים במנגנון וויסות התלוי בחמצן שיכול לווסת של גורם השעתוק של HIF, כאשר מנגנון זה כרוך בהידרוקסילציה של שייר פרולין ספציפי ב-HIF-1α. ההשערה היא שבתאים במצב היפוקסיה שייר הפרולין אינו עובר הידרוקסילציה באופן המונע הרס של HIF-α במנגנון של ubiquitination והמשך פירוק ב-proteasome. | |
| − | |||
| − | אחד הממצאים החשובים בקשר בין HIF והשריית פעילות EPO הוא הגילוי של תת יחידה HIF-1α, המפקחת על ביטוי הגן ל-EPO. תאים שאינם במצב היפוקסיה אינם מכילים כמות ניתנת לגילוי של HIF-1α, וכאשר תאים אלה נכנסים למצב של היפוקסיה מתבטא בהם HIF-1α תוך 30 דקות. מספר מודלים הוצעו התומכים במנגנון וויסות התלוי בחמצן שיכול לווסת של גורם השעתוק של HIF, כאשר מנגנון זה כרוך בהידרוקסילציה של שייר פרולין ספציפי ב-HIF-1α. ההשערה היא שבתאים במצב היפוקסיה שייר הפרולין אינו עובר הידרוקסילציה באופן המונע הרס של HIF-α במנגנון של ubiquitination והמשך פירוק ב-proteasome. | ||
===תפקידים נוספים של EPO=== | ===תפקידים נוספים של EPO=== | ||
| שורה 97: | שורה 97: | ||
===תרחישים קליניים בהם רמת EPO מוגברת בפלזמה=== | ===תרחישים קליניים בהם רמת EPO מוגברת בפלזמה=== | ||
| − | |||
אנמיות שונות כולל אנמיה אפלסטית, פוליציטמיה שניונית [מצבי היפוקסיה בגבהים, COPD, לייפת (פיברוזיס) ריאתית], גידולים המייצרים EPO דוגמת פיאוכרומוציטומה, גידולי כליה כנפרובלסטומה או אדנוקרצינומה, cerebellar hemangioblastoma, הפאטומה, leiomyoma, הריון, מחלת כליות פוליציסטית, סימנים ראשונים של דחיית כליה מושתלת, לאחר תרומת דם או דימום מסיבה אחרת באדם בריא. | אנמיות שונות כולל אנמיה אפלסטית, פוליציטמיה שניונית [מצבי היפוקסיה בגבהים, COPD, לייפת (פיברוזיס) ריאתית], גידולים המייצרים EPO דוגמת פיאוכרומוציטומה, גידולי כליה כנפרובלסטומה או אדנוקרצינומה, cerebellar hemangioblastoma, הפאטומה, leiomyoma, הריון, מחלת כליות פוליציסטית, סימנים ראשונים של דחיית כליה מושתלת, לאחר תרומת דם או דימום מסיבה אחרת באדם בריא. | ||
===תרחישים קליניים בהם רמת EPO יורדת בפלזמה=== | ===תרחישים קליניים בהם רמת EPO יורדת בפלזמה=== | ||
| − | + | כשל כרוני של הכליות, [[פוליציטמיה ראשונית]] (polycythemia vera), אנמיה של מחלות כרוניות. | |
| − | כשל כרוני של הכליות, פוליציטמיה ראשונית (polycythemia vera), אנמיה של מחלות כרוניות. | ||
===השפעת תרופות ותכשירים על רמת אריתרופויאטין=== | ===השפעת תרופות ותכשירים על רמת אריתרופויאטין=== | ||
| − | |||
הגברת רמת EPO בפלזמה נגרמת משימוש בסטרואידים אנאבוליים כמו גם מצריכת EPO אקסוגני כמו Epogen. לעומת זאת רמת EPO בפלזמה תרד בנשאי HIVהמטופלים עם AZT, וכן צריכת amphotericin B מעכבת את התגובה המקובלת של עליה ברמת EPO במטופלים עם אנמיה. | הגברת רמת EPO בפלזמה נגרמת משימוש בסטרואידים אנאבוליים כמו גם מצריכת EPO אקסוגני כמו Epogen. לעומת זאת רמת EPO בפלזמה תרד בנשאי HIVהמטופלים עם AZT, וכן צריכת amphotericin B מעכבת את התגובה המקובלת של עליה ברמת EPO במטופלים עם אנמיה. | ||
===השימוש האסור של EPO בספורט תחרותי=== | ===השימוש האסור של EPO בספורט תחרותי=== | ||
| − | |||
EPO זכה שלא לטובתו לפרסום רב בגין השימוש האסור בו בעיקר בתחום הרכיבה על אופניים, אך גם בענפי ספורט אחרים כאגרוף, שיט, ריצות או הליכות למרחקים ארוכים, טריאתלון והחלקה על הקרח-cross country, במה שנודע כ-blood doping. אחד הגורמים המגבילים את סיבולת השריר במאמץ ממושך בעצימות גבוהה הוא מידת החמצון שלו. זו אם כך הסיבה לכך שספורטאים חטאו בשימוש אסור ב-EPO כדי להגביר את תהליך הובלת החמצן לשרירים, ובכך להגדיל את דרגת סבילותם במאמץ. הזרקת EPO מגדילה את ההמאטוקריט מה שנותן יתרון באותם ענפי ספורט בהם היא נאסרה. | EPO זכה שלא לטובתו לפרסום רב בגין השימוש האסור בו בעיקר בתחום הרכיבה על אופניים, אך גם בענפי ספורט אחרים כאגרוף, שיט, ריצות או הליכות למרחקים ארוכים, טריאתלון והחלקה על הקרח-cross country, במה שנודע כ-blood doping. אחד הגורמים המגבילים את סיבולת השריר במאמץ ממושך בעצימות גבוהה הוא מידת החמצון שלו. זו אם כך הסיבה לכך שספורטאים חטאו בשימוש אסור ב-EPO כדי להגביר את תהליך הובלת החמצן לשרירים, ובכך להגדיל את דרגת סבילותם במאמץ. הזרקת EPO מגדילה את ההמאטוקריט מה שנותן יתרון באותם ענפי ספורט בהם היא נאסרה. | ||
| שורה 117: | שורה 113: | ||
===EPO במרוצי אופניים=== | ===EPO במרוצי אופניים=== | ||
| − | |||
ההנחה היא שהשימוש ב-EPO בצורותיו השונות במרוצי האופניים היוקרתיים החל בסביבות שנת 1990. מי ששמם נכרך כחלוצים בתחום זה היו הרופאים האיטלקים Conconi ו-Ferrari, שהיו קשורים לשערוריית קבוצת הרוכבים האיטלקית Festina, שנפסלה במלואה בטור-דה-פרנס בשנת 1998. אכן ההבנה שנטילת EPO מגבירה משמעותית את VO2max, סחפה רוכבים מקבוצות ולאומים שונים ממשתתפי מרוץ זה אל תוך מערבולת השימוש האסור ב-EPO, שהגיעה לשיאה בהודאה גורפת של רוכבים נודעים מקבוצת U.S. Postal Service, בצריכת EPO. לאחר שהזוכה האמריקני בטור בשנת 2010, Floyd Landis, נתפס בקלקלתו וזכייתו נפסלה, הוא הודה והסגיר את הסוד העגום לפיו רובם המכריע של רוכבי קבוצה זו השתמשו ב-EPO, כולל לאנס ארמסטרונג, הזוכה האגדי ב-7 מרוצי טור-דה-פרנס רצופים, שנאלץ בדיעבד להודות שכל זכיותיו הסתייעו בצריכת EPO. | ההנחה היא שהשימוש ב-EPO בצורותיו השונות במרוצי האופניים היוקרתיים החל בסביבות שנת 1990. מי ששמם נכרך כחלוצים בתחום זה היו הרופאים האיטלקים Conconi ו-Ferrari, שהיו קשורים לשערוריית קבוצת הרוכבים האיטלקית Festina, שנפסלה במלואה בטור-דה-פרנס בשנת 1998. אכן ההבנה שנטילת EPO מגבירה משמעותית את VO2max, סחפה רוכבים מקבוצות ולאומים שונים ממשתתפי מרוץ זה אל תוך מערבולת השימוש האסור ב-EPO, שהגיעה לשיאה בהודאה גורפת של רוכבים נודעים מקבוצת U.S. Postal Service, בצריכת EPO. לאחר שהזוכה האמריקני בטור בשנת 2010, Floyd Landis, נתפס בקלקלתו וזכייתו נפסלה, הוא הודה והסגיר את הסוד העגום לפיו רובם המכריע של רוכבי קבוצה זו השתמשו ב-EPO, כולל לאנס ארמסטרונג, הזוכה האגדי ב-7 מרוצי טור-דה-פרנס רצופים, שנאלץ בדיעבד להודות שכל זכיותיו הסתייעו בצריכת EPO. | ||
גרסה אחרונה מ־20:57, 28 בינואר 2023
| מדריך בדיקות מעבדה | |
| אריתרופויאטין | |
|---|---|
| Erythropoietin | |
| שמות אחרים | EPO או hemopoietin |
| מעבדה | כימיה בדם |
| תחום | הערכת מצבי אנמיה, פוליציטמיה ואף הערכת תפקוד כליות |
| טווח ערכים תקין | 5-34 מילי-יחידות למ"ל. יש לציין שערכי EPO הנמדדים בדגימת בוקר גבוהים יותר מאלה המתקבלים במדידת EPO בשעות אחה"צ בגין מחזורים יומיים של הפרשת ההורמון |
| יוצר הערך | פרופ' בן עמי סלע |
מטרת הבדיקה
שימושית באבחנה מבדלת בין פוליציטמיה ראשונית ושניונית. טובה לגילוי וניטור נפרובלסטומה חוזרת או גידולים כלשהם המייצרים EPO. מדידת רמת EPO מתבצעת לסייע בהחלטה לגבי הסיבות לאנמיה או לפוליציטמיה, או בבירור של מפגעי מח עצם.
בסיס פיזיולוגי
EPO הוא גליקופרוטאין שמשקלו המולקולארי 34,000 דלטון בממוצע, והוא מאופיין על ידי דרגת גליקוזילציה גבוהה כאשר הסוכרים מהווים 40% מהמוליקולה. תקופת מחצית החיים של EPO בדם היא של 5 שעות, אך זו שונה לגבי EPO אנדוגני או לגבי תכשירי EPO הריקומביננטיים-אקסוגניים. גליקוזילציה מוגברת או שינויים אחרים במבנה המולקולה של EPO המיוצרת במעבדה, גורמים להגברת היציבות שלה בגוף, ולצורך בפחות הזרקות בשעת טיפול.
רקע היסטורי: ב-1906 העלו Carnot ו-DeFlandre בפאריז את הרעיון שייצור תאי דם אדומים מפוקח ומושפע באופן הורמונאלי. לאחר שהקיזו את דמן של ארנבות, ועשו עירוי של פלזמה מארנבות אלה לארנבות אחרות, הבחינו בעלייה מהירה ביצירת תאי הדם האדומים בארנבות (רטיקולוציטוזה) להם נעשה העירוי הודות למה ששני חוקרים אלה הגדירו כ-hemopoietin. מחקרים נוספים על ידי Reissman ו-Erslev הראו כי חומר מסוים במחזור הדם מסוגל לעודד יצירה של תאים אדומים והגדלת ההמטוקריט. החומר בודד וזוהה כאריתרופויאטין.
ההמאטולוג Adamson והנפרולוג Eschbach בחנו סוגים שונים של כשלי כליות ואת תפקיד EPO טבעי ביצור תאי דם אדומים. בשנות ה-70 חקרו השניים תגובת EPO בכבשים, ומצאו שהוא מעודד ייצור של תאי דם אדוומים במח העצם ועשוי לסייע בטיפול במצבי אנמיה. ב-1968 Goldwasser ו-Kung החלו בניקוי EPO אנושי, וכעבור 9 שנים הצליחו במשימתם, מה שאפשר לרצף חלקית את חומצות האמינו ולזהות את הגן המקודד ל-EPO. מאוחר יותר גילה מחקר באוניברסיטת קולומביה דרך לסנתז אריתרופויאטין. על בסיס מחקר זה החלה חברת Amgen בייצור אריתרופויאטין סיננתי בשם אפוגן (Epogen), שזכה לאישור ה-FDA ב-1989.
תכשירי EPO
EPO כאמור מיוצר בעיקר על ידי הכליות כאשר יש ירידה בדרגת החמצון של הדם, אם כי 10-12% מ-EPO מקורו מהכבד. מאז שנת 1985 EPO אנושי מיוצר באופן מסחרי בטכנולוגיה של recombinant DNA בתרביות תאים, לטיפול באנמיה במטופלי דיאליזה ובחולי סרטן. במקביל מיוצרים תכשירים סינתטיים של EPO, שיעילותם אף גבוהה מזו של ההורמון הטבעי. הגדלת אחוז הסוכר במולקולה, מביאה להאטה בפינוי של EPO מהגוף, ומאריכה את משך השפעתו. תכשירים עם גליקוזילציה מוגברת של EPO מגיעים ב-3 צורות: תכשיר “alpha” (המשמש בעיקר ברפואה וטרינארית), תכשיר "beta" בעל יעילות קלינית דומה לזו של “alpha”, ו-Darbepoetin, שאחוז הגליקוזילציה שלו גבוה במיוחד, והשפעתו ממושכת יותר מזו של האחרים.
ידוע ממחקרים אחדים ששיירי חומצה סיאלית המהווה סוכר קצה בשרשרת הסוכרית של גליקופרוטאינים דוגמת EPO, חיוני לשימור הפעילות הביולוגית של EPO. זאת כיון שהסרת סוכר-קצה זה על ידי פעילות של האנזים sialidase בפלזמה, גורמת לחשיפה של הסוכר הבא ברצף- galactose, הנוטה להיקשר לקולטן Ashwell בכבד, ובכך להחיש את הפינוי של גליקופרוטאינים מזרם הדם. כיון שכך, היה סביר שהוספת שיירי חומצה סיאלית כחלק משרשראות סוכריות שתתווספנה על מוליקולת EPO הטבעית, תגדיל את משך השהיה של מוליקולת "EPO משופר" בדם להארכת משך פעילותו הביולוגית.
לשם כך נוצרת מוליקולת NESP או darbepoetin alfa, לו הוספו 2 שרשראות אוליגו-סכרידיות, והוא מכיל אם כך 5 שרשראות כאלה במקום 3 המופיעות ב-EPO הטבעי. שינוי זה במוליקולה התאפשר בטכנולוגיה הריקומביננטית בה שוחלפו 5 שיירים של חומצות אמינו ברצף הפפטידי של EPO באופן הבא: Ala30Asn ,His32thr ,Pro87Val ,Trp88Asn ו-Pro90Thr. הוספה של 2 שיירי אספרגין (Asn) מאפשרת יצירה של 2 אתרי N-glycosylation נוספים בעמדות 30 ו-88. אכן מוליקולת NESP מכילת 22 שיירי חומצה סיאלית במקום 14 שיירים במולקולת EPO המקורית. המשקל המולקולארי של NESP הוא 38,500 ואילו זה של EPO המקורי 30,400.
אחוז החלק הסוכרי במוליקולת NESP הוא 52% לעומת 40% ב-EPO. תקופת מחצית החיים של NESP בדם לאחר עירוי ורידי היא 25.3 שעות לעומת 8.5 שעות של EPO. כאשר NESP ניתן בהזרקה מתחת לעור תקופת מחצית החיים שלו היא 48.8 שעות לעומת 18-24 שעות של EPO בדם, לאחר הזרקה תת-עורית.
תכשירי EPO רקומביננטיים כוללים את Epogen/Procrit שהוא epoetin alfa, וכן את Aranesp שהוא darbepoetin alfa, תכשירי EPO אלפא משמשים לטיפול באנמיה הנובעת ממחלת כליות כרונית, או במצבי myelodysplasia, הנובעים מטיפולי כימותרפיה והקרנות בחולי סרטן. תכשיר זה מוכר גם כ-NESP או novel erythropoiesis stimulating protein. גליקופרוטאין זה הוא בעל תקופת מחצית חיים ארוכה מתכשירי EPO הקודמים, ומיועד לטיפול של חולים עם כשל כליות כרוני (CRF) בהם ניתן לטפל במינון נמוך תוך שמירה על רמת המוגלובין נאותה.
בטכנולוגיית DNA ריקומביננטי ודרגות גליקוזילציה שונות נוצרים למעשה עוד ארבע צורות של EPO בנוסף לאלפא EPO, ואלה הן צורות בטא, דלתא, אומגה וזטא. בקבוצת תכשירי epoetin beta נכללים מותגים של Hoffmann-La Roche כגון Recormon, וכן Mircera שהוא EPO אליו מוצמד שייר methoxy polyethylene glycol. מותג של epoetin delta ידוע כ-Dynepo, ומותג של epoetin omega ידוע כ-Epomax. מותג מוכר של epoetin zeta ידוע כ-Retacrit ומשמש בעיקר לטיפול באנמיה נגרמת מטיפולים כימותרפיים.
התפקיד של EPO ביצירת תאי דם אדומים
כאמור EPO הוא הורמון הכרחי ביצירת תאי-דם אדומים. בתנאים של חסר חמצן, בעיקר הכליות מייצרות ומפרישות EPO העושה דרכו להתקשרות על קולטניו הנמצאים על פני תאים קדם-אריתרובלסטים ואריתרובלסטים באזופיליים בתהליכי ההתמיינות שלהם. השפעתו של EPO על תאים ראשוניים אלה (progenitors) הנמצאים במח העצם, מסייעת להם להישרד על ידי שהוא מגן עליהם מפני אפופטוזיס. EPO אמנם נחשב לגורם האריתרופויאטי חשוב ביותר, אך הוא נעזר לפעילותו בגורמי גדילה נוספים כגון IL-11, IL-6, IL-4, IL-3, IL-1 וכן insulin growth factor-1, כמו גם granulocyte colony-stimulating factor או G-CSF, וכן granulocyte-macrophage (GM)-CSF ו-CSF או stem cell factor, הקשורים אף הם להתפתחות של שורות תאים אריתרואידיים הנובעים מ-multipotent progentors.
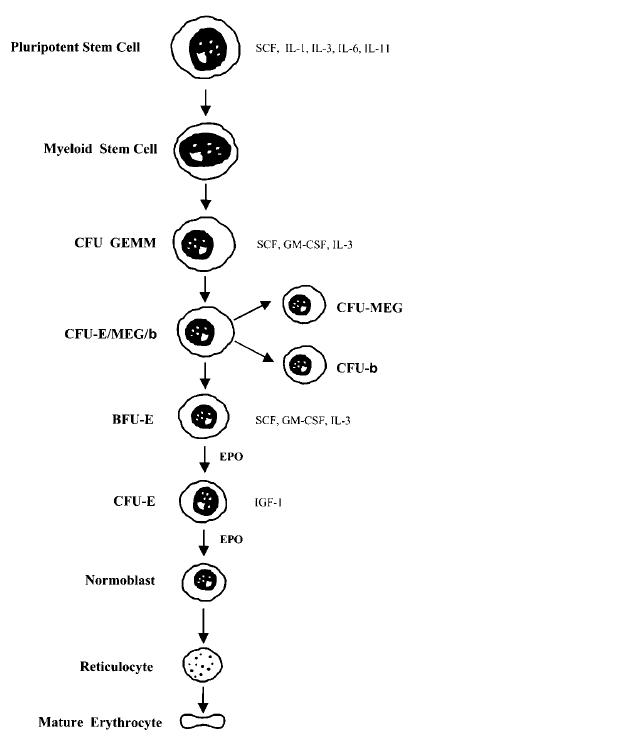
כמו בתרשים שמתואר בתרשים למטה, פעילותו של EPO באה לביטוי בשני שלבים מתקדמים יחסית במהלך המסלול מ-pluripotent stem cell עד ליצירת האריתרוציט הבשל, דהינו אריתרופויאטין מתחיל לפעול בשני השלבים המתחילים המתחילים ב-BFU-E או burst-forming unit erythroid עד ליצירת הנורמובלסט, שהיא צורת התא המקדימה את הרטיקולוציט המוביל לאריתרוציט הבוגר.
היבטים טיפוליים של EPO באנמיה
בשנת 1987 היה זה Eschbach שדיווח לראשונה על תוצאות טיפול עם EPO אנושי ריקומביננטי לתיקון אנמיה כתוצאה ממחלת כליות סופנית. ה-FDA אישר תכשיר זה לטיפול בחולים עם מחלת כליות כרונית ביוני 1989. בשנת 2000 הגדיר Eschbach מספר עקרונות לשיפור הטיפול עם rHuEPO באלה עם CRF:
- הטיפול האופטימאלי הוא במתן 3 עירויים במינון שמעל 15 יחידות לק"ג משקל גוף.
- באופן ממוצע, מתן הזריקה באופן תת-עורי יעיל יותר מעירוי תוך-ורידי, גם אם רק כ-25% מהחומר המוזרק תת-עורית נספג.
- מחקרים פרמאקו-קינטיים מראים שתקופת מחצית החיים של rHuEPO הניתן בעירוי היא 4-9 שעות, בעוד שתקופת מחצית החיים של אותו תכשיר בהזרקה תת-עורית היא למעלה מ-24 שעות.
- חשוב להפסיק מתן rHuEPO מעט לפני שרמת ההמוגלובין השיגה את יעדה. רמת המוגלובין יכולה לרדת באופן יותר מהיר מהצפוי בהפסקת הטיפול באריתרופויאטין, כיוון שהמוגלובין מוגבר יכול לדכא במשוב יצירת EPO אנדוגני.
- טיפול ב-rHuEPO מוביל לחסר ברזל, וחיוני שמטופל עם אנמיה כתוצאה ממחלת כליות כרונית ינוטר בהמשך לחסר ברזל על ידי מדידת רמת פריטין בנסיוב, כמו גם דרגת הריוויון של טרנספרין.
קיים פיתוי לטפל עם EPO בכל תרחיש נתון של אנמיה, בו מח העצם אינו מגיב כראוי ביצירה נאותה של אריתרוציטים. אך יש לקחת בחשבון שברוב המקרים אי התגובה של מח העצם אינו נובע בהכרח מכשל של הכליות בייצור EPO, ואלה דווקא מייצרות כמויות מוגברות של EPO בתגובה לאנמיה. כך שבמקרים אלה מתן תוספת של EPO אקסוגני לא יתרום לשיפור האנמיה, שכן הבעיה נעוצה בחוסר תגובה הולמת של מח העצם ל-EPO האנדוגני התקין.
מנגנון הפעולה
- הקולטן ל-EPO
לתאי-אב ליצירת כדוריות אדומות במח העצם יש קולטנים ל-EPO כאשר קישור ההורמון לקולטן מעודד יצירת כדוריות דם אדומות. קישור EPO לקולטניו, מביא לשפעול של רצף ריאקציות איתות תוך-תאיות המתחילות בחלבון, Janus kinase 2 או JAK2. הביטוי של קולטנים ל-EPO נמצא במספר רקמות כמו מח העצם, אך גם מערכת העצבים ההיקפית. בזרם הדם עצמו, תאי דם אדומים בוגרים אינם מבטאים קולטנים ל-EPO, ולכן גם אינם מגיבים לו.
מספר הקולטנים ל-EPO על פני התאים האריתרואידיים מוגבל יחסית למה שמקובל לגבי קולטנים לליגנדים ביולוגיים אחרים, ומדובר בפחות מ-1,000 קולטנים לתא. קולטנים אלה מבוטאים בעיקר בין שלב ה-CFU-E לשלב ה-pronormoblast. מספר קטן של קולטנים מבוטא על פני התאים בשלב ה-BFU-E (ראה בתרשים למעלה), ובשלבי ה-normoblast והרטיקולוציט כבר לא מופיעים קולטנים אלה כלל.
הגן המקודד לקולטן של EPO שובט בתאי אריתרו-לויקמיה בעכברים, ונמצא שהקולטן הוא חלבון במשקל מולקולארי המוערך בין 66 ל-78 אלף דלטון. קולטן זה פועל כ-dimer, כאשר מולקולת EPO אחת נקשרת לשני מרכיבי הדימר ובכך משנה את הקונפורמציה של הקולטן, הנחוצה לשפעול מערכת JAK2. מעבר האיתות התוך תאי של קישור EPO מסתייע על ידי זירחון מהיר של 8 שיירי טירוזין בחלק התוך ציטפלזמי של הקולטן, אם כי הקולטן עצמו אינו מכיל פעילות אנדוגנית של האנזים טירוזין קינאזה. מתברר ששפעול JAK2 מסתייע גם על ידי פעילות protein kinase C, וכן ש-EPO כורך גם את המסלול RAS/MAP kinase, ואת פעילות האנזים phosphatidylinositol 3-kinase. ידוע גם ש-SCF או stem cell factor מגיב עם הקולטן ל-EPO.
וויסות יצירת EPO במצבי היפוקסיה
רמות EPO בדם בדרך כלל נמוכות בהעדר אנמיה, ובממוצע 10mU/ml. אלא שבמצבי עקה היפוקסית רמת EPO בדם יכולה אף לעלות פי אלף ולהגיע לערכים של 10,000mU/ml. מוליקולת EPO מסונתזת בעיקר בקורטקס הכלייתי בתאי פיברובלסטים אינטרסטיציאליים בכליה הנמצאים בקשר קרוב עם תאים סב-אבוביים (peritubular) קפילאריים, ותאי אפיתל אבוביים בדרגת התמחות גבוהה. חלק קטן של EPO (כ-10-12%) מיוצר בכבד בתאים סב-סינוסואידאליים. יצירת EPO בכבד מתרחשת בעיקר בעובר ובתקופה הפרינטאלית בעוד שיצירת EPO בכליות מתרחשת בעיקר בבגרות. מיקום ייצורו של EPO בתאי כליה או בכבד התאפשר על ידי שיטות היברידיזציהin situ להדגמת התאים המכילים EPOmRNA. מעניינת במיוחד ההדגמה על ידי Loya וחב', שהשתמשו בעכברים טרנסגניים עם היפוקסיה, בהם ניתן היה לאתר באופן בולט יצירת EPO בתאים אפיתליאליים בכליה. וויסות יצירת EPO מושפע ממנגנוני משוב הפועלים בהתאם לרמת החמצון של תאי הדם. קיימים גורמי שעתוק ל-EPO, הידועים כ-HIFs או hypoxia-inducible factors, שעוברים הידרוקסילציה ומעוכלים בפרוטאוזומים התאיים בנוכחות רמת חמצן גבוהה.
אחד הממצאים החשובים בקשר בין HIF והשריית פעילות EPO הוא הגילוי של תת יחידה HIF-1α, המפקחת על ביטוי הגן ל-EPO. תאים שאינם במצב היפוקסיה אינם מכילים כמות ניתנת לגילוי של HIF-1α, וכאשר תאים אלה נכנסים למצב של היפוקסיה מתבטא בהם HIF-1α תוך 30 דקות. מספר מודלים הוצעו התומכים במנגנון וויסות התלוי בחמצן שיכול לווסת של גורם השעתוק של HIF, כאשר מנגנון זה כרוך בהידרוקסילציה של שייר פרולין ספציפי ב-HIF-1α. ההשערה היא שבתאים במצב היפוקסיה שייר הפרולין אינו עובר הידרוקסילציה באופן המונע הרס של HIF-α במנגנון של ubiquitination והמשך פירוק ב-proteasome.
תפקידים נוספים של EPO
בנוסף לפעילותו המקובלת בהגנה מפני אנמיה והיפוקסיה, יש ל-EPO חלק ביצירת יתר לחץ-דם בשל השפעתו בכיווץ כלי-דם, בהשריית תהליכי אנגיוגנזה, כמו גם בשגשוג של סיבי שרירים חלקים. נמצא כמו כן ש-EPO עשוי להגביר ספיגת ברזל על ידי דיכוי ההורמון הנוצר בכבד-hepcidine. כמו כן משתתף EPO בתהליך ריפוי פצעים או פגיעות חודרניות אחרות. מספר מחקרים הדגימו ש-EPO מעודדת יצירת כלי דם חדשים (angiogenesis) שעלולה להחיש תהליכים ממאירים.
במערכת העצבים EPO משפיע על יכולת תאי העצב להגן על עצמם בתנאי היפוקסיה כגון בשבץ מוחי. נראה שהעלייה הניכרת של עד פי-100 מרמת הבסיס של EPO בתגובה לתרחיש היפוקסיה מוחי, מאפשרת השפעה הגנתית זו. הקולטן ל-EPO ממוקם בעיקר בקליפת המוח, במוחון (cerebellum), בהיפוקאמפוס, בהיפופיזה ובעמוד השדרה. המנגנון דרכו EPO מגן על מערכת העצבים הוא בהקטנת ההשפעה הרעילה של גלוטמאט, ביצירה מוגברת של גורמים עצביים אנטי-אפופטוטיים ובהשפעות נוגדות דלקת ונוגדות חמצון.
מתן EPO
הטיפול ב-EPO ניתן על ידי הזרקה תת-עורית, כאשר מקובל להתחיל ברצף של 3 פעמים בשבוע במקביל למתן תוסף ברזל פומי. רמת ההמאטוקריט/המוגלובין נמדדת אחת לשבוע בתחילת הטיפול, ומינון EPO מותאם בהמשך בהתאם. רוב המטופלים מגיעים לרמות רצויה של כדוריות אדומות תוך 4 שבועות מתחילת הטיפול. מטופלים רבים יכולים לאחר האיזון הנדרש ברמת הכדוריות להיות מטופלים בזריקה שבועית אחת לתחזוק המצב. לגבי התכשיר NESP ברוב המקרים של אנמיה על רקע מחלת כליות כרונית המינון הוא טיפול שבועי אחד של 0.45 מיקרוגרם לק"ג משקל בעירוי או בהזרקה תת-עורית. מחקרים אחרים ממליצים על מתן rHuEPO במינון של 50 יחידות לק"ג משקל, פעמיים או 3 פעמים בשבוע.
החשיבות של מתן תוסף ברזל במהלך ההזרקות של EPO היא בכך שהיא מאפשרת למח העצם לקבל את כל "התצרוכת" של מרכיבי התזונה החיוניים ליצירה מוגברת של כדוריות אדומות המתבקשת כתוצאה ממתן EPO. כמו כן מומלץ ליטול תוספי מולטי-ויטמינים האמורים לספק די ויטמינים מקבוצת B, החיוניים אף הם ליצירה מוגברת של כדוריות אדומות. יש מטופלים בהם מתן קרניטין כתוסף משפר אף הוא את התגובה ל-EPO.
תופעות לוואי של טיפול ב-EPO
אחת התופעות הלא רצויות של טיפול ב-EPO היא תגובת מערכת החיסון של הגוף ביצירת נוגדנים כנגד מוליקולה חלבונית זו. הבעיה היא שנוגדנים נוצרים לא רק כנגד EPO אקסוגני ממקור אנושי, אלא שעלולה להופיע תגובת נוגדנים שניונית כנגד האריתרופויאטין האנדוגני של המטופל עצמו. תופעת לוואי זו עלולה לעתים לייצר אנמיה חריפה שניתנת לטיפול רק בעזרת עירוי דם. לאחר הפסקת הטיפול ב-EPO אקסוגני, רמת הנוגדנים למולקולה זו דועכת לאורך תקופה של 2-12 חודשים.
בחלק מהמטופלים המגיבים לטיפול ב-EPO בעליה ברמת המוגלובין, ייתכן מצב שהפעילות הארירופויטית המוחשת תגביר את הצורך בברזל, גם כאשר מאגרי הברזל תקינים. תרחיש זה הידוע כחסר ברזל פונקציונלי, נובעת בדרך כלל ממצבים דלקתיים בהם hepcidin משתחרר מהכבד בעודף, ויש מעצור בשחרור ברזל מהרקמות. ניתן לזהות חסר פונקציונלי של ברזל על ידי מדידת ריוויון טרנספרין (TIBC) עם תוצאה של פחות מ-20%, וכן מדידת רמת פריטין בדם עם תוצאה של למטה מ-100 מיקרוגרם לליטר.
בחלק מהמטופלים ב-EPO מתפתחת תופעה של יתר לחץ-דם שמקורה כנראה בעלייה מוגזמת בספירת הדם האדומה מה שתורם להגברה לא רצויה בצמיגות הדם. במטופלים אלה ניטור לחץ הדם יכול לסייע במניעת התופעה. הסבר אחר להופעת יתר לחץ-דם, הוא שטיפול ב-EPO עלול להגביר את כיווץ כלי-הדם (vaso-constriction) כתוצאה מעלייה ברמת סידן בציטופלזמת התאים, מה שגורם לעמידות לפעילות מרחיבת כלי הדם של חד תחמוצת החנקן (NO). גורמים נוספים שעלולים שיכולים להיות קשורים להשפעה ההיפרטנסיבית של EPO, הם יצירה מוגברת של הגורם לכיווץ כלי-דם אנדותלין, השפעה מעודדת על יצירת renin ו-angiotensinogen, וכן שינויים ברמת פרוסטגלנדינים ברקמת כלי הדם. לתכשירי EPO אלפא מצורפות אזהרות מפני הגברת הסיכון למוות, אוטם שריר לב, שבץ מוחי, תסחיפים פקקתיים ורידיים, חזרת תהליכים סרטניים רדומים, ועוד השפעות לוואי לא רצויות בדרגת חומרה גבוהה.
סיבוך נדיר של טיפול ב-EPO ידוע כ-PRCA או pure red cell aplasia על רקע התפתחות נוגדנים ל-EPO האנדוגני. מקרים בודדים אלה תוארו בחולים עם אי ספיקת כליות כרונית שקבלו Eprex בטיפול תת עורי. יש לקחת בחשבון אפשרות של סיכון תרומבואמבולי לפני טיפול ב-EPO בעיקר באלה עם רקע אישי או משפחתי של פקקת ורידית או עורקית, שכיבה ממושכת וחוסר ניידות, או אלה עם תרומבופיליה תורשתית.
תרחישים קליניים בהם רמת EPO מוגברת בפלזמה
אנמיות שונות כולל אנמיה אפלסטית, פוליציטמיה שניונית [מצבי היפוקסיה בגבהים, COPD, לייפת (פיברוזיס) ריאתית], גידולים המייצרים EPO דוגמת פיאוכרומוציטומה, גידולי כליה כנפרובלסטומה או אדנוקרצינומה, cerebellar hemangioblastoma, הפאטומה, leiomyoma, הריון, מחלת כליות פוליציסטית, סימנים ראשונים של דחיית כליה מושתלת, לאחר תרומת דם או דימום מסיבה אחרת באדם בריא.
תרחישים קליניים בהם רמת EPO יורדת בפלזמה
כשל כרוני של הכליות, פוליציטמיה ראשונית (polycythemia vera), אנמיה של מחלות כרוניות.
השפעת תרופות ותכשירים על רמת אריתרופויאטין
הגברת רמת EPO בפלזמה נגרמת משימוש בסטרואידים אנאבוליים כמו גם מצריכת EPO אקסוגני כמו Epogen. לעומת זאת רמת EPO בפלזמה תרד בנשאי HIVהמטופלים עם AZT, וכן צריכת amphotericin B מעכבת את התגובה המקובלת של עליה ברמת EPO במטופלים עם אנמיה.
השימוש האסור של EPO בספורט תחרותי
EPO זכה שלא לטובתו לפרסום רב בגין השימוש האסור בו בעיקר בתחום הרכיבה על אופניים, אך גם בענפי ספורט אחרים כאגרוף, שיט, ריצות או הליכות למרחקים ארוכים, טריאתלון והחלקה על הקרח-cross country, במה שנודע כ-blood doping. אחד הגורמים המגבילים את סיבולת השריר במאמץ ממושך בעצימות גבוהה הוא מידת החמצון שלו. זו אם כך הסיבה לכך שספורטאים חטאו בשימוש אסור ב-EPO כדי להגביר את תהליך הובלת החמצן לשרירים, ובכך להגדיל את דרגת סבילותם במאמץ. הזרקת EPO מגדילה את ההמאטוקריט מה שנותן יתרון באותם ענפי ספורט בהם היא נאסרה.
מעבר לשיקולים האתיים של אי הגינות ספורטיבית והשגת יתרון של סבילות גופנית על פני מתחרים אחרים, לעתים הגזמה או אי הקפדה במינון EPO המוזרק, עלולה להביא לעליה מופרזת במסת תאי הדם האדומים, מה שעלול להפחית את שפיעת הדם בכלי הדם עקב הגברת צמיגותו, ועלול לגרום לתרחישי פקקת ושבץ. למרות שמקובל שהשימוש האסור ב-EPO בקרב ספורטאים רווח כבר בשנות ה-90, רק בשנת 2000 פותחה בצרפת במעבדה הלאומית למניעת שימוש בסמי המרצה בספורט, שיטה בה ניתן היה להבדיל באנליזה של השתן בין EPO סינתטי לזה האנדוגני של הספורטאי הנבדק. אבחנה זו מתאפשרת עקב הבדלים בין אריתרופויאטין אנדוגני לזה האקסוגני, כגון post-translational modification שמופיעים רק באנדוגני.
בשנת 2002 בעת משחקי החורף ב-Salt Lake City דיווח לראשונה Don Catlin מייסד המעבדה האולימפית האנליטית ב-UCLA, על גילוי של darbepoetin alfa בשתן של ספורטאי. באולימפיאדת לונדון ב-2012, הורחק מהתחרות מתחרה בהליכה למרחק 50 ק"מ, שזכה באולימפיאדת בייג'ין בשנת 2008 במדליית זהב באותו ענף, לאחר שהתגלה שנטל EPO. יצוין שהחל משנת 2004 בה החלו להתבצע בספורטאים בנוסף לבדיקות בדגימות שתן גם בדיקות בדגימות דם, התגלו אף חומרים שנלקחו כדי לעודד יצירה של EPO אנדוגני. כך לדוגמה נתגלו עקבות של קובלט כלוריד, כמו גם של קושר הברזל deferroxamine, וכן של חומרים המנטרלים oxo-glutarate, האמורים לעודד יצירת EPO.
EPO במרוצי אופניים
ההנחה היא שהשימוש ב-EPO בצורותיו השונות במרוצי האופניים היוקרתיים החל בסביבות שנת 1990. מי ששמם נכרך כחלוצים בתחום זה היו הרופאים האיטלקים Conconi ו-Ferrari, שהיו קשורים לשערוריית קבוצת הרוכבים האיטלקית Festina, שנפסלה במלואה בטור-דה-פרנס בשנת 1998. אכן ההבנה שנטילת EPO מגבירה משמעותית את VO2max, סחפה רוכבים מקבוצות ולאומים שונים ממשתתפי מרוץ זה אל תוך מערבולת השימוש האסור ב-EPO, שהגיעה לשיאה בהודאה גורפת של רוכבים נודעים מקבוצת U.S. Postal Service, בצריכת EPO. לאחר שהזוכה האמריקני בטור בשנת 2010, Floyd Landis, נתפס בקלקלתו וזכייתו נפסלה, הוא הודה והסגיר את הסוד העגום לפיו רובם המכריע של רוכבי קבוצה זו השתמשו ב-EPO, כולל לאנס ארמסטרונג, הזוכה האגדי ב-7 מרוצי טור-דה-פרנס רצופים, שנאלץ בדיעבד להודות שכל זכיותיו הסתייעו בצריכת EPO.
הוראות לביצוע הבדיקה
נטילת הדם נעשית במבחנה כימית (פקק אדום או צהוב) או במבחנת ליתיום-הפארין (פקק ירוק). אין להשתמש במבחנת ספירת-דם (EDTA) (פקק סגלגל). אין צורך בצום. הבדיקה יציבה בטמפרטורת החדר למשך 8 שעות, בקירור למשך שבוע, או בהקפאה למשך חודש.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק