הבדלים בין גרסאות בדף "מחלת פרקינסון - Parkinson's disease"
| (106 גרסאות ביניים של 3 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
{{מחלה | {{מחלה | ||
|תמונה=Sir William Richard Gowers Parkinson Disease sketch 1886.jpg | |תמונה=Sir William Richard Gowers Parkinson Disease sketch 1886.jpg | ||
|כיתוב תמונה=איור של יציבה אופיינית לחולה פרקינסון | |כיתוב תמונה=איור של יציבה אופיינית לחולה פרקינסון | ||
| − | |שם עברי=פרקינסון | + | |שם עברי=מחלת פרקינסון |
|שם לועזי=Parkinson's disease | |שם לועזי=Parkinson's disease | ||
| − | |שמות נוספים= | + | |שמות נוספים=מחלת הרטטת, Idiopathic or primary parkinsonism |
|ICD-10={{ICD10|G|20||g|20}}, {{ICD10|F|02|3|f|00}} | |ICD-10={{ICD10|G|20||g|20}}, {{ICD10|F|02|3|f|00}} | ||
|ICD-9={{ICD9|332}} | |ICD-9={{ICD9|332}} | ||
|MeSH=D010300 | |MeSH=D010300 | ||
| − | |יוצר הערך=ד"ר | + | |יוצר הערך=ד"ר מאיר קסטנבאום |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
{{הרחבה|מחלת פרקינסון}} | {{הרחבה|מחלת פרקינסון}} | ||
| − | + | מחלת פרקינסון היא מחלה ניוונית נוירולוגית נפוצה עם ביטויים מוטוריים ולא מוטוריים. מהלך המחלה הוא מתקדם, אך קצב התקדמות המחלה שונה בין החולים. לאבחנה נכונה של המטופל ולטיפול תואם, חשיבות מכרעת בשליטה על התסמינים ועל איכות החיים של המטופל ובני משפחתו. קיימים טיפולים מגוונים לא תרופתיים, תרופתיים פומיים, משאבות וטיפולים ניתוחיים, המסייעים בטיפול במגוון התסמינים של מחלת פרקינסון. טיפול רב מקצועי, רצוי על ידי אנשי צוות המיומנים בטיפול בחולי פרקינסון, באופן קבוע, מסייע לטיפול בתסמינים ולשיפור איכות הטיפול בחולים. צפויה כניסה של טיפולים תרופתיים וטכנולוגיות טיפוליות חדשות, שעשויות לשנות דרמטית את מהלך המחלה, לעכב את התקדמותה, וייתכן שאף לרפאה. | |
| − | מחלת פרקינסון היא | ||
| − | |||
| − | == | + | ==רקע== |
| − | המחלה | + | '''מחלת פרקינסון (Parkinson's Disease)''' היא מחלה ניוונית נוירולוגית נפוצה עם ביטויים מוטוריים (Motor) ולא מוטוריים. מהלך המחלה הוא מתקדם (progressive), אך קצב התקדמות המחלה שונה בין החולים. המחלה נוטה להיות אסימטרית (asymmetrical), אך עם השנים מערבת את שני צדי הגוף. נכון ל-2024 אף טיפול לא הוכח כמרפא, או מאט, את קצב התקדמות המחלה, אולם קיימים טיפולים תרופתיים ולא תרופתיים יעילים לטיפול בתסמינים של המחלה. |
| − | פרקינסון | + | מחלת פרקינסון תוארה לראשונה בשנת 1817 על ידי James Parkinson. בעבר נטו לייחס למחלת הפרקינסון תסמינים מוטוריים בלבד, אולם מצטברות עדויות לגבי מעורבות מגוון תסמינים לא מוטוריים גדול אשר פעמים רבות גורמים להפרעה תפקודית ניכרת, יותר מאשר התסמינים המוטוריים. |
| − | + | ==קליניקה== | |
| + | מחלת הפרקינסון יכולה להתבטא במגוון רחב של תסמינים. לא כל חולה בהכרח יפתח את כלל התסמינים, וסדר הופעתם שונה בין חולים שונים. | ||
| + | ניתן לחלק את התסמינים לשתי קבוצות - תסמינים מוטוריים ולא מוטוריים. | ||
| − | + | ===תסמינים מוטוריים שכיחים=== | |
| − | + | '''רעד''' – רעד הוא תסמין שכיח במחלת פרקינסון, ונוטה להשתנות בעוצמתו ובפיזורו בגוף לאורך שנות המחלה. ישנם חולי פרקינסון שלא יפתחו רעד לכל אורך שנות המחלה. הרעד האופייני בחולה פרקינסון הוא במנוחה (רעד ביד בעת ישיבה ללא פעילות של היד), אולם יכול להופיע גם רעד תנוחתי (בעת שהיד מושטת לפנים) וגם רעד בפעולה (בזמן אכילה, שתייה וכתיבה). הפיזור האנטומי (anatomical) של הרעד כולל ידיים (השכיח ביותר), אך יכול לכלול גם רגליים, לשון ולסת. | |
| − | |||
| − | + | פעמים רבות הרעד מופיע רק בצד אחד של הגוף. הרעד במחלת פרקינסון איננו קבוע, ולסירוגין יכול להופיע ולהיעלם. עוצמת הרעד איננה קבועה, ופעמים רבות עשויה להחמיר בעוצמתה בעת מצבי דחק (stress). הרעד במחלת פרקינסון נעלם בעת שינה. | |
| − | |||
| − | |||
| − | + | '''איטיות''' – איטיות היא המאפיין הבולט של מחלת פרקינסון וכוללת איטיות בהליכה, איטיות בביצוע פעולות יומיות כגון הלבשה, רחצה ואכילה. חומרת האיטיות משתנה בין החולים, אולם בהיעדר טיפול האיטיות מחמירה עם הזמן, ועשויה לגרום להפרעה תפקודית משמעותית. פרט לאיטיות בתנועה קיים מרכיב של מיעוט תנועתי שעשוי להתבטא בהיעדר הבעות פנים ("פני מסכה"), מיעוט מצמוץ והפחתה בתנועות הספונטניות של החולה. לעיתים קרובות החולה אינו מבחין בכך שהוא נעשה איטי יותר בהליכה ובפעולות היומיות, והדבר מורגש לראשונה על ידי בני משפחתו של החולה. | |
| − | + | '''נוקשות''' - נוקשות במחלת פרקינסון אופיינית ועשויה לערב את הצוואר, הידיים והרגליים. החולה עשוי להרגיש תחושה של שריר תפוס, כבדות וקושי בהנעת הצוואר והגפיים. לעיתים הנוקשות גורמת לאי נוחות ואף לתחושת כאב באזור המעורב. הנוקשות יכולה להתבטא בקושי להסתובב במיטה ולקום מישיבה. | |
| − | |||
| − | + | '''הפרעת הליכה וחוסר יציבות''' – מאפיין בולט של מחלת פרקינסון היא ההפרעה בהליכה וחוסר יציבות. מאפייני ההליכה של חולי פרקינסון כוללים הליכה איטית, כפופה קדימה, עם היעדר טלטול הידיים בזמן הליכה (יד צמודה לגו), צעדים קצרים, גרירת רגליים, נטייה להלך על האצבעות וחוסר יציבות. עשויה להופיע נטייה לריצה קדימה עם צעדים קצרים ומהירים (festinating gait) וחוסר יכולת לבלום את התנועה. כמו כן, עם השנים עשויים להופיע קפאונות בהליכה (מצב בו הרגל "נדבקת לרצפה" לזמן קצר), בעיקר בעת סיבוב, תחילת הליכה ובעת מעבר דרך פתח צר. עם התקדמות המחלה, היציבות נפגעת וייתכנו נפילות שעלולות לגרום לפציעות. בחלק מהחולים הפרעת היציבות גורמת לפחד מנפילה, ולאור זאת לצמצום ההליכה. בשלבים מתקדמים של מחלה הפרעת ההליכה מאלצת את המטופלים להשתמש במקל ובהליכון ולעיתים אף לשימוש בכיסא גלגלים. | |
| − | + | '''Dystonia''' – נגרמת עקב כיווץ לא רצוני של שרירים, אשר יכולים לגרום לעיוות בתנוחת אצבעות הרגליים (כיפוף, משיכת כף רגל פנימה או החוצה). התכווצות השרירים עלולה לגורם לכאב. תופעה זאת יכולה להתרחש כחלק ממהלך המחלה, אך לעיתים עשויה להיגרם גם על ידי הטיפול התרופתי אותו החולה נוטל. | |
| − | |||
| − | + | '''תנודות מוטוריות''' – מצבם המוטורי של החולים אינו קבוע לאורך היממה ומשתנה בהתאם למשך הזמן שעבר מהמועד האחרון של נטילת התרופה, משך שנות המחלה, מתח ומיעוט שינה. בקרב חולים רבים המטופלים תרופתית מתפתחים מצבי ON בהם החולה מתפקד היטב מבחינה מוטורית ומצבי OFF בהם חלה החמרה באיטיות, בנוקשות, ברעד ובהפרעת ההליכה. משך ההשפעה של מנת תרופה עשוי להתקצר עם השנים, דבר המצריך נטילת מספר גבוה של מנות תרופה בטווח זמנים שהולך ומתקצר, תופעה הנקראת wearing OFF. כמו כן, חלק מהחולים מפתחים [[תנועות בלתי רצוניות|תנועות לא רצוניות]] בעלות גוון סיבובי לאחר שימוש ממושך בתרופות (דיסקינזיות, Dyskinesia). תנועות אלו נוטות להופיע בעיקר בעת מצב ON ועשויות לערב את הפנים, הגו והגפיים. פעמים רבות תנועות אלו לא מורגשות על ידי החולה, אלא על יד בני משפחתו. חולים מסוימים עוברים מספר פעמים ביום בין מצבי ON ו-OFF. | |
| − | + | '''הפרעה בדיבור''' ([[Dysarthria]]) – במרבית המקרים לחולי פרקינסון יש הפרעה בדיבור. ההפרעה האופיינית היא דיבור שקט בעוצמה נמוכה ולעיתים דיבור לא ברור. | |
| − | |||
| − | + | '''הפרעה בבליעה''' ([[הפרעות בליעה|Dysphagia]]) – בדרך כלל לא מופיעה בשנים הראשונות למחלה, אולם עם השנים עלול להתפתח קושי בבליעה עם סכנה להתפתחות [[דלקת ריאות - Pneumonia|דלקת ריאות]] על רקע שאיפת מזון לדרכי הנשימה ([[aspiration pneumonia]]). ההפרעה בבליעה גם גורמת לירידה בצריכה קלורית ועקב כך לירידה במשקל. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | === | + | ===תסמינים לא מוטוריים שכיחים=== |
| − | + | '''שינויים קוגניטיביים''' (cognitive) – בחלק מן החולים עשויה להתפתח הפרעה קוגניטיבית בדרגה משתנה, החל מהפרעה קלה ולא מורגשת בזיכרון ועד ל[[דמנציה|שטיון]] (Dementia) עם הפרעה משמעותית בזיכרון, בתפקודים ניהוליים, בקשב ובהתמצאות. בדרך כלל שינויים קוגניטיביים בולטים אינם אופייניים בשנים הראשונות של מחלת פרקינסון. הזיות ראייה ומחשבות בעלות גוון רודפני ([[הפרעת אישיות פרנואידית - Paranoid personality disorder|Paranoidal]]) עשויות להופיע לעיתים כחלק מהשינויים הקוגניטיביים של המחלה ולעיתים על רקע טיפול תרופתי כנגד מחלת פרקינסון. | |
| − | |||
| − | |||
| − | |||
| − | + | '''מצב רוח ירוד וחרדה''' – [[דיכאון - Depression|דיכאון]] ו[[חרדה]] מופיעים בקרב אחוז ניכר מחולי הפרקינסון וגורמים להפרעה ניכרת באיכות החיים. דיכאון יכול להתבטא בתחושת עצבות, הסתגרות בבית ובחוסר רצון להשתתף בפעילויות מחוץ לבית, בירידה בתיאבון ובהפרעה באיכות השינה. חרדה מתבטאת בתחושת אי שקט פנימי, לחץ, חוסר נוחות, דאגה מפני העתיד הלא ברור, ומפני התקדמות אפשרית של המחלה. בחלק מהחולים מופיעים התקפי חרדה המתבטאים ב[[דפיקות לב]] מואצות, [[קוצר נשימה]] ותחושת [[כאב בחזה|לחץ בחזה]]. | |
| − | |||
| − | + | דיכאון וחרדה גורמים להפרעה תפקודית שיכולה להתבטא בהחמרה מוטורית ובהפרעה חברתית ותעסוקתית. | |
| − | |||
| − | + | '''כאב''' – כאב במקומות שונים בגוף מופיע בשכיחות גבוהה במחלת פרקינסון ולעיתים מקדימים את אבחון המחלה. בין המקומות השכיחים לכאב – גב, צוואר, כתפיים וגפיים. | |
| − | |||
| − | + | '''ירידה בחוש הריח''' – הפרעה בחוש הריח שכיחה מאוד, ופעמים רבות מופיעה שנים בטרם הופעת התסמינים והסימנים המוטוריים ואבחון המחלה. | |
| − | + | '''הפרעות שינה''' – שכיחות בחולי פרקינסון. [[הפרעת שינה|הפרעת השינה]] יכולה להתבטא בקושי בהירדמות, התעוררויות מרובות, חלומות מוחשיים עם נטייה לדיבור, צעקות מתוך שינה ותנועות בגפיים מתוך שינה עד כדי נפילה מהמיטה. תופעה זאת נקראת REM (Rapid Eye Movement) sleep behavior disorder. פעמים רבות תופעה זאת מקדימה במספר שנים את התפתחות התסמינים התנועתיים של המחלה. אם חולה אינו ישן טוב, הדבר עשוי להחמיר את מצבו המוטורי של החולה. | |
| − | |||
| − | + | '''עצירות''' – שכיחה מאוד בקרב חולי פרקינסון, ופעמים רבות ה[[עצירות]] מקדימה את הופעת התסמינים המוטוריים. | |
| − | |||
| − | + | '''הפרעה בשליטה על שתן''' – כולל נטייה ל[[הפרעות במתן שתן|דחיפות במתן שתן]] עד כדי [[אנורזיס|איבוד שליטה על השתן]]. | |
| − | + | '''הפרעה בתפקוד מיני ובזיקפה''' - קיימת שכיחות מוגברת של [[הפרעה בתפקוד המיני|הפרעה בתפקוד מיני]] בקרב חולי פרקינסון. | |
| − | + | '''סחרחורת בשינוי תנוחה''' – ה[[סחרחורת]] נגרמת עקב [[ירידת לחץ דם]] במעבר בין שכיבה לישיבה ועמידה ([[Orthostatism]]) ועשויה לגרום לתחושת חולשה בעת עמידה, עד כדי [[איבוד הכרה]]. תופעה זאת קשורה הן למחלת פרקינסון והן לטיפול התרופתי הניתן כנגד מחלת פרקינסון. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | '''הפרעות שליטה בדחפים''' – מתבטאות בנטייה להתקפי אכילה בלתי נשלטים, בזבוז כספים רבים בקניות, הימורים פתולוגיים והתעסקות יתר במין. הפרעות השליטה בדחפים יכולות לגרום למתח גדול בני בני זוג, לאיבוד כספים ולתוצאות הרסניות. תופעות אלה עשויות להיגרם כתוצאה משימוש בתרופות אנטי-פרקינסוניות, בעיקר מקבוצת ה-[[t:Dopamine agonists - N04BC|Dopamine agonists]]. | |
| − | |||
| − | + | ==אתיולוגיה (Etiology)== | |
| − | + | הגורמים למחלת פרקינסון לא ידועים. ההשערות הן שגורמים גנטיים (genetic) בשילוב עם גורמים סביבתיים, גורמים לתהליכים של נזק חמצוני, להפרעה בתפקוד המיטוכונדריה (Mitochondria), לתהליכי דלקת ומנגנונים של מערכת החיסון ולקיפול לא תקין של חלבון, אשר קשורים בהתפתחות המחלה. | |
| − | + | נמצאה שכיחות גבוהה של מחלת פרקינסון בקרב אנשים הנחשפים לקוטלי חרקים. כמו כן, נמצאה שכיחות גבוהה בקרב אנשים עם רקע של [[חבלות ראש - Head injury|חבלות ראש]] משמעותיות בעבר. | |
| − | + | [[שתיית קפה]] ו[[עישון]] מפחיתים את הסיכון לחלות בפרקינסון. הסיבה אינה ברורה, וייתכן שקשורה בהשפעת [[Nicotine]] ו-[[Caffeine]] על התפתחות המחלה. נערכים מחקרים הבודקים את השפעתם על קצב התקדמות המחלה. | |
| − | + | '''גנטיקה:''' | |
| − | |||
| − | + | שכיחות מחלה גבוהה בקרב אנשים עם סיפור משפחתי של מחלת פרקינסון (פי 2.3 מאשר באוכלוסייה הכללית). נמצאו עשרות מוטציות גנטיות (genetic mutations) הנמצאות בקשר להתפתחות המחלה. בקרב האוכלוסייה היהודית האשכנזית, הגנים (genes) הנפוצים הקשורים בהתפתחות המחלה כוללים את LRRK2{{כ}} (Leucine-Rich Repeat Kinase 2) ו-GBA{{כ}} ( beta-Glucocerebrosidase) שמופיעים בכ-1/3 מחולי הפרקינסון היהודים האשכנזים. גנים אלה נמצאים בשכיחות נמוכה יותר בקרב אוכלוסיות אחרות. | |
| − | + | צורת התורשה של חלק מהמוטציות היא דומיננטית (Dominant) (מעבר מוטציה מאב או אם לצאצא), וחלקם רצסיביות (Recessive) (דורשות נוכחות מוטציה גם אצל האב וגם אצל האם). קיימת חדירות חלקית של המוטציות, כלומר, רק חלק מהאנשים הנושאים את המוטציה יפתחו את תסמיני המחלה. | |
| − | |||
| − | == | + | ==אפידמיולוגיה (Epidemiology)== |
| − | + | שכיחות המחלה עולה עם עליית הגיל, ומגיעה לשני אחוזים בגיל 80. גיל האבחון הממוצע הוא בעשור השביעי לחיים. כשבעה אחוזים מחולי הפרקינסון מאובחנים לפני גיל 50, ובחלקם מופיעות מוטציות גנטיות. | |
| − | + | מעריכים שיש כ-7.5 מיליון חולים במחלת פרקינסון בעולם. בישראל מספר חולי הפרקינסון מוערך בכ-30,000. המחלה שכיחה יותר בגברים לעומת נשים, ביחס של 1:1.5. | |
| − | |||
| − | == | + | ==פתולוגיה (Pathology)== |
| − | + | קיים ניוון של נוירונים המכילים [[Dopamine]] בגזע המוח באזור הנקרא Substantia nigra. עם התקדמות המחלה אזורים נוספים במוח עוברים ניוון. ניוון הנוירונים המכילים Dopamine אחראי למרבית התסמינים התנועתיים של המחלה. ניוון של נוירונים המכילים את המתווך הכימי [[סרוטונין - Serotonin|Serotonin]], תורם להתפתחות תסמינים של מצב רוח ירוד ושינויים במאזן [[Acetylcholine]]{{כ}}/Dopamine, קשורים בשינויים הקוגניטיביים המופיעים במחלה. | |
| − | + | מאפיין פתולוגי עיקרי של המחלה הוא נוכחות גופיף לוי (Lewy body) בתוך הנוירונים. גופיף לוי מכיל חלבון הנקרא [[Alpha-synuclein]] שמצטבר עקב שינוי במבנה המרחבי שלו. נערכים מחקרים הבודקים את השפעת נוגדנים כנגד חלבון Alpha-synuclein על תסמיני המחלה. | |
| − | |||
| − | + | '''סרטן:''' | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | בקרב החולים יש שכיחות גבוהה של סרטן עור מלנומה ביחס לאוכלוסייה הכללית. על כן מומלצת בדיקת רופא עור שגרתית לצורך אבחון מוקדם של סרטן עור. | |
| − | == | + | == אבחנה== |
| − | + | אבחנה ודאית של מחלת פרקינסון מתאפשרת רק באמצעות קבלת פתולוגיה מוחית המדגימה ניוון תאי עצבים ושקיעה של חלבון Alpha-synuclein. [[ביופסיה]] מוחית לא מבוצעת באנשים עם חשד למחלה. מבחינה מעשית האבחנה היא קלינית על סמך האנמנזה אופיינית, ממצאי הבדיקה הגופנית ובדיקות הדימות. המחלה מאובחנת ומטופלת לרוב על ידי נוירולוגים. | |
| − | + | כאשר יש שילוב של תסמינים וממצאים בבדיקה הכוללים איטיות, נוקשות ורעד, עולה חשד למחלת פרקינסון. קריטריונים קליניים נוספים שתומכים באבחנה הם תסמינים לא סימטרים בין שני צידי הגוף, מהלך התקדמות תסמינים הדרגתי, תגובה טובה של תסמינים לטיפול בתרופות המכילות לבודופא והיעדר תסמינים המכוונים למחלות אחרות. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ===אבחנה מבדלת=== | |
| + | בחלק מהאנשים מטופלים שמגיעים עם רעד, איטיות ונוקשות ([[Parkinsonism]]) לא מדובר במחלת פרקינסון אלא במחלות אחרות. אבחנה מבדלת של מחלת פרקינסון כוללת: | ||
| + | *רעד ראשוני - תסמונת נוירולוגית אחרת המתבטאת ברעד בידיים בפעולה | ||
| + | *[[תסמונות פרקינסון פלוס]] (Parkinson-Plus syndromes) {{כ}}(MSA{{כ}} (Multiple System Atrophy){{כ}}, PSP{{כ}} (Progressive Supranuclear Palsy){{כ}}, CBD{{כ}} (CorticoBasal Degeneration)) | ||
| + | *פרקינסוניזם שניוני (Secondary parkinsonism) (על רקע אירועים מוחיים קודמים, תהליכים תופסי מקום, תהליכים דלקתיים) | ||
| + | *פרקינסוניזם משני לתרופות - בעיקר תרופות מקבוצת הנוירולפטיקה (neuroleptics), הגורמות לחסימת הקולטן ל-Dopamine. תרופות אלו נמצאות בעיקר בשימוש לטיפול במחלות פסיכיאטריות, כגון [[Schizophrenia]] | ||
| + | *[[הידרוצפלוס נורמוטנסיבי - Normal pressure hydrocephalus|normal pressure hydrocephalus]] - מצב בו קיימת הרחבת חדרי המוח (Hydrocephalus) בשילוב עם תסמינים הכוללים הפרעת הליכה הדומה להליכה במחלת פרקינסון, הפרעה בשליטה על שתן ושינויים קוגניטיביים | ||
| − | === | + | ===הדמיה מוחית=== |
| − | + | הדמיה מוחית איננה הכרחית לביצוע האבחנה של מחלת פרקינסון, אולם לרוב אנשים עם חשד למחלת פרקינסון מופנים לבדיקות הדמיה, לצורך שלילת סיבות אחרות לתסמינים. | |
| − | + | ביצוע [[CT]]{{כ}} (Computer Tomography) או [[MRI]]{{כ}} (Magnetic Resonance Imaging) של המוח מסייעים לשלול סיבות נוספות לפרקינסוניזם (מצבים המתבטאים בתסמינים הכוללים רעד, איטיות ונוקשות), כגון פרקינסוניזם על רקע אירועים מוחיים, תהליכים דלקתיים, או גידולים במוח ומחלות ניווניות אחרות. | |
| − | תופעות לוואי | + | מיפוי מוח [[DaT-SPECT]] Scan{{כ}} (Dopamine transporter Single Photon Emission Computed Tomography) או [[F-dopa PET CT]] scan{{כ}} (Fluoro-DihydroxyPhenylAlanine Positron Emission Tomography CT) יכולים לסייע באבחנה של מחלת פרקינסון. בדיקות אלו מזהות את קצוות תאי העצבים המכילים Dopamine. במחלת פרקינסון אופיינית ירידה בקליטת החומר האיזוטופי (Isotope), דבר התומך בתהליך ניווני. בדיקת מיפוי המוח אינה מבוצעת באופן שגרתי לצורך אבחנה, אלא בעיקר במקרים של חוסר בהירות לגבי האבחנה במצבים בהם מנסים להבדיל בין רעד ראשוני למחלת פרקינסון ובמצבים בהם קיים חשד שהתסמינים נגרמים עקב תופעות לוואי של תרופות. |
| − | + | == טיפול== | |
| − | + | קיימים טיפולים מגוונים לשיפור תסמיני המחלה, בהם טיפולים לא תרופתיים ותרופתיים. נכון להיום הטיפולים מוכחים כמשפרים את תסמיני המחלה, אולם אין הוכחה לקיום טיפולים המעכבים את התקדמות המחלה, או כאלה שגורמים לריפוי המחלה. | |
| − | |||
| − | + | טיפולים לא תרופתיים כוללים [[פעילות גופנית]], [[פיזיותרפיה]], [[ריפוי בעיסוק]], [[קלינאות תקשורת]] ו[[דיאטה]]. | |
| − | |||
| − | + | הטיפול בתסמינים התנועתיים של המחלה מבוסס בעיקר על תרופות פומיות הפועלות על מנגנון המתווך הכימי ה-Dopamine. בנוסף קיים שימוש במשאבות תת-עוריות ומשאבות למעי הדק המזליפות תרופות בצורה רציפה, וניתוח לגירוי מוחי עמוק. | |
| − | |||
| − | |||
| − | + | לצורך טיפול מיטבי בחולה פרקינסון, ולאור המעורבות הרב מערכתית של המחלה בקרב החולים, נדרש טיפול של צוות מטפלים נרחב, בתלות תסמיני החולה, חומרתם ומידת ההפרעה לתפקוד המוטורי, הקוגניטיבי, הנפשי, התעסוקתי והחברתי. | |
| − | + | אנשי הצוות המטפלים בחולי פרקינסון כוללים נוירולוג, רצוי נוירולוג המומחה בטיפול בחולי פרקינסון. עבודות שפורסמו מראות שטיפול בחולים על ידי מומחה לפרקינסון משפר את דיוק האבחנה ואת תוצאות הטיפול בחולה. עוד בצוות המטפל בחולי פרקינסון כלולים מומחים ברפואת המשפחה, פסיכיאטריה, סיעוד, פיזיותרפיה, ריפוי בעיסוק, קלינאות תקשורת, דיאטה, עבודה סוציאלית, אימון כושר, פסיכולוגיה וסקסולוגיה. | |
| − | + | ===טיפולים לא תרופתיים למחלת פרקינסון=== | |
| + | מצטברות עדויות התומכות ביעילות של טיפולים לא תרופתיים לשיפור תסמינים של מחלת פרקינסון. קיימות עבודות מחקריות רבות שהדגימו שלפעילות גופנית על סוגיה השונים (כולל פעילות אירובית, תרגילי כוח, אימוני שווי משקל, הידרותרפיה (hydrotherapy), ריקודים, Tai Chi, שימוש בהליכה במציאות מדומה) יש השפעה חיובית על מצב החולים. פעילות גופנית קבועה מהווה המלצה טיפולית ראשונה במעלה בכל שלבי המחלה. לפעילות גופנית השפעה הן על תסמינים מוטוריים והן על תסמינים לא מוטוריים. אין המלצה ברורה לגבי סוג הפעילות הגופנית, משכה, עוצמתה ותדירותה. יש להקפיד על פעילות גופנית המותאמת למצבו הרפואי של החולה ותוך שמירה על בטיחותו. קיימת חשיבות למניעת נפילות ופציעות במהלך הפעילות הגופנית. אנשי הצוות שמטפלים באמצעות פעילות גופנית כוללים את התחומים פיזיותרפיה, ריפוי בעיסוק ואימון כושר. | ||
| − | + | '''אימונים קוגניטיביים''' – עשויים לשפר תפקוד קוגניטיבי ואף את התפקוד המוטורי. קיימות עבודות שחוקרות את השפעתם של טיפולים פסיכולוגים וריפוי באמצעות מוזיקה ואומנות על התפקוד הקוגניטיבי. | |
| − | + | '''טיפול בהפרעת בליעה''' - חולים רבים מפתחים הפרעות בדיבור ובבליעה. הפרעה בבליעה מגדילה את הסיכון לירידה במשקל ולסיבוך של שאיפה ריאתית עם התפתחות דלקת ריאות. הערכת בליעה על ידי קלינאי/ת תקשורת, לימוד שיטות לבליעה נכונה ושינוי דיאטטי מסייעים להפחית את שכיחות הסיבוכים. | |
| − | + | נכון לשנת 2024, אין הוכחה ליעילות של טיפולים ב[[תוספי תזונה]] ו[[ויטמינים]] בטיפול במחלה. | |
| − | |||
| − | + | ===תגובה לטיפול=== | |
| + | בשנים הראשונות של מחלת פרקינסון התגובה המוטורית לטיפול התרופתי בדרך כלל טובה. מרבית החולים מציינים שיפור באיטיות, בנוקשות, ברעד ובהליכה בעקבות הטיפול. עם השנים משך השפעת התרופות פוחת, ויש צורך בהעלאת מינון ותדירות מתן התרופות. החלון הטיפולי מצטמצם, ומתפתחות תנודות מוטוריות כולל מצבי ON ומצבי OFF. כמו כן, עם השנים, מחמיר חוסר היציבות ומתפתחים קפאונות בהליכה שמגיבים פחות טוב לטיפול תרופתי, וגורמים לנפילות ולהפרעה תפקודית. לאורך השנים, תיתכן הופעת תסמינים לא מוטוריים המגיבים פחות טוב לטיפול תרופתי ועשויים לגרום להחמרה תפקודית. | ||
| − | + | ===טיפולים להפרעה מוטורית=== | |
| + | הטיפולים התרופתיים הקיימים ברובם מבוססים על תרופות המכילות [[Levodopa]] שהופכות במוח ל-Dopamine, תרופות המעכבות את פירוק ה-Dopamine, או תרופות הפועלות ישירות על הקולטן ל-Dopamine. טיפול המכיל Levodopa הוא הטיפול היעיל ביותר לשיפור התסמינים התנועתיים של המחלה. | ||
| − | + | <big>ברשימה הבאה מוצגים טיפולים תרופתיים הקיימים לטיפול בתסמינים המוטוריים במחלת פרקינסון:</big> | |
| − | |||
| − | + | ====תרופות מקבוצת [[:t:קטגוריה:Monoamine oxidase inhibitors, non-selective - N06AF|Monoamine oxidase inhibitors]]==== | |
| + | [[Rasagiline]] (שם מסחרי Azilect) ו-[[Selegiline]] (שם מסחרי Selegiline) - אלו הן תרופות המעכבות את האנזים Monoamine oxidase B, וכך מעכבות את פירוק ה-Dopamine. אלו תרופות הנמצאות לרוב בשימוש בשלבים מוקדמים של מחלת פרקינסון, ונחשבות כבעלות יעילות נמוכה יחסית בשיפור התסמינים התנועתיים. תופעות הלוואי כוללות כאבי ראש ואי נוחות בטנית. | ||
| − | + | תרופה נוספת מקבוצה זאת היא [[Safinamide]] (שם מסחרי Xadago). זאת תרופה הפועלת במנגנון משולב של עיכוב האנזים Monoamine oxidase B ובנוסף ויסות (modulation) של המתווך הכימי Glutamate. תרופה זאת משמשת לטיפול בחולי פרקינסון בשלבים מתקדמים תחת טיפול תרופתי ב-Levodopa עם תנודות במצבם התנועתי ומסייעת להקלת על מצבי ה-OFF והדיסקינזיות. | |
| − | ==== | + | ====Amantadine==== |
| − | + | [[Amantadine]] (שם מסחרי: Pk-Merz). תרופה זאת עובדת במנגנון משולב הכולל השפעה נוגדת למתווך הכימי Glutamate, נוגדת למתווך הכימי Acetyl-Choline ובעלת השפעה על המתווך הכימי Dopamine. תרופה זאת יכולה לסייע לשיפור התסמינים התנועתיים של המחלה הכוללים רעד, איטיות ונוקשות, ובנוסף יכולה להקל על התנועות הלא רצוניות (דיסקינזיות), שמופיעות אצל חולים לאחר מספר שנות טיפול ב-Dopamine. תרופה זאת יכולה להינתן פומית או בצורת מתן עירוי תוך ורידית, ויכולה לשפר מצבים של OFF תנועתי וקיפאון בהליכה. | |
| − | תופעות לוואי | + | תופעות לוואי כוללות ירידה בלחץ הדם, נפיחות בכפות הרגליים, [[יובש בפה]], עצירת שתן, עצירות. |
| − | === | + | ====תרופות מקבוצת Dopamine agonists==== |
| − | + | תרופות מקבוצת [[:t:קטגוריה:Dopamine agonists - N04BC|Dopamine agonists]] הן תרופות שפועלות על הקולטן ל-Dopamine ומדמות את פעילות ה-Dopamine. הן בעלות יעילות גבוהה בשיפור התסמינים התנועתיים. דוגמאות לתרופות אלו הן [[Pramipexole]] (שם מסחרי Sifrol) ו-[[Ropinirole]] (שם מסחרי Requip). תרופות אלו ניתנות פעמים רבות בשלבים מוקדמים/בינוניים של המחלה כאמצעי לשיפור התסמינים התנועתיים, תוך עיכוב מועד התחלת הטיפול ב-Levodopa. תרופות אלו בשימוש נפוץ יותר בחולי פרקינסון צעירים יחסית. בגילאים מבוגרים התרופות פחות בשימוש עקב הסיכון להתפתחות [[הזיות]] ו[[בלבול]]. | |
| − | + | תופעות לוואי כוללות ירידת לחץ דם, [[בחילות]], ישנוניות, בלבול, הזיות, והפרעות שליטה בדחפים כולל הימורים פתולוגיים, היפר-סקסואליות (hypersexuality) ו[[הפרעת אכילה|אכילה כפייתית]]. | |
| − | + | ====תרופות המכילות Levodopa==== | |
| + | תרופות אלו מכילות Levodopa ביחד עם חומר מסוג Dopa decarboxylase inhibitor שתפקידו למנוע את פירוק ה-Levodopa במערכת העיכול ולהפחית תופעות לוואי כגון בחילה וירידת לחץ דם. Levodopa הופך במוח ל-Dopamine שפועל על הקולטן ל-Dopamine. תרופות אלו יעילות לשיפור התסמינים התנועתיים של המחלה. עם התקדמות המחלה רוב החולים יטופלו בתרופות המכילות Levodopa. לרוב, בשנים הראשונות של הטיפול ב-Levodopa קיים שיפור משמעותי בתסמינים התנועתיים. עם התקדמות המחלה והמשך ניוון העצבים במוח, יש צורך בהעלאה הדרגתית של מינון ה-Levodopa. לאחר מספר שנות טיפול בחלק מחולי הפרקינסון מתפתחות תנודות מוטוריות עם מצבי ON, מצבי OFF ודיסקינזיות. משך השפעת התרופה מתקצר ויש צורך בהעלאת המינון ותדירות מתן התרופות. דוגמאות לתרופות מקבוצה זאת כוללות: [[Carbidopa]]/Levodopa (שם מסחרי Dopicar ו-Sinemet), [[Benserazide]]/Levodopa (שם מסחרי Levopar, Madopar). | ||
| − | + | תופעות לוואי כוללות בחילות, ירידת לחץ דם ובשימוש ממושך התפתחות של תנודות מוטוריות עם מצבי OFF ודיסקינזיות. | |
| − | + | ====מעכבי אנזים Catechol-O-methyltransferase==== | |
| + | תרופות הפועלות על ידי עיכוב האנזים Catechol-O-methyltransferase מסייעות במניעת הפירוק של Levodopa, וכך מאפשרות לכמויות גדולות יותר לחדור את מחסום הדם-מוח ולשפר את התסמינים התנועתיים של המחלה. לרוב תרופות אלו נמצאות בשימוש בחולים עם מצבי OFF. | ||
| − | + | תרופות אלו ניתנות בשילוב עם תרופות המכילות Levodopa בצורת כדור הנקרא [[Entacapone]] (שם מסחרי Comtan), או בכדור אחד המכיל 3 מרכיבים פעילים Carbidopa/Levodopa/Entacapone (שם מסחרי [[Stalevo]]). | |
| − | + | תופעות לוואי כוללות בחילות, דיסקינזיות, סחרחורת ו[[שלשול]]. | |
| − | |||
| − | === | + | ====תרופות מקבוצת Anti-cholinergics==== |
| − | + | תרופות מקבוצה זאת פועלות על ידי עיכוב פעילות המתווך הכימי Acetyl-Choline. תרופות אלו יכולות לשפר תסמינים של רעד ו-Dystonia. השימוש בתרופות אלו פחת עקב פרופיל תופעות הלוואי. תרופות אלו נמצאות בשימוש בחלק מחולי הפרקינסון הצעירים ובמקרים של רעד קשה שלא מגיבים לטיפולים אחרים. | |
| − | + | דוגמאות לתרופות מקבוצה זאת: [[Biperiden]] (שם מסחרי Dekinet), [[Trihexyphenidyl]] (שם מסחרי Artane). | |
| − | |||
| − | + | תופעות לוואי כוללות יובש בפה, עצירות, אצירת שתן, בלבול והזיות. | |
| − | |||
| − | === | + | ===טיפול בחולים עם תנודות במצב התנועתי=== |
| − | + | בחולים עם תנודות מוטוריות הכוללים מצבי ON, OFF ודיסקינזיות עם הפרעה משמעותית בתפקוד, קיימים מספר טיפולים פולשניים שיכולים לשפר את התסמינים. ניתן לטפל באמצעות משאבות להזלפה רציפה תת-עורית של [[Apomorphine]], הזלפה רציפה של ג'ל המכיל Levodopa ישירות למעי הדק, הזלפה רציפה תת- עורית של Foslevodopa, או באמצעות ניתוח לגירוי מוחי עמוק. | |
| − | ==== | + | ====Apomorphine (שם מסחרי Apogo)==== |
| − | + | מנגנון פעולה של Dopamine agonist. התרופה Apomorphine פועלת באמצעות הפעלה של הקולטן ל-Dopamine. ניתנת בצורת זריקה תת-עורית באמצעות עט ([[Apogo]] pen), או באמצעות משאבה (Apogo pump), המזליפה בצורה רציפה Apomorphine לתת העור. צורת מתן התרופה בזריקה תת-עורית בעלת השפעה מהירה מאוד על שיפור התסמינים התנועתיים (השפעה תוך כ-10 דקות) ומיועדת להקלת מצבי OFF אצל חולים עם תנודות מוטוריות. משך השפעת הזריקה עד כשעה. בחולים עם מצבי OFF מרובים ביום ניתן להשתמש במשאבת Apomorphine לצורך הזלפה רציפה של תרופה להקלת התסמינים. | |
| − | + | תופעות לוואי כוללות ירידת לחץ דם, בחילות, סחרחורת, פצעים באזור ההזרקה, ישנוניות, בלבול, הזיות והפרעות שליטה בדחפים. | |
| − | |||
| − | ==== | + | ====משאבה המזליפה ג'ל המכיל Levodopa ישירות למעי הדק - (שם מסחרי: Duodopa)==== |
| − | + | [[Duodopa]] הוא טיפול במשאבה המזליפה ג'ל המכיל Levodopa/Carbidopa בצורה רציפה לתריסריון שבמעי הדק באמצעות צינורית המוחדרת למערכת העיכול בפעולה ניתוחית. במעי הדק נספגת התרופה, כך שמתגברים על המעבר האיטי של התרופה במערכת העיכול. על המטופל לשאת עליו את המשאבה במשך היום. לרוב, הזלפת התרופה נמשכת כ-16 שעות ביממה ומחליפה את הטיפול הפומי ב-Levodopa. טיפול זה ניתן לחולי פרקינסון בשלבים מתקדמים של המחלה, המגיבים טוב לטיפול ב-Levodopa, אך פיתחו תנודות מוטוריות, הכוללות זמני ON ו-OFF ודיסקינזיות. כאשר ההפרעה בתפקוד עקב התנודות המוטוריות משמעותית, הטיפול במשאבה מאפשר שמירה על רמה קבועה של Dopamine בדם והפחתה משמעותית בזמני OFF ובחומרתם ושיפור בתנועות הלא רצוניות (דיסקינזיות). תופעות לוואי של טיפול זה כוללות זיהום במערכת העיכול, כאבי בטן, סתימה ותזוזה של הצינורית. | |
| − | ==== | + | ====משאבה תת-עורית שמזליפה פוס-לבודופא באופן רציף - (שם מסחרי: Produodopa)==== |
| − | + | השימוש במשאבה החל בעולם בשנת 2023. המשאבה [[Produodopa]] היא משאבה המזליפה Foslevodopa/Foscarbodopa לתת-העור באמצעות צינורית המחוברת מצד אחד למשאבה ומצידה השני לעור ואינה דורשת ניתוח. משאבה זו מיועדת לטיפול בחולי פרקינסון עם תנודות מוטוריות לצורך שיפור מצבי OFF ודיסקינזיות. המשאבה מאפשרת מתן רציף של התרופה במינון אישי ומדויק לכל מטופל בהתאם לצרכיו במשך 24 שעות ביממה ובכך מדמה את המצב הפיזיולוגי בגוף ומחליפה את הטיפול הפומי ב-Levodopa. הוכח שטיפול זה משפר את התנודות המוטוריות ואת ההתעוררות בבוקר במצב OFF. | |
| − | + | תופעות הלוואי של טיפול זה, בנוסף לתופעות הידועות של Levodopa במתן פומי, הן בעיקר תופעות אודם וזיהומים עוריים. | |
| − | |||
| − | |||
| − | ==== | + | ====ניתוח גירוי מוחי עמוק==== |
| − | טיפול | + | ניתוח גירוי מוחי עמוק (Deep Brain Stimulation, DBS) הוא טיפול לחולי פרקינסון המתאפיינים בתנודות מוטוריות, תגובה טובה ל-Levodopa, גיל צעיר יחסית, ללא מחלות רקע משמעותיות, ללא ירידה קוגניטיבית. הניתוח נמצא בשימוש מזה כ-30 שנים. במהלך טיפול זה מוכנסות אלקטרודות למוח (בדרך כלל לשני הצדדים) לאזורים ספציפיים המשפיעים על התנועתיות. כמו כן, מוכנס קוצב לאזור החזה. באמצעות שינוי מאפייני הקיצוב המוחי ניתן להשפיע על התפקוד המוטורי של החולה. עדויות שהצטברו לאורך השנים מראות שניתוח גירוי מוחי עמוק מהווה טיפול יעיל לחולים הסובלים מתנודות מוטוריות. התסמינים המוטוריים המגיבים היטב לגירוי מוחי עמוק כוללים דיסקינזיות, מצבי OFF, נוקשות, איטיות, רעד ו-Dystonia. הניתוח דורש נוירוכירורג/ית שהתמקצע/ה בתחום זה, ולאחר הניתוח יש צורך בהגעה תדירה לבית החולים לצורך התאמת מאפייני הקיצוב המוחי על ידי נוירולוג/ית. כמו כל תהליך ניתוחי קיים סיכון בביצוע ניתוח זה הכולל התפתחות [[דימום מוחי]], [[אוטם מוחי|אוטם]] ו[[זיהום מוחי|זיהום]]. ניתוח זה עשוי להשפיע לרעה על מצבו הקוגניטיבי של החולה, על היציבות ועל היכולת לדבר. |
| + | |||
| + | ====טיפול ב-Focused ultra sound==== | ||
| + | טכנולוגיה טיפולית שנכנסה לשימוש. מדובר בטיפול לא פולשני בו גלי על-קול בתדירות גבוהה גורמים לחימום ולהרס של רקמת מוח באופן מכוון, תחת הנחיית MRI. טיפול זה אושר על ידי מנהל המזון והתרופות האמריקאי לטיפול ברעד ובדיסקינזיות של מחלת פרקינסון. לטיפול זה פוטנציאל לשיפור גם של תסמינים מוטוריים כגון רעד ואיטיות. החלטה על מיקום האזור במוח אליו יכוון הטיפול תלוי בתסמין. תופעות לוואי כוללות בחילות, כאב ראש, נימול, הפרעה ביציבות. | ||
| + | |||
| + | ===טיפולים להפרעות לא מוטוריות=== | ||
| + | הפרעות לא מוטוריות מתפתחות עם השנים במחלת פרקינסון ועשויות לגרום להפרעה תפקודית משמעותית יותר מההפרעה המוטורית. הפרעות אלו מהוות גורם שכיח ליציאת מטופל מהבית למסגרת מוסדית. הטיפול הוא תסמיני, בהתאם לתסמין ולהפרעה התפקודית הנגרמת. אמצעי הטיפול כוללים טיפולים לא תרופתיים באמצעות אנשי מקצוע פארא-רפואיים כגון מרפאים בעיסוק, קלינאי תקשורת, דיאטנים, פעילות גופנית, הפחתת תרופות קיימות והוספת טיפול תרופתי בהתאם לתסמין. | ||
| + | |||
| + | ההפרעות הלא מוטוריות יכולות לערב מערכות רבות בגוף וכוללות הפרעה קוגניטיבית, דיכאון וחרדה, הפרעה בחוש הריח, הפרעה בדיבור ובבליעה, הפרעה בשליטה על השתן, הפרעה בתפקוד מיני, עצירות, סחרחורת, הפרעה בשינה, ריור. הטיפול במגוון ההפרעות הלא מוטוריות הוא בהתאם לתסמין ולחומרת השפעתו על תפקוד המטופל ועל איכות חייו. | ||
| + | |||
| + | ===תרופות בפיתוח=== | ||
| + | קיים מחקר ענף לגבי טיפולים במחלת פרקינסון לתסמינים המוטוריים והלא מוטוריים. כמו כן, מתקיימים מחקרים לפיתוח טיפול למניעת התקדמות המחלה. בשנים הקרובות צפויה כניסת תרופות חדשות וטכנולוגיות חדשות לטיפול במחלת פרקינסון. | ||
| + | |||
| + | בין הטיפולים שנחקרים וצפויים להיכנס לשימוש כלולות צורות מתן חדשות של Levodopa וגם צורות חדשות של Amantadine ושל תרופות המעכבות את האנזימים Catechol-O-methyltransferase ו-Monoamine oxidase B. | ||
| + | |||
| + | בנתיחות לאחר המוות בחולי פרקינסון מוצאים שקיעה של החלבון Alpha-synuclein באזורים שונים במוח. עדויות מחקריות קושרות שקיעה של Alpha-synuclein להתקדמות התהליך הניווני העצבי במוח. ייתכן שצורות רעילות של החלבון עוברות מהחלל התוך תאי לחלל החוץ תאי ומשם מתקדמות לתוך תא נוירון שכן. עבודות בבעלי חיים שפורסמו מראות שבמודלים של פרקינסון בעכברים, שימוש בנוגדן כנגד Alpha-synuclein שיפור מוטורי בעכברים. נערכים מחקרים הבודקים את השפעת חיסון על טיפול ומניעת התקדמות של מחלת פרקינסון. נבדקת השפעת חיסון סביל (באמצעות נוגדנים של החלבון Alpha-synuclein ששוקע ברקמת המוח) וחיסון פעיל (באמצעות Antigen הגורם ליצירת נוגדנים כנגד החלבון) על התקדמות התסמינים בחולי פרקינסון. בנוסף נמצאים במחקר תרופות המיועדות לחולי פרקינסון עם מוטציה בגן GBA ותרופות אחרות לחולי פרקינסון עם מוטציה בגן LRRK2. | ||
| + | |||
| + | {{ייחוס|ד"ר מאיר קסטנבאום, סגן מנהל מחלקה נוירולוגית ומנהל מרפאת הפרעות תנועה, בי"ח מאיר, כפר סבא, meirkes@gmail.com{{ש}}המידע שבדף זה עודכן בתמיכה של חברת Abbvie, ללא מעורבות בתכנים}} | ||
[[קטגוריה:גריאטריה]] | [[קטגוריה:גריאטריה]] | ||
[[קטגוריה:נוירולוגיה]] | [[קטגוריה:נוירולוגיה]] | ||
גרסה אחרונה מ־12:43, 4 בספטמבר 2024
| מחלת פרקינסון | ||
|---|---|---|
| Parkinson's disease | ||
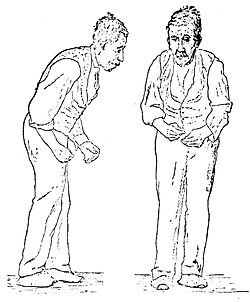
| ||
איור של יציבה אופיינית לחולה פרקינסון
| ||
| שמות נוספים | מחלת הרטטת, Idiopathic or primary parkinsonism | |
| ICD-10 | Chapter G 20., Chapter F 02.3 | |
| ICD-9 | 332 | |
| MeSH | D010300 | |
| יוצר הערך | ד"ר מאיר קסטנבאום | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלת פרקינסון
מחלת פרקינסון היא מחלה ניוונית נוירולוגית נפוצה עם ביטויים מוטוריים ולא מוטוריים. מהלך המחלה הוא מתקדם, אך קצב התקדמות המחלה שונה בין החולים. לאבחנה נכונה של המטופל ולטיפול תואם, חשיבות מכרעת בשליטה על התסמינים ועל איכות החיים של המטופל ובני משפחתו. קיימים טיפולים מגוונים לא תרופתיים, תרופתיים פומיים, משאבות וטיפולים ניתוחיים, המסייעים בטיפול במגוון התסמינים של מחלת פרקינסון. טיפול רב מקצועי, רצוי על ידי אנשי צוות המיומנים בטיפול בחולי פרקינסון, באופן קבוע, מסייע לטיפול בתסמינים ולשיפור איכות הטיפול בחולים. צפויה כניסה של טיפולים תרופתיים וטכנולוגיות טיפוליות חדשות, שעשויות לשנות דרמטית את מהלך המחלה, לעכב את התקדמותה, וייתכן שאף לרפאה.
רקע
מחלת פרקינסון (Parkinson's Disease) היא מחלה ניוונית נוירולוגית נפוצה עם ביטויים מוטוריים (Motor) ולא מוטוריים. מהלך המחלה הוא מתקדם (progressive), אך קצב התקדמות המחלה שונה בין החולים. המחלה נוטה להיות אסימטרית (asymmetrical), אך עם השנים מערבת את שני צדי הגוף. נכון ל-2024 אף טיפול לא הוכח כמרפא, או מאט, את קצב התקדמות המחלה, אולם קיימים טיפולים תרופתיים ולא תרופתיים יעילים לטיפול בתסמינים של המחלה.
מחלת פרקינסון תוארה לראשונה בשנת 1817 על ידי James Parkinson. בעבר נטו לייחס למחלת הפרקינסון תסמינים מוטוריים בלבד, אולם מצטברות עדויות לגבי מעורבות מגוון תסמינים לא מוטוריים גדול אשר פעמים רבות גורמים להפרעה תפקודית ניכרת, יותר מאשר התסמינים המוטוריים.
קליניקה
מחלת הפרקינסון יכולה להתבטא במגוון רחב של תסמינים. לא כל חולה בהכרח יפתח את כלל התסמינים, וסדר הופעתם שונה בין חולים שונים. ניתן לחלק את התסמינים לשתי קבוצות - תסמינים מוטוריים ולא מוטוריים.
תסמינים מוטוריים שכיחים
רעד – רעד הוא תסמין שכיח במחלת פרקינסון, ונוטה להשתנות בעוצמתו ובפיזורו בגוף לאורך שנות המחלה. ישנם חולי פרקינסון שלא יפתחו רעד לכל אורך שנות המחלה. הרעד האופייני בחולה פרקינסון הוא במנוחה (רעד ביד בעת ישיבה ללא פעילות של היד), אולם יכול להופיע גם רעד תנוחתי (בעת שהיד מושטת לפנים) וגם רעד בפעולה (בזמן אכילה, שתייה וכתיבה). הפיזור האנטומי (anatomical) של הרעד כולל ידיים (השכיח ביותר), אך יכול לכלול גם רגליים, לשון ולסת.
פעמים רבות הרעד מופיע רק בצד אחד של הגוף. הרעד במחלת פרקינסון איננו קבוע, ולסירוגין יכול להופיע ולהיעלם. עוצמת הרעד איננה קבועה, ופעמים רבות עשויה להחמיר בעוצמתה בעת מצבי דחק (stress). הרעד במחלת פרקינסון נעלם בעת שינה.
איטיות – איטיות היא המאפיין הבולט של מחלת פרקינסון וכוללת איטיות בהליכה, איטיות בביצוע פעולות יומיות כגון הלבשה, רחצה ואכילה. חומרת האיטיות משתנה בין החולים, אולם בהיעדר טיפול האיטיות מחמירה עם הזמן, ועשויה לגרום להפרעה תפקודית משמעותית. פרט לאיטיות בתנועה קיים מרכיב של מיעוט תנועתי שעשוי להתבטא בהיעדר הבעות פנים ("פני מסכה"), מיעוט מצמוץ והפחתה בתנועות הספונטניות של החולה. לעיתים קרובות החולה אינו מבחין בכך שהוא נעשה איטי יותר בהליכה ובפעולות היומיות, והדבר מורגש לראשונה על ידי בני משפחתו של החולה.
נוקשות - נוקשות במחלת פרקינסון אופיינית ועשויה לערב את הצוואר, הידיים והרגליים. החולה עשוי להרגיש תחושה של שריר תפוס, כבדות וקושי בהנעת הצוואר והגפיים. לעיתים הנוקשות גורמת לאי נוחות ואף לתחושת כאב באזור המעורב. הנוקשות יכולה להתבטא בקושי להסתובב במיטה ולקום מישיבה.
הפרעת הליכה וחוסר יציבות – מאפיין בולט של מחלת פרקינסון היא ההפרעה בהליכה וחוסר יציבות. מאפייני ההליכה של חולי פרקינסון כוללים הליכה איטית, כפופה קדימה, עם היעדר טלטול הידיים בזמן הליכה (יד צמודה לגו), צעדים קצרים, גרירת רגליים, נטייה להלך על האצבעות וחוסר יציבות. עשויה להופיע נטייה לריצה קדימה עם צעדים קצרים ומהירים (festinating gait) וחוסר יכולת לבלום את התנועה. כמו כן, עם השנים עשויים להופיע קפאונות בהליכה (מצב בו הרגל "נדבקת לרצפה" לזמן קצר), בעיקר בעת סיבוב, תחילת הליכה ובעת מעבר דרך פתח צר. עם התקדמות המחלה, היציבות נפגעת וייתכנו נפילות שעלולות לגרום לפציעות. בחלק מהחולים הפרעת היציבות גורמת לפחד מנפילה, ולאור זאת לצמצום ההליכה. בשלבים מתקדמים של מחלה הפרעת ההליכה מאלצת את המטופלים להשתמש במקל ובהליכון ולעיתים אף לשימוש בכיסא גלגלים.
Dystonia – נגרמת עקב כיווץ לא רצוני של שרירים, אשר יכולים לגרום לעיוות בתנוחת אצבעות הרגליים (כיפוף, משיכת כף רגל פנימה או החוצה). התכווצות השרירים עלולה לגורם לכאב. תופעה זאת יכולה להתרחש כחלק ממהלך המחלה, אך לעיתים עשויה להיגרם גם על ידי הטיפול התרופתי אותו החולה נוטל.
תנודות מוטוריות – מצבם המוטורי של החולים אינו קבוע לאורך היממה ומשתנה בהתאם למשך הזמן שעבר מהמועד האחרון של נטילת התרופה, משך שנות המחלה, מתח ומיעוט שינה. בקרב חולים רבים המטופלים תרופתית מתפתחים מצבי ON בהם החולה מתפקד היטב מבחינה מוטורית ומצבי OFF בהם חלה החמרה באיטיות, בנוקשות, ברעד ובהפרעת ההליכה. משך ההשפעה של מנת תרופה עשוי להתקצר עם השנים, דבר המצריך נטילת מספר גבוה של מנות תרופה בטווח זמנים שהולך ומתקצר, תופעה הנקראת wearing OFF. כמו כן, חלק מהחולים מפתחים תנועות לא רצוניות בעלות גוון סיבובי לאחר שימוש ממושך בתרופות (דיסקינזיות, Dyskinesia). תנועות אלו נוטות להופיע בעיקר בעת מצב ON ועשויות לערב את הפנים, הגו והגפיים. פעמים רבות תנועות אלו לא מורגשות על ידי החולה, אלא על יד בני משפחתו. חולים מסוימים עוברים מספר פעמים ביום בין מצבי ON ו-OFF.
הפרעה בדיבור (Dysarthria) – במרבית המקרים לחולי פרקינסון יש הפרעה בדיבור. ההפרעה האופיינית היא דיבור שקט בעוצמה נמוכה ולעיתים דיבור לא ברור.
הפרעה בבליעה (Dysphagia) – בדרך כלל לא מופיעה בשנים הראשונות למחלה, אולם עם השנים עלול להתפתח קושי בבליעה עם סכנה להתפתחות דלקת ריאות על רקע שאיפת מזון לדרכי הנשימה (aspiration pneumonia). ההפרעה בבליעה גם גורמת לירידה בצריכה קלורית ועקב כך לירידה במשקל.
תסמינים לא מוטוריים שכיחים
שינויים קוגניטיביים (cognitive) – בחלק מן החולים עשויה להתפתח הפרעה קוגניטיבית בדרגה משתנה, החל מהפרעה קלה ולא מורגשת בזיכרון ועד לשטיון (Dementia) עם הפרעה משמעותית בזיכרון, בתפקודים ניהוליים, בקשב ובהתמצאות. בדרך כלל שינויים קוגניטיביים בולטים אינם אופייניים בשנים הראשונות של מחלת פרקינסון. הזיות ראייה ומחשבות בעלות גוון רודפני (Paranoidal) עשויות להופיע לעיתים כחלק מהשינויים הקוגניטיביים של המחלה ולעיתים על רקע טיפול תרופתי כנגד מחלת פרקינסון.
מצב רוח ירוד וחרדה – דיכאון וחרדה מופיעים בקרב אחוז ניכר מחולי הפרקינסון וגורמים להפרעה ניכרת באיכות החיים. דיכאון יכול להתבטא בתחושת עצבות, הסתגרות בבית ובחוסר רצון להשתתף בפעילויות מחוץ לבית, בירידה בתיאבון ובהפרעה באיכות השינה. חרדה מתבטאת בתחושת אי שקט פנימי, לחץ, חוסר נוחות, דאגה מפני העתיד הלא ברור, ומפני התקדמות אפשרית של המחלה. בחלק מהחולים מופיעים התקפי חרדה המתבטאים בדפיקות לב מואצות, קוצר נשימה ותחושת לחץ בחזה.
דיכאון וחרדה גורמים להפרעה תפקודית שיכולה להתבטא בהחמרה מוטורית ובהפרעה חברתית ותעסוקתית.
כאב – כאב במקומות שונים בגוף מופיע בשכיחות גבוהה במחלת פרקינסון ולעיתים מקדימים את אבחון המחלה. בין המקומות השכיחים לכאב – גב, צוואר, כתפיים וגפיים.
ירידה בחוש הריח – הפרעה בחוש הריח שכיחה מאוד, ופעמים רבות מופיעה שנים בטרם הופעת התסמינים והסימנים המוטוריים ואבחון המחלה.
הפרעות שינה – שכיחות בחולי פרקינסון. הפרעת השינה יכולה להתבטא בקושי בהירדמות, התעוררויות מרובות, חלומות מוחשיים עם נטייה לדיבור, צעקות מתוך שינה ותנועות בגפיים מתוך שינה עד כדי נפילה מהמיטה. תופעה זאת נקראת REM (Rapid Eye Movement) sleep behavior disorder. פעמים רבות תופעה זאת מקדימה במספר שנים את התפתחות התסמינים התנועתיים של המחלה. אם חולה אינו ישן טוב, הדבר עשוי להחמיר את מצבו המוטורי של החולה.
עצירות – שכיחה מאוד בקרב חולי פרקינסון, ופעמים רבות העצירות מקדימה את הופעת התסמינים המוטוריים.
הפרעה בשליטה על שתן – כולל נטייה לדחיפות במתן שתן עד כדי איבוד שליטה על השתן.
הפרעה בתפקוד מיני ובזיקפה - קיימת שכיחות מוגברת של הפרעה בתפקוד מיני בקרב חולי פרקינסון.
סחרחורת בשינוי תנוחה – הסחרחורת נגרמת עקב ירידת לחץ דם במעבר בין שכיבה לישיבה ועמידה (Orthostatism) ועשויה לגרום לתחושת חולשה בעת עמידה, עד כדי איבוד הכרה. תופעה זאת קשורה הן למחלת פרקינסון והן לטיפול התרופתי הניתן כנגד מחלת פרקינסון.
הפרעות שליטה בדחפים – מתבטאות בנטייה להתקפי אכילה בלתי נשלטים, בזבוז כספים רבים בקניות, הימורים פתולוגיים והתעסקות יתר במין. הפרעות השליטה בדחפים יכולות לגרום למתח גדול בני בני זוג, לאיבוד כספים ולתוצאות הרסניות. תופעות אלה עשויות להיגרם כתוצאה משימוש בתרופות אנטי-פרקינסוניות, בעיקר מקבוצת ה-Dopamine agonists.
אתיולוגיה (Etiology)
הגורמים למחלת פרקינסון לא ידועים. ההשערות הן שגורמים גנטיים (genetic) בשילוב עם גורמים סביבתיים, גורמים לתהליכים של נזק חמצוני, להפרעה בתפקוד המיטוכונדריה (Mitochondria), לתהליכי דלקת ומנגנונים של מערכת החיסון ולקיפול לא תקין של חלבון, אשר קשורים בהתפתחות המחלה.
נמצאה שכיחות גבוהה של מחלת פרקינסון בקרב אנשים הנחשפים לקוטלי חרקים. כמו כן, נמצאה שכיחות גבוהה בקרב אנשים עם רקע של חבלות ראש משמעותיות בעבר. שתיית קפה ועישון מפחיתים את הסיכון לחלות בפרקינסון. הסיבה אינה ברורה, וייתכן שקשורה בהשפעת Nicotine ו-Caffeine על התפתחות המחלה. נערכים מחקרים הבודקים את השפעתם על קצב התקדמות המחלה.
גנטיקה:
שכיחות מחלה גבוהה בקרב אנשים עם סיפור משפחתי של מחלת פרקינסון (פי 2.3 מאשר באוכלוסייה הכללית). נמצאו עשרות מוטציות גנטיות (genetic mutations) הנמצאות בקשר להתפתחות המחלה. בקרב האוכלוסייה היהודית האשכנזית, הגנים (genes) הנפוצים הקשורים בהתפתחות המחלה כוללים את LRRK2 (Leucine-Rich Repeat Kinase 2) ו-GBA ( beta-Glucocerebrosidase) שמופיעים בכ-1/3 מחולי הפרקינסון היהודים האשכנזים. גנים אלה נמצאים בשכיחות נמוכה יותר בקרב אוכלוסיות אחרות.
צורת התורשה של חלק מהמוטציות היא דומיננטית (Dominant) (מעבר מוטציה מאב או אם לצאצא), וחלקם רצסיביות (Recessive) (דורשות נוכחות מוטציה גם אצל האב וגם אצל האם). קיימת חדירות חלקית של המוטציות, כלומר, רק חלק מהאנשים הנושאים את המוטציה יפתחו את תסמיני המחלה.
אפידמיולוגיה (Epidemiology)
שכיחות המחלה עולה עם עליית הגיל, ומגיעה לשני אחוזים בגיל 80. גיל האבחון הממוצע הוא בעשור השביעי לחיים. כשבעה אחוזים מחולי הפרקינסון מאובחנים לפני גיל 50, ובחלקם מופיעות מוטציות גנטיות.
מעריכים שיש כ-7.5 מיליון חולים במחלת פרקינסון בעולם. בישראל מספר חולי הפרקינסון מוערך בכ-30,000. המחלה שכיחה יותר בגברים לעומת נשים, ביחס של 1:1.5.
פתולוגיה (Pathology)
קיים ניוון של נוירונים המכילים Dopamine בגזע המוח באזור הנקרא Substantia nigra. עם התקדמות המחלה אזורים נוספים במוח עוברים ניוון. ניוון הנוירונים המכילים Dopamine אחראי למרבית התסמינים התנועתיים של המחלה. ניוון של נוירונים המכילים את המתווך הכימי Serotonin, תורם להתפתחות תסמינים של מצב רוח ירוד ושינויים במאזן Acetylcholine/Dopamine, קשורים בשינויים הקוגניטיביים המופיעים במחלה.
מאפיין פתולוגי עיקרי של המחלה הוא נוכחות גופיף לוי (Lewy body) בתוך הנוירונים. גופיף לוי מכיל חלבון הנקרא Alpha-synuclein שמצטבר עקב שינוי במבנה המרחבי שלו. נערכים מחקרים הבודקים את השפעת נוגדנים כנגד חלבון Alpha-synuclein על תסמיני המחלה.
סרטן:
בקרב החולים יש שכיחות גבוהה של סרטן עור מלנומה ביחס לאוכלוסייה הכללית. על כן מומלצת בדיקת רופא עור שגרתית לצורך אבחון מוקדם של סרטן עור.
אבחנה
אבחנה ודאית של מחלת פרקינסון מתאפשרת רק באמצעות קבלת פתולוגיה מוחית המדגימה ניוון תאי עצבים ושקיעה של חלבון Alpha-synuclein. ביופסיה מוחית לא מבוצעת באנשים עם חשד למחלה. מבחינה מעשית האבחנה היא קלינית על סמך האנמנזה אופיינית, ממצאי הבדיקה הגופנית ובדיקות הדימות. המחלה מאובחנת ומטופלת לרוב על ידי נוירולוגים.
כאשר יש שילוב של תסמינים וממצאים בבדיקה הכוללים איטיות, נוקשות ורעד, עולה חשד למחלת פרקינסון. קריטריונים קליניים נוספים שתומכים באבחנה הם תסמינים לא סימטרים בין שני צידי הגוף, מהלך התקדמות תסמינים הדרגתי, תגובה טובה של תסמינים לטיפול בתרופות המכילות לבודופא והיעדר תסמינים המכוונים למחלות אחרות.
אבחנה מבדלת
בחלק מהאנשים מטופלים שמגיעים עם רעד, איטיות ונוקשות (Parkinsonism) לא מדובר במחלת פרקינסון אלא במחלות אחרות. אבחנה מבדלת של מחלת פרקינסון כוללת:
- רעד ראשוני - תסמונת נוירולוגית אחרת המתבטאת ברעד בידיים בפעולה
- תסמונות פרקינסון פלוס (Parkinson-Plus syndromes) (MSA (Multiple System Atrophy), PSP (Progressive Supranuclear Palsy), CBD (CorticoBasal Degeneration))
- פרקינסוניזם שניוני (Secondary parkinsonism) (על רקע אירועים מוחיים קודמים, תהליכים תופסי מקום, תהליכים דלקתיים)
- פרקינסוניזם משני לתרופות - בעיקר תרופות מקבוצת הנוירולפטיקה (neuroleptics), הגורמות לחסימת הקולטן ל-Dopamine. תרופות אלו נמצאות בעיקר בשימוש לטיפול במחלות פסיכיאטריות, כגון Schizophrenia
- normal pressure hydrocephalus - מצב בו קיימת הרחבת חדרי המוח (Hydrocephalus) בשילוב עם תסמינים הכוללים הפרעת הליכה הדומה להליכה במחלת פרקינסון, הפרעה בשליטה על שתן ושינויים קוגניטיביים
הדמיה מוחית
הדמיה מוחית איננה הכרחית לביצוע האבחנה של מחלת פרקינסון, אולם לרוב אנשים עם חשד למחלת פרקינסון מופנים לבדיקות הדמיה, לצורך שלילת סיבות אחרות לתסמינים.
ביצוע CT (Computer Tomography) או MRI (Magnetic Resonance Imaging) של המוח מסייעים לשלול סיבות נוספות לפרקינסוניזם (מצבים המתבטאים בתסמינים הכוללים רעד, איטיות ונוקשות), כגון פרקינסוניזם על רקע אירועים מוחיים, תהליכים דלקתיים, או גידולים במוח ומחלות ניווניות אחרות.
מיפוי מוח DaT-SPECT Scan (Dopamine transporter Single Photon Emission Computed Tomography) או F-dopa PET CT scan (Fluoro-DihydroxyPhenylAlanine Positron Emission Tomography CT) יכולים לסייע באבחנה של מחלת פרקינסון. בדיקות אלו מזהות את קצוות תאי העצבים המכילים Dopamine. במחלת פרקינסון אופיינית ירידה בקליטת החומר האיזוטופי (Isotope), דבר התומך בתהליך ניווני. בדיקת מיפוי המוח אינה מבוצעת באופן שגרתי לצורך אבחנה, אלא בעיקר במקרים של חוסר בהירות לגבי האבחנה במצבים בהם מנסים להבדיל בין רעד ראשוני למחלת פרקינסון ובמצבים בהם קיים חשד שהתסמינים נגרמים עקב תופעות לוואי של תרופות.
טיפול
קיימים טיפולים מגוונים לשיפור תסמיני המחלה, בהם טיפולים לא תרופתיים ותרופתיים. נכון להיום הטיפולים מוכחים כמשפרים את תסמיני המחלה, אולם אין הוכחה לקיום טיפולים המעכבים את התקדמות המחלה, או כאלה שגורמים לריפוי המחלה.
טיפולים לא תרופתיים כוללים פעילות גופנית, פיזיותרפיה, ריפוי בעיסוק, קלינאות תקשורת ודיאטה.
הטיפול בתסמינים התנועתיים של המחלה מבוסס בעיקר על תרופות פומיות הפועלות על מנגנון המתווך הכימי ה-Dopamine. בנוסף קיים שימוש במשאבות תת-עוריות ומשאבות למעי הדק המזליפות תרופות בצורה רציפה, וניתוח לגירוי מוחי עמוק.
לצורך טיפול מיטבי בחולה פרקינסון, ולאור המעורבות הרב מערכתית של המחלה בקרב החולים, נדרש טיפול של צוות מטפלים נרחב, בתלות תסמיני החולה, חומרתם ומידת ההפרעה לתפקוד המוטורי, הקוגניטיבי, הנפשי, התעסוקתי והחברתי.
אנשי הצוות המטפלים בחולי פרקינסון כוללים נוירולוג, רצוי נוירולוג המומחה בטיפול בחולי פרקינסון. עבודות שפורסמו מראות שטיפול בחולים על ידי מומחה לפרקינסון משפר את דיוק האבחנה ואת תוצאות הטיפול בחולה. עוד בצוות המטפל בחולי פרקינסון כלולים מומחים ברפואת המשפחה, פסיכיאטריה, סיעוד, פיזיותרפיה, ריפוי בעיסוק, קלינאות תקשורת, דיאטה, עבודה סוציאלית, אימון כושר, פסיכולוגיה וסקסולוגיה.
טיפולים לא תרופתיים למחלת פרקינסון
מצטברות עדויות התומכות ביעילות של טיפולים לא תרופתיים לשיפור תסמינים של מחלת פרקינסון. קיימות עבודות מחקריות רבות שהדגימו שלפעילות גופנית על סוגיה השונים (כולל פעילות אירובית, תרגילי כוח, אימוני שווי משקל, הידרותרפיה (hydrotherapy), ריקודים, Tai Chi, שימוש בהליכה במציאות מדומה) יש השפעה חיובית על מצב החולים. פעילות גופנית קבועה מהווה המלצה טיפולית ראשונה במעלה בכל שלבי המחלה. לפעילות גופנית השפעה הן על תסמינים מוטוריים והן על תסמינים לא מוטוריים. אין המלצה ברורה לגבי סוג הפעילות הגופנית, משכה, עוצמתה ותדירותה. יש להקפיד על פעילות גופנית המותאמת למצבו הרפואי של החולה ותוך שמירה על בטיחותו. קיימת חשיבות למניעת נפילות ופציעות במהלך הפעילות הגופנית. אנשי הצוות שמטפלים באמצעות פעילות גופנית כוללים את התחומים פיזיותרפיה, ריפוי בעיסוק ואימון כושר.
אימונים קוגניטיביים – עשויים לשפר תפקוד קוגניטיבי ואף את התפקוד המוטורי. קיימות עבודות שחוקרות את השפעתם של טיפולים פסיכולוגים וריפוי באמצעות מוזיקה ואומנות על התפקוד הקוגניטיבי.
טיפול בהפרעת בליעה - חולים רבים מפתחים הפרעות בדיבור ובבליעה. הפרעה בבליעה מגדילה את הסיכון לירידה במשקל ולסיבוך של שאיפה ריאתית עם התפתחות דלקת ריאות. הערכת בליעה על ידי קלינאי/ת תקשורת, לימוד שיטות לבליעה נכונה ושינוי דיאטטי מסייעים להפחית את שכיחות הסיבוכים.
נכון לשנת 2024, אין הוכחה ליעילות של טיפולים בתוספי תזונה וויטמינים בטיפול במחלה.
תגובה לטיפול
בשנים הראשונות של מחלת פרקינסון התגובה המוטורית לטיפול התרופתי בדרך כלל טובה. מרבית החולים מציינים שיפור באיטיות, בנוקשות, ברעד ובהליכה בעקבות הטיפול. עם השנים משך השפעת התרופות פוחת, ויש צורך בהעלאת מינון ותדירות מתן התרופות. החלון הטיפולי מצטמצם, ומתפתחות תנודות מוטוריות כולל מצבי ON ומצבי OFF. כמו כן, עם השנים, מחמיר חוסר היציבות ומתפתחים קפאונות בהליכה שמגיבים פחות טוב לטיפול תרופתי, וגורמים לנפילות ולהפרעה תפקודית. לאורך השנים, תיתכן הופעת תסמינים לא מוטוריים המגיבים פחות טוב לטיפול תרופתי ועשויים לגרום להחמרה תפקודית.
טיפולים להפרעה מוטורית
הטיפולים התרופתיים הקיימים ברובם מבוססים על תרופות המכילות Levodopa שהופכות במוח ל-Dopamine, תרופות המעכבות את פירוק ה-Dopamine, או תרופות הפועלות ישירות על הקולטן ל-Dopamine. טיפול המכיל Levodopa הוא הטיפול היעיל ביותר לשיפור התסמינים התנועתיים של המחלה.
ברשימה הבאה מוצגים טיפולים תרופתיים הקיימים לטיפול בתסמינים המוטוריים במחלת פרקינסון:
תרופות מקבוצת Monoamine oxidase inhibitors
Rasagiline (שם מסחרי Azilect) ו-Selegiline (שם מסחרי Selegiline) - אלו הן תרופות המעכבות את האנזים Monoamine oxidase B, וכך מעכבות את פירוק ה-Dopamine. אלו תרופות הנמצאות לרוב בשימוש בשלבים מוקדמים של מחלת פרקינסון, ונחשבות כבעלות יעילות נמוכה יחסית בשיפור התסמינים התנועתיים. תופעות הלוואי כוללות כאבי ראש ואי נוחות בטנית.
תרופה נוספת מקבוצה זאת היא Safinamide (שם מסחרי Xadago). זאת תרופה הפועלת במנגנון משולב של עיכוב האנזים Monoamine oxidase B ובנוסף ויסות (modulation) של המתווך הכימי Glutamate. תרופה זאת משמשת לטיפול בחולי פרקינסון בשלבים מתקדמים תחת טיפול תרופתי ב-Levodopa עם תנודות במצבם התנועתי ומסייעת להקלת על מצבי ה-OFF והדיסקינזיות.
Amantadine
Amantadine (שם מסחרי: Pk-Merz). תרופה זאת עובדת במנגנון משולב הכולל השפעה נוגדת למתווך הכימי Glutamate, נוגדת למתווך הכימי Acetyl-Choline ובעלת השפעה על המתווך הכימי Dopamine. תרופה זאת יכולה לסייע לשיפור התסמינים התנועתיים של המחלה הכוללים רעד, איטיות ונוקשות, ובנוסף יכולה להקל על התנועות הלא רצוניות (דיסקינזיות), שמופיעות אצל חולים לאחר מספר שנות טיפול ב-Dopamine. תרופה זאת יכולה להינתן פומית או בצורת מתן עירוי תוך ורידית, ויכולה לשפר מצבים של OFF תנועתי וקיפאון בהליכה.
תופעות לוואי כוללות ירידה בלחץ הדם, נפיחות בכפות הרגליים, יובש בפה, עצירת שתן, עצירות.
תרופות מקבוצת Dopamine agonists
תרופות מקבוצת Dopamine agonists הן תרופות שפועלות על הקולטן ל-Dopamine ומדמות את פעילות ה-Dopamine. הן בעלות יעילות גבוהה בשיפור התסמינים התנועתיים. דוגמאות לתרופות אלו הן Pramipexole (שם מסחרי Sifrol) ו-Ropinirole (שם מסחרי Requip). תרופות אלו ניתנות פעמים רבות בשלבים מוקדמים/בינוניים של המחלה כאמצעי לשיפור התסמינים התנועתיים, תוך עיכוב מועד התחלת הטיפול ב-Levodopa. תרופות אלו בשימוש נפוץ יותר בחולי פרקינסון צעירים יחסית. בגילאים מבוגרים התרופות פחות בשימוש עקב הסיכון להתפתחות הזיות ובלבול.
תופעות לוואי כוללות ירידת לחץ דם, בחילות, ישנוניות, בלבול, הזיות, והפרעות שליטה בדחפים כולל הימורים פתולוגיים, היפר-סקסואליות (hypersexuality) ואכילה כפייתית.
תרופות המכילות Levodopa
תרופות אלו מכילות Levodopa ביחד עם חומר מסוג Dopa decarboxylase inhibitor שתפקידו למנוע את פירוק ה-Levodopa במערכת העיכול ולהפחית תופעות לוואי כגון בחילה וירידת לחץ דם. Levodopa הופך במוח ל-Dopamine שפועל על הקולטן ל-Dopamine. תרופות אלו יעילות לשיפור התסמינים התנועתיים של המחלה. עם התקדמות המחלה רוב החולים יטופלו בתרופות המכילות Levodopa. לרוב, בשנים הראשונות של הטיפול ב-Levodopa קיים שיפור משמעותי בתסמינים התנועתיים. עם התקדמות המחלה והמשך ניוון העצבים במוח, יש צורך בהעלאה הדרגתית של מינון ה-Levodopa. לאחר מספר שנות טיפול בחלק מחולי הפרקינסון מתפתחות תנודות מוטוריות עם מצבי ON, מצבי OFF ודיסקינזיות. משך השפעת התרופה מתקצר ויש צורך בהעלאת המינון ותדירות מתן התרופות. דוגמאות לתרופות מקבוצה זאת כוללות: Carbidopa/Levodopa (שם מסחרי Dopicar ו-Sinemet), Benserazide/Levodopa (שם מסחרי Levopar, Madopar).
תופעות לוואי כוללות בחילות, ירידת לחץ דם ובשימוש ממושך התפתחות של תנודות מוטוריות עם מצבי OFF ודיסקינזיות.
מעכבי אנזים Catechol-O-methyltransferase
תרופות הפועלות על ידי עיכוב האנזים Catechol-O-methyltransferase מסייעות במניעת הפירוק של Levodopa, וכך מאפשרות לכמויות גדולות יותר לחדור את מחסום הדם-מוח ולשפר את התסמינים התנועתיים של המחלה. לרוב תרופות אלו נמצאות בשימוש בחולים עם מצבי OFF.
תרופות אלו ניתנות בשילוב עם תרופות המכילות Levodopa בצורת כדור הנקרא Entacapone (שם מסחרי Comtan), או בכדור אחד המכיל 3 מרכיבים פעילים Carbidopa/Levodopa/Entacapone (שם מסחרי Stalevo).
תופעות לוואי כוללות בחילות, דיסקינזיות, סחרחורת ושלשול.
תרופות מקבוצת Anti-cholinergics
תרופות מקבוצה זאת פועלות על ידי עיכוב פעילות המתווך הכימי Acetyl-Choline. תרופות אלו יכולות לשפר תסמינים של רעד ו-Dystonia. השימוש בתרופות אלו פחת עקב פרופיל תופעות הלוואי. תרופות אלו נמצאות בשימוש בחלק מחולי הפרקינסון הצעירים ובמקרים של רעד קשה שלא מגיבים לטיפולים אחרים.
דוגמאות לתרופות מקבוצה זאת: Biperiden (שם מסחרי Dekinet), Trihexyphenidyl (שם מסחרי Artane).
תופעות לוואי כוללות יובש בפה, עצירות, אצירת שתן, בלבול והזיות.
טיפול בחולים עם תנודות במצב התנועתי
בחולים עם תנודות מוטוריות הכוללים מצבי ON, OFF ודיסקינזיות עם הפרעה משמעותית בתפקוד, קיימים מספר טיפולים פולשניים שיכולים לשפר את התסמינים. ניתן לטפל באמצעות משאבות להזלפה רציפה תת-עורית של Apomorphine, הזלפה רציפה של ג'ל המכיל Levodopa ישירות למעי הדק, הזלפה רציפה תת- עורית של Foslevodopa, או באמצעות ניתוח לגירוי מוחי עמוק.
Apomorphine (שם מסחרי Apogo)
מנגנון פעולה של Dopamine agonist. התרופה Apomorphine פועלת באמצעות הפעלה של הקולטן ל-Dopamine. ניתנת בצורת זריקה תת-עורית באמצעות עט (Apogo pen), או באמצעות משאבה (Apogo pump), המזליפה בצורה רציפה Apomorphine לתת העור. צורת מתן התרופה בזריקה תת-עורית בעלת השפעה מהירה מאוד על שיפור התסמינים התנועתיים (השפעה תוך כ-10 דקות) ומיועדת להקלת מצבי OFF אצל חולים עם תנודות מוטוריות. משך השפעת הזריקה עד כשעה. בחולים עם מצבי OFF מרובים ביום ניתן להשתמש במשאבת Apomorphine לצורך הזלפה רציפה של תרופה להקלת התסמינים.
תופעות לוואי כוללות ירידת לחץ דם, בחילות, סחרחורת, פצעים באזור ההזרקה, ישנוניות, בלבול, הזיות והפרעות שליטה בדחפים.
משאבה המזליפה ג'ל המכיל Levodopa ישירות למעי הדק - (שם מסחרי: Duodopa)
Duodopa הוא טיפול במשאבה המזליפה ג'ל המכיל Levodopa/Carbidopa בצורה רציפה לתריסריון שבמעי הדק באמצעות צינורית המוחדרת למערכת העיכול בפעולה ניתוחית. במעי הדק נספגת התרופה, כך שמתגברים על המעבר האיטי של התרופה במערכת העיכול. על המטופל לשאת עליו את המשאבה במשך היום. לרוב, הזלפת התרופה נמשכת כ-16 שעות ביממה ומחליפה את הטיפול הפומי ב-Levodopa. טיפול זה ניתן לחולי פרקינסון בשלבים מתקדמים של המחלה, המגיבים טוב לטיפול ב-Levodopa, אך פיתחו תנודות מוטוריות, הכוללות זמני ON ו-OFF ודיסקינזיות. כאשר ההפרעה בתפקוד עקב התנודות המוטוריות משמעותית, הטיפול במשאבה מאפשר שמירה על רמה קבועה של Dopamine בדם והפחתה משמעותית בזמני OFF ובחומרתם ושיפור בתנועות הלא רצוניות (דיסקינזיות). תופעות לוואי של טיפול זה כוללות זיהום במערכת העיכול, כאבי בטן, סתימה ותזוזה של הצינורית.
משאבה תת-עורית שמזליפה פוס-לבודופא באופן רציף - (שם מסחרי: Produodopa)
השימוש במשאבה החל בעולם בשנת 2023. המשאבה Produodopa היא משאבה המזליפה Foslevodopa/Foscarbodopa לתת-העור באמצעות צינורית המחוברת מצד אחד למשאבה ומצידה השני לעור ואינה דורשת ניתוח. משאבה זו מיועדת לטיפול בחולי פרקינסון עם תנודות מוטוריות לצורך שיפור מצבי OFF ודיסקינזיות. המשאבה מאפשרת מתן רציף של התרופה במינון אישי ומדויק לכל מטופל בהתאם לצרכיו במשך 24 שעות ביממה ובכך מדמה את המצב הפיזיולוגי בגוף ומחליפה את הטיפול הפומי ב-Levodopa. הוכח שטיפול זה משפר את התנודות המוטוריות ואת ההתעוררות בבוקר במצב OFF.
תופעות הלוואי של טיפול זה, בנוסף לתופעות הידועות של Levodopa במתן פומי, הן בעיקר תופעות אודם וזיהומים עוריים.
ניתוח גירוי מוחי עמוק
ניתוח גירוי מוחי עמוק (Deep Brain Stimulation, DBS) הוא טיפול לחולי פרקינסון המתאפיינים בתנודות מוטוריות, תגובה טובה ל-Levodopa, גיל צעיר יחסית, ללא מחלות רקע משמעותיות, ללא ירידה קוגניטיבית. הניתוח נמצא בשימוש מזה כ-30 שנים. במהלך טיפול זה מוכנסות אלקטרודות למוח (בדרך כלל לשני הצדדים) לאזורים ספציפיים המשפיעים על התנועתיות. כמו כן, מוכנס קוצב לאזור החזה. באמצעות שינוי מאפייני הקיצוב המוחי ניתן להשפיע על התפקוד המוטורי של החולה. עדויות שהצטברו לאורך השנים מראות שניתוח גירוי מוחי עמוק מהווה טיפול יעיל לחולים הסובלים מתנודות מוטוריות. התסמינים המוטוריים המגיבים היטב לגירוי מוחי עמוק כוללים דיסקינזיות, מצבי OFF, נוקשות, איטיות, רעד ו-Dystonia. הניתוח דורש נוירוכירורג/ית שהתמקצע/ה בתחום זה, ולאחר הניתוח יש צורך בהגעה תדירה לבית החולים לצורך התאמת מאפייני הקיצוב המוחי על ידי נוירולוג/ית. כמו כל תהליך ניתוחי קיים סיכון בביצוע ניתוח זה הכולל התפתחות דימום מוחי, אוטם וזיהום. ניתוח זה עשוי להשפיע לרעה על מצבו הקוגניטיבי של החולה, על היציבות ועל היכולת לדבר.
טיפול ב-Focused ultra sound
טכנולוגיה טיפולית שנכנסה לשימוש. מדובר בטיפול לא פולשני בו גלי על-קול בתדירות גבוהה גורמים לחימום ולהרס של רקמת מוח באופן מכוון, תחת הנחיית MRI. טיפול זה אושר על ידי מנהל המזון והתרופות האמריקאי לטיפול ברעד ובדיסקינזיות של מחלת פרקינסון. לטיפול זה פוטנציאל לשיפור גם של תסמינים מוטוריים כגון רעד ואיטיות. החלטה על מיקום האזור במוח אליו יכוון הטיפול תלוי בתסמין. תופעות לוואי כוללות בחילות, כאב ראש, נימול, הפרעה ביציבות.
טיפולים להפרעות לא מוטוריות
הפרעות לא מוטוריות מתפתחות עם השנים במחלת פרקינסון ועשויות לגרום להפרעה תפקודית משמעותית יותר מההפרעה המוטורית. הפרעות אלו מהוות גורם שכיח ליציאת מטופל מהבית למסגרת מוסדית. הטיפול הוא תסמיני, בהתאם לתסמין ולהפרעה התפקודית הנגרמת. אמצעי הטיפול כוללים טיפולים לא תרופתיים באמצעות אנשי מקצוע פארא-רפואיים כגון מרפאים בעיסוק, קלינאי תקשורת, דיאטנים, פעילות גופנית, הפחתת תרופות קיימות והוספת טיפול תרופתי בהתאם לתסמין.
ההפרעות הלא מוטוריות יכולות לערב מערכות רבות בגוף וכוללות הפרעה קוגניטיבית, דיכאון וחרדה, הפרעה בחוש הריח, הפרעה בדיבור ובבליעה, הפרעה בשליטה על השתן, הפרעה בתפקוד מיני, עצירות, סחרחורת, הפרעה בשינה, ריור. הטיפול במגוון ההפרעות הלא מוטוריות הוא בהתאם לתסמין ולחומרת השפעתו על תפקוד המטופל ועל איכות חייו.
תרופות בפיתוח
קיים מחקר ענף לגבי טיפולים במחלת פרקינסון לתסמינים המוטוריים והלא מוטוריים. כמו כן, מתקיימים מחקרים לפיתוח טיפול למניעת התקדמות המחלה. בשנים הקרובות צפויה כניסת תרופות חדשות וטכנולוגיות חדשות לטיפול במחלת פרקינסון.
בין הטיפולים שנחקרים וצפויים להיכנס לשימוש כלולות צורות מתן חדשות של Levodopa וגם צורות חדשות של Amantadine ושל תרופות המעכבות את האנזימים Catechol-O-methyltransferase ו-Monoamine oxidase B.
בנתיחות לאחר המוות בחולי פרקינסון מוצאים שקיעה של החלבון Alpha-synuclein באזורים שונים במוח. עדויות מחקריות קושרות שקיעה של Alpha-synuclein להתקדמות התהליך הניווני העצבי במוח. ייתכן שצורות רעילות של החלבון עוברות מהחלל התוך תאי לחלל החוץ תאי ומשם מתקדמות לתוך תא נוירון שכן. עבודות בבעלי חיים שפורסמו מראות שבמודלים של פרקינסון בעכברים, שימוש בנוגדן כנגד Alpha-synuclein שיפור מוטורי בעכברים. נערכים מחקרים הבודקים את השפעת חיסון על טיפול ומניעת התקדמות של מחלת פרקינסון. נבדקת השפעת חיסון סביל (באמצעות נוגדנים של החלבון Alpha-synuclein ששוקע ברקמת המוח) וחיסון פעיל (באמצעות Antigen הגורם ליצירת נוגדנים כנגד החלבון) על התקדמות התסמינים בחולי פרקינסון. בנוסף נמצאים במחקר תרופות המיועדות לחולי פרקינסון עם מוטציה בגן GBA ותרופות אחרות לחולי פרקינסון עם מוטציה בגן LRRK2.
המידע שבדף זה נכתב על ידי ד"ר מאיר קסטנבאום, סגן מנהל מחלקה נוירולוגית ומנהל מרפאת הפרעות תנועה, בי"ח מאיר, כפר סבא, meirkes@gmail.com
המידע שבדף זה עודכן בתמיכה של חברת Abbvie, ללא מעורבות בתכנים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק