הבדלים בין גרסאות בדף "סרטן ריאה - Lung Cancer"
| שורה 13: | שורה 13: | ||
{{הרחבה|סרטן ריאה}} | {{הרחבה|סרטן ריאה}} | ||
==אפידמיולוגיה== | ==אפידמיולוגיה== | ||
| − | שיעור התחלואה מסרטן ריאה נמצא בעלייה מתמדת, | + | שיעור התחלואה מסרטן ריאה נמצא בעלייה מתמדת, ונכון לשנת 2011 הוא גורם התמותה מסרטן מספר אחד בגברים והשלישי אצל הנשים. בארצות הברית מאובחנים כ-172,000 מקרים חדשים בשנה, בישראל מאובחנים כ-1,500 חולים חדשים בשנה. גורם הסיכון העיקרי הוא [[עישון]], אשר מעלה את הסיכון לכל סוגי סרטן ריאה. |
| − | ;סרטן ריאה נחלק לשני סוגים עיקריים | + | ;סרטן ריאה נחלק לשני סוגים עיקריים |
| − | * '''סרטן ריאה של התאים הלא קטנים - Non- | + | * '''סרטן ריאה של התאים הלא קטנים - Non-Small Cell Lung Cancer'''{{כ}} '''(NSCLC)''' - מהווה כ-85 אחוזים מכלל מקרי סרטן ריאה. קיימים שלושה סוגים של סרטן ריאה מסוג NSCLC: |
| − | + | ** '''סרטן ריאה מסוג התאים הקשקשיים - Squamous cell carcinoma''' | |
| − | + | ** '''סרטן ריאה מסוג אדנוקרצינומה - Adenocarcinoma''' | |
| − | + | ** '''סרטן ריאה מסוג התאים הגדולים - Large cell (Anaplastic) carcinoma''' | |
| − | * '''סרטן ריאה מסוג התאים הקשקשיים - Squamous cell carcinoma''' | + | * '''סרטן ריאה של התאים הקטנים - Small Cell Lung Cancer''' {{כ}} '''(SCLC)''' - מהווה כ-15 אחוזים מכלל מקרי סרטן ריאה |
| − | * '''סרטן ריאה מסוג אדנוקרצינומה - Adenocarcinoma''' | ||
| − | * '''סרטן ריאה מסוג התאים הגדולים - Large cell ( | ||
==אבחנה== | ==אבחנה== | ||
| − | התסמינים | + | התסמינים המביאים את החולה להיבדק הם בדרך כלל: [[שיעול]], [[קוצר נשימה]], [[כיח דמי]] (Hemoptysis), [[כאבים בחזה]] ו[[דלקות ריאה]] נשנות. לעיתים הגידול מתגלה במקרה בצילום חזה שמבוצע מסיבה אחרת. |
| − | אבחון סרטן ריאה כולל: בדיקה גופנית, [[ספירת דם]] מלאה ו[[כימיה]], צילום חזה, [[CT]] חזה, ברונכוסקופיה או ניקור מחטי לאישור האבחנה הפתולוגית. | + | אבחון סרטן ריאה כולל: בדיקה גופנית, [[ספירת דם]] מלאה ו[[:קטגוריה:בדיקות מעבדה: כימיה בדם|כימיה]], [[צילום חזה]], [[CT]]{{כ}} (Computed Tomography) חזה, [[ברונכוסקופיה]] (Bronchoscopy) או ניקור מחטי (Needle biopsy) לאישור האבחנה הפתולוגית (Pathology). |
| − | בדיקות נוספות להערכת מידת התפשטות המחלה: PET-CT, CT מוח במידת הצורך. | + | בדיקות נוספות להערכת מידת התפשטות המחלה: [[PET-CT]], CT{{כ}} (Positron-Emission Tomography) מוח במידת הצורך. |
==שלבי המחלה (Staging)== | ==שלבי המחלה (Staging)== | ||
| − | ;נקבע לפי TNM | + | ;נקבע לפי TNM{{כ}} (Tumor, Nodes, Metastasis) |
| − | + | {{ש}}T - גודל הגידול | |
| − | * T1 - גידול מתחת ל-3 | + | * T1 - גידול מתחת ל-3 סנטימטרים |
| − | * T2 - גידול מעל 3 | + | * T2 - גידול מעל ל-3 סנטימטרים |
| − | * T3 - גידול חודר לדופן החזה או | + | * T3 - גידול חודר לדופן החזה או לפלאורת המיצר (Mediastinal pleura) |
| − | * T4 - גידול חודר ללב, כלי דם גדולים, וושט, תפליט פלאורלי | + | * T4 - גידול חודר ללב, כלי דם גדולים, וושט, תפליט פלאורלי (Pleural effusion) |
| − | + | {{ש}}N - מעורבות בלוטות | |
| − | * N1 - מעורבות בלוטות בשער הריאה או | + | * N1 - מעורבות בלוטות בשער הריאה או תוך ריאתיות (Eneropulmonary) |
* N2 - בלוטות במיצר באותו צד של הגידול | * N2 - בלוטות במיצר באותו צד של הגידול | ||
* N3 - בלוטות במיצר בצד הנגדי של הגידול ו/או בלוטות על בריחיות | * N3 - בלוטות במיצר בצד הנגדי של הגידול ו/או בלוטות על בריחיות | ||
| − | + | {{ש}}M - גרורות מרוחקות | |
* M0 - ללא גרורות מרוחקות | * M0 - ללא גרורות מרוחקות | ||
| − | * M1 - ישנן גרורות מרוחקות, האתרים השכיחים הם: בלוטת | + | * M1 - ישנן גרורות מרוחקות, האתרים השכיחים הם: בלוטת יותרת הכיליה (Adrenal), כבד, עצמות, ריאה שנייה או פיזור ריאתי, מוח |
| − | * '''Stage I'''{{ש}}T1 | + | {{ש}}* '''Stage I'''{{ש}}T1 N0 M0{{ש}}T2 N0 M0 |
* '''Stage II IIA'''{{ש}}T1 N1 M0 | * '''Stage II IIA'''{{ש}}T1 N1 M0 | ||
* '''Stage II IIB'''{{ש}}T2 N1 M0{{ש}}T3 N0 M0 | * '''Stage II IIB'''{{ש}}T2 N1 M0{{ש}}T3 N0 M0 | ||
* '''Stage IIIA''' {{ש}}T1 N2 M0{{ש}}T2 N2 M0{{ש}}T3 N1 M{{ש}}T3 N2 M0 | * '''Stage IIIA''' {{ש}}T1 N2 M0{{ש}}T2 N2 M0{{ש}}T3 N1 M{{ש}}T3 N2 M0 | ||
| − | * '''Stage IIIB'''{{ש}}Any N3 M0{{ש}}T4 Any M0 | + | * '''Stage IIIB'''{{ש}}Any T N3 M0{{ש}}T4 Any N M0 |
| − | * '''Stage IV'''{{ש}}Any Any M1 | + | * '''Stage IV'''{{ש}}Any T Any N M1 |
==פרוגנוזה== | ==פרוגנוזה== | ||
| − | הפרוגנוזה נקבעת | + | הפרוגנוזה נקבעת על פי מידת התפשטות המחלה. בדרך כלל התסמינים מופיעים רק בשלב מתקדם של המחלה, כך שמרבית המקרים מתגלים כשהמחלה מפושטת וסיכויי הריפוי נמוכים. |
==גילוי מוקדם== | ==גילוי מוקדם== | ||
| − | באוקטובר 2006 התפרסמו לראשונה תוצאות מחקר רב היקף (מעל 30,000 אנשים) שבדק על יעילות CT במינון קרינה נמוך, כבדיקת סקר לגילוי מוקדם של סרטן | + | באוקטובר 2006 התפרסמו לראשונה תוצאות מחקר רב היקף (מעל 30,000 אנשים) שבדק על יעילות CT במינון קרינה נמוך, כבדיקת סקר לגילוי מוקדם של סרטן ריאה באוכלוסייה בסיכון גבוה. תוצאות המחקר מצביעות על יעילות השיטה: כ-85 אחוזים ממקרי סרטן הריאה במחקר התגלו בשלב I והחיות ל-10 שנים הייתה 92 אחוזים. אולם בשלב זה יש צורך בנתונים נוספים על מנת להמליץ על CT במינון קרינה נמוך כבדיקה שגרתית לגילוי מוקדם. |
מתוך 100 חולים חדשים 70 יהיו בלתי מנותחים עקב מחלה מפושטת, ו-30 יהיו מנותחים, כאשר: 20 יהיו בשלב מוקדם של המחלה, 10 יהיו בשלב מחלה מתקדמת בבית החזה. | מתוך 100 חולים חדשים 70 יהיו בלתי מנותחים עקב מחלה מפושטת, ו-30 יהיו מנותחים, כאשר: 20 יהיו בשלב מוקדם של המחלה, 10 יהיו בשלב מחלה מתקדמת בבית החזה. | ||
==טיפול== | ==טיפול== | ||
| − | ההחלטה על טיפול בסרטן הריאה נעשית בעיקר לפי דרגת התפשטות המחלה ( | + | ההחלטה על טיפול בסרטן הריאה נעשית בעיקר לפי דרגת התפשטות המחלה (Staging). |
====Stage I + Stage II==== | ====Stage I + Stage II==== | ||
| − | '''ניתוח רדיקלי''' באם מצבו של החולה מאפשר זאת (מבחינת תפקודי ריאה ולב):{{ש}}'''ניתוחים''' – | + | '''ניתוח רדיקלי''' (Radical) באם מצבו של החולה מאפשר זאת (מבחינת תפקודי ריאה ולב):{{ש}}'''ניתוחים''' – כריתת אונה (Lobectomy), כריתת ריאה מלאה.{{ש}}'''פחות מכריתת אונה''' - ניתוח לא מספיק השוני ביניהם הוא אחוז תמותה בניתוח ותחלואה - שניהם גבוהים יותר בכריתת ריאה מלאה. |
;טיפול משלים | ;טיפול משלים | ||
| − | * '''קרינה''' - אין הצדקה | + | * '''קרינה''' - אין הצדקה ל[[טיפול קרינתי]] משלים באופן שגרתי אחרי כריתה מלאה. מטה אנליזה (Metaanalysis) של Port שהתפרסמה ב-1998 הוכיחה שתוספת קרינה לאחר כריתה מלאה לא משפרת את שיעורי ההישרדות לחמש שנים. יש לתת קרינה אם הכריתה הכירורגית (Surgical) לא הייתה שלמה ו/או אם החתך הניתוחי עובר דרך הגידול |
| − | * '''טיפול כימי משלים''' - נעשו שש עבודות | + | * '''טיפול כימי משלים''' - נעשו שש עבודות אקראיות שבדקו יעילות של [[טיפול כימותרפי]] (Chemotherapy) משלים לאחר ניתוח כריתה מלא. כל העבודות למעט אחת הראו יתרון ברור בהיוותרות בחיים בזרוע שטופלה בכימותרפיה. לכן טיפול כימי משלים מהווה חלק מהטיפול השגרתי לאחר ניתוח כריתה מלא והשילוב המקובל הוא [[Cisplatin]] ו-[[Navelbine]]. |
====Stage III==== | ====Stage III==== | ||
| − | * '''Stage III A''' - קבוצת חולים בעלי פוטנציאל ניתוחי - בשלב זה של המחלה יש מעורבות של בלוטות במיצר. לאבחנה דרושה הוכחה פתולוגית | + | * '''Stage III A''' - קבוצת חולים בעלי פוטנציאל ניתוחי - בשלב זה של המחלה יש מעורבות של בלוטות במיצר. לאבחנה דרושה הוכחה פתולוגית מ-Mediastinoscopy{{כ}} ('''PET''' בעצמו לא מספק מכיוון שיש לפחות 8 אחוזים False Positive). |
לקבוצת חולים זו נהוג להציע טיפול משולב הכולל לפחות סשי סוגי טיפולים כימותרפיה neo adjuvant וניתוח ו/או כימותרפיה, קרינה וניתוח. שאלות שעדיין לא נענו במלואן: | לקבוצת חולים זו נהוג להציע טיפול משולב הכולל לפחות סשי סוגי טיפולים כימותרפיה neo adjuvant וניתוח ו/או כימותרפיה, קרינה וניתוח. שאלות שעדיין לא נענו במלואן: | ||
גרסה מ־02:36, 12 בפברואר 2018
| סרטן ריאה | ||
|---|---|---|
| Lung Cancer | ||
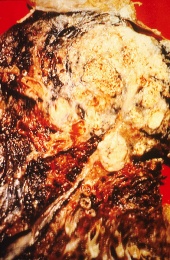
| ||
חתך רחבי של ריאת אדם; השטח הלבן באונה העליונה הוא סרטן, והאזורים השחורים הם שינויי צבע שנגרמו עקב עישון.
| ||
| ICD-10 | Chapter C 33. Chapter C 34. |
|
| ICD-9 | 162 | |
| MeSH | D002283 | |
| יוצר הערך | ד"ר מיה גוטפריד, מנהלת היחידה לגידולי ריאה מכון אונקולוגי, מרכז רפואי מאיר | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן ריאה
אפידמיולוגיה
שיעור התחלואה מסרטן ריאה נמצא בעלייה מתמדת, ונכון לשנת 2011 הוא גורם התמותה מסרטן מספר אחד בגברים והשלישי אצל הנשים. בארצות הברית מאובחנים כ-172,000 מקרים חדשים בשנה, בישראל מאובחנים כ-1,500 חולים חדשים בשנה. גורם הסיכון העיקרי הוא עישון, אשר מעלה את הסיכון לכל סוגי סרטן ריאה.
- סרטן ריאה נחלק לשני סוגים עיקריים
- סרטן ריאה של התאים הלא קטנים - Non-Small Cell Lung Cancer (NSCLC) - מהווה כ-85 אחוזים מכלל מקרי סרטן ריאה. קיימים שלושה סוגים של סרטן ריאה מסוג NSCLC:
- סרטן ריאה מסוג התאים הקשקשיים - Squamous cell carcinoma
- סרטן ריאה מסוג אדנוקרצינומה - Adenocarcinoma
- סרטן ריאה מסוג התאים הגדולים - Large cell (Anaplastic) carcinoma
- סרטן ריאה של התאים הקטנים - Small Cell Lung Cancer (SCLC) - מהווה כ-15 אחוזים מכלל מקרי סרטן ריאה
אבחנה
התסמינים המביאים את החולה להיבדק הם בדרך כלל: שיעול, קוצר נשימה, כיח דמי (Hemoptysis), כאבים בחזה ודלקות ריאה נשנות. לעיתים הגידול מתגלה במקרה בצילום חזה שמבוצע מסיבה אחרת.
אבחון סרטן ריאה כולל: בדיקה גופנית, ספירת דם מלאה וכימיה, צילום חזה, CT (Computed Tomography) חזה, ברונכוסקופיה (Bronchoscopy) או ניקור מחטי (Needle biopsy) לאישור האבחנה הפתולוגית (Pathology).
בדיקות נוספות להערכת מידת התפשטות המחלה: PET-CT, CT (Positron-Emission Tomography) מוח במידת הצורך.
שלבי המחלה (Staging)
- נקבע לפי TNM (Tumor, Nodes, Metastasis)
T - גודל הגידול
- T1 - גידול מתחת ל-3 סנטימטרים
- T2 - גידול מעל ל-3 סנטימטרים
- T3 - גידול חודר לדופן החזה או לפלאורת המיצר (Mediastinal pleura)
- T4 - גידול חודר ללב, כלי דם גדולים, וושט, תפליט פלאורלי (Pleural effusion)
N - מעורבות בלוטות
- N1 - מעורבות בלוטות בשער הריאה או תוך ריאתיות (Eneropulmonary)
- N2 - בלוטות במיצר באותו צד של הגידול
- N3 - בלוטות במיצר בצד הנגדי של הגידול ו/או בלוטות על בריחיות
M - גרורות מרוחקות
- M0 - ללא גרורות מרוחקות
- M1 - ישנן גרורות מרוחקות, האתרים השכיחים הם: בלוטת יותרת הכיליה (Adrenal), כבד, עצמות, ריאה שנייה או פיזור ריאתי, מוח
* Stage I
T1 N0 M0
T2 N0 M0
- Stage II IIA
T1 N1 M0 - Stage II IIB
T2 N1 M0
T3 N0 M0 - Stage IIIA
T1 N2 M0
T2 N2 M0
T3 N1 M
T3 N2 M0 - Stage IIIB
Any T N3 M0
T4 Any N M0 - Stage IV
Any T Any N M1
פרוגנוזה
הפרוגנוזה נקבעת על פי מידת התפשטות המחלה. בדרך כלל התסמינים מופיעים רק בשלב מתקדם של המחלה, כך שמרבית המקרים מתגלים כשהמחלה מפושטת וסיכויי הריפוי נמוכים.
גילוי מוקדם
באוקטובר 2006 התפרסמו לראשונה תוצאות מחקר רב היקף (מעל 30,000 אנשים) שבדק על יעילות CT במינון קרינה נמוך, כבדיקת סקר לגילוי מוקדם של סרטן ריאה באוכלוסייה בסיכון גבוה. תוצאות המחקר מצביעות על יעילות השיטה: כ-85 אחוזים ממקרי סרטן הריאה במחקר התגלו בשלב I והחיות ל-10 שנים הייתה 92 אחוזים. אולם בשלב זה יש צורך בנתונים נוספים על מנת להמליץ על CT במינון קרינה נמוך כבדיקה שגרתית לגילוי מוקדם.
מתוך 100 חולים חדשים 70 יהיו בלתי מנותחים עקב מחלה מפושטת, ו-30 יהיו מנותחים, כאשר: 20 יהיו בשלב מוקדם של המחלה, 10 יהיו בשלב מחלה מתקדמת בבית החזה.
טיפול
ההחלטה על טיפול בסרטן הריאה נעשית בעיקר לפי דרגת התפשטות המחלה (Staging).
Stage I + Stage II
ניתוח רדיקלי (Radical) באם מצבו של החולה מאפשר זאת (מבחינת תפקודי ריאה ולב):
ניתוחים – כריתת אונה (Lobectomy), כריתת ריאה מלאה.
פחות מכריתת אונה - ניתוח לא מספיק השוני ביניהם הוא אחוז תמותה בניתוח ותחלואה - שניהם גבוהים יותר בכריתת ריאה מלאה.
- טיפול משלים
- קרינה - אין הצדקה לטיפול קרינתי משלים באופן שגרתי אחרי כריתה מלאה. מטה אנליזה (Metaanalysis) של Port שהתפרסמה ב-1998 הוכיחה שתוספת קרינה לאחר כריתה מלאה לא משפרת את שיעורי ההישרדות לחמש שנים. יש לתת קרינה אם הכריתה הכירורגית (Surgical) לא הייתה שלמה ו/או אם החתך הניתוחי עובר דרך הגידול
- טיפול כימי משלים - נעשו שש עבודות אקראיות שבדקו יעילות של טיפול כימותרפי (Chemotherapy) משלים לאחר ניתוח כריתה מלא. כל העבודות למעט אחת הראו יתרון ברור בהיוותרות בחיים בזרוע שטופלה בכימותרפיה. לכן טיפול כימי משלים מהווה חלק מהטיפול השגרתי לאחר ניתוח כריתה מלא והשילוב המקובל הוא Cisplatin ו-Navelbine.
Stage III
- Stage III A - קבוצת חולים בעלי פוטנציאל ניתוחי - בשלב זה של המחלה יש מעורבות של בלוטות במיצר. לאבחנה דרושה הוכחה פתולוגית מ-Mediastinoscopy (PET בעצמו לא מספק מכיוון שיש לפחות 8 אחוזים False Positive).
לקבוצת חולים זו נהוג להציע טיפול משולב הכולל לפחות סשי סוגי טיפולים כימותרפיה neo adjuvant וניתוח ו/או כימותרפיה, קרינה וניתוח. שאלות שעדיין לא נענו במלואן:
- כמה מנות טיפוליות יש לתת: 3, 4 או 5?
- מהו השילוב התרופתי היעיל ביותר?
- האם יש צורך בקרינה בנוסף לכימותרפיה?
- Stage IIIB - שלב מחלה מתקדמת מקומית – בדרך כלל מחלה לא נתיחה. הטיפול היעיל ביותר הוא שילוב של כימותרפיה וקרינה. ההמלצה: טיפול כימי בהתחלה ואחר כך שילוב בו-זמני של כימותרפיה וקרינה (בדרך כלל שילוב של תרופות radio sensitizing).
Stage IV
מחלה גרורתית - בשלב זה ניתן בדרך כלל טיפול סיסטמי פליאטיבי אשר מטרתו שיפור חיי החולה על ידי הפחתה או העלמה של התסמינים (שיעול, חולשה, קוצר נשימה) והארכת חיים עם טיפול כימותרפי משולב ההישרדות החציונית היא 8–10 חודשים וכ-40% יחיו מעל שנה. לעומת זה, בטיפול תומך ההישרדות החציונית היא 4–5 חודשים בלבד ורק 10% ייוותרו בחיים כעבור שנה.
טיפול תרופתי
יש מספר תרופות שהוכיחו יעילות בטיפול בסרטן ריאה:
בדרך כלל נהוג לטפל בחולים במצב תפקודי טוב 0 או 1 Performance status – PS על ידי שילוב של שתי תרופות (אחת מהדור החדש ואחת מהדור הישן) במשך 4–6 מחזורי טיפול - לדוגמה שילוב של טקסוטר + ציספלטין או נבלבין + קרבופלטין וכדומה. מספר עבודות מבוקרות הראו שהשילובים השונים נבדלים בעיקר ברעילות ולא ביעילות. במשך שנים נעשו ניסיונות לשפר את יעילות הטיפול על ידי הוספת תרופה כימותרפית שלישית אבל, למרות שיפור בשיעורי התגובה, השילובים המשולשים לא השיגו שיפור בהארכת חיים והיו כרוכים ברעילות מרובה. לחולים במצב תפקודי ירוד, 2 PS ומעלה, נהוג לתת טיפול בתרופה בודדת מאחר שהטיפול המשולב כרוך ברעילות לא מבוטלת, ומטרת הטיפול היא להאריך חיים תוך שמירה במידת האפשר על איכות החיים.
- חולים מבוגרים (מעל גיל 70)
שתי עבודות אירופאיות שנעשו עם נבלבין הוכיחו כי מתן טיפול כימי סל תרופה בודדת נבלבין טוב יותר בשיעורי התגובה, באיכות החיים ואף באורך החיים לעומת טיפול תומך. כמו כן, ניתוח של עבודות שבדקו יעילות שילובים בקו ראשון הראה שלא היה הבדל ביעילות הטיפול בין חולים צעירים למבוגרים (מעל 70).
עבודה חדשה שהתפרסמה בשנה האחרונה הראתה כי טקסוטר הדגים שיעורי תגובה ואורך חיים טובים יותר בהשוואה לנבלבין. היום ניתן להציע לחולים מעל גיל 70 טיפול בנבלבין או בטקסוטר. הגישה המקובלת היום היא להתייחס לגיל הביולוגי ולא הכרונולוגי ולהציע גם לחולים מבוגרים טיפול כימותרפי, בתרופה בודדת או בשילוב, אם מצבם התפקודי מאפשר זאת. הטיפולים הכימותרפיים פועלים באופן לא ספציפי ופוגעים גם בתאים בריאים ולכן מלווים בתופעות לוואי רבות. בדרך כלל dose limiting toxicity היא דיכוי מח עצם. בשילובים של שתי תרופות, תופעות הלוואי השכיחות הנוספות הן נשירת שיער, בחילות, חולשה, סחרחורת, הפרעה במערכת העיכול ורעילות של מערכת העצבים ההיקפית. לכן יש להעריך בכל פגישה עם החולה, בנוסף ליעילות, את רעילות הטיפול ולשקול המשך טיפול בהתאם. בחולים במצב כללי ותפקודי טוב אשר נכשלו על קו טיפולי כימי ראשון ניתן להציע קו טיפולי שני. בעבר הייתה רק תרופה אחת שיעילותה הוכחה בקו טיפולי שני - טקסוטר. נוספו אפשרויות טיפוליות נוספות לקו שני: אלימטה שהיא כימותרפיה עם יעילות דומה לטקסוטר אבל עם פרופיל בטיחותי טוב יותר, וטרסבה תרופה מכוונת מטרה - targeted therapy -כנגד המסלול של EGFR הטיפול בקו שני נותן כ-9% שיעור תגובה עם הישרדות חציונית של כ-8 חודשים.
- גרורות למוח
בהתפתחות גרורות מוחיות בשלב מחלה מתקדם, האופציה הטיפולית היא קרינה לכל המוח (WBRT). במקרה של גרורה בודדת: ניתוח ו/או radiosurgery ואחר כך לשקול קרינה לכל המוח. יש לזכור כי הקרינה מורידה שכיחות של גרורות מוחיות, אך אינה משפיעה על אורך החיים.
טיפולים מכווני מטרה בסרטן ריאה
- טרסבה
טרסבה היא טיפול ממוקד כנגד הקולטן לגורם הגדילה epidermal growth factor receptor (EGFR) אשר מצוי על קרום התא ומשחק תפקיד מרכזי בהתפתחות הגידול הסרטני. טרסבה מעכבת את פעולתו של אנזים מסוג Tyrosine Kinase שאחראי על הפעלת שרשרת התגובות שמתרחשת בעקבות הפעלת הקולטן. חסימת הפעלת הקולטן באמצעות עיכוב האנזים גורמת עיכוב בתהליכי הגדילה והחלוקה של התא הסרטני.
טרסבה היא התרופה היחידה הפועלת כנגד המסלול של HER1/EGFR שהביאה להארכת חיים בחולי סרטן ריאה. יעילותה של טרסבה הודגמה במחקר פאזה שלישית שכלל 731 חולים שנכשלו על טיפול כימי קודם, והשווה טיפול בטרסבה לטיפול תומך. המחקר הראה שמתן טרסבה שיפר משמעותית את כל מדדי המחלה: שיעור התגובה, עיכוב הזמן עד התקדמות המחלה, שיפור בתסמיני המחלה והארכת חיים: בהשפעת טרסבה התארכה ההישרדות החציונית ב-43%. על בסיס מחקר זה, נרשמה טרסבה ברחבי העולם כולל בישראל לטיפול בסרטן ריאה גרורתי מסוג NSCLC לאחר כישלון של טיפול כימי אחד לפחות (קו שני ומעלה). בנוסף, טרסבה היא התרופה היחידה שהוכיחה יעילות בקו טיפולי שלישי במחקר פאזה III מבוקר. לטרסבה פרופיל בטיחותי גבוה, השונה מזה של כימותרפיה תופעות הלוואי העיקריות של טרסבה הן פריחה ושלשול המופיעות בדרך כלל בדרגה קלה וניתנות לשליטה. יתרון נוסף בטרסבה הוא העובדה שהיא ניתנת כטבלייה אחת ליום ולא כעירוי תוך ורידי. ניתן לטפל בטרסבה גם בחולים במצב תפקודי ירוד שאינם יכולים לקבל כימותרפיה ולא קיבלו טיפולים כלשהם למחלתם. משרד הבריאות הישראלי אישר התוויה נוספת לטרסבה - כקו טיפולי ראשון בסרטן לבלב גרורתי (בשילוב עם גמציטבן).
- אווסטין
אווסטין היא תרופה ביולוגית הפועלת כנגד תהליך יצירת כלי הדם של הגידול (אנגיוגנזה). אווסטין היא נוגדן ספציפי לגורם הגדילה של כלי דם (VEGF). על ידי קישור ל- VEGF היא מונעת את יצירת כלי הדם לגידול וכתוצאה מעכבת את צמיחת הגידול והתפשטותו. אווסטין רשומה בישראל לטיפול קו ראשון בשילוב עם כימותרפיה בסרטן מעי גס גרורתי. ביוני 2005 פורסמו לראשונה תוצאות מחקר פאזה שלישית רב-מרכזי, מבוקר E4599 שבדק האם תוספת אווסטין למשלב כימותרפי של קרבופלטין וטקסול משפרת את יעילות הטיפול. במחקר השתתפו 878 חולי סרטן ריאה מפושט מסוג תאים קטנים לא קשקשיים (Non Squamous NSCLC) שלא קיבלו טיפול קודם למחלתם. המחקר הראה כי בחולים שטופלו באווסטין בשילוב עם כימותרפיה הייתה הפחתה של 20% בסיכון לתמותה במשך כל זמן המחקר, בהשוואה לחולים שקיבלו כימותרפיה בלבד, וההישרדות החציונית של החולים שטופלו באווסטין התארכה (12.3 לעומת 10.3 חודשים). על בסיס תוצאות מחקר זה אווסטין נרשמה על ידי ה-FDA באוקטובר 2006 לטיפול בסרטן ריאה גרורתי מסוג תאים קטנים לא קשקשיים בשילוב עם כימותרפיה (קרבופלטין/טקסול) והיא הוגשה לרישום גם באירופה. ישנן תרופות ביולוגיות נוספות מקבוצת מעכבי VEGF ומעכבי VEGF ו- EGFR הנמצאות עדיין בשלבי מחקר קליני מתקדם.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק