אנגיופתיה של עמילואיד מוחי - Cerebral amyloid angiopathy
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| אנגיופתיה של עמילואיד מוחי | ||
|---|---|---|
| Cerebral amyloid angiopathy | ||

| ||
| שמות נוספים | אנגיופתיה של עמילואיד מוחי (אע"מ) - Cerebral Amyloid Angiopathy- CAA | |
| ICD-10 | Chapter I 68.0 | |
| MeSH | D016657 | |
| יוצר הערך | ד"ר איתן אוריאל | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – עמילואידוזיס
אנגיופתיה של עמילואיד מוחי מתאפיין בשקיעה של החלבון הקונגופילי (Congophilic) עמילואיד ביתא (Amyloid beta) בכלי דם בקליפת וקרומי המוח. המחלה זוהתה כבר בתחילת המאה הקודמת אולם רק בשנות השבעים של המאה הקודמת התגלה הקשר בינה לבין סיכון מוגבר לדמם תוך מוחי בעיקר באוכלוסייה ללא יתר לחץ דם[1],[2]. אנגיופתיה של עמילואיד מוחי מוכר גם כגורם למנעד רחב של הפרעות נוירולוגיות מעבר לדימום תוך מוחי לרבות ירידה קוגניטיבית[3],[4] ואוטמים מוחיים [5],[6].
למרות שלרוב האבחנה של אנגיופתיה של עמילואיד מוחי איננה נעשית במהלך החיים, מדובר במחלה שכיחה מאוד. שכיחותה באוכלוסייה המבוגרת הכללית כ-10-50% ואף עולה עם הגיל עד לשכיחות של כ-80% בחולים הסובלים מאבחנה של שיטיון על שם אלצהיימר[4].
פתוגנזה
ההופעה הספורדית של אע"מ מתאפיינת בשקיעה של ע"מ בדפנות כלי דם קפילריים ועורקיים בקליפת המוח, קרומי המוח ובמוחון. ע"ב באע"מ דומה במבנהו לחלבון המרכיב את הפלאקים במחלת אלצהיימר. אע"מ איננו נמצא באסוציאציה עם ביטויים קליניים סיסטמיים של שקיעת עמילואיד כגון עמילואידוזיס ראשוני או שניוני. שרשרת האירועים הגורמת לשקיעת ע"ב בכלי דם מוחיים עדיין איננה מובנית במלואה וככל הנראה הינה תוצאה של הפרה באיזון שבין יצור ע"ב לפינויו. כמו כן לא ברור האם המקור לשקיעת ע"ב באע"מ הינו ממערכת הדם הסיסטמית, דופן כלי הדם או תאים במערכת עצבים המרכזית. העדר אע"מ במודלים טרנסגנים המבטאים רמות גבוהות של ע"ב בדם וכן האפיניות של החלבון דווקא לכלי דם שטחיים במוח אינן תומכות בפלסמה כמקור לאע"מ . מחקרים עדכניים הדגימו גם כי שבץ מוח איסכמי עשוי לעודד שקיעה של ע"ב ככל הנראה על רקע התערבות במנגנוני הפינוי [7].
ע"ב הוא חלבון בעל 40 או 42 חומצות אמיניות הנגזר מפרקורסור לעמילואיד - APP לאחר חיתוך באנזימים β סקרטז ו γ סקרטז. החלבון בעל 40 חומצות אמיניות הוא מרכזי בפתוגנזה של אע"מ בעוד שהחלבון המורכב מ-42 חומצות משחק תפקיד מרכזי במחלת אלצהיימר. עליה ביחס ביניהם עשויה לגרום למעבר של החלבון מפרנכימת המוח למדור הוסקולרי. הפיזור של אע"מ הינו סגמנטלי ומפושט. מחקרים פתולוגים הדגימו כי שקיעת ע"ב וכן הדת"מ הנלווה שכיחים בעיקר באיזורים לוברים ואחוריים [8], בניגוד לאזורים העמוקים הכוללים את התלמוס וגרעיני הבסיט שאינם מעורבים במחלה. מבחינה היסטולוגית, ע"ב חודר לשכבות המדיה והאדוניטציה בדופן כלי הדם המדגימים אובדן תאי שריר חלק והחלפתם בע"ב וכן עיבוי של הדופן ומראה היסטולוגי אופייני של "דופן בתוך דופן". בנוסף, כלי הדם עשויים לעבור שינויים נקרוטיים, שקיעת היאלין, יצירת מפרצות זעירות ושינויים חסימתיים וכן דלף של דם לרקמת המוח מכלי הדם הפגוע. לאחרונה, הודגם כי ע"ב מוריד ביטוי חלבונים מסוג קלאודין 1,5 המהווים חלק מ tight junction של תאי אנדותל ומעלה ביטוי של מתלופרוטאזות 2, 9 הגורמות לנזק בדופן התא. האבחון הפתולוגי של המחלה נעשה על ידי צביעת קונגו - אדום תחת מיקרוסקופ אור. מאחר והרגישות של הצביעה היא נמוכה יחסית, אימנוהיסטוכמיה עם נוגדנים פלורסנטים לע"ב היא בדיקת הבחירה ההיסטולוגית.
דמם מוחי משני לאע"מ
דמם לוברי ראשוני מהווה את הסימן החשוב ביותר של אע"מ ואת הסיבה העיקרית לאבחון. שתי הסיבות המרכזיות לדת"מ במבוגרים הן שינויים מבניים, משניים ליתר לחץ דם, ואע"מ. בניגוד ל- אע"מ, דת"מ על רקע יתר לחץ דם מערב מבנים עמוקים ברקמת המוח, בעיקר את התלמוס, גרעיני הבסיס וגזע המוח. חלק מהחולים סובלים מפתולוגיה משולבת , דהיינו משינויים מבניים על רקע יתר לחץ דם ושקיעת ע"ב. עובדה זו איננה מפתיעה שכן כ 30% מהחולים עם אע"מ סובלים גם מיתר לחץ דם לא מאוזן.
המנגנון הגורם לקרע כלי הדם בחולים עם אע"מ איננו ברור לגמרי אולם ככל הנראה כולל היענות נמוכה וחולשה של הדופן הגורמות לנזק אינטימלי. שינויים אלו עלולים לגרום, בסופו של דבר, לדלף של דם בצורה של דימומים זעירים לא תסמינים -cerebral microbleeds או, לחילופין, לדת"מ תסמיני. הסיבה מדוע הפגיעה בחלק מכלי הדם מתבטאת בדימומים זעירים ובחלק מהם בדת"מ אינה ברורה. יתכן כי עובי כלי הדם אחראי להבדל בין המצבים, כאשר פגיעה בכלי דם עבים יותר נוטה לגרום לדימומים זעירים בעוד כלי דם דקים יותר מועדים לדת"מ [9].
ברוב המקרים דת"מ על רקע אע"מ הוא עצמוני, לעיתים קרובות חוזר, וממוקם בעיקר בקליפת המוח, האיזור הקליפתי-תת קליפתי או בחומר הלבן התת קליפתי. המוחון עשוי גם הוא להיות מעורב.
הביטוי הקליני של דת"מ משני לאע"מ דומה לסוגים אחרים של דת"מ ותלוי בעיקר בגודל הדמם ומיקומו. התסמינים השכיחים כוללים כאבי ראש, חסרים נוירולוגים מוקדיים, פרכוסים ושינויים בהכרה. דימומים זעירים עשויים להיות לא תסמינים או לגרום לתסמינים נוירולוגים חולפים העלולים להיות מאובחנים כפרכוסים חלקיים או אירועים איסכמיים חולפים.
דמם תת עכבישי וכן סידרוסיס שטחי (superficial siderosis) מהווים גם הם ביטויים דימומיים של אע"מ. בניגוד לדעה הרווחת כי דמם תת עכבישי באע"מ מהווה למעשה התפשטות של הדמם הלוברי הראשוני, נראה כיום כי הוא עשוי להימצא גם באתרים מתחקים מהדמם הראשוני ולהיגרם באופן ראשוני כחלק מהמחלה.
מחקרים אפידימיולוגיים הדגימו כי הגן לאפוליפופרוטאין APO E מהווה גורם סיכון לדת"מ בחולי אע"מ. בעוד שהאלל ל ε4 APOE מעלה שקיעה של ע"ב בכלי הדם המוחיים האלל ל ε2 APOE מעלה סיכון לדת"מ על ידי פגיעה במבנה דופן כלי הדם. גורמי סיכון לדת"מ בנשאי 2ε APOE כוללים טיפול בנוגדי צימות טסיות ונוגדי קרישה, יתר לחץ דם וחבלות ראש קלות. [10]
נשאות ε2 APOE בחולים עם דת"מ לוברי המטופלים בקומדין מהווה פוטנציאל עתידי לזיהוי חולים הנמצאים בסיכון מוגבר לדת"מ על רקע טיפול בתכשירים נוגדי קרישה.
כיום אין טיפול מניעתי לדת"מ בחולים עם אע"מ. במחקר ה PROGRESS[11] איזון לחצי דם על ידי פרינדופריל עם ובלי משתנים נמצא במוריד סיכון לדת"מ בחולים הסובלים מאע"מ, כך שאיזון לחצי דם בחולים אלו מהווה גישה טיפולית הגיונית. מחקרים הנעשים כיום בודקים שימוש בנוגדנים מונוקלונאלים לפינוי העמילואיד מדפנות כלי דם המוחיים.
למרות שנראה כי קיים סיכון מוגבר לדת"מ בחולים עם אע"מ העוברים טיפול טרומבוליטי או מטופלים בנוגדי קרישה יש צורך במחקרים פרוספקטיבים נוספים על מנת להעריך סיכון מול תועלת בחולים אלו. המידע שבידנו כיום לא תומך בביצוע בדיקות תהודה מגנטית או בדיקות גנטיות עובר להתחלת טיפול בנוגדי קרישה. בחולים עם עבר של דת"מ לוברי משני לאע"מ ואבחנה של פרפור עליות נראה כי הסיכון בנוגדי קרישה גבוה מהתועלת [12]. גם טיפול בנוגדי צימות טסיות נמצא כמעלה סיכון לדת"מ בחולי אע"מ, במיוחד בחולים עם מספר גבוה של דימומים זעירים בהדמיה[13], אולם לא ברור האם הסיכון גבוה מהתועלת במניעה שנייונית של ארועים כליליים או מוחיים.
הדמיה
אבחנה ודאית של אע"מ דורשת בדיקה היסטופתולוגית המדגימה משקעי ע"ב על פני דופן כלי הדם ולפיכך האבחנה נעשית בעיקר לאחר המוות. ניתן לבצע אבחנה פתולוגית גם בחיים על ידי ביופסיית מוח או ניקח דת"מ אולם מדובר במקרים נדירים וכך שישנה חשיבות רבה לאבחון על סמך בדיקות הדמיה לא פולשניות. רצף גרדיאנט -אקו-GRE בבדיקת תהודה מגנטית מאפשר זיהוי של דימומים זעירים חדשים וישנים. לנוכחותם ישנה גם חשיבות בניבוי סיכון להדרדרות תפקודית בעתיד או להערכת סיכון לדת"מ [14]. בדומה למשקעי ע"ב או דת"מ משני לאע"מ , גם דימומים זעירים נוטים להתקבץ באיזורים לוברים אחוריים.
קריטריון בוסטון מתבסס על הנטיה של הדימומים הזעירים באע"מ להיות מרובים ולהתרכז באיזורים לוברים (טבלה 1).
טבלה 1 - קריטריון בוסטון לאבחון אע"מ
|
באמצעות שילוב של נתונים קליניים, הדמייתיים ופתולוגיים ניתן לסווג דת"מ למשני לאע"מ באופן אפשרי, בסבירות גבוהה או ודאית. לפי הקריטריון, ניתן לאבחן אע"מ בסבירות גבוהה במבוגרים עם לפחות שני דימומים, חדים או ישנים, באזורים לוברים, לרבות דימומים זעירים, וללא סיבה אחרת לדמם. הכללת סידרוזיס שטחי כחלק מהביטויים הדימומיים מעלה את הרגישות של הקריטריון ללא פגיעה בסגוליות. שימוש ברצפים מתקדמים יותר כגון -susceptibility weighted imaging-SWI המבוססים על טכניקת גרדיאנט-אקו מעלים את רגישות האבחנה. ממצאים היפואינטינסיים ב SWI נמצאו בקורלציה לדימומים זעירים בהיסטולוגיה ועשויים לשמש כביומרקר הדמייתי לאבחון אע"מ. עם זאת, חשוב לזכור כי בדיקת תהודה מגנטית איננה יכולה לזהות את משקעי ע"ב עצמו אלא רק ביטויים דימומיים משנים לו. מיפוי מוח עם תרכובות הנקשרות לע"ב כגון -amyloid binding compound Pittsburgh Compound B - PLB מסוגל לאבחון משקעי ע"מ בחולים אלו.
ביטויים איסבמיים
למרות שאע"מ ידוע בעיקר כגורם לדת"מ, המנעד הקליני של המחלה הינו רחב וכולל גם ביטויים איסכמיים. ע"ב עלול לגרום לחצרות חלל כלי הדם, לפגיעה ברגולציה של זרימת הדם, פגיעה במבנה ובתפקוד תאי האנדותל וביכולת כלי הדם להתרחב בתגובה לגירויים פיזיולוגיים. שינויים אלו עומדים ככל הנראה בבסיס האסכמיה המוחית בחולי אע"מ הגורמת לתופעות קליניות והדמייתיות כגון אוטמים מוחיים ולויקואריוזיס (אותות חריגים בחומר הלבן ברצף FLAIR שנמצאו כקשורים להידרדרות תפקודית באוכלוסייה המבוגרת).
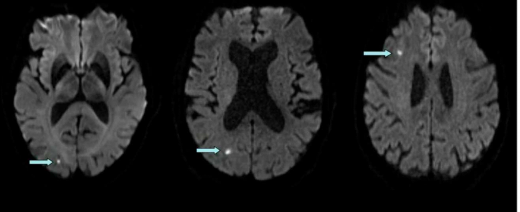
אוטמים זעירים cerebral micro-infarcts הם אותות חריגים קטנים ולא תסמיניים הניתנים לזיהוי ברצף DWI בבדיקת תהודה מגנטית (תמונה 1).
לאור גודלם המיקרוסקופי(בין 100-500 מיקרון) ניתן לזהות אותם רק בשלב החד. אוטמים אלו תוארו לאחרונה כשכיחים מאוד בחולים לאחר דת"מ בעיקר על רקע אע"מ. אוטמים זעירים אלו נמצאו באסוציאציה עם דימומים זעירים כך שסביר להניח כי הם תוצאה של מחלת כלי דם קטנים משנית לאע"מ. העובדה כי ניתן למצוא אוטמים זעירים גם מעבר לשלב החד של דת"מ מעלה את האפשרות כי הם מהווים ביטוי לאסכמיה שקטה ומתמדת בחולים אלו [15]. איסכמיה זו עלולה להוות גורם, לא מוכר עד כה, להדרדרות קלינית בחולים לאחר דת"מ.
ירידה קוגניטיבית בחולי אע"מ
מחלת כלי דם מוחיים קטנים ואע"מ באופן פרטני מהווים סיבות מרכזיות לשיטיון על רקע וסקולרי. הדרדרות קוגנטיבית נצפתה בחולים עם אע"מ משפחתי או ספורדי גם בהעדר ארוע מוחי או שינויים פתולוגיים האופיינים למחלת אלצהיימר. בכ- 40% מהחולים באע"מ קיימת ירידה קוגניטיבית כלשהי. למרות שהבסיס לירידה הקוגניטיבית איננו ברור, סביר להניח כי הוא קשור לשינויים מבניים שהודגמו בחולים, מעבר לדת"מ, לרבות דימומים זעירים, לויקואריוזיס, אוטמים זעירים, דלקת ושינויים מפושטים במסלולים שהודגמו בטכנולוגיה של diffusion tensor imaging.
מספר מחקרים קלינים-פתולוגים קהילתיים גדולים הדגימו את התפקיד המרכזי של אע"מ בשיטיון. המחקרים בדקו תפקודים קוגנטיבים במהלך החיים עם שינויים פתולוגיים לאחר המוות. מחקר ה MRC, למשל, הראה קשר הדוק בין אע"מ לשיטיון גם במודל רב משתני שכלל גיל, משקל מוח, נוכחות פלאקים, טאנגלים, גופיפי לואי ומחלה צרברו-וסקולרית [4].
אע"מ משפחתי
רוב מקרי האע"מ מופיעים באופן ספורדי באוכלוסייה המבוגרת בעוד שצורות משפחתיות הן נדירות. הופעה משפחתית מתאפיינת בגיל הופעה צעיר ובתמונה קלינית קשה יותר. מוטציות הגורמות למחלה המשפחתית תוארו בגן ל APP וגם בגנים שאינם מקודדים לע"מ כגון 1BR, ציסטטין C וטרנסטירטין. גם מוטציות באזורי החיתוך לגנים לסקרטאזות β, γ עלולות לגרום לאע"מ אולם לרוב יחד עם הופעה מוקדמת של מחלת אלצהיימר . באופן מעניין, רוב המוטציות, להוציא את הוריאנט האיסלנדי של ציסטטין C, אינן מתאפיינות בשכיחיות גבוהה של דת"מ. מעניין גם לציין כי יתכן מופע קליני שונה לחלוטין בקרב נשאים של אותן מוטציות.
מדובר בתת קבוצה ייחודית של אע"מ המתאפיינת בהידרדרות קוגניטיבית מהירה, פרכוסים, כאבי ראש, חסרים נוירולוגים מוקדיים ושינויים מפושטים בחומר הלבן. התמונה הפתולוגית כוללת משקעי ע"ב ווסקוליטיס. חשוב להגיע לאבחנה נכונה בחולים אלו שכן מדובר בתת קבוצה המגיבה לטיפול מדכא חיסון כגון סטרואידים או ציקלופוספמיד. התגובה לטיפול כוללת גם שיפור בתמונה הפתולוגית ואף ירידה בטיטר נוגדנים כנגד ע"ב בנוזל השדרה העשויים בעתיד לשמש כביו-מרקר לאבחון המחלה והערכת תגובה לטיפול. שינויים קליניים, הדמייתיים ופתולוגים דומים נמצאו גם בתת קבוצה של חולים שקיבלו חיסון שכלל נוגדנים כנגד ע"מ הכולל 42 חומצות אמינו (bapineuzumab) כטיפול ניסיוני במחלת אלצהיימר. שינויים אלו הודגמו בעיקר בחולים שקבלו מינון גבוה יותר של התכשיר או בנשאים של ε4 APOE. שינויים אלו תומכים בתיאוריה כי מדובר בתגובה חיסונית כנגד ע"מ.
לסיכום, כיום ישנן הוכחות רבות כי אע"מ משחק תפקיד מרכזי לא רק בפתופיזיולוגיה של דת"מ לוברי אלא גם בביטויים האיסכמיים של מחלת כלי דם קטנים במוח וככזה הוא תורם תרומה מרכזית להתפתחות שיטיון על רקע וסקולרי באוכלוסייה המבוגרת. מאז תיאורו הראשוני לפני עשרות שנים חלה התפתחות מרשימה בהבנת הפתוגנזה, גנטיקה ואבחנה של האע"מ, אולם עדיין קיים צורך במחקרים פרוספקטיביים להערכת אסטרטגיות חדשות למניעה וטיפול במחלה.
ביבליוגרפיה
- ↑ Vinters HV. Cerebral amyloid angiopathy. A critical review. Stroke. 1987;18:311-24.PubMedCrossRef
- ↑ Okazakl H, Reagan TJ, Campbell RJ. C I'm ico pat ho logic studies of primary cerebral amyloid angiopathy. Mayo Clin Proc. 1979;54{l):22-31.PubMed
- ↑ Pfeifer LA, White LR, Ross GW, et al. Cerebral amyloid angiopathy and cognitive function: the HAAS autopsy study. Neurology. 2002;58(ll):1629-34.PubMedCrossRef
- ↑ 4.0 4.1 4.2 Neuropathology Group. Medical Research Council Cognitive Function and Aging Study. Pathological correlates of late-onset dementia In a multicentre, community-based population In England and Wales. Neuropathol-ogy Group of the Medical Research Council Cognitive Function and Ageing Study {MRC CFAS). Lancet. 2001;357(9251):169-75
- ↑ Kimberly WT, Gilson A, Rost NS, et al. Silent ischemic Infarcts are associated with hemorrhage burden In cerebral amyloid angiopathy. Neurology. 2009,72(14):1230-
- ↑ Gregolre SM, Charidimou A, Gadapa N, et al. Acute Ischaemlc brain lesions In Intracerebral haemorrhage: multl- centre cross-sectional magnetic resonance Imaging study. Brain. 2011;134:2376-86.
- ↑ Garcla-ALloza M, Gregory J, Kuchibhotla KV, et al. Cerebrovascular lesions Induce transient -amyloid deposition. Brain. 2011;134:3697-707
- ↑ Masuda J, Tanaka K, Ueda K, Omae T. Autopsy study of incidence and distribution of cerebral amyloid angiopathy In Hlsayama, Japan. Stroke. 1988;19(2):205-10
- ↑ Greenberg SM, Nandlgam RN, Delgado R et al. Mlcrobleeds versus macrobleeds: evidence for distinct entitles. Stroke. 2009;40(7):2382-6
- ↑ McCarron MO, Nlcoll JA, Ironside JW, et al. Cerebral amyloid angiopathy-related hemorrhage. Interaction of APOE epsllon2 with putative clinical risk factors. Stroke. 1999;30:1643-6
- ↑ Arlma H, Tzourlo C, Anderson C, PROGRESS Collaborative Group, et al. Effects of perlndoprll-based lowering of blood pressure on Intracerebral hemorrhage related to amyloid angiopathy: the PROGRESS trial. Stroke. 2010;41:394-6
- ↑ Eckman MH, Rosand J, Knudsen KA, et al. Can patients be antlcoagulated after Intracerebral hemorrhage? A decision analysis. Stroke. 2003;34:1710-6
- ↑ Biffi A, Halpin A, Towflghi A, et al. Aspirin and recurrent Intracerebral hemorrhage in cerebral amyloid angiopathy. Neurology. 2010;75:693-8.
- ↑ Greenberg SM, Eng JA, Ning M, et al. Hemorrhage burden predicts recurrent Intracerebral hemorrhage after lobar hemorrhage. Stroke. 2004;35:1415-20
- ↑ Aurlel E, Gurol ME, Ayres A, et al. Characteristic distributions of intracerebral hemorrhage-associated diffusion-weighted lesions. Neurology. 2012 11;79{24):2335-41
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר איתן אוריאל, היחידה לשבץ מוח, מחלקה נוירולוגית, מרכז רפואי תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק