קרצינומה אפידרמואידית של הוושט - Esophageal epidermoid carcinoma
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של הוושט | |
אפידמיולוגיה
- השכיחות של שאת זו במקומות שונים בעולם שונה. היא שכיחה יותר בשכבות סוציואקונומיות נמוכות, בסין, ביפן, בדרום אפריקה, בפורטו־ריקו ועוד. שיעור ההיארעות הגבוה בעולם נמצא בחגורת הים הכספי, צפון אירן, צפון סין והרפובליקות הדרומיות של חבר העמים לשעבר. במקומות אלה ההיארעות היא 100 חולים ל-100,000
- היא שכיחה יותר בקרב שחורים, ובאוכלוסייה המבוגרת. בזכרים השכיחות גבוהה פי 5-2 מאשר בנקבות.
- בישראל מאובחנים מדי שנה כ-120 חולים חדשים. עלייה מסוימת בהיארעות חלה עם ההגירה הגדולה לישראל מחבר העמים לשעבר. השכיחות בקרב האוכלוסיה יהודית היא פי 10 לעומת הערבית.
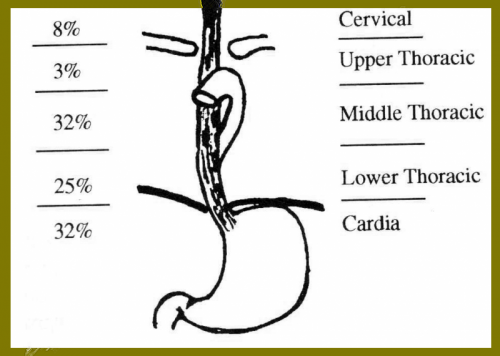
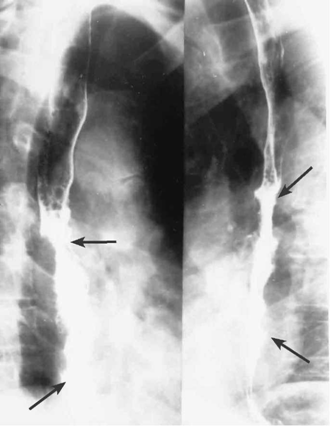
- השאת שכיחה יותר בשליש האמצעי של הוושט (אם אין מביאים בחשבון את שאתות הקרדיה). השאתות בוושט הצווארי שכיחות פחות, ואולם נשים נפגעות יותר מגברים במיקום זה. התפלגות השאתות לפי מיקומן בוושט מוצגת באיור 30.1.
- שינויים סביבתיים ודיאטתיים הם בעלי משקל בהבדל זה. מאכלים חמים ומשקאות אלכוהוליים חריפים במיוחד גורמים לגירוי כרוני של הרירית בוושט ולשינויים ממאירים בו.
- אכלזיה, בקע סרעפתי, כוויות, לויקופלקיה ועישון סיגריות נמצאו בשכיחות יתר בחולים הלוקים בשאתות ממאירות בוושט.
פתולוגיה
מבחינה פתולוגית השאתות הללו יכולות להיות מכויבות ופולשניות, או בצורת גושים הבולטים לנהור הוושט וחוסמים אותו. מיקרוסקופית, מקורן של השאתות הוא בתאי הקרן המכילים קרטין ופניני קרן. הן יכולות להיות בעלות התמיינות (דיפרנציאציה) גבוהה או אנפלסטית. יש הטוענים שאין התאמה בין דרגת ההתמיינות של השאת לבין ההיוותרות בחיים.
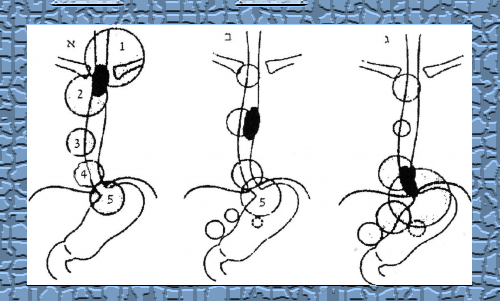
שאתות בוושט הצווארי והאמצעי מתפשטות לקשריות הלימפה סביב הטרכיאה, הברונכים והוותין (aorta). שאתות בשליש התחתון מתפשטות לסרעפת, לפריקרד, לפונדוס, לקרדיה ולקשריות הלימפה של הקיבה והמיצר (איור 31.1).
השאת בוושט יכולה להתפשט: התפשטות ישירה (direct spread), התפשטות לאורך התת־ רירית והתפשטות טרנסמורלית לטרכיאה, לברונכוס, לוותין, לסרעפת ולעצבים. או דרך בלוטות הלימפה האזוריות.
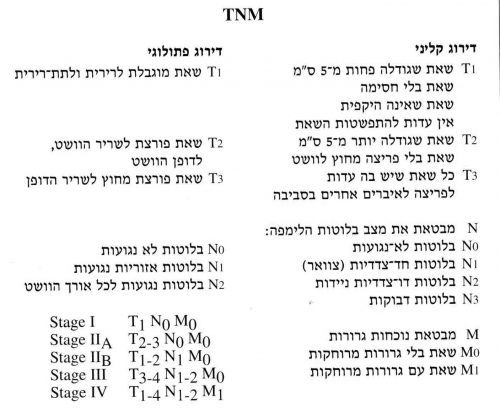
דירוג המחלה נעשה בשיטת TNM.
- ה-T מבטאת Tumor, והוא נחלק ל-4 דרגות קליניות ו-3 פתולוגיות.
- ה-N מבטאת Node, ומתחלק ל-4 קבוצות קליניות ו-3 פתולוגיות.
- ה-M מבטאת נוכחות או אי נוכחות גרורות (ראה טבלה 7.1).
היפנים מחלקים את ה-TNM בצורה שונה:
- T1 - שאת מוגבלת לרירית ולתת־רירית;
- T2 - שאת חודרת לשריר הדופן.
- T3 - שאת חודרת לאדונטיציה;
- T4 - שאת חודרת לאיברים סמוכים.
- N1 בלוטות לא־נגועות; N2 בלוטות נגועות.
- M1 שאת בלי גרורות; M2 שאת עם גרורות
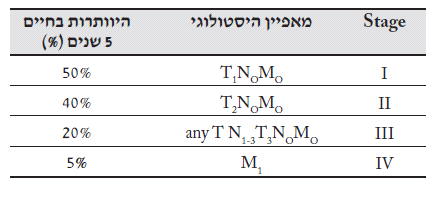
קיימת התאמה טובה בין דירוג המחלה לבין ההישרדות בחיים. ככל שהדרגה נמוכה יותר ההישרדות טובה יותר (טבלה 8.1)
| דרגת המחלה | הישרדות 5 שנים |
|---|---|
| I | 50% |
| IIa | 23% |
| IIb | 22% |
| III | 17% |
| Iv | 0% |
תסמינים קליניים
- דיספגיה היא התסמין השכיח ביותר. היא מתפתחת בצורה הדרגתית. תחילה, הקושי הוא בבליעת מוצקים, ולאחר מכן בבליעת מזון דייסתי ולבסוף החולה אינו מסוגל לבלוע נוזלים ואף רוק.
- ירידה במשקל, מכיוון שהחולה אינו מסוגל לאכול או עקב מחלה מפושטת.
- פגיעות במערכות סמוכות, כגון הסרעפת, הטרכיאה או ה-recurrent laryngeal nerve, מעידות על התפשטות המחלה בבית החזה.
- תסמינים נדירים יותר הם
- צרידות, הנובעת מפגיעה recurrent laryngeal nerved עקב התפשטות מדיאסטינאלית.
- שיעול כרוני, דלקות ריאה או המופטיזיס, הנובעות מפריצת השאת ללרינקס או לסימפונות.
- גוש בבטן, נתן למשש גוש בבטן עליונה בחולים בעלי שאתות של הקרדיה או הוושט התחתון.
- קשריות לימפה סופרה־קלויקולריות מוגדלות, כעדות לנוכחות גרורתית בהן.
בכל אדם לאחר גיל 40 המתלונן על קשיים בבליעה יש לברר את התסמינים כדי לשלול שאת ממארת בוושט. למרות המודעות לשאתות אלה, חולים מופיעים כשהשאתות מפושטות כבר בשלב האבחנה. מכיוון שהשאת גדלה בדרך כלל לאט, התסמינים הקליניים מופיעים בשלב מתקדם. אמינות השיטות השונות באבחון דירוג השאתות בוושט סוכמה בטבלה 9.1.
| השיטה | אמינות | ||
|---|---|---|---|
| T | N | M | |
| CT | 55% | 60% | 90% |
| EUS* | 90% | 70% | 70% |
| טורקוסקופיה | 90% | ||
אבחנה
האבחנה נעשית בעזרת:
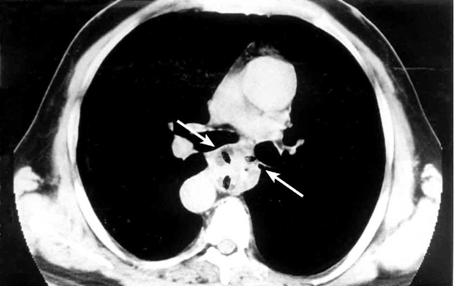
- טומוגרפיה ממוחשבת: מאפשרת לראות את השאת, להעריך את אורך השאת בוושט, את מצב קשריות הלימפה ואת החדירה לאיברים אחרים בבית החזה או בבטן (תצלום 14.1).
- אנדוסקופיה מאפשרת לראות את השאת. בזמן אנדוסקופיה ניתן לקחת ביופסיות ולאמת את האבחנה. לעתים, עקב הבצקת או החסימה, אין אפשרות ליטול ביופסיות מהמקומות המתאימים, לכן לא נקבל אבחנה נכונה. שיפור ניכר באבחנה חל מאז שהאנדוסקופ הפיברואופטי וטכניקת Brushy נכנסו לשימוש. שיעור האבחנות ההיסטולוגיות המדויקות עומד על 97%.
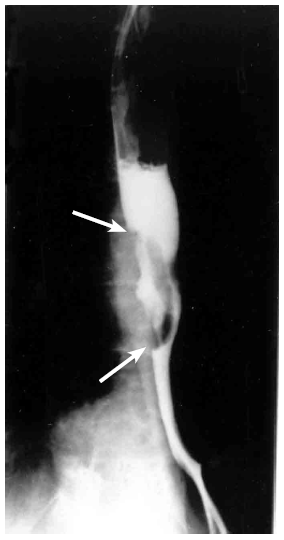
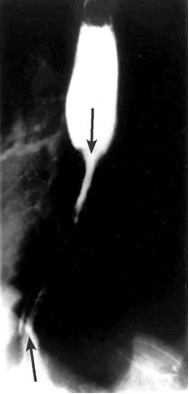
- צילומי הוושט, לאחר בליעת בריום: בצילומי הוושט ניתן לראות פגם מילוי, כיבים, אי־סדירות של הרירית, היצרויות, הפרעות בגל הפריסטלטי והרחבת הוושט מעל החסימה (תצלומים 15.1-17.1).
- לרינגוסקופיה ובדיקת מיתרי הקול יש לבצע בחולים שאובחנה בהם שאת של השליש האמצעי והעליון של הוושט, כדי לעמוד על מידת החדירה של השאת. גרורות נשלחות בדרך כלל לבלוטות הלימפה המקומיות והסופרה־קלויקולריות, ורק לאחר מכן לריאות ולכבד.
- יש המוסיפים לבדיקות האבחנה גם מדיאסטינוסקופיה ופלאורוסקופיה כדי להעריך את התפשטות המחלה.
- אולטרה־סאונד אנדוסקופי (endoscopic ultrasound) – בעזרת האולטרה־סאונד אפשר העריך את גודל השאת והתפשטותה, ואת בלוטות הלימפה שמסביבה. בדיקת האולטרה־סאונד האנדוסקופית היא כיום כלי עזר חשוב בהערכת האפשרות לכרות את השאת.
- PET-CT – שיטה שהיא שילוב של מיפוי איזוטופית בעזרת ....והדמיה אנטומית בעזרת CT מהווה אמצעי מעולה לזיהוי מעורבות בלוטות לימפה בתחנות השונות . מכיוון שחתכי ה-CT ב-PET הם רחבים יותר הוא פחות טוב להדמיה אנטומית ה-CT הספיראלי ולכן לא מחליף אותו.
טיפול
חולים בזמן האבחנה נמצאים במצב כללי ותזונתי ירוד, ובמקצתם השאת מפושטת ואינה ניתנת לכריתה כירורגית, חולים אלה יטופלו בטיפולים מקלים. חולים בהם הכריתה הכירורגית אפשרית (חולים נתיחים) ברובם יעברו ניתוחים מקלים ומיעוטם ניתוחים מרפאים. הכימותרפיה מאכזבת ונותר להציע לחולים אלה טיפול קרינתי או טיפול כירורגי.
טיפול קרינתי
שאתות אפידרמואידיות רגישות לטיפול קרינתי. טיפול זה הוא טיפול הבחירה לשאתות בצוואר ובשליש העליון של הוושט החזי, בחולים שאובחנו בהם שאתות קטנות או בחולים שיש לגביהם הוריית נגד לניתוח עקב מצבם הכללי.
הוריות־נגד לטיפול קרינתי הן:
- מדיאסטיניטיס
- נצורים לדרכי הנשימה
כהכנה לטיפול הקרינתי יש להזין חולים אלה בתזונה עשירה, אנטרלית או פארא־אנטרלית. מטרת הכנה זו היא לשפר את תגובתם לקרינה ואת יכולת עמידתם בפני סיבוכי הקרינה. הקרנות יכולות לשמש לאחת מהמטרות הבאות:
- טיפול מרפא (curative).
- טיפול מקל (palliative).
- טיפול קדם־ניתוחי (preoperative).
הקרנות מרפאות: מקרינים 6,000 ראד במשך 7-6 שבועות. 2,000 ראד מוקרנים באלכסון, כדי למנוע פגיעה בחוט השדרה. מכיוון שההתפשטות היא לאורך הדופן, יש להקרין בשדות נרחבים מעל לשאת ומתחתיה. בזמן ההקרנות מופיעה בצקת של האזור, וחולים החסומים חלקית יפתחו חסימה מלאה. לכן, לפני תחילת הטיפול בהקרנות, יש להזין את החולים דרך גסטרוסטומיה עד חלוף החסימה. במקצת מהחולים שאובחנה בהם שאת קטנה, תיעלם השאת לאחר ההקרנות לגמרי ולא תימצא לה עדות בפרפרט ההיסטולוגי.
הקרנות מקלות: הקרנות אלה מטרתן לשחרר את החסימה בוושט, כדי שהחולה יוכל לאכול. מקרינים 4,500-4,000 ראד במשך 4 שבועות. ב־50% מהחולים יש הטבה במצב והם יכולים לאכול.
הקרנות קדם־ניתוחיות: הקרנות אלה ניתנות כדי להקטין את השאת ואת מידת התפשטותה. מקרינים מנות של 4,000-2,000 ראד במשך 4-2 שבועות. מאפשרים מנוחה במשך שבועיים עד חודש ואז מנתחים. תוכנית טיפולים זו נקראת השיטה על־שם נאקאימה (Nakayama). ההקרנות מקטינות את השאת ויוצרות בצקת קלה מסביבה המאפשרת דיסקציה כירורגית קלה יותר. יש המשלבים מתן הקרנות עם כימותרפיה קדם ניתוחית (Neoadjuvant chemotherapy).
קרינה כטיפול ראשוני היא בעלת פעילות מוגבלת בשאת ממאירה של הוושט. משלב קרינה עם ניתוח לא שיפר את שיעור ההישרדות של החולים, והשפעתו על הבקרה המקומית אינה ברורה. לנוכח היתרון שנמצא למשלב טיפולי של קרינה וכימותרפיה, מוגבל כיום התפקיד של הקרינה לטיפול מקל בחולים שמצבם הכללי ירוד, ואשר אינם מסוגלים לעמוד בטיפולים אחרים.
סיבוכי ההקרנות הם:
- אזופאגיטיס.
- התנקבויות.
- דימומים.
- היצרויות.
- פנוימוניטיס ונזק לחוט השדרה.
כימותרפיה בסרטן הוושט
לכימותרפיה טרום ניתוחית יתרונות אפשריים רבים. אלה כוללים הקטנת השאת הראשונית, דבר במשפר את אפשרות הכריתה והבקרה המקומית, טיפול מוקדם במיקרו־גרורות, והערכה פתולוגית של התגובה לטיפול, העשויה לאפשר בחירה טובה יותר של טיפול בתר ניתוחי. כימותרפיה טרום ניתוחית נחקרה בניסויים שלב 2 עם משלבים של ציסטפלטין -FU5. בארבע מחקרים מבוקרים בשלים, כולל מחקר בין קבוצתי אמריקאי גדול, לא הודגם יתרון לכימותרפיה טרום ניתוחית ולכן יש להתייחס אליה כאל טיפול ניסיוני.
כימותרפיה וקרינה:
כימותרפיה־קרינה כטיפול יחידני מביאה לשיפור משמעותי בשיעור ההישרדות והבקרה המקומית ביחס לקרינה בלבד, ולכן זהו הטיפול התקני הלא ניתוחי לשאתות ממאירות של הוושט. למרות ההתקדמות שהושגה במשלב זה תוצאותיו אינן מספקות: שיעור ההישרדות ארוכת טווח נמוכה מ-30% ומידת הרעילות של הטיפול רבה.
כימותרפיה־קרינה כטיפול טרום־ניתוחי נועדה לנצל את היתרונות של הטיפולים: הטיפול הטרום ניתוחי יכול לעלות את שיעור אפשרות הכריתה (נתיחות) על־ידי הורדת דירוג המחלה, ולהקטין באמצעות הכימותרפיה את הסיכון להישנות מחלה מערכתית. הניתוח יכול לשפר את הבקרה המקומית המושגת על־ידי כימותרפיה־קרינה בלבד. חוקרים דיווחו על שיעור תגובה פתולוגית שלמה (CPR) ב-20%-30% ועל טווח רחב של שיעורי הישרדות. בארבעה מחקרים מבוקרים נערכה השוואה בין כימותרפיה־קרינה טרום ניתוחית לניתוח בלבד. מחקרים אלה מראים יתרון בשליטה המקומית בטיפול המשולב לעומת ניתוח בלבד. אולם לגבי ההישרדות, שני מחקרים הראו יתרון ואילו שניים אחרים לא הצליחו להראות יתרון בהישרדות.
בשני מחקרים מבוקרים נבדק תפקיד הניתוח לאחר כימותרפיה־ קרינה. מחקרים אלה הראו שניתוח לאחר כימותרפיה־קרינה משפר את הבקרה המקומית אך השפעתו על הישרדות החולים, במיוחד אלה שהגיבו לטיפול אינה ברורה. יתכן שעקר תפקידו של הניתוח לאחר טיפול טרום ניתוחי הוא ניסיון להציל חלק מהחולים שלא הגיבו לטיפול.
הגישה הטיפולית
בחולים עם שאתות הניתנות לכריתה בניתוח, בחירה בכל אחת משתי החלופות היינו טיפול כימותרפי־קרינה אם או ללא תוספת ניתוח נראית סבירה. לחולים עם מחלה מתקדמת, שבה הסיכוי לניתוח מרפא (R0) הוא נמוך, כימותרפיה־קרינה היא האפשרות המועדפת. בחולים עם מחלה מוקדמת (T1-2 N0) ניתוח מהווה את בטיפול התקני היחיד. בחולים עם שאתות ממאירות של הוושט בשליש העליון הכרוכים בסיכון גבוה יותר לסיבוכים, קיימת עדיפות לכימותרפיה־ קרינה. מאידך, הסבילות לכימותרפיה־קרינה של שאתות בחלק הרחיקני של הוושט ובאזור המעבר ושט־קיבה היא בדרך כלל ירודה יותר וקיימת לכן העדפה לניתוח.
טיפולים פליאטיביים
טיפולים פליאטיביים בשאת ממארת בוושט יתבצעו בהתקיים אחד הקריטריונים הבאים:
- מיקום השאת הוא בוושט החזי העליון והאמצעי.
- גיל החולה 75 שנה ויותר.
- תפקודי הריאה שלו פגומים (1.5> 1 FEV).
- תפקוד לבבי פגום - 40% > ejection fraction.
- שיתוק של עצב ה-recurrent laryngeal.
- תסמונת הורנר.
- כאבי גב קבועים.
- שיתוק של הסרעפת.
- יצירת פיסטולות.
- תפליט פלאורלי עם תאי שאת.
- שאת שקוטרה יותר מ-8 ס"מ.
- ירידה של יותר מ-20% במשקל.
- בלוטות לימפה מוגדלות בטומוגרפיה ממוחשבת.
- גרורות מרוחקות.
- התפשטות מקומית נרחבת.
- פריצה לתוך המדיאסטינום.
מטרת הטיפולים הללו היא לאפשר תזונה ובליעת רוק. טיפול בהקרנות הוא דרך אחת טובה להשגת הקלה, תוארו שיטות כירורגיות רבות שמטרתן לאפשר לחולים לאכול ואיכות חיים סבירה. שיטות אלה אפשר לחלק כך:
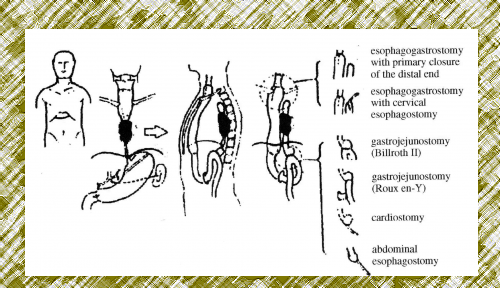
- מעקפים כירורגיים: בעזרת הקיבה, המעי הדק או הכרכשת, המועברים מתחת לסטרנום או מעליו, וכוללים, או שאינם כוללים, כריתה של הוושט. כך מתאפשר מעקף של החסימה, והחולה מסוגל לאכול ולבלוע רוק (ראה איור 32.1).
- טכניקות המאפשרות האכלה, כגון גסטרוסטומיה (הכנסת צנתר לקיבה) או גיגונוסטומיה (הכנסת צנתר למעי הדק) המאפשרות להזין את החולה דרך הצנתרים. יש מנתחים המוסיפים גם אזופאגוסטומיה צווארית (יצירת פתח בין הוושט לעור הצוואר), המאפשרת לחולה לבלוע רוק.
- צנרור (intubation) בעזרת תותבים, כגון celestein או סוטר, אפשר להכניסם לוושט בעזרת גסטרוסקופ או בדרך כירורגית. התותבים הללו הם צינורות בורגיים (ספירליים) גמישים המתרחבים בצורת קונוס בחלקם העליון (איור 33.1). לפני החדרת התותב מבצעים הרחבה של החסימה בעזרת מרחיבים המוחדרים בדרך אנדוסקופית או כירורגית לאחר פתיחת הקיבה. מחדירים את התותב כך שהקונוס שבראשו יושב על קצה השאת בוושט ונאחז בו. פעולה זו מאפשרת לחולה לבלוע מזון ורוק. טכניקה זו מקלה על החולה אך כרוכה בשיעור תמותה של כ-14%, בזמן שהחולה נמצא עדיין בבית החולים. הפטירות נובעות מהתנקבויות, מדלקת המיצר, מאספירציות עקב רפלוקס או מחסימת התותב. לכן יש להשתמש בשיטה זו רק בחולים שאובחנה בהם שאת מפושטת ושאורך החיים הצפוי להם קצר, או בחולים הלוקים בנצורים לדרכי הנשימה העליונות. בחולים עם נצורים (פסטולות) לדרכי הנשימה התותב יושב בגובה הנצור וחוסם אותו.
- הכנסת האנדוסקופ הפיבראופטי לשימוש קליני הביאה עמה מהפכה בטיפול במחלות מערכת העיכול. אחד הנושאים בעל עניין גובר והולך הוא הטיפול האנדוסקופי בשאתות של מערכת העיכול ובתחום זה זכה לשימוש נפוץ ביותר הטיפול בעזרת קרן הלייזר (LASER - light amplification by stimulated emission of radiation). ניתן להעביר קרן של Argon או Nd/YAG laser דרך תעלת האנדוסקופ בתוך מוביל. פעולת קרן הלייזר על הרקמה מתרחשת כאשר אנרגיית האור הנפלטת הופכת לחום: בטמפרטורה של יותר מ־06 מ"צ מושרית קרישה וביותר מ-100 מ"צ - התאדות של הרקמה. תוצאות מצטברות של הטיפול בליזר ב-1359 חולים הלוקים בהיצרות ממארת במערכת העיכול העליונה (מהם 816 חולי סרטן הוושט) מצביעות על הצלחת הטיפול בהקלת החסימה ב-83% מהחולים, על התנקבות הדופן בעקבות הטיפול ב-2.1% מהחולים ועל שיעור תמותה של 1% מהחולים. הטיפול בלייזר בסרטן הוושט אינו נעדר סיבוכים. העיקרי הוא התנקבות הדופן. שיעור התנקבות הוושט, כפי שמדווח בעבודות השונות, הוא 6%-0%, לעומת 9%-% 11 לאחר החדרה אנדוסקופית של צינור תותב, המקובל כיום כטיפול מקל בסרטן מתקדם של הוושט. גורמי הסיכון להתנקבות הוושט בעקבות הטיפול בלייזר הם טיפול קרינתי קודם, זווית חדה בשאת באזור הקרדיה וביצוע הרחבה (bougienage) בו־זמנית. שיעור התמותה בעקבות טיפול בלייזר הוא 5%-1%, לעומת שיעור תמותה של 16%-2% בעקבות החדרת צינור תותב.
טיפול כירורגי
לפני ניתוח יש לוודא שלחולה רזרבה ריאתית טובה על־ידי מבחני נשימה. FEV1 הקטן מ-50% מהמצופה מהווה בדרך כלל הורית נגד לניתוח. מכיוון שהניתוח הוא נרחב, החולים נדרשים לתפקוד לבבי טוב ולשם כך דרושה הערכה לבבית הכוללת מיפוי לב ותפקוד לב במאמץ. חולים עם ממצאים המעידים על אסכמיה פעילה או תפוקת לב ירודה מהווים קבוצה שבה קיימת הורית נגד יחסית לניתוח. רוב החולים עם שאתות ממאירות בוושט מגיעים לניתוח במצב תזונתי ירוד. אלה המוגדרים כסובלים מתת תזונה קשה זקוקים להכנה מטבולית באמצעות מתן הזנת על תוך ורידית, הכוללת מנות חלבון גבוהות בשיעור של 1.5 גר' לק"ג וכמות אנרגיה גבוהה (30 קק"ל לק"ג משקל).
בחלק מהחולים יש לשקול טיפול כימותרפי־קרינתי לפני הניתוח.
הניתוח חייב לכלול כריתה של השאת, כריתת הרקמות שמסביב והוצאת קשריות הלימפה האזוריות. הקירבה של השאת אל איברים חיוניים מגבילה לפעמים את הכריתה. יש מנתחים הממליצים לבצע כריתה שלמה של הוושט בכל החולים, בלא התחשבות במיקום. הסיבות לכך הן:
- התפשטות השאת בתוך דופן הוושט למרחק ניכר מהמוקד הראשוני אינה מאפשרת כריתה מרפאת בטוחה.
- ההשקות בוושט אינן בטוחות, ושיעור הדלפים מקו ההשקה הוא גבוה. הסיבות לשיעור הגבוה של מקרי הדלף מקו ההשקה הן:
- חוסר סרוזה בוושט.
- אספקת הדם לוושט מצטיינת במיעוט קו-לטרלים בין העורקים בוושט, ולפיכך נזק לכלי דם הקרוב לקו ההשקה עלול לגרום לנמק של הוושט בקו ההשקה ולדלף.
שאתות הוושט התחתון
שאתות אלה אפשר לכרות בצורה קלה יותר. הן שולחות גרורות, בעיקר לקשריות הלימפה הבטניות, לאורך העקומה הקטנה ולצליאק. הגישה לניתוחים אלה היא:
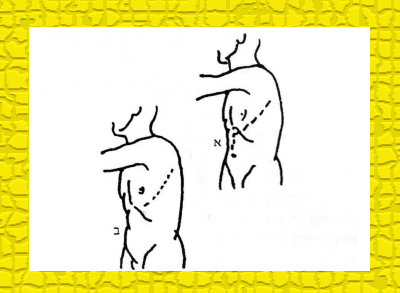
- אבדומינו-טורקלית : מתחילים את הניתוח בגישה בטנית כדי להעריך את אפשרות הכריתה (מידת הרסקטביליות) של השאת לאחר שחרור הקיבה ניגשים לחזה דרך טורקוטומיה שמאלית, הממשיכה את החתך הבטני (איור 34.1א).
- יש הממליצים על גישה טורקלית בלבד. דרך טורקוטומיה שמאלית במיטת הצלע השישית (איור 34.1 ב)
- אם התכנון הוא לבצע כריתת וושט שלמה יש לגשת תחילה בגישה בטנית ולאחר מכן התורקוטומיה ימנית
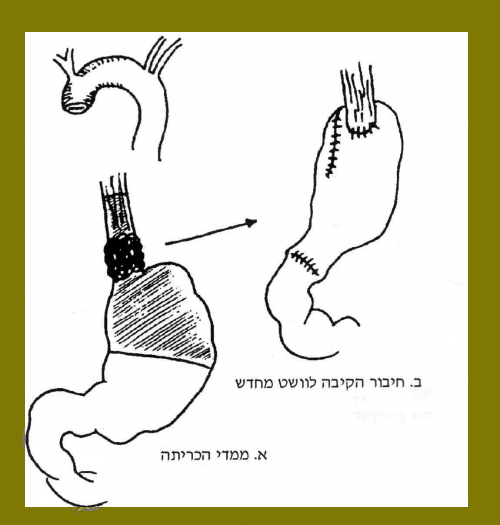
בשתי השיטות מבצעים מוביליזציה של השאת והוושט, פתיחה רדיאלית של הסרעפת, שחרור הקיבה על־ידי ניתוקה מה־vasa brevia וה־left gastric vessels, שמירה על right gastric vessels וה-gastroepiploic vessel. כריתת הקיבה כ-5 ס"מ מתחת לחיבור האזופאגוגסטרי וכריתת הוושט 10 ס"מ מעל השאת (gastrectomy and distal esophagectomy (proximal ידועה גם כשיטת & Ivor Lowis (איור 25.1 א ו-ב). יש מנתחים המעדיפים גם בחולים אלה לבצע כריתת ושט שלמה (ר' איור 37.1).
יש לכלול בכריתה גם את בלוטות הלימפה האזוריות לאורך העקומה הקטנה והקרדיה והבלוטות סביב הוושט (איור 36.1).
בהמשך ממולץ לבצע פילורופלסטיקה מכיוון שבניתוח זה העצבים התועים (vagus) נכרתים אף הם. את הקיבה מביאים לבית החזה ומבצעים השקה בין הוושט לבין הפונדוס . ההשקה יכולה להתבצע דנית בשכבה אחת או בשתי שכבות, או כפי שמקובל יותר כיום על ידי מקלב (stapler) המותיר שתי שורות של סיכות המחברות בין הקיבה לוושט. בגמר ההשקה מעבירים זונדה דרך ההשקה אל הקיבה. בעבר נהגו להשאיר את הזונדה במשך 10 ימים, כיום יותר מנתחים נוטים להוציא את הזונדה לאחר 4-3 ימים. את הניתוח מסיימים בסגירת הסרעפת ובית החזה ומשאירים נקז תחת מים בבית החזה. נקז זה נשאר ימים מספר, לרוב 8-6 ימים, שהוא פרק הזמן שבו עלול להופיע הדלף מקו ההשקה.
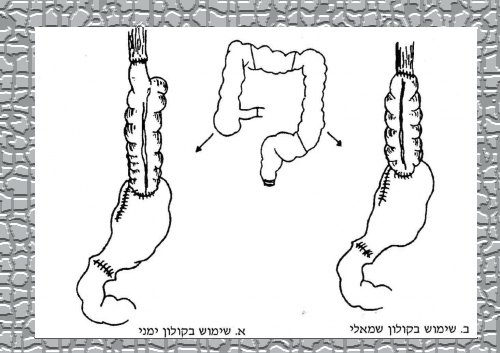
יש מנתחים המעדיפים להכניס בין הקיבה לגדם הוושט שתל של כרכשת או מעי דק (איור 37.1). אלה המבצעים השתלות של הכרכשת משתמשים בכרכשת הימנית או השמאלית. רוב המנתחים מעדיפים את הכרכשת השמאלית. בילדים, מעדיפים את הכרכשת הימנית מכיוון שקל יותר לבצע השקה בין הוושט למעי הכרוך הסופי. אספקת הדם לכרכשת, המהווה את השתל, מבוססת על middle colics artery. אם משתמשים במעי הדק, יש להקפיד לשמור על אספקת הדם שלו על־ידי ניתוק המזו מתחת לגובה הקשתות א-וסקולריות הקרובות למעי.
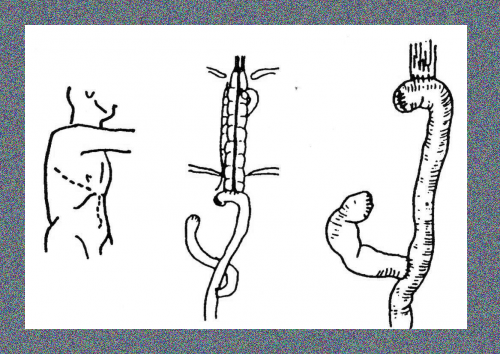
- Transhiatal esophagectomy -(כריתה דרך פער הוושט - Orringer)
בניתוח זה ניגשים דרך הבטן ומפרידים את הקיבה מהוושט (proximal gastrectomy). מרחיבים את ההיאטוס, ודרכו מפרידים את הוושט בבית החזה גבוה ככל האפשר. ניגשים דרך פתיחת הצוואר משמאל אל הוושט הצווארי, חושפים אותו, ומשחררים בעזרת האצבעות ומכשירים את הוושט הטורקלי העליון. בעזרת מלקחיים מושכים את הוושט התחתון אל הצוואר (esophageal stripping). דרך הפתח הנוצר מעבירים קטע כרכשת או מעי דק ומחברים בינו לבין הוושט הצווארי ובינו לבין הקיבה הנותרת. שיטה זו הפכה למקובלת ביותר בקרב מנתחים בעולם המערבי.
בחולה המועמד לניתוח מרפא (R0) של שאת בוושט התחתון והקרדיה, יש להתחיל את הניתוח בגישה בטנית ולבצע הערכה של הפיזור בבטן העליונה. אם יש פריצה של השאת מעבר לדופן ובלוטות מוגדלות, מומלץ לבצע כריתת ושט דרך ההיאטוס (transhiatal esophagectomy).
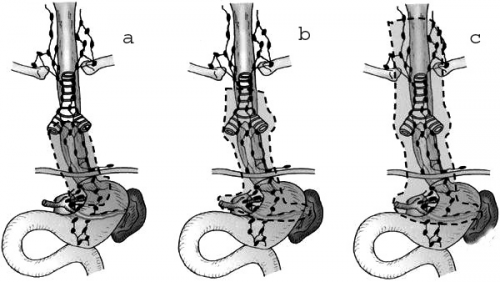
אם אין נגיעות בבלוטות ואין פריצה דרך הדופן בחלק הבטני, עוברים לבצע תורקוטומיה ימנית (right postrolateral thoracotomy). גם כאן מבצעים הערכה של הנגע - אם הוא פורץ את הדופן ומה מצב הבלוטות. אם השאת פורצת או שהבלוטות נגועות, מומלץ לבצע כריתה פשוטה של הוושט (בלא הבלוטות סביבה). מסיימים את הניתוח בהבאת הקיבה לצוואר ובחיבור ביניהם (cercical esophago-gastrostomy). אם אין פריצה והבלוטות אינן נראות נגועות, יש לבצע כריתה נרחבת של הוושט (enbloc dissection). כריתת הוושט כגוש אחד (en bloc) כוללת כריתת הוושט דרך בית החזה מלווה בכריתת תוכן המיצר כדוגמת: צינור בית החזה (thoracic duc), קרום הצדר, כפורת הלב וכריתה נרחבת של בלוטות בשני שדות או שלושה לפי גרסת היפנים (איור 25.1 א). חוזרים לבטן ומבצעים כריתה של שני השלישים הקריבניים של הקיבה ובלוטות הלימפה האזוריות והשקה בין הוושט הצווארי לקיבה על־ידי קטע קולון (cervical esophago-colostomy and abdominal colo-gastrostomy).
בשאתות של הקרדיה יש מנתחים (בעיקר היפנים) הממליצים לבצע כריתת קיבה שלמה וכריתת הוושט עד גובה הצוואר (-total esophago gastrectomy) ולחבר בין המעי הדק לוושט הצווארי על־ידי קטע של כרכשת או מעי דק (איור 38.1).
שאתות הוושט האמצעי
הגישה המקובלת היא תורקואבדומינאלית, כשהתורקוטומיה היא ימנית. התורקוטומיה הימנית מאפשרת גישה קלה יותר לוושט, אבל מחייבת לפרוטומיה נפרדת. Belsey מתאר גישה דרך תורקוטומיה שמאלית, פתיחת הסרעפת, מוביליזציה של הקיבה בלא צורך בלפרוטומיה, בניתוח יש לשחרר את כל הוושט, לשחרר את הקיבה ולכרות את הוושט מתחת לקרדיה. כורתים את כל הוושט עד הצוואר ומבצעים השקה בין פונדוס הקיבה לבין הוושט הצווארי, או בכל רמה בבית החזה. אין כל בעיה באספקת הדם כאשר מושכים את הקיבה לצוואר.
יש המעדיפים להכניס קטע כרכשת במקום הוושט שנכרת. אלה מעדיפים את אזור הכפיפה הטחולית והכרכשת היורדת על פני הכרכשת הימנית. לאחר שחרור הסגמנט של הכרכשת, תוך כדי שמירה על אספקת הדם שלו, מעבירים אותו אל מתחת לקיבה דרך ההיאטוס אל בית החזה דרך מיטת הוושט או דרך תעלה רטרוסטרנלית ומבצעים השקה אנטיפריסטלטית בין הוושט לקטע הכרכשת ובין הקיבה בדופנה הקדמי לבין הקצה המרוחק של הכרכשת. כמובן, גם בניתוח זה יש לבצע פילורופלסטיקה. אם אספקת הדם לקטע הכרכשת בצוואר לקויה, אפשר להוציא את הקטע על פני העור בצוואר בצורת אזופאגוקולוסטומי, להמתין ימים מספר ואז לבצע את ההשקה בצוואר. טכניקה חלופה היא לבצע את הניתוח בשני שלבים:
- ביצוע מעקף רטרוסטרנלי
- כריתת השאת
חלופה אחרת היא הכנת קטע הכרכשת בבטן והשארתו שם, ובה בעת ביצוע כריתת הוושט. בניתוח שני מעבירים את קטע הכרכשת המנותק לבית החזה ומבצעים את ההשקות.
שאתות השליש העליון של הוושט
התוצאות הניתוחיות בקבוצת חולים זו הן גרועות, ולכן טיפול הבחירה הוא הקרנות של השאת. ניתוח אפשרי הוא כריתה שלמה של הוושט והחלפתו בכרכשת או בקיבה.
שאתות הוושט הצווארי
שאתות בצוואר הן בעיה קשה עקב סמיכות השאת לאיברים חיוניים רבים. חדירה לתוכם אינה מאפשרת ניתוחים רדיקאליים ולפיכך רוב השאתות אינן ניתנות לכריתה. כריתה של שאת בצוואר מחייבת בדרך כלל ביצוע לרינגיקטומיה, תירואידקטומיה -bilateral neck dissection. השחזור יכול להתבצע על־ידי קטע כרכשת, קיבה או תחליפים כמו יצירת צינור עור, מעור הצוואר יחד עם הפלטיזמה, וחיבורו לקריקופרינגאוס או לפרינקס ולוושט הרחיקני. שיטה אחרת משתמשת במתלה של הפקטורליס עם העור מעליו ליצירת צינור והשקתו. טכניקות אלה מבוצעות בשלבים. יש מנתחים המשתמשים במתלה חופשי של מעי דק ובפיום כלי הדם של המעי ל-inferior thyroidal artery (איור 39.1).
Nelson מוסיף גם הזרקות מקומיות של ציקלופוספמיד נוסף על טיפול כימי מערכתי. שיעור התמותה הניתוחית המדווח הוא 7% ושיעור ההיוותרות בחיים ל-5 שנים הוא 25%-20%.
הגישות השונות לניתוחי סרטן הוושט מסוכמות בטבלה 10.1.
הגישה הניתוחית הנבחרת
הגישה הניתוחית הנבחרת לשאת ממאירה של הוושט שנויה במחלוקת. הדיווחים בספרות הרפואית ביחס להשוואה בין גישה דרך החזה וזו שדרך פער הוושט (stripping) אינם אחידים, הן לגבי שיעור התחלואה והתמותה הניתוחית והן ביחס לתוצאות המאוחרות. לא ניתן היום לקבוע שכריתה של שאת בוושט דרך בית החזה (טורקוטומיה) מביאה לשיעורים גבוהים יותר של הישרדות ובקרה מקומית מחד גיסא, ומאידך גיסא שהיא קשורה לשיעורים גבוהים יותר של סיבוכים בתר ניתוחיים. למרות שבדיווחים המעודדים מיפן על שיעור הישרדות גבוהים יותר בכריתות נרחבות של קשריות-לימפה (בשלושה שדות), מחקרים מבוקרים לא הצליחו להדגים יתרון לגישה זו בהשוואה לכריתות פחות נרחבות. התחלואה והתמותה הסב ניתוחים בכריתות נרחבות בעולם המערבי היא גבוהה ולמעשה מוחקת את יתרון הכריתה הנרחבת.
תוצאות
לפי פארקר, רק ב-53% מהחולים השאת ניתנת לכריתה. אקאקורה מיפן מדווח שלאחר הקרנות ניתן לכרות את השאת ב-88% מהחולים. שיעור התמותה הניתוחית המדווח הוא 20%-10% בסדרות השונות.
בלא טיפול, אורך החיים הממוצע הוא 7.5 חודשים מתחילת התסמינים. לפי פארקר, שיעור ההיוותרות בחיים לשנתיים הוא 27% ול-5 שנים 12%, וזאת עם שימוש בהקרנות לאחר הניתוח. אקאקורה מדווח על שיעור היוותרות בחיים של 25% למשך 5 שנים במתן טיפול משולב: הקרנות־ניתוח־הקרנות. נאקיאמה מדווח על שיעור היוותרות בחיים של 37.5% למשך 5 שנים יחסית ל-19% בקבוצה מנותחת בלא הקרנות.
שיעורי ההיוותרות בחיים ל-5 שנים לפי הדירוג של שאת הוושט מוצגים בטבלה 10.1:
טיפולים בשאתות מאירות מוקדמות של הוושט: Ambulative Methods
שאתות מוקדמות של הוושט הן שאתות המוגבלות למוקוזה בלבד, in situ cancers ו- High to moderate grade of dysplasia -, ניתנות לכריתה מוגבלת. הטכניקות בעזרתן ניתן לכרות מקומית את השאתות הללו הן: (photodynamic therapy (PDT, צריבה על־ידי לייזר או urgon plasma coagulation. התוצאות הראשוניות שדווחו לאחר שימוש בטכניקות אלה היו טובות עם העלמות של השאת ב-80% מהמטופלים, אולם שיעור החזרות המקומיות לטווח ארוך היה גבוה.
- Minimal Invasive Esophgectomy
בשיטה זו, הגישה לכריתת הוושט מאפשרת נזק מיקטי ככל האפשר באמצעות הקטנת מרחב הניתוח. שיטה כזו שפותחה לאחרונה היא כריתה אנדוסקופית של רירית הוושט הנגועה - (Endoscopic Mucosal Resection (EMR. גם בשיטה זו אחוז ההצלחות הראשוניות גבוה, אולם שיעור החזרות לטווח של 12 חודשים הוא כ-40%. לכן מומלץ בשלב זה לבצע EMR רק בחלים עם הוראות נגד לניתוח.
גישה אחרת היא שימוש בגישה הלפרוסקופית או הטורקוסקופית בכריתת הוושט. הניתוח יכול להיות כולו בגישה לפרוסקופית טורקוסקופית ורק הקטע הצווארי מבוצע בגישה הפתוחה, או שילוב של שתי הגישות במידה שונה בשלבי הניתוח השונים, כאשר חלקים שוני של הניתוח מבוצעים באחת משתי הגישות (טבלה 1. 12) (איור 1. 29).
| Transhiatal | ||
| Laparotomy and cervical approach | ||
| Peritumoral or two-field lymph node dissection | ||
| En bloc resection feasible for distal esophageal tumors | ||
| Cervical anastomosis | ||
| Transthoracic | ||
| Ivor Lewis | ||
| Right thoracotomy and laparotomy | ||
| Peritumoral or two-field lymph node dissection | ||
| En bloc resection feasible for mid-/distal thoracic tumors | ||
| McKeown or "three hole" | ||
| Right thoracotomy, laparotomy, cervical approach | ||
| Peritumoral, two-field or three-field lymph node dissection | ||
| En bloc resection feasible for mid-/distal thoracic tumors | ||
| Cervical anastomosis | ||
| Left thoracotomy | ||
| Left thoracotomy with or without cervical approach | ||
| Peritumoral lymph nodes dissection | ||
| Intrathoracic or cervical anastomosis | ||
| Left thoracoabdominal | ||
| Left thoracoabdominal approach | ||
| Peritumoral or two-field lymph node dissection | ||
| Intrathoracic anastomosis |
| Endoscopic mucosal resection |
| Combined thoracoscopic/laparoscopic esophagectomy |
| Laparoscopic transhiatal esophagectomy |
| Thoracoscopically assisted esophagectomy |
| Hand-assisted laparoscopic transhiatal esophagectomy |
ראו גם
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן - מומחה בכירורגיה, מנהל היחידה לבריאות השד מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק