אפידמיולוגיה של גידולים המטולוגיים ממאירים - לוקמיה, לימפומה ומיאלומה - Leukemia, lymphoma and myeloma - epidimiology
| אפידמיולוגיה של גידולים המטולוגיים ממאירים - לוקמיה, לימפומה ומיאלומה | ||
|---|---|---|
| ' | ||

| ||
| יוצר הערך | ד"ר ארזה סטימצקי, פרופסור אורה פלטיאל | |
מבוא
הגידולים ההמטולוגיים הממאירים מהווים נתח משמעותי מעומס התחלואה והתמותה מגידולים ממאירים בישראל[1]. זוהי קבוצה הטרוגנית של מחלות הכוללת: לוקמיה, לימפומה (לימפומה מסוג הודג'קין ולימפומה שאינה הודג'קין) ומיאלומה. המחלות נבדלות בפתופיזיולוגיה, בגורמי הסיכון, בפרוגנוזה ובצורת הטיפול. בסקירה זו נציג בקצרה נתונים על אפידמיולוגיה - היארעות ומגמות, גורמי הסיכון והפרוגנוזה של קבוצות אלו, בדגש על ממצאים ממחקרים עדכניים.
לוקמיה
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה
"לוקמיה" היא שם כולל לשאתות ממאירות ממקור תאי אב במח העצם. שאתות אלו מתאפיינות בריבוי תאים ממאירים במח העצם ובדם הפריפרי מחד גיסא, ובעצירה או פגיעה בהתמיינות וביצירת שורות הדם התקינות מאידך גיסא. ארבע הצורות העיקריות של לוקמיה הן לוקמיה מיאלואידית חריפה, לוקמיה מיאלואידית כרונית, לוקמיה לימפטית חריפה ולוקמיה לימפטית כרונית (המסווגת כלימפומה). כל אחת שונה מבחינת התפוצה, ההסתמנות הקלינית והפרוגנוזה. ההיארעות הכוללת של מקרי הלוקמיה מכל סוגיה בישראל נותרה יציבה פחות או יותר בין השנים 2012-1980[2].
לוקמיה מיאלואידית חריפה - Acute Myeloid Leukemia - AML
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה מיאלואידית
אפידמיולוגיה תיאורית: AML היא מחלה אגרסיבית, השכיחה בילדים מתחת לגיל שנה, עם היארעות (מספר מקרים חדשים לשנה) של 1.8 מקרים ל-100,000[3]. לאחר גיל שנה היארעות AML יורדת משמעותית, ומתחילה לעלות שוב בגיל ההתבגרות - בגיל 25 היארעות AML בארצות הברית היא 1/100,000 מקרים, ולאחר מכן היא עולה אקספוננציאלית עם הגיל עד ל-21/100,000 מקרים בגיל 80 ומעלה. הגיל החציוני באבחנת המחלה הוא 65 שנים. היארעות המחלה בארצות הברית לא השתנתה מאז סוף המאה ה-20[4].
המחלה שכיחה יותר בגברים מאשר בנשים[3]. בישראל השכיחות המתוקננת לגיל של AML היא 2.86/100,000 מקרים בגברים יהודים ו-1.86/100,000 בנשים יהודיות[5]. המחלה שכיחה יותר בארצות הברית ובאירופה בהשוואה לאסיה ואפריקה[3], ובישראל שכיחה יותר בערבים מאשר ביהודים[5].
גורמי סיכון: האטיולוגיה של AML אינה ברורה. גורמי הסיכון הסביבתיים הידועים להתפתחות המחלה כוללים חשיפה לקרינה מייננת, חשיפה לבנזן בתעשייה, עישון (RR, Relative Risk - הסיכון היחסי = 2-1.5) וחשיפה קודמת לתרופות כימיות[3], אך גורמים אלה אחראים על מיעוט המקרים. מצבים גנטיים, כגון תסמונת דאון ואנמיה על שם פנקוני, ומחלות המטולוגיות שונות, כגון אנמיה אפלסטית, תסמונת מיאלודיספלסטית (MDS, Myelodysplastic Syndrome) ומחלות מיאלופרוליפרטיביות (Myeloproliferative Neoplasms), מעלים גם הם את הסיכון לפתח AML. במקרה זה נגדיר את הלוקמיה כלוקמיה שניונית.
פרוגנוזה: מאמצע שנות ה-70 של המאה העשרים ועד שנת 2000 נרשמה עלייה בשיעור ההישרדות הכולל לחמש שנים של חולי AML, מ-6 אחוזים ל-20 אחוזים. עם זאת, עלייה זו נצפתה בעיקר בחולים בני 45 ומטה, בהם שיעור ההישרדות לחמש שנים עומד על 45 אחוזים, לעומת פחות מ-5 אחוזים בבני 65 ומעלה[4].
לוקמיה לימפטית חדה - Acute Lymphocytic Leukemia - ALL
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה לימפובלסטית חדה (חריפה)
אפידמיולוגיה תיאורית: זוהי הלוקמיה (והממאירות ככלל) השכיחה ביותר בקרב ילדים. כ-60 אחוזים ממקרי ALL מופיעים מתחת לגיל 20, ושיא ההיארעות - כ-7/100,000 מקרים - הוא בין הגילים 1–4 שנים[4]. לאחר גיל 5 היארעות המחלה יורדת משמעותית, ועולה שוב מגיל 50 ומעלה. ההיארעות המתוקננת לגיל בישראל שונה בין המינים, כ-0.93/100,000 מקרים בגברים יהודים לעומת 0.38/100,000 בנשים יהודיות[5], והיא נותרה יציבה בעשורים האחרונים.
גורמי סיכון: סיפור משפחתי של ALL ומחלות המטולוגיות ככלל מהווה גורם סיכון למחלה הן בילדים[6] והן במבוגרים[7]. בנוסף, ALL שכיחה יותר באנשים הסובלים מתסמונת דאון. כל אלו מעלים חשד למרכיב גנטי אפשרי במחלה, ואכן, מחקרים גנטיים בילדים העלו מספר אתרים גנטיים פוטנציאליים הקשורים בפתופיזיולוגיה של ALL[6]. גורמי הסיכון הסביבתיים להתפתחות ALL שונים ככל הנראה בילדים ובמבוגרים. בילדים, חשיפה לקרינה מייננת (הן תוך רחמית והן לאחר הלידה) הוכחה כמעלה סיכון להתפתחות המחלה. בנוסף, נראה כי חשיפה לזיהומים, ככל הנראה ויראליים, מעלה גם היא את הסיכון, אם כי לא נמצא גורם מזהם ספציפי שנקשר במחלה[6]. מאידך, קיימת היפותזה כי חשיפה למזהמים בתקופת הינקות מהווה גורם מגן בפני המחלה ("היפותזת ההיגיינה"). הנקה נמצאה אף היא כגורם מגן[8]. במבוגרים נמצא כי עבודה בתעשיית העור או הטקסטיל וצריכת אלכוהול קשורים בסיכון מוגבר להתפתחות ALL[7].
פרוגנוזה: ההישרדות בחולי ALL היא תלוית גיל. פיתוח של פרוטוקולים כימותרפיים מוסדרים העלה את שיעור ההישרדות לחמש שנים מ-10 אחוזים בשנות השישים של המאה ה-20 עד ל-90 אחוזים בילדים עד גיל עשר. שיעור ההישרדות יורד משמעותית עם הגיל, ומעל גיל 60 שיעור ההישרדות לחמש שנים עדיין נמוך מ-10 אחוזים[6].
לוקמיה מיאלואידית כרונית - Chronic Myeloid Leukemia - CML
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה מיאלואידית
מחלה של תאי אב המטופויטיים, המסווגת כמחלה מיאלופרוליפרטיבית. המחלה נגרמת על ידי הטרנסלוקציה (9;22)t - כרומוזום פילדלפיה - הגורמת ליצירת גן מאוחה מהגנים ABL ו-BCR.
אפידמיולוגיה תיאורית: היארעות CML עולה עם הגיל, והגיל החציוני לאבחנת המחלה הוא 53[9]. המחלה שכיחה מעט יותר בגברים מאשר בנשים. בישראל, היארעות המחלה המתוקננת לגיל בשנת 2012 הייתה 0.86/100,000 מקרים בגברים יהודים ו-0.29/100,000 מקרים בנשים יהודיות[5], וההיארעות באוכלוסייה הערבית הייתה גבוהה מעט יותר. היארעות המחלה יציבה בעשורים האחרונים.
גורמי סיכון: גורמי הסיכון המוכחים להתפתחות CML כוללים השמנת יתר, עישון וחשיפה סביבתית לקרינה מייננת ולבנזן[9].
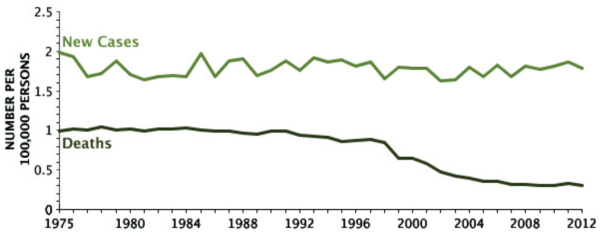
פרוגנוזה: פיתוחן של תרופות מעכבות טירוזין קינאז בשני העשורים האחרונים גרמו לעלייה ניכרת בהשגת הפוגה מלאה במחלה ובהישרדות ל-5 שנים בקרב חולי CML, וההישרדות עלתה מכ-40 אחוזים עד למעלה מ-80 אחוזים (תרשים 1)[10].
לוקמיה לימפטית כרונית - Chronic Lymphocytic Leukemia - CLL
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה לימפוציטית כרונית
שאת ממאירה של לימפוציטים בשלים מסוג B, המסווגת כלימפומה על פי הגדרות ארגון הבריאות העולמי (WHO, World Health Organization), וזהה למעשה למחלה Small Lymphocytic Lymphoma.
אפידמיולוגיה תיאורית: CLL מהווה כ-30 אחוזים מכלל הממאירויות של תאי B בשלים במבוגרים, והיא הלוקמיה השכיחה ביותר בקרב מבוגרים[11]. היארעות CLL היא כ-4/100,000 מקרים, ונותרה יציבה בעשורים האחרונים. ההיארעות עולה עם הגיל, והגיל החציוני לאבחנת המחלה הוא 73[12]. המחלה שכיחה יותר בגברים לעומת נשים (RR = 1.9-1.7) ובלבנים לעומת שחורים, והיא נדירה בקרב אנשים ממוצא אסיאתי[11].
גורמי סיכון: גורם הסיכון המוצק והעקבי ביותר ל-CLL הוא היסטוריה משפחתית של ממאירות המטולוגית כלשהי. גורמי סיכון נוספים כוללים זיהום בהפטיטיס C ועבודה בחווה או במספרה[12].
פרוגנוזה: CLL היא מחלה כרונית המאופיינת בתקופות ארוכות של יציבות, אם כי חלק מן החולים יציגו התנהגות אגרסיבית יותר והתקדמות מהירה של המחלה, במיוחד בנוכחות מוטציה או חסר של הגן ל-p53. בנוסף, לעיתים רחוקות - סיכון מצטבר של כ-5 אחוזים לחמש שנים וכ-10 אחוזים לעשר שנים - המחלה עשויה לעבור טרנספורמציה ללימפומה אגרסיבית (טרנספורמציה על שם ריכטר)[13].
שיפור הטיפול התרופתי, ובייחוד פיתוח הנוגדן נגד CD20, שנקרא Rituximab (Mabthera) העלו את התגובה לטיפול ואת שיעורי ההישרדות לחמש שנים מכ-70 אחוזים בשנות ה-70 של המאה ה-20 ל-85 אחוזים[4]. תרופות שפותחו שיפרו את ההישרדות ללא הישנות ואת ההישרדות הכללית במחלה, אפילו בשלבים המתקדמים ובקרב בעלי מוטציות ב-p53.
לימפומה מסוג הודג'קין
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לימפומה#לימפומה על שם הודג'קין
לימפומה מסוג הודג'קין (Hodgkin Lymphoma - HL) היא שאת ממאירה בעלת מאפיינים קליניים ייחודיים, שתוארה לראשונה על ידי סר תומאס הודג'קין ב-1832. מקורם של תאי הגידול הוא בלימפוציטים מסוג B, אך התאים הממאירים מהווים רק כאחוז אחד מסך מסת הגידול, ושאר המסה מורכב מתסנין דלקתי תגובתי הכולל לימפוציטים פוליקלונליים מסוגי B ו-T, אאוזינופילים, תאי פלסמה ונויטרופילים.
אפידמיולוגיה תיאורית: HL היא סוג הסרטן השמיני בשכיחותו בארצות הברית בקרב ילדים ומתבגרים, ובין חמשת סוגי הסרטן השכיחים ביותר במבוגרים צעירים. בישראל ההיארעות המתוקננת לגיל של המחלה עומדת על כ-3/100,000 מקרים. היא עלתה בין השנים 1980–2000 ברוב קבוצות האוכלוסייה, מכ-2 ל-3 מקרים ל-100,000, ומאז התייצבה.
שלוש קבוצות גיל נמצאות בסיכון גבוה יותר להתפתחות HL (שלושה "שיאים" למחלה): ילדים מתחת לגיל 10, מבוגרים צעירים בגילים 15–35, וגיל 50 ומעלה[14]. המחלה שכיחה יותר בנשים לעומת גברים (RR = 1.2-1.1) וביהודים לעומת ערבים (RR=1.3)[14].
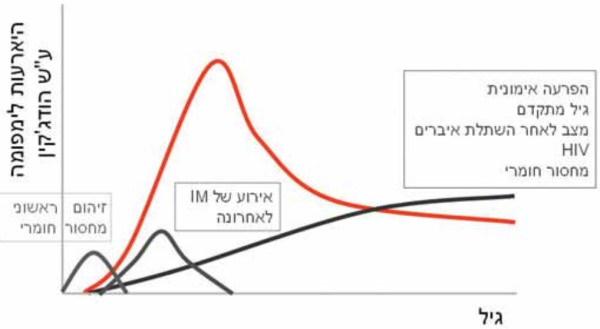
גורמי סיכון: האטיולוגיה של HL כוללת מרכיבים תורשתיים וסביבתיים. היארעות גבוהה יותר של המחלה בקרב קרובי משפחה של חולים העלתה את החשד כי למחלה מרכיב גנטי, ומחקרים גנטיים אכן מצאו מספר אתרים גנטיים הקשורים בסיכון מוגבר למחלה[15]. במקביל, גורמי הסיכון ל-HL כוללים מצב סוציו-אקונומי גבוה, מספר אחאים קטן במשפחה[16], ורקע של אסתמה ומחלות אטופיות[17]. אופי גורמי הסיכון הללו היווה בסיס להיפותזה, כי היעדר חשיפה לגורמי זיהום בילדות המוקדמת מעלה את הסיכון לחלות במחלה, בדומה ל-ALL בילדים. כ-50-40 אחוזים ממקרי HL קשורים בנגיף אפשטיין-בר (EBV, Epstein-Barr Virus), הנמצא בתאי הגידול בדגימות הפתולוגיות. אירוע של מחלת הנשיקה (Infectious mononucleosis) מעלה את הסיכון לחלות ב-HL ב-4–5 השנים שלאחר המחלה[16]. גידולים חיוביים ל-EBV שכיחים יותר במדינות מתפתחות, באוכלוסייה ממעמד סוציו-אקונומי נמוך ובקבוצת הגיל המבוגר. ככל שהמדינה מפותחת יותר והמעמד הסוציו-אקונומי עולה, קטנה שכיחות הגידולים החיוביים ל-EBV, ובמקביל עולה שכיחות המחלה בקבוצת הגיל של מבוגרים צעירים (תרשים 2)[16]. גם נתונים אלו תומכים בתאוריית היעדר החשיפה למזהמים בילדות כגורם להתפתחות HL במבוגרים צעירים.
פרוגנוזה: המחלה מגיבה היטב לטיפול, ושיעורי הריפוי עומדים על כ-85 אחוזים בכל קבוצות הגיל. נתונים השוואתיים מגרמניה ומארצות הברית מצביעים על שיעור הישרדות לחמש שנים של מעל 90 אחוזים בקבוצת המבוגרים הצעירים בשתי המדינות, לעומת שיעור הישרדות של 50–60 אחוזים בלבד בקבוצת הגיל של בני 60 ומעלה[18].
לימפומה שאינה הודג'קין
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לימפומה#לימפומה שאינה הודג'קין
לימפומה שאינה הודג'קין (Non-Hodgkin Lymphoma - NHL) מהווה שם כולל לשאתות ממאירות שמקורן בלימפוציטים - כ-90 אחוזים מקורן בלימפוציטים מסוג B, וכ-10 אחוזים בלימפוציטים מסוג T. מבחינה היסטולוגית, המחלה מסווגת לפי החלוקה המקובלת על ארגון הבריאות העולמי, הכוללת 36 תתי-סוגים נכון לשנת 2009.
אפידמיולוגיה תיאורית: הסיכון ל-NHL עולה עם הגיל, והמחלה שכיחה יותר בגברים מאשר בנשים. היארעות המחלה בישראל היא 15.7/100,000 מקרים בגברים יהודים ו-11.8/100,000 מקרים בנשים יהודיות. היארעות המחלה באוכלוסייה הערבית נמוכה מעט יותר - כ-10/100,000 מקרים. זוהי הממאירות החמישית בשכיחותה בקרב גברים והשישית בקרב נשים בישראל[19].
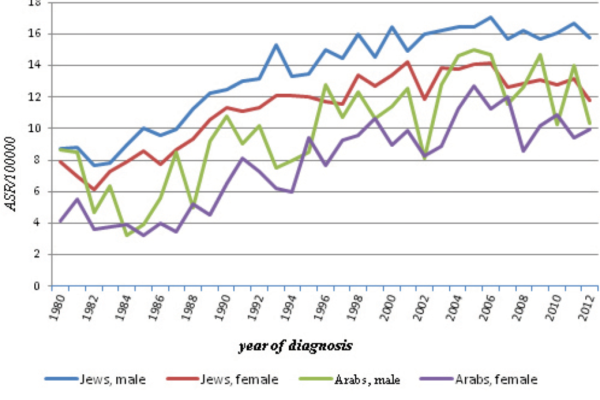
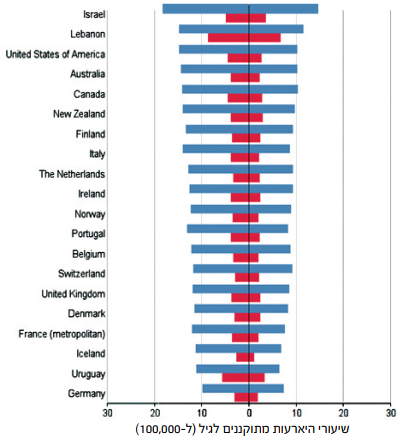
היארעות NHL עלתה משמעותית בכל רחבי העולם המערבי מאז שנות ה-70 של המאה העשרים. בישראל היא הוכפלה בין השנים 1980 ל-2002, ומאז נותרה יציבה (תרשים 3)[20]. העלייה הניכרת בהיארעות NHL מוסברת בחלקה על ידי התקדמות יכולת האבחון של לימפומות ושינויים באופן הסיווג שלהן. חלק אחר מוסבר על ידי עלייה בשכיחות חולי HIV (Human Immunodeficiency Virus), וקיימת סברה כי חלק נוסף מהעלייה נובע מחשיפה מוגברת למזהמים סביבתיים, כגון חומרי הדברה. על פי השוואות בינלאומיות ההיארעות בישראל גבוהה יחסית לעולם, ונתונים מציבים את ישראל במקום הראשון בעולם בהיארעות NHL (תרשים 4)[19]. הסיבה להיארעות הגבוהה במיוחד בישראל אינה ברורה.
גורמי סיכון: גורם סיכון מרכזי ועקבי להתפתחות NHL הוא הפרעה כלשהי בתפקוד מערכת החיסון או בבקרה עליה. הפרעות אלו כוללות מחלות אוטואימוניות, מחלות של כשל חיסוני (מולד או נרכש), ושימוש בתרופות גורם סיכון מרכזי נוסף הוא חשיפה לזיהומים. הידבקות בנגיפים וחיידקים שונים, כגון HIV, EBV, HCV (Hepatitis C Virus) והליקובקטר פילורי, נמצאה כמעלה סיכון להתפתחות NHL. גורמי סיכון סביבתיים אחרים שהוכחו כקשורים בהתפתחות NHL כוללים: חשיפה לממסים תעשייתיים, כגון בנזן וטריכלורואתילן; קוטלי חרקים ועשבים; צבעי שיער; והשמנת יתר[21].
גורם סיכון ברור אחר הוא סיפור משפחתי של מחלות המטולוגיות בכלל ולימפומות בפרט[22], ממצא המכוון למקור גנטי למחלה. מחקרים גנטיים ואפידמיולוגיים רבים בוצעו בניסיון להבין טוב יותר את הקשר בין גורמי הסיכון הגנטיים והסביבתיים. חלק מן המחקרים מצביעים על מערך גנטי המגביר רגישות לחשיפה לגורמי סיכון סביבתיים מסוימים[21]. השערה נוספת היא כי פגמים גנטיים מולדים קלים במערכת החיסון מהווים גורם סיכון. ממצאים מהקוהורט הירושלמי מראים עלייה של פי שלושה בסיכון לפתח NHL במבוגרים צעירים שאושפזו בינקותם עקב זיהום, בהשוואה לכאלו שלא אושפזו[23].
חלק מגורמי הסיכון ל-NHL הוכחו כקשורים בהתפתחות תתי-סוגים ספציפיים של לימפומה, ממצא המעיד על ההטרוגניות של NHL הן מבחינת האטיולוגיה והן מבחינה ביולוגית[22].
פרוגנוזה: שיעורי ההישרדות לחמש שנים מכלל חולי NHL עומדים על 66.7 אחוזים בגברים יהודים ו-68.9 אחוזים בנשים יהודיות. בקרב הערבים השיעור גבוה מעט יותר ועומד על כ-71 אחוזים בנשים ובגברים כאחד. שיעורים אלו נכונים לשנים 2006-2001, ומשקפים עלייה של 10–15 אחוזים בשיעור ההישרדות בהשוואה לעשור קודם לכן[19]. עלייה זו נובעת הן מפיתוח וכניסה לשוק של תרופות חדשות לטיפול בלימפומה, והן משיפור הטיפול התומך בחולים.
מיאלומה נפוצה
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מיאלומה נפוצה
אפידמיולוגיה תיאורית: מיאלומה נפוצה (Multiple Myeloma) היא שאת ממאירה ממקור תאי פלסמה. היא מהווה כ-10 אחוזים מהגידולים ההמטולוגיים הממאירים בארצות הברית - הגידול ההמטולוגי השני בשכיחותו, והשכיח ביותר בחולים מעל גיל 65.
היארעות המחלה המתוקננת לגיל בישראל היא כ-4/100,000 מקרים[5]. על פי נתונים מארצות הברית, היארעות מיאלומה עלתה מתחילת שנות ה-70 ועד לשנות ה-90 של המאה העשרים, ומאז התייצבה. בפילוח על פי קבוצות גיל נראה כי בקרב קבוצת הגיל של בני 70 ומטה ממשיכה העלייה בהיארעות המחלה, ולעומת זאת היא יורדת בקרב בני 70 ומעלה[24]. המחלה שכיחה בגברים יותר מאשר בנשים (RR=1.3), ובישראל שכיחה מעט יותר ביהודים מאשר בערבים[5] ומעט יותר בקרב צעירים יהודים שהוריהם ילידי אירופה מאשר בקרב אלו שהוריהם ילידי המזרח התיכון[25]. בארצות הברית מיאלומה שכיחה יותר בשחורים לעומת לבנים.
גורמי סיכון: כמעט כל מקרי המיאלומה מתפתחים על רקע של MGUS (Monoclonal Gammopathy of Undetermined Significance), מצב שכיח הנצפה בכ-5 אחוזים מהאוכלוסייה לאחר גיל 70. גורמי סיכון סביבתיים ידועים להתפתחות מיאלומה כוללים חשיפה לקוטלי חרקים (RR=1.47), עבודה בחווה (RR=1.87), עבודה ככבאי או במספרה, והשמנת יתר (RR=1.2)[26]. בנוסף, הסיכון למחלה עולה בנוכחות סיפור משפחתי של מיאלומה, וכאמור בקבוצות אתניות ספציפיות. ממצאים אלו מכוונים לגורם גנטי בהתפתחות המחלה, ואכן מחקריםגילו מספר אתרים גנטיים פוטנציאליים הקשורים בסיכון לפתח מיאלומה[26].
פרוגנוזה: במשך שנים עמד חציון ההישרדות מאבחון המיאלומה על 34 חודשים. מאז מפנה המאה ה-21 חל שיפור משמעותי, בעיקר בקרב קבוצת הגיל הצעירה יותר - חציון ההישרדות בקרב חולים בני 50 ומטה עומד על 5.2 שנים, ועל 7 שנים בחולים צעירים שעברו טיפול אינטנסיבי ולאחריו השתלת מח עצם[27] (תרשים 5). שיפור זה משויך לכניסתן לשוק של תרופות חדשות ולשיפור מערך הטיפול במחלה. עם זאת, כ-10 אחוזים מחולי המיאלומה מתים בתוך חודשיים מגילוי המחלה, בדרך כלל מזיהומים או מאי-ספיקת כליות.
סיכום
השאתות ההמטולוגיות הממאירות מהוות קבוצה הטרוגנית של מחלות, השונות זו מזו מבחינה אפידמיולוגית ומבחינת גורמי הסיכון. מחקרים אינטנסיביים מאפשרים לנו לצייר תמונה מפורטת יותר של גורמי הסיכון לפיתוח ממאירויות אלו, בדגש על יחסי הגומלין בין המרכיב הגנטי והסביבתי, ומצביעים על תפקידה המרכזי של מערכת החיסון בפתוגנזה של המחלות. עם זאת, דרוש עוד מחקר רב להבנת האטיולוגיות וגורמי הסיכון, ובעיקר לחיפוש גורמי סיכון הניתנים לשינוי (Modifiable), במטרה להפחית את היארעות המחלות הללו במקביל להתקדמות שחלה בטיפול בהן.
ביבליוגרפיה
- ↑ הרישום הלאומי לסרטן - אומדן הסיכון לתחלואה במחלה ממארת לאורך החיים באוכלוסייה הישראלית מתוך: http://www.health.gov.il/PublicationsFiles/probability_ Feb_2011.pdf
- ↑ הרישום הלאומי לסרטן - לוקמיה מתוך: http://www.health.gov.il/UnitsOffice/HD/ICDC/ICR/ CancerIncidence/Pages/Leukemia.aspx
- ↑ 3.0 3.1 3.2 3.3 Deschler B, Lubbert M. Acute myeloid leukemia: epidemiology and etiology. Cancer. 2006 Nov 1;107(9):2099-107
- ↑ 4.0 4.1 4.2 4.3 SEER cancer statistics review 1975-2002, Table XIII-1 - Leukemia (invasive). http://seer.cancer.gov/archive/ csr/1975_2002/results_merged/sect_13_leukemia.pdf
- ↑ 5.0 5.1 5.2 5.3 5.4 5.5 Silverman B. Israel National Cancer Registry, personal communication
- ↑ 6.0 6.1 6.2 6.3 Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia. Lancet. 2013 June 1; 381(9881)
- ↑ 7.0 7.1 Skibola CF, Slager SL, Berndt SI, et al. Medical history, lifestyle, family history, and occupational risk factors for adult acute lymphocytic leukemia: the InterLymph non-Hodgkin lymphoma subtypes project. J Natl Cancer Inst Monogr, 2014 Aug;2014(48):125-9
- ↑ Amitay EL, Keinan-Boker L. Breastfeeding and childhood leukemia incidence: a meta-analysis and systematic review. JAMA Pediatr. 2015 Jun; 169(6)
- ↑ 9.0 9.1 Kabat GC, Wu JW, Moore SC, et al. Lifestyle and dietary factors in relation to risk of chronic myeloid leukemia in the NIH-AARP diet and health study. Cancer Epidemiol Biomarkers Prev. 2013 May;22(5):848-54.
- ↑ Pavlik T, Janousova E, Mayer J, et al. Current survival measures reliably reflect modern sequential treatment in CML: correlation with prognostic stratifications. Am J Hematol. 2013, 88:790-797
- ↑ 11.0 11.1 Linet MS, Schubauer-Berigan MK, Weisenburger DD, et al. Chronic lymphocytic leukaemia: an overview of aetiology in light of recent developments in classification and pathogenesis. Br J Haematol. 2007 Dec. 139(5): 672-686
- ↑ 12.0 12.1 Slager SL, Benavente Y, Blair A, et al. Medical history, lifestyle, family history, and occupational risk factors for chronic lymphocytic leukemia/small lymphocytic lymphoma: the InterLymph non-Hodgkin lymphoma subtypes project. J Natl Cancer Inst Monogr. 2014 Aug;2014(48):41-51
- ↑ Jain P, O'Brien S. Richter's transformation in chronic lymphocytic leukemia. Oncology (Williston Park). 2012 Dec;26(12):1146-52
- ↑ 14.0 14.1 1. הרישום הלאומי לסרטן - לימפומה מסוג הודג'קין מתוך:. http://www.health.gov.il/UnitsOffice/HD/ICDC/ICR/ CancerIncidence/Pages/Hodgkin-Lymphoma.aspx
- ↑ Kushekhar K, van den Berg A, Nolte I, et al. Genetic associations in classical hodgkin lymphoma: a systematic review and insights into susceptibility mechanisms. Cancer Epidemiol Biomarkers Prev. 2014 Dec;23(12): 2737-47
- ↑ 16.0 16.1 16.2 Hjalgrim H .On the aetiology of Hodgkin lymphoma. Dan Med J. 2012 Jul;59(7):B4485
- ↑ Martinez-Maza O, Cozen W, Penichet ML, et al. Epidemiological evidence: IgE, allergies, and hematopoietic malignancies. In: Penichet MLaJ-J, E, editor. Cancer and IgE Introducing the concept of allergooncology. Springer Science; 2010
- ↑ Pulte D, Jansen L, Gondos A., et al. Improved population level survival in younger Hodgkin lymphoma patients in Germany in the early 21st century. Br J Haematol. 2014, 164: 851-857
- ↑ 19.0 19.1 19.2 משרד הבריאות - לימפומה שאינה הודג'קין בישראל - 1990-2012 מתוך: http://www.health.gov.il/PublicationsFiles/NHL2015.pdf
- ↑ הרישום הלאומי לסרטן - לימפומה שאינה הודג'קין מתוך: http://www.health.gov.il/UNITSOFFICE/HD/ICDC/ICR/ CANCERINCIDENCE/Pages/Non_Hodgkin_Lymphoma.aspx
- ↑ 21.0 21.1 Bassig BA, Lan Q, Rothman N, et al. Current understanding of lifestyle and environmental factors and risk of non-Hodgkin lymphoma: an epidemiological update. J Cancer Epidemiol. 2012; 2012: 978930
- ↑ 22.0 22.1 Morton LM, Slager SL, Cerhan JR, et al. Etiologic heterogeneity among non-Hodgkin lymphoma subtypes: the InterLymph non Hodgkin lymphoma subtypes project. J Natl Cancer Inst Monogr. 2014 Aug;2014(48):130-44
- ↑ Paltiel O, Laniado DE, Yanetz R, et al. The risk of cancer following hospitalization for infection in infancy: a population-based cohort study. Cancer Epidemiol Biomarkers Prev. 2006 Oct;15(10): 1964-8
- ↑ Libby E, Garcia D, Quintana D, et al. Disease-specific survival for patients with multiple myeloma: significant improvements over time in all age groups. Leuk Lymphoma. 2014,55(12): 2850-7
- ↑ Leiba M, Afek A, Derazne E, et al. Israeli-born offspring of Jewish immigrants of Middle Eastern origin have a lower incidence of multiple myeloma than those of european origin: a cohort study of 746,200 Israeli men followed from late adolescence. Leuk Lymphoma. October 2014; 55(10): 2290-5
- ↑ 26.0 26.1 Sergentanis TN, Zagouri F, Tsilimidos G, et al. Risk factors for multiple myeloma: a systematic review of meta-analyses. Clin Lymphoma Myeloma Leuk. 2015;15(10):563-77
- ↑ Kristinsson SY, Landgren O, Dickman PW, et al. Patterns of survival in multiple myeloma: a population-based study of patients diagnosed in Sweden from 1973 to 2003. J Clin Oncol. 2007;25(15):1993-9
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר ארזה סטימצקי, המכון ההמטולוגי, בי"ח הדסה עין כרם ופרופסור אורה פלטיאל המכון ההמטולוגי, בי"ח הדסה עין כרם ובית הספר לבריאות הציבור של האוניברסיטה העברית והדסה
תודות לד"ר ברברה סילברמן, מנהלת הרישום הלאומי לסרטן במשרד הבריאות הישראלי, על הפקת נתונים במיוחד לסקירה זו.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק