בירור אונקוגנטי - נייר עמדה
|
| |
|---|---|
| בירור אונקוגנטי | |
| תחום | אונקולוגיה |
| |
| האיגוד המפרסם | איגוד הגנטיקאים הרפואים בישראל |
| קישור | באתר doctorsonly |
| תאריך פרסום | ספטמבר 2023 |
| יוצר הערך | ד"ר רינת ברנשטיין מולכו, ד"ר רויטל ברוכים, פרופ' יעל גולדברג, ד"ר מורן גל, פרופ' אפרת לוי להד, ד"ר שרי ליברמן, פרופ' איתן פרידמן, גב' ענבל קדר, ד"ר שירי שקדי-רפיד. |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – איתור ומניעת מחלות ממאירות
הקדמה
מטרת נייר עמדה זה היא לשקף את ההיבטים השונים של האונקוגנטיקה: הייעוץ האונקוגנטי - את מי מומלץ להפנות לייעוץ, ההתוויות לבירור גנטי, הליך הבירור האונקוגנטי והבדיקות המומלצות.
מטרת האונקוגנטיקה היא לברר אם קיים בסיס תורשתי לממאירות. זיהוי בסיס תורשתי כזה מאפשר התווית טיפול מיטבי למי שחלה בסרטן, ומאפשר לזהות אנשים המצויים בסיכון גבוה יותר באופן משמעותי מהסיכון של פרטים באוכלוסייה הכללית לחלות בסרטן. איתור אנשים המצויים בסיכון יתר לאור קיום שינוי גנטי אצלם או על סמך גורמי סיכון אחרים כגון סיפור משפחתי או ממצאים קליניים (כגון פוליפים או ממצאים אחרים טרום סרטניים) מאפשר הפחתת תחלואה ותמותה מסרטן על ידי גילוי מוקדם, או אמצעים מניעתיים או מקטיני סיכון.
נייר העמדה נועד לאפשר יישום מטרות אלו, מתוך התחשבות גם בהיבטים ייחודיים למדינת ישראל, שבכללם היבטים כלכליים, זמינות משאבי המעבדה ושירותי הייעוץ הגנטי וסוגיות של בריאות הציבור. נייר העמדה מתבסס על המלצות הנהוגות בעולם, עם התאמה למציאות המקומית ונכתב כשיתוף פעולה של רבים מהעוסקים באונקוגנטיקה בישראל.
מאחר שמדובר בתחום שכל היבטיו מתפתחים במהירות, מומלץ לבדוק את התאמתו שנתיים ממועד פרסומו.
נייר העמדה דן בסוגיות הבאות:
- ייעוץ אונקוגנטי:
- את מי מומלץ להפנות לייעוץ
- הליך הייעוץ
- הבדיקות האונקוגנטיות:
- התוויות
- הבירור המומלץ
- הליך הבירור
- תוצאות הבירור:
- דו"ח (דין וחשבון) התשובה
- ההמלצות להמשך בירור, מעקב ומניעה
נספחים:
- טופס הפנייה לבירור גנטי על ידי מומחה בתחומו
- דף הסבר אודות הבדיקה האונקוגנטית
- סיכום ההתייחסות לווריאנטים עם חדירות נמוכה
- סיכום המלצות מעקב לנשאיות ונשאים עם מוטציה ב-BRCA 1/2
- דף הסבר לתוצאה שלילית (תקינה) בבדיקת סקר BRCA
- טבלת סיכום משמעות 17 גנים המעלים סיכון לסרטן שד, שחלה ולבלב
- אלגוריתם הבירור הגנטי - תרשים זרימה
סיכום והמלצות
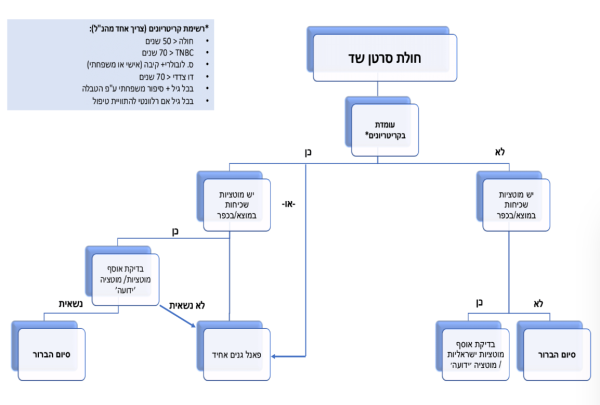
- הפנייה לייעוץ אונקוגנטי - מומלץ להפנות חולי סרטן, או מטופלים בריאים עם סיפור משפחתי/ממצאים מחשידים בבדיקה קלינית, העומדים בקריטריונים המפורטים להלן, ובתנאי שלבירור הגנטי משמעות מעשית - יישומית קלינית (actionable) לגבי בחירת הטיפול ו/או מעקב, ו/או הליכים להפחתת סיכון
- הליך הייעוץ האונקוגנטי כולל:
- ייעוץ אונקוגנטי מקדים (טרום בדיקה) - נדרש ייעוץ אונקוגנטי מקדים (בהתאם לחלופות המקובלות) (למעט בבדיקת הסקר). בעת ההפנייה לבדיקה באחריות הגנטיקאי/מסירת התשובה וייעוץ לאחר התשובה:
- על הגורם המפנה (רופא/ה מומחה בתחומו/גנטיקאי/ת/יועצ/ת גנטי/ת) למסור את התשובה
- מומלץ ייעוץ אונקוגנטי (post test) על ידי גנטיקאי/ת/ יועץ/ת גנטי/ת במקרים בהם בבדיקה דווח על ממצא בבדיקה (VOUS/פתוגני/סביר שפתוגני) ו/או במקרים שבהם הבדיקה תקינה אך עדיין קיים חשד גבוה לקיום המצב התורשתי
- הגורם המייעץ:
- באופן שגרתי הייעוץ האונקוגנטי יינתן על ידי גנטיקאי/ת /יועץ/ת גנטי/ת
- אצל חולי סרטן/מטופלים פעילים (בשלבי אבחון/טיפול אונקולוגי) הייעוץ המקדים יכול להינתן גם על ידי רופא מומחה בתחומו (כירורג, אונקולוג, גינקואונקולוג, גסטרואנטרולוג) ובתנאי שבאחריותו:
- למלא את טופס ההפנייה המצורף
- למסור את התשובה למטופל
- להבטיח מתן ייעוץ גנטי משלים על ידי גנטיקאי/ יועץ/ת גנטי/ת בזמן סביר במקרים בהם נדרש (כמפורט לעיל). בכדי לאפשר רצף טיפולי המאפשר גם למומחה בתחומו להפנות לבירור גנטי ולהבטיח מתן ייעוץ גנטי למטופל לאחר קבלת התשובה, אנו קוראים ליצירת מנגנונים מוסדרים דרך קופות החולים/בתי החולים, שיקלו על רצף טיפולי ולוח זמנים סביר
- ייעוץ אונקוגנטי מקדים (טרום בדיקה) - נדרש ייעוץ אונקוגנטי מקדים (בהתאם לחלופות המקובלות) (למעט בבדיקת הסקר). בעת ההפנייה לבדיקה באחריות הגנטיקאי/מסירת התשובה וייעוץ לאחר התשובה:
- המלצה לבירור גנטי - יומלץ על בירור גנטי לחולי סרטן או פוליפוזיס העונים על קריטריונים כמפורט, לבריאים שהסיכוי לנשאות אצלם נאמד ב-10 אחוזים ומעלה, או שבמשפחתם מוטציה המוגדרת actionable. הברור הגנטי נערך לרוב בדגימת דם לזיהוי שינוי גנטי מורש (גרמינלי) וכולל בדיקת מוטציות מוגדרות, ובדיקת פאנל גרמינלי נרחב. כמו כן, נערכות בדיקות גידול בחשד ללינץ'
- בירור גנטי גרמינלי:
- בדיקת מוטציות ייחודיות - תיבדקנה רק מוטציות המוגדרות כ־actionable - כלומר מחייבות מעקב ייחודי/רלוונטי להחלטה טיפולית
- מוטציה משפחתית תיבדק אם יש סיכון של לפחות 2.5 אחוזים לנשאות (דין 'סקר אשכנזי')
- מוטציות שאותרו בגידול תיבדקנה אם הן מוטציות מייסד, או לפי אחת ההנחיות כמפורט בהמשך. לציין כי בדיקת ריצוף ברקמה גידולית אינה מחליפה/מייתרת בדיקה גרמינלית
- בדיקת מוטציות נפוצות - בדיקה זו נועדה לאפשר בירור ממוקד, זול ויעיל, ובתנאי שתייעל את הליך הבירור - כלומר, אם חיובית, תאפשר עצירת הבירור. לכן הבדיקה אמורה להיות זולה ואמינה ולכלול רק ווריאנטים ש:
- חדירותם גבוהה
- שכיחותם באוכלוסייה הנבדקת גבוהה
- קיומם אצל הנבדק/ת יאפשר המלצות קליניות ברות יישום, שיש להן משמעות מבחינת הפחתת תחלואה ותמותה מסרטן. המלצה - לצמצם את רשימת המוטציות בהתאם לנזכר למעלה ולאפשר גמישות במקרים ייחודיים
- פאנל אונקוגנטי גרמינלי רחב - מומלץ לכלול בפאנל זה רק גנים המוגדרים כבעלי חדירות בינונית/גבוהה (high/medium penetrance genes), להשתמש בטכנולוגיה המאפשרת גם זיהוי חסרים ותוספות. אין להגביל את מספר הגנים הנכללים בפאנל, ובלבד שיכללו כל הגנים הידועים כמעלים סיכון לגידול/ים שהם סיבת ההפנייה
- שינויים לדיווח: יש לדווח על ממצאים המסווגים כפתוגנים/חשודים לפתוגנים על פי הקריטריונים של ה-ACMG (American College of Medical Genetics and Genomics). אם המעבדה בוחרת לדווח גם על שינויים שמשמעותם לא ברורה (VOUS), עליה לכלול הסבר ופירוט מנומק לקביעת הסיווג
- הליך הבדיקה - במקרים בהם נדרש ברור דו-שלבי (מוטציות נפוצות תחילה ולאחר מכן בדיקת פאנל), ההנחיה והייעוץ יינתנו מראש והמעבר בין שלב לשלב יבוצע באופן רציף במעבדה, ניתן ליידע את המטופלים על התוצאה של השלב הראשון, אך אין חובה בייעוץ גנטי נוסף. מומלץ להשלים בדיקת פאנל/מוטציות נפוצות בפרק זמן סביר (תוך חודש לבדיקה אחת, עד חודשיים אם מבצעים שתי בדיקות ברצף)
- בדיקת מוטציות ייחודיות - תיבדקנה רק מוטציות המוגדרות כ־actionable - כלומר מחייבות מעקב ייחודי/רלוונטי להחלטה טיפולית
- בדיקת גידול בשאלה של תסמונת לינץ' - (MSI ו/או IHC לחלבוני ה-MMR): יש להקפיד על יישום חוזר מנכ"ל (13.2020) בו מומלץ ביצוע Universal Screening בגידולי מעי ורחם בחולים>70 שנים
- המלצות נוספות:
- להוריד מגבלת גיל לביצוע הבדיקה
- לאפשר בדיקה מביופסיה אם נחוץ עבור החלטה טיפולית (כגון בגידולי רקטום)
- להרחיב את הבירור גם לגידולים נוספים הקשורים לתסמונת לינץ' כמומלץ בהנחיות NCCN המעודכנות
- השלמת הבדיקה: במקרים של היעדר ביטוי MLH1 בגידול מומלץ לבצע המשך בירור על ידי בדיקת BRAF בגידולי מעי ומתילציה בגידול מכל סוג, בכפוף להכנסת הבדיקה לסל הבריאות
- המלצות נוספות:
- בדיקה גרמינלית בעקבות ממצא סומטי: מומלצת בדיקה גנטית גרמינלית לשינויים גנטיים שזוהו בדגימת גידול כאשר יש חשד משמעותי שהם מורשים, כמפורט בהמשך
- בירור גנטי גרמינלי:
- מעקב אחר נשאים/יות של תסמונת סרטן:
- מומלץ להפנות נשאים/יות למרפאות ייחודיות/צוות רב-תחומי שילווה אותן לאורך חייהן
- מומלצת מעורבות גנטיקאי בצמתי קבלת החלטות וקביעת מדיניות של מרפאות המעקב
- מומלץ להפנות נשאים/יות בגיל יילודה לייעוץ טרום לידתי
- מומלץ להפנות את בן/ת הזוג של הנשא/ית לייעוץ גנטי במקרים בהם ידועה מחלה רצסיבית הנגרמת ממוטציות בי אלליות בגן המוטנט
יש צורך בהקצאת משאבים ייעודיים לצורך הטיפול בנשאיות, זאת כדי לענות על הדרישה שלא זוכה למענה מיטבי בישראל.
- בדיקת סקר גנטי לאיתור נשאיות ל-BRCA1/2 בקרב נשים אשכנזיות:
- מומלץ ביצוע בדיקת הסקר בנשים בריאות ממוצא אשכנזי (מלא או חלקי) מגיל 25, ללא נשאות ידועה במשפחה. נשים עם סיפור משפחתי המתאים למפורט במסמך (טבלה 2) תופנינה לייעוץ גנטי בעת ביצוע בדיקת הסקר
- על הליך הבדיקה לכלול הסברים על הבדיקה, מגבלותיה ומשמעויותיה
- תוצאות שליליות (ללא נשאות) תועברנה לנבדקת עם המלצות להמשך מעקב הנהוג בהנחיית רופא/ה מטפל
- נשאיות תזומנה לייעוץ גנטי תוך שבועיים מקבלת ההודעה על הנשאות
- מומלץ המשך ביצוע מעקב בנשאיות במרפאות ייעודיות
- לשקול התאמת אוכלוסיות נוספות לביצוע בדיקת מוטציות ב BRCA1/2 במסגרת סקר אוכלוסייה
הפנייה לייעוץ גנטי
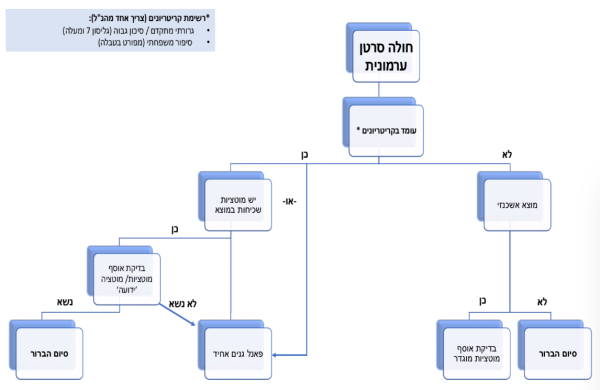
מומלץ להפנות לייעוץ גנטי על ידי רופא/ה גנטיקאי/ת או יועצ/ת גנטי/ת על פי הקריטריונים הבאים:
- בחולים בסרטן: חולים העונים על אחד הקריטריונים הבאים, ובתנאי שהאבחון מיועד להשפיע על החלטה טיפולית או שינוי בהמלצות למעקב לגילוי מוקדם או טיפול מקטין סיכון, להם או לבני משפחתם:
- אחד מהקריטריונים המפורטים בטבלה 1
- חשודים כנשאים של תסמונת רב-מערכתית הקשורה גם בסיכון מוגבר לסרטן (כגון NF1 - Neurofibromatosis type 1 ,MEN - Multiple endocrine neoplasia)
- הערכת הסיכון לנשאות בגנים העיקריים הקשורים לסרטן מורש נאמדת לפחות ב-10 אחוזים על-פי ספרות עדכנית, או על פי תוכנות ניבוי מוסכמות
- מצב שלדעתו המנומקת של הרופא המפנה ועל פי שיקולו הקליני, מחייב בירור אונקוגנטי
- פרטים בריאים* אם מאפיינים בהיסטוריה האישית ו/או המשפחתית שלהם המעלים חשד קליני לקיום רקע מורש לסרטן העונים על אחד הקריטריונים הבאים, ובתנאי שהאבחון מיועד להשפיע על החלטה טיפולית או שינוי בהמלצות למעקב לגילוי מוקדם או טיפול מקטין סיכון:
- אחד מהקריטריונים המפורטים בטבלה 2
- חשודים כנשאים של תסמונת רב-מערכתית הכרוכה גם בסיכון לסרטן
- במשפחתם אותרה מוטציה המעלה סיכון באופן משמעותי לסרטן, ומוגדרת actionable
- קרוב משפחה דרגה 1 שהוא חולה ועונה על הקריטריונים המדווחים בטבלה 1
- מצב שלדעתו המנומקת של הרופא המפנה ועל פי שיקולו הקליני מחייב בירור גנטי
שימוש בתוכנות הניבוי - מומלץ להשתמש במודלים כגון CRA express או BRCAPro, Tyrer-Cuzick, CanRisk
(Hughes riskapp) בהקשר לסרטן השד, או תוכנות כמו ה-Premm לסרטן המעי הגס.
תוכנת upenn-BRCA בבריאות מניסיוננו גורמת להערכת יתר משמעותית, ולכן מומלץ לא להסתמך עליה.
*בדיקת בריאים אינה כלולה במפורש בסל הבריאות - מומלץ להכלילה בתנאים המפורטים.
הליך הייעוץ האונקוגנטי
הליך הייעוץ הגנטי המסורתי כולל ייעוץ גנטי טרום בדיקה (פרונטלי או מרחוק - טלפוני/וירטואלי), הנערך על ידי גנטקאי/ת/ יועץ/ת גנטי/ת. לאחר הייעוץ מתבצעת בדיקה גנטית ולאחר קבלת התוצאה נמסרת התוצאה לנבדק/ת. מסירת תשובה תקינה נעשית בעל-פה ו/ואו בכתב, ובמקרים של נשאות או סיפור משפחתי משמעותי נערך ייעוץ חוזר משלים לאחר קבלת התוצאה כנדרש. יתרונות הליך זה רבים. עם זאת, הדרישה לייעוץ ובירור גנטי עולה, ולעיתים, דרוש מענה בטווח זמן קצר לצורך קבלת החלטות טיפוליות (כגון החלטה על טיפול במעכבי PARP בחולות סרטן שחלות). לאור זאת, קיים קושי לאפשר ייעוץ מקדים על ידי גנטיקאי/ת לכל, בעיקר בשל מחסור בכוח אדם וזמינות, ובשל הרצון להקל ולפשט את ההליך למטופלים.
חלופה להליך זה בחולי סרטן פעילים מקובלת בעולם וקיימת במספר בתי חולים בישראל - main streaming. בהליך מקוצר זה הייעוץ וההסבר המקדים והפניית חולי/לות סרטן פעילים לבירור הגנטי המתאים, נעשה על ידי הרופאים/אות המטפלים/ות (בתחומי כירורגית שד, גינקולוגיה, אונקולוגיה, או גסטרואנטרולוגיה). במחקרים הודגם שגישה זו מעלה משמעותית את שיעור ביצוע הבדיקות הגנטיות בקרב חולים[1]. איגוד הגנטיקאים המליץ בעבר לאפשר את מודל ה-main streaming. אנו מחזקים המלצה זו, עם דגש על חובת הגורם המפנה לבדיקה למסור תשובה ולהבטיח את הייעוץ המשלים, כמתחייב על פי הדרישות המפורטות.
- ייעוץ אונקוגנטי מקדים (טרום בדיקה) נדרש תמיד (למעט בבדיקת הסקר). יינתן על ידי גנטיקאי/ת יועץ/תי גנטי/ת או על ידי רופא/ה מומחה/חית בתחומו/ה בחולי סרטן פעילים. הייעוץ המקדים יכלול אנמנזה אישית ומשפחתית מלאה, הערכת הסיכוי לקיום מצב תורשתי הקשור לסרטן, הבהרת משמעות הבדיקה ותוצאותיה ואפשרויות הבדיקה השונות למטופל והפנייה לבדיקה המתאימה. באחריות הרופא/ה המפנה להפנות לבדיקה המתאימה: בדיקת מוטציות נפוצות בלבד/ריצוף פאנל אונקו-גנטי או בדיקה דו- שלבית (בהתאם לרשימת הקריטריונים המפורטת בטבלה 1, ובטופס ההפנייה לבדיקה, ראו נספח 1)
- ייעוץ אונקוגנטי למסירת תוצאות הבדיקה: בייעוץ זה תוסברנה תוצאות הבדיקה, מגבלות הבירור, ויומלץ על בירור המשך אישי או משפחתי במידת הצורך. תינתן הערכת סיכון והמלצות למעקב ומניעה בהתאם לתוצאות הבדיקה והסיפור המשפחתי
- הייעוץ למסירת תוצאות הבדיקה יינתן על ידי הגורם שהפנה לבדיקה הגנטית
- ייעוץ חוזר על ידי על ידי גנטיקאי/ת יועץ/ת גנטי.ת נדרש במקרים בהם:
- דווח על ממצא בבדיקה: פתוגני/ככל הנראה פתוגני/ממצא שמשמעותו הקלינית אינה ברורה (VOUS)
- תשובה תקינה אך חשד קליני גבוה לקיום רקע מורש לסרטן
- לבקשת המטופל/ת
- דגשים לייעוץ גנטי בחולים: בכל מקרה, ובפרט שהייעוץ המקדים ניתן על ידי רופא בתחומו שאינו גנטיקאי יש להקפיד על הצעדים הבאים:
- מילוי טופס הפנייה לבדיקה (נספח 1)
- מתן דף הסבר על הבדיקה (נספח 2)
- להבטיח את הרצף הטיפולי, כלומר הבטחת מתן הייעוץ הנחוץ לפני ואחרי הבדיקה. בכל מקרה האחריות על מתן הסבר ראשוני, קבלת התוצאות, מתן התוצאות למטופל, הבטחת הייעוץ הגנטי המשלים במידת הצורך, היא על הגורם הרפואי המפנה. אנו קוראים ליצירת מנגנונים מוסדרים דרך קופות החולים/בתי החולים שיקלו על שמירת הרצף הטיפולי ויאפשרו ביצוע ההליך ביעילות ובאופן מסודר
- הברור הגנטי: ההמלצות המפורטות לעיל גובשו על סמך הקווים המנחים של ה-The National Institute for Health and Care Excellence (NICE) באנגליה, The European Society for Medical Oncology (ESMO) האירופאי וה-The National Comprehensive Cancer Network (NCCN) בארצות הברית[2][3][4]
הבירור הגנטי
הבירור האונקוגנטי נערך לרוב בדגימת דם ומטרתו זיהוי מוטציות מורשות. הבירור כולל בדיקת מוטציות מוכרות, ובדיקת פאנל גרמינלי נרחב. במסגרת זו גם נערכות בדיקות בגידול עצמו בחשד לתסמונת לינץ'. ישנם מקרים בהם מומלץ ביצוע בדיקת דם לשינויים שזוהו בגידול ושעולה חשד שהם שינוי גנטי מורש. יודגש שבמקרים בהם יש התוויה לבירור גנטי גרמינלי, מומלץ לבצעו, גם אם בדיקה סומטית שנערכה בגידול הייתה שלילית.
- בירור גנטי גרמינלי:
- בדיקת מוטציות ייחודיות - תיבדקנה רק מוטציות המוגדרות כ actionable - כלומר מחייבות מעקב ייחודי/ רלוונטי להחלטה טיפולית
- מוטציה משפחתית תיבדק אם יש סיכון של לפחות 2.5 אחוזים לנשאות (דין 'סקר אשכנזי')
- מוטציות שאותרו בגידול תיבדקנה אם הן מוטציות מייסד, או לפי אחת ההנחיות כמפורט בהמשך. לציין כי בדיקת ריצוף ברקמה גידולית אינה מחליפה/מייתרת בדיקה גרמינלית
- בדיקת מוטציות נפוצות - בדיקה זו נועדה לאפשר בירור ממוקד, זול ויעיל, בטווחי זמן קצרים, ובתנאי שתייעל את הליך הבירור - כלומר, שאם תזוהה מוטציה בבדיקה זו הדבר יאפשר את עצירת הבירור. לכן, בדיקה זו אמורה להיות זולה ואמינה, לכלול רק מוטציות ש: א. חדירותן גבוהה, ב. שכיחותן גבוהה באוכלוסייה הנבדקת (עדה/כפר/חמולה). לציין שאם יש מוטציה 'עדתית' שאינה נכללת ברשימה סגורה, ועונה על הקריטריונים הנזכרים למעלה, יש לבדקה בהמלצת הגנטיקאי (למשל לנבדק דרוזי בצפון, בדואי, רוסי לא יהודי)
- יש לעדכן את רשימת המוטציות הנבדקות בהתאם לספרות המקצועית והנתונים המקומיים אחת לשנתיים
- מומלץ להוציא מרשימה זו את הווריאנטים בעלי חדירות נמוכה (עד פי 2 מהסיכון באוכלוסייה)[5][6]. לגבי השינויים הנפוצים: c.3920T<A;p.I1307K בגן APC ו־p. S428F c.1283C<T; בגן CHEK2. פירוט בנספח 3
- בשל ה-yield הנמוך בבדיקות אלו, למעט המוטציות האשכנזיות, אנו רואים הצדקה רפואית ומדעית לבדיקה של מוטציה נפוצה ב-BRCA במקרים הבאים:
- חולות סרטן שד שלא עומדות בקריטריונים לבדיקה רחבה (הסיכון > 10 אחוזים) ובעדתן מוטציה נפוצה
- מקרים בהם סיכוי סביר שהבדיקה תייתר בדיקת פאנל אם תהיה חיובית (חולת סרטן שחלה, חולים וחולות בסרטן לבלב, ערמונית מפושט או מתקדם). במקרים אלו ההחלטה לגבי ברור דו-שלבי או בדיקת פאנל תחילה נתונה למכונים/קופות - ובלבד שאם מבוצע באופן דו-שלבי, לא יצריך ייעוץ גנטי באמצע, ושבכל אחת מהחלופות התשובה הסופית תינתן בפרק זמן סביר (עד חודשיים מיום ביצוע הבדיקה)
- בדיקת מוטציות ייחודיות - תיבדקנה רק מוטציות המוגדרות כ actionable - כלומר מחייבות מעקב ייחודי/ רלוונטי להחלטה טיפולית
טבלה מספר 1 - הבירור הגנטי המומלץ בחולי סרטן
| סוג גידול | חולים - אינדיקציה | תנאי נוסף/סיפור משפחתי )אותו צד הורי (אצל קרובים דרגה ראשונה/שנייה | הבדיקה |
| שתי ממאירויות ראשוניות באותו אדם | גיל ≤ 60 (לא כולל סרטן צוואר הרחם ו-BCC - Basal Cell Carcinoma) | פאנל גנים אחידa | |
| שד | אם ידועה מוטציה נפוצה בעדה/הכפר/השבט | חולת סרטן שד בכל גיל וללא תלות בסיפור משפחתי | נפוצות |
| שד | 50 > | פאנל גנים אחידa | |
| טריפל (-) < 75 | פאנל גנים אחידa | ||
| גבר | פאנל גנים אחידa | ||
| לובולרי + קיבה | פאנל גנים אחידa | ||
| לובולרי + ספור משפחתי | קיבה - DGC | פאנל גנים אחידa | |
| דו-צדדי < 70 | פאנל גנים אחידa | ||
| בכל גיל אם יש סיפור משפחתי כמפורט | שחלה/לבלב/ערמונית high risk/שד גבר/שד בצעירה מ־50/ערמונית או שד ב-2 קרובים נוספים מאותו צד הורי | פאנל גנים אחידa | |
| בכל גיל אם רלוונטי להתוויית טיפול | לדוגמה - סרטן שד גרורתי שלילי ל-Her2 | פאנל גנים אחידa | |
| שחלה אפיתליאלי | (פרט ל-borderline) | פאנל גנים אחידa | |
| לבלב אקסוקריני | כולם | פאנל גנים אחידa | |
| מעי גס/רחם | Positive universal screening | MMRDc. אם אין אפשרות לבדיקת גידול - רק ממלאים קריטריוני הבת'סדה | פאנל גנים אחיד |
| 50 > | פאנל גנים אחיד | ||
| בכל גיל אם יש סיפור משפחתי כמפורט | סיפור משפחתי העומד בקריטריונים של הבת'סדה | ||
| שאר גידולי לינץb | Positive universal screening | MMRDc. אם אין אפשרות לבדיקת גידול - רק אם עונים על קווי הבת'סדה | פאנל גנים אחיד |
| פוליפוזיס במעי הגס | >20 אדנומות | פאנל גנים אחיד | |
| > 10 אדנומות/2 המרטומות/ > serrated polyps 5 | עם גורמי סיכון נוספים (כגון גיל < 50/הפטובלסטומה/דסמואיד או סרטן מעי בקרוב משפחה מדרגה 1 או 2) | פאנל גנים אחיד | |
| >10 אדנומות | הורים קרובי משפחה/ערבים/צפון אפריקאים | פאנל גנים אחיד | |
| לפחות 2 אדנומות | גיל צעיר מ-40 | ||
| קיבה DGC | 50 > | פאנל גנים אחיד | |
| כל גיל אם סיפור אישי או משפחתי כמפורט | חך/שפה שסועים/סרטן שד לובולרי (במטופל או במשפחתו) | פאנל גנים אחיד | |
| פוליפוזיס בקיבה | מעל 30 | פאנל אחיד הכולל
APC פרומוטור 1B | |
| כליה | 45> | פאנל מתאים | |
| רב-מוקדי | פאנל מתאים | ||
| כל גיל + סיפור משפחתי | חולה RCC (Renal Cell Carcinoma) | פאנל מתאים | |
| מאפיינים המחשידים ל-HLRCC
SDH BHD VHL |
פאנל מתאים | ||
| ערמונית | אשכנזי | נפוצות | |
| גרורתי מתקדם/סיכון גבוה (גליסון 7 ומעלה) | פאנל גנים אחיד a | ||
| + סיפור משפחתי | שד/מעי/רחם מתחת 50/שד בגבר/שחלה/לבלב/ערמונית מתקדם/מתחת 60/שד/ערמונית ב-2 קרובים | פאנל גנים אחיד a | |
| כל גידול | אם כרוך בחשד קליני > 10 אחוזים למרכיב תורשתי | לדוגמה GIST ללא מוטציה סומטית ב-kit/PDGFRa /סרקומה בגיל צעיר/ACC בילדות/גליומה בילדות או תסמונות NF, סרטן כגון MEN1/2, NF ועוד | פאנל מתאים לפי ספרות רפואית מבוססת |
| מוטציה פתוגנית בגידול - על פי ההנחיות בהמשך | מוטציה או פאנל לשיקול המעבדה |
- פאנל אחידa: לחולי סרטן שד שחלה ערמונית לבלב בעדות המתאימות - מומלץ על מוטציות שכיחות באוכלוסיית ישראל תחילה. אם תקין ועונים על אינדיקציה נוספת להמשיך אוטומטית לבדיקת פאנל גנים מורחב
- גידולי לינץ נוספיםb, בהתאם לשיקול דעת קליני: sebaceous neoplasm, small bowel, ovarian, gastric, pancreas, biliary tract, brain, invasive bladder, urothelial, and adrenocortical cancers
- cבגידולים בהם התגלה היעדר MLH1/PMS2 - יש להשלים בירור סומטי תחילה, כמפורט ב-3.2, אם ישנו סיפור משפחתי
Diffuse gastric cancer (DGC), Mismatch repair deficiency (MMRD), Gastrointestinal stromal tumors (GISTs), Renal cell carcinoma (RCC), Von Hippel-Lindau syndrome (VHL), Birt-Hogg-Dube syndrome, Succinate dehydrogenase (SDH), Hereditary leiomyomatosis and renal cell cancer (HLRCC), Multiple endocrine neoplasia type 1/2 (MEN1/2), Neurofibromatosis (NF).
טבלה 2 - הבירור הגנטי המומלץ לבריאים
| סוג הממאירות במשפחה | פירוט הספור המשפחתי (מאותו צד הורי) - דרגה ראשונה/שנייה. | הבדיקה |
| הכל | מוטציה משפחתית actionable - סיכון של 2.5 אחוזים לנשאות. | מוטציה משפחתית |
| שד | סיכון של 10 אחוזים ומעלה לזיהוי שינוי פתוגני לפי מודלים כגון Tyrer-Cuzick,
BRCAPro, CanRisk. (אשכנזים - לאחר שלילת מוטציות אשכנזיות - כלומר חישוב כ-'לא אשכנזי') |
פאנל גנים אחיד a |
| שחלה אפיתליאלי | קרובה מדרגה ראשונה או דרגה שנייה מצד האב. | פאנל גנים אחיד a |
| לבלב אקסוקריני | סיכון של 10 אחוזים ומעלה לזיהוי שינוי פתוגני לפי מודלים כגון BRCAPro CanRisk.
(אשכנזים - לאחר שלילת מוטציות אשכנזיות - כלומר חישוב כ-'לא אשכנזי'). |
פאנל גנים אחיד a |
| מעי גס | - קרוב מדרגה ראשונה עם סרטן מעי/רחם מתחת לגיל 50, או
- קרוב מדרגה ראשונה עם שני גידולים ראשונים של תסמונת לינץ' ללא תלות בגיל. או - שני קרובי מדרגה ראשונה/שנייה (באותו צד הורי) עם גידולי 'לינץ', שאחד מהם צעיר מ 50, או - שלושה קרובים מדרגה ראשונה/שנייה (באותו צד הורי) עם גידולי 'לינץ', או - סיכון של 10 אחוזים לזיהוי שינוי פתוגני בתוכנות כגון MMRpro PREMM5 MMRpredict |
פאנל גנים אחיד |
| קיבה | שני קרובי משפחה מדרגה ראשונה/שנייה עם גידולי קיבה/קרוב משפחה עם DGC + קרובה עם סרטן שד לובולרי מתחת לגיל 70/קרוב אחד שחלה בגיל צעיר מ-50. | פאנל גנים אחיד a |
| כליה | 2 קרובי משפחה מדרגה ראשונה/שנייה עם RCC. או קרוב אחד מדרגה ראשונה עם סרטן כליה מתחת גיל 46. או קרוב משפחה אחד מדרגה ראשונה עם גידול דו-צדדי/רב-מוקדי. | פאנל מתאים |
| גידול אחר | אם חשד לנשאות אצל המטופל המקבל ייעוץ 10 אחוזים. | פאנל מתאים |
- a פאנל אחיד: לחולי סרטן שד, שחלה, ערמונית, לבלב, בעדות המתאימות - מומלץ על מוטציות שכיחות באוכלוסיית ישראל תחילה. אם תקין ועונים על אינדיקציה נוספת להמשיך אוטומטית לבדיקת פאנל גנים מורחב.
- פאנל אונקוגנטי גרמינלי רחב - חוזר סל הבריאות 2020 מנחה ביצוע פאנל אונקוגנטי לחולים בסרטן בתנאי שעומדים בקריטריונים שקבע. החוזר מתייחס לחולי שד, שחלה, לבלב, חולי מעי וחולים עם פוליפוזיס. בנוסף בחוזר מצוינת האפשרות לבדוק גם חולים בסרטן )כלשהו (שהסיכוי לנשאות אצלם נאמד בכ- 10 אחוזים, ללא ציון סוג הגידול. בסוף החוזר מפורטות 2 רשימות של גנים המומלצים לבדיקה על ידי ה־NCCN כמנחי פעולה. רשימה אחת מתייחסת לשד/שחלות/לבלב )19 גנים (ורשימה שנייה מתייחסת לגידולי מערכת העיכול (12 גנים), ומצוין שרשימה זו תעודכן מעת לעת. המלצתנו המעודכנת היא:
- לכלול בפאנל המעודכן גנים המוגדרים כ high/medium penetrance genes
- אין להגביל את מספר הגנים הנכלל בפאנל, ובלבד שיכללו גנים הידועים כמעלים סיכון לגידול/ים שהם סיבת ההפנייה הראשונית או העיקרית (טבלה 3). אנו ממליצים על רשימה מוסכמת (פאנל אחיד) לכל הגידולים הנפוצים (שד, שחלה, רחם, לבלב, ערמונית, מעי קיבה) ייבדקו כל הגנים בפאנל האחיד בשל החפיפה הרבה בין המצבים התורשתיים ועל מנת לדאוג לאחידות הבדיקה, בפרט בהקשר של main streaming. טבלה 3 - פאנל הגנים האחיד: רשימת הגנים שצריכים להיבדק בשל תחלואה בסרטן שד, שחלות, לבלב, ערמונית, רחם, קיבה, מעי ופוליפוזיס
| APC | BRCA1 | CHEK2 | MSH2 | NTHL1 | RAD51C |
| ATM | BRCA2 | MSH6 | PALB2 | RAD51D | |
| #AXIN2 | BRIP1 | *GREM1 | **PMS2 | POLD1 | SMAD4 |
| BARD1 | CDH1 | *EPCAM | MUTYH | POLE | STK11 |
| BMPR1A | CDKN2A | MLH1 | NF1 | PTEN | TP53 |
* בדיקה ל CNV האופייני (דופליקציה -GREM1, חסר - EPCAM)
**בדיקה המבחינה בין הפסוודוגן לגן
#ייש לכלול במקרים של היפודונטיה
- במקרים בהם סיבת הפנייה היא גידול ייחודי, לדוגמה Neuroendocrine, Melanoma ,GIST ללא מוטציה סומטית ב-kit/PDGFRa, פוליפוזיס, או כל גידול נדיר אחר, יש לבחור את רשימת הגנים המתאימה על פי האבחנה, ולבקש פאנל מתאים, כמקובל במצבים מונוגנים אחרים
- טכנולוגיה: יש להשתמש בטכנולוגיה המאפשרת זיהוי של נוקליאוטידים בודדים וגם שינויים מבניים (חסרים ותוספות)
- דיווח תוצאות: יש לדווח על ממצאים המסווגים כפתוגנים/חשודים לפתוגנים על פי הקריטריונים של ה-ACMG. אם המעבדה בוחרת לדווח על שינויים שמשמעותם הקלינית אינה ברורה variant of uncertain significance) VUS), יש לכלול הסבר ופירוט מנומק בהתאם לקריטריונים של ה-ACMG לקביעת הסיווג. שינויים בעלי חדירות נמוכה כגון הווריאנט p.I1307K בגן APC ידווחו כ־risk factor (נספח 3)
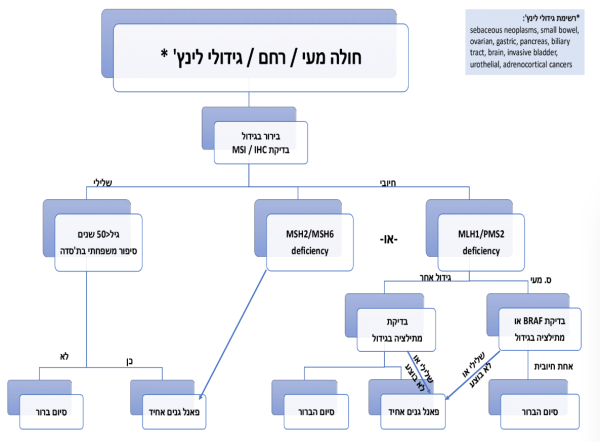
בירור גנטי בשאלה של תסמונת לינץ'
חוזר מנכ"ל 13.2020 הממליץ על ביצוע universal screening בכל גידולי המעי והרחם בחולים שאובחנו לפני גיל 70. הבדיקה כוללת Immunohistochemistry screening (IHC) לחלבוני ה-(MMR) mismatch repair genes, או בדיקת (Microsatellite Instability (MSI ובדיקת מוטציות ב-BRAF במקרה של היעדר ביטוי MLH1. המלצות ה-NCCN עודכנו, וכבר ב-2021 הומלץ על הרחבת הבירור בחולים נוספים. איגוד הגנטיקאים קורא לאמץ את המלצות ה-NCCN, להרחיב את בדיקת ה-universal screening כמפורט למטה.
- הרחבת הבירור המומלץ:
- להוריד את הגבלת הגיל ולבצע universal screening בכל גידולי המעי הגס והרחם
- הדגימה: עדיף לבצע את הבדיקה על פרפרט ניתוחי, אך אם חשוב לבדוק את החשד לנשאות לפני החלטה ניתוחית (כגון החלטה על היקף הניתוח) או טיפולית, כגון בחולים עם גידולי רקטום המועמדים לטיפול כימי-קרינתי מקדים, יש לבצע את הבדיקה בדגימה מביופסיה (בשל השלכה על בחירת טיפול אונקולוגי מקדים ואפשרות להיעדר פרפרט ניתוחי במקרים של תגובה קלינית מלאה)
- הרחבת ההתוויות לביצוע בירור בגידולים: מומלץ להרחיב את universal screening לכל חולי סרטן המעי והרחם (על ביופסיה או פרפרט ניתוחי) ללא הגבלת גיל, ולשקול ביצוע בירור זה גם בגידולים הבאים הנחשבים כקשורים לנשאות של תסמונת לינץ', בפרט אם מדובר בגידול גרורתי/גיל צעיר, או בהמלצת הגנטיקאי: sebaceous neoplasms, small bowel, ovarian, gastric, pancreas, biliary tract, brain, muscle-invasive bladder ca, urothelial, and adrenocortical cancers
- שיטת בדיקת הגידול - universal screening - כאמור הבדיקות המקובלת לאבחון Mismatch repair -deficient (MMRD) היא IHC או MSI-PCR ובגידולי רחם בדיקת IHC עדיפה[7]. בדיקה בטכנולוגיה אחרת - Tumor NGS עדיין לא מקובלות בעולם כבדיקות סקירה לתסמונת לינץ'
- השלמת הליך הבירור בגידולים - אם בוצעה בדיקת IHC ודווח על היעדר MLH1/PMS2, או בוצעה בדיקת MSI והודגמה אי-יציבות - יש להשלים את הבירור באופן רציף כחלק מהעיבוד הפתולוגי על ידי בדיקת הגידול למוטציה ב־BRAF (אינפורמטיבית רק בסרטן המעי) או בדיקת מתילציה של הפרומוטור של הגן MLH1 (אינפורמטיבית בכל הגידולים). בדיקת המתילציה אינה מבוצעת במעבדות קליניות בישראל. מומלץ להוסיף את בדיקת המתילציה לסל, ולבדוק מתילציה כחלק מהבירור הגנטי כיוון שמשליכה על האבחון הגנטי
- מומלץ להפנות כל מטופל עם בדיקת גידול המחשידה ללינץ' (כאשר בדיקת BRAF/מתילציה תקינה) לייעוץ גנטי ולבדיקת פאנל גרמינלי הכולל את הגנים הרלוונטיים (טבלה 3)
- אם החולה צעיר מ-50, יש להמשיך בכל מקרה לפאנל גרמינלי, גם אם בדיקת הגידול תקינה
בדיקה גרמינלית בעקבות ממצא סומטי
ריצוף גנטי של רקמות גידולים מהווה "common practice" במהלך הטיפולי בחלק מסוגי הסרטן, מאפשר דיוק וטיוב הטיפול האונקולוגי[8][9]. הרוב המכריע של הממצאים הסומטיים אינו גרמינלי, אולם בבדיקה הגידולית לעיתים מזוהים גם ממצאים משמעותיים מבחינת הגנטיקה המורשת - מוטציות החשודות להיות גרמינליות. הבירור הסומטי לא בהכרח מאתר את כל השינויים הגרמינליים (בייחוד שינויים מסוג תוספות/חסרים, שיכולים להוות עד כ-10 אחוזים מהשינויים הגרמינליים), הן בשל אופי הבדיקה, איכות ה-DNA בדגימה, והבדלים בכלים הביואינפורמטיים בהם נעשה שימוש. בעבודות תואר כי 8–10 אחוזים מהוריאנטים הגרמינליים אינם מזוהים בבדיקות הסומטיות[10][11]. רק בדיקה משולבת של גידול עם רקמה תקינה מאפשרת איתור מקסימלי של ממצאים מולקולריים, הן סומטיים והן גרמינליים והסקת מסקנות לגבי משמעותם. לכן יש לשאוף לבירור מקיף על ידי בדיקה משולבת. נייר עמדה זה מתייחס למצב הקיים, בו מרביתן של הבדיקות בהן נבדקים גידולים המבוצעות במכונים הפתולוגים או במעבדות ייחודיות, מבוססות על בדיקת הגידול בלבד[12]. לכן המלצותנו הן לבירור גרמינלי בעקבות תוצאות בירור סומטי. בעולם קיימים ניירות עמדה שונים, הנבדלים זה מזה בעיקר ברמות הרגישות הנדרשות. המלצות ה-ESMO (ESMO Precision Medicine working group)[13] מכוונות לביצוע בירור כאשר ישנו סיכוי מקדמי של 10 אחוזים לאיתור מוטציה גרמינלית בגן רלוונטי - Pretest probability of 10 אחוזים of germinal variant in actionable cancer gene. ישנה המלצה לבצע בדיקה גרמינלית של ווריאנט סומטי בתנאי שה-Variant Allele Frequency (VAF) שלו בגידול גבוה מ-30 עבור SNV, וגבוה מ-20 עבור Indel, לא כל הווריאנטים המופיעים ב-VAF גבוה מחשידים למצב תורשתי (לדוגמה BRAF V600E, רוב המוטציות ב TP53) לכן, על סמך מחקר משולב, מומלץ בחלק מהמקרים להוסיף לאלגוריתם תנאים נוספים הנוגעים למתאם בין הגידול, הגן, וגיל החולה. מסמך משותף של ה-Clinical Genome Resource (ClinGen), Cancer Genomics Consortium (CGC) וה-Variant Interpretation for Cancer Consortium (VICC)[14] קבע גם אמות מידע שתאפשרנה בדיקת הווריאנטים הסומאטיים החשודים גם ככאלה שקיימים גם ברמת תאי האב, אך מסמך זה לא התחייב לסיכוי מקדמי של 10 אחוזים לאיתור המוטציה.
המלצותינו בנייר העמדה הנוכחי מבוססות על ניירות העמדה האלה, במטרה לאפשר איתור ווריאנטים שיש סיכוי של 10 אחוזים או יותר שיהיו מורשים.
- מומלץ בירור גרמינלי לאחר ביצוע בדיקה גנומית בגידול (או בביופסיה נוזלית liquid biopsy) לגבי ווריאנטים הממלאים את שלשת הקריטריונים הבאים:
- השינוי ממוקם בגן הידוע כ-cancer predisposition gene
- השינוי מסווג כ-P/LP ב-germline
- ה-VAF בגידול גבוה מ-30 אחוזים עבור SNV, וגבוה מ-20 אחוזים עבור Indel (דרישה זו לאחוזי מציאת העותק המוטנטי לא נחוצה במקרים של מוטציות מייסד/מוטציות גרמינליות מוכרות באוכלוסייה הנבדקת. במקרים אלו מומלץ להמשיך לבירור גרמינלי גם אם ה-VAF נמוך מערכי הסף הנזכרים למעלה)
- ווריאנטים העונים על שלשת התנאים המפורטים למעלה יעברו סינון נוסף על פי טבלה 4
- האיגוד ממליץ על ייעוץ גנטי הכולל הסבר לגבי משמעויות ההיבט התורשתי, לפני ביצוע בדיקה גרמינלית, גם אם מבוצעת במקביל לבדיקה הסומטית, וגם אם זו בדיקת המשך לבדיקה הסומטית.
טבלה 4 - המלצות לבירור גרמינלי למוטציות שזוהו בגידול על פי גן
| מומלץ תמיד | ,PALB2 ,MSH6 ,MSH2 ,MLH1 ,BRIP1 ,BRCA2, BRCA1
VHLa, RAD51C, RAD51D ,RET ,SDHA,SDHAF2, ,PMS2 SDHB, SDHC, SDHD, TSC2, MUTYHb |
| מומלץ רק, אם הווריאנט מתאים לסוג הגידול | POLE, FLCN, FH, BAP1 |
| מומלץ רק אם הופיעו בחולים < 30 שנים | APC, RB1 |
| מומלץ רק אם הופיעו בחולים < 30 שנים, בגידול המתאים למחלה | TP53c, NF1 |
aמלבד במקרים בהם אותרו בגידולי כילייה, bרק אם אותרו ווריאנטים ביאללים ברקמת הגידול. cמלבד גידולי מח.
מעקב אחר נשאים/ות של תסמונת סרטן
תפקיד הגנטיקאי/ת או היועצ/ת הגנטית להפנות את הנשא/ים לגורמים הרפואיים המקצועיים. מומלץ לתת מידע אודות ההמלצות המקובלות בעת היידוע על הנשאות, אך להדגיש שהמעקב המדויק יומלץ על ידי הרופאים המקצועיים. לתוכנית מעקב מפורטת לנשאי BRCA1/2 ולנשאי תסמונות סרטן אחרות, ראו נספח 4.
- מומלץ להפנות נשאים/יות למרפאות ייחודיות/צוות רב תחומי שתלוונה אותן לאורך חייהן
- מומלצת מעורבות גנטיקאי בצמתי קבלת החלטות וקביעת מדיניות של מרפאות המעקב
- לנשאיות בגיל פריון מומלץ על ייעוץ טרום לידתי
- במקרים של נשאים/יות של מוטציות בגנים בהם ידועה מחלה רצסיבית הנגרמת ממצב של מוטציות בי- אלליות מומלץ ייעוץ גנטי ייעודי לבן/ת הזוג
יש צורך בהקצאת משאבים ייעודיים לצורך זה כדי לענות על הדרישה שלא זוכה למענה מיטבי בישראל.
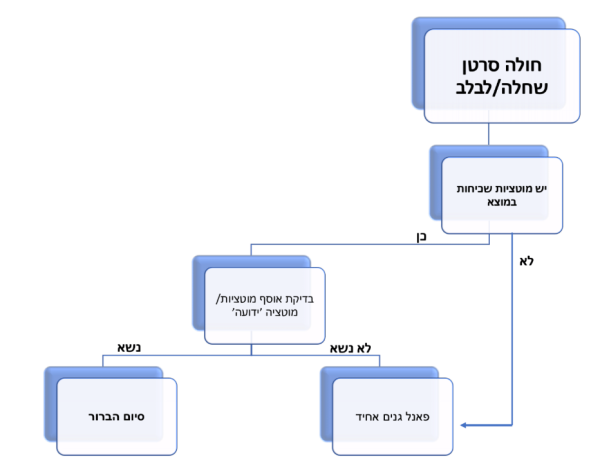
בדיקת סקר גנטי לאיתור נשאיות ל-BRCA1/2 בנשים אשכנזיות
נשאות של מוטציות בגנים BRCA1/2 כרוכה בסיכון יתר משמעותי לסרטן שד ולסרטן שחלות[15][16][17][18]. לנשאיות מגיל 25 מומלץ ביצוע מעקב מוגבר וניתוחים מניעתיים: כריתה מניעתית של הטפולות והשדיים. אמצעי מעקב ומניעה אלה הוכחו כיעילים בהקטנת התחלואה והתמותה[2][19]. באוכלוסייה האשכנזית נמצאה שכיחות גבוהה - 2.5 אחוזים (1:40) של 3 מוטציות מייסד: 185delAG ו-5382insC בגן BRCA1, ו-6174delT בגן[20][21]BRCA2. באשכנזים שלוש מוטציות אלה מהוות 95 אחוזים מהמוטציות בגנים[22]BRCA1/2.
בדיקות סקר גנטיות למוטציות ב־BRCA1/2: ארגון הבריאות העולמי קבע קריטריונים הנדרשים לביצוע בדיקת סקר כך שיתאימו גם לביצוע בדיקת סקר למחלה גנטית[23][24][25]. לאור החשש מנזק אישי וחברתי כגון אפליה בתעסוקה ובביטוח, יש צורך שהסקר ילווה במנגנון הסברתי וייעוצי המכבד את ערך האוטונומיה של הנבדק. וככלל, שהתועלת בבדיקה תגבר על הנזק שעשוי להיגרם בעטייה.
בדיקת המוטציות השכיחות באשכנזים בגנים BRCA1/2 עומדת בקריטריונים שהותוו על ידי ארגון הבריאות העולמי. לפיכך, בשנת 2020 נכללה בסל הבריאות בדיקה זו לנשים יהודיות ממוצא אשכנזי[26]. מלבד הגדרת מוצא קהל היעד של הנבדקות, לא הוגדרו קריטריונים נוספים לגבי הנבדקות, והליך הבדיקה.
לצורך כתיבת פרק זה, נערך בירור מקיף מול קופות החולים, ונאספו נתונים לגבי מנגנון ביצוע הסקר, הנשים שהשתתפו, המוטציות הנבדקות, ומנגנון מסירת התוצאות. סך הכל נבדקו מעל 30,000 נשים, מרביתן בקופות החולים כללית, מכבי ומאוחדת.
המלצותינו המפורטות לעיל מתבססות גם על הניסיון שהצטבר בקופות החולים מאז התחלת ביצוע הסקר בפועל:
- יידוע על קיום הבדיקה: מומלץ ליידע אודות בדיקות הסקר צוותי רפואה רלוונטיים (גינקולוג/ית, כירורג/ית שד, רופא/ת משפחה, אחים/ות ועוד). על קופות החולים ומשרד הבריאות להעלות את המודעות הציבורית
- ביצוע הסקר מומלץ לנשים העומדות בקריטריונים הבאים:
- מומלץ ביצוע בדיקת הסקר בנשים מגיל 25. הסיכון לתחלואה בגיל < 25 אינו משמעותי ולכן ההמלצות למעקב בנשאיות הן מגיל זה. לפיכך, אין תועלת בביצוע בדיקת הסקר לפני גיל זה. כמו כן, בדיקת נשים בגיל < 25 אינה עומדת בקריטריונים המקובלים לבדיקות סקר
- בדיקת הסקר מיועדת לנשים בריאות. נשים שחלו בסרטן תופנינה לייעוץ ובירור גנטי כפי שפורט בסעיף 1.1
- נשים ללא נשאות ידועה במשפחתן של מוטציה בגנים הקשורים בעלייה בסיכון לסרטן. נשים עם מוטציה במשפחה תיבדקנה במסגרת ייעוץ גנטי. בדיקות הסקר באופן מהותי נועדו לאנשים בסיכון רגיל. נשים עם מוטציה במשפחה נמצאות בסיכון של עד 50 אחוזים לנשאות, וכן נדרשות לבירור מותאם שיכלול את המוטציה המשפחתית. מנתוני הקופות עולה ששיעור משמעותי של הנשאיות בסקר ידעו מראש על מוטציה במשפחתן. בדיקת הסקר מהווה מענה פשוט גם עבורן. יש צורך להבין את החסמים הקיימים להליך הייעוץ הגנטי השגרתי, ולהקל עליהם במידת האפשר
- נשים עם סיפור משפחתי, כמפורט בטבלה 2, תופנינה לייעוץ גנטי בעת ביצוע בדיקת הסקר: בנשים עם סיפור משפחתי יש חשיבות רבה בייעוץ גנטי. זאת היות שרק 50 אחוזים מהמקרים המשפחתיים מוסברים על ידי מוטציות בגנים[27]BRCA1/2. תוצאת בדיקה שלילית במסגרת הסקר ללא ייעוץ, יכולה להיות מלווה בתחושת ביטחון כוזבת (false reassurance). חשש זה קיים לגבי נשים בכל רמת סיכון, אך בעל פוטנציאל נזק גדול יותר בנשים עם סיפור משפחתי. באחריות קופת החולים להנגיש את קביעת הייעוץ הגנטי עבור נשים אלה בעת בדיקתן
- מנגנון ביצוע הבדיקה במסגרת הסקר - בשונה מבדיקות סקר טרום לידתי, לבדיקת סקר זו יש משמעות רפואית לנבדקת עצמה. לפיכך, מומלץ ליצור מנגנון כגון צוות רפואי שהוכשר לכך (אחיות מידע גנטי), סרטון הסבר וכדומה, בכדי לספק מידע מקדים, לאפשר קבלת החלטה שקולה, ולמקסם התאמת האישה לסקר
- הבדיקה הגנטית:
- מרבית הקופות כללו בבדיקה מלבד 3 המוטציות האשכנזיות גם מוטציות שכיחות באוכלוסייה היהודית בישראל בגנים BRCA1/2 (קיט 14 מוטציות)
- מומלץ לעדכן את רשימת המוטציות הנבדקות כך שתיכלולנה את כל המוטציות הידועות בגנים BRCA1/2, שבכללן המוטציה c.5434C<G ;p.P1812A בגן BRCA1) שאינה ב־14 המוטציות הנבדקות (כפי שהומלץ עבור הנבדקות לאחר ייעוץ) סעיף 3.1.2.1
- מסירת תוצאות:
- נשאיות: במסגרת הסקר הבדיקה הגנטית מבוצעת ללא ייעוץ גנטי מקדים. נשים המקבלות תוצאת נשאות ללא ייעוץ המסביר תוצאה זו, ניזונות ממידע זמין ולא מקצועי, וחוות מצוקה גדולה. מומלץ לתת ייעוץ גנטי לנשים המתגלות כנשאיות באופן דחוף, עד שבועיים מיום שיודעו על נשאותן
- נשים שאינן נשאיות: בנוסף לדיווח הממוחשב המעבדתי, יש לצרף דף הסבר לתוצאה שיכלול התייחסות לנושאים הבאים: סיכון שארי לגורם גנטי שלא נבדק, הפנייה לייעוץ גנטי אם יש סיפור משפחתי, קיומו של סיכון לתחלואה בסרטן על אף תוצאות הבדיקה, והמלצה להמשך מעקב. לדף תוצאה לדוגמה ראו נספח 5
- המשך ביצוע מעקב בנשאיות: נשים שאותרו כנשאיות בסקר מופנות לביצוע מעקב במרפאות נשאיות מולטי-דיספלינריות. ביצוע מעקב במרפאות אלה נותן מענה קליני, ומאפשר ביצוע מעקב ומניעה יעילים יותר. בנוסף, ניתן מענה גם בתחום הרגשי[28][29][30]. הפנייה למרפאת נשאיות וטיפול עקבי בנשאיות עומד בקנה אחד עם אחד הקריטריונים לביצוע בדיקת סקר - קיומם של שירותים רפואיים לבדיקה ומעקב. ישנו עומס רב עד כדי אי קבלת נשאיות חדשות למעקב באזור המרכז והצפון. מומלץ לפעול להרחבת היצע התורים ולפתיחת מרפאות נוספות כך שקביעת התורים למרפאות הנשאיות תהיה זמינה באופן נגיש ושוויוני
- ביצוע סקר באוכלוסיות נוספות: יש לשקול על פי הממצאים בספרות והנתונים המקומיים ביצוע סקר גם באוכלוסיות נוספות (עדה/כפר/חמולה) בהן נמצא שיעור נשאות גבוה של מוטציות חוזרות
ביבליוגרפיה
- ↑ Rumford M, Lythgoe M, McNeish I, et al. Oncologist-led BRCA 'mainstreaming' in the ovarian cancer clinic: A study of 255 patients and its impact on their management. Sci Rep. 2020 Feb 25;10)1(:3390. doi: 10.1038/s41598-020-60149-5. PMID: 32098980; PMCID: PMC7042365
- ↑ 2.0 2.1 NCCN )National Comprehensive Cancer Network( Clinical Practice Guidelines in Oncology. Genetic/ Familial High-Risk Assessment: Breast and Ovarian, Version Version 2.2023
- ↑ Blair VR, McLeod M, Carneiro F, et al. Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol. 2020 Aug;21)8(:e386-e397. doi: 10.1016/S1470-2045)20(30219-9. PMID: 32758476; PMCID: PMC7116190
- ↑ Stjepanovic N, Moreira L, Carneiro F, et al. ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Hereditary gastrointestinal cancers: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-upt. Ann Oncol. 2019 Oct 1;30)10(:1558-1571. doi: 10.1093/annonc/ mdz233. PMID: 31378807.
- ↑ Vaidyanathan A, Kaklamani V. Understanding the Clinical Implications of Low Penetrant Genes and Breast Cancer Risk. Curr Treat Options Oncol. 2021 Aug 23;22)10(:85. doi: 10.1007/s11864-021-00887-4. PMID: 34424438
- ↑ Samadder NJ, Riegert-Johnson D, Boardman L, et al. Comparison of Universal Genetic Testing vs Guideline-Directed Targeted Testing for Patients With Hereditary Cancer Syndrome. JAMA Oncol. 2021 Feb 1;7)2(:230-237. doi: 10.1001/jamaoncol.2020.6252. Erratum in: JAMA Oncol. 2021 Feb 1;7)2(:312. PMID: 33126242; PMCID: PMC7600058
- ↑ Bartley AN, Mills AM, Konnick E, et al. Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy: Guideline From the College of American Pathologists in Collaboration With the Association for Molecular Pathology and Fight Colorectal Cancer. Arch Pathol Lab Med. 2022 Oct 1;146)10(:1194-1210. doi: 10.5858/arpa.2021-0632-CP. PMID: 35920830
- ↑ Cheng DT, Mitchell TN, Zehir A, et al. Memorial Sloan Kettering-Integrated Mutation Profiling of Actionable Cancer Targets (MSK-IMPACT): A Hybridization Capture-Based Next-Generation Sequencing Clinical Assay for Solid Tumor Molecular Oncology. J Mol Diagn. 2015 May;17)3(:251-64. doi: 10.1016/j. jmoldx.2014.12.006. Epub 2015 Mar 20. PMID: 25801821; PMCID: PMC5808190
- ↑ Garcia EP, Minkovsky A, Jia Y, Ducar MD, et al. Validation of OncoPanel: A Targeted Next-Generation Sequencing Assay for the Detection of Somatic Variants in Cancer. Arch Pathol Lab Med. 2017 Jun;141)6(:751-758. doi: 10.5858/arpa.2016-0527-OA. Epub 2017 Mar 3. PMID: 28557599
- ↑ Lincoln SE, Nussbaum RL, Kurian AW, et al. Yield and Utility of Germline Testing Following Tumor Sequencing in Patients With Cancer. JAMA Netw Open. 2020 Oct 1;3)10(:e2019452. doi: 10.1001/ jamanetworkopen.2020.19452. Erratum in: JAMA Netw Open. 2021 Jul 1;4)7(:e2123147. PMID: 33026450; PMCID: PMC7542302
- ↑ Terraf P, Pareja F, Brown DN, et al. Comprehensive assessment of germline pathogenic variant detection in tumor-only sequencing. Ann Oncol. 2022 Apr;33)4(:426-433. doi: 10.1016/j.annonc.2022.01.006. Epub 2022 Jan 21. PMID: 35074424; PMCID: PMC9172914
- ↑ Hyman DM, Taylor BS, Baselga J. Implementing Genome-Driven Oncology. Cell. 2017 Feb 9;168)4(:584- 599. doi: 10.1016/j.cell.2016.12.015. PMID: 28187282; PMCID: PMC5463457
- ↑ Mandelker D, Donoghue M, Talukdar S, et al. Germline-focussed analysis of tumor-only sequencing: recommendations from the ESMO Precision Medicine Working Group. Ann Oncol. 2019 Aug 1;30)8(:1221- 1231. doi: 10.1093/annonc/mdz136. Erratum in: Ann Oncol. 2021 Aug;32)8(:1069-1071. PMID: 31050713; PMCID: PMC6683854
- ↑ Horak P, Griffith M, Danos AM, et al. Standards for the classification of pathogenicity of somatic variants in cancer (oncogenicity): Joint recommendations of Clinical Genome Resource (ClinGen), Cancer Genomics Consortium (CGC), and Variant Interpretation for Cancer Consortium )VICC(. Genet Med. 2022 May;24)5(:986-998. doi: 10.1016/j.gim.2022.01.001. Epub 2022 Jan 29. Erratum in: Genet Med. 2022 Sep;24)9(:1991. PMID: 35101336; PMCID: PMC9081216
- ↑ King MC, Marks JH, Mandell JB; Breast and ovarian cancer risks due to inherited mutations in BRCA1 and BRCA2. Science. 2003, Oct 24;302)5645(:643-6. doi: 10.1126/science.1088759. PMID: 14576434
- ↑ Levy-Lahad E, Plon SE. Cancer. A risky business--assessing breast cancer risk. Fam Cancer. 2004;3)3- 4(:259-64. doi: 10.1126/science.1091465. PMID: 14576407
- ↑ Robles-D^az L, Goldfrank DJ, Kauff ND, et al. Hereditary ovarian cancer in Ashkenazi Jews. Fam Cancer. 2004;3)3-4(:259-64. doi: 10.1007/s10689-004-9552-0. PMID: 15516850
- ↑ Simchoni S, Friedman E, Kaufman B et al. Familial clustering of site-specific cancer risks associated with BRCA1 and BRCA2 mutations in the Ashkenazi Jewish population. Proc Natl Acad Sci USA 2006; 103)10(:3770-4. doi: 10.1073/pnas.0511301103. Epub 2006 Feb 28. PMID: 16537453; PMCID: PMC1450152
- ↑ Domchek SM, Friebel TM, Neuhausen SL, et al. Mortality after bilateral salpingo-oophorectomy in BRCA1 and BRCA2 mutation carriers: a prospective cohort study. Lancet Oncol. 2006 Mar;7)3(:223-9. doi: 10.1016/S1470-2045)06(70585-X. PMID: 16510331
- ↑ Levy-Lahad, E. and E Friedman. Cancer risks among BRCA1 and BRCA2 mutation carriers. British Journal of Cancer )2007( 96, 11 - 15. doi: 10.1038/sj.bjc.6603535. PMID: 17213823; PMCID: PMC2360226
- ↑ Roa BB, Boyd AA, Volcik K, Richards CS. Ashkenazi Jewish population frequencies for common mutations in BRCA1 and BRCA2. Nat Genet. 1996 Oct;14)2(:185-7. doi: 10.1038/ng1096-185. PMID: 8841191
- ↑ Kauff ND, Perez-Segura P, Robson ME, et al. Incidence of non-founder BRCA1 and BRCA2 mutations in high risk Ashkenazi breast and ovarian cancer families. J Med Genet. 2002 Aug;39)8(:611-4. doi: 10.1136/ jmg.39.8.611. PMID: 12161607; PMCID: PMC1735198
- ↑ Burke W, Coughlin SS, Lee NC, Weed DL, Khoury MJ. Application of population screening principles to genetic screening for adult-onset conditions. Genet Test. 2001 Fall;5)3(:201-11. doi: 10.1089/10906570152742245. PMID: 11788085
- ↑ Wilson JMG, Jungner F. Principles and practice of mass screening for disease. Public Health Paper No. 34 )World Health Organization, Geneva(
- ↑ Holtzman NA. Are we ready to screen for inherited susceptibility to cancer? Oncology 1996;10)1(:57-64; discussion 67. PMID: 8924366
- ↑ 3.2020 חוזר מנכ"ל mk03_2020 הרחבת סל הבריאות 2020
- ↑ Gabai-Kapara E, Lahad A, Kaufman B, et al. Population-based screening for breast and ovarian cancer risk due to BRCA1 and BRCA2. Proc Natl Acad Sci U S A. 2014 Sep 30;111)39(:14205-10. doi: 10.1073/ pnas.1415979111. Epub 2014 Sep 5. PMID: 25192939; PMCID: PMC4191771
- ↑ Pomerantz A, Tsoref D, Grubstein A, et al. Rate of breast biopsy referrals in female BRCA mutation carriers aged 50 years or more: a retrospective comparative study and matched analysis. Breast Cancer Res Treat. 2022 Jun;193)2(:507-514. doi: 10.1007/s10549-021-06498-9. Epub 2022 Apr 7. PMID: 35391652; PMCID: PMC9090689
- ↑ Hadar T, Mor P, Amit G, Lieberman S, Gekhtman D, Rabinovitch R, Levy-Lahad E. Presymptomatic Awareness of Germline Pathogenic BRCA Variants and Associated Outcomes in Women With Breast Cancer. JAMA Oncol. 2020 Sep 1;6)9(:1460-1463. doi: 10.1001/jamaoncol.2020.2059. PMID: 32644100; PMCID: PMC7349080
- ↑ Bernstein-Molho R, Kaufman B, Ben David MA, et al. Breast cancer surveillance for BRCA1/2 mutation carriers - is "early detection" early enough? Breast. 2020 Feb;49:81-86. doi: 10.1016/j.breast.2019.10.012. Epub 2019 Nov 6. PMID: 31760168; PMCID: PMC7375664
נספח 1 - טופס הפנייה לבדיקה גנטית
תאריך הבקשה:
אל קופת החולים:
טופס הפנייה לבדיקה אונקוגנטית (שד, שחלה, לבלב, קיבה, ערמונית, מעי, רחם)
פרטי רופא/ה מפנה:
שם: ד"ר _____________ מומחיות: _____________ מספר רישיון: _____________
מקום עבודה: _____________ טל. בעבודה: _____________
דוא"ל:________________________________________
פרטי מטופל/ת (מדבקה):
שם מלא: _____________ ת"ז: _____________ טל. נייד: _____________
אבחנה: _____________ גיל אבחנה: _____________
• מוצא אם: סב (אימהי) _____________ סבתא (אימהית): _____________
• מוצא אב: סב (אבהי) _____________ סבתא (אבהית): _____________
סיפור משפחתי של סרטן:
מצד האם (קירבה, סוג סרטן וגיל תחלואה) ____________________________________________________
מצד האב (קירבה, סוג סרטן וגיל תחלואה) ____________________________________________________
אחים/ילדים/אחיינים (קירבה, סוג סרטן וגיל תחלואה) ____________________________________________________
הבדיקה כוללת בשלב ראשון מוטציות נפוצות
אם הבדיקה תקינה, הבירור יורחב רק אם המטופל עונה על לפחות אחד מהבאים, לכן יש לסמן אם מתאים:
| שד | מתחת 50 |
| טריפל (-) מתחת 75 | |
| גבר | |
| גידול ממאיר נוסף | |
| לובולרי+ספור משפחתי של סרטן קיבה | |
| דו-צדדי מתחת 70 | |
| סיפור משפחתי (אותו צד הורי) אצל קרובים דרגה ראשונה/שנייה של (נא להקיף את המתאים): שחלה/לבלב/ערמונית high risk/שד גבר/שד בצעירה מ-50/ערמונית ב-2 קרובים נוספים מאותו צד הורי | |
| אם רלוונטי להתוויית טיפול | |
| שחלה אפיתליאלי | |
| לבלב אקסוקריני | |
| ערמונית | גרורתי מתקדם/סיכון גבוה (גליסון 7 ומעלה) |
| סיפור משפחתי (אותו צד הורי) אצל קרובים דרגה ראשונה/שנייה של (נא להקיף את המתאים): שד/מעי/רחם מתחת 50/שד בגבר/שחלה/לבלב/ערמונית מתקדם/מתחת 60/ערמונית ב-2 קרובים |
החולה קיבל/ה הסבר על משמעות הבדיקה הגנטית, קיבל/ה דף הסבר מפורט והופנ/תה לייעוץ גנטי שיבוצע לאחר קבלת תוצאות הבדיקה
מבקש/ת לאשר לה/ו בדיקת המוטציות הקשורות לסרטן מורש הנפוצות בישראל במסגרת קופת החולים / לספק טופס 17 עבור הבדיקה קוד משה"ב J1311 לביצוע במכון גנטי בבי"ח _______________________________________
□ אם הבדיקה תקינה, מומלץ המשך הבירור על ידי בדיקת פאנל נרחב.
נא להחזיר את התשובה למייל __________________________ או פקס __________________________.
חתימת הרופא/ה/יועצ/ת גנטי/ת המפנה: _______________________________________
נספח 2 - דף הסבר לבדיקה גנטית - רקע תורשתי לסרטן שד/שחלות/לבלב/ערמונית
שלום רב,
הופנית לבדיקה גנטית לאיתור שינויים גנטיים שכיחים (מוטציות נפוצות) באוכלוסייה בישראל במספר גנים הקשורים לסרטן על רקע תורשתי - BRCA1, BRCA2, CHEK2, MUTYH, MSH2, MSH6, MLH1, PMS2, APC, TP53.
אצל אחד מארבעים יהודים ממוצא אשכנזי קיים שינוי גנטי (מוטציה) באחד משני גנים - BRCA1 ו-BRCA2. בעדות אחרות בישראל השכיחות של מוטציות בגנים אלה נמוכה באופן משמעותי. לנשים הנושאות מוטציות בגנים אלה סיכון מוגבר לחלות בעיקר בסרטן שד ו/או סרטן שחלה ובשיעור נמוך יותר סרטן לבלב, ולגברים הנושאים מוטציות אלה עלול להיות סיכון מוגבר לסרטן ערמונית, שד, לבלב וייתכן גם לממאירויות אחרות. מעבר לשני הגנים הנזכרים למעלה, מוכרות מספר מוטציות שכיחות בגנים אחרים שקשורות לסיכון מוגבר לתחלואה בסרטן, בעיקר גידולי מערכת העיכול או גידולים גינקולוגיים. הבדיקה שתבוצע לך מתאימה כבירור ראשוני לאנשים ממוצא אשכנז, עיראק, אירן, אפגניסטן, תימן, צפון אפריקה, מדינות הבלקן, מזרח אירופה (לא יהודים), אתיופיה, ערבי מוסלמי או נוצרי. בדיקה ספציפית זו לא מהימנה עבור אנשים ממוצא קראי, דרוזי ומוצאים נוספים שלא נמנים ברשימה הנזכרת למעלה (במקרים אלה מומלץ לפנות לייעוץ גנטי לפני ביצוע הבדיקה).
ניתן למצוא שינויים בגנים הנזכרים למעלה בכ-35-15 אחוזים מהנשים שחלו בסרטן שחלות (תלוי במוצא), בכ-12-5 אחוזים מהנשים שחלו בסרטן שד (תלוי במוצא), בכ-20-5 אחוזים מהגברים שחלו בסרטן שד (תלוי במוצא), ובכ-3–12 אחוזים מחולי סרטן לבלב (תלוי במוצא).
לאנשים בריאים שנושאים מוטציות באחד הגנים הנ"ל מומלצת תוכנית מעקב ומניעה מוגברת מגיל צעיר, שעשויה להקטין את הסיכון לתחלואה ולתמותה.
הבדיקה מתבצעת על ידי לקיחת דגימת דם, לא מצריכה צום, ותשובותיה נשלחות תוך 2–6 שבועות לרופא המפנה.
לביצוע הבדיקה יש להצטייד במכתב הפנייה מהרופא. במקביל לביצוע הבדיקה מומלץ לתאם תור לייעוץ גנטי. הבדיקה הראשונית אליה הופנית לא מסבירה את כל המקרים בהם יש נטייה תורשתית לממאירות, ולכן גם אם לא מתגלה אחת המוטציות השכיחות הנבדקות (=תשובה שלילית/תשובה תקינה), לא ניתן לשלול רקע תורשתי לתחלואה. מסיבה זו את/ה מופנה/ית לייעוץ גנטי אחרי קבלת תוצאות הבדיקה. בייעוץ ניתן יהיה לדון על אפשרות להרחבת בירור וכן להמליץ על מעקב מתאים לך ולבני המשפחה המורחבת, בהתאם לסיפור המשפחתי הספציפי. אם את/ה מעוניין/נת לבדוק אפשרות של ביצוע בירור גנטי מקיף כבר כעת או לקבל מידע יותר מפורט על הבדיקה אליה הופנית, מומלץ לקבל ייעוץ גנטי לפני ביצוע הבדיקה.
קיבלתי הסבר על מהות הבדיקה מד"ר _________________________, ואני מעוניין/נת לבצע את הבדיקה לפני הייעוץ הגנטי.
שם: _________________________ חתימה:_________________________ תאריך: _________________________
שם הרופא/ה המסביר/ה: _________________________ חתימה וחותמת: _________________________
נספח 3 - סיכום ההתייחסות לווריאנטים עם חדירות נמוכה
ווריאנטים מסוג זה תוארו בגנים ספציפיים הקשורים לנטייה המורשת לפתח סרטן, אך שיעור העלייה בסיכון שיש לנשאי ווריאנטים אלה היא עד פי 2 יחסית לאוכלוסייה הכללית[1]. שלא כמו ווריאנטים פתוגניים בחדירות גבוהה, ווריאנטים אלו מעוררים מספר אתגרים וסוגיות ייחודיות בהתייחס לבירור והייעוץ הגנטי.
הם לרוב שכיחים באוכלוסייה הכללית או בתתי-אוכלוסיות מסוימות, ההשערה היא שתרומתם להיווצרות הסרטן היא מועטה וחלקית בלבד, כך שקרוב לוודאי שהשפעתם מצטרפת לגורמים רבים אחרים - גנטיים ושלא גנטיים (הורשה מולטיפקטוראלית, פוליגנית או אוליגוגנית). זיהויים בנבדק חולה בסרטן אינו מהווה הסבר בלעדי למחלה אצלו. ייתכן וחולה זה נושא בנוסף גם ווריאנט פתוגני אחר, המקנה סיכון גבוה יותר (חדירות גבוהה יותר) לסרטן. לכן, כאשר הם נבדקים במסגרת בדיקת מוטציות שכיחות ספציפיות, ישנו חשש שאיתורם בבדיקה יגרור מסקנה מוטעה שאותר הגורם התורשתי לסרטן, ולא יבוצע המשך בירור גנטי רחב יותר.
תחושת ביטחון כוזבת (False Reassurance) - קרובי משפחה של החולה אשר זוהה כנשא של אחד מווריאנטים אלו, אשר ייבדקו ויתגלה שאינם נושאים ווריאנט זה, עלולים לקבל תחושה מוטעה שהם אינם בסיכון מוגבר בשל הרקע המשפחתי, בעוד שהערכות הסיכון וההמלצות למעקב עבורם צריכות להתבסס על בסיס הקליניקה והפנוטיפ של סרטן במשפחה (בלי קשר לנוכחות או היעדר הווריאנט). היבט זה רלוונטי במיוחד למשפחות שבהן קיים חשד קליני גבוה לגורם תורשתי כאחראי עיקרי לתחלואה בסרטן.
על פי ה-NCCN התכנית למעקב וגילוי מוקדם צריכה להיות מבוססת על ממצאים גנטיים המוגדרים כפתוגניים או בסבירות גבוהה להיות פתוגניים בלבד, שלהם יש יישום קליני-מעשי[2].
על פי חוזר מנכ"ל מספר 13/2020[3] נבדקות 51 מוטציות נפוצות ב-10 גנים שונים כבדיקת הבסיס לחולי סרטן שד, שחלה, לבלב, מערכת העיכול, רחם, גידולים האופייניים לתסמונת Lynch.
במסגרת בדיקה זו נבדקים גם 2 וריאנטים שמתאימים להגדרה של ווריאנטים עם חדירות נמוכה:
- c.3920T<A:p.l1307K בגן APC
- c.1283C<T;p. S428F בגן CHEK2
לגבי ווריאנטים אלו, לא ניתן לומר שנוכחותם אצל חולה סרטן ו/או אצל נבדק עם רקע משפחתי של סרטן מהווה הסבר מספק להתפתחות הממאירות אצל החולה הנבדק, או בקרב בני המשפחה שחלו בסרטן.
כלומר, לא ניתן לשלול שקיים גורם גנטי אחר להתפתחות הסרטן אצלו, וגם ההמלצות למעקב אצל קרובי המשפחה של חולה הסרטן לא יהיו שונות בצורה משמעותית בקרב קרובי המשפחה שנבדקו ונמצאו נשאי הווארינט, וקרובי המשפחה שלא ירשו את הווארינט. כלומר הממצא הגנטי בגן בעל חדירות נמוכה אינו בעל משמעות יישומית מבחינת ההמלצות ועזרה בהתווית משטר המעקב לגילוי מוקדם.
c.1283C>T;p. S428F בגן CHEK2: שינוי זה ידוע כמוטציית אב מייסד ששכיחותה כ-1 אחוז באשכנזים, ונדירה באוכלוסיות אחרות. על פי מחקר שבדק את הסיכון לסרטן בקרב נשאיות של ווארינט זה בישראל, מצא כי ככל הנראה שינוי זה בגן אינו מעלה באופן מובהק את הסיכון ללקות בסרטן השד או המעי הגס[4]. כמו כן, מחקר רטרוספקטיבי גדול שפורסם בספטמבר 2022[5] הראה כי שינוי זה אינו קשור באופן מובהק עם עלייה בסיכון לפתח סוגי סרטן שונים, כולל סרטן שד או המעי הגס. לציין כי מאמר זה לא הדגים קשר לסרטן מעי גס בנשאי מוטציה כלשהי בגן CHEK2 בין אם מדובר במוטציות מסוג LOF או Missense. על פי הנחיות ה-NCCN המעודכנות - נוכחות ווריאנט זה לא משנה את ההמלצות למעקב. כלומר, בעת כתיבת נייר העמדה ניתן לומר שהמידע בספרות מבוסס דיו על מנת לקבוע היעדר סיכון מוגבר לסרטן (שד או מעי) אצל נשים נשאיות לעומת נשים שאינן נשאיות[5].
c.3920T>A:p.l1307K בגן APC: ווריאנט זה שכיח יחסית באנשים ממוצא אשכנזי (9-5 אחוזים לעומת 1–2 אחוזים באוכלוסייה הכללית)[6][7][8] ומצוי גם באוכלוסיות שונות (מצרים, ערבים ישראלים). ווריאנט זה נמצא כמעלה את הסיכון לסרטן המעי הגס באופן מתון (בערך פי 2 יחסית לסיכון הרקע הקיים באוכלוסייה - סיכון אבסולוטי של בין 5–10 אחוזים)[9][10][11][12][13]. שתי עבודות הראו סיכון מעט מוגבר גם לממאירויות אחרות[14][15] אולם בשלב זה לא הביאו להמלצות ייחודיות למעקב פרט למעקב קולונסקופיות. על פי ה-NCCN: לנשאים ונשאיות של מוטציה זו, גם ללא רקע משפחתי של סרטן המעי הגס, מומלץ מעקב קולונוסקופי מגיל 40 בתדירות של כל 5 שנים.
בשל ההמלצה למעקב קולונוסקופיה מגיל 40 לעומת גיל 50 כמקובל באוכלוסייה, מדובר בשלב זה בווריאנט שהוא actionable, לכן יש לדווח עליו אם מאותר בבדיקה של פאנל רחב, כ-risk factor, אולם אין מקום לכלול אותו במסגרת בדיקה מצומצמת של מוטציות נפוצות. ניתן למסור את תשובת הנשאות ללא צורך בייעוץ גנטי.
המלצה: לא לכלול ווריאנטים בעלי חדירות נמוכה בבדיקת המוטציות הנפוצות. בבדיקת פאנל רחב - לא לדווח על הווריאנט ב-check2, לדווח על APC כ-risk factor.
ביבליוגרפיה
- ↑ Samadder NJ, Riegert-Johnson D, Boardman L, et al. Comparison of Universal Genetic Testing vs Guideline-Directed Targeted Testing for Patients With Hereditary Cancer Syndrome. JAMA Oncol. 2021 Feb 1;7)2(:230-237. doi: 10.1001/jamaoncol.2020.6252. Erratum in: JAMA Oncol. 2021 Feb 1;7)2(:312. PMID: 33126242; PMCID: PMC7600058
- ↑ NCCN )National Comprehensive Cancer Network( Clinical Practice Guidelines in Oncology. Genetic/ Familial High-Risk Assessment: Breast and Ovarian, Version Version 2.2023
- ↑ 13.2020 חוזר מנכ"ל https://www.health.gov.il/hozer/mr13_2020.pdf בדיקות אונקוגנטיות מולקולריות לאיתור מוטציות תורשתיות בחולי סרטן (שד, שחלה, לבלב, מערכת העיכול, רחם, גידולים אופיינים לתסמונת Lynch)
- ↑ Laitman Y, Nielsen SM, Hatchell KE, et al. Re-evaluating cancer risks associated with the CHEK2 p.Ser428Phe Ashkenazi Jewish founder pathogenic variant. Fam Cancer. 2022 Jul;21)3(:305-308. doi: 10.1007/s10689-021-00278-6. Epub 2021 Oct 8. PMID: 34622392
- ↑ 5.0 5.1 ychkovsky BL, Agaoglu NB, Horton C, et al. Differences in Cancer Phenotypes Among Frequent CHEK2 Variants and Implications for Clinical Care-Checking CHEK2. JAMA Oncol. 2022 Nov 1;8)11(:1598-1606. doi: 10.1001/jamaoncol.2022.4071. PMID: 36136322; PMCID: PMC9501803
- ↑ Boursi B, Sella T, Liberman E, et al. The APC p.I1307K polymorphism is a significant risk factor for CRC in average risk Ashkenazi Jews. Eur J Cancer. 2013 Nov;49)17(:3680-5. doi: 10.1016/j.ejca.2013.06.040. Epub 2013 Jul 26. PMID: 23896379
- ↑ Frayling IM, Beck NE, Ilyas M, et al. The APC variants I1307K and E1317Q are associated with colorectal tumors, but not always with a family history. Proc Natl Acad Sci U S A. 1998 Sep 1;95)18(:10722-7. doi: 10.1073/pnas.95.18.10722. PMID: 9724771; PMCID: PMC27962
- ↑ Liang J, Lin C, Hu F, Wang F, Zhu L, Yao X, Wang Y, Zhao Y. APC polymorphisms and the risk of colorectal neoplasia: a HuGE review and meta-analysis. Am J Epidemiol. 2013 Jun 1;177)11(:1169-79. doi: 10.1093/ aje/kws382. Epub 2013 Apr 10. PMID: 23576677
- ↑ Rozen P, Shomrat R, Strul H, et al. Prevalence of the I1307K APC gene variant in Israeli Jews of differing ethnic origin and risk for colorectal cancer. Gastroenterology. 1999 Jan;116)1(:54-7. doi: 10.1016/s0016- 5085)99(70228-3. PMID: 9869602
- ↑ Gryfe R, Di Nicola N, Lal G, Gallinger S, Redston M. Inherited colorectal polyposis and cancer risk of the APC I1307K polymorphism. Am J Hum Genet. 1999 Feb;64)2(:378-84. doi: 10.1086/302262. PMID: 9973276; PMCID: PMC1377748
- ↑ Laken SJ, Petersen GM, Gruber SB, et al. Familial colorectal cancer in Ashkenazim due to a hypermutable tract in APC. Nat Genet. 1997 Sep;17)1(:79-83. doi: 10.1038/ng0997-79. PMID: 9288102
- ↑ Boursi B, Sella T, Liberman E, et al. The APC p.I1307K polymorphism is a significant risk factor for CRC in average risk Ashkenazi Jews. Eur J Cancer. 2013 Nov;49)17(:3680-5. doi: 10.1016/j.ejca.2013.06.040. Epub 2013 Jul 26. PMID: 23896379
- ↑ Liang J, Lin C, Hu F, et al. APC polymorphisms and the risk of colorectal neoplasia: a HuGE review and meta-analysis. Am J Epidemiol. 2013 Jun 1;177)11(:1169-79. doi: 10.1093/aje/kws382. Epub 2013 Apr 10. PMID: 23576677
- ↑ Leshno A, Shapira S, Liberman Eet al. The APC I1307K allele conveys a significant increased risk for cancer. Int J Cancer. 2016 Mar 15;138)6(:1361-7. doi: 10.1002/ijc.29876. Epub 2015 Oct 13. PMID: 26421687
- ↑ Forkosh E, Bergel M, Hatchell KE, et al. Ashkenazi Jewish and Other White APC I1307K Carriers Are at Higher Risk for Multiple Cancers. Cancers )Basel(. 2022 Nov 29;14)23(:5875. doi: 10.3390/ cancers14235875. PMID: 36497357; PMCID: PMC9740723
נספח 4 - סיכום המלצות מעקב לנשאיות ונשאים עם מוטציה ב-BRCA1/2
מוטציות בגנים BRCA1/2 מהוות את גורם הסיכון המשמעותי ביותר לתחלואה בסרטן שד ושחלות בנשים. בנוסף, במחקר שמבוסס על נתוני למעלה מ-5300 משפחות שפורסם ב-JCO[1], מדווח שמוטציות ב-BRCA2 מעלות סיכון לסרטן הערמונית ושד בגברים במידה משמעותית מעל הסיכון של לא נשאים. באותו מחקר לא נמצא קשר בין מוטציות ב-BRCA1 לסרטן ערמונית, והעלייה בסיכון לסרטן שד בגברים עם מוטציות ב-BRCA1 היא מינימלית (סיכון האבסולוטי של 0.4 אחוזים). מוטציות בשני הגנים BRCA1/2 אכן קשורות לעלייה משמעותית סטטיסטית בסיכון לסרטן לבלב וקיבה, אך גם במקרה זה מדובר בסיכון אבסולוטי של בין 3–5 אחוזים במהלך החיים. בנוסף נשלל קשר לגידולי רחם, מלנומה, מלנומה של העין ומספר ממאירויות נוספות.
בדיקות הסקר שנכנסו לסל ב-2020 ועלייה בשימוש בבדיקות גנומיות בחולי סרטן גרורתיים, צפויות להביא לזיהוי מספר רב של נשאיות בריאות (ובעקבותיהן גם בני משפחה גברים נשאים), מה שצפוי להביא לעלייה בצריכת שירותי רפואה, ביניהם ייעוצים גנטיים, ביקורי רופאים מקצועיים, בדיקות דימות, ביופסיות, ניתוחים מקטיני סיכון ועוד. יש מחסור בתורים לייעוצים גנטיים אחרי קבלת תוצאות חיוביות בבדיקות סקר, וזמינות נמוכה של מרפאות מעקב לנשים נשאיות בסיכון. נושא המעקב אחרי גברים נשאים עדיין שנוי במחלוקת. הקמה של מרפאות נשאיות נוספות לא אפשרית בכל מרכז רפואי או בקהילה, לפעמים בגלל סיבות כלכליות ולפעמים בשל היעדר כוח אדם. לכן יש חשיבות ליצור הנחיות ארציות אחידות כדי לאפשר סנכרון מבחינת מתן המלצות במהלך ייעוצים גנטיים מחד, ולנהל מעקב סדור בקהילה אחרי אותן נשים שלא יכולות או לא מעוניינות להיכנס למעקב במרפאת נשאיות במרכזים שלישוניים.
אחרי סקירת הנחיות של 15 איגודים וארגונים מקצועיים בעולם (במאמר שהוגש לסקירה), נראה שיש פער משמעותי מבחינת המלצות מעקב לנשים ולגברים נשאיות/ים BRCA1/2 בין המדינות השונות, כשעיקר ההבדלים נצפים בהמלצות לגבי גיל של התחלת מעקב ותדירות המעקב לגילוי מוקדם של סרטן שד בנשים, גיל הפסקת מעקב הדמייתי, אופן המעקב אצל נשים לאחר ביצוע ניתוחים מקטיני סיכון, ושיטות הדימות בגילאים השונים. פערים אלה נובעים בחלק מהמקרים משיקולי עלות תועלת, מאיכות המחקרים, וגם בשל פרשנות שונה של הנתונים בספרות המקצועית. אחרי מעבר על ההנחיות הבינלאומיות המפורסמות בשפה האנגלית, גיבשנו טיוטת המלצות כדי שלאחר אישורן תאומצנה על ידי האיגוד הגנטי בישראל ותפורסמנה כהנחיות ארציות כמפורט בהמשך:
- ניתן להציע לנשים בריאות עם מוטציה ב-BRCA2 טיפול בטמוקסיפן או מעכבי ארומטאז, אך המידע על יעילות של טיפולים אלה כטיפול מקטין סיכון לסרטן שד מתבסס על מספרים קטנים של נשאיות שנכללו במחקרי מניעה של אוכלוסיית נשים המוגדרת בסיכון ללא רקע תורשתי מוכח (כלומר נשאיות של BRCA) לתחלואה[2]
- ניתן להציע לנשאיות טיפול בגלולות למניעת היריון כאמצעי מניעה כיוון שבמספר מטא-אנליזות לא נצפתה עלייה בסיכון לסרטן שד על רקע טיפול זה מחד ונצפתה ירידה ברורה בסיכון לסרטן שחלות[3][4][5] אין להציע טיפול זה כאמצעי יחיד להקטנת סיכון לסרטן שחלות או במקום ניתוח כריתת שחלות וחצוצרות
- יש לדון עם כל הנשאיות על אפשרות כריתת שדיים מקטינת סיכון, בייחוד בנשים עם מוטציה ב-BRCA1 לאור נתונים על שיפור ההישרדות הכללית בעקבות ניתוח זה[6]. כמו כן, חשוב להסביר לנשים כי משמעות של גילוי מוקדם לא זהה למניעת מחלה, ושגם גילוי מוקדם של סרטן שד בנשאיות עדיין כרוך בחלק מהמקרים בטיפול אונקולוגי שיכלול כימותרפיה ו/או קרינה[7]
- אין הצדקה להציע לנשאיות כריתת רחם בשל נתונים לא עקביים לגבי עלייה בסיכון לסרטן רחם, וגם במחקרים שדיווחו על עליית סיכון, הרי שהסיכון האבסולוטי הוערך בפחות מ-5 אחוזים[8][9][10][11][12]. ניתן לדון על אפשרות של ניתוח זה בהקשר למתן טיפול הורמונלי חליפי על בסיס אסטרוגן בלבד אחרי ניתוח כריתת שחלות בנשאיות ללא רקע של סרטן שד, או בחולות סרטן שד שצפויות לקבל טמוקסיפן או אם יש התוויה גינקולוגית להסרת הרחם (שרירנים וצניחת רחם)
- מעקב שד בנשים:
- בדיקת כירורג כל 12-6 חודשים החל מגיל 25, או 5–10 שנים מוקדם יותר מגיל התחלואה הכי צעיר במשפחה (המוקדם בהם)
- מעקב MRI (Magnetic Resonance Imaging) אחת לשנה בין גילאים 25–70, מעל גיל 70 רק בנשים עם צפיפות שד גבוהה
- ממוגרפיה שנתית בין גילאי 30–75, ניתן לשקול לדחות התחלת מעקב ממוגרפי לגיל 35, ואף 40 בנשאיות מוטציה ב-BRCA1 כפי שמוצע על ידי חלק מהעבודות[13][14]. לציין כי מהנתונים של שיבא בנשאיות ידועות תחת מעקב, מתוך 100 נשאיות מוטציה ב-BRCA1 שאובחנו עם סרטן שד במסגרת מעקב, אף אחת לא אובחנה מתחת לגיל 40 עם ממוגרפיה (ומעל גיל 40 רק 3 אובחנו בממוגרפיה)
- אין המלצה לביצוע US שגרתי בנשאיות, אלא כהשלמה לממוגרפיה עם ממצא לא ברור או כשלא ניתן לבצע MRI. במהלך היריון/הנקה - בהיעדר ספרות בנושא, ולאור נתונים משיבא שדיווחו על כ-2 אחוזים סיכוי לאתר סרטן שד במהלך היריון[15], ניתן לשקול מעקב סונוגרפי פעם ב-4–6 חודשים
- אחרי כריתת שדיים מקטינת סיכון אין המלצות למעקב הדמייתי שגרתי, עקב סיכון אבסולוטי לתחלואה שמוערך בפחות מ-2 אחוזים במעקב של 2–13 שנים[16]. ניתן לשקול מעקב MRI בנשים אחרי כריתה משמרת עור/פטמה, ובהתאם לכמות רקמת השד שנשארה לאחר כריתה
- מעקב שד בגברים - לאור סיכון אבסולוטי של פחות מ-1 אחוזים בנשאי מוטציה ב-BRCA1, ועד 7 אחוזים בנשאי מוטציה ב-BRCA2[1], נכון להציע מעקב קליני רק בנשאי מוטציה ב-BRCA2 מגיל 45–50 (או בהתאם לגילאי התחלואה אצל גברים במשפחה), ומודעות/בדיקה עצמית בלבד בנשאי מוטציה ב-BRCA1
- מעקב גינקולוגי לפני כריתת שחלות וחצוצרות - המעקב שכולל US וגינלי כל 6 חודשים ובדיקת CA125 לא מומלץ על ידי אף גוף מקצועי, כיוון שהמחקרים לא הראו יתרון בהישרדות של נשים תחת מעקב זה, אף על פי שהייתה עלייה מסוימת באחוז הגידולים המאובחנים בשלב מוקדם[17][18][19]. חלק מהאיגודים ממליצים לשקול מעקב כזה. אין המלצה להמשיך מעקב מרקרים או מעקב מעבר לשגרתי באוכלוסייה אחרי כריתת שחלות/חצוצרות
- מעקב לסרטן לבלב - בשלב זה לאור level of evidence נמוך מאוד, מומלץ לשקול בלבד[20]. אמנם האיגוד האמריקאי לאנדוסקופיה גסטרואינטסטינלית ממליץ על משטר מעקב לגילוי מוקדם של סרטן לבלב לכלל הנשאים, אבל הקונצנזוס המסתמן בשלב זה הוא שצריך לדון על כך רק בנוכחות קרוב משפחה מדרגה ראשונה אחד או שניים בדרגת קרבה שנייה מאותו הצד עם סרטן לבלב, מגיל 50 (או מוקדם יותר בהתאם לגילאי התחלואה במשפחה). מעקב זה יכול לכלול MRCP (Magnetic Resonance Cholangiopancreatography) ו/או EUS (Endoscopic Ultrasound) שנתי המתחלפים - כלומר הדמיית לבלב מדי שנה באחד מאמצעי הדמיה אלה
- מעקב לסרטן ערמונית - יש מקום להתחיל מעקב PSA (Prostate Specific Antigen) מגיל 40 לנשאי מוטציה ב-BRCA2 לאור נתונים על מחלה אגרסיבית יותר וגיל תחלואה צעיר יותר בנשאים[21][22]. לאור הנתונים האחרונים שפורסמו[1], מעקב נשאי מוטציה ב-BRCA1 יכול להתבצע כמקובל באוכלוסייה ללא צורך במעקב תכוף יותר או מגיל צעיר יותר
- מעקב לסוגי סרטן אחרים:
- מעקב גסטרוסקופי - בהתאם להיסטוריה המשפחתית תוך התחשבות במספר חולי סרטן הקיבה, קרבתם לנשא וגיל האבחנה אצלם, שכן הסיכון האבסולוטי הוא נמוך[1]
- אין צורך במעקב ייחודי למלנומה עורית, מלנומה של גלגל העין או סרטן מעי גס בקרב נשאים, אלא התאמת המעקב לפי ההיסטוריה המשפחתית ללא קשר לנשאות - כמקובל לקרובי משפחה של חולים בסוגי סרטן אלה
- מתן HRT אחרי כריתת שחלות - הנושא עדיין שנוי במחלוקת[23][24][25], וכך גם משתקף בהנחיות השונות. יש לדון עם כל אישה באופן פרטני על סיכונים ותועלת מטיפול זה
- אחר - אין עלייה בסיכון לתחלואה על רקע טיפולי הפריה חוץ-גופית[26][27][28][29]. ניתן להציע לפי הצורך
סיכום ההמלצות:
| נשים | |
| בדיקת שד ידנית כל 6 חודשים | מגיל 25 (או קודם אם התחלואה במשפחה מתחת לגיל 30), ללא הגבלת גיל |
| MRI שנתי | מגיל 25 עד 70 (מעל 70 רק בנשים עם רקמת שד צפופה - C/D) |
| ממוגרפיה שנתית | 75-30
בנשאיות BRCA1 - לשקול להתחיל מגיל 35 ואף 40 מעל 75 - בהתאם למחלות רקע ותוחלת חיים צפויה |
| US שנתי | לא מומלץ אלא כהשלמה לממוגרפיה/ממצא נמוש או כשלא ניתן לבצע MRI |
| מעקב במהלך היריון/הנקה | לשקול US כל 4–6 חודשים |
| מעקב כירורגי לאחר כריתת שדיים | בדיקה ידנית בלבד, לשקול MRI בנשים אחרי כריתה משמרת עור/פטמה, ובהתאם לכמות רקמת השד שנשארה |
| מעקב לסרטן שחלות | לא מומלץ בשגרה. לשקול בדיון עם האישה תוך הסבר על מגבלות מעקב זה |
| כריתת שחלות/חצוצרות | להמליץ בין 35–40 בנשאיות מוטציה ב־BRCA1.
להמליץ בין 40–45 בנשאיות מוטציה ב-BRCA2 ועם סיום תוכנית הילודה. בשלב זה כריתת חצוצרות ללא שחלות לא מומלצת, אלא במסגרת מחקר. |
| מעקב רופא נשים אחרי כריתת שחלות | לא מומלץ באופן שגרתי |
| HRT אחרי כריתת שחלות | לדון על סיכונים מול תועלת, אין התוויית נגד מוחלטת |
| כריתת רחם | לא מומלץ רוטינית אלא כאשר יש התוויה גינקולוגית או דיון עם מי שעתידה להיות מטופלת בטמוקסיפן או HRT מכיל אסטרוגן |
| גברים | |
| מעקב ערמונית על ידי בדיקת PSA | מגיל 40 בנשאי מוטציה ב-BRCA2
בנשאי מוטציה ב-BRCA1 - כמקובל באוכלוסייה הכללית |
| כולם | |
| קולונוסקופיה | כמקובל באוכלוסייה ובהתאם לסיפור המשפחתי |
| גסטרוסקופיה | בהתאם לסיפור המשפחתי |
| מעקב לבלב (MRCP/EUS) | לדון על מגבלות המעקב, לשקול בנוכחות קרוב משפחה מדרגה ראשונה אחד, או שניים מדרגת קרבה שנייה מאותו צד של המשפחה עם סרטן לבלב, מגיל 50 (או מוקדם יותר בהתאם לגילאי התחלואה במשפחה) |
| עור | בהתאם לסיפור המשפחתי וגוון העור/מידת חשיפה לשמש |
| מומלץ לעודד נשאים ונשאיות להשתתף במחקרים בנושא מניעה/טיפולים מקטיני סיכון | |
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 Li, S.; Silvestri, V.; Leslie, G.; Rebbeck, T.R.; Neuhausen, S.L.; Hopper, J.L.; Nielsen, H.R.; Lee, A.; Yang, X.; McGuffog, L.; et al. Cancer Risks Associated With BRCA1 and BRCA2 Pathogenic Variants. JCO 2022, 40, 1529-1541, doi:10.1200/JCO.21.02112.
- ↑ King, M.-C.; Wieand, S.; Hale, K.; Lee, M.; Walsh, T.; Owens, K.; Tait, J.; Ford, L.; Dunn, B.K.; Costantino, J.; et al. Tamoxifen and Breast Cancer Incidence Among Women With Inherited Mutations in BRCA1 and BRCA2National Surgical Adjuvant Breast and Bowel Project )NSABP-P1( Breast Cancer Prevention Trial. JAMA 2001, 286, 2251-2256, doi:10.1001/jama.286.18.2251
- ↑ Friebel, T.M.; Domchek, S.M.; Rebbeck, T.R. Modifiers of Cancer Risk in BRCA1 and BRCA2 Mutation Carriers: Systematic Review and Meta-Analysis. J Natl Cancer Inst 2014, 106, dju091, doi:10.1093/jnci/ dju091
- ↑ Iodice, S.; Barile, M.; Rotmensz, N.; Feroce, I.; Bonanni, B.; Radice, P.; Bernard, L.; Maisonneuve, P.; Gandini, S. Oral Contraceptive Use and Breast or Ovarian Cancer Risk in BRCA1/2 Carriers: A Meta-Analysis. European Journal of Cancer 2010, 46, 2275-2284, doi:10.1016/j.ejca.2010.04.018
- ↑ Moorman, P.G.; Havrilesky, L.J.; Gierisch, J.M.; Coeytaux, R.R.; Lowery, W.J.; Peragallo Urrutia, R.; Dinan, M.; McBroom, A.J.; Hasselblad, V.; Sanders, G.D.; et al. Oral Contraceptives and Risk of Ovarian Cancer and Breast Cancer Among High-Risk Women: A Systematic Review and Meta-Analysis. JCO 2013, 31, 41884198, doi:10.1200/JCO.2013.48.9021
- ↑ Heemskerk-Gerritsen, B.A.M.; Jager, A.; Koppert, L.B.; Obdeijn, A.I.-M.; Collee, M.; Meijers-Heijboer, H.E.J.; Jenner, D.J.; Oldenburg, H.S.A.; van Engelen, K.; de Vries, J.; et al. Survival after Bilateral Risk-Reducing Mastectomy in Healthy BRCA1 and BRCA2 Mutation Carriers. Breast Cancer Res Treat 2019, 177, 723733, doi:10.1007/s10549-019-05345-2
- ↑ Bernstein-Molho, R.; Kaufman, B.; Ben David, M.A.; Sklair-Levy, M.; Feldman, D.M.; Zippel, D.; Laitman, Y.; Friedman, E. Breast Cancer Surveillance for BRCA1/2 Mutation Carriers - Is ”Early Detection” Early Enough? The Breast 2020, 49, 81-86, doi:10.1016/j.breast.2019.10.012
- ↑ Shu, C.A.; Pike, M.C.; Jotwani, A.R.; Friebel, T.M.; Soslow, R.A.; Levine, D.A.; Nathanson, K.L.; Konner, J.A.; Arnold, A.G.; Bogomolniy, F.; et al. Uterine Cancer after Risk-Reducing Salpingo-Oophorectomy without Hysterectomy in Women with BRCA Mutations. JAMA Oncol 2016, 2, 1434-1440, doi:10.1001/ jamaoncol.2016.1820
- ↑ de Jonge, M.M.; de Kroon, C.D.; Jenner, D.J.; Oosting, J.; de Hullu, J.A.; Mourits, M.J.E.; Gomez Garcia, E.B.; Ausems, M.G.E.M.; Margriet Collee, J.; van Engelen, K.; et al. Endometrial Cancer Risk in Women With Germline BRCA1 or BRCA2 Mutations: Multicenter Cohort Study. J Natl Cancer Inst 2021, 113, 12031211, doi:10.1093/jnci/djab036
- ↑ Pennington, K.P.; Walsh, T.; Lee, M.; Pennil, C.; Novetsky, A.P.; Agnew, K.J.; Thornton, A.; Garcia, R.; Mutch, D.; King, M.-C.; et al. BRCA1, TP53, and CHEK2 Germline Mutations in Uterine Serous Carcinoma. Cancer 2013, 119, 332-338, doi:10.1002/cncr.27720
- ↑ Biron-Shental, T.; Drucker, L.; Altaras, M.; Bernheim, J.; Fishman, A. High Incidence of BRCA1-2 Germline Mutations, Previous Breast Cancer and Familial Cancer History in Jewish Patients with Uterine Serous Papillary Carcinoma. European Journal of Surgical Oncology 2006, 32, 1097-1100, doi:10.1016/j. ejso.2006.03.032.
- ↑ Laitman, Y.; Michaelson-Cohen, R.; Levi, E.; Chen-Shtoyerman, R.; Reish, O.; Josefsberg Ben-Yehoshua, S.; Bernstein-Molho, R.; Keinan-Boker, L.; Rosengarten, O.; Silverman, B.G.; et al. Uterine Cancer in Jewish Israeli BRCA1/2 Mutation Carriers. Cancer 2019, 125, 698-703, doi:10.1002/cncr.31842.
- ↑ Contribution of Mammography to MRI Screening in BRCA Mutation Carriers by BRCA Status and Age: Individual Patient Data Meta-Analysis
- ↑ Heijnsdijk, E.A.M.; Warner, E.; Gilbert, F.J.; Tilanus-Linthorst, M.M.A.; Evans, G.; Causer, P.A.; Eeles, R.A.; Kaas, R.; Draisma, G.; Ramsay, E.A.; et al. Differences in Natural History between Breast Cancers in BRCA1 and BRCA2 Mutation Carriers and Effects of MRI Screening-MRISC, MARIBS, and Canadian Studies Combined. Cancer Epidemiology, Biomarkers & Prevention 2012, 21, 1458-1468, doi:10.1158/1055-9965. EPI-11-1196
- ↑ Faermann, R.; Friedman, E.; Kaidar-Person, O.; Brodsky, M.; Neiman, O.H.; Shalmon, A.; Gotlieb, M.; Yagil, Y.; Samocha, D.; Feldman, D.M.; et al. Pregnancy Associated Breast Cancer Among Israeli BRCA1/BRCA2 Carriers in a High-Risk Clinic. Acad Radiol 2022, S1076-6332)22(00207-0, doi:10.1016/j.acra.2022.03.030
- ↑ Ludwig, K.K.; Neuner, J.; Butler, A.; Geurts, J.L.; Kong, A.L. Risk Reduction and Survival Benefit of Prophylactic Surgery in BRCA Mutation Carriers, a Systematic Review. The American Journal of Surgery 2016, 212, 660-669, doi:10.1016/j.amjsurg.2016.06.010
- ↑ Rosenthal, A.N.; Fraser, L.S.M.; Philpott, S.; Manchanda, R.; Burnell, M.; Badman, P.; Hadwin, R.; Rizzuto, I.; Benjamin, E.; Singh, N.; et al. Evidence of Stage Shift in Women Diagnosed With Ovarian Cancer During Phase II of the United Kingdom Familial Ovarian Cancer Screening Study. J Clin Oncol 2017, 35, 14111420, doi:10.1200/JCO.2016.69.9330
- ↑ Menon, U.; Gentry-Maharaj, A.; Hallett, R.; Ryan, A.; Burnell, M.; Sharma, A.; Lewis, S.; Davies, S.; Philpott, S.; Lopes, A.; et al. Sensitivity and Specificity of Multimodal and Ultrasound Screening for Ovarian Cancer, and Stage Distribution of Detected Cancers: Results of the Prevalence Screen of the UK Collaborative Trial of Ovarian Cancer Screening )UKCTOCS(. The Lancet Oncology 2009, 10, 327-340, doi:10.1016/ S1470-2045)09(70026-9
- ↑ Jacobs, I.J.; Menon, U.; Ryan, A.; Gentry-Maharaj, A.; Burnell, M.; Kalsi, J.K.; Amso, N.N.; Apostolidou, S.; Benjamin, E.; Cruickshank, D.; et al. Ovarian Cancer Screening and Mortality in the UK Collaborative Trial of Ovarian Cancer Screening )UKCTOCS(: A Randomised Controlled Trial. Lancet 2016, 387, 945-956, doi:10.1016/S0140-6736)15(01224-6
- ↑ Sawhney, M.S.; Calderwood, A.H.; Thosani, N.C.; Rebbeck, T.R.; Wani, S.; Canto, M.I.; Fishman, D.S.; Golan, T.; Hidalgo, M.; Kwon, R.S.; et al. ASGE Guideline on Screening for Pancreatic Cancer in Individuals with Genetic Susceptibility: Summary and Recommendations. Gastrointestinal Endoscopy 2022, 95, 817-826, doi:10.1016/j.gie.2021.12.001
- ↑ Mitra, A.; Fisher, C.; Foster, C.S.; Jameson, C.; Barbachanno, Y.; Bartlett, J.; Bancroft, E.; Doherty, R.; Kote-Jarai, Z.; Peock, S.; et al. Prostate Cancer in Male BRCA1 and BRCA2 Mutation Carriers Has a More Aggressive Phenotype. Br J Cancer 2008, 98, 502-507, doi:10.1038/sj.bjc.6604132
- ↑ Castro, E.; Goh, C.; Olmos, D.; Saunders, E.; Leongamornlert, D.; Tymrakiewicz, M.; Mahmud, N.; Dadaev, T.; Govindasami, K.; Guy, M.; et al. Germline BRCA Mutations Are Associated With Higher Risk of Nodal Involvement, Distant Metastasis, and Poor Survival Outcomes in Prostate Cancer. J Clin Oncol 2013, 31, 1748-1757, doi:10.1200/JCO.2012.43.1882
- ↑ Kotsopoulos, J.; Gronwald, J.; Karlan, B.Y.; Huzarski, T.; Tung, N.; Moller, P.; Armel, S.; Lynch, H.T.; Senter, L.; Eisen, A.; et al. Hormone Replacement Therapy After Oophorectomy and Breast Cancer Risk Among BRCA1 Mutation Carriers. JAMA Oncol 2018, 4, 1059-1066, doi:10.1001/jamaoncol.2018.0211
- ↑ Rebbeck, T.R.; Friebel, T.; Wagner, T.; Lynch, H.T.; Garber, J.E.; Daly, M.B.; Isaacs, C.; Olopade, O.I.; Neuhausen, S.L.; van 't Veer, L.; et al. Effect of Short-Term Hormone Replacement Therapy on Breast Cancer Risk Reduction After Bilateral Prophylactic Oophorectomy in BRCA1 and BRCA2 Mutation Carriers: The PROSE Study Group. JCO 2005, 23, 7804-7810, doi:10.1200/JCO.2004.00.8151
- ↑ Michaelson-Cohen, R.; Gabizon-Peretz, S.; Armon, S.; Srebnik-Moshe, N.; Mor, P.; Tomer, A.; Levy-Lahad, E.; Paluch-Shimon, S. Breast Cancer Risk and Hormone Replacement Therapy among BRCA Carriers after Risk-Reducing Salpingo-Oophorectomy. European Journal of Cancer 2021, 148, 95-102, doi:10.1016/j. ejca.2021.02.007
- ↑ Kotsopoulos, J.; Librach, C.L.; Lubinski, J.; Gronwald, J.; Kim-Sing, C.; Ghadirian, P.; Lynch, H.T.; Moller, P.; Foulkes, W.D.; Randall, S.; et al. Infertility, Treatment of Infertility, and the Risk of Breast Cancer among Women with BRCA1 and BRCA2 Mutations: A Case-Control Study. Cancer Causes Control 2008, 19, 11111119, doi:10.1007/s10552-008-9175-0
- ↑ Derks-Smeets, I.A.P.; Schrijver, L.H.; de Die-Smulders, C.E.M.; Tjan-Heijnen, V.C.G.; van Golde, R.J.T.; Smits, L.J.; Caanen, B.; van Asperen, C.J.; Ausems, M.; Collee, M.; et al. Ovarian Stimulation for IVF and Risk of Primary Breast Cancer in BRCA1/2 Mutation Carriers. Br J Cancer 2018, 119, 357-363, doi:10.1038/ s41416-018-0139-1
- ↑ Perri, T.; Naor-Revel, S.; Eliassi-Revivo, P.; Lifshitz, D.; Friedman, E.; Korach, J. Fertility Treatments and Breast Cancer Risk in Jewish Israeli BRCA Mutation Carriers. Fertility and Sterility 2021, 116, 538-545, doi:10.1016/j.fertnstert.2021.02.030
- ↑ Gronwald, J.; Glass, K.; Rosen, B.; Karlan, B.; Tung, N.; Neuhausen, S.L.; Moller, P.; Ainsworth, P.; Sun, P.; Narod, S.A.; et al. Treatment of Infertility Does Not Increase the Risk of Ovarian Cancer among Women with a BRCA1 or BRCA2 Mutation. Fertility and Sterility 2016, 105, 781-785, doi:10.1016/j. fertnstert.2015.11.034
נספח 5 - דוגמה למכתב מסירת תוצאה שלילית
לכבוד: ____________________________
לאחרונה ביצעת בדיקה גנטית שמטרתה לאתר נשים בסיכון מוגבר לסרטן שד ו/או לסרטן שחלות.
בבדיקה הגנטית שנערכה לך נבדקו 3 שינויים גנטיים (מוטציות) השכיחים בנשים ממוצא אשכנזי: המוטציות delAG185 ו־insC5382 בגן BRCA1, והמוטציה delT6174 בגן BRCA2.
אצלך, לא נמצאה אף אחת ממוטציות אלה.
היות ובבדיקה הגנטית נבדקו רק 3 שינויים אלה, קיים סיכון שארי לקיומו של גורם גנטי אחר שלא נבדק, ולכן לא זוהה בבדיקה. הסיכוי לקיומו של שינוי גנטי אחר אצלך מושפע מהסיפור המשפחתי שלך, אם קיים.
גם לנשים שלא נמצאו אצלן המוטציות שנבדקו אצלך ישנו עדיין סיכון לתחלואה בסרטן.
ללא סיפור משפחתי של סרטן שד ושחלה - הסיכון לתחלואה בגידולים אלה דומה לסיכון לכל אישה באוכלוסייה הכללית.
אם קיים סיפור משפחתי של סרטן שד ושחלה, הסיכון לתחלואה גבוה יותר, ותלוי בהיקף התחלואה במשפחה. מומלץ לפנות לייעוץ גנטי לצורך הערכת הסיכון לסרטן שד ו/או סרטן שחלה, ובו גם תינתנה המלצות מתאימות למעקב ובמקרה הצורך אף למניעה.
המלצות:
- מומלץ המשך מעקב לזיהוי מוקדם של סרטן שד. אם איך לך סיפור משפחתי של סרטן שד ושחלה - מומלץ מעקב על פי הנחיות רופא משפחה/כירורג שד, המעקב המקובל כיום הוא ביצוע ממוגרפיה אחת לשנתיים מגיל 50. אם יש לך סיפור משפחתי - חשוב שתבצעי ייעוץ גנטי. המעקב יותאם לך בייעוץ הגנטי על סמך הסיפור המשפחתי והמשך הבירור הגנטי אצלך ובמשפחתך
- פנייה לייעוץ גנטי אם יש לך סיפור משפחתי של סרטן בכלל וסרטן שד ו/או שחלה: אם במשפחתך יש קרובים/ת שחלו בסרטן (הורים, אחים/יות, אחיינים/יות, דודים/ות וסבים וסבתות) מומלץ להתייעץ עם רופא המשפחה בדבר פנייה לייעוץ גנטי בעניין זה
במרבית בתי החולים בישראל קיימות מרפאות גנטיות ואף בחלק מקופות החולים ובהן ניתן לקבוע תורים לייעוץ גנטי.
נספח 6: גנים המקושרים לסרטן שד/שחלה/לבלב תורשתי - המלצות עדכניות למעקב שד שחלה ובירור במשפחה
| GENE | Breast cancer Risk | Ovarian Cancer Risk | Recommended Breast Screening | Breast/Ovarian Risk Reduction | Risk for autosomal recessive condition | Other Cancer Risks | Comments |
| ATM | 20-40 אחוזים | 2-3 אחוזים | מגיל 40:
ממוגרפיה שנתית מגיל 30–35: לשקול MRI |
RRM על בסיס סיפור משפחתי
RRSO על בסיס סיפור משפחתי |
Ataxia- Telangiectasia (AT) | סיכון לסרטן לבלב:
5-10 אחוזים ייתכן סיכון מוגבר לסרטן ערמונית |
נשאות הטרוזיגוטית - אין מניעה לקרינה. דיון נפרד לגבי
NM 000051.4(ATM):c.7271T>G (p.Val2424Gly) |
| BARD1 | 20-40 אחוזים | מגיל 40:
ממוגרפיה שנתית לשקול MRI |
RRM על בסיס סיפור משפחתי | ||||
| BRIP1 | אין מספיק מידע | 5-15 אחוזים | RRSO
בגיל 45–50 |
Fanconi anemia (FANCJ) | |||
| CDH1 | 41-60 אחוזים | מגיל 30:
ממוגרפיה שנתית, לשקול MRI |
לשקול RRM | סרטן קיבה מסוג
diffuse |
נטייה לגידולים מסוג LIC
סיכון לשפה שסועה עם או בלי חיך שסוע | ||
| CDKN2A | סרטן לבלב >15 אחוזים מלנומה:
28-76 אחוזים |
||||||
| CHEK2 | 20-40 אחוזים | מגיל 40: ממוגרפיה.
מגיל 30–35: לשקול MRI |
לשקול MMR על סמך סיפור משפחתי | מעי גס:
5-10 אחוזים |
רב השינויים מסוג LP/P MISSENSE מקנים סיכון נמוך יותר לסרטן שד ולא מגיעים לסף המתאים להמלצות הנ"ל | ||
| MSH2 (LYNCH) | <15 אחוזים | 8-38 אחוזים | מעקב בהתבסס על סיפור משפחתי | CMMRD | רחם:
21-57 אחוזים. מעי גס: 33-52 אחוזים. |
סיכון לסרטן ערמונית:
3.9-23.8 אחוזים | |
| MLH1 (LYNCH) | <15 אחוזים | 4-20 אחוזים | מעקב בהתבסס על סיפור משפחתי | CMMRD | רחם:
34-54 אחוזים. מעי גס: 46-61 אחוזים. לבלב: ~6 אחוזים. |
||
| MSH6 (LYNCH) | <15 אחוזים | 1-13 אחוזים | מעקב בהתבסס על סיפור משפחתי | CMMRD | רחם: 16-49 אחוזים.
מעי גס: 10-44 אחוזים. |
סיכון לסרטן קיבה:
1-7.9 אחוזים | |
| PMS2 (LYNCH) | <15 אחוזים | 1.3-3 אחוזים | מעקב בהתבסס על סיפור משפחתי | CMMRD | רחם:
13-26 אחוזים. מעי גס: 8.7-20 אחוזים. |
||
| NF1 | 20-40 אחוזים | בין גיל 30–50: ממוגרפיה שנתית, לשקול MRI | לשקול MMR על סמך סיפור משפחתי | GIST; MPNST CNS; Endocrine | אין מידע אודות סיכון מוגבר לסרטן השד אחרי גיל 50. מעקב במרפאה ייחודית | ||
| PALB2 | 41-60 אחוזים | 3-5 אחוזים | מגיל 30: ממוגרפיה שנתית, לשקול MRI | לשקול RRM
RRSO - לשקול מ-45 |
Fanconi anemia (FANCN) | לבלב: 5-10 אחוזים | שד בגברים: 0.9 אחוזים |
| PTEN | 40-60 אחוזים או יותר | מגיל 18: העלאת מודעות | לשקול RRM | מעי, תירואיד | בדיקה כללית אחת לשנה מגיל 18 או 5 שנים, דגש על תירואיד. | ||
| מגיל 25 בדיקת כירורג שד פעמיים בשנה.
מגיל 35: ממוגרפיה שנתית, לשקול MRI |
רחם | מעל גיל 75 שנים יש לשקול המשך מעקב בממוגרפיה באופן פרטני | |||||
| RAD51C | 20-40 אחוזים | 10-15 אחוזים | מגיל 40:
ממוגרפיה שנתית לשקול MRI |
RRM בהתבסס על סיפור משפחתי RRSO מגיל 40–45 | Fanconi anemia (FANCO) | ||
| RAD51D | 20-40 אחוזים | 10-20 אחוזים | מגיל 40:
ממוגרפיה שנתית לשקול MRI |
RRM בהתבסס על סיפור משפחתי RRSO מגיל 40–45 | נטייה לגידולים מסוג PR/ER שלילי | ||
| STK11 | 32-54 אחוזים | סיכון של מעל ל-10 אחוזים ל-SCTAT | מגיל 30:
ממוגרפיה ו-MRI שנתית בדיקת כירורג שד פעמיים בשנה |
לדון ב־RRM | לבלב:
>15 אחוזים מעי גס: 39 אחוזים קיבה: 29 אחוזים רחם: >10 אחוזים ריאות: 7-17 אחוזים אשכים: 9 אחוזים |
SCTAT- Sex cord tumor with annular tubules | |
| TP53 | 60<
אחוזים |
לא נקבע | מגיל 18:
העלאת מודעות מגיל 20: בדיקת כירורג שד פעמיים בשנה. מגיל 20–29: MRI ניגודי. מגיל 30–75: להוסיף ממוגרפיה שנתית. |
לדון באפשרות ל-RRM | גידול' ילדות לבלב:
5-10 אחוזים. מעי גס: >20 אחוזים סרקומה, לוקמיה ריאות, מוח. |
MRI כל גופי שנתי מילדות - פרוטוקול מיוחד.
להימנע מקרינה טיפולית ואבחנתית. |
הערות כלליות:
- ההמלצות על פי הנחיות ה-NCCN במועד כתיבת ההמלצות. הנתונים משתנים כל העת בהתאם למחקרים עדכניים בתחום
- הגיל בו יש לשקול בירור אצל קרובי משפחה הוא בהתאם לגיל תחילת מעקבים או לפני תכנון היריון על מנת לשקול תהליך של PGT
- יש להתחשב בסיפור משפחתי של גידולים - אם קיימת אבחנה בגיל צעיר יש להתחיל מעקבים 5–10 שנים טרם לגיל האבחנה הצעיר במשפחה
- RRM - Risk-reducing mastectomy
- RRSO - Risk-reducing bilateral salpingo-oophorectomy
- CMMRD - Constitutional mismatch repair deficiency


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק