גנטיקה בסרטן הערמונית - Genetics of prostate cancer
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| גנטיקה בסרטן הערמונית | ||
|---|---|---|
| Genetics of prostate cancer | ||
| יוצר הערך | ד"ר רחלי אוזלבו, ד"ר דוד מרגל 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – סרטן הערמונית#כללי, תסמונות סרטן מורשות
שכיחות
סרטן הערמונית הוא הסרטן המאובחן השכיח ביותר בקרב גברים. מדי שנה מאובחנים בעולם 900,000 מקרים חדשים.[1] סרטן הערמונית מהווה גם את גורם התמותה הסרטני השני בארצות הברית והשישי בעולם המערבי בקרב גברים, ב-250,000 מקרי תמותה מדי שנה.[1], [2] למרות התחלואה הגבוהה, רק מספר מצומצם של גורמי סיכון מוכרים, בהם: גיל, מוצא אתני והיסטוריה משפחתית לסרטן הערמונית.
גנטיקה כגורם לסרטן
אף שמקרי סרטן משפחתיים רבים כבר דווחו במאה הקודמת, רק בשנות השבעים הכירו בנטייה גנטית כגורם מהותי לסרטן. ב-20 השנים האחרונות מחקרים שונים זיהו ש-10%-3% מכלל מקרי הסרטן, אשר מקורם בשדיים, ברחם או במעי נגרמים ממוטציות בגנים מדכאי סרטן בתאי אב (germ line)[3]
זיהוי ראשון של הורשה גנטית בסרטן הערמונית
הצטברות של מקרי סרטן הערמונית במשפחה דווח לראשונה ב-1965[4] אולם הרעיון של סרטן ערמונית תורשתי לא התבסס עד ל-1992, כאשר פורסמו תוצאות מחקר אשר כלל 691 גברים שחלו בסרטן ערמונית.[5] אנליזה של המחקר הצביעה על כך ש-9% ממקרי סרטן הערמונית בקרב משפחות המשתתפים תורשתי ו-43% מהמקרים התורשתיים אובחנו לפני גיל 55.[5]
בשנת 1996 מופה האתר הראשון שבו נמצא האלל אשר גורם לסיכון גבוה לסרטן ערמונית משפחתי. אתר זה ממוקם על גבי הזרוע הארוכה של כרומוזום 1. גן זה גורם לרגישות לסרטן הערמונית ונקרא HPC1 (Hereditary Prostate Cancer Gene 1) [6] מאז ועד היום זוהו גנים רבים הקשורים בנטייה משפחתית לסרטן הערמונית.[7], [8], [9], [10], [11], [12], [13]
הקושי בזיהוי גנים אלו, בשילוב עם מספר גדול של אתרים מוצעים, מצביע על מורכבות הגנטיקה של הורשת סרטן הערמונית בהשוואה לגנטיקה של הורשת סוגי סרטן אחרים. אף שהגנטיקה המולקולרית של הורשת סרטן הערמונית אינה ברורה, אין כל ספק שלנטייה תורשתית יש משמעות בהתפתחות סרטן הערמונית באחוז גדול מהמקרים,[14] ושהיסטוריה משפחתית לסרטן הערמונית היא פרמטר שיש לקחת בחשבון במעקב הקליני.
היסטוריה משפחתית כגורם סיכון לסרטן הערמונית
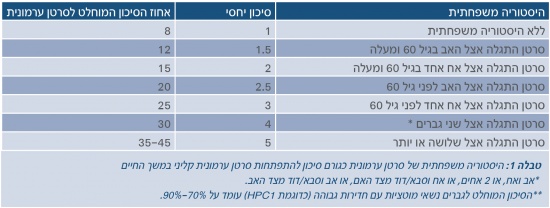
כיום ידוע שהיסטוריה משפחתית מהווה את גורם הסיכון הגדול ביותר לסרטן הערמונית. [15], [16] עובדה זו מצביעה על מעורבותם של גורמים גנטיים בהתפתחות המחלה.[17] מחקרים אפידמיולוגיים שונים הדגימו עלייה בסיכון לחלות בסרטן הערמונית עבור אדם שלו קרוב משפחה מדרגה ראשונה החולה בסרטן הערמונית.[18] סיכון זה עולה כאשר קרוב המשפחה המאובחן הוא אח, אובחן בגיל צעיר יותר וכאשר קיימים כמה מקרים במשפחה.[19], [20] טבלה 1 מסכמת תוצאות של מחקרים אחדים ומציגה את הקשר שבין היסטוריה משפחתית לסיכון לפתח סרטן ערמונית.[21], [22], [23], [24], [25]
שכיחות סרטן הערמונית הגנטי
ההערכה היא כי 10%-5% מבין מקרי סרטן הערמונית הם כתוצאה מגורמים גנטיים.18 רגישות תורשתית שכיחה אף יותר בקרב גברים בעלי סרטן ערמונית אשר מאובחן בגיל צעיר, ויכולה להוות עד כ-30% מהמקרים שאובחנו עד גיל 60, וכ-40% עד גיל 55. [26]
גנים המעורבים בהורשה של סרטן הערמונית
כדי ללמוד ולזהות את השונות הגנטית, פנוטיפים ייחודיים ודפוסי הורשה המאפיינים את סרטן הערמונית, נעשה שימוש בשיטות מחקר שונות, בהן מחקרי זיקה ומחקרי מקרי ביקורת.
מחקרי הזיקה (linkage analyses) האונקו-גנטיים מבוצעים במשפחות שאובחנו בהן מקרי סרטן רבים. תוצאות מחקרים אלו מצביעות על גנים פוטנציאליים אחדים המעורבים בהורשה של סרטן הערמונית. שלושה מהם נמצאים על כרומוזום 1 וכוללים את HPC1/RNASEL ,PCaP ו-CAPB, ומקושרים להופעת סרטן בגיל צעיר ובאופן אלים יותר. [6], [11], [27], [28], [29] גנים נוספים ממוקמים על כרומוזום 8 8p/MSR1, 8q [29], [30] כרומוזום 17 HPC2/ELAC2, HOXB13 [10] כרומוזום 20 ((HPC209 וכרומוזום X (HPCX)8.
גישה מחקרית אחרת היא מחקרי מקרי ביקורת (case control). גישה זו כרוכה בהערכת הקשר של פקטורים שונים לסרטן תוך השוואה לקבוצת ביקורת. מחקרים אלו זיהו כמה אתרים נוספים אשר שינויים בהם יכולים לגרום לסרטן הערמונית כגון EMSY ,CHEK2 ,AR ,KLF6 ,AMACR ,NBS1 ,SRD5A2 .ER[31], [32], [33], [34], [35], [36], [37]. דוגמה בולטת היא הגן לקולטן האנדרוגן AR)). קולטן זה מתבטא בכול שלבי סרטן הערמונית. כיום אנו יודעים שדפוסי ביטוי שונים של גן זה מצויים בקשר ישיר לנטייה תורשתית לסרטן הערמונית.[36], [37]
כאשר מבצעים חיפוש במאגר המידע של NCI (National Cancer Institute) נמצא רשימה ארוכה מאוד של גנים פוטנציאליים הקשורים בגנטיקה של סרטן הערמונית.[38] הקשר בין רוב הגנים המופיעים ברשימה לסרטן הערמונית עדיין לא הוכח סופית, דבר המבטא את הקושי הרב בחקר ההורשה של סרטן הערמונית.
תסמונות תורשתיות
נוסף לגנים המעורבים בהורשה של סרטן הערמונית, קיימים מצבים גנטיים נוספים המזוהים עם סיכון מוגבר לסרטן הערמונית. תסמונת לינץ' (Lynch) ותסמונת BRCA - סרטן שד ושחלות תורשתי הן מהתסמונות הגנטיות הנפוצות ביותר.
סרטן הערמונית ותסמונת Lynch
ערך מורחב – סרטן מעי גס וחלחולת
תסמונת HNPCC (Lynch Hereditary Non-Polyposis Colorectal Cancer) היא תסמונת סרטן משפחתית לגידולים ממאירים מסוגים שונים. תסמונת Lynch נגרמת בשל אי-יציבות גנומית עקב מוטציות בגנים ממשפחת MMR (Mismatch Repair) המשתתפים בתיקון DNA וכוללת ארבעה גנים עיקריים: MLH1 ,MSH2 ,MSH2 ו-PMS2.[39], [40] סרטן הערמונית מתואר כאחד הגידולים הנגרמים מתסמונת Lynch[41]. מחקר שפורסם ב-JCO בשנת 2013 הדגים עלייה של פי 2 בסיכון לפתח סרטן ערמונית בקרב גברים נשאי תסמונת Lynch בהשוואה לאוכלוסייה הכללית,[42] אולם כיום אין תמימות דעים לגבי מידת הסיכון.
סרטן הערמונית ותסמונת סרטן השד והשחלות התורשתי
תסמונת סרטן השד והשחלות התורשתי היא תסמונת המזוהה עם מוטציות בגנים BRCA1 ו-BRCA2 (Breast Cancer). בתאים רגילים, תפקיד החלבונים BRCA1 ו-BRCA2 הוא לוודא את יציבות ה-DNA, תיקון פגמים שנוצרים בו ומניעת גדילה לא מבוקרת של התא. מוטציות בגנים אלו גורמות להצטברות פגמים גנטיים וקשורות בהתפתחות של תסמונת סרטן השד והשחלות התורשתי.[43] אולם בניגוד לדעה הרווחת, מוטציות בגנים BRCA1 ו- BRCA2 משפיעות לא רק על נשים. מחקרים שונים הדגימו עלייה בסיכון לסרטן הערמונית בקרב גברים נשאים של מוטציות בגנים אלו[43]. מחקרים ראשונים בנושא העריכו סיכון יחסי של 1.82 עבור גברים נשאי מוטציות ב-BRCA1, וסיכון יחסי של 7.33 עבור גברים נשאי מוטציות ב-BRCA2 מתחת לגיל 65. [44] תוצאות ממחקרים חדשים הדגימו כי עבור גברים נשאי מוטציית BRCA1 הסיכון היחסי נמוך בהשוואה למה שתואר,[45] ואילו עבור גברים נשאי מוטציית BRCA2 הסיכון היחסי בגיל 60 גבוה משמעותית ועומד על 23[46].
מחקר שפורסם ב-2013 בכתב העת JCO הדגים כי מוטציות BRCA עלולות לגרום לפנוטיפ אלים יותר של סרטן הערמונית.[47] המחקר ניתח את מאפייני הגידול ותוצאות טיפוליות של 2,019 מטופלים עם סרטן הערמונית וכלל: 18 נשאי BRCA1, 61 נשאי BRCA2 ו-1,940 לא נשאים. תוצאות המחקר הדגימו שגברים נשאי מוטציותBRCA1/2 מאובחנים בשלב ובדרגה מתקדמים יותר הכוללים מעורבות של בלוטות לימפה וגרורות. תוצאות אלו מאשרות שמוטציות BRCA1/2 גורמות לסיכון גבוה להתפתחות סרטן הערמונית, ויש להן השלכות אפשריות על אופן המעקב אחר התפתחות סרטן הערמונית בקרב הנשאים וקרוביהם.
בינואר 2014 התפרסמו תוצאות ראשוניות של מחקר IMPACT, מחקר רב מרכזי תצפיתי בראשותה של פרופ' רוזלינד אֶאלס (Rosalind Eeles), אשר בוחן את האפקטיביות של בדיקת PSA (Prostatic Specific Antigen) באבחון סרטן הערמונית בקרב אוכלוסיית גברים נשאי מוטציות BRCA1/2.[48] במסגרת המחקר, הוצעה בדיקת PSA לגברים נשאי מוטציות BRCA1/2 בגילאי 69-40, ותוצאה של PSA>3ng/ml הובילה לביצוע ביופסיה של הערמונית. עד כה 199 גברים (8%) הדגימו רמת PSA>3ng/ml. אחוז הניבוי החיובי של ביופסיה בנוכחות PSA מעל 3 עמד על 48% (בניגוד ל-24% באוכלוסייה שאינה נשאית), וכן 66% מהסרטנים שהתגלו היו בעלי דרגת התמיינות גבוהה. ללא ספק תוצאות ראשוניות אלו מראות את חשיבות בדיקות הסקר בקרב גברים נשאי BRCA.
שכיחות מוטציות BRCA
שכיחות המוטציות בגנים BRCA1/2 משתנה בין האוכלוסיות השונות. אוכלוסיות אחדות מציגות מגוון רחב של מוטציות אשר שכיחותן נמוכה, בעוד יש קבוצות אתניות שבהן קיימת שכיחות גבוהה של מוטציות, וזאת כתוצאה מאפקט המייסד. מוטציות אלו נקראות מוטציות אב.
בספרות מתוארות 3 מוטציות אב אופייניות ושכיחות בקרב יהודים ממוצא אשכנזי: 185delAG ו-5382insC בגן BRCA1, ו-6174delT בגן BRCA2. אחוז הנשאות הכללי למוטציות BRCA1/2 עומד על 2.6% בקרב יהודים ממוצא אשכנזי, לעומת 0.2% באוכלוסייה הכללית.[49]
בזמן האחרון נמצאו מוטציות ייחודיות בקרב עדות נוספות. ביהודים ממוצא אפגני ופרסי נמצאה המוטציה Tyr978X בגן BRCA1 [50] ביהודים ממוצא תימני נמצאה המוטציה 8765delAG בגן BRCA2[51] ביהודים ממוצא עירקי נמצאה המוטציה 185delAG בגן BRCA1, אשר שכיחה גם בקרב יהודים ממוצא אשכנזי,[52] ובקרב יוצאי חבר המדינות לשעבר נמצאו המוטציות delA4135 ו-C61G[53], [54]
ייעוץ עבור גברים הנמצאים בסיכון גבוה לסרטן הערמונית
יותר ויותר גברים פונים לייעוץ אורולוגי מחשש לסרטן ערמונית תורשתי, חלקם ללא כל תסמינים. לגברים אלו יש להציע ייעוץ אונקו-גנטי, אשר יכלול מעקב אחר ההיסטוריה המשפחתית לסרטן הערמונית, והבנת הסיכון היחסי והאבסולוטי לפתח את סרטן הערמונית ביחס לאוכלוסייה הכללית.
בדיקות גנטיות
עם התקדמות הטכנולוגיה, במחצית השנייה של שנות התשעים, זוהו ושוכפלו כמה גנים האחראים לרגישות לסרטן. כמו כן פותחו בדיקות גנטיות המאפשרות לזהות במשפחות בעלות היסטוריה של סרטן, נטייה תורשתית לסרטן הערמונית ולסוגי סרטן נוספים לפני שמתפתחים תסמינים. בישראל אפשר לבדוק במסגרת סל הבריאות את המוטציות השכיחות ל-BRCA גם בקרב גברים אשר להם סיפור משפחתי מתאים. כמו כן קיימים כמה פנלים של בדיקות המאפשרים זיהוי נרחב יותר לגנים נוספים הקשורים בנטייה תורשתית לסרטן הערמונית. פנלים אלה אינם ניתנים במסגרת סל הבריאות.
בדיקות סקר אחר לסרטן הערמונית
כיום קיימת חוסר הסכמה בנוגע לתועלת בביצוע בדיקות סקר לסרטן הערמונית בהפחתת אחוזי התמותה מהמחלה בקרב האוכלוסייה הכללית. לא מכבר פרסם כוח המשימה האמריקאי לרפואה מניעתית (U.S. Preventive Service Task Force) דירוג D לבדיקת הסקר PSA לסרטן הערמונית, אשר בודקת את רמת החלבון בדם.[55] משמעות דירוג D היא כי קיימת ודאות בינונית עד גבוהה שהתועלת בבדיקה נמוכה מהנזק האפשרי. לעומת זאת, האגודה האמריקאית לאונקולוגיה קלינית, האיחוד האמריקאי לאורולוגיה והאיחוד לאורולוגיה-אונקולוגית ממליצים לבצע בדיקת סקר PSA בקרב גברים עם תוחלת חיים ארוכה.[56]
בניגוד לחוסר הסכמה לגבי התועלת שבמעקב אחר הערמונית בקרב האוכלוסייה הכללית, קיימת המלצה למעקב קבוע אחר סרטן הערמונית בקרב גברים הנמצאים בסיכון גבוה.[57] כיום, רוב מקרי סרטן הערמונית מאובחנים כתוצאה מרמתPSA גבוהה, אשר מובילה לביופסיה של הערמונית.[58], [1]
האגודה האמריקאית לסרטן ממליצה לערוך בדיקות סקר בקרב גברים בסיכון גבוה החל מגיל 40, ובמשפחות אשר נמצאו נשאיות לגורמים גנטיים לפחות 5 שנים קודם לגיל שבו אובחן סרטן במשפחה, ולפחות 10 שנים קודם להתפשטות הסרטן.[57] נוסף על כך, קיימת המלצה להפסיק החל מגיל 70 את בדיקות הסקר אם רמת ה-PSA תקינה, היות שהסיכון למוות כתוצאה מסרטן הערמונית נמוך.[57]
מרפאות מעקב
כיום קיימת מודעות גבוהה לסיכון שבנשאות מוטציות BRCA בקרב אוכלוסיית הנשים, וקיימות מרפאות ייעודיות אשר מרכזות ועוקבות אחר בדיקות המעקב השונות. למרות המידע המצטבר על הסיכון הגבוה לגברים נשאי מוטציות BRCA, עד כה לא הייתה התייחסות לצורך בבדיקות מעקב קבועות ובצורך בהקמת מרפאות ייעודיות לגברים.
בפברואר 2014 נפתחה מרפאה המיועדת לגברים נשאי מוטציות BRCA במרכז דוידוף בבית החולים בילינסון. מרפאה זו היא הראשונה מסוגה בעולם אשר מבצעת בדיקות סקר מקיפות הכוללות MRI וביופסיה של הערמונית ללא תלות ברמת ה-PSA. הבדיקות המקיפות מאפשרות בירור היתכנות לסרטן הערמונית בקרב גברים נשאים ומאפשרת הבנה טובה יותר של הסיכונים והמצב הבריאותי. המסגרת הייעודית חשובה היות והיא מאפשרת מעקב אחר אוכלוסייה זו, אשר נמצאת בסיכון גבוה לחלות בסרטן ערמונית אגרסיבי.
--סיכום==
הגנטיקה של סרטן הערמונית מורכבת ורב הנסתר על הגלוי. ברור כיום כי סיפור משפחתי הוא גורם הסיכון החשוב ביותר בפיתוח סרטן הערמונית. קיימים היום בשוק פנלים מסחריים המאפשרים זיהוי מוטציות בתאי-נבט של גנים הקשורים בסרטן הערמונית. כמו כן ידוע כי נשאות לגן BRCA מעלה לא רק את השכיחות לסרטן הערמונית אלא אף את הסיכוי לסרטן אלים יותר. מאחר שסרטן הערמונית בקרב נשאי BRCA נוטה להיות אלים יותר יש חשיבות מכרעת לגילוי מוקדם.
דגלים אדומים
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 Ferfay J, Shin HR, Bray F, et al. Estimates 0( worldwide burden ot cancer In 2008: GLOBOCAN 2008, Int J Cancer. 2010:127:2893-2917.
- ↑ Jemal A. Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90.
- ↑ Eeles R. Ponder B. Easton D. et al. Genetic Predisposition to Cancer. Oxford: Chapman & Hall, 1996.
- ↑ Morgantl G, Gianlerrari L, Cresserl A. et al. Recherches clinico-statlstiques et genetiques sur les neoplasles de la prostate. Acta Genet. 1956:6:304-5.
- ↑ 5.0 5.1 Carter B.. Beaty T, Steinberg D, el al. Mendellan Inheritance of familial prostate cancer. Proc Natl Acad Scl USA. 1992:89:3367-71.
- ↑ 6.0 6.1 Smith J, Freije D, Carpten D et al. Major susceptibility locus for proslale cancer on chromosome 1 suggested by a genome-wide search. Science. 1996:274:1371-4.
- ↑ Gibbs M. Stanford L et al. Evidence for a rare prostate cancer susceptibility locus at chromosome tp36. Am J Hum Genet. 1995:64:776-87.
- ↑ Xu J, Meyers D, Freije D, et al. Evidence for a prostate cancer susceptibility locus on the X chromosome. Nat Genet. 1998:20:175-9.
- ↑ Berry R, Schroeder J, French J, et al. Evidence for a prostate cancer- susceptibility locus on chromosome 20. Am J Hum Genet 2000:67:82-91.
- ↑ 10.0 10.1 Tavtiglan S. Simard J, Teng D, et al. A candidate prostate cancer susceptibility gene at chromosome 17p. Nat Genet, 2001 ;27:172-180.
- ↑ 11.0 11.1 Goddard K. Wltte J. Suarez B. et al. Model-free linkage analysis with covarlaies confirms linkage of prostate cancer to chromosomes 1 and 4. Am J Hum Genet. 2001 ;68:1197-206.
- ↑ Paris L, Witte S, Kupellan A. et al. identification and fine mapping of a region showing a high frequency of allelic imbalance on chromosome 16q23.2 that corresponds to a prostate cancer susceptibility locus. Cancer Res 2000:60:3645-49.
- ↑ Xu J, Zheng S. Hawkins G, et al. Linkage and association studies of prostate cancer susceptibility: evidence for linkage al 8p22-23. Am J Hum Genet. 2001 ;69:341-350.
- ↑ Lichtensteln P. Holm V, Verkasalo K. et al, Environmental and heritable factors in the causation ot cancer: analyses 01 cohorts of twins from Sweden. Denmark, and Finland. N Engl J Med. 2000:343:78-85.
- ↑ Edwards SM. Eeles RA. Unravelling the genetics of prostate cancer. Am J Med Genet C Semin Med Genet. 2004:129C:65-73.
- ↑ Bratt O. Hereditary prostate cancer: clinical aspects. J Urol. 2002:168(3): 906-13.
- ↑ Zeegers MP, Jellema A. Ostrer H. Empiric risk of prostate carcinoma for relatives of patients with prostate carcinoma: a meta-analysis. Cancer. 2003:97:1894-1903.
- ↑ Chen YC, Page JH, Chen R, et al. Family history of prostate and breast cancer and the risk of prostate cancer In the PSA era. Prostate. 2008; 68: 1582-91.
- ↑ Raymond VM. Mukherjee B. Wang F et al. Elevated risk of prostate cancer among men with lynch syndrome J Clin Oncol. 2013:31 (14):17138־.
- ↑ Rosen M and Pishvaian J. Targeting the BRCA1/2 Tumor Suppressors. Current Drug Targets. 2014:15:17-31.
- ↑ Monroe KR. Yu MC. Kolonel LN, et al. Evidence of an X-linked or recessive genetic component to prostate cancer risk. Nat Med. 1995:1:827-829.
- ↑ Narod SA. Dupont A. Cusan L, et al. The Impact of family history on early detection of prostate cancer. Nat Med. 1995:1:99-101.
- ↑ Lesko SM, Rosenberg L, and Shapiro S. Family history and prostate cancer risk. Am J Epidemiol. 1996:144:1041-47.
- ↑ Cerhan J, Parker AS. Putnam SD. et al. Family history and prostate cancer risk in a population-based cohort of Iowa men. Cancer Epidemiol Biomarkers Prev. 19998:53-60.
- ↑ Schald DJ, McDonnell SK. Blute MLet al. Evidence for autosomal dominant Inheritance of prostate cancer. Am J Hum Genet. 1998:62:1425-38.
- ↑ Bratt O. Krlstoffersson U, Lundgren R, et al. Familial and hereditary prostate cancer in southern Sweden. A population-based case-control Study. Eur J Cancer. 1999:35:272-7.
- ↑ Smith JR, Freije D. Carpten JD. et al. Major susceptibility locus for prostate cancer on chromosome 1 suggested by a genome-wide search. Science. 1996274(5291):1371-4.
- ↑ Grdnberg H. Xu J. Smith JR, et al. Early age at diagnosis in families Drovidino evidence of linkaae to the hereditarv orostate cancer locus
- ↑ 29.0 29.1 Xu J, Gillanders EM, Isaacs SD, et al. Genome-wide scan for prostate cancer susceptibility genes in the Johns Hopkins hereditary prostate cancer families. Prostate 2003:57(4):320-5.
- ↑ Lu L, Cancel-Tassin G, Valeri A, et al. Chromosomes 4 and 8 implicated in a genome wide SNP linkage scan of 762 prostate cancer families collected by the ICPCG. Prostate. 2012;72(4):410-26.
- ↑ Hebbring SJ, Fredriksson H, White KA, et al. Role of the Nijmegen breakage syndrome 1 gene in familial and sporadic prostate cancer. Cancer Epidemiol Biomarkers Prev. 2006;15(5):935-8.
- ↑ Zheng SL, Chang BL, Faith DA. et al. Sequence variants ot alpha-methylacyl-CoA racemase are associated with prostate cancer risk. Cancer Res. 2002:62(22)8485-8.
- ↑ Nurminen R, Wahlfors T, Tammela TL. et al. Identification of an aggressive prostate cancer predisposing variant at 1)ql3. Ini J Cancer. 2011:129(3)399-606.
- ↑ Narla G, Difeo A, Reeves HL, et al. A germline DNA polymorphism enhances alternative splicing of the KLF6 tumor suppressor gene and Is associated with Increased prostate cancer risk. Cancer Res. 2005;65(4):1213-22.
- ↑ Dong X, Wang L. Taniguchi K, et al. Mutations in CHEK2 associated with prostate cancer risk. Am J Hum Genet. 2003:72(2):27O-80.
- ↑ 36.0 36.1 Fromont G, Yacoub M, Valeri A, el al. Differential expression of genes related to androgen and estrogen metabolism in hereditary versus sporadic prostate cancer. Cancer Epidemiol Biomarkers Prev. 2008; 17(6) :1505-9.
- ↑ 37.0 37.1 Glovannucci E, Stampfer MJ. Krlthivas K, et al. The CAG repeat within the androgen receptor gene and its relationship to prostate cancer. Proc Natl Acad Scl USA. 1997:94 (7):3320-3.
- ↑ The National Cancer Institute. http://www.cancer.gov/cancertoplcs/pdq/genetics/prostate/HealthProfessional/ page2
- ↑ Vasen HF, MOsleln G, Alonso A, et al. Guidelines for the clinical management of Lynch syndrome (hereditary non-polyposis cancer). J Med Genet. 2007:44:353-62.
- ↑ Watson P, Riley B. The tumor spectrum In Ihe Lynch syndrome. Fam Cancer. 2005:4(3)245-248.
- ↑ Soravia C. van der Klift H, Brundler MA, et al. Prostate cancer is part of the hereditary non-polyposis colorectal cancer (HNPCC) tumor spectrum. Am J Med Genet. 2003:121:159-62.
- ↑ Raymond VM. Mukherjee B. Wang F, et al. Elevated risk of prostate cancer among men with lynch syndrome J Clin Oncol. 2013:31(14)117138,
- ↑ 43.0 43.1 Rosen M and Pishvaian J. Targeting the BRCA1/2 Tumor Suppressors. Current Drug Targets. 2014:15:17-31.
- ↑ Leongamomlert D, Mahmud N. Tymrakiewicz M, et al. Germline BRCA1 mutations increase prostate cancer risk. Br J Cancer. 2012:106:1697¬1701.
- ↑ Edwards SM, et al. Two Percent of Men with Early-Onset Prostate Cancer Harbour Germline Mutations in the BRCA2 Gene. Am J Hum Genet. 2003; 72(1): 1-12.
- ↑ Von E, Ho A, Murphy G. et al.American cancer society guidelines for the early detection of prostste cancer. Cancer. 1997:80:1805-7.
- ↑ Castro E. Goh CL, Olmos D, et al. Germline BRCA mutations are associated with higher risk of nodal involvement, distant metastasis and poor survival outcomes In prostate cancer. J Clin Oncol. 2013: 31(14)11748-57.
- ↑ Mitra AV, Bancroft EK, Barbachano Y, et al. Targeted prostate cancer screening in men with mutations in BRCA1 and BRCA2 detects aggressive prostate cancer: Preliminary analysis of the results of the IMPACT study, BJU Int. 2010:107:28-39.
- ↑ Ferla R. CalO V. Cascio S. et al.Founder mutations in BRCA1 and BRCA2 genes. Ann Oncol. 2007:18(6)1938.
- ↑ Sverdlov S, Gershonl B, Hlrsch I, et al. The Tyr978X BRCA1 Mutation In Non- Ashkenazl Jews: Occurrence In High-Risk Families, General Population and Unselected Ovarian Cancer Patients. Community Genet. 2001:4:50-55.
- ↑ Lerer I, Wang T. Peretz T. Sagi M. et al.The 8765delAG mutation in BRCA2 Is common among Jews of Yemenite extraction. Am J Hum Genet. 1998:63:272-4.
- ↑ Bruchim R, Bar-Sade A. Modan B, et al. The 185delAG BRCA1 Mutation Originated belore Ihe Dispersion of Jews in the Diaspora and Is Not Limited to Ashkenazim. Hum. Mol. Genet, 1998;7(5):801-805.
- ↑ Gorskl B, Byrskl T, Huzarskl T, et al. Founder mutations in the BRCA1 gene in Polish families with breasi - ovarian cancer. Am J Hum Genet. 2000:66:1963-8.
- ↑ Gayther SA, Harrington P. Russell P, et al. Frequently occurring germline mutation of the BRCA1 gene In ovarian cancer families from Russia. Am J
- ↑ The USPSTF Screening for Prostate Cancer. http://www. uspreventiveservicestaskforce.org/uspstf/uspsprca.htm
- ↑ Von E, Ho A, Murphy G, et al. American cancer society guidelines for the early detection of prostste cancer. Cancer. 1997:80:1805.
- ↑ 57.0 57.1 57.2 Stenman UH, Hakama M, Knekt, P, et al. Serum concentrations of prostate specific antigen and its complex with alfa 1-antichymotrypsin before diagnosis of prostate cancer, Lancet, 1994:344:1594.
- ↑ Seigel R, Ward E, Brawley O, et al. Cancer Statistics. CA Cancer J Clin. 2011:61:212-236.
קישורים חיצוניים
- גנטיקה של סרטן הערמונית, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר רחלי אוזלבו, ד"ר דוד מרגל


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק