חתימות גנומיות ככלי עזר לקבלת החלטות טיפוליות בסרטן שד מוקדם - Genomic imprinting and therapeutic decision making in early breast cancer
| חתימות גנומיות ככלי עזר לקבלת החלטות טיפוליות בסרטן שד מוקדם | ||
|---|---|---|
| Genomic imprinting and therapeutic decision making in early breast cancer | ||

| ||
| יוצר הערך | ד"ר נועה אפרת (בן-ברוך) | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – בדיקות גנטיות, סרטן השד
מדי שנה מאובחנות בישראל כ-4,000 נשים שחלו בסרטן השד. מרבית הגידולים מאובחנים בשלב מוקדם, קרי סרטן שד ללא גרורות המודגמות באברים מרוחקים, כאשר אצל חלק ניכר מהנשים שאובחנו לראשונה, הגידול מוגבל רק לשד, ללא פיזור לבלוטות לימפה אזוריות.
למרות האיבחון המוקדם, כ-30% מנשים אלו יפתחו עם הזמן גרורות באברים מרוחקים, כלומר, כבר בזמן האיבחון קיימת מחלה מיקרו-גרורתית שאינה ניתנת לאיבחון.
טיפולים סיסטמיים, כגון טיפולים כימים, הורמונליים וביולוגיים, הוכחו כיעילים בהפחתת הסיכון להופעת גרורות בעתיד, ובהגברת סיכויי הריפוי לאחר איבחון מוקדם של סרטן השד.
לפני קבלת ההחלטה על סוג הטיפול, יש להתייחס למספר שאלות עקרוניות:
- מדד פרוגנוסטי - הערכת הסיכון להישנות מחלה עם עדות לקיומן של גרורות מרוחקות, או בחינת מאפייני הגידול הספציפי, שיסייעו להעריך את הסיכון להישנות מחלה גרורתית או מקומית
- מדד פרדיקטיבי - הערכת יעילותם של מרכיבי הטיפול השונים בהפחתת הסיכון להישנות המחלה, או בחינת מאפייני הגידול הספציפי שיסייע להעריך את סוג הטיפול עם הסיכוי המשמעותי ביותר להועיל למטופלת ולשפר את מצבה
הדילמה הכרוכה בשאלות אלה מתייחסת לכך, שמצד אחד, טיפול סיסטמי שאין בו צורך או תועלת, הוא מיותר. מאידך, צריך להיזהר מלמנוע טיפול העשוי להועיל לחולות עם סיכון מוגבר להישנות המחלה.
באופן מסורתי, קביעת מדדים פרוגנוסטים נשענה על מדדים אנטומיים, כגון גודל הגידול ומידת המעורבות של קשריות הלימפה האזוריות, וכן על מאפיינים היסטופתולוגיים כגון מידת ביטויים של קולטנים להורמונים - קולטני אסטרוגן (ER, Estrogen Receptor), קולטני פרוגסטרון (PgR, ProgesteroneReceptor) או HER2/neu בתאי הגידול, קצב חלוקת התאים (ki67) ודרגת ההתמיינות ההיסטולוגית.
בנוסף להערכת הסיכון ולהישנותה של מחלה עם גרורות מרוחקות (מדד פרוגנוסטי), חלקם של מדדים אלה מוסיפים גם מידע לגבי יעילותו של טיפול משלים על ידי טיפול הורמונלי (כמו מידת הביטוי של קולטני אסטרוגן וקולטני פרוגסטרון) ו/או טיפול נוגד HER2 (מידת ביטוי של HER2 או FISH - מדד פרדיקטיבי).
ניתן לחלק את כל גידולי השד לארבע קבוצות עיקריות. ההמלצות הטיפוליות תואמות את המאפיינים הביולוגיים של הגידול, כפי שמודגם בטבלה מס' 1.
הצורך באפיון פרטני וספיציפי יותר של סרטן שד בבחינת "כל מקרה לגופו", נובע מהחלטות טיפוליות שהתבססו על תוצאות מחקרים באוכלוסיות הומוגניות לכאורה, אך אלה היו למעשה הטרוגניות לחלוטין. המהלך הקליני בקרב נשים עם סרטן שד שהיה לכאורה זהה במאפייניו, היה למעשה שונה לחלוטין.
אופי הטיפול הסיסטמי המשלים אצל חלק מהחולות הוא מובנה, ונובע מהאפיון הביולוגי של הגידול. כך למשל, כמעט לכל החולות בסרטן שד עם HER2 חיובי, יינתן טיפול כימי משלים הכולל טיפול נוגד HER2, ואילו לחולות ללא ביטוי קולטנים ל-HER2 יינתן טיפול כימי משלים בלבד.
הצורך באפיון פרטני יותר בולט בעיקר בקרב נשים עם סרטן שד בעל קולטנים חיוביים להורמונים ו-HER2 שלילי, המהוות את החלק הארי (כ-70%) של חולות המאובחנות עם סרטן שד מוקדם.
הסיכון להישנות בקבוצה זו נמצא על ספקטרום נרחב מאד, כאשר לחלק מהחולות סיכויי החלמה מצויינים, ולחלקן סיכויי החלמה נמוכים הרבה יותר.
נעשה אפיון פרטני של הגידול על מנת לסייע לרופאים המטפלים להחליט על הטיפול הסיסטמי המשלים, כאשר הסוגיות המרכזיות העומדות על הפרק הן:
- מהי רמת הסיכון להישנות מרוחקת
- האם צריך לטפל בחולה באמצעות כל מרכיבי הטיפול הסיסטמי
לצורך זה פותחו מספר בדיקות של חתימות גנומיות הבודקות מספר רב של גנים, במטרה לאפיין סרטן שד מוקדם. מרבית הבדיקות פותחו ועברו תיקוף (Validation) ככלי פרוגנוסטי בלבד באוכלוסיית החולות השכיחה והמורכבת ביותר, קרי, חולות עם סרטן שד שלו קולטנים חיוביים ו-HER2 שלילי.
חלק מהבדיקות שעברו תהליך תיקוף הפכו לכלי פרוגנוסטי ופרדיקטיבי, וכך מעבר להערכת הסיכון להישנות, נוסף מרכיב של הערכת התועלת של מרכיבי הטיפול השונים בשיפור סיכויי ההחלמה. בנוסף, השימוש בבדיקות ככלי פרוגנוסטי יכול לסייע לרופאים המטפלים להחליט האם יש צורך טיפולי, אך אינו עוזר באופן מבוקר בהחלטה לגבי סוג הטיפול המומלץ.
השימוש בבדיקות הכוללות בתוכן גם מרכיב פרדיקטיבי מסייע להחליט האם יש צורך בטיפול, ובנוסף עוזר להחליט על מרכיבי הטיפול כמו למשל, האם המטופלת תקבל טיפול כימי בנוסף לטיפול ההורמונלי.
טבלה מס. 1: שיעור היארעות סגולי לגיל של התחלואה בסרטן השד בנשים בנות 44-20 בישראל לפי שנה וקבוצת אוכלוסייה
| קולטנים שליליים | קולטנים חיוביים | |
|---|---|---|
| טיפול כימי טיפול נוגד HER2 | טיפול כימי טיפול נוגד HER2 טיפול הורמונלי |
HER2 חיובי |
| טיפול כימי | טיפול הורמונלי טיפול כימי |
HER2 שלילי |
סוגי חתימות גנומיות
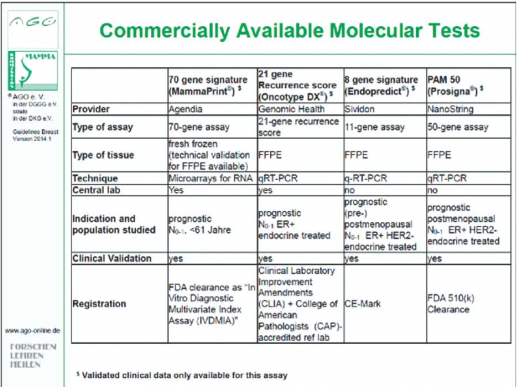
קיימות[1] מספר חתימות גנומיות שעברו פיתוח מעבדתי וקליני ופורסמו בספרות (Peer Review). נכון לשנת 2015, ארבע בדיקות זמינות באופן מסחרי: אונקוטייפ (Oncotype DX) שפותחה על ידי Health Genomic, ממהפרינט (MammaPrint) שפותחה על ידי Agendia, בדיקת פרוסיגנה (Prosigna) המבוססת על החותם של 50 PAM ובדיקת אנדופרדיקט (EndoPredict) (טבלאות מספר 2, 3).
פיתוח הבדיקות ותיקוף האלגוריתמים בוצעו על דגימות קיימות מבנק רקמות או מתוך מחקרים קיימים שכללו נתונים לגבי אפיון החולות, סוגי הטיפול ואחוזי ההישנות[2].
בדיקת ממהפרינט (MammaPrint)
בדיקת ממהפרינט[3] ניתנת לביצוע על רקמה טרייה או קפואה, וכן על רקמה שעברה שיקוע בפרפין (Paraffin). בדיקה זו פותחה על סמך אפיון מולקולרי של גידולים שנלקחו לצורך הבדיקה מקבוצה קטנה של חולות צעירות יחסית (פחות מ-55), שחלו בסרטן שד בשלב מוקדם ללא גרורות בקשריות.
חולות אלו לא קיבלו טיפול סיסטמי כלשהו לאחר הניתוח, והמעקב אחריהן נמשך לפחות 5 שנים. בקרב החולות שנבדקו נמצאה מעורבות מבחינת קולטנים להורמונים ו-HER2.
למעלה מ-25,000 גנים נסרקו, מתוכם נבחרו 70 גנים שביטויים היווה את ההבדל המשמעותי ביותר לגבי הסיכון להישנות סרטן השד עם גרורות מרוחקות.
תשובת הבדיקה מהווה מדד אבסולוטי בעזרתו ניתן לקבוע האם הסיכון להישנות המחלה (בצורת גרורות מרוחקות) בטווח של 5 שנים מהאיבחון נמוך או גבוה - זאת למרות שהתוצאה עצמה היא בגדר מדד רציף[3].
מחקרי התיקוף כללו בחלקם גם חולות מהקבוצה שלפיה פותחה הבדיקה, וגם הם בוצעו בקרב קבוצת חולות צעירות, שלהן מעורבות של קולטנים להורמונים ו-HER2, ומעורבות קשריות.
ניתן להשתמש בבדיקה הזו בחולות עם סרטן שד מוקדם (שלב 1 או 2) ללא מעורבות של קשריות לימפה וללא תלות במידת ביטוי קולטנים להורמונים.
תוצאה של סיכון נמוך (Low risk) משמעותה שלחולה סיכון של כ-10% לפתח גרורות מרוחקות תוך 10 שנים ללא כל טיפול סיסטמי. תוצאה של סיכון גבוה (High risk) משמעותה שלחולה סיכון של כ-30% לפתח גרורות מרוחקות תוך 10 שנים ללא כל טיפול סיסטמי.
אוכלוסיית החולות עליהן התבסס פיתוח בדיקה זו אינה מאפיינת את מרבית חולות סרטן השד, שכן כ-80% מהחולות מאובחנות לאחר גיל 50. בנוסף, שלושת הגנים החשובים ביותר בסרטן שד (המקודדים לקולטן לאסטרוגן, הקולטן לפרוגסטרון ו-HER2) אינם נכללים בין 70 הגנים הנבדקים בבדיקת ממהפרינט. מסיבה זו פותחו בדיקות נוספת של חברת אגנדיה, בהן בלופרינט (Blue Print) וטרגטפרינט (TargetPrint) המסווגות את גידולי השד לפי תתי סוגים (Basal-Like Luminal, HER2), ומסייעות בהערכת מידת הביטוי של הקולטנים ו-HER2.
בדיקת פרוסיגנה המבוססת על החותם 50 PAM (Prosigna Score)
ניתן לסווג סרטן שד חודרני לארבע קבוצות ביולוגיות עיקריות, על סמך הגנים המבוטאים בתאים: Luminal A, Luminal B, HER2-enriched ו-Basal-Like. אחת מצורות הסיווג לקבוצות אלו מבוצעת על ידי PCR-RT (Real Time-Polymerase Chain Reaction), ומהווה את הבסיס לבדיקת פרוסיגנה. בבדיקה זו נמדד ביטויים של 50 גנים (46 גנים בבדיקה המסחרית) המשמשים לסיווג הגידול לתתי הסוגים השונים. גנים אלו בשילוב עם גודל הגידול ומדד פרוליפרציה משמשים לקביעת מידת הסיכון להישנות המחלה (ROR, Risk Of Recurrence score). בדיקה זו פותחה עבור נשים בגיל המעבר עם סרטן שד מוקדם (שלב 1 או 2) שלו קולטנים חיוביים ו-HER2 שלילי, ללא מעורבות קשריות או עם מעורבות של 1-3 קשריות, המקבלות טיפול הורמונלי משלים.
אלגוריתם פרוגנוסטי זה נבדק בשני מחקרים: במחקר אחד (ATAC) טופלו חולות סרטן שד מוקדם על ידי Tamoxifen או Anastrozole, ובמחקר השני (ABCSG8) טופלו החולות, אף הן עם סרטן שד מוקדם, באמצעות Tamoxifen בלבד או על ידי Tamoxifen בשילוב Anastrozole.
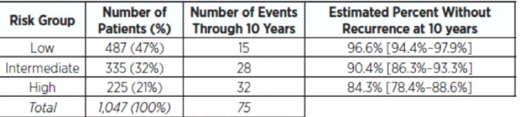
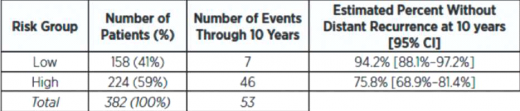
מדד ROR (שם מסחרי: Prosigna Score) מסווג את החולות לשלוש קבוצות פרוגנוסטיות שונות להערכת מידת הסיכון (נמוך, בינוני או גבוה) לפתח גרורות מרוחקות בטווח של עשר שנים מהאיבחון הראשוני לפי Package Inserts של בדיקת הפרוסיגנה[4].
טבלה מס' 4 מציינת את מידת הסיכון לפיתוח גרורות מרוחקות בקבוצת חולות ללא גרורות בבלוטות[4]: בקבוצת חולות עם 1-3 גרורות בקשריות, נקבעו שתי רמות סיכון - נמוכה וגבוהה. בפירוט האינדיקציות לבדיקת פרוסיגנה כפי שמופיעות Package Inserts ובהרשאת מנהל המזון והתרופות האמריקאי (FDA, Food and Drug Administration), נכתב כי בדיקה זו היא פרוגנוסטית בלבד, ואין להשתמש בה לצורך איבחון, ניבוי תגובה לטיפול כימי, או לצורך בחירת הטיפול האופטימלי עבור חולות.
בדיקת אונקוטייפ (Oncotype DX)
בדיקת האונקוטייפ[5] פותחה עבור נשים עם סרטן שד מוקדם (שלב 1 או 2) עם קולטנים חיוביים ו-HER2 שלילי, ללא מעורבות קשריות. מאוחר יותר נמצא כי בדיקה זו ניתנת לשימוש גם בקרב נשים שלהן מעורבות של 1-3 קשריות[6].
הפיתוח הראשוני התבסס על שלושה מחקרים קליניים בלתי תלויים, שכללו 447 חולות סרטן שד. נסקרו 250 גנים בעלי פוטנציאל להיות סמנים להישנות של סרטן השד, ומתוכם נמצאו 16 גנים הקשורים להישנות של מחלה זו. בנוסף, נבדקים 5 גנים לצורכי בקרת איכות. מדד הישנות (RS, Recurrence Score) הוגדר בעזרת אלגוריתם שכלל מידת ביטויים של גנים נבחרים. מדד זה מסווג את החולות לשלוש רמות סיכון באחוזים לפתח גרורות מרוחקות בטווח של 10 שנים:
- RS נמוך (0-18)
- RS בינוני (19-31)
- RS גבוה (32 ומעלה)
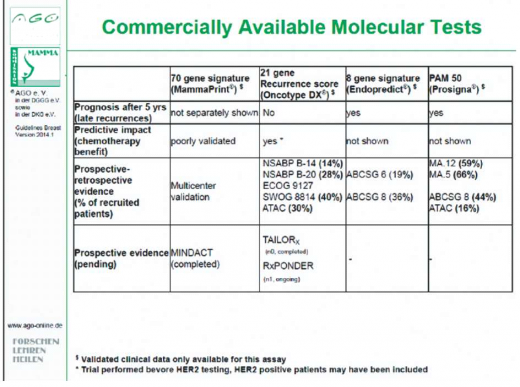
האלגוריתם נבדק באופן רטרוספקטיבי במחקרים פרוספקטיביים אקראיים בהם נכללו קבוצות מחקר גדולות, שעברו מעקב של למעלה מ-15 שנה. המשתתפות היו חולות סרטן שד בשלבים 1 או 2 עם גידולים המבטאים את הקולטן לאסטרוגן ללא ביטוי יתר של החלבון HER2, וללא מעורבות של קשריות לימפה. נמצא, כי מידת הסיכון לפתח גרורות מרוחקות בתוך 10 שנים נקבעה בשיעור של 6.8% בקרב קבוצות בעלות RS נמוך, 14.3% בקבוצות בעלות RS בינוני ו-30.5% בקרב נשים עם RS גבוה. נוסף על יעילות הבדיקה כמדד פרוגנוסטי, בדיקת האונקוטייפ נבחנה כמדד פרדיקטיבי במחקר NASBP B-20[7].
במחקר זה בוצעה השוואה בין נשים עם סרטן שד מוקדם עם קולטנים הורמונלים חיוביים ו-HER2 שלילי, שקיבלו טיפול משלים ב-Tamoxifen לבין נשים עם נתונים דומים שקיבלו טיפול משלים באמצעות Tamoxifen בשילוב עם טיפול כימותרפי. תועלת משמעותית של טיפול כימותרפי נצפתה בקרב נשים עם RS גבוה, ואילו בקרב נשים עם רמת סיכון נמוכה לא נצפתה תועלת ממשית מהטיפול זה. בשלב מאוחר יותר של פיתוח בדיקת האונקוטייפ נמצא כי הבדיקה פרדיקטיבית גם ליעילות טיפול כימי משלים בקרב חולות פוסט מנופאוזליות (Postmenopausal) עם 1-3 קשריות גרורתיות (תוצאות אלה פורסמו במחקר 8814 SWOG). כמו כן, במסגרת מחקר אחר (TransATAC)[6], נמצא כי בדיקת האונקוטייפ יעילה כמדד פרוגנוסטי אצל חולות עם סרטן שד מוקדם, עם או בלי מעורבות קשריות שטופלו על ידי מעכבי ארומטז (Aromatase inhibitor).
מחקרים פרוספקטיביים
אחת מהנקודות העיקריות בביקורת לגבי פיתוח חותמים מולקולריים היא הסתמכותם על מחקרי עבר, ולפיכך פיתוחם נעדר תיקוף פרוספקטיבי טהור. נכון לשנת 2015, נבדקות בדיקות ממהפרינט ואונקוטייפ באופן פרוספקטיבי בשלושה מחקרים רחבי היקף. בשניים מהם הסתיים שלב גיוס המשתתפות, ותוצאותיהם יפורסמו בשנים הקרובות[2].
שלושת המחקרים הללו יבדקו את מידת התועלת של תוספת טיפול כימי אצל חולות עם מידת סיכון נמוכה להתפתחות גרורות מרוחקות. תשובה פרוספקטיבית מהימנה תעזור לחדד את הצורך במתן טיפול כימי, ואולי אף לצמצם במידה ניכרת את מספר הנשים המקבלות טיפול כימי משלים.
מחקר MINDACT בודק את מידת ההתאמה בין בדיקת ממהפרינט לבין הערכת הישנות המחלה בתוכנה המכונה Adjuvant בקרב חולות סרטן שד מוקדם ללא מעורבות קשריות. נכללו בו חולות עם קולטנים חיוביים או שליליים להורמונים ועם HER2 שלילי. במחקר זה הסתיים שלב הגיוס.
החולות חולקו לשתי קבוצות עיקריות:
- חולות לגביהן הייתה הסכמה לגבי מידת סיכון ההישנות בין בדיקת ממהפרינט ל-Adjuvanti
- חולות לגביהן הייתה אי הסכמה בהתייחס למידת הסיכון בין בדיקת ממהפרינט ל-Adjuvanti
ההחלטה הטיפולית הייתה כדלקמן:
- חולות עם הסכמה בין שתי הבדיקות (לגבי מידת הסיכון) קיבלו טיפול כימי משלים אם נמצאה רמת סיכון גבוהה, ולא קיבלו טיפול כימי משלים אם רמת הסיכון שלהן נמצאה נמוכה (כל החולות קיבלו גם טיפול הורמונלי אם נמצאו מתאימות)
- חולות ללא הסכמה בין שתי הבדיקות עברו רנדומיזציה בין שימוש בממהפרינט על מנת להחליט האם יש צורך בטיפול כימי משלים, או שימוש ב-Adjuvanti, לצורך החלטה לגבי נחיצות הטיפול הכימי המשלים (גם חולות אלו קיבלו טיפול הורמונלי לפי מידת התאמתן)
מחקרים נוספים
במרכזם של שני מחקרים TAILORx ו-RxPONDER[2] ניצבת השאלה מה ערכו של הטיפול הכימי בקרב חולות סרטן שד מוקדם עם קולטנים חיוביים, HER2 שלילי, ו-RS בינוני/נמוך. המחקר עושה שימוש בבדיקת אונקוטייפ ובמדד RS כמדד ראשוני, ויבדוק בנוסף את מדד ROR של בדיקת פרוסיגנה כמדד לאנליזה משנית.
למחקר TAILORx גויסו נשים עם סרטן שד ללא מעורבות קשריות. החולות חולקו ל-3 קבוצות:
- חולות עם RS מתחת ל- 11 קיבלו טיפול הורמונלי בלבד
- חולות עם RS מעל 25 קיבלו טיפול כימי בשילוב עם טיפול הורמונלי
- חולות עם RS בין 11 ל-25 עברו רנדומיזציה בין טיפול הורמונלי בלבד לטיפול כימי בשילוב עם טיפול הורמונלי
יש לשים לב לשוני בין תחום הביניים בו מידת יעילותו של הטיפול הכימי אינה ברורה, לבין בדיקת אונקוטייפ, בה מורד הרף לקביעת RS של הטיפול כימי, שנקבע באמצע תחום הביניים. במחקר זו הסתיים שלב הגיוס.
למחקר RxPONDER מגוייסות מטופלות עם מעורבות של 1-3 קשריות, ובו חולקו המטופלות לשתי קבוצות בלבד:
- חולות עם RS פחות מ-25 עוברות רנדומיזציה בין טיפול הורמונלי בלבד לטיפול כימי וטיפול הורמונלי
- חולות עם RS מעל 25 יקבלו טיפול לפי החלטת הרופא המטפל
מחקר זה נמצא עדיין בשלב הגיוס.
המלצות לשימוש בקווים מנחים בינלאומיים
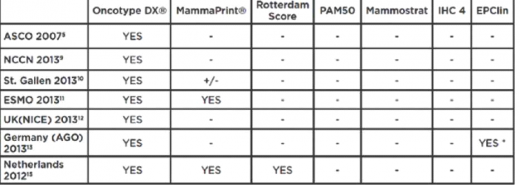
הבדיקה היחידה המומלצת לשימוש באופן גורף היא בדיקת אונקוטייפ. בדיקת ממהפרינט מומלצת על ידי ESMO והקווים המנחים של הולנד[8]. שאר הבדיקות אינן מומלצות עדיין במסגרת קווים מנחים. המלצות אלו נכונות לשנת 2014 וייתכן שהן ישתנו בשנים הקרובות.
ביבליוגרפיה
- Parker JS, Mullins M, Cheang MC, et al. Supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol 2009 Mar10;27(8):1160-7.
- ↑ AGO. Prognostic and Predictive Factors. Guidelines of the AGO Breast Committee. 2014 Apr 21. Available from: www.ago-online.de/en/guidelines-mamma/ march-2014
- ↑ 2.0 2.1 2.2 Goncalves R, Bose R. Using multigene tests to select treatment for early-stage breast cancer. J Natl Compr Canc Netw. 2013 Feb 1;11(2):174-82.
- ↑ 3.0 3.1 van de Vijver MJ, He YD, van't Veer LJ, et al. A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med. 2002 Dec 19;347(25):1999-2009.
- ↑ 4.0 4.1 NanoString Technologies Inc: Prosigna™ Breast Cancer Prognostic Gene Signature Assay [Package Insert]. Seattle, WA: NanoString Technologies, Inc; 2013.
- ↑ Paik S, Shak S, Tang G, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med. 2004 Dec 30;351(27):2817-26.
- ↑ 6.0 6.1 Albain KS, Barlow WE, Shak S, et al. Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with node-positive, oestrogen-receptor-positive breast cancer on chemotherapy: a retrospective analysis of a randomised trial. Lancet Oncol. 2010 Jan;11(1):55-65.
- ↑ Paik S, Tang G, Shak S, et al. Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer. J Clin Oncol. 2006 Aug 10;24(23): 3726-34.
- ↑ Kern P, Rezai M, Singer C, Kimmig R. Genomic testing in international guidelines. EMJ Oncol. 2013;1:68-74.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר נועה אפרת (בן-ברוך) - מנהלת המכון האונקולוגי, המרכז הרפואי קפלן, רחובות


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק