טיפול תאי במלנומה גרורתית - Cell therapy in metastatic melanoma
| טיפול תאי במלנומה גרורתית | ||
|---|---|---|

| ||
| יוצר הערך | ד"ר יונתן כהן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מלנומה
מבוא
הטיפול במלנומה גרורתית עבר מהפכה עם כניסתם של מעכבי נקודות הבקרה (מנ"ב) והטיפול המכוונן (מעכבי BRAF ו-MEK). טיפולים אלו העלו משמעותית את ההישרדות החציונית במלנומה, ובמקרים מסוימים יש אף רמזים לריפוי בעקבות טיפולים אלו. עם זאת, גם עם טיפולים חדישים אלו, בשיעור ניכר מהחולים המחלה תתקדם, וכ-40 אחוזים מהם ימותו מן המלנומה הגרורתית בתוך חמש שנים[1]. קבוצת חולים זו, שאצלה המחלה מתקדמת, מועמדת לטיפולים נוספים, ובהם טיפולים תאיים (Adoptive Cell Therapy - ACT).
התשתית החיסונית לטיפול תאי
במקרים רבים ניתן לזהות הסננה של תאי T בתוך הגידול (Tumor Infiltrating Lymphocytes - TILs). תאים אלו מועשרים בשבטים (Clones) אשר הקולטן שלהם (T cell receptor) מזהה אנטיגנים ייחודיים לגידול. במקרים רבים, תאים אלו מעוכבים באופן הפיך וניתן להחזיר אותם למצב פעיל באמצעות מנ"ב ולייצר חיסוניות נגד הגידול. על אף קיומם התדיר של תאי T מסוג זה, ההצלחה של מנ"ב היא חלקית. זאת בין היתר בשל מורכבות סביבת הגידול המכילה רכיבים שונים המעכבים את התגובה החיסונית, לרבות נקודות בקרה נוספות, תאי T מווסתים (T regulatory cells), תאים מעכבים ממוצא מיאלודי (Myeloid derived suppressor cells) וסביבה מטבולית דכאנית. בנוכחות תאי T יש אם כך פוטנציאל לתגובה נגד הגידול שמנ"ב הנוכחיים לא ממצים. הסרה של הסביבה המעכבת או לחלופין הוצאת תאי T מתוך סביבה זו היא בעלת פוטנציאל לאפשר חזרה של תאי T למצב פעיל.
הליך הטיפול ב-ACT
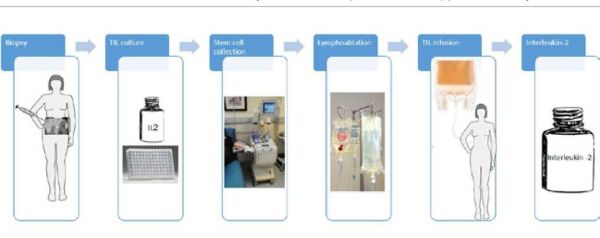
הטיפול התאי כולל דגימה של אתר מחלה וזריעת חלקי הגידול בתרבית המכילה את הציטוקין IL-2 (Interleukin-2). תנאי התרבית נותנים עדיפות לגדילה של לימפוציטים, אם TILs אלו גדלים, הם מופרדים ומתורבתים עד להגעה למאות מיליוני תאים. במקביל, המטופל מקבל טיפול כימי הכולל Fludarabine (Fludara)[2] ו-Cyclophosphamide/Cytoxan (Endoxan)[2] (או בפרוטוקולים מסוימים שילוב עם הקרנה כל גופית - TBI, Total Boday Irradiation) אשר מביא לדלדול של הלימפוציטים במטופל, ללא הכחדה של מח העצם. בשלב הבא הלימפוציטים מהתרבית מועברים בחזרה למטופל, ולאחר מכן ניתנות מנות חוזרות של IL-2 דרך הווריד (ראה תרשים מספר 1). המטופל מאושפז עד חלוף תופעות הלוואי, ובפרט עד התאוששות מח העצם.
יעילות הטיפול ב-ACT
הטיפול ב-ACT "נולד" במעבדה של סטיבן רוזנברג במכון הלאומי לבריאות בארצות הברית בשנות השמונים של המאה ה-20. באותן שנים נמצא שלטיפול ב-IL2 במינונים גבוהים יש פוטנציאל להביא לתגובה טובה ב-16 אחוזים מחולי מלנומה גרורתית, כאשר בכ-5 אחוזים מהחולים הודגמה נסיגה מלאה של הגידול אשר נמשכה לאורך כל זמן המעקב אחר החולים[3]. בהמשך עלה הרעיון להשתמש ב-TIL לטיפול, כאשר ה-IL2, אשר רק בשנים אלה הפך זמין, איפשר את גדילתם בתרבית.
בדיווח ראשוני ב-New England Journal of Medicine ב-1988 לגבי יעילות הטיפול ב-ACT ב-20 חולים, 11 חולים הראו נסיגה של הגידול[4]. פרסום מאוחר יותר סיכם את הניסיון עם 86 חולים והראה שיעור תגובה של 34 אחוזים, שיעול כפול מזה שהתקבל קודם לכן בטיפול ב-IL-2 לבד[5]. שיפור נוסף בתוצאות התקבל עם מתן כימותרפיה במינונים גבוהים: 18 מתוך 35 חולים (51 אחוזים) הראו נסיגה של המלנומה הגרורתית בטיפול זה[6]. במעקב ארוך טווח 20 מתוך 93 חולים הראו נסיגה מלאה (CR - Complete Remission) של הגרורות, וב-19 מתוכם (95 אחוזים), התגובה נמשכה לאורך כל זמן המעקב שנע בין 37 ל-82 חודשים[7]. הליך ייצור הטיפול, אשר מבוסס על גידול תאים אוטולוגיים (ולא על מוצר מדף), הגביל במשך השנים את זמינות הטיפול למרכזים נבחרים ומנע ביצוע מחקרי פאזה III גדולים. עם זאת, פורסמו מחקרים ממרכזים נוספים, אשר הדגימו שיעורי תגובה משתנים בסדרי גודל של עשרות אחוזים[8].
מרבית המחקרים בנוגע ל-ACT הקדימו את עידן מנ"ב. מכאן עולה השאלה לגבי המקום של ACT ברצף הטיפולי בחולי מלנומה גרורתית אשר הראו עמידות (ראשונית או נרכשת) למנ"ב. מכאן עולות מספר שאלות, כמו:
האם לחולים אלו שמורה יכולת להגיב ל-ACT, באיזה סדר גודל ומה המקום של טיפול המשלב מנ"ב עם ACT. ישנם מחקרים המגייסים חולים ברחבי העולם אשר בוחנים שאלה זו (למשל NCT03638375, NCT03374839, NCT02360579, NCT02621021) אולם ישנן עדויות ראשוניות (וכך גם הניסיון שלנו) ליעילות של ACT גם בקרב חולים עמידים למנ"ב אם כי באחוזים נמוכים משמעותית מאלו שתוארו בחולים טרום עידן מנ"ב. במחקר שכבר הוזכר[7], בקרב 20 חולים אשר הגיבו ב-CR, רבע היו לאחר כישלון של טיפול במעכב של 4-CTLA, כאשר סך הכל מתוך 11 מטופלים שהיו לאחר כישלון של anti-CTLA4 (64 אחוזים) 7 הראו נסיגה של הגרורות. במחקר נוסף, מתוך 57 חולים, 13 היו לאחר כישלון של טיפול ב-anti-CTLA4, 5 מהם הראו נסיגה של הגידול (38 אחוזים)[9]. הרושם שמתקבל הוא שבקרב חולים אשר נכשלו הן על נוגד 1-PD והן על נוגד CTLA-4, שיעורי התגובה נמוכים יותר.
רעילות ובחירת חולים
פרוטוקול הטיפול ב-ACT מלווה בשיעור גבוה של תופעות לוואי הנובעות הן מהטיפול הכימי והן ממתן IL-2. תופעות לוואי אלו מחייבות הערכה מקיפה של מטופלים טרם כניסה ל-ACT. בין היתר, ההכנה לטיפול כוללת הערכה של המצב התפקודי הכללי, ובפרט התפקוד הלבבי והריאתי ובדיקות מעבדה מקיפות, לרבות לאיתור מזהמים שונים.
תופעות לוואי שכיחות כוללות פאנציטופניה, לרבות חום ונויטרופניה, שלשול, בצקת ריאות, אי-ספיקת כליות, תת-לחץ דם, חום וצמרמורות, הפרעה בתפקודי כבד וזיהומים. לעיתים קרובות נדרשת התאמת מינון או הפסקה של מתן IL-2 בשל תופעות הלוואי. עם זאת, דיווחים על תמותה כתוצאה מרעילות של ACT הם נדירים.
דילמות בטיפול התאי ואפשרויות לשיפור הטיפול
במשך השנים נעשו ניסיונות לשפר את פרוטוקול הטיפול ב-ACT, הן בפן של רעילות הטיפול והן בפן של יעילותו. תופעות הלוואי בעיקרן נתרמות מטיפול לימפו-אבלטיבי (Lymphoablative treatment) ומטיפול במינון גבוה של IL-2. כפי שכבר הוזכר, הוספת טיפול לימפו-אבלטיבי שיפר משמעותית את תוצאות הטיפול ב-ACT, על כן לא נראה שניתן יהיה לוותר על רכיב זה. מרבית הפרוטוקולים העדכניים כוללים את המשלב הקלאסי של Fludarabine ו-Cytoxan, וטרם הוכח שיש פרוטוקול רעיל פחות המשמר את יעילות הטיפול. מינון ה-IL-2 נגזר במקור מהטיפול במינוני IL-2 גבוהים כטיפול יחיד. ישנן מספר עבודות אשר הראו תגובות גם למינוני IL-2 נמוכים יותר[10], אולם גם בהיבט זה אין הכרעה אם התפשרות על המינון מלווה בירידה בשיעורי התגובה.
תוארו ניסיונות, ברובם פרה-קליניים, לזהות אוכלוסיות נבחרות של TIL שהן בעלות פוטנציאל הישרדות, שגשוג, זיהוי אנטיגנים גידוליים והרג תאי גידול משופרים. ניסיונות קליניים מוקדמים השתמשו ב-TIL שהראו פעילות בהדגרה (אינקובציה) עם מלנומה אוטולוגית, אולם בהמשך הוכח ש-TIL "צעירים" שלא עברו מיון הם יעילים לפחות במידה שווה[11]. שיטות נוספות כוללות בחירת TIL המבטאים PD-L1 או 41BB, אולם אלו לא נכנסו לשימוש שגרתי.
הנדסה גנטית בטיפולים תאיים - Chimeric antigen receptors Recombinant TCRs-l
נוכחות תאי T בעלי יכולת לזהות אנטיגנים גידוליים היא תנאי הכרחי להצלחת מנ"ב ו-ACT בצורתו הקלאסית. בהיעדר יכולת זיהוי כזו, נדרשת גישה שונה על מנת לייצר חיסוניות כנגד הגידול. אחת הגישות משתמשת בחיסונים על מנת להפעיל שבטים רלוונטיים. אולם גם גישה זו תלויה בקיום T cell receptor) TCR) אנדוגני שניתן להפעיל ולהרחיב. גישות של הנדסה גנטית של תאי T יוצרות "מעקף" לחסם קריטי זה. ניתן להקנות לתאי T אוטולוגיים לא ספציפיים יכולת לזהות אנטיגן גידולי באמצעות הדבקה של תא T בנגיף המקודד ל-TCR או Chimeric Antigen Receptor) CAR). ה-TCR במערכות כאלו זהה ל-TCR טבעי (נטיבי) אולם מזהה אנטיגן ספציפי בהקשר של HLA (Human Leukocyte Antigen) ייחודי, כלומר ה-TCR ייקשר רק כאשר אותו אנטיגן ספציפי יוצג על מולקולת MHC (Major Histocompetability Complex) מ-HLA יחיד. מולקולת ה-CAR היא הכלאה בין נוגדן ל-TCR אשר מבוטא על פני קרום תא ה-T. החלק החוץ תאי של ה-CAR הוא למעשה נוגדן עם יכולת קישור לאנטיגנים המוצגים על פני מעטפת התא הגידולי, החלק התוך-תאי מכיל את החלק התוך-תאי של ה-TCR וכך גורם להפעלת תא ה-T באותו האופן כפי שמתקבל מהפעלת TCR. ל-CAR יתרון בכך שאינו דורש הצגה של האנטיגן על MHC ויש לו יכולת לזהות אנטיגנים לא רק על בסיס הרצף הפפטידי אלא גם לפי שינויים של החלבון, מנגד אין למולקולה זו יכולת לזהות אנטיגנים תוך-תאיים. ה-TCR המהונדס יכול לזהות אנטיגנים תוך-תאיים אולם מוגבל לכאלו המוצגים על MHC, וכאמור, כל TCR מתאים רק לנושאים את אותו הפלוטיפ של MHC. דורות מתקדמים של CAR מכילים בנוסף לאלמנט ההפעלה של ה-TCR רכיבים נוספים המגבירים את ההפעלה של תא ה-T.
טיפול בתאי T משובטים ב-CAR המוכוון נגד CD19, חלבון ממברנלי על פני תאי B, הוא היחיד שהגיע לכדי רישום לאחר שהוכיח יעילות מרשימה בטיפול בלוקמיות ולימפומות של תאי B עמידים. בגידולים סולידיים, כמו מלנומה, הקושי המשמעותי הוא בזיהוי האנטיגן את התא כגידולי. אנטיגן לא ספציפי עלול להוביל לתגובה אוטו-אימונית חריפה. במקרים רבים נראה שהאנטיגנים המשמעותיים בתיווך חיסוניות נגד גידול הם פרטניים לחולה מסוים ונובעים ממוטציות אקראיות, טיווח של נאו-אנטיגנים אלו יצריך תכנון TCR/CAR עבור כל מטופל - גישה שאינה ישימה. מטרות אפשריות לטיפול הן חלבונים אשר באופן תקין לא נמצאים באדם הבוגר, המבוטאים בהתפתחות העוברית ומבוטאים מחדש בגידולים. דוגמה לכך הוא ה-1-NY-ESO אשר מבוטא בכרבע מהמלנומות. מחקר ראשוני עם TCR נגד אנטיגן מחלבון 1-NY-ESO בקונטקסט של HLA-*A201 בחולי סינוביאל סרקומה ומלנומה המבטאים חלבון זה, הראה תגובה ב-61 אחוזים (11 מ-18) מחולי הסרקומה ו-55 אחוזים (11 מ-20) מחולי המלנומה.
עבודה עדכנית הדגימה שניתן לבודד מדם פריפרי לימפוציטים פעילים המזהים אנטיגנים גידוליים[12], אף שלא הודגם שניתן לטפל באמצעות תאים אלו באופן ישיר, ׳ייתכן שניתן יהיה להשתמש ברצף של ה-TCR שיבודד מתאים אלו על מנת להנדס ולהדביק תאי T לא ספציפיים באותו ה-TCR.
סיכום
הטיפול התאי באמצעות TIL מהווה חלופה בקו טיפולי מתקדם בחולי מלנומה גרורתית נבחרים. בחולים לאחר כישלון של טיפול במנ"ב שיעורי התגובה נמוכים יותר, אך גם בתרחיש זה ישנם חולים עם רווח ארוך טווח מ-ACT. ניתן לצפות לעליית הטיפולים באמצעות תאי T מהונדסים על חשבון הטיפול הקלאסי ב-ACT, אולם בגידולים הסולידיים בכלל ובמלנומה בפרט טיפולים אלו טרם הבשילו.
ביבליוגרפיה
- ↑ Ugurel S, Rohmel J, Ascierto PA, et al. Survival of patients with advanced metastatic melanoma: the impact of novel therapies-update 2017. Eur J Cancer. 2017 Sep;83:247-57. Epub 2017 Aug 23
- ↑ 2.0 2.1 או תרופות בעלות שמות מסחריים אחרים, המכילות חומר פעיל דומה. או תרופות בעלות שמות מסחריים אחרים המכילות חומר פעיל זהה.
- ↑ Atkins MB, Kunkel L, Sznol M, et al. High-dose recombinant interleukin-2 therapy in patients with metastatic melanoma: long-term survival update. Cancer J Sci Am. 2000 Feb;6 Suppl 1:S11-14
- ↑ Rosenberg SA, Packard BS, Aebersold PM, et al. Use of Tumor-Infiltrating Lymphocytes and Interleukin-2 in the Immunotherapy of Patients with Metastatic Melanoma. N Engl J Med. 1988 Dec 22;319(25):1676-80
- ↑ Rosenberg SA, Yannelli JR, Yang JC, et al. Treatment of patients with metastatic melanoma with autologous tumor¬infiltrating lymphocytes and interleukin 2. J Natl Cancer Inst. 1994 Aug 3;86(15):1159-66
- ↑ Dudley ME, Wunderlich JR, Yang JC, et al. Adoptive cell transfer therapy following non-myeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma. J Clin Oncol. 2005 Apr 1;23(10):2346-57
- ↑ 7.0 7.1 Rosenberg SA, Yang JC, Sherry RM, et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clin Cancer Res. 2011 Jul 1;17(13):4550-7. Epub 2011 Apr 15
- ↑ Cohen JE, Merims S, Frank S, et al. Adoptive cell therapy: past, present and future. Immunotherapy. 2017;9(2):183- 96
- ↑ Besser MJ, Shapira-Frommer R, Itzhaki O, et al. Adoptive transfer of tumor-infiltrating lymphocytes in patients with metastatic melanoma: intent-to-treat analysis and efficacy after failure to prior immunotherapies. Clin Cancer Res. 2013 Sep 1;19(17):4792-800. Epub 2013 May 20
- ↑ Nguyen LT, Saibil SD, Sotov V, et al. Phase II clinical trial of adoptive cell therapy for patients with metastatic melanoma with autologous tumor-infiltrating lymphocytes and low-dose interleukin-2. Cancer Immunol Immunother CII. 2019 Feb 11; 773-85. Epub 2019 Feb 11
- ↑ Dudley ME, Gross CA, Langhan MM, Garcia MR, Sherry RM, Yang JC, et al. CD8+ enriched “young” tumor infiltrating lymphocytes can mediate regression of metastatic melanoma. Clin Cancer Res. 2010 Dec 15;16(24):6122-31. Epub 2010 Jul 28
- ↑ Cafri G, Yossef R, Pasetto A, et al. Memory T cells targeting oncogenic mutations detected in peripheral blood of epithelial cancer patients. Nat Commun. 2019 Jan 25;10(1):449
המידע שבדף זה נכתב על ידי ד"ר יונתן כהן - מכון שרת לאונקולוגיה, מרכז רפואי הדסה עין כרם, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק