טרסטוזומאב דרוקסטקאן לטיפול בסרטן קיבה חיובי לסמן HER2 - Trastuzumab deruxtecan for the treatment of HER2-positive gastric cancer
| ENHERTU - הבשורה המפתיעה לטיפול בסרטן קיבה חיובי לסמן HER2 | ||
|---|---|---|
| Trastuzumab deruxtecan for the treatment of HER2-positive gastric cancer | ||

| ||
| יוצר הערך | ד"ר קטרינה שולמן | |
סרטן הקיבה (Gastric cancer) הוא הסרטן השישי בשכיחותו בעולם ובישראל מאובחנים מדי שנה כ-750 מקרים חדשים[1][2]. מאחר שמרבית החולים אינם מפתחים תסמינים בשלב המוקדם ובהיעדר בדיקות סקר, המחלה לרוב מאובחנת בשלבים המתקדמים, כאשר הגידול מפושט לבלוטות הלימפה או לאיברים אחרים (אתרי הגרורות השכיחים ביותר הם הכבד וחלל הצפק) והאופציה הניתוחית אינה מתאפשרת כשלב ראשון של טיפול. שלב זה של המחלה בדרך כלל אינו ניתן לריפוי ומטרות הטיפול הן שליטה בהתקדמות הגידול הסרטני, הארכת חיי המטופל והקלה בתסמינים. על אף השיפור שחל באפשרויות הטיפול בסרטן קיבה מתקדם, הוא נותר אחד מסוגי הסרטן הקשים ביותר לריפוי עם פרוגנוזה גרועה ושיעור הישרדות ל-5 שנים שעומד על 5–20 אחוזים[3][4].
הטיפול הכימותרפי נחשב במשך שנים לטיפול המקובל בארנוקרצינומה גרורתית של הקיבה. אולם, למרות השילובים השונים של הטיפולים הכימותרפיים והשימוש הנרחב בהם, חציון ההישרדות הכוללת של החולים מוגבל ועומד על כ-7–8 חורשים. היעדר פריצת דרך משמעותית ביעילות של התרופות הציטוטוקסיות המשמשות לטיפול בסרטן הקיבה, מחזקת את הצורך בטיפולים שיתבססו על גורמים פרוגנוסטיים ובטיפולים מותאמים וחדשניים עבור חולים עם סרטן קיבה גרורתי[4][5]. מטרתם של טיפולים יעילים יותר היא להגדיל את שיעורי התגובה, להאריך את ההישרדות ללא התקדמות מחלה ואת ההישרדות הכוללת, תוך ניהול תופעות הלוואי של הטיפול, הקלה על תסמינים הקשורים למחלה ושיפור איכות החיים של החולים.
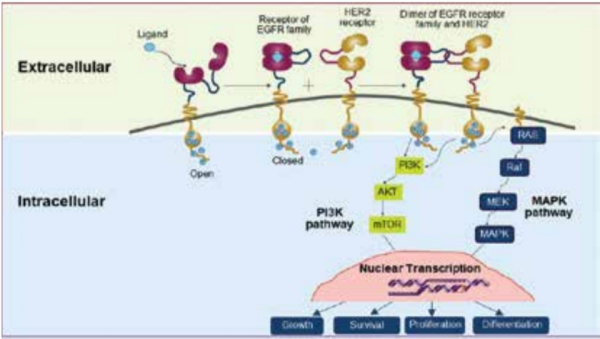
HER2 (2 Human Epidermal growth factor Receptor) הוא קולטן (חלבון) המקודד על ידי הגן ERBB2. קולטנים אלה מבוטאים על פני תאי האפיתל ומתפקדים בהעברת מסרים תוך-תאיים (הפעלת הקולטן HER2 גורמת להפעלת שרשרת ממסר של אותות דרך הציטופלזמה אל תוך הגרעין).
בגידולים סרטניים מסוימים, הגן ל-HER2 עובר הגברה (Amplification - ייצור עותקים מרובים של הגן ברמת DNA71). תהליך זה מוביל לביטוי יתר של קולטנים (Overexpression) ולשגשוג בלתי מבוקר של התאים אשר תורם להתפתחות ולהתקדמות הגידול הסרטני (תרשימים 1–2).
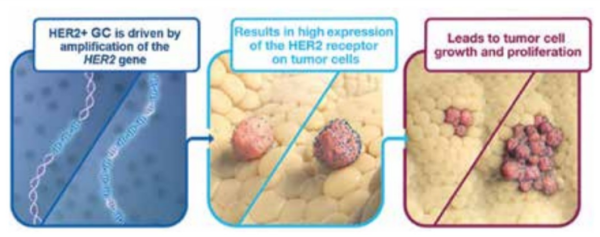
הגברה או ביטוי יתר של HER2 הן הפרעות מולקולריות המתרחשות בכ-15–20 אחוזים מכלל מקרי סרטן הקיבה. במהלך תהליך האבחון של סרטן קיבה/מעבר ושט-קיבה (GEJ - Gastro-Esophageal Junction), לצד בירור היקף הגידול ומידת התפשטותו, יש הכרח בבירור הסמנים המולקולריים של הגידול. בסרטן קיבה בירור זה כולל בין היתר את HER2 והוא מתבצע על מנת לקבוע את האסטרטגיה הטיפולית. הבדיקות מתבצעות במעבדות לפתולוגיה בבתי החולים ומהוות סטנדרט רוטיני להערכת רקמת הגידול.
במרוצת השנים פותחו טיפולים חדשים מוכוונים כנגד הסמן HER2 ובהם התרופה Trastuzumab. ההשפעה של תכשיר זה על המהלך הקליני של סרטן שד חיובי ל-HER2, כפי שהוכחה במחקרים קליניים, ביססה את הטיפול כסטנדרט הטיפולי בנשים עם סרטן שד גרורתי מסוג HER2 חיובי. לכן, לאחר זיהוי ההגברה של HER2 בסרטן קיבה, היעילות הקלינית של Trastuzumab נבדקה גם באדנוקרצינומה של הקיבה/מעבר ושט קיבה בשלב הגרורתי במחקר העולמי TOGA, מחקר אקראי שלב III[8]. מחקר זה בדק את התוספת של Trastuzumab לטיפול במשלב הכימותרפי Cisplatin ו-Fluorouracil בחולים עם אדנוקרצינומה בקיבה/מעבר ושט קיבה מתקדם חיובי ל-HER2. תוצאות המחקר הדגימו יתרון לתוספת של Trastuzumab לכימותרפיה בכלל אוכלוסיית המחקר. ניתוח פוסט-הוק של מחקר ה-TOGA הדגים כי תוספת של Trastuzumab לטיפול כימותרפי הובילה לשיפור של מעל ארבעה חודשים בהישרדות הכוללת עם יחס סיכון של 0.65 = HR (Hazard Ratio), בחולים שביטאו רמות גבוהות של HER2 בהשוואה לחולים עם ביטוי נמוך. על בסיס תוצאות מחקר T0GA, התכשיר Trastuzumab נרשם ונכלל בסל שרותי הבריאות הממלכתי כטיפול בארנוקרצינומה גרורתית של הקיבה/מעבר ושט קיבה בשילוב עם כימותרפיה, עבור חולים עם ביטוי יתר של HER2 (בדיקה אימונוהיסטוכימית 3 IHC+ או בדיקת FISH - Fluorescence In Situ Hybridization (חיובית כאשר הבדיקה האימונוהיסטוכימית היא ברמה של 2+) שטרם קיבלו טיפול למחלה הגרורתית.
לאחר הישגי מחקר TOGA, נבדקו מולקולות נוספות במספר מחקרים קליניים. אולם, אף אחד מהמחקרים לא הצליח להראות שיפור קליני משמעותי מעבר לטיפול הסטנדרטי כדי להיחשב כחלופה בת קיימא ל-Trastuzumab כטיפול ממוקד HER2 בסרטן קיבה/מעבר ושט קיבה מתקדם בקו ראשון (JACOB ,LOGiC ,HELOISE)[9][10][11]. תכשירים ממוקדי מטרה אשר הוכיחו יתרון בטיפול בסרטן שד חיובי ל-HER2 נבדקו גם בסרטן קיבה בשורה של מחקרים כגון: GATSBY ,T-ACT ו-TyTAN[12][13][14], אך הם לא הצליחו להוכיח יעילות קלינית מעבד לטיפול הסטנדרטי הקיים בסרטן קיבה בחולים עם HER2 חיובי שמחלתם התקדמה על טיפול עם Trastuzumab.
עבור מטופלים שהתקדמו על טיפול מבוסס Trastuzumab בקו ראשון, נחוצים תכשירים חדשים שמשפרים את התוצאות הקליניות של חולי סרטן קיבה חיובי ל-HER2 ושמתגברים על מנגנוני העמידות שנרכשים תוך כדי הטיפול עם Trastuzumab. נשאלת השאלה - מהי הסיבה לכך שלא כל הגידולים אשר הוגדרו כחיוביים ל-HER2 מגיבים לטיפול כנגד HER2. שאלה זו מהווה אתגר נוסף לחוקרים בעת פיתוח תכשירים חדשים. קיימות מספר סיבות מוכרות לתופעת העמידות:
- רמת הקולטן HER2 ברקמת הגידול עשויה להשתנות לאחר טיפול קודם עם Trastuzumab ולהוביל לתגובה מופחתת לטיפול ההמשכי
- סרטן קיבה הוא ממאירות הטרוגנית ביותר עם שינויים גנומיים ומולקולריים מורכבים (Complex genomic landscape)
- מספר שינויים מולקולריים הנגרמים על ידי מוטציות בגנים, כגון RAS ,EGFR ,MET ,HGF ,P13K ,PTEN, יכולים להפחית את ההשפעה מעכבת הגדילה של תכשירים כנגד HER2
התכשיר Trastuzumab deruxtecan
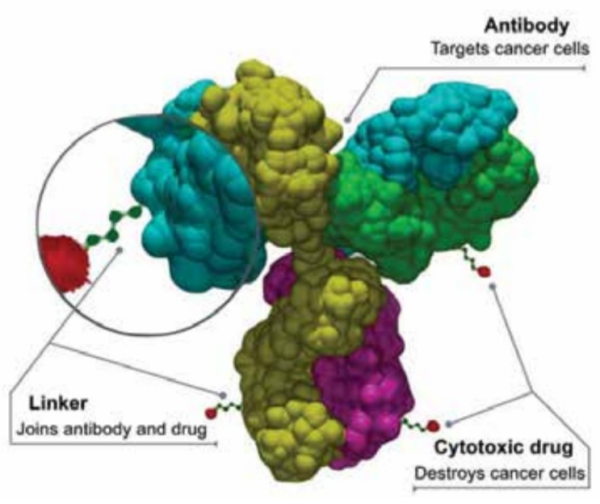
התכשיר Trastuzumab deruxtecan המופץ בשם המסחרי Enhertu T-DXd[15] משתייר לקבוצה חדשה של תרופות אונקולוגיות בשם Antibody-Drug Conjugate (ADC), מדובר במולקולה המהווה טיפול ממוקד מטרה המורכב מנוגדן חד שבטי (Monoclonal mAb ,antibody) מסוג IgG1 אנושי כנגד HER2, בעל אותו רצף חומצות אמינו כמו Trastuzumab, אשר מקושר באופן קובלנטי למולקולה מחברת (Drug linker) וכולל תרופת מטען שהיא חומר אנטי-סרטני בעל עוצמה גבוהה[16][17].
המבנה הייחודי של Enhertu משפיע על תכונותיו ומהווה הבדל משמעותי לעומת מולקולות אחרות בקבוצת מולקולות ה-ADC[16][17].
- תרופת המטען היא מעכב מסוג טופואיזומרז-1 בעלת פוטנטיות רבה ובעלת יכולת חדירות דרך ממברנות;
- היחס בין תרופת המטען הציטוטוקסית לנוגדן החד שבטי גבוה במיוחד (Drug to Antibody ratio ~ 8)
- הלינקר נחתך באופן סלקטיבי בתאי הגידול (Tumor-selective cleavable linker);
- ייתכן שיכולת החדירות הגבוהה של התרופה לממברנות מובילה לחדירת חומר פעיל גם לתאי גידול סמוכים ללא תלות בביטוי HER2 (היפותיזה המכונה bystander antitumor effect)[18], (תרשים 3). מאפיינים אלה מגבירים באופן פוטנציאלי את ההשפעה ההרסנית על תאי הגידול
הטכנולוגיה של ADC צוברת מעמד רב עוצמה ומשתלבת בטיפולים החדשים פורצי הדרך בתחום האונקולוגי. התכשיר Enhertu, שנחקר ונרשם, מדגים תוצאות קליניות המשנות את ההנחיות הטיפוליות הקיימות.
מחקר DESTINY-Gastric01 פאזה II, אקראי, רב מרכזי, תווית פתוחה[20], בחן את היעילות והבטיחות הקלינית של התכשיר Enhertu לעומת כימותרפיה לפי בחירת החוקר, באוכלוסייה אסיאתית (יפן וקוריאה). המחקר גייס 187 מטופלים עם סרטן קיבה/מעבר ושט-קיבה מתקדם או גרורתי חיובי ל-HER2, שמחלתם התקדמה על לפחות שני קווי טיפול קודמים שכללו טיפולים סטנדרטיים מבוססי Fluoropyrimidine ו-Platinum וטופלו בעברם בנוגדן אנטי HER2 - Trastuzumab. התוצא הראשוני של המחקר היה שיעור התגובה האובייקטיבית (ORR, overall response rate). הטיפול עם Enhertu, כפי שהוערך על ידי ועדה מרכזית בלתי תלויה (Independent central review), הביא לשיעורי תגובה כוללת של 51.3 אחוזים (42 אחוזים Confirmed ORR), אשר הייתה גבוהה משמעותית בהשוואה לשיעור תגובה של 14.3 אחוזים (12.5 אחוזים Confirmed ORR) עם טיפול כימותרפי בלבד לפי בחירת החוקר (0.0001>p). עשרה מטופלים (8.4 אחוזים) בזרוע שקיבלה Enhertu השיגו תגובה מלאה (CR - Complete Response) של נסיגת גידול. זוהי תוצאה הסרת תקדים בקו טיפול מתקדם[21].
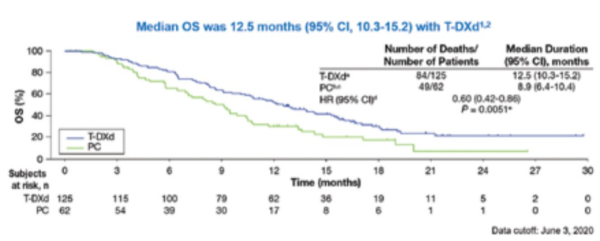
כמו כן, הושג שיפור משמעותי בהישרדות הכוללת OS - Overall Survival (תוצא שניוני במחקר) בקרב המטופלים שקיבלו Enhertu עם תוצאה מובהקת סטטיסטית ויתרון של כארבעה חודשים מול זרוע הביקורת (חציון ההישרדות הכוללת למטופלים שטופלו עם Enhertu היה 12.5 חודשים לעומת 8.9 חודשים בזרוע שטופלה עם טיפול כימותרפי סטנדרטי לפי בחירת הרופא (HR=0.60; 95% CI*, 0.42 to 0.86; P = 0.0051) (תרשים 4).
*CI - Confidence Interval
בנוסף, נמצא שחציון משך התגובה (Duration of Response) היה 12.5 חודשים (CI could not be estimated, 5.6 to 95%) בזרוע של המטופלים שקיבלו Enhertu, לעומת פחות מארבעה חודשים (95%, 4.9 CI, 3.0 to) בזרוע של המטופלים שטופלו עם טיפול סטנדרטי לפי בחירת הרופא. גם תוצאה זו מהווה פריצת ררך משמעותית וחסרת תקדים בקו טיפול מתקדם זה[20][21].
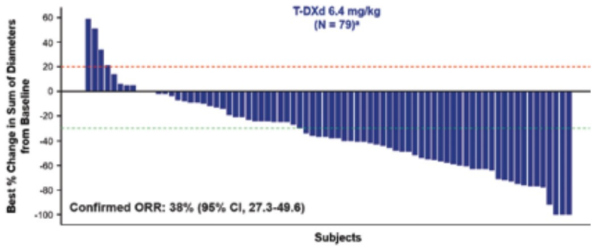
מחקר DESTINY-Gastric02[22] מכוון ספציפית לאוכלוסיית חולים מערביים, אשר גויסו ממרכזים רפואיים באירופה ובארצות הברית, עם סרטן קיבה/מעבר ושט קיבה מסוג אדנוקרצינומה חיובי לסמן HER2, הנמצאים בשלב מחלה בלתי נתיחה או גרורתית ואשר התקדמו על טיפול אחד קודם כנגד הקולטן HER2 המבוסס על הנוגדן Trastuzumab. 79 מטופלים גויסו למחקר, כאשר הגיל החציוני עמד על 61 שנים ול-86 אחוזים מהמטופלים היה ביטוי גבוה של הסמן IHC 3+) HER2). תוצאות המחקר הוצגו בפעם הראשונה בבמת כנס האיגוד האירופאי לאונקולוגיה רפואית - European Society Medical Oncology - ESMO 2021. באנליזה ראשונית מתוך מחקר DESTINY-Gastric02 הודגמו שיעור תגובה אובייקטיבית (Confirmed ORR) ונסיגה של התהליך הממאיר בקרוב ל-40 אחוזים מהמטופלים כפי שהוערך על ידי ועדה מרכזית בלתי תלויה (Independent Central Review).
3 תגובות מלאות (Complete Response, CR) ו-27 (34 אחוזים) תגובות חלקיות (Partial Response, PR) נצפו בחולים שטופלו עם Enhertu (תרשים 5)[22]. התוצאות החיוביות של DESTINY-Gastric02 תואמות את אלו שנראו במחקר הרישום DESTINY-Gastric01.
פרופיל תופעות הלוואי בשני המחקרים היה עקבי ובדומה לפרופיל תופעות הלוואי המוכר עם טיפול כימותרפי. במחקר Destiny-Gastric01 תופעות הלוואי השכיחות ביותר של הטיפול עם Enhertu לעומת טיפול הביקורת היו ירידה בנויטרופילים (65 אחוזים לעומת 35 אחוזים), אנמיה (60 אחוזים לעומת 30 אחוזים) ותופעות לוואי הקשורות למערכת העיכול, בעיקר בחילה (60 אחוזים לעומת 50 אחוזים) וירידה בתיאבון (60 אחוזים לעומת 45 אחוזים). תופעת לוואי בסיכון מיוחד שעלולה לקרות תחת הטיפול עם Enhertu היא ILD - Interstitial Lung Disease/פניאומוניטיס. שיעור התופעה מגיע ל-10 אחוזים כאשר דרגה מתקדמת אובחנה בכ-2.5 אחוזים מהמקרים. אבחון מוקדם של התופעה מוריד סיכון לסיבוך משמעותי קליני ומכאן החשיבות להנחות את המטופל לדווח לצוות המטפל על סימפטומים כמו קוצר נשימה, שיעול, חום והופעה או החמרה בתסמינים נשימתיים[23].
בהתבסס על תוצאות מחקר DESTINY-Gastric01, התרופה Enhertu אושרה לשימוש על ידי ה-FDA (Food and Drug Administration, בינואר 2021) ומומלצת על ידי קווי ההנחיה הבינלאומיים של ה-NCCN (National Comprehensive Cancer Network) באונקולוגיה (NCCN Guidelines) לסרטן קיבה ומעבר ושט קיבה, לטיפול בחולים עם סרטן קיבה או מעבר ושט קיבה חיובי ל-HER2 לא נתיח או גרורתי שקיבלו טיפול קודם[24]. הטיפול נרשם בישראל באוגוסט 2021 והוגש לסל התרופות 2023.
תיאור מקרה מהספרות
תיאור מקרה מהספרות של מטופל עם אדנוקרצינומה בקיבה בשלב גרורתי אשר נכשל על מספר קווי טיפול קודמים הכוללים
Cisplatin, Capecitabin ו-Trastuzumab, Ramucirumab ו-Paclitaxel ו-Irinotican, מדגים את הצורך במציאת תרופה נוספת עם יכולת קלינית משמעותית שתשפיע על הגידול ובמיוחד במקרה זה כאשר חלק מהגרורות היו גרורות במוח. המטופל קיבל טיפול עם Enhertu ולפי הדיווח בתיאור המקרה, לאחר חמישה מחזורים נצפה שיפור בתסמינים הקליניים, כאשר טומוגרפיה ממוחשבת (CT - Computed Tomography) והדמיית תהודה מגנטית (MRI - Magnetic Resonance Imaging) הדגימו כיווץ משמעותי של הגידול[25].
המולקולה T-DXd נמצאת בתהליך פיתוח קליני נרחב הכולל את מחקר Destiny gastric 03, ניסוי פאזה Ib/II. המחקר בודק את הבטיחות של Enhertu עם משלבים שונים של כימותרפיה ו/או טיפול אימונותרפיה, בניגוד למחקרים קודמים שבדקו את Enhertu כטיפול בודד. פרוטוקול המחקר דווח במהלך כנס 2022 ASCO Gastrointestinal Cancers Symposium ונכון לתחילת שנת 2023, ממתינים לעדכון ולסיכום התוצאות[26].
לסיכום, בעוד שהתועלת של הטיפול כנגד HER2 בגידול מסוג סרטן קיבה גרורתי בקו ראשון הוכחה היטב, המחלה מתקדמת בסופו של דבר ולאחר מכן אפשרויות הטיפול מוגבלות. התוצאות החיוביות של המחקרים שבחנו את יעילות Enhertu בסרטן קיבה מראות שיעור תגובה גבוה ושיפור בהישרדות הכוללת, מחזקות את פרופיל היעילות והבטיחות של Enhertu ומביאות בשורה, חדשנות ותקווה הן לחולים והן לרופאים המטפלים.
ביבליוגרפיה
- ↑ https://www.gov.il/he/departments/publications/reports/ stomach-cancer-report-2021
- ↑ https://gco.iarc.fr/today/data/factsheets/populations/376- is rael-fact-sheets, pdf
- ↑ Bernards, N.; Creemers, G. J.; Nieuwenhuijzen, G, A.; Bosscha, K.; Pruijt, J. F.; Lemmens, V. E., No improvement in median survival for patients with metastatic gastric cancer despite increased use of chemotherapy. Annals of oncology : official journal of the European Society for Medical Oncology 2013, 24 (12), 3056-60
- ↑ 4.0 4.1 Kahraman, S.; Yalcin, S., Recent Advances in Systemic Treatments for HER-2 Positive Advanced Gastric Cancer. OncoTargets and therapy 2021, 14,4149-4162
- ↑ Hu, H. M.; Tsai, H. J.; Ku, H. Y.; Lo, S. S.; Shan, Y. S.; Chang, H. C.; Chao, Y.; Chen, J. S.; Chen, S. C.; Chiang, C. J.; Li, A. F.; Wang, H. P.; Wang, T. E.; Bai, L. Y.; Wu, M. S.; Chen, L. T.; Liu, T. W.; Yang, Y. H״ Survival outcomes of management in metastatic gastric adenocarcinoma patients. Scientific reports 2021, 11 (1), 23142
- ↑ Gerson, J. N.; Skariah, S.; Denlinger, C. S.; Astsaturov, I., Perspectives of HER2-targeting in gastric and esophageal cancer. Expert Opinion on Investigational Drugs 2017, 26 (5), 531-540
- ↑ Lv, Q.; Meng, Z.; Yu, Y.; Jiang, F.; Guan, D.; Liang, C.; Zhou, J.; Lu, A.; Zhang, G., Molecular Mechanisms and Translational Therapies for Human Epidermal Receptor 2 Positive Breast Cancer. 2016,17 (12), 2095
- ↑ Bang, Y. J.; Van Cutsem, E.; Feyereislova, A.; Chung, H. C.; Shen, L; Sawaki, A.; Lordick, F.; Ohtsu, A.; Omuro, Y.; Satoh, T.; Aprile, G.; Kulikov, E.; Hill, J.; Lehle, M.; Ruschoff, J.; Kang, Y. K., Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro- oesophageal junction cancer (T0GA): a phase 3, open-label, randomised controlled trial. Lancet (London, England) 2010, 376 (9742), 687-97
- ↑ Shah, M. A.; Xu, R. H.; Bang, Y. J.; Hoff, P. M.; Liu, T.; Herrdez-Baranda, L. A.; Xia, F.; Garg, A.; Shing, M.; Tabernero, J., HELOISE: Phase lllb Randomized Multicenter Study Comparing Standard-of■Care and Higher-Dose Trastuzumab Regimens Combined With Chemotherapy as First-Line Therapy in Patients With Human Epidermal Growth Factor Receptor 2-Positive Metastatic Gastric or Gastroesophageal Junction Adenocarcinoma. Journal of clinical oncology : official journal of the American Society of Clinical Oncology < 2017, 35 (22), 2558-2567
- ↑ Hecht, J. R.; Bang, Y. J.; Qin, S. K.; Chung, H. C.; Xu, J. M.; Park, J. O.; Jeziorski, K.; Shparyk, Y.; Hoff, P. M.; Sobrero, A.; Salman, P.; Li, J.; Protsenko, S. A.; Wainberg, Z. A.; Buyse, M.; Afenjar, K.; Houb, V.; Garcia, A.; Kaneko, T.; Huang, Y.; Khan-Wasti, S.; Santillana, S.; Press, M. F.; Slamon, D., Lapatinib in Combination With Capecitabine Plus Oxaliplatin in Human Epidermal Growth Factor Receptor 2-Positive Advanced or Metastatic Gastric, Esophageal, or Gastroesophageal Adenocarcinoma: TRIO-013/LOGiC-A Randomized Phase III Trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2016, 34 (5), 443-51
- ↑ Tabernero, J.; Hoff, P. M.; Shen, L.; Ohtsu, A.; Shah, M. A.; Cheng, K.; Song, C.; Wu, H.; Eng-Wong, J.; Kim, K.; Kang, Y. K״ Pertuzumab plus trastuzumab and chemotherapy for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (JACOB): final analysis of a double-blind, randomised, placebo- controlled phase 3 study. The Lancet. Oncology 2018, 19(10), 1372-1384
- ↑ Makiyama, A.; Sukawa, Y.; Kashiwada, T.; Kawada, J.; Hosokawa, A,; Horie, Y.; Tsuji, A.; Moriwaki, T.; Tanioka, H.; Shinozaki, K.; Uchino, K,; Yasui, H.; Tsukuda, H.; Nishikawa, K.; Ishida, H.; Yamanaka, T.; Yamazaki, K.; Hironaka, S.; Esaki, T.; Boku, N.; Hyodo, I,; Muro, K., Randomized, Phase II Study of Trastuzumab Beyond Progression in Patients With HER2-P0sitive Advanced Gastric or Gastroesophageal Junction Cancer: WJOG7112G (T-ACT Study). Journal of clinical oncology: official journal of the American Society of Clinical Oncology 2020, 38 (17), 1919-1927
- ↑ Thuss-Patience, P. C.; Shah, M. A.; Ohtsu, A.; Van Cutsem, E.; Ajani, J. A.; Castro, H.; Mansoor, W.; Chung, H. C.; Bodoky, G.; Shitara, K.; Phillips, G. D. L.; van der Horst, T.; Harle-Yge, M. L.; Althaus, B. L.; Kang, Y. K., Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. The Lancet. Oncology 2017, 18(5), 640-653
- ↑ Satoh, T.; Xu, R. H.; Chung, H. C.; Sun, G. P.; Doi, T.; Xu, J. M.; Tsuji, A.; Omuro, Y.; Li, J.; Wang, J. W.; Miwa, H.; Qin, S. K.; Chung, I. J.; Yeh, K. H.; Feng, J. F.; Mukaiyama, A.; Kobayashi, M.; Ohtsu, A.; Bang, Y. J., Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN--a randomized, phase III study. Journal of clinical oncology: ספרות: official journal of the American Society of Clinical Oncology 2014, 32(19), 2039-49
- ↑ או שמות מסחריים אחרים
- ↑ 16.0 16.1 Nakada, T.; Sugihara, K.; Jikoh, T.; Abe, Y.; Agatsuma, T., The Latest Research and Development into the Antibody¬Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chemical & pharmaceutical bulletin 2019, 67 (3), 173-185
- ↑ 17.0 17.1 Ogitani, Y.; Aida, T.; Hagihara, K.; Yamaguchi, J.; Ishii, C.; Harada, N.; Soma, M.; Okamoto, H.; Oitate, M.; Arakawa, S.; Hirai, T.; Atsumi, R.; Nakada, T.; Hayakawa, I.; Abe, Y.; Agatsuma, T״ DS-8201a, A Novel HER2- Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1. Clinical cancer research : an official journal of the American Association for Cancer Research 2016, 22 (20), 5097-5108
- ↑ Ogitani, Y.; Hagihara, K.; Oitate, M.; Naito, H.; Agatsuma, T., Bystander killing effect of DS-8201a, a novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity. Cancer science 2016,107 (7), 1039-46
- ↑ https://www.adcreview.com/the-review/antibody-drug- conjugates/whal-are-antibody-drug-conjugates
- ↑ 20.0 20.1 Shitara, K.; Bang, Y.-J.; Iwasa, S.; Sugimoto, N.; Ryu, M.- H.; Sakai, D.; Chung, H.-C.; Kawakami, H.; Yabusaki, H.; Lee, J.; Saito, K.; Kawaguchi, Y.; Kamio, T.; Kojima, A.; Sugihara, M.; Yamaguchi, K., Trastuzumab Deruxtecan in Previously Treated HER2-P0sitive Gastric Cancer. 2020, 382 (25), 2419-2430
- ↑ 21.0 21.1 21.2 Yamaguchi K et al. Presented at: ASCO Virtual Congress 2021; June 4-8, 2021
- ↑ 22.0 22.1 Van Cutsem E et al. Presented at: ESMO Virtual Congress 2021; September 17-21,2021
- ↑ Enhertu® prescribing information approved by Israel ministry of health. May 2022
- ↑ The NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Gastric Cancer V.2.2022. © National Comprehensive Cancer Network, Inc, 2022
- ↑ Yoshida, J.; Sugiyama, K.; Satoh, M.; Shiraishi, K.; Nishibori, R.; Kitagawa, C., Efficacy of trastuzumab deruxtecan in an advanced gastric cancer patient with brain metastasis. Current problems in cancer 2021,45 (6), 100757
- ↑ Yelena Janjigian et al. Presented at: ASCO Gastrointestinal Cancers Symposium; January 20-22, 2022; San Francisco, CA
המידע שבדף זה נכתב על ידי ד"ר קטרינה שולמן, מנהלת מכון אונקולוגי מרחבי, בית החולים כרמל, המרכז הרפואי לין
הכתבה בחסות בלתי תלויה של חברת אסטרהזניקה
IL-33O9


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק