הבדלים בין גרסאות בדף "סרטן ריאה - Lung Cancer"
| (52 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 8: | שורה 8: | ||
|ICD-9={{ICD9|162}} | |ICD-9={{ICD9|162}} | ||
|MeSH={{MeSH|D002283}} | |MeSH={{MeSH|D002283}} | ||
| − | |יוצר הערך=ד"ר | + | |יוצר הערך=ד"ר אליזבטה דודניק |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
{{הרחבה|סרטן ריאה}} | {{הרחבה|סרטן ריאה}} | ||
| − | ==אפידמיולוגיה== | + | ==אפידמיולוגיה וגורמי סיכון== |
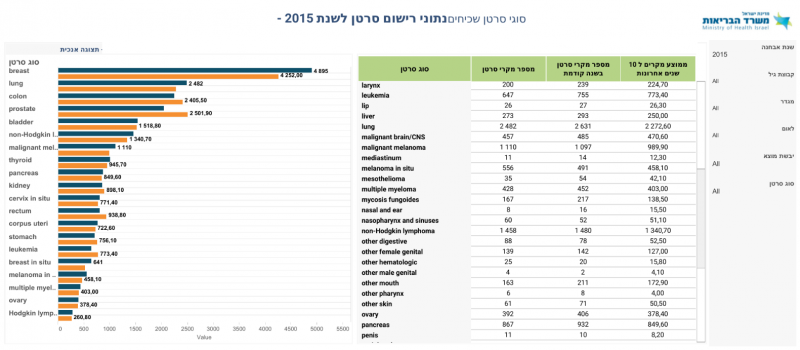
| − | שיעור התחלואה | + | סרטן הריאה מהווה את אחד הגידולים הנפוצים ביותר בעולם. שיעור התחלואה בסרטן הריאה מצוי בעלייה מתמדת, וממאירות זו מהווה את גורם התמותה המוביל מסרטן בקרב גברים ונשים כאחד. לפי הערכה סטטיסטית מבוססת על נתוני עבר, 228,820 אנשים יאובחנו עם סרטן ריאה בארצות הברית במהלך 2020 ו- 135,720 ימותו כתוצאה מהמחלה{{הערה|שם=הערה1|Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics. ''Adv Exp Med Biol''. 2016;893:1-19. doi:10.1007/978-3-319-24223-1_1}}. לפי נתוני הרישום הלאומי לסרטן, בישראל מאובחנים מדי שנה כ-2500 מקרים חדשים של שאת ריאה{{הערה|שם=הערה2|1=[https://public.tableau.com/views/_5224/sheet3_1?%3Aembed=y&%3AshowVizHome=nhttps%3A%2F%2Fpublic.tableau.com%2Fviews%2F_5224%2Fsheet2%3F%3Aembed&%3AshowVizHome=no&%3AshowTabs=y&%3Adisplay_count=y&%3Adisplay_static_image=y#%21 נתוני רישום סרטן לשנת 2015 - סוגי סרטן שכיחים]}}. |
| − | + | [[קובץ:סרטן2015.png|מרכז|ממוזער|800 פיקסלים|תמונה 1 - סרטן ריאה בישראל - מגמת התחלואה בעשור 2006–2015]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | + | == גורמי סיכון == |
| − | + | '''עישון''': גורם הסיכון העיקרי, כתלות במספר שנות העישון ובכמות הסיגריות ליום. עישון אחראי על התפתחות כ-85 אחוזים מכלל מקרי סרטן ריאה{{הערה|שם=הערה3|Taylor R, Najafi F, Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. Int J Epidemiol. 2007;36(5):1048-1059. doi:10.1093/ije/dym158}}. [[עישון]] פאסיבי (Passive) גם הוא מעלה סיכון לחלות בסרטן ריאה{{הערה|שם=הערה4|Taylor R, Najafi F, Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. Int J Epidemiol. 2007;36(5):1048-1059. doi:10.1093/ije/dym158}}. | |
| − | + | '''מחלת ריאות חסימתית כרונית''' על רקע עישון (Chronic obstructive pulmonary disease ,[[COPD]]) נספרים גם הם עם גורמי סיכון להתפתחות שאת ריאה. אנו עדים לעלית השיעור של מקרי סרטן ריאה בקרב לא מעשנים. | |
| − | + | '''זיהום אוויר''' | |
| − | + | '''חשיפה תעסוקתית''' [כגון לאזבסט ([[Asbestosis]]), סיליקה ([[Silica]]), סולר, גז רדון (Radon)] | |
| − | |||
| − | + | '''חשיפה לקרינה מייננת''' (כגון קרינה טיפולית בשל [[מחלת הודג'קין|Hodgkin's disease]] או במסגרת תאונות עבודה) | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | '''סיפור משפחתי של סרטן ריאה''' | |
| − | |||
| − | |||
| − | |||
| − | + | == קליניקה == | |
| − | + | התסמינים השכיחים של סרטן ריאה כוללים [[שיעול]], [[קוצר נשימה]], [[כיח דמי]], [[כאבים בחזה]], [[דלקות ריאה]] נשנות, [[חוסר תיאבון]], [[ירידה במשקל]] ו[[חולשה]] כללית. בחולים עם תסמינים לרוב מאובחנת המחלה בשלב מתקדם. בעוד אבחון המחלה בטרם התפתחות התסמינים אפשרי ומומלץ. כך, אבחון מוקדם (בדיקת סקר, Screening) של סרטן ריאה מבוסס על טומוגרפיה ממוחשבת (Computer Tomography ,[[CT]]) של בית חזה באנשים נמצאים בקבוצת הסיכון להתפתחות סרטן ריאה (כגון מעשנים כבדים עם היסטוריית עישון של 30 שנות/חפיסה ויותר) מעלה שיעור המקרים המאובנים בשלבים מוקדים וכתוצאה מכך – גורם לירידה של 20 אחוזים בשיעור התמותה מסרטן ריאה{{הערה|שם=הערה5|National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011;365(5):395-409. doi:10.1056/NEJMoa1102873}}. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | האבחנה של סרטן ריאה מבוצעת לרוב על ידי נטילת [[ביופסיה]] (Biopsy) באמצעות בדיקת [[ברונכוסקופיה]] (Bronchoscopy) או דיקור מונחה טומוגרפיה ממוחשבת (Computed Tomography Guided lung biopsy), אשר באמצעותם ניתן לקבוע גם את סוג ההיסטולוגי (Histological) של הגידול. לקביעת שלב המחלה ודרגת ההתפשטות של הגידול משתמשים בבדיקות הדמיה כגון [[PET-CT|FDG-PET]] scan{{כ}} (Fluorodeoxyglucose-Positron Emission Tomography){{כ}} ו[[בדיקת תהודה מגנטית|תהודה מגנטית]] (Magnetic Resonance Imaging - MRI){{כ}}{{הערה|שם=הערה6|[https://www.nccn.org/professionals/physician_gls/default.aspx#nscl NCCN Guidelines]}}. | |
| − | |||
| − | == | + | ==סיווג הגידולים== |
| − | + | לפי המלצת הארגון הבריאות העולמי ( World Health Organization – WHO) משנת 2015 מקובל לחלק גידולי ריאה לשני סוגים עיקריים{{הערה|שם=הערה7|Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol. 2015;10(9):1243-1260. doi:10.1097/JTO.0000000000000630}}: סרטן ריאה בנוי תאים שאינם קטנים (Non-Small Cell Lung Carcinoma – [[NSCLC]] המהווים כ-80 אחוזים ממקרי סרטן ריאה) וגידולים נוירו-אנדוקריניים (Neuroendocrine) בתוכם השולט הוא סוג סרטן ריאה בנוי תאים קטנים (Small-Cell Lung Carcinoma – [[SCLC]]). | |
| − | + | === Non-Small Cell Lung Carcinoma{{כ}} - NSCLC === | |
| + | מורכב ממספר תתי-סוגים היסטולוגים{{הערה|שם=הערה7}} | ||
| − | == | + | ==== Adenocarcinoma - סרטן ריאה מטיפוס בלוטי ==== |
| − | === | + | [[אדנוקרצינומה|Adenocarcinoma]] - תת-הסוג השכיח מבין NSCLC ושכיחותו נמצאת במגמת עלייה מתמדת. מקור הגידול כאן הוא בדרכי האוויר הקטנות, ולפיכך מדובר בגידולים ממוקמים לרוב בפריפריה של הריאה. מבחינת המאפיינים הפתולוגיים והצביעות האימונוהיסטוכימיות (Immunohistochemical) (המשמשות לקביעת הסוגים השונים של גידולי ריאה), תאי אדנוקרצינומה נצבעות חיובית ל-TTF-1, Napsin A ושלילית ל-p40, p63 |
| − | |||
| − | ==== | + | ==== Squamous-cell carcinoma - סרטן ריאה מטיפוס קשקשי ==== |
| − | + | [[Squamous cell carcinoma of the lung|Squamous-cell carcinoma]] - שכיחותו היחסית נמצאת במגמת ירידה, והוא מהווה כ-20–30 אחוזים מכלל סרטני הריאה NSCLC. מקור הגידול כאן בסמפונות הגדולים, ולרוב מיקומם מרכזי וקרוב למיצר. מבחינה אימונוהיסטוכימית, תאי גידול קשקשי נצבעות חיובית ל- ל- p40, p63 ושלילית ל- TTF-1 ,Napsin A | |
| − | + | ==== סוגים אחרים ==== | |
| − | + | קרצינומה של תאים גדולים (Large Cell Carcinoma), קרצינומה אדנו-קשקשית (Adeno-squamous), קרצינומה Sarcomatoid, קרצינומה מסוג Salivary gland - סוגים אלו נדירים. | |
| − | |||
| − | === | + | === הגידולים הנוירו-אנדוקריניים של הריאה === |
| − | + | המהווים כ-20 אחוזים ממקרי סרטן ריאה - כוללים{{הערה|שם=הערה7}}. | |
| − | + | ==== Small-cell lung carcinoma –{{כ}} SCLC - סרטן ריאה בנוי תאים קטנים ==== | |
| − | + | התת-סוג השולט בקבוצה זו, לרוב מתפתח בקרב מעשנים כבדים, המתאפיין במהלך אגרסיבי (Aggressive) והתפתחות פיזור מרוחק בשני שלישים מהמקרים כבר בעת האבחון הראשוני. הגידול לרוב ממוקם במרכז בית החזה כאשר מקורו בסמפונות הגדולים. מבחינה היסטולוגית, גידול זה בנוי תאים עגולים או אובליים (Oval) בגודל קטן, בעל מורפולוגיה נוירו-אנודקרינית (Nuroendocrine Morphology), שיעור מיטוטי (Mitotic) גבוה ודרגת התמיינות נמוכה. נצבע חיובית ל- Synaptophysin, Chromogranin A, NSE, CD56 שאלה מהווים צביעות אופינייות לגידולים נוירו-אנדוקריניים | |
| − | ==== | + | ==== Large-cell neuroendocrine carcinoma of lung - סרטן ריאה נוירו-אנדוקריני בנוי תאים גדולים ==== |
| − | + | תת-סוג נדיר יותר, דומה מאוד מבחינת המאפיינים והתנהגות לסרטן ריאה בנוי תאים קטנים, אך מורפולוגית שונה מבחינת גודל התאים כאמור לעיל | |
| − | + | ==== Carcinoid ==== | |
| + | כאן יש להבדיל בין תת-סוג הטיפוסי ולא טיפוסי (אגרסיבי יותר בין שניהם). הגידולים שהתפתחותם לא קשורה לעישון, הם מתאפיינים בגדילה איטית ומהלך המחלה שפיר יותר. מורפולוגית בעלי מורפולוגיה נוירו-אנודקרינית, שיעור מיטוטי נמוך ודרגת התמיינות גבוהה. | ||
| − | == | + | == שלב המחלה בעת האבחון== |
| − | + | לשלב המחלה יש משמעות פרוגנוסטית, וכן הגישה הטיפולית נקבעת בהתאם. שלב המחלה מוגדר לפי סיווג ה-TNM ומבוסס על גודל הגידול הראשוני, חדירה לאיברים סמוכים, מעורבות בלוטות לימפה בשער הריאה, במיצר ובאזור העל-בריחי, וכן פיזור משני מרוחק{{הערה|שם=הערה8|Detterbeck FC. The eighth edition TNM stage classification for lung cancer: What does it mean on main street?. J Thorac Cardiovasc Surg. 2018;155(1):356-359. doi:10.1016/j.jtcvs.2017.08.138}} | |
| − | + | סיווג TNM מתייחס לשלושה מאפיינים: | |
| − | + | #מאפיין T – גודל ומידת החדירה של הגידול הראשוני | |
| + | #מאפיין N – נקבע בהתאם לדרגת המעורבות ומיקום של בלוטות לימפה אזוריות | ||
| + | #מאפיין M – מתאר הימצאות גרורות מרוחקות באיברים שונים (כגון ריאה, שלד, כבד, בלוטות יותרת הכיליה ומוח) | ||
| − | + | נמצאת בשימוש הגרסה השמינית של הסיווג, שניתן לעיין בהגדרותיה בתמונה 2. במקביל, בסרטן ריאה מסוג SCLC משתמשים בסיווג דו-שלבי, כאשר שלב הממוקם (Limited stage) עונה להגדרה של מחלה הנכללת בשדה קרינה אחד, בעוד ובשלב מתקדם (Extensive stage) ישנו פיזור מרוחק או לחלופין מחלה כה גדולה ששדה קרינה אחד לא יכול להכליל את מלוא הגידול בו. | |
| − | === | + | כ-57 אחוזים מהחולים החדשים מאובחנים בשלב גרורתי (שלב 4){{הערה|שם=הערה1}} זה מסביר שיעור הישרדות נמוך יחסית בתום 5 שנים ממועד אבחון המחלה - העומד על 19 אחוזים{{הערה|שם=הערה1}}. עם זאת, שיעורי הישרדות בתום 5 שנים בשלבים מוקדמים של המחלה (שלב 1,2) גבוהים בהרבה ונעים בין 55 ל-90 אחוזים{{הערה|שם=הערה9|Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016;11(1):39-51. doi:10.1016/j.jtho.2015.09.009}}. תחזית בשלב 3 של המחלה נקבע בהתאם לדרגת המעורבות של הבלוטות האזוריות, שיעורי הישרדות ל-5 שנים כאן נעים בין 15 ל-40 אחוזים{{הערה|שם=הערה9}}. |
| − | |||
| − | + | [[קובץ:סרטן-2015-1.png|ממוזער|מרכז|800 פיקסלים|תמונה 2 - הגדרות של קטגוריות T, N, M לפי הגרסה מספר 8 של American Joint Commission on Cancer TNM staging system (AJCC) for NSCLC{{כ}}{{הערה|שם=הערה8}}.]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | [[קובץ:סרטן2015-2.png|מרכז|800 פיקסלים]] | |
| − | + | [[קובץ:סרטן2015-3.png|ממוזער|מרכז|800 פיקסלים|תמונה 3 - תחזית (הישרדות חציונית – MST, הישרדות בתום 24 חודש ו-60 חודש ממועד האבחון) של סרטן ריאה מסוג NSCLC בהתאם לשלב המחלה{{הערה|שם=הערה9}}.]] | |
| − | |||
| − | |||
| − | + | הטיפול נקבע בהתאם לשלב המחלה ומשלב ניתוח''',''' [[קרינה]], [[כימותרפיה]] (Chemotherapy), [[אימונותרפיה]] (Immuotherapy), טיפול ביולוגי (Biological) מכוון מטרה ו[[טיפול פליאטיבי|טיפול תומך]] (Palliative care) לפי הצורך. במרבית המקרים (מלבד השלבים המוקדמים של המחלה בהם עיקר הטיפול הוא כירורגי או קרינתי הניתן לבדו), הטיפול בסרטן ריאה משלב שיטות טיפול שונות (Multi-modality treatment){{כ}}{{הערה|שם=הערה10|Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28 Suppl 4:iv1-iv21. doi:10.1093/annonc/mdx222}}. | |
| − | + | ==חידושים בטיפול בשלב מתקדם== | |
| + | יותר ממחצית מחולי סרטן ריאה מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה, כבד, בלוטות יותרת הכליה ומוח .עד העשור הראשון של המאה ה-21, הגישה הטיפולית בשלב זה התבססה על טיפול כימותרפי. שינוי מהפכני שחל בעשור השני של המאה ה-21 הביא לשיפור משמעותי בתחזית כלל התפחות שיטות הטיפול בשני כיוונים עיקריים: | ||
| + | #'''טיפולים ביולוגים מכווני מטרה''' – השיטה כאן מבוססת על זיהוי של המנגנון המולקולרי (Molecular) שאחראי על התפתחות הסרטן (Driver mutation) ושימוש בטיפול ביולוגי מכוון כנגד מנגנון משפעל | ||
| + | #'''טיפולים אימונותרפיים''' על ידי מעכבי נקודות בקרה חיסונית (Immune check-point inhibitors) - השיטה שמורידה את השפעתם של הגורמים המעכבים ממערכת החיסון של הגוף ועל ידי כך מאפשרת לה תקוף את הגידול הסרטני | ||
| − | + | ===טיפולים ביולוגים מכווני מטרה=== | |
| + | מדובר בטיפול ביולוגי מותאם אישית, שהתאפשר בזכות זיהוי של מוטציות (Mutations) משפעלות בתאי הגידול (כגון מוטציות בגנים (Genes){{כ}} EGFR{{כ}}, [[ROS-1]]{{כ}}, [[ALK]]{{כ}} (Anaplastic Lymphoma Kinase){{כ}}, [[NTRK]]{{כ}} (Neurotrophin Tyrosine Kinases){{כ}}, [[BRAF]]{{כ}}, [[c-MET]]{{כ}}, [[RET]]{{כ}} (REarranged during Transfection) ו-[[HER-2]]{{כ}} (Human Epidermal Growth factor Receptor 2) ופיתוח תרופות הפועלות נגד המוטציות הללו. כך, כ-30–40 אחוזים מגידולי ריאה גרורתיים מסוג Adenocarcinoma עשויים להיות גידולים נושאי מוטציה הפעלתית, שכנגדה קיימים טיפולים ממוקדי מטרה הניתנים בצורת פומית. לאורך השנים, פותחו דורות חדשים של תכשירים ביולוגיים עבור המוטציות הללו, לרבות תכשירים שמסוגלים להתמודד עם מנגנוני העמידות הנרכשת (עמידות שמפתחים תאי סרטניים במהלך הטיפול) ומאפשרים מתן מספר טיפולים ביולוגיים ברצף אחד לאחר השני. כך לדוגמה, פותחו כבר מספר דורות מעכבי EGFR (כגון [[T:Gefitinib|Gefitinib]]{{כ}}, [[Erlotinib]]{{כ}}, [[T:Afatinib|Afatinib]]{{כ}}, [[Osimertinib]]), מעכבי ALK{{כ}} ([[Crizotinib]]{{כ}}, [[Alectinib]]{{כ}}, [[T:Ceritinib|Ceritinib]]{{כ}}, [[Brigatinib]]{{כ}}, [[T:Lorlatinib|Lorlatinib]]) מעכבי ROS-1{{כ}} ([[Crizotinib]]{{כ}}, [[T:Entrectinib|Entrectinib]]{{כ}}, [[T:Repotrectinib|Repotrectinib]]{{כ}}, [[T:Lorlatinib|Lorlatinib]]) ומעכבי c-MET{{כ}} ([[Crizotinib]]{{כ}}, [[T:Capmatinib|Capmatinib]]{{כ}}, [[T:Tepotinib|Tepotinib]]{{כ}}, [[T:Savolitinib|Savolitinib]]). טיפולים אלה שינו לטובה את מהלך המחלה בחולים שגידולם נושא מוטציה משפעלת, איפשרו לחלק מהחולים לשרוד 5 שנים ואף יותר{{הערה|שם=הערה11|Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-1064. doi:10.1016/j.annonc.2020.04.478}}, וכן שיפרו משמעותית את איכות חייהם. | ||
| − | + | ;בחירת החולים: | |
| − | + | בחירת חולים שמתאימים לטיפולים מכווני מטרה היא קריטית, וכדי למצוא את המוטציה ההפעלתית בגידול מסוים מומלץ לבצע אבחון מולקולרי מעמיק עם תיעדוף לשיטות שמבוססות על ריצוף גנומי (Genomic sequencing) מהדור החדש - Next Generation Sequencing) NGS). בדיקות אלה, המכונות בדיקות גנומיות מקיפות, מאבחנות את הפרופיל המולקולרי (Molecular profile) של הגידול, ובאמצעות ריצוף של מאות גנים במקביל הן מתאימות בצורה מדויקת יותר אפשרויות טיפול ממוקד המכוונות כנגד המוטציות ההפעלתיות. | |
| − | === | + | ===טיפולים אימונותרפיים=== |
| − | + | אחד מהמאפיינים של סוגי סרטן רבים הוא שהתאים הסרטניים מוצאים דרך להתחמק מתגובת מערכת החיסון. {{ש}}אימונותרפיה חדישה ״מורידה את הבלמים״ ממערכת החיסון וכך מגבירה את יכולת מערכת החיסון להילחם בסרטן. אימונתרפיה היוותה פריצת דרך משמעותית בטיפול בסרטן ריאה מתקדם. כך לדוגמה, בסרטן ריאה מתקדם מסוג NSCLC, מחקרים רבים הוכיחו כי מתן אימונותרפיה בהשוואה למתן כימותרפיה מביא להישרדות ארוכה יותר{{הערה|שם=הערה12|Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823-1833. doi:10.1056/NEJMoa1606774}}, רעילות קלה יותר ואיכות חיים טובה יותר{{הערה|שם=הערה13|Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017;18(12):1600-1609. doi:10.1016/S1470-2045(17)30690-3}}{{הערה|שם=הערה14|Reck M, Schenker M, Lee KH, et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden: patient-reported outcomes results from the randomised, open-label, phase III CheckMate 227 trial. Eur J Cancer. 2019;116:137-147. doi:10.1016/j.ejca.2019.05.008}}. היתרון הבולט של אימונותרפיה הוא בעובדה כי המטופלים שמגיבים לטיפול עשויים לשרוד שנים ארוכות. כך לדוגמה, 25-14 אחוזים, בהתאם לדרגת הביטוי של PD-L1 {{כ}}(Programmed Death Ligand-1) בתאי הגידול מהחולים עם NSCLC בשלב מתקדם עשויים לשרוד 4 שנים ויותר ממועד תחילת אימונותרפיה{{הערה|שם=הערה15|Antonia SJ, Borghaei H, Ramalingam SS, et al. Four-year survival with nivolumab in patients with previously treated advanced non-small-cell lung cancer: a pooled analysis. Lancet Oncol. 2019;20(10):1395-1408. doi:10.1016/S1470-2045(19)30407-3}}{{הערה|שם=הערה16|Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study. J Clin Oncol. 2019;37(28):2518-2527. doi:10.1200/JCO.19.00934}}. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | = | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==ראו גם== | ==ראו גם== | ||
| שורה 141: | שורה 104: | ||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
{{הערות שוליים|יישור=שמאל}} | {{הערות שוליים|יישור=שמאל}} | ||
| − | + | {{שש}} | |
| − | + | {{ייחוס|ד"ר אליזבטה דודניק, רופאה בכירה, שרות גידולי ריאה, מרכז דוידוף, ב"ח בלינסון, מזכירת חוג ישראלי לסרטן ריאה, עורכת אתר רשמי של החוג הישראלי לסרטן ריאה}} | |
| − | {{ייחוס|ד"ר | ||
[[קטגוריה:אונקולוגיה]] | [[קטגוריה:אונקולוגיה]] | ||
[[קטגוריה:פולמונולוגיה]] | [[קטגוריה:פולמונולוגיה]] | ||
גרסה אחרונה מ־11:26, 26 באוקטובר 2020
| סרטן ריאה | ||
|---|---|---|
| Lung Cancer | ||
| ||
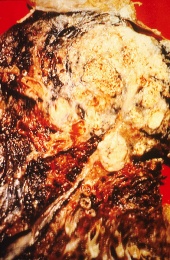
חתך רחבי של ריאת אדם; השטח הלבן באונה העליונה הוא סרטן, והאזורים השחורים הם שינויי צבע שנגרמו עקב עישון.
| ||
| ICD-10 | Chapter C 33. Chapter C 34. |
|
| ICD-9 | 162 | |
| MeSH | D002283 | |
| יוצר הערך | ד"ר אליזבטה דודניק | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן ריאה
אפידמיולוגיה וגורמי סיכון
סרטן הריאה מהווה את אחד הגידולים הנפוצים ביותר בעולם. שיעור התחלואה בסרטן הריאה מצוי בעלייה מתמדת, וממאירות זו מהווה את גורם התמותה המוביל מסרטן בקרב גברים ונשים כאחד. לפי הערכה סטטיסטית מבוססת על נתוני עבר, 228,820 אנשים יאובחנו עם סרטן ריאה בארצות הברית במהלך 2020 ו- 135,720 ימותו כתוצאה מהמחלה[1]. לפי נתוני הרישום הלאומי לסרטן, בישראל מאובחנים מדי שנה כ-2500 מקרים חדשים של שאת ריאה[2].
גורמי סיכון
עישון: גורם הסיכון העיקרי, כתלות במספר שנות העישון ובכמות הסיגריות ליום. עישון אחראי על התפתחות כ-85 אחוזים מכלל מקרי סרטן ריאה[3]. עישון פאסיבי (Passive) גם הוא מעלה סיכון לחלות בסרטן ריאה[4].
מחלת ריאות חסימתית כרונית על רקע עישון (Chronic obstructive pulmonary disease ,COPD) נספרים גם הם עם גורמי סיכון להתפתחות שאת ריאה. אנו עדים לעלית השיעור של מקרי סרטן ריאה בקרב לא מעשנים.
זיהום אוויר
חשיפה תעסוקתית [כגון לאזבסט (Asbestosis), סיליקה (Silica), סולר, גז רדון (Radon)]
חשיפה לקרינה מייננת (כגון קרינה טיפולית בשל Hodgkin's disease או במסגרת תאונות עבודה)
סיפור משפחתי של סרטן ריאה
קליניקה
התסמינים השכיחים של סרטן ריאה כוללים שיעול, קוצר נשימה, כיח דמי, כאבים בחזה, דלקות ריאה נשנות, חוסר תיאבון, ירידה במשקל וחולשה כללית. בחולים עם תסמינים לרוב מאובחנת המחלה בשלב מתקדם. בעוד אבחון המחלה בטרם התפתחות התסמינים אפשרי ומומלץ. כך, אבחון מוקדם (בדיקת סקר, Screening) של סרטן ריאה מבוסס על טומוגרפיה ממוחשבת (Computer Tomography ,CT) של בית חזה באנשים נמצאים בקבוצת הסיכון להתפתחות סרטן ריאה (כגון מעשנים כבדים עם היסטוריית עישון של 30 שנות/חפיסה ויותר) מעלה שיעור המקרים המאובנים בשלבים מוקדים וכתוצאה מכך – גורם לירידה של 20 אחוזים בשיעור התמותה מסרטן ריאה[5].
האבחנה של סרטן ריאה מבוצעת לרוב על ידי נטילת ביופסיה (Biopsy) באמצעות בדיקת ברונכוסקופיה (Bronchoscopy) או דיקור מונחה טומוגרפיה ממוחשבת (Computed Tomography Guided lung biopsy), אשר באמצעותם ניתן לקבוע גם את סוג ההיסטולוגי (Histological) של הגידול. לקביעת שלב המחלה ודרגת ההתפשטות של הגידול משתמשים בבדיקות הדמיה כגון FDG-PET scan (Fluorodeoxyglucose-Positron Emission Tomography) ותהודה מגנטית (Magnetic Resonance Imaging - MRI)[6].
סיווג הגידולים
לפי המלצת הארגון הבריאות העולמי ( World Health Organization – WHO) משנת 2015 מקובל לחלק גידולי ריאה לשני סוגים עיקריים[7]: סרטן ריאה בנוי תאים שאינם קטנים (Non-Small Cell Lung Carcinoma – NSCLC המהווים כ-80 אחוזים ממקרי סרטן ריאה) וגידולים נוירו-אנדוקריניים (Neuroendocrine) בתוכם השולט הוא סוג סרטן ריאה בנוי תאים קטנים (Small-Cell Lung Carcinoma – SCLC).
Non-Small Cell Lung Carcinoma - NSCLC
מורכב ממספר תתי-סוגים היסטולוגים[7]
Adenocarcinoma - סרטן ריאה מטיפוס בלוטי
Adenocarcinoma - תת-הסוג השכיח מבין NSCLC ושכיחותו נמצאת במגמת עלייה מתמדת. מקור הגידול כאן הוא בדרכי האוויר הקטנות, ולפיכך מדובר בגידולים ממוקמים לרוב בפריפריה של הריאה. מבחינת המאפיינים הפתולוגיים והצביעות האימונוהיסטוכימיות (Immunohistochemical) (המשמשות לקביעת הסוגים השונים של גידולי ריאה), תאי אדנוקרצינומה נצבעות חיובית ל-TTF-1, Napsin A ושלילית ל-p40, p63
Squamous-cell carcinoma - סרטן ריאה מטיפוס קשקשי
Squamous-cell carcinoma - שכיחותו היחסית נמצאת במגמת ירידה, והוא מהווה כ-20–30 אחוזים מכלל סרטני הריאה NSCLC. מקור הגידול כאן בסמפונות הגדולים, ולרוב מיקומם מרכזי וקרוב למיצר. מבחינה אימונוהיסטוכימית, תאי גידול קשקשי נצבעות חיובית ל- ל- p40, p63 ושלילית ל- TTF-1 ,Napsin A
סוגים אחרים
קרצינומה של תאים גדולים (Large Cell Carcinoma), קרצינומה אדנו-קשקשית (Adeno-squamous), קרצינומה Sarcomatoid, קרצינומה מסוג Salivary gland - סוגים אלו נדירים.
הגידולים הנוירו-אנדוקריניים של הריאה
המהווים כ-20 אחוזים ממקרי סרטן ריאה - כוללים[7].
Small-cell lung carcinoma – SCLC - סרטן ריאה בנוי תאים קטנים
התת-סוג השולט בקבוצה זו, לרוב מתפתח בקרב מעשנים כבדים, המתאפיין במהלך אגרסיבי (Aggressive) והתפתחות פיזור מרוחק בשני שלישים מהמקרים כבר בעת האבחון הראשוני. הגידול לרוב ממוקם במרכז בית החזה כאשר מקורו בסמפונות הגדולים. מבחינה היסטולוגית, גידול זה בנוי תאים עגולים או אובליים (Oval) בגודל קטן, בעל מורפולוגיה נוירו-אנודקרינית (Nuroendocrine Morphology), שיעור מיטוטי (Mitotic) גבוה ודרגת התמיינות נמוכה. נצבע חיובית ל- Synaptophysin, Chromogranin A, NSE, CD56 שאלה מהווים צביעות אופינייות לגידולים נוירו-אנדוקריניים
Large-cell neuroendocrine carcinoma of lung - סרטן ריאה נוירו-אנדוקריני בנוי תאים גדולים
תת-סוג נדיר יותר, דומה מאוד מבחינת המאפיינים והתנהגות לסרטן ריאה בנוי תאים קטנים, אך מורפולוגית שונה מבחינת גודל התאים כאמור לעיל
Carcinoid
כאן יש להבדיל בין תת-סוג הטיפוסי ולא טיפוסי (אגרסיבי יותר בין שניהם). הגידולים שהתפתחותם לא קשורה לעישון, הם מתאפיינים בגדילה איטית ומהלך המחלה שפיר יותר. מורפולוגית בעלי מורפולוגיה נוירו-אנודקרינית, שיעור מיטוטי נמוך ודרגת התמיינות גבוהה.
שלב המחלה בעת האבחון
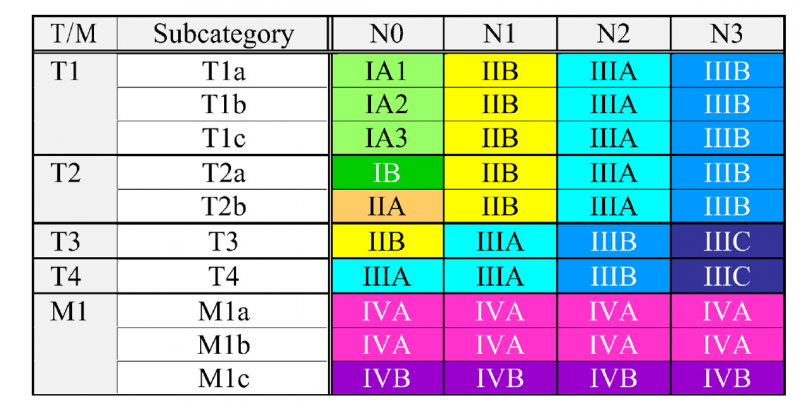
לשלב המחלה יש משמעות פרוגנוסטית, וכן הגישה הטיפולית נקבעת בהתאם. שלב המחלה מוגדר לפי סיווג ה-TNM ומבוסס על גודל הגידול הראשוני, חדירה לאיברים סמוכים, מעורבות בלוטות לימפה בשער הריאה, במיצר ובאזור העל-בריחי, וכן פיזור משני מרוחק[8]
סיווג TNM מתייחס לשלושה מאפיינים:
- מאפיין T – גודל ומידת החדירה של הגידול הראשוני
- מאפיין N – נקבע בהתאם לדרגת המעורבות ומיקום של בלוטות לימפה אזוריות
- מאפיין M – מתאר הימצאות גרורות מרוחקות באיברים שונים (כגון ריאה, שלד, כבד, בלוטות יותרת הכיליה ומוח)
נמצאת בשימוש הגרסה השמינית של הסיווג, שניתן לעיין בהגדרותיה בתמונה 2. במקביל, בסרטן ריאה מסוג SCLC משתמשים בסיווג דו-שלבי, כאשר שלב הממוקם (Limited stage) עונה להגדרה של מחלה הנכללת בשדה קרינה אחד, בעוד ובשלב מתקדם (Extensive stage) ישנו פיזור מרוחק או לחלופין מחלה כה גדולה ששדה קרינה אחד לא יכול להכליל את מלוא הגידול בו.
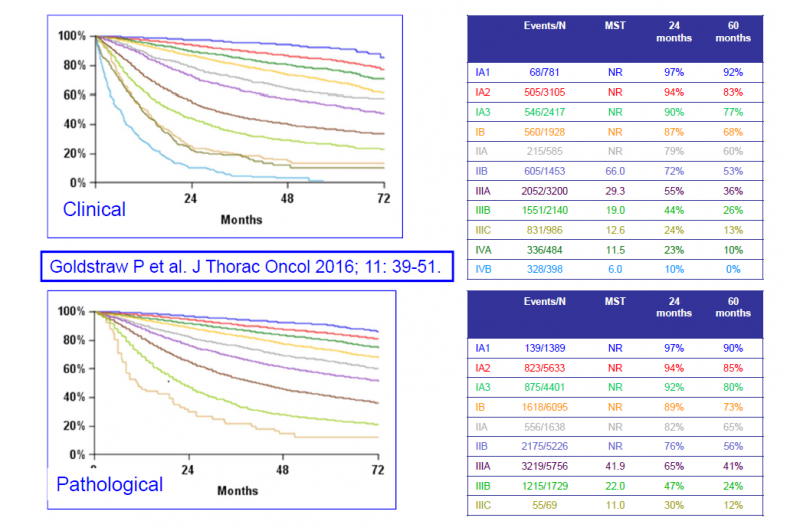
כ-57 אחוזים מהחולים החדשים מאובחנים בשלב גרורתי (שלב 4)[1] זה מסביר שיעור הישרדות נמוך יחסית בתום 5 שנים ממועד אבחון המחלה - העומד על 19 אחוזים[1]. עם זאת, שיעורי הישרדות בתום 5 שנים בשלבים מוקדמים של המחלה (שלב 1,2) גבוהים בהרבה ונעים בין 55 ל-90 אחוזים[9]. תחזית בשלב 3 של המחלה נקבע בהתאם לדרגת המעורבות של הבלוטות האזוריות, שיעורי הישרדות ל-5 שנים כאן נעים בין 15 ל-40 אחוזים[9].
הטיפול נקבע בהתאם לשלב המחלה ומשלב ניתוח, קרינה, כימותרפיה (Chemotherapy), אימונותרפיה (Immuotherapy), טיפול ביולוגי (Biological) מכוון מטרה וטיפול תומך (Palliative care) לפי הצורך. במרבית המקרים (מלבד השלבים המוקדמים של המחלה בהם עיקר הטיפול הוא כירורגי או קרינתי הניתן לבדו), הטיפול בסרטן ריאה משלב שיטות טיפול שונות (Multi-modality treatment)[10].
חידושים בטיפול בשלב מתקדם
יותר ממחצית מחולי סרטן ריאה מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה, כבד, בלוטות יותרת הכליה ומוח .עד העשור הראשון של המאה ה-21, הגישה הטיפולית בשלב זה התבססה על טיפול כימותרפי. שינוי מהפכני שחל בעשור השני של המאה ה-21 הביא לשיפור משמעותי בתחזית כלל התפחות שיטות הטיפול בשני כיוונים עיקריים:
- טיפולים ביולוגים מכווני מטרה – השיטה כאן מבוססת על זיהוי של המנגנון המולקולרי (Molecular) שאחראי על התפתחות הסרטן (Driver mutation) ושימוש בטיפול ביולוגי מכוון כנגד מנגנון משפעל
- טיפולים אימונותרפיים על ידי מעכבי נקודות בקרה חיסונית (Immune check-point inhibitors) - השיטה שמורידה את השפעתם של הגורמים המעכבים ממערכת החיסון של הגוף ועל ידי כך מאפשרת לה תקוף את הגידול הסרטני
טיפולים ביולוגים מכווני מטרה
מדובר בטיפול ביולוגי מותאם אישית, שהתאפשר בזכות זיהוי של מוטציות (Mutations) משפעלות בתאי הגידול (כגון מוטציות בגנים (Genes) EGFR, ROS-1, ALK (Anaplastic Lymphoma Kinase), NTRK (Neurotrophin Tyrosine Kinases), BRAF, c-MET, RET (REarranged during Transfection) ו-HER-2 (Human Epidermal Growth factor Receptor 2) ופיתוח תרופות הפועלות נגד המוטציות הללו. כך, כ-30–40 אחוזים מגידולי ריאה גרורתיים מסוג Adenocarcinoma עשויים להיות גידולים נושאי מוטציה הפעלתית, שכנגדה קיימים טיפולים ממוקדי מטרה הניתנים בצורת פומית. לאורך השנים, פותחו דורות חדשים של תכשירים ביולוגיים עבור המוטציות הללו, לרבות תכשירים שמסוגלים להתמודד עם מנגנוני העמידות הנרכשת (עמידות שמפתחים תאי סרטניים במהלך הטיפול) ומאפשרים מתן מספר טיפולים ביולוגיים ברצף אחד לאחר השני. כך לדוגמה, פותחו כבר מספר דורות מעכבי EGFR (כגון Gefitinib, Erlotinib, Afatinib, Osimertinib), מעכבי ALK (Crizotinib, Alectinib, Ceritinib, Brigatinib, Lorlatinib) מעכבי ROS-1 (Crizotinib, Entrectinib, Repotrectinib, Lorlatinib) ומעכבי c-MET (Crizotinib, Capmatinib, Tepotinib, Savolitinib). טיפולים אלה שינו לטובה את מהלך המחלה בחולים שגידולם נושא מוטציה משפעלת, איפשרו לחלק מהחולים לשרוד 5 שנים ואף יותר[11], וכן שיפרו משמעותית את איכות חייהם.
- בחירת החולים
בחירת חולים שמתאימים לטיפולים מכווני מטרה היא קריטית, וכדי למצוא את המוטציה ההפעלתית בגידול מסוים מומלץ לבצע אבחון מולקולרי מעמיק עם תיעדוף לשיטות שמבוססות על ריצוף גנומי (Genomic sequencing) מהדור החדש - Next Generation Sequencing) NGS). בדיקות אלה, המכונות בדיקות גנומיות מקיפות, מאבחנות את הפרופיל המולקולרי (Molecular profile) של הגידול, ובאמצעות ריצוף של מאות גנים במקביל הן מתאימות בצורה מדויקת יותר אפשרויות טיפול ממוקד המכוונות כנגד המוטציות ההפעלתיות.
טיפולים אימונותרפיים
אחד מהמאפיינים של סוגי סרטן רבים הוא שהתאים הסרטניים מוצאים דרך להתחמק מתגובת מערכת החיסון.
אימונותרפיה חדישה ״מורידה את הבלמים״ ממערכת החיסון וכך מגבירה את יכולת מערכת החיסון להילחם בסרטן. אימונתרפיה היוותה פריצת דרך משמעותית בטיפול בסרטן ריאה מתקדם. כך לדוגמה, בסרטן ריאה מתקדם מסוג NSCLC, מחקרים רבים הוכיחו כי מתן אימונותרפיה בהשוואה למתן כימותרפיה מביא להישרדות ארוכה יותר[12], רעילות קלה יותר ואיכות חיים טובה יותר[13][14]. היתרון הבולט של אימונותרפיה הוא בעובדה כי המטופלים שמגיבים לטיפול עשויים לשרוד שנים ארוכות. כך לדוגמה, 25-14 אחוזים, בהתאם לדרגת הביטוי של PD-L1 (Programmed Death Ligand-1) בתאי הגידול מהחולים עם NSCLC בשלב מתקדם עשויים לשרוד 4 שנים ויותר ממועד תחילת אימונותרפיה[15][16].
ראו גם
למידע נוסף ועדכני ראו:
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics. Adv Exp Med Biol. 2016;893:1-19. doi:10.1007/978-3-319-24223-1_1
- ↑ נתוני רישום סרטן לשנת 2015 - סוגי סרטן שכיחים
- ↑ Taylor R, Najafi F, Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. Int J Epidemiol. 2007;36(5):1048-1059. doi:10.1093/ije/dym158
- ↑ Taylor R, Najafi F, Dobson A. Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent. Int J Epidemiol. 2007;36(5):1048-1059. doi:10.1093/ije/dym158
- ↑ National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011;365(5):395-409. doi:10.1056/NEJMoa1102873
- ↑ NCCN Guidelines
- ↑ 7.0 7.1 7.2 Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol. 2015;10(9):1243-1260. doi:10.1097/JTO.0000000000000630
- ↑ 8.0 8.1 Detterbeck FC. The eighth edition TNM stage classification for lung cancer: What does it mean on main street?. J Thorac Cardiovasc Surg. 2018;155(1):356-359. doi:10.1016/j.jtcvs.2017.08.138
- ↑ 9.0 9.1 9.2 Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016;11(1):39-51. doi:10.1016/j.jtho.2015.09.009
- ↑ Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28 Suppl 4:iv1-iv21. doi:10.1093/annonc/mdx222
- ↑ Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-1064. doi:10.1016/j.annonc.2020.04.478
- ↑ Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823-1833. doi:10.1056/NEJMoa1606774
- ↑ Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017;18(12):1600-1609. doi:10.1016/S1470-2045(17)30690-3
- ↑ Reck M, Schenker M, Lee KH, et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden: patient-reported outcomes results from the randomised, open-label, phase III CheckMate 227 trial. Eur J Cancer. 2019;116:137-147. doi:10.1016/j.ejca.2019.05.008
- ↑ Antonia SJ, Borghaei H, Ramalingam SS, et al. Four-year survival with nivolumab in patients with previously treated advanced non-small-cell lung cancer: a pooled analysis. Lancet Oncol. 2019;20(10):1395-1408. doi:10.1016/S1470-2045(19)30407-3
- ↑ Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study. J Clin Oncol. 2019;37(28):2518-2527. doi:10.1200/JCO.19.00934
המידע שבדף זה נכתב על ידי ד"ר אליזבטה דודניק, רופאה בכירה, שרות גידולי ריאה, מרכז דוידוף, ב"ח בלינסון, מזכירת חוג ישראלי לסרטן ריאה, עורכת אתר רשמי של החוג הישראלי לסרטן ריאה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק