דלקת כבד נגיפית B - טיפול - Hepatitis B - treatment
הופניתם מהדף עדכון טיפולי בדלקת כבד נגיפית B לדף הנוכחי.
| עדכון טיפולי בדלקת כבד נגיפית B | ||
|---|---|---|
| Hepatitis B - Treatment | ||

| ||
| שמות נוספים | דלקת כבד נגיפית B- אפידמיולוגיה, אבחנה, מניעה וטיפול | |
| ICD-10 | Chapter B 16., Chapter B 18.0-Chapter B 18.1 |
|
| ICD-9 | 070.2 | |
| MeSH | D006509 | |
| יוצר הערך | פרופסור ריפעת ספדי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפטיטיס
דלקת כבד נגיפית B (Hepatitis B) נחשבת לאחד הזיהומים השכיחים והקשים ביותר בעולם וגורמת מדי שנה למותם של כמיליון חולים על פי נתוני ארגון הבריאות העולמי (WHO ,World Health Organization) משנת 2000. דלקת כבד נגיפית B נגרמת על ידי נגיף דלקת כבד B (HBV ,Hepatitis B Virus), ובצורתה החריפה עלולה לגרום תסמינים קשים ורבים, כגון חולשה, עייפות, חום, הקאה וכן להופעת צהבת. המחלה החריפה עלולה להפוך לכרונית ב- 5-10% מן המבוגרים. בילדים, הסיכון להפוך לחולה כרוני גבוה עוד יותר [1].
אפידמיולוגיה
יותר משני מיליארד בני אדם, כמעט שליש מתושבי העולם, נדבקו בדלקת כבד נגיפית B, מהם כ- 350 מיליון הינם נשאים כרוניים [2]. יותר משליש מהנפגעים בעולם נמצאים באסיה, במזרח התיכון ובאפריקה [3]. רוב החולים חסרי תסמינים, ולמרות זאת המחלה גורמת לאחוזי תמותה גבוהים מסיבוכי המחלה ברבע מן הנשאים, כגון אי-ספיקת כבד (Liver insufficiency), שחמת (Cirrhosis) [4] וגידול בכבד [5]. בשנת 1992 המליץ ארגון הבריאות העולמי לחסן נגד דלקת כבד נגיפית B. בזכות תכנית החיסונים הבינלאומית, שיעור ההמצאות של נשאי הנגיף בעולם המערבי עומד על פחות מ- 2%.
שיעור נשאות הנגיף בישראל נע בין פחות מ- 1% ל- 8% לפי אזורי מגורים [6]. השיעורים נעים בין 0.63% (באוכלוסייה היהודית-אשכנזית) ל- 8.2% (בקרב חלקים מאוכלוסייה הערבית) [7], ומגיעים עד 18% בקרב האוכלוסייה האתיופית [8]. שיעור הנשאות לנגיף בקרב הנשים המוסלמיות עומד על 4.3%, לעומת 0.67% בקרב הנשים היהודיות באותה העיר [9]. במחקר עדכני יותר שנערך בשנת 2005 בירושלים, שיעור הנשאות ל- HBV לפי זיהוי חיובי של הסמן אנטיגן שטח הפנים של HBV (HBsAg ,Hepatitis B Surface Antigen) בקרב אוכלוסיית מבוטחי קופת חולים כללית היה 2.6%, אך עמד על 3.9% בקרב המבוטחים הערבים, לעומת 1.59% בקרב היהודים [10].
העברת הנגיף מהאם לילוד גורמת להדבקתם של 40% מכלל הילדים שנולדים לאימהות עם HBsAg חיובי בדרום מזרח אסיה [11]. מסקירת הספרות לאחר שנת 1992 עולה כי שיעור הדבקה כרונית בצורה אנכית בארץ הוא אפס [12]. על פי נתונים משנת 2005 בירושלים, הדבקה של HBV מהאם לילוד מתרחשת בשיעור של 8.4% לפי זיהוי חיובי של נוגדנים לחלבון הליבה של HBV (anti-HBc ,Hepatitis B Core Antibody), כאשר 4.4% מהמקרים שזוהו נותרו נשאי HBsAg עד תום תקופת המעקב [13]. לפי זיהוי נוגדנים לאנטיגן שטח פני הנגיף HBV (anti-HBs ,Hepatitis B Surface Antibody), נמצא כי 37% מהילדים היו עם כייל נוגדני anti-HBs שלילי, 41% עם כייל נוגדנים בשיעור 11-100 מילי-יחידות בינלאומיות למיליליטר, ו- 22% עם כייל נוגדנים מעל 100 מילי-יחידות בינלאומיות למיליליטר.
בדיקות מעבדה
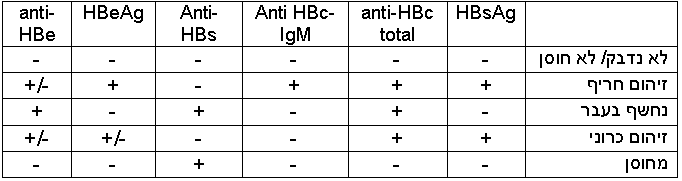
בעזרת כלים מעבדתיים, אפשר לזהות מרכיבי נגיף המעידים על נשאות שלו בגוף, כולל את חלבון HBsAg (נקרא "אנטיגן אוסטרליה" בעבר), חלבון הליבה של HBV (HBc ,Hepatitis B Core Antigen) הנמצא בתוך הנגיף ולא משתחרר בקלות למחזור הדם, אנטיגן e של HBV (HBeAg ,Hepatitis B e-Antigen) המהווה חלק מהליבה שכן משוחרר למחזור הדם, ואת חלקיקי הגנום של הנגיף עצמו (HBV-DNA) בשיטות תגובת שרשרת של פולימראז (PCR ,Polymerase Chain Reaction) כמותיות ואיכותיות. מערכת החיסון מגיבה ובונה נוגדנים נגד האנטיגנים של הנגיף, אשר ניתן לזהותם בדם. קיימים שני סוגים של נוגדנים מסוג anti-HBc: נוגדן מסוג M (IgM ,Immunoglobulin M), שמרמז על זיהום חריף בששת חודשים האחרונים, ונוגדן מסוג G (IgG ,Immunoglobulin G) שמרמז על זיהום בעבר [14].
מניעה
החיסון הפעיל נגד HBV
ערכים מורחבים – דלקת כבד Hepatitis B, חיסון נגד דלקת כבד B לקבוצות בסיכון
הדרך הטובה ביותר למניעת הדבקה רוחבית היא קבלת חיסון פעיל. החיסון המסורתי הישן בארץ היה חיסון פעיל נגד HBV מסוג ENGERIX-B, אך לאחרונה אושר בסל הבריאות חיסון חדש בשם Sci B Vac, הכולל לא רק את HBsAg אלא גם את חלבוני Pre-S1 ו- Pre-S2 שהינם בעלי השפעה חיסונית חזקה יותר. החיסון החדש מביא לתגובה מהירה יותר, רמות נוגדנים גבוהות יותר ואחוז מגיבים גבוה בהשוואה לתכשירים על בסיס HBsAg בלבד. החיסון לדלקת כבד נגיפית B כולל שלוש זריקות הניתנות במהלך חצי שנה, ומעניק חיסוניות למשך שנים רבות. כיום מחסנים בארץ את כל התינוקות כחלק משגרת החיסונים בטיפת חלב (זריקה ראשונה מיד אחרי הלידה). מחקר פרוספקטיבי בארץ הראה יתרונות של חיסון פעיל חדש לעומת החיסון הישן במניעת העברת הדבקה מהאם לילוד, ותוצאות המחקר אומצו על ידי משרד הבריאות והוטמעו בהמלצותיו [15]. כמו כן, מחסנים בחיסון הפעיל עובדי מערכת הבריאות, מטיילים למדינות המזרח וקרובי משפחה של חולה או נשא HBV תוך מעקב אחר רמת הנוגדנים בדמם. בנוסף לחיסונים, יש צורך במניעה מכאנית (Mechanical), הכוללת זהירות ממגע ישיר עם הפרשות חולה או נשא HBV, דקירות ממחטים או ציוד חד כלשהו הנמצא בשימוש החולה או הנשא, ושימוש בקונדום בעת קיום יחסי מין [16].
החיסון הסביל נגד HBV
החיסון הסביל נגד HBV מושג על ידי מתן נוגדן ייחודי כנגד הנגיף (HBIG ,Hepatitis B Immune Globulin). החיסון ניתן זמן קצר לפני או מיד לאחר חשיפה ל- HBV. ההגנה מיידית, אך יעילה לתקופה של שלושה עד ששה חודשים בלבד. החיסון הסביל אינו מומלץ כטיפול מונע לפני החשיפה מכיוון שהוא יקר, יעיל לזמן קצר וגורם לעתים נדירות לתופעות לוואי לא רצויות כגון אנפילקסיס (Anaphylaxis). HBIG ניתן למבוגר תוך שעות מזמן החשיפה.
טיפול
ראו גם – דלקת כבד נגיפית - Hepatitis Infection - B#טיפול
הטיפול במחלה החריפה
הטיפול בדלקת כבד נגיפית B חריפה הוא נגד התסמינים בלבד, למעט המקרים הקשים בהם רוב הניסיון הטיפולי שתואר היה עם Zeffix (Lamivudine). לאחרונה פורסמו עבודות עם תרופות חדישות יותר. בזכות התערבות טיפולית מהירה במקרים קשים, כיום נדירים מקרים חדשים של אי-ספיקת כבד חדה על רקע הנגיף. יש להיזהר ממצבי נשאות HBV כרוניים שלא היו מאובחנים, ומגיעים לתשומת לב רפואית רק בעת שפעול נגיפי המדמה מחלה חריפה ויכול אף להטעות סרולוגית. מצב כזה זקוק להתחלת טיפול מיידית.
הטיפול במחלה הכרונית
לעומת המחלה החריפה, מקובל לטפל בחולה כרוני פעיל על פי ריכוז עומס נגיפי מעל 2,000 יחידות למיליליטר בסרום עם עדות של נזק כבדי. עדות זאת, באופן היסטורי, מתקבלת באמצעות ביופסיית כבד, אך לאור החודרנות שבביופסיה, ניתן להסתפק גם בעליית אנזימי כבד או עדות לנזק בבדיקות לא חודרניות כגון פיברומקס (FibroMax test) ופיברוסקאן (Fibroscan). שתי הטכנולוגיות מאושרות בסל הבריאות לאומדן נזק כבדי לפני טיפול במחלת דלקת כבד נגיפית C (Hepatitis C) ולא לשימוש אחר.
הטיפול בדלקת כבד נגיפית B כרונית מחולק לשתי שורות של תרופות: אינטרפרון אלפא (Interferon alfa) ותכשירים פומיים ממשפחת האנלוגים לנוקלאוטידים/נוקלאוזידים (NUC's ,Nucleotide/side analogues). יעדי הטיפול הינם דיכוי עמוק וממושך של נוכחות הנגיף בדם יחד עם הורדת נזק כבדי קיים ומניעת נזק עתידי נוסף.
אינטרפרון אלפא
האינטרפרון המומלץ היום לשימוש הוא Pegasys (Peginterferon alfa-2a). הטיפול עם Pegasys ניתן למשך 48 שבועות, ובאם משפיע על דיכוי נגיפי, תגובה טובה זו נשמרת כמעט לכל החיים. הטיפול אומנם כרוך בתופעות לוואי רבות (שמרביתן נסבלות) אך נוכח זמן קצוב לטיפול והיעדר הופעת עמידויות, קיימים בו יתרונות רבים לעומת תכשירים פומיים.
באם מתייחסים להיעלמות עומס נגיפי אחרי שנת טיפול כמדד ליעילות נוגדת-הנגיף של Pegasys, אזי הטיפול באמצעותו נמצא יעיל ב- 25% מהנשאים עם HBeAg חיובי וב- 63% מהנשאים עם HBeAg שלילי. שלושה אחוזים מהמגיבים בשנה ראשונה עשויים לסלק כליל גם את חלבון HBsAg. הסיכוי לסילוק נגיפי עולה גם אחרי הפסקת טיפול מוצלח, ואף תואר כמגיע עד שיעורים של 12% בשנה החמישית מסיום הטיפול [17].
טיפול זה כיום הינו מונחה תגובה הן של עומס נגיפי (HBV-DNA) אך גם של ריכוז חלבון HBsAg [18]. היות והיתרון הבולט של טיפול זה הינו התגובה המתמשכת אחרי הפסקת התרופה, המאפשר פרידה מהתלות היומית, מטופלים רבים מעדיפים אותו על פני טיפולים פומיים ארוכי שנים. יתרה מכך, טיפול קצוב כזה כנראה עדיף לנשים בגיל הפוריות כי הוא עשוי לבטל את הפסקת הטיפול הרציף בזמן היריון וחידושו לאחר מכן, וכתוצאה מכך מפחית סכנת עמידות והעברת ההדבקה מהאם לילוד.
אנלוגים לנוקלאוטידים/נוקלאוזידים
תכשירי NUC's ניתנים פומית, כמעט נטולי תופעות לוואי ויעילים מאוד בדיכוי נגיפי. החסרונות שלהם נובעים מהצורך בטיפול לתקופות ארוכות- לעתים לכל החיים. הטיפול בהם כרוך בסיכונים להופעת עמידויות מצטברות לאורך שנות הטיפול, ובפרט במטופלים עם בעיות היענות טיפולית. נגזרות NUC's חדשות הינן בעלות מתאר יעילות טוב יותר מבחינת דיכוי נגיפי, ובנוסף גם יותר בטוחות לשימוש בשל סיכון נמוך לעמידות. תכשירי NUC's כנגד HBV הזמינים כעת בארץ כוללים (לפי סדר כרונולוגי של כניסתם לשוק) את התרופות Zeffix, Hepsera (Adefovir), Sebivo (Telbivudine), Baraclude (Entecavir), Tenofovir ו- Truvada (תערובת של שתי תרופות על בסיס Tenofovir).
למעט Truvada הרשום לנשאי נגיף הכשל החיסוני האנושי (HIV ,Human Immunodeficiency Virus) בלבד, שאר התכשירים רשומים בסל בריאות בהורית טיפול ב- HBV בארץ. ההצלחה לשנת טיפול ראשונה בחולים נאיביים לטיפול (Treatment-naive patients) מתבטאת בדיכוי נגיפי עד ערכי עומס נגיפי לא מדיד בדם. ההצלחה הטיפולית עם Zeffix הייתה 39% במטופלי HBeAg חיובי לעומת 72% במטופלי HBeAg שלילי, עם Hepsera ההצלחה הייתה 21% לעומת 51%, עם Baraclude הייתה 67% לעומת 90%, עם Sebivo 60% לעומת 88%, ועם Tenofovir 74% לעומת 91%, בהתאמה. מדובר בהצלחה מרשימה של דיכוי נגיפי ללא תופעות לוואי, אך במחיר תלות תרופתית וטיפול שיש לו התחלה ברורה אך לא סיום.
תוארו ניסיונות סיום טיפול בתכשירים שונים אך בכולם נצפתה התלקחות בעשרות אחוזים, גם כאשר מנסים לנבא ולאתר מטופלים המתאימים יותר להפסקה [19]. התלקחות עשויה להיות מסכנת חיים בחלק מהמקרים ואף תוארו מקרי תמותה, בפרט בקרב שחמתיים. כמו כן, להבדיל מהתגובה אל Pegasys, נדיר שטיפולים פומיים יביאו אל סילוק חלבון HBsAg.
חוסר תגובה לטיפול נובעת גם מעמידות, אך יכול להיגרם מחוסר יעילות ראשוני ובעיקר מירידה בהיענות טיפולית. הסיכון השנתי המצטבר להופעת עמידויות עם Zeffix (24% לשנה ראשונה, 38% לשנייה, 49% לשלישית, 67% לרביעית ועד 70% בתום שנה חמישית) גבוה יותר מאשר תחת טיפול ב- Hepsera (0%, 3%, 11%, 18% ו- 29%, בהתאמה). סיכון זה נמוך יותר בתכשירים החדשים: ב- Sebivo עומד הסיכון על 4% בשנה ראשונה, ועד 22% בשנה השנייה. הסיכון לעמידויות לטיפול ב- Baraclude עומד על כ- 0.2% בשנה ראשונה, 0.5% בשנה השנייה ו- 1.2% בשנה השלישית ומעלה. לא תוארו עמידויות לטיפול ב- Tenofovir.
קיימות בדיקות לנוכחות תשניות (Mutations) המביאות לעמידויות לתרופות שונות, העשויות להנחות את סוגיית המעבר בין תרופות במקרי אי יעילות הטיפול [20], ברם השימוש הקליני בבדיקות אלו לרוב מצטמצם מול תכשירים חדשים יעילים.
עד כה לא נצפתה יעילות מוגברת בשילוב תרופתי של Zeffix [21] או Sebivo יחד עם Pegasys, ואף נצפו סיבוכים נוירופתיים (Neuropathy) תחת שילובים אלו [22]. יחד עם זאת, מקובלת מדיניות של תוספת תרופה חדשה על גבי קיימת במידה ומתפתחת עמידות, לדוגמה תוספת Hepsera ל- Zeffix או ל- Sebivo. התגובה לתרופות ירודה יותר באופן כללי כאשר מדובר בחולים עם עומס נגיפי התחלתי גבוה מאוד, ובמקרים אלו שילוב של Baraclude עם Tenofovir מעלה את התגובה מסך של 62% במטופלי Baraclude לבד ל- 79% בשילוב עם Tenofovir [23].
טיפול ב- Hepsera וב- Tenofovir כרוך בסיכון לפגיעה כלייתית, ועל כן יש צורך במינון מותאם תחת טיפול בתכשירים אלו, בייחוד בהתחשב בעובדה כי כ- 14% מחולי דלקת כבד נגיפית B הם בעלי פגיעה כלייתית מלכתחילה [24]. להבדיל מתכשירים אלו, טיפול ב- Sebivo לא רק שלא מביא לפגיעה כלייתית, אלא אף משפר את התפקוד הכלייתי באופן משמעותי לעומת מטופלי Zeffix [25].
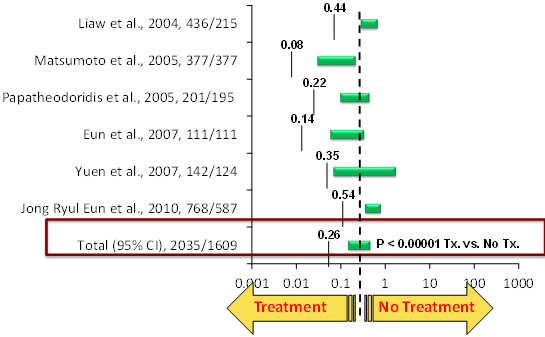
טיפול נוגד-נגיף מוצלח ארוך-טווח תואר כיעיל גם להסגת שחמת בחזרה למצב לא שחמתי ובריא יותר, הן באמצעות Baraclude [26], והן באמצעות Zeffix, שאף הוכחה כמונעת התפתחות סרטן הכבד [27]. היעילות של כלל התכשירים נוגדי-הנגיף בהורדת הסיכון ליציאת שחמת מאיזון קליני, בהורדת תמותה קשורה ל-HBV ובמניעת סרטן הכבד נסקרה היטב ומוצגת בגרף [28]:
טיפול באוכלוסיות מיוחדות
הטיפול לאחר השתלת כבד בשל HBV מסתמך כיום על שילוב של NUC's יחד עם נוגדני anti-HBs אשר מוזלפים לווריד תחילה בזמן הניתוח- בשלב שהכבד חולה הורחק ולפני השתלת הכבד החדש, ולאחר מכן בצורה תקופתית עם שימור רמות נוגדנים בדם מעל סף הגנה מסוים, אשר רמתו שנויה במחלוקת. קיימים מספר תכשירי נוגדנים אנושיים המופקים להזלפה ורידית. תכשיר אחר מיועד להזרקות לשריר ובדרך כלל כולל כספית וכרוך בסיכון להרעלת כספית בזריקות חוזרות. לאחרונה פותח אף תכשיר להזרקה תת-עורית. במושתלים, העדיפות היא מתן של תכשירי NUC's חדשים [29].
אתגר חשוב כיום הוא הטיפול והמניעה בחולים מדוכאי מערכת חיסון, כגון חולים המקבלים כימותרפיה או תכשירים סטרואידים (Steroids) וביולוגים, עם או בלי מחלת בסיס המטולוגית. אוכלוסיית מטופלים זו הולכת וגדלה בשנים האחרונות. אין ספק לגבי חולים עם נשאות פעילה שדינם כדין נשאים פעילים רגילים. כמו כן, אין חילוקי דעות לגבי הצורך בטיפול מניעתי גם בחולים נשאי HBV לא פעילים אשר מתוכננים או כבר מקבלים טיפול מדכא חיסון. עבודות רבות בהקשר זה נערכו על טיפול ב- Zeffix, אך לאחרונה מתרחב המחקר בנושא גם לתכשירים נוספים מתקדמים יותר. המחלוקת היא בנושא החולים אשר אינם נשאים של חלבון HBsAg היות וסילקו את נוכחותו בעבר. הם עשויים להתלקח מול דיכוי עמוק של מערכת החיסון, בפרט מטופלים המטו-אונקולוגים המקבלים CHOP עם או ללא Mabthera (Rituximab). בנוסף, קיימת אי הסכמה לגבי חולים עם חיסון טבעי ורמת נוגדני anti-HBs הגנתית, אשר גם עשויים להתלקח במקרים של דיכוי עמוק. מוסכם לטפל בחולים אלו כאשר ניתן לאתר כל ריכוז של עומס נגיפי בדם, אך הגישה היא לתת טיפול גם בהיעדרו בחולים עם דיכוי עמוק.
הגדרת הבראה מזיהום HBV
המטרה הסופית היא סילוק cccDNA מתוך תאי כבד נגועים, ועל ידי כך למנוע תופעה של הפעלת הנגיף בחשיפה לדיכוי חיסוני. ברם, מטרה זו חסרת חשיבות באם גנום נגיפי מושחל אל זה האנושי בשלבי הדבקה מוקדמים [30]. על כן, ההגדרה של הבראה קלינית או תפקודית מוגבלת לחולים אשר סילקו את הנגיף טבעית (איבדו את ה-HBsAg) ואף פיתחו חיסון טבעי- anti-HBs (HBs seroconversion), והגם שלא הגיעו בהכרח אל סילוק cccDNA מלא. אם הגדרה זו של סילוק אירעה תחת טיפול אנטי נגיפי, עדיין הבראה תפקודית מוגדרת בהעדר התלקחות אחרי הפסקת טיפול.
אתרי מטרה נגיפיים לטיפולים חדישים
הגישה הטיפולית העתידית צפויה לכלול שילוב תרופתי שיאפשר סילוק נגיפי. התגלית החדישה פורצת הדרך בתחום היא קולטני hNTCP (Human sodium taurocholate cotransporting polypeptide, הידוע גם כן בשם SCL0A1) על פני תאי הכבד, כי הם אלה האחראים על כניסת הנגיף לתא ועל כן ניתן לעכב אותם [31]. תגלית קודמת חשובה היתה זו של ליפופפטיד נגזר מה-preS1 Domain של מעטפת נגיפית (Myrcludex-B), אשר מונעת את ההדבקה הנגיפית לתרביות רקמה של תאי כבד [32]. מניעת כניסה נגיפית זו מנעה גם את ההדבקה בנגיף HDV (Hepatitis D Virus) באותו מודל עכברים uPA/SCID אנושי. עיכוב כניסת הנגיף לתא על ידי preS peptide מתווכת למעשה דרך הקולטנים hNTCP [33]. יתרה מכן, תרופות המעכבות את תפקוד הקולטנים hNTCP, כמו Cyclosporine, הורידו אף הן הדבקה נגיפית במודלים של תאי כבד [34]. היות שכניסת נגיף חוזרת לתאי כבד מתחדשים היא חיונית להתמדת הזיהום, קיים בסיס לשימוש במעכבים אלה כטיפול בזיהום כרוני של HBV לבד או צולב עם HDV.
השלב המוקדם ליצירת cccDNA, מתוך Relaxed circular DNA (rcDNA) genome nuclear delivery, מהווה מטרה אנטי נגיפית חשובה. התרחישים התאיים והביוכימיים הנדרשים לתהליך זה מחוללים את המעבר של נוקליאוקפסידים לגרעין, והתמרת rcDNA genome אל cccDNA דרך הסרת פולימיראז הקשור בצורה קובלנטית ל-Minus-strand DNA נגיפי, הסרת RNA primers קצרים לבניית Plus-strand DNA, ההשלמה של Plus-strand DNA, וההסרה של Minus-strand DNA redundancy נגיפי [35], [36]. שלבים אלה מערבים ככל הנראה מספר אנזימים תאיים, כולל TDP2 ואנדונאוקליאזות, שקשה לכוון לעברם טיפול תפקודי במחזור חיי הנגיף [37], [38]. מתן אנלוגים של מאוקליאוטידים (NAs) לא מונע את היצירה ההתחלתית של cccDNA אחרי הדבקה במודל של תאי כבד. ברם, מתן ממושך בחולים עם זיהום כרוני כן צמצם את מאגר cccDNA, ככל הנראה על ידי מניעת Recycling של גנום נגיפי מכיל נוקליאוקפסידים אל הגרעין.
זוהו שני תרכיבים Disubstituted-sulfonamides שהצליחו לסלק cccDNA מחולים עם זיהום כרוני, על ידי מניעת יצירה התחלתית ו/או אחזקה על ידי Recycling נוקליאוקפסידי, אך לא על ידי פירוק cccDNA קיים [39]. מצד שני, הוכח שאינטרפרון אלפא והפעלת קולטן לימפוטוקסין בטא (Lymphotoxin beta) העלו את ההתבטאות של ציטדין די-אמינזות (Cytidine deaminase) מסוג APOBEC3A וגם APOBEC3B, בהתאמה, והביאו לפירוק cccDNA נגיפי. יתרה מכן, חלבון הליבה HBc יכול לתווך את יחסי הגומלין של APOBE 3A/B עם cccDNA, אשר גורם בסופו של דבר לפירוק cccDNA נגיפי [40]. גם אינטרפרון הוכח כמוריד אציטלציה היסטונית של cccDNA קשור ואת גורמי השיעתוק שלו [41], לרבות הרמה של STAT1/ STAT2. חלבון HBx נחוץ להדבקה נגיפית ברמת ויסות שיעתוק cccDNA [42] וגם רמת חלבון DDB1 שפותח עוד אופק עתידי לטיפול [43].
מולקולות Non-nucleosidic בודדות ממשפחת פניל-פרופינמיד (AT-61 & AT-130), ממשפחת הטרוארילדהידרופרמידינים (BAY41-4109), מנעו RNA encapsidation או Destabilize nucleocapsids, בהתאמה [44], [45]. תכשירים אלה עיכבו HBV מזן בר וגם מוטנטים עמידי NAs [46], על ידי קשירתם לחלבון HBc.
השימוש ב-siRNA לשיעתוק HBx, HBc, HBsAg, HBeAg צפוי להביאה להשפעות רבות אנטי נגיפיות [47], ויש התקדמות באתגר ההובלה למטרה. התערבות בשלבי מורפוגנזה נגיפית דרך גליקוזילציה של מעטפת חלבונית הראתה יסוד להוכחה [48]. הפעלה חיסונית הומוראלית של מסלולי TLR2/7 הראתה אף היא יתרון אנטי נגיפי [49]. היות שגם מערכת חיסונית תאית פגועה בהדבקה כרונית עם עייפות תאי T, אז חיזוקם מחדש אמור לשחזר פעילות אנטי נגיפית [50], [51], למשל עם עיכוב מעכבי בקרה שליליים או תרופות אנטי אפופטוטיות [52] ואולי בשילוב עם NAs [53].
ביבליוגרפיה
- ↑ Yeo W, Hepatology 2006; 43:209.
- ↑ Sandler SG, Am J Epidemiology 1977; 106: 76.
- ↑ Lee WN, Engl J Med 1997; 337:1733.
- ↑ Fattovich G, et al. J Infect Dis 1987;155: 931-935.
- ↑ Beasley RP, Cancer 1988; 61:1942-1956.
- ↑ Safadi R, et al. Harefuah. 2012; 151:671-4.
- ↑ Sandler SG, Am J Epidemiology 1977; 106: 76.
- ↑ Zamir C, et al. Pediatric infectious disease 1999; 18, 262-266.
- ↑ Bogomolski-Yahalom V, J Med Virol 1991.;34:217-22.
- ↑ Safadi R, et al. Harefuah. 2012; 151:671-4.
- ↑ Teo EK, Uptodate on epidemiology 2006.
- ↑ Zamir C, et al. Pediatric infectious disease 1999; 18, 262-266.
- ↑ Safadi R, et al. Harefuah. 2012; 151:671-4.
- ↑ Yeo W, Hepatology 2006; 43:209-20.
- ↑ Safadi R, et al. European Association for the Study of Liver annual meeting, London, 2014.
- ↑ Broderick A, Uptodate 2006
- ↑ Marcellin et al. Gastroenterology 2009.
- ↑ Moucari et al. Antiviral Therapy 2009.
- ↑ Hepatology 2013;58:1888-1896.
- ↑ Safadi R, et al. Liver Int. 2011.
- ↑ Marcellin et al. Gastroenterology 2009.
- ↑ Marcellin and Safadi, et al. J Hepatol. 2014.
- ↑ Lok A, et al. Gastroenterology. 2012.
- ↑ Gish RG, et al. Clinical Gastroenterology and Hepatology 2012;10:941–946.
- ↑ Gane E, et al. Gastroenterology 2013.
- ↑ Zhang and Safadi, et al. Hepatology 2010.
- ↑ Liaw YF et al. N Engl J Med 2004;351:1521-1531.
- ↑ Zhang Q-Q, et al. Virology Journal 2011;8(72):1-11.
- ↑ Fung J, et al. Gastroenterology 2011; 141:1212-19.
- ↑ Seeger C, Zoulim F, Mason WS. 2014. Hepadnaviruses. In Field’s virology (ed. Knipe DM, Howley PM), p. 2185. Lippincott Williams & Wilkins, Philadelphia.
- ↑ Yan H, Zhong G, Xu G, He W, Jing Z, Gao Z, Huang Y, Qi Y, Peng B, Wang H, et al. 2012. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus. eLife 1: e00049.
- ↑ Petersen J, Dandri M, Mier W, Lutgehetmann M, Volz T, von Weizsacker F, Haberkorn U, Fischer L, Pollok JM, Erbes B, et al. 2008. Prevention of hepatitis B virus infection in vivo by entry inhibitors derived from the large envelope protein. Nat Biotechnol 26: 335-341.
- ↑ Lutgehetmann M, Mancke LV, Volz T, Helbig M, Allweiss L, Bornscheuer T, Pollok JM, Lohse AW, Petersen J, Urban S, et al. 2012. Humanized chimeric uPA mouse model for the study of hepatitis B and D virus interactions and preclinical drug evaluation. Hepatology 55: 685–694.
- ↑ Watashi K, Sluder A, Daito T, Matsunaga S, Ryo A, Nagamori S, Iwamoto M, Nakajima S, Tsukuda S, Borroto-Esoda K, et al. 2014. Cyclosporin A and its analogs inhibit hepatitis B virus entry into cultured hepatocytes through targeting a membrane transporter, sodium taurocholate cotransporting polypeptide (NTCP). Hepatology 59: 1726–1737.
- ↑ Seeger C, Zoulim F, Mason WS. 2014. Hepadnaviruses. In Field’s virology (ed. Knipe DM, Howley PM), p. 2185. Lippincott Williams & Wilkins, Philadelphia.
- ↑ Zoulim F, Testoni B, Lebosse F. 2013b. Kinetics of intrahepatic covalently closed circular DNA and serum hepatitis B surface antigen during antiviral therapy for chronic hepatitis B: Lessons from experimental and clinical studies. Clin Gastroenterol Hepatol 11: 1011–1013.
- ↑ Sohn JA, Litwin S, Seeger C. 2009. Mechanism for CCC DNA synthesis in hepadnaviruses. PLoS ONE 4: e8093.
- ↑ Koniger C, Wingert I, Marsmann M, Rosler C, Beck J, Nassal M. 2014. Involvement of the host DNA-repair enzyme TDP2 in formation of the covalently closed circular DNA persistence reservoir of hepatitis B viruses. Proc Natl Acad Sci 111: E4244–E4253
- ↑ Cai D, Mills C, Yu W, Yan R, Aldrich CE, Saputelli JR, Mason WS, Xu X, Guo JT, Block TM, et al. 2012. Identification of the disubstituted sulfonamide compounds as specific inhibitors of hepatitis B virus covalently closed circular DNA formation. Antimicrob Agents Chemother 56: 4277–4288.
- ↑ Lucifora J, Xia Y, Reisinger F, Zhang K, Stadler D, Cheng X, Sprinzl MF, Koppensteiner H, Makowska Z, Volz T, et al. 2014. Specific and nonhepatotoxic degradation of nuclear hepatitis B virus cccDNA. Science 343: 1221–1228.
- ↑ Belloni L, Allweiss L, Guerrieri F, Pediconi N, Volz T, Pollicino T, Petersen J, Raimondo G, Dandri M, Levrero M. 2012. IFN-α inhibits HBV transcription and replication in cell culture and in humanized mice by targeting the epigenetic regulation of the nuclear cccDNA minichromosome. J Clin Invest 122: 529–537.
- ↑ Belloni L, Pollicino T, De Nicola F, Guerrieri F, Raffa G, Fanciulli M, Raimondo G, Levrero M. 2009. Nuclear HBx binds the HBV minichromosome and modifies the epigenetic regulation of cccDNA function. Proc Natl Acad Sci 106: 19975–19979.
- ↑ Li T, Robert EI, van Breugel PC, Strubin M, Zheng N. 2010. A promiscuous α-helical motif anchors viral hijackers and substrate receptors to the CUL4-DDB1 ubiquitin ligase machinery. Nat Struct Mol Biol 17: 105–111.
- ↑ Deres K, Schroder CH, Paessens A, Goldmann S, Hacker HJ, Weber O, Kramer T, Niewohner U, Pleiss U, Stoltefuss J, et al. 2003. Inhibition of hepatitis B virus replication by drug-induced depletion of nucleocapsids. Science 299: 893–896.
- ↑ Delaney WE, Edwards R, Colledge D, Shaw T, Furman P, Painter G, Locarnini S. 2002. Phenylpropenamide derivatives AT-61 and AT-130 inhibit replication of wild-type and lamivudine-resistant strains of hepatitis B virus in vitro. Antimicrob Agents Chemother 46: 3057–3060.
- ↑ Billioud G, Pichoud C, Puerstinger G, Neyts J, Zoulim F. 2011. The main hepatitis B virus (HBV) mutants resistant to nucleoside analogs are susceptible in vitro to non-nucleoside inhibitors of HBV replication. Antiviral Res 92: 271–276.
- ↑ Bertoletti A, Ferrari C. 2012. Innate and adaptive immune responses in chronic hepatitis B virus infections: Towards restoration of immune control of viral infection. Gut 61: 1754–1764.
- ↑ Yu W, Goddard C, Clearfield E, Mills C, Xiao T, Guo H, Morrey JD, Motter NE, Zhao K, Block TM, et al. 2011. Design, synthesis, and biological evaluation of triazolo-pyrimidine derivatives as novel inhibitors of hepatitis B virus surface antigen (HBsAg) secretion. J Med Chem 54: 5660–5670.
- ↑ Lanford RE, Guerra B, Chavez D, Giavedoni L, Hodara VL, Brasky KM, Fosdick A, Frey CR, Zheng J, Wolfgang G, et al. 2013. GS-9620, an oral agonist of toll-like receptor-7, induces prolonged suppression of hepatitis B virus in chronically infected chimpanzees. Gastroenterology 144: 1508–1517.
- ↑ Knolle PA, Thimme R. 2014. Hepatic immune regulation and its involvement in viral hepatitis infection. Gastroenterology 146: 1193–1207.
- ↑ Bertoletti A, Ferrari C. 2012. Innate and adaptive immune responses in chronic hepatitis B virus infections: Towards restoration of immune control of viral infection. Gut 61: 1754–1764.
- ↑ Kosinska AD, Zhang E, Johrden L, Liu J, Seiz PL, Zhang X, Ma Z, Kemper T, Fiedler M, Glebe D, et al. 2013. Combination of DNA prime—Adenovirus boost immunization with entecavir elicits sustained control of chronic hepatitis B in the woodchuck model. PloS Pathog 9: e1003391.
- ↑ Michel ML, Deng Q, Mancini-Bourgine M. 2011. Therapeutic vaccines and immune-based therapies for the treatment of chronic hepatitis B: Perspectives and challenges. J Hepatol 54: 1286–1296.
המידע שבדף זה נכתב על ידי פרופסור ריפעת ספדי - מנהל יחידת הכבד במכון המשולב לגסטרואנטרולוגיה ומחלות כבד, המחלקה הפנימית, מרכז רפואי הדסה, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק