Monocyte chemotactic protein-1
| מדריך בדיקות מעבדה | |
| Monocyte Chemotactic Protein-1 | |
|---|---|
| שמות אחרים | MCP-1, CCL2 או chemokine (C-C motif) ligand 2, monocyte macrophage/monocyte chemotactic and activating factor (MCAF), small inducible cytokine A2, Small inducible cytokine A2, Monocyte chemoattractant protein 1,Monocyte secretory protein JE , TDCF ((tumor derived chemotactic factor, SCYA2 ,GDCF-2 ,SMC-CF ,HSMCR30 ,MGC9434 , HC11 |
| מעבדה | כימיה בדם |
| תחום | מדד אפשרי לתחלואת לב ולמפגעים אחרים |
| טווח ערכים תקין | 125±42 פיקוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
משמעות ביולוגית וקלינית
MCP-1 הוא ציטוקין קטן החבר בתת-משפחת CC של משפחת העל של הציטוקינים. ל-MCP-1 יש יכולת לשמש כ- chemoattractant עוצמתי וכמשפעל של מונוציטים, מקרופאגים, תאי-NK, תאי T, אאוזינופילים, באזופילים, ותאים דמויי-כוכב (stellate cells) בכבד. MCP-1 מסוגל לגייס מונוציטים, תאי memory T ותאים דנדריטים לאזורי דלקת. MCP-1 נכרך עם סוגים אחדים של מחלות דלקתיות כרוניות. ה-cDNA של MCP-1 באדם מקודד לחלבון קודמן (precursor) המכיל 99 חומצות אמינו, בו נכלל פפטיד signal הידרופובי בן 23 חומצות אמינו, המבוקע ליצירת החלבון הבשל בן 76 חומצות אמינו עם משקל מולקולארי של 13,000 דלטון, שהוא פוליפפטיד מונומרי (Van Coillie וחב' ב-Cytokine Growth Factor Rev משנת 1999). רצף 76 חומצות האמינו הוא כדלקמן:
QPDAINAPVTCCYNFTNRKISVQRLASYRRITSSKCPKEAVIFKTIVAKE ICADPKQKWVQDSMDHLDKQTQTPKT
1 MCP-מבוטא בראש ובראשונה על ידי מונוציטים, מקרופאגים, ותאים דנדריטים. גורם הגדילה של טסיות-דם, PDFR, משמש משרן מרכזי של הגן CCL2. כדי שישופעל, צריך שהחלבון MCP-1 יעבור ביקוע על ידי אנזים ה-metalloproteinase, MMP-12.
MCP-1 מושרה על ידי תווכים דלקתיים שונים כגון LPS, IL-1, TNF-α, IL-6, IL-4 ואינטרפרון-γ. מספר סוגי תאים נמצאו מייצרים MCP-1 כולל תאים חד-גרעיניים, תאי פיטום (mast cells), תאי-T, אוסטאו-בלסטים, פיברובלסטים, תאי אנדותל, תאי סטרומה של מח עצם, תאי אפיתל, תאי מיקרוגליה, אסטרוציטים ותאי שריר חלק. MCP-1 מבוטא גם בנוירונים בעיקר ב-cerebral cortex, ב-globus pallidus, ב-substantia nigra, בהיפוקמפוס, בתאי Purkinje במוחון, בגרעינים ההיפותלאמיים הפארא-ונטריקולאריים והסופרה-אופטיים, בהיפותלמוס הלטרלי, בגרעינים הטריגמינלים המוטוריים ואלה של עמוד השדרה, וה- gigantocellular reticular nucleus BanisadrBBB (Banisadr וחב' ב-Comp Neurol משנת 2005).
MCP-1 הוא ליגנד שנקשר ל-7 מקטעים טרנס-ממברנליים הקשורים לקולטן CCR2 הנמצא בתאחיזה ל-G-protein. כמו שמקובל לגבי כימוקינים, MCP-1 משתף מספר ליגנדים נוספים בקישור לקולטן CCR2, כדוגמת MCP-2 (הידוע כ-CCL8), MCP-3 (הידוע כ-CCL7), MCP-4 (הידוע כ-CCL13) וכן murine MCP-5. מספר מחקרים מצביעים על ראיות על כך שקיימים גם קולטנים אחרים ל-MCP-1. למרות שהרלוונטיות הפיזיולוגית אינה ברורה, נמצא שבתנאי in vitro רמות גבוהות של MCP-1 נקשרות ומשפעלות את הקולטן CCR1.
מספר ראיות שונות בעיקר במודלים in vitro בחיות, מצביעות על כך ש MCP-1 הוא מרכיב חשוב בתהליכים דלקתיים. נמצא מתאם בין רמות מוגברות של MCP-1 באדם לבין פתולוגיות דלקתיות כגון ספסיס, מחלת Crohn, lupus nephritis, טרשת נפוצה, amyotrophic lateral sclerosis, דלקת פרקים שגרונית, פנקראטיטיס חריפה וטרשת עורקים. MCP-1 משודרג במספר סוגי סרטן כולל סרטן קיבה, גליומה ממאירה, esophageal squamous cell carcinoma, וסרטני השחלות, בלבלב, שלפוחית השתן, וסרטן השד.
MCP-1 הוא בעל פעילות כמוטקטית המשפיעה על מונוציטים ובזופילים, אך אינו משפיע על נויטרופילים ואאוזינופילים. לאחר ביקוע של השייר ה-N טרמינלי, MCP-1 מאבד את זיקתו לבזופילים, והופך chemoattractant לאאוזינופילים. תאי פיטום ובזופילים המטופלים עם MCP-1, מפרישים את תוכן הגרנולות שלהם אך תוך התא. השפעה זו מתגברת גם על ידי טיפול מוקדם עם IL-3 או על ידי ציטוקינים אחרים (Conti וחב' ב-Immunol משנת 1995, ו-Bischoff וחב' ב-J Exp Med משנת 1992). MCP-1 מגביר את הפעילות האנטי-סרטנית של מונוציטים והוא אף חיוני ליצירת גרנולומות.
ניתן למצוא MCP-1 בנקודות בקיעת שיניים ובאזורי ניוון עצם. ברקמת העצם, MCP-1 מבוטא על ידי תאים אוסטאוקלסטים ואוסטאובלסטים בשלים, והוא נמצא תחת הבקרה של גורם השעתוק NFκB. בתאי אוסטאוקלסטים באדם, שני החלבונים-MCP-1 ו-CCL-5 הידוע גם כ-RANTES (או regulated on activation, normal T cell expressed and secreted), משרים יצירת של תאים רב-גרעיניים ממונוציטים מטופלים ב-M-CSF בהיעדר RANKL, ומשרים גם יצירה של אוסטאוקלסטים החסרים את האנזים catepsin K וכן יכולת ספיחה. יש השערה ש-MCP-1 ו-RANTES, פועלים כלולאה אוטוקרינית בהתמיינות של אוסטאוקלסטים באדם (Kim וחב' ב-J Biol Chem משנת 2005).
הקולטנים של MCP-1
רבים מהקולטנים של הכמוקינים ממשפחת CC (CCRs) שובטו בהתבסס על motifs שמורים היטב של הקולטנים של IL-8 שאופיינו קודם לכן. רבים מהגנים המקודדים לחלבוני קוטנים אלה, המכילים בערך 360 חומצות אמינו כרוכים זה בזה של כרומוזום 3p21-22 (Wells וחב' ב- J Leukoc Biol משנת 1996). כל הקולטנים של כמוקינים שזוהו הם GPCRs, השייכים למשפחת קולטני rhodopsin או serpentine. כללית, קולטנים אלה מורכבים מקצה N-טרמינלי חוץ-תאי קצר, מ-7 מקטעים טרנס-ממברנאליים הידרופוביים שכל אחד מהם קשור למשנהו על ידי 3 לולאות תוך-תאיות ו-3 לולאות חוץ-תאיות, וכן על ידי קצה C-טרמינלי תוך תאי. רוב קולטני CCRs הקושרים אחד או יותר MCPs משמשים להתקשרות של כמוקינים נוספים ממשפחת CC, והם מבוטאים על מגוון סוגי לויקוציטים. בנוסף, כל ה-MCPs באדם נקשרים לפחות ל-2 קולטנים. CCR2 ו-CCR4 הם 2 קולטנים הקושרים MCP-1 (Craig ו-Loberg ב-Cancer Metas Rev משנת 2006).
MCP-1 משפיע דרך הקולטן CCR2, אך בניגוד ל-MCP-1, הביטוי של CCR2 מוגבל באופן יחסי למספר סוגי תאים. ישנם 2 צורות spliced של CCR2, דהיינו CCR2A ו-CCR2B השונים ביניהם רק ב"זנבות" ה-C טרמינליים. (Charo וחב' ב-Proc Natl Acad Sci USA משנת 1994). הקולטן CCR2A הוא האיזופורם העיקרי ובא לביטוי בתאים חד-גרעיניים ובתאי שריר חלק וסקולריים (Bartoli וחב' ב-Acta Neuropathol משנת 2001), ואילו מונוציטים ותאי NK משופעלים מבטאים בעיקר את האיזופורם CCR2B. חשוב לציין של-CCR2 יש תפקיד דואלי, והוא משפיע על פעילויות דלקתית ואנטי-דלקתית. כמו כן, נמצאו שבעה SNPs או single nucleotide polymorphisms לגבי CCR2. נמצא שעכברים חסרי CCR2 עמידים להשריית נוירופתיות סנסוריות (Thacker וחב' ב-Anesth Analg משנת 2007).
מקטעים במולקולת MCP-1 החיוניים לפעילותו הביולוגית
יש מאמינים ש-MCP-1 זהה ל-JE, גן שהביטוי שלו מושרה בפיברובלסטים של עכברים על ידי platelet-derived growth factor (Cochran וחב' ב-Cell משנת 1983). למעשה, MCP-1 היה הראשון מבין הכמוקינים ממשפחת CC באדם שהתגלו, כאשר הגן המקודד לו ממוקם בכרומוזום 17 (בעמדה 17q11.2). במשפחת הכמוקינים הזו נכללים לפחות 4 חברים (MCP-1, -2,-3 ,-4). ההומולוגיה ברצף חומצות האמינו של 4 חברי הקבוצה האמורים גבוהה, ונעה בין 61% לגבי CCL8 ו-CCL4, ו-71% לגבי CCL7. בנוסף לכמוקינים אלה, בודדו צורות בעלות משקלים מולקולאריים שונים של MCP-1 שמקורן ב-O גליקוזילציה שלו. נמצא שגליקוזילציה של MCP-1 מפחיתה מעט את היכולת הכמוטקטית שלו. MCP-1 מיוצר על ידי מגוון של תאים או באופן קונסטיטוטיבי או כתוצאה מהשריה על ידי עקה חמצונית, על ידי ציטוקינים, או על ידי גורמי גדילה. אנליזה של מוטציות ב-MCP-1, הביאה לזיהוי של 2 אזורים של מבנה ראשוני, שהם קריטיים לפעילות הביולוגית של MCP-1 (Beall וחב' ב-Biochem J משנת 1996). המבנה הראשון מורכב מהרצף Thr-10 עד Tyr-13, ואילו המבנה השני מורכב מהשיירים 34 ו-35 ברצף חומצות האמינו. מוטציות בשיירים 10 או 13 מחלישה את הפעילות הביולוגית של MCP-1{כ}} (Ebisawa וחב' משנת 1994). החשיבות של המבנה השני הוכחה על ידי התוצאות של 2 מוטציות, כאשר באחת מהן הוחדר שייר פרולין בין Ser-34 ו-Lys-35, ובמוטציה השנייה הייתה החלפה של הרצף Ser-34-Lys-35 על ידי הרצף Gly-Pro-Lys. כל אחת ממוטציות אלו פגעה חמורות בפעילות של MCP-1. כמו כן נמצא שהספציפיות של MCP-1 לסוגי התאים השונים, מושפעת על ידי מוטציות בשיירים 28 ו-30, אך לא על ידי מוטציה בשייר 30 בלבד. יתרה מכך, שמט (deletion) של שיירים בקצה ה-N-טרמינלי גורם לאיבוד הפעילות של MCP-1 (Gong ו-Clark-Lewis ב-J Exp Med משנת 1995), ונמצא שאחדות ממולקולות MCP-1 עם שמט באזור ה-N טרמינלי, אף משמשות כאנטגוניסטים של MCP-1 (Gong וחב' באותו כתב עת משנת 1997).
חשיבות קלינית
MCP-1 קשור למספר תחלואות המתאפיינות בהסננה של מונוציטים, כגון פסוריאזיס, דלקת פרקים שגרונית וטרשת עורקים (Xia ו-Sui ב-Expert Opin Therap Oatents משנת 2009). הזרקה של נוגדנים כנגד MCP-1 במודל של גלומרולו-נפריטיס הפחיתה את הסננת המקרופאגים ותאי T, והפחיתה תהליכי הצטלקות ושיבוש פעילות הכליות (Lloyd וחב' ב-J Exp Med משנת 1997). MCP-1 כרוך בתהליכים נוירו-דלקתיים הנוטלים חלק במגוון מחלות ניווניות של ה-CNS (Gerard ו-Rollins ב-Nature Immunol משנת 2001). הביטוי של MCP-1 בתאי גליה מוגבר באפילפסיה (Foresti וחב' ב-Neuroinflamm משנת 2009, ו-Fabine וחב' ב-J Neuroimmunol משנת 2010), באיסכמיה מוחית (Kim וחב' ב-J Neuroimmunol משנת 1995), במחלת אלצהיימר (Hickman ו-El Khouri ב-CNS Neurol Disorders Drugs Targets משנת 2010), ב-EAE (Ransohoff וחב' ב-FASEB J משנת 1993) ובפציעה מוחית טראומטית (Semple וחב' ב-J Cerebral blood Flow Metab משנת 2010).
היפומתילציה של אתרי CpG בתוך אזור הפרומוטר של MCP-1, מושפעת מריכוזים גבוהים של גלוקוזה המגבירים את רמות MCP-1 בדם, מה שמגביר סיבוכים וסקולאריים בסוכרת type 2 (Liu וחב' ב-J Endocrinological Invest משנת 2012). בנוסף, MCP-1 משרה ביטוי של amylin דרך מסלולי ERK1/ERK2/JNK-AP3 ו-NF-KB הבלתי תלויים ב-MCP-1. השדרוג של amylin על ידי MCP-1, תורם להגדלת רמת amylin בפלזמה, כמו גם את דרגת העמידות לאינסולין ב-obesity (Cai וחב' ב-PLos One משנת 2011). MCP-1 פוגע באיתות של אינסולין בתאי שריר שלד, דרך שפעול של ERK1/2 במינונים הדומים לריכוזים הפיזיולוגיים שלו בפלזמה (200 פיקוגרם/מ"ל), אך ללא שפעול של מסלול ה-NF-kB. בנוסף, MCP-1 מפחית באופן משמעותי את קליטת גלוקוזה המושרית על ידי אינסולין בתאי שריר, MCP-1 מייצג את מולקולת הקישור בין רקמת השומן ובין תאי השריר (Sell וחב' ב-Endocrinology משנת 2006).
Adiposity מעלה את רמת MCP-1 בפלזמה
השמנת-יתר נחשבת כגורם מסייע לתחלואת לב, לשבץ מוחי לסוכרת ולסרטן. שימוש בטכנולוגיה של DNA microarray הביאה את Takahashi וחב' ב-J Biol Chem משנת 2003, לנסות לזהות את המולקולות שניתן להסביר בעזרתן את הקשר בין obesity לבין מפגעים וסקולאריים, על ידי השוואה של ביטוי mRNA של בערך 12,000 גנים ברקמת שומן לבן של עכברים שהוזנו בדיאטה רגילה, לעומת אלה שהוזנו בדיאטה עתירת-שומן או אלה שהוזנו ב-D-Trp34 neuropeptide המשרה obesity בעכברים. הביטוי של MCP-1 mRNA היה גבוה פי-7.2 בעכברים שמנים בהשוואה לעכברים נורמאליים, מה שגרם להעלאה משמעותית של MCP-1 באדיפוציטים. גם רמות MCP-1 בפלזמה היו מוגברות בעכברים שמנים, ובהתאם נמצא מתאם חזק בין רמות MCP-1 בפלזמה לבין משקלם של העכברים. כמו כן מצאו חוקרים אלה שעירוי של MCP-1 לעכברים רזים הגביר את אוכלוסיית המונוציטים החיוביים ל-CD11b, ללא השריית שינויים במשקל הגוף.
בתהליך הטרשתי שמור תפקיד חשוב למונוציטים המגיעים לאזור פגיע בדופן כלי הדם, נצמדים אליו וחודרים לתוך החלל שמתחת לשכבת האנדותל, שם הם עוברים התמיינות למקרופאגים ולתאי קצף עמוסי-ליפידים (Gerrity ב-Am J Pathol משנת 1981). שלבים אלה מבוקרים על ידי ציטוקינים כמוטקטיים וביניהם MCP-1 המוגבר במקרופאגים, בתאי אנדותל ובתאי שריר חלק ברובד הטרשתי (Zimmet וחב' ב-משנת 2001).
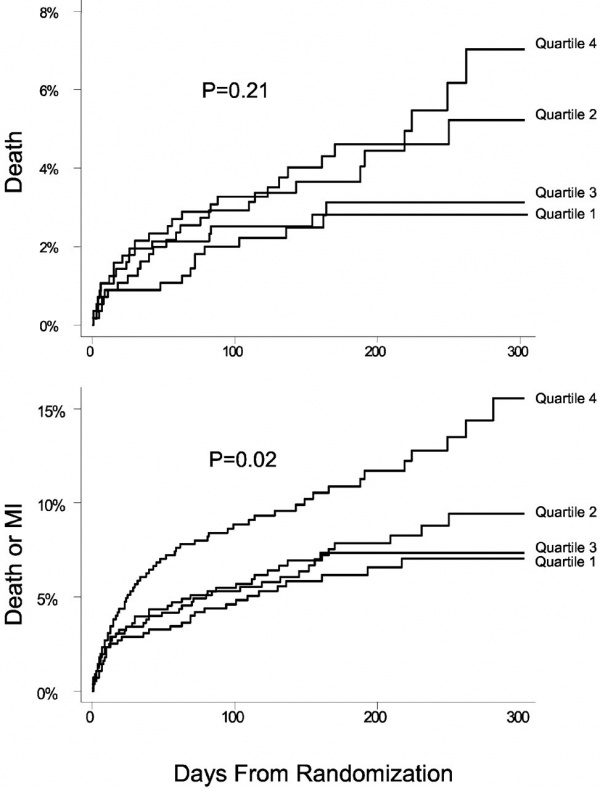
הקשר בין רמות של MCP-1 בפלזמה לבין ממצאים קליניים ארוכי –טווח במטופלים עם תסמונת כלילית חריפה (ACS)
De Lemos מאוניברסיטת טקסס ב-Dallas הוא אחד החוקרים המובילים בייחוס של MCP-1 כסמן סיכון וסמן פרוגנוסטי במטופלים עם ACS, ובתור שכזה יכול להוות יעד תרפויטי (de Lemos וחב' ב- J Am Coll Cardiol משנת 2007). מחקרים עדכניים מצאו שרמת MCP-1 היא בעלת ערך פרוגנוסטי בתקופה מידית לאחר אירוע כלילי חריף והן בטווח הכרוני שלאחר אירוע כזה. המחקר האמור של de Lemos הראה שאם -MCP-1 מוגבר לאחר ,ACS שיעור האירועים השליליים גבוה יותר. מחקר זה מצא שאם מוסיפים את מדד MCP-1 למדידות של CRP ו-BNP, משתפר בהרבה ערך הניבוי (predictive value).
במספר מחקרים קטנים, רמות MCP-1 בפלזמה נמצאו מוגברות ביותר בקרב מטופלים עם ACS, וממוצעות ברמתן בקרב אלה עם מחלה כלילת יציבה. אך עם זאת, הייתה חפיפה ניכרת בין רמות MCP-1 בשתי קבוצות המטופלים האלה (Cipollone וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2001, Nishiyama וחב' ב-Jpn Circ J משנת 1998 ו-Economou וחב' ב-Int J Cardiol משנת 2001). בשנת 2002 פרסמו de Lemos וחב' ב-Circulation את תוצאות מחקרם בו נמדדו רמות MCP-1 בדגימות פלזמה קפואות של 279 מתנדבים בריאים ושל 2,270 דגימות של מטופלים עם ACS שנכללו בניסוי OPUS-TIMI 16. רמות MCP-1 ממוצעות נמדדו כ-157 פיקוגרם/מ"ל בפלזמה של הנבדקים הבריאים, ו-178 פיקוגרם/מ"ל בדגימות של אוכלוסיית OPUS-TIMI 16 (עם מובהקות של 0.001p<). בניסוי OPUS-TIMI 16, רמות MCP-1 בבסיס הניסוי היו במתאם עם גיל מבוגר, מגדר נשי, סוכרת, יתר לחץ-דם, מחלת לב כלילית קודמת ואי-ספיקת כליות (עם מובהקות של p<0.01 לכל אחד מהפרמטרים הללו). לעומת זאת, לא היה מתאם בין רמות MCP-1 לבין סטאטוס עישון, מדד מסת הגוף (BMI), מקטע הפליטה (EF) ורמת טרופונין I או CRP. לאחר התאמה להבדלים בפרמטרים של בסיס הניסוי, לשינויים ב-ECG, לטרופונין I ול-CRP, רמת MCP-1 הגדול מהאחוזון ה-75th, הייתה כרוכה בסיכון מוגבר של 53% למוות או ל-MI במהלך 10 חודשים של מעקב (p=0.01), (תרשים למטה):
הרמות בנסיוב של MCP-1 במטופלים עם שבץ מוחי איסכמי או עם אוטם שריר הלב
נדידה של תאי דלקת מושרית על ידי כמוקינים, נכרכה בפתוגנזה של מצבים טרשתיים כגון שבץ מוחי איסכמי, או MI. במחקר של Arakeyan וחב' ב-Mediators of Inflammation משנת 2005, נבחן הכמוקין MCP-1 במטופלים עם אחת משני התרחישים האמורים. רמות MCP-1 בנסיוב נקבעו בשיטת ELISA ב-40 מתנדבים בריאים, ב-40 מטופלים עם שבץ איסכמי וב-64 מטופלים עם MI. בהשוואה לקבוצת הבריאים בהם רמת MCP-1 החציונית נמדדה כ-239 פיקוגרם/מ"ל, רמת MCP-1 הייתה מוגברת בקבוצת השבץ האיסכמי (384 פיקוגרם/מ"ל, 0.001p<) ובקבוצת ה-MI עם רמה חציונית של 360 פיקוגרם/מ"ל, 0.002p<). לא נמצא קשר בין רמות הציטוקין לבין גורמי הסיכון לטרשת עורקים (יתר לחץ-דם, סוכרת, עישון, צריכת אלכוהול), ו-MCP-1 גם לא הושפע מגיל או מגדר. אכן, בניסויים בחיות, רמות גבוהות של MCP-1 mRNA נמצאו במוח 6 שעות לאחר השריית איסכמיה צרברארלית. רמת השיא של MCP-1 במוח ובקליפת המוח של חולדות לאחר השריית איסכמיה, הופיעה לאחר 12–48 שעות (Yamagami וחב' ב-J Leukoc Biology משנת 1999, ו-Wang וחב' ב-Stroke משנת 1995). הביטוי של MCP-1 mRNA היה מוגבר באזור האוטם של שריר הלב לאחר MI באופן דומה לממצאים המוחיים בשבץ (Van וחב' ב-Cardiovasc Res משנת 1994, ו-Ito וחב' ב-Lab Invest משנת 2003). כמוקינים משרים chemotaxis על ידי שפעול של קולטנים הקשורים לחלבוני G הטרו-טרימריים, כאשר קישור זה כרוך במולקולות ספיחה וב-GAGs או glycosaminoglycans (Hyduk וחב' ב-Blood משנת 2007). שפעול הקולטנים וחלבוני G מוביל לשפעול של cascade תוך-תאי של איתותים, המעודדים נדידת התא לכיוון מקור הכמוקינים. חלבונים בתוך כל תת-משפחה של כמוקינים, אך לא כאלה המשתייכים לתת משפחות אחרות, יכולים להיקשר באופן תחרותי לאותו קולטן על פני תא המטרה (Leonard ו-Yoshimura ב-Immunology Today משנת 1990). כמוקינים שהם כמוטקטיים למונוציטים יכולים להיקשר למספר סוגי קולטנים על פני תאים אלה, כדוגמת MCP-1, MIP-1β ו-RANTES שהוא CCL5 או chemokine (C-C motif) ligand 5 .
כמוקינים ניתנים גם למיון ל-2 תת-משפחות תפקודיות: כימוקינים דלקתיים וכימוקינים הומאו-סטאטיים. כימוקינים דלקתיים מפקחים על הגיוס של לויקוציטים במהלך פציעה רקמתית או דלקת, בה בשעה שכימוקינים הומאו-סטאטיים פועלים לניתוב לויקוציטים לאיברים לימפואידיים וכן למח העצם ולתימוס במהלך ההמאטופויאזה (Wagner וחב' משנת 2007). לבסוף, בנוסף לתפקידיהם במערכת החיסון, כימוקינים וקולטני הכימוקינים קשורים גם כן לפתולוגיה של מפגעים אוטו-אימוניים, למחלות ריאות כאסתמה ו-COPD, לדחיית שתלים, לסרטן ולמחלות וסקולאריות.
MCP-1 ותחלואת לב בחולי סוכרת ובמטופלי דיאליזה
בשנת 2009 התפרסם ב-Diabetes Care מחקרם של Piemonti וחב', שבחנו את הקשר בין רמות MCP-1 לבין תמותה ממחלה קרדיו-וסקולארית בנבחנים בגיל הממוצע של 61±12 שנה עם או בלי סוכרת. בניסוי נכללו 363 משתתפים עם BMI של ±6.630.1 ק"ג/מ2, מתוכם 15% עם סוכרת type 2, ו-12% עם סבילות פגומה לגלוקוזה. תוצאות ניסוי זה היו כדלקמן: בבסיס הניסוי רמת MCP-1 הייתה מוגברת בנבדקים עם סוכרת type 2 (ומובהקות של p<0.05), והראתה מתאם משמעותי עם סמני סיכון ביולוגיים לטרשת עורקים. לאחר 15 שנות מעקב, מתוך 363 המתחילים בניסוי נפטרו 82 איש ממחלה קרדיו-וסקולארית. אנליזה חד-משתנית מצאה שגיל, מגדר, רמות גלוקוזה ואינסולין בצום, פיברינוגן, סטאטוס של עמידות לגלוקוזה, הרגלי עישון ורמת MCP-1, היו במתאם עם תמותה קרדיו-וסקולארית. רמות MCP-1 נמדדו גם במטופלים בהמו-דיאליזה בשיטת ELISA לבחון את הקשרם לדלקת, דיס-ליפידמיה ולאירועים וסקולאריים. בניסוי שפורסם על ידי Papayianni וחב' בשנת 2012 ב-Nephrol Dial Transplant נכללו 81 מטופלי דיאליזה מתוכם 45 גברים בגיל הממוצע של 15±57 שנה, ו-35 מתנדבים בריאים. כל המשתתפים היו בטיפולי דיאליזה למעלה מ-3 חודשים, וחפים מתרחישי דלקת פעילה. דגימות הדם נלקחו ישירות מהפיסטולה העורקית-ורידית לפני ואחרי כל טיפול דיאליזה. רמת MCP-1 טרם הדיאליזה נמצאה משמעותית גבוהה יותר בחולים מאשר בבריאים (148±427 לעומת 42±125 פיקוגרם/מ"ל, p<0.0001) ). רמת MCP-1 לאחר הדיאליזה הייתה גבוהה יותר מזו שלפני הדיאליזה (153±567 פיקוגרם/מ"ל.
תכשירים המשפיעים על יצירת MCP-1 ואופן הפרשתו
- אנטגוניסטים של הקולטן של leukotriene מפחיתים את הכמוטקסיס המושרה על ידי MCP-1 (Hung וחב' ב- Pediatr Allergy Immunol משנת 2006)
- Trichostatin A המעכב של histone acetylase מדכא את יצירת MCP-1 המושרית על ידי ליפופוליסכרידים (Aung וחב' ב- J Acquir Immune Defic Syndr משנת 2001)
- Doxycycline מפחית יצירת MCP-1 (Raza וחב' ב- Exp Lung Res משנת 2006)
- ליזו-פוספוליפידים מגבירים את יצירת MCP-1 המושרית על ידי IL-1 (Lin וחב' ב- J Cell Biochem משנת 2006)
- Quercetin (3,3′,4′,5,7-pentahydroxyflavone) מפחית את יצירת MCP-1 המושרית על ידי TNF-α (Nanua וחב' ב- Am J Respir Cell Mol Biol משנת 2006)
- Heme oxygenase-1 מפחית את הביטוי של MCP-1 (Shokawa וחב' ב- J Pharmacol Sci משנת 2006).
- נוגדנים כנגד Fas או כנגד TNF-α משדרגים את יצירת MCP-1 באסטרוציטים (Ogier וחב' ב-BMC Neurosci משנת 2005)
תפקיד MCP-1 במחלות
MCP-1 והקולטן שלו CCR2 מושרים או מדוכאים במגוון מחלות. שימוש בעכברים טרנסגניים החסרים MCP-1, או על ידי שימוש בנוגדנים או כמעכבים הפוגעים בפעילות MCP-1 בעכברים וכן ניתוח מחקרים אפידמיולוגיים באדם.
- הופעת פקקת על ידי יצירת tissue factor (Charo ו-Taubman ב-Circ Res משנת 2004)
- הפלות חוזרות על ידי השרית MCP-1 מפעולת IL-1β (Huang וחב' ב- J Reprod Immunol משנת 2006)
- מחלות מעי דלקתיות על ידי התמיינות של מקרופאגים של מערכת העיכול בהשריה של MCP-1 (Spoettl וחב' ב-Clin Exp Immunol משנת 2006)
- בטרשת נפוצה קיים מתאם בין MCP-1 והנזק האקסונאלי, וכן עם היפרטרופיה של אסטרוציטים (Tanuma וחב' ב-Acta Neuropathologica משנת 2006)
- בתחושת כאב (Nociception) יש דה-פולריזציה של נוירונים מתווכת על ידי MCP-1 (Sun וחב' ב-J Neurophysiol משנת 2006)
- בסיבוכים נוירולוגיים של HIV, יש שדרוג של MCP-1 ושפעול של תאי גליה בתווך של Tat (Flora וחב' ב-Exp Neurol משנת 2005)
- בנזק רטינופתי המושרה על ידי חמצן, יש עלייה ניכרת ב-MCP-1 במקרופאגים ובתאי מיקרוגליה (Davies וחב' ב-Mol Vis משנת 2006)
- בפגיעה נוירו-קוגניטיבית הכרוכה ב-HIV, יש מתאם בין רמת MCP-1 בפלזמה (Ragin וחב' ב-Neurology משנת 2006)
- בווסקולריזציה טרייה המושרית על ידי גידולים סרטניים, יש השפעה של MCP-1 בהסננה של מקרופאגים (Wang וחב' ב-Oncogene משנת 2006)
- באסתמה אלרגית יש הפרשה של MCP-1 המושרית על ידי IL-4 ו-IL-13 באפיתל הברונכיאלי (Ip וחב' משנת 2006)
- בדלקת פרקים שגרונתית (RA) רמת MCP-1 עולה לפני תסמיני התרחיש (Rantapaa-Dahlqvist וחב' משנת 2007).
- במות תאים נוירונאליים באיסכמיה יש הגברה של אסטרוציטים המבטאים MCP-1 ושל תאים המבטאים את הקולטנים שלו (Sakurai-Yamashita וחב' משנת 2006)
- בפגיעה נוירונאלית על ידי NMDA יש ייצור מוגבר של MCP-1 על ידי אסטרוציטים (Katayama וחב' ב- Neurosci Lett משנת 2002)
התפקיד של MCP-1 במפגעים נוספים
MCP-1 והקולטן שלו CCR2 נמצאו מוגברים ומשחקים תפקיד מרכזי בהתפתחות של טרשת עורקים (Namiki וחב' ב-Artheriosclr Thromb Vasc Biol משנת 2002). יתרה מכך, ההתמיינות של מקרופאגים במעיים שובשה על ידי MCP-1, מה שמרמז לכך ש-MCP-1 פוגע בהתמיינות תאים במעיים המתרחשת ברירית של אלה הסובלים ממחלת מעי דלקתית (IBD) (Spoettl וחב' ב-Clin Exp Immunol משנת 2006). מחקרים נוספים כרכו את השריית MCP-1 על ידי IL-4 ו-IL-13 בתאי אפיתל של הסמפונות לפוטנציאל של מעורבות MCP-1 באסתמה אלרגית (Ip וחב' ב-Clin Exp Immunol משנת 2006). יתרה מכך, רמות MCP-1 היו מוגברות משמעותית באלה עם rheumatoid arthritis (Rantapaa-Dahlqvist וחב' ב- Ann Rheum Dis משנת 2007). בנוסף, על ידי שימוש במודל של עכברים טרנסגניים, נמצא ש-MCP-1 בצירקולציה עשוי לתרום להופעת עמידות לאינסולין במטופלים סוכרתיים (Kamei וחב' ב-J Biol Chem משנת 2006). לבסוף, נמצא ש-MCP-1 מעורב גם במפגעים נוירולוגיים כגון מוות של נוירונים כתוצאה מאיסכמיה, כאשר רמות MCP-1 היו מוגברות באסטרוציטים (Sakurai-Yamashita וחב' ב- Cell Mol Neurobiol משנת 2006).
החשיבות של MCP-1 והקולטן שלו CCR2 אינה מוגבלת להופעה של מחלת עורקים כליליים, אלא גם במחלות דלקתיות. וכך, תוצאות דומות התקבלו לגבי experimental allergic encephalitis המהווה מודל ל-MS במכרסמים (Izikson וחב' ב-J Exp Med משנת 2000). במחקרים אלה נמצא, שעכברים החסרים MCP-1 או את הקולטן שלו, גייסו הרבה פחות מונוציטים אל תוך ה-CNS וחומרת המחלה הייתה פחותה בהרבה.
גיוס של מונוציטים/מקרופאגים באיבר מסוים בתגובה לדלקת היא תגובה חיונית כדי להרחיק פתוגנים פולשים על ידי פגוציטוזיס. הודגם גיוס של מספר גדול של מיקרוגליה מתוך המוח ושל מונוציטים מהדם הקשורים לפינוי משקעים של β-amyloid (Britschgi וחב' משנת 2007, ו- El Khoury וחב' ב-Med משנת 2007).
MCP-1 מיוצר על ידי סוגי תאים רבים כולל תאי אנדותל, פיברובלסטים, תאי אפיתל, תאי שריר חלק, תאי מזנגיום, אסטרוציטים, מקרופאגים, מונוציטים ותאי מיקרוגליה (Cushing וחב' ב-Proc Natl Acad Sci USA משנת 1990, Standiford וחב' ב-J Biol Chem משנת 1991, Brown וחב' ב-Kidney Int משנת 1992 ו-Barna וחב' ב-J Neuroimmunol משנת 1994). עם זאת, מונוציטים ומקרופאגים הם המקור העיקרי של MCP-1 (על פי Yoshimura וחב' ב-FEBS lett משנת 1989). נראה ש-MCP-1 מווסת את הנדידה וההסננה של מונוציטים, לימפוציטים מסוג memory T וכן תאי NK.
בעזרת סימון א-סימטרי של MCP-1 בניסויי NMR, נקבע המבנה של הדימר בתמיסה (Handel ו-Domaille ב-Biochemistry משנת 1996). מחקרים אלה הראו שהמבנה השניוני של MCP-1 מורכב מ-4 אזורים של β-sheet. אלה כוללים את שיירים 9–11 (β0), שיירים 27–31 (β1), שיירים 40–45 (β2) ושיירים 51–54 (β3). בנוסף ל-4 הגְּדִילים (starnds) של ה-β sheets, ישנם 2 אזורים סליליים (helical). גדיל ארוך נמשך משייר 58 לשייר 69. כמו כן נמצא על ידי Zhang ו-Rollins בשנת 1995 ב-Mol Cell Biol שהשיירים 6–16 מעורבים בדימריזציה של MCP-1. השיירים הכרוכים בדימריזציה הם Asn6, Phe15 ,Asn14 ,Tyr13 ,Cys11 ,Val9 ,Ala7 ו-Thr16 ליד הקצה ה-N-טרמינלי, וכן Ile51 ,Glu50 ו-Cys52. נמצא שניתן להחליש את התפקוד של MCP-1 על ידי שמאפשרים לו ליצור דימר עם צורת מוטנט בלתי פעיל של MCP-1. לדוגמה, נמצא שהמוטנט 7ND עם מוטציית שמט בקצה ה-N טרמינלי, בו חסרים השיירים 2–8, פועל כמעכב של MCP-1 על ידי שהוא מונע התקשרותו לקולטן CCR2 (על ידי Kitamoto ו-Egashira ב-Expert Rev Cardiovasc The משנת 2003). נמצא שעכברים טרנסגניים המבטאים את הגן 7ND, חסמו את מסלול הפעולה של MCP-1, ומנעו יצירת נגע טרשתי ללא כל השפעה על ריכוזי הליפידים בנסיוב.
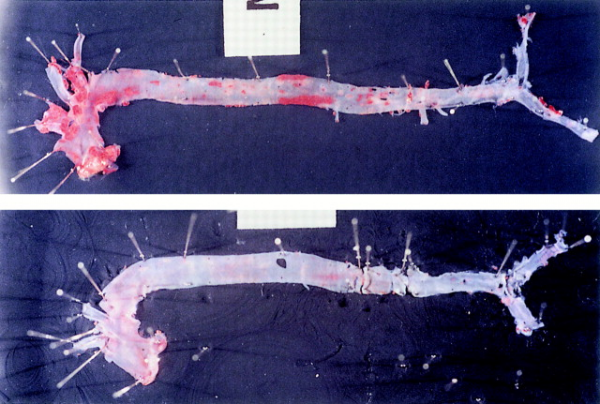
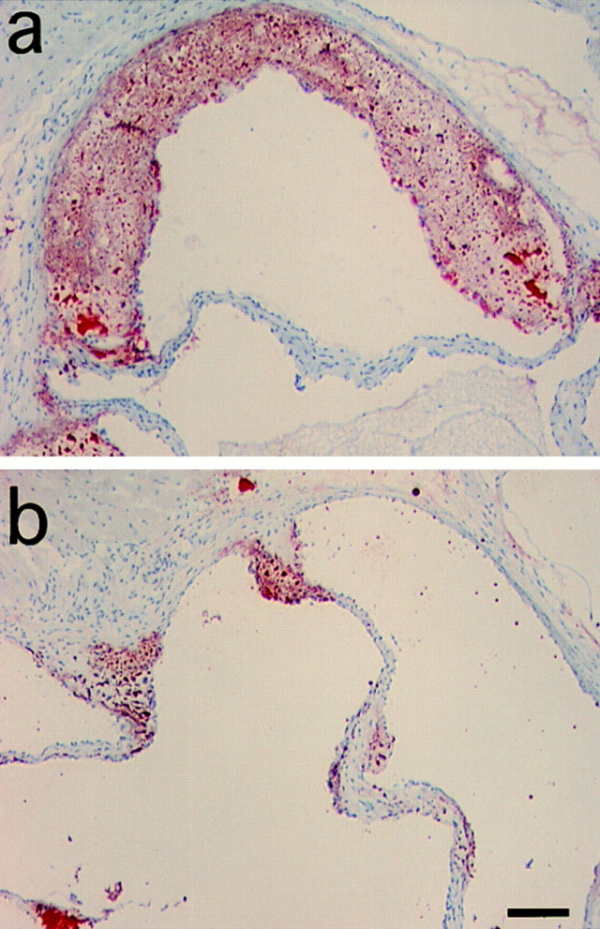
חסר של MCP-1 מפחית את טרשת העורקים בעכברים טרנסגנים החסרים את הקולטן של LDL
גיוס מונוציטים מהדם לאזור התת-אפיתליאלי העורקי הוא אחד השלבים הראשונים של אתרוגנזיס. MCP-1 הוא בסבירות גבוהה אחד האיתותים המשתתפים בתהליך זה. כדי לבחון את מנגנון הפעולה של MCP-1, עכברים בהם נמנעה יצירת הקולטן של LDL, וממילא תהליכי טרשת העורקים שלהם מוגברים, שמשו את Gu וחב' במחקרם משנת 1998 שהתפרסם ב-Molecular Cell, כאשר האכילו את העכברים הללו בדיאטה עתירת כולסטרול. נמצא שרמה נמוכה של MCP-1 הייתה כרוכה בשקיעה מוגברת של ליפידים באזורים שונים בעורקיהם. אמנם בעכברים עם פגיעה גנטית כפולה של חסר בקולטנים ל-LDL וחסר ב-MCP-1 (דהיינו compound deficient mice) מספר המקרופאגים שהגיעו לאזור הדופן העורקית נמצא נמוך יותר. (תמונות למטה):
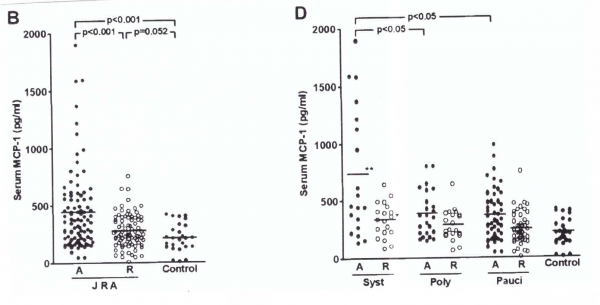
MCP-1 כמדד רגיש לדלקת פרקים שגרונתית בילדים (Juvenile RA)
דלקת פרקים שגרונתית בילדים (להלן JRA) היא המחלה הראומטית השכיחה ביותר בילדים, והיא מתאפיינת במספר גדול של לויקוציטים שעוברים הסננה למפרקים הדלקתיים. האפשרות של מעורבות MCP-1 בתהליך פתולוגי זה נבחנה על ידי Yao וחב' במאמר ב-Arthritis Rheumat משנת 2006. הסתבר שרמות MCP-1 מוגברות בכל סוגי JRA כאשר הרמות הגבוהות ביותר הופיעו בצורה הסיסטמית של JRA. למרות שרמות אלה פחתו לאחר טיפול, הן עדיין נותרו גבוהות בהשוואה לביקורת של ילדים בריאים. גם בנוזל הסינוביאלי רמות MCP-1 נמצאו מוגברות ב-JRA. רמה ממוצעת של MCP-1 בנסיוב של מטופלים עם JRA פעיל נקבעה כ-437 פיקוגרם/מ"ל, לעומת רמה ממוצעת של 213 פיקוגרם/מ"ל בביקורת בריאה. רמת MCP-1 בהופעה סיסטמית של JRA (734 פיקוגרם/מ"ל) הייתה משמעותית גבוהה מרמת כמוקין זה בביקורת בריאה (0.001p<). תמונה למטה:
ראיות לכך ש-MCP-1 יכול לקבוע איבוד עצם בתגובה להורמון פארא-תירואידי (PTH)
אנשי היחידה של NYU Dentistry בראשות Nicola Partridge במחקר על ההשפעה הקטבולית של PTH בהיפר-פארא-תירואידיזם (HPT), הראו לראשונה ב-Sci Rep משנת 2017, ש-MCP-1 דרוש לתגובה הקטבולית ל-PTH. HPT הוא המצב בו רמות מוגברות באופן לא תקין של PTH בדם מאיצות תהליך איבוד עצם. במחקר קודם הראו חוקרים אלה ש-MCP-1 חיוני בהופעת תהליך אנאבולי של PTH בו דווקא מוגברת יצירת עצם, והם בקשו לבחון האם כמוקין זה יכול גם לגרום להשפעה קטבולית, בו רקמת העצם מתדלדלת. במחקר הנוכחי התמקדו החוקרים בתפקיד של MCP-1 ביצירת אוסטאוקלסטים המושרית על ידי PTH. המחקר התבצע בעכברים נקבות שהושרה בהן מצב של HPT על ידי עירוי משך שבועיים לתוכן של PTH, או בעכברי knock-out משוללי MCP-1 שאף הם עברו עירוי עם PTH אנושי. נמצא שהיכולת של PTH להגביר יצירת אוסטאוקלסטים in vitro, נפגעת משמעותית בתאים שמקורם בעכברי knock-out החסרים MCP-1 והמסקנה היא שהכמוקין האחרון חשוב כחלבון איתות בהשריית יצירת אוסטאוקלסטים על ידי PTH וספיגת עצם הנובעת מכך.
ממצא זה תומך באפשרות ש-MCP-1 עשוי לשמש סמן לפעילות של PTH באנשים עם HPT, שכן רמות מוגברות של MCP-1 בנסיוב נמצאו במתאם טוב עם רמות מוגברות של PTH בנשים. דקות ספורות לאחר שבני-אדם עוברים ניתוח להסרת אדנומה של בלוטת הפארא-תירואיד, רמת MCP-1 פוחתת. כיוון שרמות גבוהות בנסיוב של MCP-1 גורמות לתאי-דם לבנים ולאוסטאוקלסטים להתגרות, תהליך זה עשוי להיות בעל השפעות סיסטמיות על הלב, על רקמת השומן כמו גם השפעות על העצם.
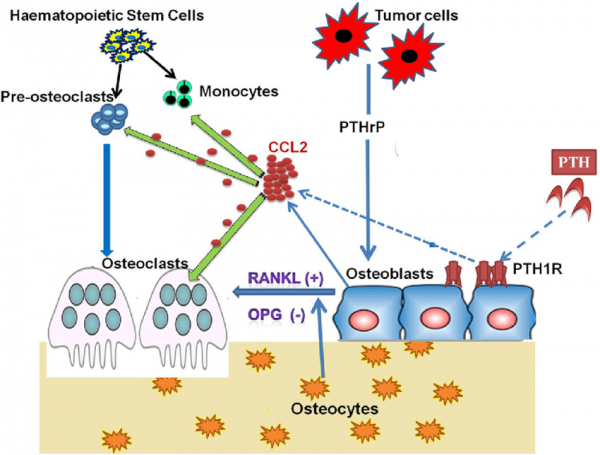
אוסטאוקלסטים הם תאים גדולים רב-גרעיניים הנוצרים מאיחוי של תאים פרוגניטורים חד-גרעיניים הנובעים מה-lineage של מונוציטים/מקרופאגים. לעומתם אוסטאובלסטים נובעים מתאי גזע מזנכימאליים. בתהליך ה-remodeling של העצם, אוסטאובלסטים וכן אוסטאוקלסטים תלויים במידה רבה אחד בשני כדי לשמור על מסת עצם תקינה. אוסטאובלסטים מפרישים MCP-1 בעת התקשרות ההורמון PTH לקולטן שלו הידוע כ-PTH1R או parathyroid hormone/parathyroid hormone-related peptide receptor, הנמצא על פני אוסטאובלסטים. MCP-1 המושרה על ידי PTH, מעודד גיוס של מונוציטים ושל קדם-אוסטאוקלסטים לאזורים של remodeling. בעת ובעונה אחת, MCP-1 משתתף גם באיחוי של קדם-אוסטאוקלסטים ליצירת אוסטאוקלסטים בשלים. העלייה הזמנית בביטוי של MCP-1 והביטוי של אוסטאוקלסטים הנובע מכך, נדרשים להשפעה האנאבולית של PTH על העצם. תאים סרטניים מייצרים את ה-PTHrP או parathyroid hormone-related peptide, המעודד ביטויו של MCP-1 בתאים אוסטאובלסטים יוצרי עצם. הגברה ב-MCP-1 אוסטאובלסטי, מגבירה יצירת אוסטאוקלסטים וספיגת עצם מה שמסייע לשגשוג התאים הסרטניים בעצם.
הוראות לביצוע הבדיקה
דגימות פלזמה נלקחו במבחנות סודיום ציטראט (פקק בצבע תכלת), והוקפאו תוך 60 דקות מנטילת הדם בטמפרטורה של מינוס 70 מעלות צלזיוס. המבדק נעשה בשיטת ELISA בשימוש עם נוגדן חד שבטי כנגד MCP-1 ממקור עכבר (חברת Biosite), בפלטות TECAN Genesis, כאשר רמת MCP-1 נמדדת כמותית על ידי כימות עוצמת הצבע הצהוב המתקבל מתגובה של הנוגדן המכוון כנגד mouse IgG והמסומן באנזים alkaline phosphatase עם המצע שלו באורך גל של 412 ננומטר. ניתן לדגום את הדם גם למבחנה כימית (פקק אדום או צהוב). הנסיוב יציב בקירור בטמפרטורה של -70°C עד שנתיים, ואילו הפלזמה יציבה בקירור (2-8°C) עד 24 שעות.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק