אזואוספרמיה - Azoospermia
| אזואוספרמיה | ||
|---|---|---|
| Azoospermia | ||
| ||
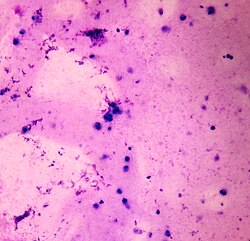
Semen analysis revealing no sperm cells and multiple white blood cells
| ||
| ICD-10 | Chapter N 46. | |
| ICD-9 | 606.0 | |
| יוצר הערך | ד"ר שי שפי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – תת-פריון הגבר
התמודדות עם אזואוספרמיה (העדר זרע בזירמה, Azoospermia) דורשת מהאנדרולוג שילוב של היסטוריה, בדיקה פיסיקלית, בדיקות מעבדה מודרניות, וטיפול ניתוחי מתקדם. מדובר באבחנה ששכיחותה באוכלוסייה הגברית מגיעה לכדי 1%, ועד ל-10-15% מהפונים למרפאות לפריון הגבר.
מקובל לסווג אזואוספרמיה לאטיולוגיה חסימתית, בה קיים ייצור תקין של תאי זרע, שאינם יכולים להיפלט בזירמה עקב חסימה מכנית, או לאטיולוגיה לא-חסימתית, בה קיימת בעיה בייצור תאי הזרע.
אבחנת אזואוספרמיה היא מעבדתית, ותלויה בקבלת תוצאות בדיקת זרע.
עד לפני כ-2 עשורים, גברים אזואוספרמיים הוגדרו כעקרים, והאפשרויות היחידות שעמדו בפניהם כדי להפוך לאבות היו תרומת זרע או אימוץ.
עם זאת, שימוש מושכל בטכניקות ניתוחיות מודרניות בשילוב עם טכנולוגיות הפריה מתקדמות אשר פותחו בשנים האחרונות, מאפשר לחלק לא מבוטל מגברים אלה להפוך לאבות לצאצאים ביולוגיים.
אפידמיולוגיה
למרות שלאלה שאינם עוסקים במקצוע נתפס הנושא לעתים כבעייה נדירה ושולית, הרי ששכיחות האבחנה באוכלוסייה הגברית מגיעה לכדי 1%, ועד ל-10-15% מהפונים למרפאות לפריון הגבר.[1]
אטיולוגיה
קיימות 2 שיטות עיקריות לסיווג אזואוספרמיה.
בדומה לכשלון בתפקוד הכליה, ניתן לקבץ את האבחנות השונות לבעיות טרום-אשכיות, אשכיות או בתר-אשכיות (Pre-testicular, Testicular, Post-testicular). הקבוצה הראשונה נדירה יחסית, וכוללת את המקרים בהם הפרעה אנדוקרינית משבשת את ייצור הזרע (כישלון אשכים משני). בקבוצה השנייה ההפרעה בייצור הזרע ממוקמת לאשך עצמו (כישלון אשכים ראשוני), ואילו בקבוצה השלישית, ייצור הזרע תקין, אך חסימה רחיקנית (דיסטלית) לאשך מונעת את פליטת הזרע.
השיטה השנייה מסווגת אזואוספרמיה לאטיולוגיה חסימתית או לא-חסימתית, ונוחה יותר לשימוש בדיון אפשרויות הטיפול והפרוגנוזה למציאת זרע.
אזואוספרמיה חסימתית
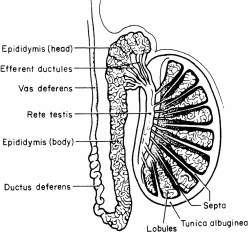
כ-30-40% ממקרי האזואוספרמיה הם בעלי אטיולוגיה חסימתית (Obstructive azoospermia). במצב זה קיים ככלל ייצור תקין של תאי זרע, שאינם יכולים להפלט בזירמה בגלל חסימה מכנית. למעשה, חסימה בכל מיקום אנטומי החל מ-Efferent ductules, דרך יותרת האשך (אפידידימיס) וצינור הזרע (Vas deferens), ועד לחיבור המערכת בשופכה הפרוסטטית, תגרום לחסימה ולתמונה קלינית של אזואוספרמיה חסימתית.
הסיבות לאזואוספרמיה חסימתית מגוונות, ויכולות להיות מולדות או נרכשות.
אזואוספרמיה חסימתית - אבחנה מבדלת
סיבות מולדות
- CBAVD, CUAVD (נשאות CF או מלפורמציה אורוגניטלית)
- תסמונת יאונג (Young syndrome)
- חסימה אידיופטית של יותרת האשך (Idiopathic epididymal obstruction)
- חסימה של ה-Ejaculatory duct
- ציסטות בבלוטת הערמונית (Prostatic Cysts)
סיבות נרכשות
- תיקון בקע מפשעתי (תיקון בקע דו-צדדי "רגיל" בילדים, שימוש ברשת במבוגרים)
- חסימה של ה-Ejaculatory duct
- מצב אחרי דלקות (יותרת האשך, ערמונית)
- מצב לאחר כריתת הערמונית דרך השופכה ((Transurethral resection of the prostate (TURP) או ביופסית ערמונית
- חסימת צינורות הזרע
- מצב אחרי כריתת צינור הזרע (Vasectomy)
חסר דו צדדי מולד של צינור הזרע (CBAVD ,Congenital Bilateral Absence of the Vas Deferens)
לייפת כיסתית (Cystic fibrosis, CF) היא המחלה האוטוזומלית רצסיבית השכיחה ביותר בגזע הלבן, שיעורה עד ל-1:1600 לידות בקבוצות אתניות שמוצאן צפון אירופאי, ושיעור הנשאות מגיע לכדי 1:20. הגן המעורב מוקם לכרומוזום 7, ומקודד חלבון ממברנאלי (Cystic fibrosis transmembrane conductance regulator; CFTR). CFTR מתפקד כתעלת כלוריד, ואותר בדרכי הנשימה, העיכול, כבד, לבלב, עור ומערכת המין. עד כה זוהו למעלה מ-1300 מוטציות שונות בגן זה.[2] מהות המוטציות ושכיחותן שונה בקבוצות אתניות שונות. ככלל, השכיחות גבוהה יותר בעולם המערבי, ומגיעה לשיא באזור הים התיכון. מסיבות מובנות, לא ניתן לחפש את כל המוטציות הידועות בכל נבדק, וכתוצאה, הרכב הפנל לאיתורן הוא נושא הנתון בויכוח, בשל האפשרות הסטטיסטית לכישלון באיתור מוטציה ספציפית.
CBAVD נמצא כאטיולוגיה של 6% ממקרי אזואוספרמיה חסימתית וב-1% מן הגברים הלא פוריים.[3] האבחנה דורשת מודעות ומיומנות בבדיקה הפיסיקלית של שק האשכים, שם לא נמוש צינור הזרע משני הצדדים. האשכים עצמם בעלי נפח ומרקם תקינים, ויותרת-האשך נמושה רק בחלקה הפרוקסימלי (ראש). בדיקת הזרע תראה אזואוספרמיה, נפח נמוך, pH ופרוקטוז נמוכים. הפרופיל ההורמונלי תקין.
בהתאם לדיווחים רבים בספרות, מצב זה מחולק ל-2 קבוצות עיקריות:
- הקבוצה העיקרית מהווה 60-90% מהגברים הלוקים בתסמונת, ובהם תמצא מוטציה באלל אחד של גן לייפת כיסתית. זהו מצב של נשאות, ללא תסמינים של המחלה, למעט היעדר צינוריות הזרע. כמעט כל הגברים חולי לייפת כיסתית סובלים מאזואוספרמיה חסימתית על רקע CBAVD.
- בקבוצה המשנית, המהווה 10-40% מהגברים, לא נמצאת מוטציה ב-CFTR, ואצלם מאובחן במקביל מצב של היעדר כליה (Renal agenesis) חד-צדדי.
שתי הקבוצות הללו נבדלות מבחינת הרקע האמבריונאלי שלהן. ואכן, בתקופת ההתפתחות העוברית, כל צינור מזונפרי (Mesonephric duct) אחראי להיווצרות 2 תת-יחידות שונות. מהראשונה יתפתחו הכליה והשופכן, ומהשניה יתפתחו 2/3 דיסטליים של יותרת-האשך, צינור הזרע ושלפוחיות הזרע. ההפרדה בין 2 תת היחידות הללו נוצרת בשבוע ה-7 להריון, ומכאן שהפגיעה הגורמת גם להיעדר כליה נוצרת לפני נקודת זמן זו, בעוד שהפגיעה הגורמת ל-CBAVD בלבד, נוצרת מאוחר יותר.[4]
התבטאות קלינית שונה במקצת הנה CUAVD - חסר חד צדדי מולד של צינור הזרע (Congenital unilateral absence of the Vas Deferens), בה נמוש צינור זרע בצד אחד בלבד. על ידי על קול חולחלתי ((Trans rectal ultrasound (TRUS) ניתן לזהות אנומליות שונות (בדרך כלל אטרזיה) גם בצד השני עד ל-Ejaculatory duct. במצב זה שכיחות היעדר כליה מגיעה לכ-25%, לעומת כ-10% במקרי CBAVD.
- דגשים
- יש לשלול מוטציה ב-CFTR (כלומר, נשאות ללייפת כיסתית) במצבים בהם מתגלית אנומליה ב-TRUS, אפילו אם הבדיקה הפיסיקלית תקינה.
- בכל מקרה של נשאות מסוג זה, יש להפנות את הגבר לייעוץ גנטי רשמי, ולשלוח גם את בת הזוג לבדיקת נשאות ללייפת כיסתית.
- מכיוון ש-CBAVD וכישלון ראשוני של האשך הנם מצבים לא תלויים, קיימים מקרים בהם הם תוארו ביחד.[5] התמונה הקלינית הכללית יכולה להעלות את החשד לצירוף זה.
אזואוספרמיה לא-חסימתית
אחת הבעיות התובענית ביותר באנדרולוגיה היא, ללא ספק, אזואוספרמיה לא-חסימתית, וגם במקרה זה ניתן למצוא גורמים לא מעטים.
אזואוספרמיה לא-חסימתית - אבחנה מבדלת
- סיבות מולדות
- אברציות כרומוזומליות (לדוגמה: תסמונת קליינפלטר)
- חסרים בכרומוזום Y
- הפרעות אנדוקריניות כגון היפוגונדוטרופיק היפוגונדיזם (Hypogonadotropic Hypogonadism), תסמונת קלמן (Kallman syndrome) וגידול בבלוטת יותרת המוח (היפופיזה), לרוב פרולקטינומה
- מוטציות בקולטן לאנדרוגנים
- אשכים טמירים
- לא מוסבר (אידיופטי)
- סיבות נרכשות
- גורמים הרעילים לאשכים (גונדוטוקסינים)
- כימוטרפיה וטיפולים ציטוטוקסיים אחרים
- טיפול בטסטוסטרון
- סטרואידים לבניית הגוף (Anabolic steroids) - הקרנות
- וריקוצלה
- זיהום קשה באשכים, לדוגמה לאחר חזרת (Postpubertal mumps orchitis)
- טראומה
תסמונת קליינפלטר (Klinefelter syndrome)
תסמונת קליינפלטר מהווה את האטיולוגיה הגנטית השכיחה ביותר לאזואוספרמיה (כ-14% מהמקרים). הטריאדה הקלאסית כוללת אשכים קטנים ומוצקים, אזואוספרמיה, וגינקומסטיה. מאפיינים נוספים הנם קומה גבוהה, השמנה, סוכרת, דליות ומחלות ממאירות שונות, ועוד, אך רוב החולים מציגים רק חלק ממגוון המאפיינים שתוארו. ב-90% קיים כרומוזום X עודף (47,XXY), ו-10% מהמקרים הם מוזאיקה (תערובת של 46,XXY,47/XY), ורק אצלם ניתן לעתים למצוא אבהות טבעית. רמת הטסטוסטרון בדרך כלל נמוכה, בעוד שרמת הגונדוטרופינים (הורמון מגרה זקיק (FSH), הורמון הצהבה (LH)) גבוהה.
בביופסית אשך נמצא טרשת (סקלרוזיס) והיאליניזאציה (Hyalinization). שיעור ההצלחה "ההיסטורי" במציאת זרע בתסמונת קליינפלטר לא עולה בד"כ על 50%, אך קבוצתו של Schlegel מראה שיעורי הצלחה של כ-70%.[6]
קליניקה
אזואוספרמיה חסימתית
גברים הלוקים באזואוספרמיה חסימתית יבחינו לעתים בנפח נמוך של הזירמה. בבדיקתם נמצא אשכים במרקם ונפח תקינים (20 מ"ל ומעלה).
אזואוספרמיה לא-חסימתית
בבדיקת האשכים ניתן להתרשם פעמים רבות ממרקם רך, וכן מנפח נמוך (< 20 מ"ל). מכיוון שאבוביות הזרע (Semineferous tubules) והתאים הטרמינליים מהווים כ-80% מנפח האשך, ממצא זה אינו מפתיע בגברים עם אזואוספרמיה לא-חסימתית והפרעות אחרות בייצור הזרע.[7]
אבחנה
אבחנת אזואוספרמיה היא מעבדתית, ותלויה בקבלת תוצאות בדיקת הזרע. בתור שכזו, הכרחי להקפיד על הכללים של ארגון הבריאות העולמי לגבי בדיקות זרע. לפיהם, העדר זרע בסקירה הראשונית של הדגימה, חייב לקבל אישור נוסף אחרי סרכוז ב-3000g למשך 15 דקות, ובדיקת המשקע בצורה יסודית בהגדלה x400. ויתור על סרכוז יגרום לאבחנה שגויה של אזואוספרמיה (False positive) בכ-20% מהמקרים.[8]
אבחנת אזואוספרמיה חסימתית
הערכת הנפח מתבצעת על ידי אורכידומטר על שם פרדר (Prader orchidometer). לעתים לא ניתן למשש את צינור הזרע, או לחילופין למצוא בו אי סדירות, עיבוי או היצרות. תפיחות של יותרת-האשך או מישוש שלפוחית זרע (Seminal vesicle) בבדיקת החלחולת מרמזים גם הם על הפרעה חסימתית.
בבדיקת הזרע
- היעדר מוחלט של תאי זרע
- נפח נמוך (< 1.5 מ"ל), במידה שהחסימה מאזור שלפוחיות הזרע ודיסטלית.
במקרים של חסימה פרוקסימלית יותר, בדרך כלל הנפח יהיה תקין, עקב התרומה הזניחה של האשך, יותרת-האשך וצינור הזרע לנפח הזירמה.
- pH נמוך (< 7.2) במידה שהחסימה מאזור שלפוחיות הזרע ודיסטלית, בגלל היעדר נוזל בסיסי שמקורו בשלפוחיות הזרע.
- פרוקטוז נמוך במידה שהחסימה מאזור שלפוחיות הזרע ודיסטלית, בגלל היעדר נוזל עשיר בפרוקטוז שמקורו בשלפוחיות הזרע.
בנוסף להפרעה חסימתית, האבחנה המבדלת של נפח זירמה נמוך כוללת גם בעיות איסוף (דגימה חלקית), התנזרות קצרה מדי משפיכה (< 48 שעות), היפוגונדיזם (ערכים נמוכים של טסטוסטרון), ושפיכה אחורית (Retrograde ejaculation). גורמים אלה יש לברר על ידי לקיחת אנמנזה מכוונת, או בדיקות מעבדה מתאימות.
הפרופיל ההורמונלי באזואוספרמיה חסימתית תקין לרוב. למרות זאת, לעתים מתפתחת הפרעה משנית בייצור הזרע בחסימות נרכשות, וכתוצאה יתקבלו ערכי FSH גבוהים מהנורמה.
אחד מהכלים היעילים ביותר בבירור אזואוספרמיה חסימתית ונפח שפיכה נמוך הוא TRUS, שלו תפקיד חשוב באבחנה המבדלת בין אזואוספרמיה חסימתית לבין אזואוספרמיה לא-חסימתית, דבר המשפיע על המשך הבירור, הפרוגנוזה, וצורת הטיפול.[9]
יש לציין כי קיימים מצבים של חסימה חלקית, חד-צדדית, או פונקציונלית, אשר לא יתבטאו באזואוספרמיה.
אבחנת אזואוספרמיה לא-חסימתית
בבדיקת הזרע
- היעדר מוחלט של תאי זרע
- נפח תקין (> 1.5-2.0 מ"ל)
- pH תקין (> 7.2)
- פרוקטוז תקין
הורמונים
במרבית המקרים שמקורם בכישלון ראשוני של האשך נמצא רמות גבוהות של FSH, בדרך כלל גדולות לפחות פי שתיים מהנורמה. בחלק מהמקרים רמות טסטוסטרון תהיינה גבוהות, דבר המצביע על כישלון אנדוקריני של האשך, בנוסף לכישלון האקסוקריני (ייצור הזרע). במקרים אלה נמצא רמות LH תקינות או גבוהות.
בירור גנטי
יש להציע בדיקת קריוטיפ וחסרים זעירים (Microdeletion) בכרומוזום Y לכל הגברים הלוקים באזואוספרמיה לא-חסימתית על רקע כשלון ראשוני של האשך. בגברים אלה, נמצא כי שיעור אברציות כרומוזומליות הוא 15-20%, ושל חסר בכרומוסום Y הוא 13-15%.[10] בגברים עם כשלון משני של האשך (Hypogonadotropic Hypogonadism) ניתן לבדוק מוטציות בגנים KAL 1-3, אך הבדיקה לא מתבצעת באופן שגרתי, ויש ליצור קשר עם מעבדה מיוחדת.
לתוצאות הבירור הגנטי יכולות להיות השלכות מעשיות הן מבחינת פרוגנוסטית, למשל במקרה של חסר זעיר בכרומוזום Y, והן מבחינת השלכות אפשריות על העובר. לעתים ניתן יהיה לברור עוברים שאינם נגועים על ידי שימוש בטכניקה של ביופסיית תא יחיד מהעובר המתפתח ביום 3 לאחר הפריה חוץ-גופית (Preimplantation genetic diagnosis; PGD). הדנ"א שמופק מתא זה נבדק למחלות גנטיות ספציפיות ע"י שיטות כ-FISH או כ-PCR.
מסקירת הספרות לגבי חסרים זעירים בכרומוזום Y, עולה כי לתוצאה חיובית יש ערך פרוגנוסטי במספר רמות:[11]
- תאי זרע בזירמה
הפרוגנוזה הטובה ביותר היא אצל גברים עם חסר במקטע AZFc, שחלקם יהיו אוליגוספרמיים. חסר שלם של מקטע AZFa או AZFb הנו נדיר, אך הסיכוי למציאת זרע זניח. - היסטולוגיה בביופסיית אשך
קיים קשר בין חסר שלם של AZFa לבין ממצא של "תאי סרטולי בלבד" (Sertoli cell only), ובין חסר שלם של AZFb לבין עצירה בהבשלה (Maturation arrest). לעומתם, חסר ב-AZFc קשור לתת-יצירת תאי זרע (Hypospermatogenesis) או ל"תאי סרטולי בלבד מסוג 2" (Type II Sertoli Cell Only), שהיא צורה נרכשת עם סיכוי רב יותר למציאת זרע בהפקת זרע כירורגית. - הפקת זרע כירורגית ותוצאות הפריה חוץ גופית משולבת במיקרומניפולציה של הזרקת זרע בודד לביצית (IVF-ICSI)
הסיכוי למציאת זרע בגברים אזואוספרמיים עם חסר במקטע AZFc אינו שונה מהסיכוי בקבוצה כולה ועומד על כ-50%. חסר שלם של מקטע AZFa או AZFb, או מספר תת-אזורים במקטעים אלה, מצביע על פרוגנוזה גרועה ביותר, אך מבוסס על מספר קטן מאוד של תצפיות. מספר מצומצם ביותר של מחקרים עסק בשאלת תוצאות IVF-ICSI בגברים אזואוספרמיים עם חסרים בכרומוזום Y למול גברים אזואוספרמיים ללא חסרים כאלה. ברובם לא נמצא הבדל בין שתי הקבוצות מבחינת שיעורי ההפריה וההריונות. - צאצאים
גברים עם חסר בכרומוזום Y מעבירים אותו לצאצאיהם הזכרים. צאצאים אלו בריאים, אך יראו הפרעות פריון בדומה לאבותיהם. אולם, עקב נטייה אפשרית של מוטציות לגדול עם הדורות, יתכן כי צאצאים עתידיים יראו פגיעה פנוטיפית משמעותית יותר. בנוסף, חלק מהגברים בעלי חסר במקטע AZFc מראים הדרדרות תלוית-זמן בייצור הזרע, וייעוץ גנטי אצלם כולל המלצה להקפאת זרע בגיל צעיר.
עם זאת, יש לזכור שהבירור הגנטי המוצע היום מוגבל לבדיקות בודדות, ומשול לחיפוש מטבע מתחת למנורה. מקרים רבים של אזואוספרמיה לא-חסימתית נשארים בגדר אידיופטים, והערכה רווחת היא שרובם ככולם בעלי אטיולוגיה גנטית שאינה מוכרת או ניתנת להוכחה כיום, לפחות לא באופן שגרתי.
טיפול
בתחילת שנות ה-90 של המאה הקודמת, הובילה הצלחה מקרית במעבדה למהפכה של ממש בטיפול בגברים אזואוספרמיים.[12] עד אז, לא היתה בשימוש שיטה למיקרומניפולציה של תאי זרע. דיווחם הקצר של Palermo ואח' לכתב העת Lancet פרץ את הדרך לשימוש היומיומי בטכניקה הנקראת כיום ICSI (Intra Cytoplasmic Sperm Injection), ומאפשרת להשיג הריון ע"י שימוש בזרע בודד, ללא תלות במקורו (זירמה / יותרת האשך / אשך). טכניקה זו היא שנתנה את הדחיפה לשימוש בשיטות שונות להפקת זרע כירורגית, ובהמשך לפיתוח שיטות מיקרוכירורגיות מתקדמות. אבן דרך חשובה נוספת בתחום זה מהווה פרסום השיטה להפקת זרע כירורגית מהאשך, שפותחה ע"י Schlegel לפני כעשור, הנודעת בקיצור כ-microTESE.[13] בהמשך פורסמו שיטות מיקרוכירורגיות נוספות, להפקת זרע גם מיותרת האשך. גורם נוסף המעשיר את אפשרויות הטיפוליות הוא היכולת להקפיא ולשמור זרע אנושי לצורך שימוש עתידי.
הטיפול באזואוספרמיה חסימתית
חלק מהמצבים, כגון מצב אחרי כריתת צינור הזרע (Vasectomy) או חסימות ביותרת האשך מתאימים לשחזור מיקרוכירורגי מורכב יותר או פחות. בחירת חולים נכונה מביאה ליחסי עלות-תועלת עדיפים בשחזור למול הפקת זרע כירורגית בחלק מהמקרים. הפקת זרע כירורגית הינה אופציה הקיימת בכל המקרים, ולבטח באלה שאינם ניתנים לשחזור, כדוגמת CBAVD.
השיטות הקיימות להפקת זרע כירורגית במקרים של אזוזאוספרמיה חסימתית הן:
- שאיבת זרע מן האשך (Testicular sperm aspiration (TESA))
- שאיבת זרע מיותרת האשך באופן מילעורי (Percutaneous epididymal sperm aspiration (PESA))
- שאיבת זרע מיותרת האשך באופן מיקרוכירורגי (Microsurgical epididymal sperm aspiration (MESA))
שתי השיטות הראשונות אינן כרוכות בהשקעה ניכרת בלימוד ובציוד. ככלל, כאבים והתאוששות קלים יותר בשיטות המסתמכות על דיקור מילעורי לעומת שיטות פתוחות. PESA כרוכה בהצטלקויות וחסימות משניות ביותרת האשך, והיא פחות פופולרית בדרך כלל. MESA כרוכה בהשקעה ניכרת הן בלימוד המנתח והן בציוד מחד, אך תפוקתה (מספר תאי זרע לפרוצדורה) ואיכותם (רובם בתנועה), עושה אותה לשיטה הנבחרת במקומות בהן קיימת אפשרות לביצועה, מאידך. באופן כללי, הפרוגנוזה למציאת זרע באזואוספרמיה חסימתית קרובה ל-100%, ומקרים מסויימים נמצא יתרון גם לשחזור מיקרוכירורגי מורכב.
הטיפול באזואוספרמיה לא-חסימתית
אחת הבעיות התובענית ביותר באנדרולוגיה היא, ללא ספק, אזואוספרמיה לא-חסימתית, אולם שיטות מודרניות מאפשרות לגברים רבים הלוקים באזואוספרמיה לא-חסימתית להשיג אבהות ביולוגית.
כדי להבין את הרציונל שמאחורי השיטות המתקדמות להפקת זרע כירורגית בכשלון ראשוני של האשך המלווה באזואוספרמיה לא-חסימתית, יש להיות מודעים לשלוש עובדות יסוד:[14]
- בחלק מהגברים בהם לא נמצא זרע בזירמה, ניתן למצוא כמויות קטנות של זרע ב"כיסים" מיקרוסקופיים של יצירת זרע (ספרמטוגנזיס) בתוך האשך.
- באמצעים העומדים לרשותנו היום, לא ניתן לחזות מראש הצלחה או כשלון במציאת זרע בניתוח לגבי גבר ספציפי, ובנוסף, לא ניתן לאתר מראש את מיקום ה"כיסים" הנ"ל.
- ביופסית אשך היא כלי שיעילותו לחיזוי מציאת זרע באשך הכושל היא שולית, במקרה הטוב, והמידע שמספקת נכון רק לגבי הנקודה הספיציפית במרחב ממנו נלקחה. בחלק מהביופסיות אף ניתן להבחין ביותר מדגם היסטולוגי אחד.
השיטות לניסיון הפקת זרע כירורגית באזואוספרמיה לא-חסימתית
- דיקור האשך בניסיון לשאוב זרע בשיטת TESA או באמצעות שימוש במחט דקה - TEFNA (Testicular fine needle aspiration)
- נטילת דגימה ברקמת האשך לשם בידוד תאי זרע - TESE (Testicular sperm extraction)
- נטילת דגימה ברקמת האשך לשם בידוד תאי זרע באופן מיקרוכירורגי (Microsurgical dissection TESE, או בקיצור: microTESE)
שתי השיטות הראשונות מצריכות פחות השקעה הן בציוד והן בלימוד, ושיעור ההצלחה במציאת זרע נמצא ביחס ישר למספר הדיקורים / מספר הביופסיות. ככל שעולה מספר האתרים הנדגמים, קטן הסיכוי לפספס אזור/ים עם ייצור זרע (Sampling error). ככלל, הסיכויים למציאת זרע באזואוספרמיה לא-חסימתית טובים יותר בשיטה פתוחה.[15] מחד, לא הוכח יתרון חד-משמעי מחינת הסיכוי הכללי למציאת זרע בשיטה המיקרוכירורגית על פני TESE קונבנציונלי, אך הדברים אמורים רק במקרים בהם מבצעים ביופסיות מרובות. מאידך, ביופסיות מרובות מעלות משמעותית את הסיכון לפגיעה אנדוקרינית והיפוגונדיזם. בנוסף, במקרים בהם הפתולוגיה הקשורה לאזואוספרמיה לא-חסימתית קשה יותר ("תאי סרטולי בלבד" או "עצירת הבשלה"), יש יתרון ברור ל-microTESE.[16]
יתרונות MicroTESE על TESE כוללים:
- שימוש בטכניקה שונה לחלוטין (דיסקצית רקמה) מאפשר היקף סקירה רחב הרבה יותר של רקמת האשך.
- שימוש במיקרוסקופ מאפשר לדגום אבוביות בעלות מראה מתאים לייצור זרע מוקדי (פוקאלי) (עובי ואטימות / גוון).
- סה"כ כריתת רקמה במשקל נמוך משמעותי מפרוצדורה של ביופסיות מרובות (ללא מיקרוסקופ).
אחוזי הצלחה המדווחים במציאת זרע ע"י microTESE שונים ממרכז למרכז, נעים לרוב בין 40-60% ותלויים בניסיון המנתח וברמת המעבדה האמבריולוגית.[17][18]
מבט לעתיד
במבט לעתיד, שתי כיוונים מסקרנים נמצאים בשלבים מחקריים:
- פיתוח יכולות לזהות זרע בגברים עם אזואוספרמיה לא-חסימתית טרם או בזמן הניתוח.
- "ייצור" זרע בגוף או במעבדה ע"י שימוש בתאי גזע.[19]
פרוגנוזה
עד לפני כ-2 עשורים, גברים אזואוספרמיים הוגדרו כעקרים, והאפשרויות היחידות שעמדו בפניהם כדי להפוך לאבות היו תרומת זרע או אימוץ. הטיפול באזואוספרמיה עלול להתגלות כתובעני, בייחוד בגברים הלוקים באזואוספרמיה לא-חסימתית. למרות זאת, שימוש מושכל בטכניקות ניתוחיות מודרניות בשילוב עם טכנולוגיות הפריה מתקדמות, מאפשר לחלק לא מבוטל מגברים אלה להפוך לאבות לצאצאים ביולוגיים, דבר שלפני פחות מ-2 עשורים היה בגדר חלום בלבד.
דגלים אדומים
ביבליוגרפיה
- ↑ Practice Committee of the American Society for Reproduction Medicine in collaboration with the Society for Male Reproduction and Urology. Evaluation of the azoospermic male. Fertil Steril 2008;90:S74-77.
- ↑ Cystic Fibrosis Mutation Database. http://www.genet.sickkids.on.ca/cftr/
- ↑ Oates RD. The genetic basis of male reproductive failure. Urol Clin N Am 2008;35:257-270.
- ↑ McCallum T, Milunsky J, Munarriz R, Carson R, Sadeghi-Nejad H, Oates R. Unilateral renal agenesis associated with congenital bilateral absence of the vas deferens: phenotypic findings and genetic considerations. Hum Reprod 2001;16:282-288.
- ↑ Meng MV, Black LD, Cha I, Ljung BM, Pera RA, Turek PJ. Impaired spermatogenesis in men with congenital absence of the vas deferens. Hum Reprod 2001;16:529-533.
- ↑ Schiff JD, Palermo GD, Veeck LL, Goldstein M, Rosenwaks Z, Schlegel PN. Success of testicular sperm extraction [corrected] and intracytoplasmic sperminjection in men with Klinefelter syndrome. J Clin Endocrinol Metab 2005;90:6263-6267.
- ↑ Sigman M, Jarow JP. Male infertility. In Wein AJ, Kavoussi LR, Novick LC, Partin AW, Peters CA (Eds) Campbell-Walsh Urology, 9th edition, 2007, pp. 609-653, Philadelphia, Saunders.
- ↑ Swanton A, Itani A, McVeigh E, Child T. Azoospermia: is sample centrifugation indicated? A national survey of practice and the Oxford experience. Fertil Steril 2007;88:374-378.
- ↑ Raviv G, Mor Y, Levron J, Shefi S, Zilberman D, Ramon J, Madgar I. Role of transrectal ultrasonography in the evaluation of azoospermic men with low volume ejaculate. J Ultrasound Med 2006; 25:825–829.
- ↑ Shefi S, Turek PJ. Definition and current evaluation of subfertile men. Int Braz J Urol 2006;32:385-397.
- ↑ Shefi S, Turek PJ. Sex chromosomes abnormalities and male infertility: a clinical perspective. In De Jonge C, Barratt C (Eds) The sperm cell, 2006, pp. 261-278, Cambridge University Press.
- ↑ Palermo G, Jorish H, Devroy P, Van Steirteghem AC. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet 1992;340:17-18.
- ↑ Schlegel PN: Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999;14:131-135.
- ↑ Tournaye H, Liu J, Nagy PZ, Camus M, Goossens A, Silber S, Van Steirteghem AC, Devroey P. Correlation between testicular histology and outcome after intracytoplasmicsperm injection using testicular spermatozoa. Hum Reprod 1996;11:127-132.
- ↑ . Jarow JP. Male infertility best practices policies. American Urological Association annual Meeting, 2009.
- ↑ Harris SE, Sandlow JI. Sperm acquisition in nonobstructive azoospermia: what are the options? Urol Clin N Am 2008;35:235-242.
- ↑ Schlegel PN. Nonobstructive azoospermia: A revolutionary surgical approach and results. Semin Reprod Med 2009;27:165–170.
- ↑ Ishikawa T, Nose R, Yamaguchi K, Chiba K, Fujisawa M. Learning curves of microdissection testicular sperm extraction for nonobstructive azoospermia. Fertil Steril. 2009 May 7. [Epub ahead of print].
- ↑ Kossack N, Meneses J, Shefi S, Nguyen HN, Chavez S, Nicholas C, Gromoll J, Turek PJ, Reijo-Pera RA. Isolation and characterization of pluripotent human spermatogonial stem cell-derived cells. Stem Cells. 2009;27:138-149.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק