אלקטרופורזה של חלבוני דם - Plasma protein electrophoresis
| מדריך בדיקות מעבדה | |
| אלקטרופורזה של חלבוני דם | |
|---|---|
| Plasma protein electrophoresis | |
| מעבדה | כימיה של הדם |
| יחידות מדידה | גרם לד"ל |
| טווח ערכים תקין | סך רמת חלבונים בדם מעל גיל 1 שנה - 6.3-8.0. רמת אלבומין: בגיל 0-15 יום - 3.0-3.9; בגיל 15 יום עד שנה - 2.2-4.8; בגיל שנה עד 16 שנה - 3.6-5.2; מעל גיל 16 שנה - 3.7-5.2. רמת אלפא-1: גלובולין - בגיל פחות משנה - 0.1-0.3; בגיל שנה עד 16 שנה - 0.1-0.4; בגיל מעל 16 שנה - 0.15-0.35. רמת אלפא-2: גלובולין - בגיל 0-15 יום - 0.3-0.6; בגיל 15 יום עד שנה - 0.5-0.9; בגיל שנה עד 16 שנים - 0.5-1.2; מעל גיל 16 שנים - 0.4-0.8. רמת ביתא-גלובולין: בגיל 0-15 יום - 0.4-0.6; בגיל 15 יום עד שנה - 0.5-0.9; בגיל שנה עד 16 שנים - 0.5-1.1; בגיל מעל 16 שנה - 0.5-1.0. רמת גמה-גלובולין: בגיל 0-15 יום - 0.7-1.4; בגיל 15 יום עד שנה - 0.5-1.3; בגיל שנה עד 16 שנה - 0.5-1.7; מעל גיל 16 שנה - 35.0.6-1. באלקטרופורזה של הנסיוב אלבומין מהווה 58-74% מכלל חלבוני הפלזמה, מקטע אלפא-1 מהווה 2.0-3.5% מכלל החלבון, אלפא-2 מהווה 5.4-10.6%, מקטע ביתא מהווה 7.0-14.0% וגמה גלובולין מהווה 8.0-18.0% מכלל החלבון. בנוזל שדרה (CSF)- % המקטעים השונים ביחס לסך החלבון ב-CSF: prealbumin מהווה-2-7%; אלבומין-56-76%; אלפא-1 גלובולין-2-7%; אלפא-2 גלובולין-4-12%; ביתא גלובולין-8-18%; גמה-גלובולין-3-12%. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
אלקטרופורזה של חלבונים תידרש במצבים הבאים:, שקיעת דם מוגברת, פרוטאינוריה גבוהה בדם בבני 40 שנה ומעלה (בעיקר באלה עם רמה מוגברת של גלובולינים ביחס לאלבומין), חסר באימונוגלובולין, דלקות חוזרות. בדיקת אלקטרופורזה של חלבוני דם תידרש כאשר התסמינים מחשידים למפגעים של תאי פלזמה כגון מיאלומה נפוצה, מאקרו-גלובולינמיה ע"ש Waldenstrom או עמילואידוזיס ראשונית, כגון אנמיה בלתי מוסברת, חולשה, עייפות, כאבי גב, כאבי עצמות בלתי מוסברים, הופעת שברי עצם פתולוגיים או שלא מתאונה או מוקדי הרס עצמות (bone lytic lesions), נורופתיה היקפית בלתי מוסברת שאינה קשורה לסוכרת, חשיפה לרעלן או לכימותרפיה, היפרקלצמיה משנית לאפשרות של ממאירות (שיכולה להיות כרוכה באיבוד משקל, עייפות, כאב עצמות או דימומים לא רגילים), הופעת חלבון Bence-Jones בשתן, היפר-גאמא-גלובולינמיה, הופעת גלילי Rouleaux של אריתרוציטים במשטחי דם, אי-ספיקת כליות בלתי מוסברת מלווה בעליה ברמת חלבון בדם.
בסיס פיזיולוגי
אלקטרופורזה היא שיטה להפרדת חלבונים על מצע קשיח, תוך התבססות על תכונות ביו-פיסיקאליות שונות הן בגודלם של החלבונים, במבנה התלת ממדי שלהם אך בעיקר במטען החשמלי הכולל שלהם. לאחר ההפרדה בין החלבונים על פני מצע ההרצה, ניתן לאתר או לאפיין אותם או על ידי צביעות עם ריאגנטים ויטאליים, או על ידי שימוש במגיב אימונולוגי, בטכנולוגיה של אימונו-פלואורסצנציה או אימונו-פיקסציה.
לאחר נטילת הדם והפרדת הנסיוב מתבצעת האלקטרופורזה על ידי הרצת הדגימה על פני מצע של agarose או של צלולוז אצטאט בשדה חשמלי, בדרך כלל בבופר טריס-ברביטאל pH8.6, או דומה לו. בסביבה הבסיסית של בופר ההרצה נטענים חלבוני הפלזמה השונים מטען שלילי בהתאם לנקודה האיזואלקטרית שלהם. לכן חלבון כאלבומין עם pI של 4.9 ייטען שלילית יחסית באופן ניכר יותר, ולכן תנועתו בשדה החשמלי לכיוון האנודה (הקוטב החיובי) תהיה מהירה יותר מאשר אימונוגלובולינים לדוגמה שנעים אך מעט ונשארים בסמוך לקטודה (הטעונה שלילית). לאחר השלמת ההרצה האלקטרופורטית וקיבוע (fixation) של מצע ההרצה, מתבצעת צביעת החלבונים על ידי השריית המצע בתמיסות צבע, בנוכחות צבעים בעלי זיקה גבוהה לחלבונים כגון amido bleak, וכן Coomassie blue או Ponceau S. לאחר הצביעה תהליך של de-staining בדרך כלל עם תמיסת חומצה אצטית כדי להרחיק את צביעת הרקע, ניתן לבצע כימות ומדידת עוצמת הצביעה של המקטעים השונים על ידי דנסיטומטריה. בשנים האחרונות יש נטייה לעבור לפרוצדורה בעזרת capillary zone electrophoresis, בה ניתן להריץ באופן אינדיבידואלי כל דגימת דם בנפרד, באופן שמשך ההרצה כולו אינו עולה על 90 שניות בהשוואה ל-20 דקות בהליך המקובל, ואין בו צורך בקיבוע מצע ההרצה, בצביעתו או בתהליך de-staining, כאשר הזיהוי הדנסיטומטרי של שיאי החלבונים מתבצע בזמן אמת מהלך ההרצה על ידי חיישן המזהה חלבונים על פי הבליעה האופטית שלהם באורך גל 210 ננומטר.
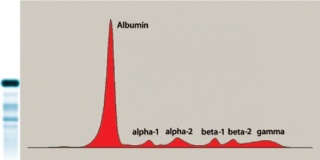
באלקטרופורזה אופיינית של נסיוב מתקבלים 5 מקטעי צביעה עיקריים כאשר המקטע הבולט ביותר הוא זה של החלבון אלבומין הנע סמוך לאנודה, כאשר כל שאר מקטעי החלבונים הנצבעים מוגדרים כגלובולינים. אלבומין כשלעצמו הוא החלבון העיקרי בין חלבוני הדם ומהווה כ-60% מכלל מסת החלבונים בפלזמה. מקטעי הגלובולינים מתחלקים ל: alpha-2 ,alpha-1 כאשר מקטע beta המתחלק אף הוא ל-beta-1 ו-beta-2, ו-gamma globulin, המקטע הסמוך ביותר לקוטב השלילי-הקטודה.
Prealbumin: חלבון זה הוא החלבון המהיר ביותר בין חלבוני הפלזמה לכיוון האנודה והוא יכול לעתים בודדות להיראות לפני השיא הבולט של אלבומין. Prealbumin זוהה למעשה כ-transthyretin או TTR שהוא החלבון הקושר את ההורמון תירוקסין (T4) וכן retinol. בדרך כלל רמת prealbumin בדגימות פלזמה נמוכה מסף הגילוי שלו בצביעות הרגילות באלקטרופורזה, אך ניתן לגלות חלבון זה בנוזל השדרה (CSF) לאחר ריכוזו או בעזרת צביעה בצבעי כסף.
החלבון אלבומין מיוצר בכבד בתנאים פיזיולוגיים נורמאליים, והוא מופיע בהרצה טיפוסית כשיא גבוה הנצבע חזק, אם כי לעתים נדירות ביותר הוא עשוי להופיע כשיא מפוצל לשני שיאים זהים בעוצמתם מצב הידוע כ-bisalbuminemia, בו מיוצרים שני תת-מקטעים של אלבומין כתוצרים של שני גנים שונים. מצבים פתולוגיים שכיחים הכרוכים בירידה ברמת אלבומין בפלזמה הם תזונה לקויה, פגיעה בתפקוד הכבד המסנתז אלבומין כגון צמקת הכבד (צירוזיס), תסמונת נפרוטית, כיחשון (cachexia), מפגעי מעי הגורמים לספיגה לקויה של חלבון (protein-losing enteropathy) וכן כוויות קשות. גם טיפולים הורמונאליים שונים או הריון יכולים להפחית רמת אלבומין בפלזמה, וכן הדבקות כרוניות בפתוגנים שונים ושטפי-דם. מנגד, תרחישים של התייבשות ואובדן נוזלים, מביאים להעלאת רמת אלבומין בפלזמה ולהופעת שיא בולט יוותר במצג האלקטרופורטי.
ישנם מספר וריאנטים של אלבומין שמתבטאים בצביעה רחבה ודיפוזית יותר של החלבון, אך אין כל היבט פתולוגי ידוע להופעת וריאנטים אלה. לעתים מתקבל מקטע אלבומין שנע מעט מהר יותר מהמקובל, וזה יכול להופיע כאשר לאלבומין נקשרים בילירובין בכמות חריגה, כמו גם חומצות שומן חופשיות, פניצילין ואספירין. לעתים גם אלבומין ינוע מהר יותר בשדה האלקטרופורטי כתוצאה בביקוע עודף של החלבון על ידי האנזים הפרוטאוליטי טריפסין במצבים של פנקראטיטיס חריפה.
השטח שבין אלבומין לשיא של alpha-1 מכונה albumin-alpha-1-interzone. צביעה מוגברת של אזור זה יכולה להתקבל על ידי רמה מוגברת של alpha-1 lipoprotein, במחלה אלכוהולית של הכבד, בהיריון או לעתים בשנות ההתבגרות המינית. שיא חד העלול להופיע באזור זה יימצא לעתים במקרים של קרצינומה של הכבד כתוצעה מרמה מוגברת של alpha-fetoprotein.
מקטעי אלפא
תחום אלפא מכיל את שני מקטעי אלפא, אלפא-1 ו-אלפא-2. מקטע אלפא-1 מכיל בעיקר את החלבונים alpha-1 antitrypsin, transcortin, וכן alpha-1-acid glycoprotein ו-thyroid binding globulin. יש לציין שהחלבון alpha-1-acid glycoprotein נקשר ונצבע חלש מאוד על ידי צבעים מקובלים לצביעת חלבונים ולכן קשה לזהותו באלקטרופורזה. תחום אלפא-2 מכיל בעיקר את החלבונים צרולופלזמין, alpha-2 macroglobulin, אפוליפופרוטאין Bו-haptoglobin. מקטעי אלפא-1 וכן אלפא-2 מייצגים את חלבוני הפאזה החריפה (acute phase proteins העולים ברמתם במצבי ממאירות, הדבקות, דלקת או טראומות שונות).
מקטע אלפא-1 מוגבר במצבי דלקת ובהיריון שכן החלבון אלפא-1-אנטי-טריפסין נחשב acute phase protein קלאסי, אך מקטע זה נמצא מופחת בחסר מולד של החלבון alpha-1-anti trypsin הקשור לתרחיש של נפחת הריאות (אמפיזמה). גם החלבון orosomucoid נע בצמוד ל-alpha-1-anti-trypsin, אך orosomucoid נצבע הרבה יותר חלש, באופן ש-alpha-1-anti-trypsin הוא החלבון הדומיננטי במקטע של אלפא-1. כיון שהחלבון אלפא-1-אנטיטריפסין מכיל שייר בודד של חומצת האמינו ציסטאין, ומכאן שיש לו שייר סולפהידרילי (SH-) בודד שאינו יכול ליצור קשרים די-סולפידיים בתוך חלבון זה, יכולים חלבונים שונים, פפטידים כמו גלוטתיון וכן ציסטאין או הומוציסטאין להיקשר לחלבון זה ולשנות במקצת את ניידותו האלקטרופורטית. יש דיווחים על כל שגם חלבון Bence-Jones יכול להיספח לאלפא-1-אנטי-טריפסין ולהאט את מהירות נדידתו בשה האלקטרופורטי. מקטע אלפא-1 מוגבר במצבים ממאירים ובמחלות כבד.
מקטע אלפא-1 יכול להיות מופחת גם בתסמונת נפרוטית שכן החלבון אלפא-1-אנטי-טריפסין הוא בעל משקל מולקולארי נמוך יחסית של 54 אלף דלטון, ובהתאם יכול להיות מופרש בשתן בכמות גדולה מהרגיל. מקטע אלפא-1 מופחת במחלת Tangier עם חסר תורשתי של אלפא-1-ליפופרוטאין.
התחום שבין אלפא-1 לאלפא-2 הידוע כ- Alpha-1 - Alpha-2 Interzone: שני פסים חלשים היכולים להופיע באלקטרופורזה מייצגים את החלבונים alpha-1 antichymotrypsin ואת החלבון הקושר ויטמין D. במצבי דלקת תיתכן צביעה מוגברת של תחום ביניים שכן alpha-1 antichymotrypsin נחשב acute phase protein.
מקטע אלפא-2: מקטע אלפא-2 מורכב בעיקר מצרולופלזמין, alpha-2-macroglobulin, אפוליפופרוטאין B ומ-haptoglobin. הגברה יחסית במקטע זה תופיע בתסמונת נפרוטית שכן המקטע זה מתרכזים חלבונים בעלי משקל מולקולארי יחסית גבוה שאינם יכולים להסתנן בפקעיות הכליה גם בתסמונת זו. הגברת מקטע אלפא-2 תימצא במצבי דלקת שכן haptoglobin נחשב למגיב acute phase, בשימוש בגלולות נגד הריון, בשימוש באדרנוקורטיקו-סטרואידים, בתת-פעילות של יותרת הכליה וביתר פעילות של בלוטת התריס. ירידה בצביעה של אלפא-2 תופיע במחלות כבד, ובאנמיה המוליטית או המוליזה על רקע כלשהו בגלל ירידה זמנית ברמת החלבון haptoglobin הקושר המוגלובין ומתפנה איתו מהדם למערכת הרטיקולו-אנדותליאלית. מקטע אלפא-2 תקין ומקטע אלפא-1 מוגבר, הם מתווה אופייני למחלה גרורתית של הכבד ולצמקת הכבד.
החלבון אלפא-2-מאקרוגלובולין יכול להיות מוגבר בילדים וכן בקשישים, והוא מופיע כחזית חדה של הפס המייצג את מקטע אלפא-2. חלבון זה יכול לעלות יחסית לחלבנים אחרים פי-10 למעלה בתסמונת נפרוטית בגלל גודלו יוצא הדופן (מעל 700 אלף משקל מולקולארי) שמונע ממנו מעבר דרך פקעיות הכליה לשתן, בה בשעה שחלבונים קטנים אכן אובדים מהדם בדרך זו. אלפא-2-מאקרוגלובולין עולה ברמתו בדם כבר בשלבים המוקדמים של נפרופתיה סוכרתית. מקטע אלפא-2 מופחת במצבי תת-תזונה, באנמיה מגלובלסטית, במחלת כבד קשה, במחלת וילסון, וב-Protein-losing enteropathies. מקטע אלפא-2 מוגבר במצבי דלקת כרוניים, המצבי ממאירות ובשלבי התאוששות מכוויות חמורות.
התחום שבין אלפא-2 וביתא גלובולין הידוע כ-Alpha-2 - Beta Interzone: קריוגלובולינים שאינם מסיסים בקור יוצרים פס בתחום זה שאינו נראה בפלזמה כיון שהוא שוקע על ידי הפארין המופיע במבחנה כנוגד קרישה. רמת הצביעה של תחום זה נמוכה במצבי דלקת וגבוהה בהיריון. הפס של חלבון ביתא-ליפופרוטאין מופיע בתחום זה באופן מעט משונן (crenated), וניתן למצוא רמות גבוהות של β lipoprotein בתסמונת נפרוטית, ב- type II hypercholesterolaemia וב-hypertriglyceridemia.
מקטע ביתא
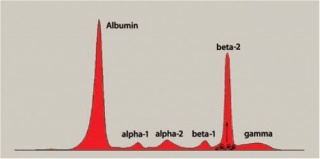
מקטע ביתא שנראה אמנם גראפית כמורכב מפס אחד, מתחלק למעשה לשני תת-שיאים (בעיקר בנסיוב טרי) המוגדרים כביתא-1 וביתא-2. תת-מקטע ביתא-1 מכיל בעיקר את החלבונים טרנספרין, hemopexin , אנטי-תרומבין-III, מרכיבי המשלים, ולעתים גם אימונוגלובולינים. ואילו תת המקטע ביתא-2 מכיל בעיקר ביתא-ליפופרוטאין. במקטע ביתא יכולים להופיע גם אימונוגלובלינים דוגמת IgA, IgM ו-IgG. בהתאם נמצא מקטע ביתא מוגבר במצב של אנמיה על רקע חסר ברזל בה מוגברת רמת טרנספרין, וכן בשליש ההיריון השלישי , או בטיפול באסטרוגנים. מקטע ביתא מוגבר בצמקת מרתית, לעתים בקרצינומה, במחלת Cushing, בחלק מהמקרים של סוכרת, בתת-פעילות של בלוטת התריס, ביתר לחץ-דם ממאיר, בנפרוזיס, בצהבת חסימתית וב-polyarteritis nodosa. הגברה בתת-מקטע ביתא-2 תתרחש עקב עליה ב-LDL בהיפר-כולסטרולמיה. רמות מופחתות של מקטע ביתא נמצא במצבי תת-תזונה או ב-hypo-beta-lipoproteinemia. מקטע ביתא מוגבר בתרחיש של היפר-ליפופרואינמיה ראשונית או שניונית (בעיקר type 2). מקטע ביתא נמצא מופחת בהיפו-ביתא-ליפופרוטאינמיה, ובאלה עם חסר IgA.
באזור ביתא-2 ניתן לזהות לעתים גם פרקציה C3 של חלבוני משלים (complement), וזו מוגברת בדרך כלל בתגובת acute phase. דיכוי של פרקציה C3 מתרחש במפגעים אוטואימוניים כאשר מערכת המשלים עוברת שפעול ופרקציה C3 נקשרת על ידי הקומפלקסים החיסוניים שנוצרים ומורחקת מהפלזמה. פיברינוגן, אף הוא חלבון השייך למקטע ביתא-2 נמצא בפלזמה תקינה אך נעדר מהנסיוב. לעתים, דם הנלקח ממטופלים המטופלים בהפארין, אינו נקרש באופן מלא וניתן למצוא פיברינוגן בצורת פס הנודד לעמדה בין ביתא וגמה-גלובולינים. בדגימות נסיוב השוהות מעל 3 ימים עד בדיקתן המקטע של ביתא-2 אינו ניתן לזיהוי.
התחום שבין ביתא לגמה הידוע כ-beta-gamma-interzone: החלבון CRP מופיע בתחום שבין ביתא וגמה גלובולין, מה שגורם לשני מקטעים אלה להיראות מחוברים beta/gamma fusion. גם אימונוגלובולין A נא יחסית יותר מהר מאימונוגלובולינים אחרים לכיוון האנודה לכן מיקומו בדרך כלל באיזור ביתא/גמה, ומצג אלקטרופורטי זה מופיע גם בצמקת הכבד, בהדבקות של דרכי הנשימה, במחלות עור, או בדלקת מפרקים שגרונית, בהם יש עלייה ברמת IgA.
מקטע גמה
חמשת האימונוגלובולינים (IgA, IgM, IgE, IgG ו-IgD) הם החלבונים היחידים המופיעים לאחר אלקטרופורזה במקטע גמה תקין, אם כי ייתכן שאימונוגלובולינים אלה בחלקם יכולים אף להופיע במקטעי אלפא וביתא. אם נרשמת עליה בצביעה של מקטע גמה, השלב הראשון בפענוח ממצא זה לבחון אם מדובר בצביעה רחבה המאפיינת גמופתיה רב-שבטית, או שמא מדובר בשיא חד וברור (spike) המבטא בדרך כלל גמופתיה חד-שבטית. בתסמינים של agammaglobulinemia או hypogammaglobulinemia כגון מצבי חסר של IgA, צפויה צביעת חסר חלשה של מקטע גמה. היפוגמהגלובולינמיה יותר שכיחה בקרב תינוקות, אך יכולה להופיע גם במטופלים עם X-linked agammaglobulinemia. חסר ב-IgA מתרחש ב-1 מתוך 500 אנשים באוכלוסיה.
גמופתיה רב-שבטית (פוליקולנאלית)
הדבקות בקטריאליות או נגיפיות ומצבי דלקת, ממאירויות אחדות ומספר תהליכים פעילים בגוף כגון מחלות כבד ומחלה אוטואימונית, יכולים להתבטא בהופעת שיא רחב באזור גמה: מתווה זה מצביע על הגברה רב שבטית של אימונוגלובולינים, ולהלן מפגעים המתבטאים בגמופתיה זו:
- מחלת כבד כגון צמקת הכבד, מחלת כבד אלכוהולית, והפאטיטיס נגיפית או אוטואימונית, צמקת מרתית ראשונית, primary sclerosing cholangitis.
- מחלות רקמת חיבור כגון rheumatoid arthritis ,SLE, סקלרודרמה, תסמונת Sjögren, סרקואידוזיס, temporal arteritis.
- תרחישי הדבקות בקטריאליות כגון אוסטיאו-מיאליטיס, אנדוקרדיטיס, שחפת, ובקטרמיה. מפגעים נגיפיים כגון HIV/AIDS, הפאטיטיס C, נגיף אפשטיין-באר, varicella.
- מפגעים או ממאירויות המאטולוגיות: לאוקמיה, לימפומה non Hodgkin ,CLL, תלאסמיה, אנמיה חרמשית.
- ממאירויות לא המאטולוגיות: קרצינומה ממקור ריאה, שחלות, קיבה, כליה וכבד.מפגעים דלקתיים שונים: מפגעי מערכת העיכול כולל ulcerative colitis ומחלת קרוהן.
- מפגעים ריאתיים כולל לייפת כיסתית (CF), ברונכיטיס כרונית, bronchiectasis ו-pneumonitis, מחלות אנדוקריניות כולל מחלת Graves ו-Hashimoto’s thyroiditis.
גמופתיה חד-שבטית (מונוקלונאלית)
ממצא ראשוני של גמופתיה חד-שבטית בדרך כלל במקטע גמה (אך לעתים גם במקטעי ביתא ואלפא-2) דורש הערכה נוספת לקבוע את הסיבה לאי-סדירות זו. נבדקים עם MGUS חייבים להיות תחת פיקוח וניטור תקופתי, שכן 1-1.5% מבין אלה עם ממצא MGIS ייפתחו מדי שנה מיאלומה נפוצה או ממאירות אחרת הבאה לביטוי בגמופתיה חד-שבטית.
אם רמת ה-M spike (הידוע גם כ-paraprotein) המתגלה בנסיוב מגיעה ל-1.5-2.5 גרם לדציליטר, חשוב לבצע בדיקה נפלומטרית כדי לקבל נתון כמותי של האימונוגלובולינים, וכן לבצע איסוף שתן של 24 שעות לאלקטרופורזה ואימונופיקסציה. אם ממצאים אחרונים אלה מתקבלים תקינים, יש לחזור על האלקטרופורזה של חלבוני הנסיוב אחת ל-3-6 חודשים: אם הממצא של אלקטרופורזות אלה תקין, יש לחזור על פרוצדורה זו אחת לשנה. בדרך כלל במקרים של MM הופעת ה-spike מופיעה על רקע של היפו-גמהגלובולינמיה.
אם רמת ה-M spike המתקבלת גבוהה מ-2.5 גרם לדציליטר, מומלץ על ידי איגודים רפואיים שונים לבצע הערכה של בדיקת מח העצם (בדרך כלל עצם הירך או הזרוע). בנוסף, מומלץ לבצע מדידת רמות של β2 microglobulin וכן של CRP, כמו גם איסוף שתן של 24 שעות לאלקטרופורזה ואימונופיקסציה. אם יש חשד ל-Waldenström’s macroglobulinemi, מיאלומה נפוצה עמילואידוזיס או לתהליך לימפו-פרוליפרטיבי אחר למרות מצג אלקטרופוזיס נורמאלי, מומלץ על בדיקת אימונופיקסציה, סריקת CT בטנית ושאיבת מח עצם וביופסיה. אלקטרופורזה בלבד של חלבוני דם או שתן, אינה יכולה להיחשב בדיקה בדיקת סקר מספקת לגמופתיות חד-שבטיות. לעתים אלקטרופורזה אינה רגישה דייה לגילוי כמות מזערית של חלבון M חד-שבטי.
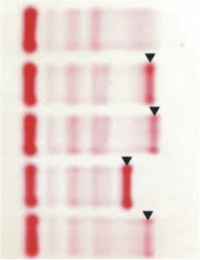
גמופתיה חד-שבטית הידועה גם כ-M spike, מבטאת ייצור חד-שבטי (מונוקלונאלי) של סוג אחד של אימונוגלובולין, מה שעלו לרמז על תהליך ממאיר של שגשוג יתר של תאי פלזמה מסוג מסוים, כאשר מיאלומה נפוצה (MM) היא הסיבה הרווחת ביותר לשיאים חדים (spikes) מסוגי IgG ו-IgA. לעומת זאת, לויקמיה כרונית לימפתית (CLL) בדרך כלל כרוכה יותר עם פרפרוטאינים מסוג IgM, כמו גם Waldenstrom's macroglobulinaemia ,plasma cell leukemia ,solitary plasmacytomas וכן monoclonal gammopathy of undetermined significance או MGUS .יש לציין שעד 8% מהבדיקות בין הנבדקים הגריאטריים בבריאות תקינה תראינה מצג של spike חד שבטי המתפרש כ-MGUS.
מקטע גמה מוגבר יתקבל במפגעים הבאים: עמילואידוזיס, Waldenström’s macroglobulinemia, מיאלומה נפוצה, מיאלומה חבויה, MGUS, צמחלות ראומטואידיות ומחלות קולאגן ברקמות חיבור, לימפומה ממאירה, מחלת הודג'קין, צמקת הכבד, CLL, הדבקות כרוניות (מחלות גרנולומטוזיות), תסמונת POEMS, מחלת Castleman, מחלת שרשראות כבדות, solitary plasmacytoma ו- light chain deposition disease. ירידה במקטע גמה גלובולינים תימצא ב- agammaglobulinemia וב-hypogammaglobulinemia.
רמת חלבון M עשויה לסייע לבצע אבחנה מבדלת בין מיאלומה נפוצה (MM) לבין MGUS. אבחנה פסקנית של מיאלומה נפוצה דורשת מעורבות של 10-15% תאי פלזמה שיתגלו בביופסיה של מח העצם. בחלק מהמאובחנים עם מפגעים של תאי פלזמה, אלקטרופורזה של חלבוני הפלזמה עלולה להתקבל תקינה לחלוטין כיון שהאימונוגלובולין החד-שבטי חסר, או שרמתו נמוכה מדי ומתחת לסף הגילוי על ידי הצביעות הרגילות. אחד המחקרים שבחנו נקודה זו, הראה הופעה של spike חד רק ב-82% מכלל המטופלים עם מיאלומה נפוצה. עקב ממצאים אלה מומלץ לבצע אלקטרופורזה של השתן באופן גורף בכל המטופלים החשודים לחוסר איזון (dyscrasia) של תאי פלזמה.
נושא אחרון זה הוא גודלו של אותו חלבון M המוגדר כ-spike ראוי לתשומת לב. למרות שבדרך כלל במקרים של MM רמת שיא זה היא מעל 3 גרם לדציליטר, בערך 20% ממטופלים אלה הם בעלי חלבון M הקטן בגודלו מ-1 גרם לדציליטר. תרחיש של היפו-גמהגלובולינמיה מופיע בערך ב-10% של מטופלים עם MM שאין מוצאים אצלם spike, שיתגלה רק אם מבצעים בדיקה של immunofixation שהיא רגישה יותר. לעומת זאת ברוב המקרים האחרונים ניתן למצוא רמה גבוהה של חלבון Bence-Jones בשתן, כאשר חלבון זה מבטא שרשראות קלות מסוג קאפה או למבדה חד-שבטיות חופשיות, מה שמבטא את החשיבות האבחונית הקריטית של אלקטרופורזה של השתן במקרים אלה. ראוי לציין שהריכוז המינימאלי של חלבון M חד שבטי שיאפשר גילוי בהליך השגרתי של אלקטרופורזה הוא 0.5 גרם לדציליטר, רמה המייצגת בערך 1 מיליארד של תאי פלזמה מייצרים נוגדנים.
הפרדה אלקטרופורטית של CSF
הפרדה של חלבוני נוזל השדרה באלקטרופורזה על מצע agarose חיונית במיוחד באבחון של טרשת נפוצה, עם זיהוי של פסים אוליגוקלונאליים של IgG, באחוז גבוה של לוקים במפגע נוירולוגי זה (כ-85%). פסים אלה נוצרים על ידי מספר מוגבל של שבטים (clones) של תאי B המצויים במערכת העצבים המרכזית. פסים אוליגוקלונאליים מופיעים גם במטופלים עם נוירו-סיפיליס, SSPE או subacute sclerosing panencephalitis וכן במטופלים בפאזה מתקדמת של rubella panencephalitis. כמדד לטרשת נפוצה יש למדד זה רגישות של 77% וסגוליות של 99%.
השפעת תרופות על חלבוני הפלזמה באלקטרופורזה
רמת אלפא-1 גלובולינים מוגברת על ידי טיפול בטסטוסטרון. רמת אלפא-2 גלובולינים מוגברת על ידי אסטרוגנים, גלולות למניעת הריון ו-phenytoin. רמת אלפא-2 גלובולינים מופחתת על ידי טיפול באנזים asparaginase. רמת ביתא גלובולינים עולה על ידי אסטרוגנים וגלולות למניעת הריון, ופוחתת על ידי טיפול ב-asparaginase.
הוראות לביצוע הבדיקה
נטילת דם במבחנה כימית (פקק אדום או צהוב), שיש לבחון כנסיוב טרי, או לאחר אחסון של עד 72 שעות במקרר. הנסיוב יציב לצורך בדיקה זו עד 6 חודשים בהקפאה במינוס 20 מעלות, או לזמן בלתי מוגבל בהקפאה במינוס 70 מעלות. עדיף לבצע את האלקטרופורזה בדגימות שאינן המוליטיות או ליפמיות. אלקטרופורזה של דגימות שתן מתבצעות בדגימות שתן חד פעמי או באיסוף 24 שעות. יש להימנע במידת האפשר ביצוע אלקטרופורזה בדגימות נסיוב המוליטיות או כאלה עם משקעים רבים גם לאחר סרכוז, או צמיגות בתוצאה מרמת שומנים גבוהה (chylous). כן מתבצעת אלקטרופורזה בנוזל עמוד שדרה (CSF) בתנאי שהנוזל צלול למראית עין או מכיל כמות זעומה של כדוריות דם אדומות לאחר סרכוז. תנאי האחסון של דגימות CSF זהות לאלה של הנסיוב.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק