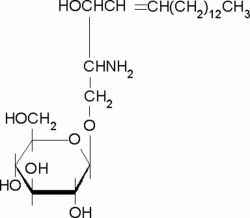
גלוקו-פסיכוזין - Glucopsychosine
| מדריך בדיקות מעבדה | |
| גלוקו-פסיכוזין | |
|---|---|
| Glucopsychosine | |
| שמות אחרים | glycosylsphingosine |
| |
משקל מולקולרי: g/mol461.63; נוסחה: C24H47NO7
| |
| מעבדה | כימיה בדם מיובש |
| תחום | אבחון וניטור מחלת גושה |
| טווח ערכים תקין | פחות מ- nmol/ml 0.04 |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
בדיקת קו-שני בבדיקות סקר-יילודים כאשר מזוהה חסר באנזים β-glucosidase ; אבחון וניטור של ילדים עם מחלת גושה; אישוש האבחון של מחלת גושה שכן גלוקופסיכוזין מוגבר אופייני למחלה זו; ניטור יעילות הטיפול בחולי גושה.
מאפייני מחלת גושה
ערך מורחב – מחלת גושה - Gaucher's disease
האנזים β-glucosidase מסייע לביקוע של glucosylceramide (או glucocerebroside) וכן של glucopsychosine (או glucosylsphingosine). מחלת גושה נגרמת על ידי מוטציות בגן GBA, וידועים קרוב ל-300 מוטציות העלולות לפגוע בפעילות האנזים. המוטציות השכיחות ביותר בישראל הן: N370S, 84GG, IVS2+1, D409H, L444P ו-V394L. במחלת גושה, פגיעה באנזים ה-Glucocerebrosidase גורמת לאגירת Glucocerebroside, הנאגר בעיקר ב-Macrophages, המכונים Gaucher cells, הנאגרים בכבד, בטחול, במח העצם ואף בריאות. לכן, סובלים חולי גושה מתסמינים כגון הגדלת כבד והטחול, אנמיה, תרומבוציטופניה, כאבי עצמות, Osteoporosis, פגיעה קשה במפרק הירך וקריסת חוליות עמוד השדרה. נראה ש-glucosylceramide מתפרק ל-glucosylsphingosine, שרמתו גבוהה במיוחד בפלזמה של חולי גושה. חומר זה פוגע בפעילותם של תאים שונים. על אף שהמנגנון טרם פוענח, נראה כי glucoceramide שלא פורק הופך לחומר בשם glucosylsphingosine (Lyso-GL-1), שרמתו גבוהה במיוחד בפלזמה של חולי גושה. חומר זה גורם לירידה בפעילותם של תאים שונים. עדות לרעילות של הליפידים הנאגרים בפלזמה של החולים ניתן למצוא במחלת גושה בה מעורבת מערכת העצבים (סוגים 2 ו-3), במסגרתה נראה כי ההשפעה על המוח נובעת מהשפעתם הרעילה של ליפידים ביו-פעילים.
קיימים שלושה סוגים של המחלה עם התבטאות קלינית שונה, כמו גם שוני בגיל בו מופיעים תסמיני המחלה, החל במפגע קטלני בתקופת סב-הלידה, עד לסוג מחלה א-תסמיני. המחלה נגרמת על ידי הצטברות ליזוזומלית של glucosylceramide בתאים שונים אך בעיקר במקרופאגים (Orvisky וחב' ב- Mol Genet Metab ב-2002).
כל שלושת סוגי Gaucher מתאפיינים בכבד ובטחול מוגדלים, ובאי-סדירות המטולוגית.
מחלת גושה סוג 1
מחלת גושה type 1 היא בעלת שכיחות של 1:40,000 עד 1:70,000 באוכלוסיות השונות, אך נפוצה הרבה יותר בקרב יהודים ממוצא אשכנזי, עם שכיחות של 1:900. סוג 1 של המחלה הוא השכיח ביותר, ומהווה למעלה מ-90% מכלל המקרים של Gaucher. סוג זה מאופיין באופן כללי כמחלת עצם, כבד וטחול מוגדלים, אנמיה, ותרומבוציטופניה, בעיות קרישה, מחלת ריאות, אך ללא מעורבות של מערכת העצבים המרכזית. יש ווריאביליות גדולה במשך ההישרדות, ואלה עם type 1 יכולים לחיות מ-6–80 שנה.
מחלה סוג 1 היא בעלת ביטוי רבגוני, במסגרתה תיתכן שונות בעוצמת הופעת התסמינים בין אחים הנושאים את אותן מוטציות ואף בין תאומים זהים. חולים תסמיניים מוגדרים ככאלה בהופעת אחד או יותר מהתסמינים הבאים: הגדלה של כבד ו/או טחול, אנמיה, ירידה ברמת הטסיות, ירידה בצפיפות עצם, osteopenia או osteoporosis, הסננה של מח העצם ב"תאי Gaucher", עיוותי עצם, שברים, תמט מפרקים (בעיקר מפרק הירך), עיכוב בהתפתחות המינית, הפלות או דמם בזמן מחזור ועייפות, הנפוצה מאוד בקרב חולי גושה. בחולים לאחר כריתת טחול תיראה הסננה חמורה יותר של מח העצם ב"תאי Gaucher" ועל כן תחמיר מחלת העצם. גם בחולים הנחשבים לכאורה א-תסמיניים, ניתן למצוא חלק מהתסמינים לעיל בדרגת חומרה קלה. מחלת גושה יכולה להתבטא בגילים שונים, בעוצמות שונות ובאיברים שונים. הביטוי הדומיננטי (Dominant) עשוי להיות מחלת עצם או מחלה המטולוגית.
מחלת גושה מסוג 2
מחלה זו הידועה כ-acute neuropathic, התסמינים האופייניים כוללים ניוון מהיר של חלקו הקדמי של גזע המוח, פיגור פסיכומוטורי בולט, התקפים הכוללים רעידות ופרכוסים, לצד פזילה או חוסר תיאום של העיניים, שעלולים לגרום לירידה בחדות ראייה. המחלה מתאפיינת הן בסימנים בולבריים הכוללים התקפי חנק, דום נשימה וקושי בבליעה והן בסימנים פירמידליים הכוללים Opisthotonus (הקשתת הגב), retroflexion, ונעילת לסתות (Trismus). הגדלה של כבד וטחול ולעיתים גם אנמיה וירידה ברמת הטסיות, נפוצים גם הם. עם זאת, חולים אלה לא סובלים ממחלת העצם האופיינית לגושה מסוג 1 או 3. כבד וטחול מוגדלים ומחלת ריאות, הגורמים למוות בתחום הגילים של 2–4 שנים. שכיחותה באוכלוסייה הכללית כ-1 ל-120,000.
מחלת גושה מסוג 3
בחולים אלה ניכרת מחלה של האיברים הפנימיים (הגדלת כבד ו/או טחול) הדומה לזו המופיעה בחולים מסוג 1 (כולל מחלת עצם), ואכן הם לעיתים מאובחנים כסובלים מסוג 1, כאשר ההתבטאות העצבית מופיעה רק בהמשך חייהם. התסמינים העצביים עשויים לכלול שיתוק של עצב הראייה, ניסטגמוס, התקפי עוויתות ואפילפסיה מוקלונית מתקדמת, שיטיון ו-Ataxia נצפו בשלבים מאוחרים יותר. סוג זה מתאפיין בהסתיידות מסתם אבי העורקים והמסתם הדו-צניפי, בהגדלת טחול, בעכירות קרנית וב-supranuclear ophthalmoplegia. שכיחותה באוכלוסייה היא 1 ל-120,000 בדומה לסוג 2. מחלת גושה type 3 באה לביטוי מתחת גיל שנתיים, אך קצב התקדמותה אטי יותר והיא ידועה כ-chronic neuropathic, והלוקים בסוג זה יכולים לשרוד עד לעשור השלישי או הרביעי לחייהם. מחלת גושה type 2 מהווה כ-1% מכלל מקרי המחלה, והמחלה type 3 המאופיינת על ידי המוטציה D409H, מהווה כ-5% מכלל מקרי המחלה, ואלה המאובחנים עם type 3 יכולים לשרוד 2–60 שנה. type 3- של Gaucher אובחן במספר מקרים בקרב האוכלוסייה הערבית בישראל.
קיימים סוגים נוספים נדירים ביותר של המחלה הכוללים צורה סב-לידתית קטלנית הכרוכה באנומליות של העור ובהידרופס פטאליס לא אימוני, שהיא בצקת כללית של העובר עם הצטברות נוזלים בבית החזה, בבטן, בעור ובשליה. כאשר ב-75% מהמקרים, היא מופיעה במנגנון לא אימוני. צורה נדירה נוספת מאופיינת על ידי הסתיידות של המסתמים האורטלי והמיטראלי, טחול מוגדל באופן מתון, עכירות של הקרנית והפרעה במבט.
המתאם בין רמות glucosylsphingosine בפלזמה ופרמטרים של מחלה
רמות glucosylsphingosine בחולים לא מטופלים עם מחלת type 1 Gaucher הושוו עם חומרת המחלה, אך לא נמצא מתאם משמעותי (ρ = 0.23; P = 0.13). נמצא מתאם משמעותי בין רמות glucosylsphingosine לבין נפח הכבד (ρ = 0.57; P < 0.0001) . כמו כן לא נמצא מתאם עם סיבוכי שלד, אך מתאם משמעותי נמצא ביחס לפרקציית השומן של מח העצם (ρ = −0.43; P = 0.01) . הועלתה השערה ש- glucosylsphingosine משפיע באופן שלילי על אוסטאובלסטים, באופן שרמות גבוהות של glucosylsphingosine יכולות לתרום לאופי ה-osteopenic של העצם בחולי גושה. לכן בוצעה בפלזמה של חולי גושה השוואה בין הרמות הללו לבין 2 סמנים ספציפיים של יצירת עצם, osteocalcin ו-P1NP. מתאם שלילי נמצא בין glucosylsphingosine לבין osteocalcin (ρ = −0.22; P = 0.30). מגמה שלילית דומה, אם כי עם משמעות סטטיסטית נמוכה, נמצאה בין glucosylsphingosine בפלזמה לבין P1NP (ρ = −0.21; P = 0.33) . חולי גושה עם רמות גבוהות יותר של osteocalcin ו-P1NP, או עם רמות קרובות לתחום הנורמלי, נוטים להראות רמות plasma glucosylsphingosine נמוכות יחסית בפלזמה.
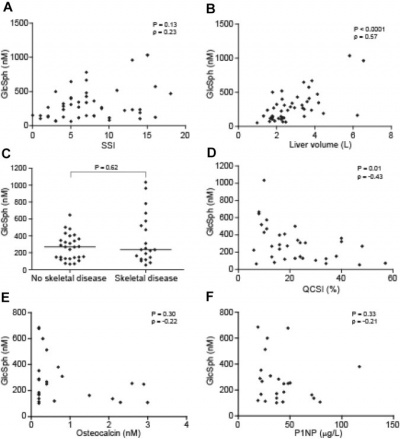
(B) glucosylsphingosine בפלזמה ונפח הכבד (n=45);
(C) glucosylsphingosine בפלזמה ומחלת שלד (n=48);
(D) glucosylsphingosine בפלזמה ופרקציית שומן במח העצם (n=34);
(E) glucosylsphingosine בפלזמה ורמת osteocalcin (n=24);
(F) glucosylsphingosine בפלזמה ורמת PINP (n=24).
מנגנוני נזק של glucosylsphingosine מוגבר
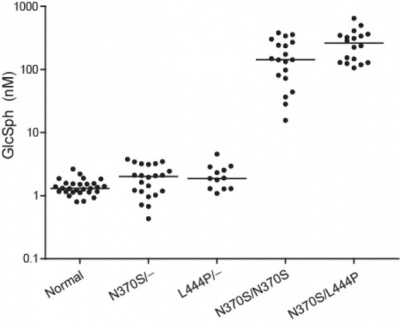
ממצא בולט הוא שרמת glucosylsphingosine בפלזמה קשורה לחסר האנזים glucocerebrosidase . נתון זה משתקף גם בממצא שהומוזיגוטים למוטציה N370S, מראים מהלך מחלה מתון יותר בהשוואה לאלה שהם compound heterozygotes ל-N370S ול-L444P (Eitan וחב' ב-Prenat Diagn משנת 2010). אכן במוטציה N370S, האנזים glucocerebrosidase הוא בעל פעילות שארית (Ohashi וחב' ב-J Biol Chem משנת 1991), בעוד שהמוטציה L444P באנזים זה גורמת לו להתקפל בצורה לא-נכונה, ולכן הוא מושמד על ידי פרוטאזומים במערכת ה-ubiquitin (Bendikov-Bar וחב' ב-Blood Cells Mol Dis משנת 2011). האנזים glucosylceramide synthase מקטלז לא רק את הביוסינתזה של glucosylceramide מ-ceramide ומ-UDP-glucose, אלא גם את הסינתזה של glucosylsphingosine (Cortino ו-Caputto ב-Lipids משנת 1972). רוב ה- glucosylsphingosine נוצר מריאקציית deacylation של ה- glucosylceramide המצטבר, כפי שהוצע על ידי Yamaguchi וחב' ב-J Biochem משנת 1994.
הנזק הטוקסי של הצטברות glucosylsphingosine
Glucosylsphingosine דווח כגורם להידרוליזה של תאי דם אדומים בריכוזים נמוכים (Taketomy וחב' ב-Bichim Biophys Acta משנת 1976, וכן כמעכב של האנזים החיוני להעברת אותות החיוניים להתנהגות התא protein kinase, (Hannun ו-Bell ב-Science משנת 1989). בנוסף הודגם ש- glucosylsphingosine גורם נזק לנוירונים כולינרגיים. עיכוב של protein kinase C על ידי psychosine נראה פוגע בתפקוד הנורמלי של אוליגודנדרוציטים ושל תאי Schwann. בנוסף, psychosine מפחית את פעילות kinase המשופעלת על ידי AMP, מה שגורם לאיבוד אנרגיה תאית. בנוסף, psychosine משפעל את phospholipase A2, ובכך מגביר את יצירת lysophosphatidylcholine, את השחרור של חומצה ארכידונית ומעכב את פעילות CTP:phosphocholine cytidylyl-transferase, ובכך מפחית סינתזת phosphatidylcholine, שהוא מרכיב עיקרי בממברנת התא.
מחקרים מצאו עלייה מסיבית של glucosylsphingosine במוח של מטופלים עם type 2 ו-type 3 של המחלה, לעומת עלייה פחותה של חומר זה במוח של חולי type 1 (על פי Raghavan וחב' ב-Biochem Biophys Res Commune משנת 1973, ו-Nilsson ו-Svennerholm ב-J Neurochem משנת 1982). במהלך השנים הוצע שרמה מוגברת של glucosylsphingosine כרוכה במספר תסמינים קליניים (Schueler וחב' ב-Neurobiol Dis משנת 2003, ו-Mistry וחב' ב-Proc Natl Acad Sci USA משנת 2010). לדוגמה, מחקרים עם אוסטאובלסטים בתרבית של כברים ששמשו כמחלת מודל של Gaucher type 1 הוליכו להיפותזה ש-glucosylsphingosine יכול לתרום באופן פעיל לצפיפות מופחתת של מינרלים בעצם, בהפריעו לתפקוד הרגיל של אוסטאובלסטים על ידי שינוי ההומאוסטזיס של סידן בתאים אלה (Lloyd-Evans וחב' ב-Biochem J משנת 2003). בנוסף, תפקיד הוצע ל-glucosylsphingosine בתסמינים הנוירולוגיים של מחלת גושה (על פי Sun וחב' ב-Hum Mol Genet משנת 2010, Ballabio ו- Gieselmann ב-Biochim Biophys Acta משנת 2009, ו-Svennerholm וחב' ב-J lipid Res משנת 1980).
מחקרם של Dekker וחב' שהתפרסם ב-Blood משנת 2011, שופך אור על התפקיד המרכזי של glucosylsphingosine במחלת גושה. אבחון המחלה התבצע על ידי הדגמת חסר האנזים וכן בשיטת genotyping בלויקוציטים ובפיברובלסטים. דגימות דם נלקחו מ-50 מטופלים הולנדיים (23 גברים ו-27 נשים) מאובחנים עם Gaucher type 1. רוב המשתתפים היו compound heterozygotes למוטציה N370S, כאשר חמישה משתתפים היו הומוזיגוטים למוטציה זו.
רמות glucosylsphingosine בחולי גושה ובאנשים בריאים
רמות של glucosylsphingosine ושל glucosylceramide נקבעו בדגימות פלזמה של 28 אנשים בריאים ומ-64 חולי גושה type 1 ועוד 14 מטופלים נוספים מקליניקת Gaucher באוניברסיטת Yale. נמצא שרמות glucosylsphingosine בפלזמה של כל חולי גושה type 1 היו מוגברות בממוצע פי למעלה מ-200 לרמה ממוצעת של 230.7nM. בפלזמה של נבדקים בריאים רמת חומר זה נקבעה כ-1.3nM, בממוצע. לשם השוואה, glucosylceramide נמצא מוגבר משמעותית בפלזמה של Gaucher, אך רק פי-3: בפלזמה של Gaucher רמה ממוצעת של 17.9 מיקרומולר לעומת רמה ממוצעת של 5.7 מיקרומולר באנשים בריאים.
המתאם בין רמות glucosylsphingosine לבין סמנים בפלזמה המיוחסים למחלת גושה
זוהו מספר סמנים חלבוניים של מחלת גושה המופיעים בצירקולציה (Aerts וחב' ב-Acta Pediatr משנת 2008). הודגם שהאנזים chitotriosidase (על פי Hollak וחב' ב-J Clin Invest משנת 1994), וכן הכמוקין CCL18 (על פי Boot וחב' ב-Blood משנת 2004), מיוצרים על ידי תאי Gaucher ומופרשים לצירקולציה. שני הסמנים האחרונים מועמדים טובים לסייע באבחון המחלה, כיוון שרמתם בפלזמה עולה באופן בולט ב-type 1 של Gaucher, ורמתם עולה עם התקדמות תסמיני המחלה. משך שנים היה ידוע ש-glucosyceramide מוגבר הן בפלזמה וכן באריתרוציטים במחלת גושה, כמו כן יש עלייה שניונית ברמת גנגליוזידים וגליקוליפידים אחרים בפלזמה של חולי גושה type 1 (על פי Mewikle וחב' ב-Blood Cells Mol Dis משנת 2008, Groener וחב' ב-Biocim Biophys Acta משנת 2008, ו-Ghauharali-van der Vlugt ב-Clin Chim Acta משנת 2008).
האנזים chitotriosidase ו-CCL18, מופרשים מתאי Gaucher (על פי Boven וחב' ב-Am J Clin Pathpl משנת 2004). בחולים עם גנוטיפ Wild-type של chitotrisidase נמצא מתאם משמעותי בין רמות glucosylsphingosine ו-chitotriosidase (p<0.0001; ρ=0.66) . נמצא גם מתאם משמעותי בין רמות glucosylsphingosine ו-CCL18, אם כי ברמת משמעות נמוכה יותר (ρ=0.40; p=0.01).
השפעת הטיפול בחולי גושה על רמות glucosylsphingosine
טיפול אנזימטי עם אנזים רקומביננטי בו מופיע mannose כסוכר קצה, מביא לתגבור של מקרופאגים עם קולטנים המכילים mannose קצה, עם פעילות ליזוזומלית של האנזים glucocerebrosidase. טיפול זה מביא להפחתה מהירה ובולטת של תאי Gaucher ברקמות שונות ובמח העצם. גם רמות chitotriosidase ו-CCL18 פחתו לאחר טיפול זה. בנוסף, אנליזה של משפחה עם מספר אחאים הומוזיגוטיים למוטציה L444P ב-glucocerebrosidase הסובלים מ-Gaucher type 3, שהטיפול בהם החל בגיל מאוד מוקדם. אנליזה של דגימות פלזמה של משפחה זו, העלתה שכבר בגיל מאוד צעיר רמות glucosylshingosine היו כבר גבוהות כאשר הטיפול החל.
גישה אבחונית של מחלת גושה יכולה להדגים את הממצא האופייני של תאי Gaucher בבחינה של מח העצם, גילוי של אנומליות המטולוגיות, וכבד וטחול מוגדלים. האבחון יכול להיות מאושר על ידי פעילות חסרה או מופחתת של האנזים acid β-glucosidase בלויקוציטים או בטיפות דם מיובש, וכן על ידי אנליזה גנטית של הגן GBA. כבדיקת קו-שני ניתן למדוד רמת glucopsychosine המוגבר בנבדקים תסמיניים ומאשש את אבחון המחלה. בדיקה זו אינה מסוגלת לזהות נשאים של מוטציות בגן GBA.
הכנת הדגימות וכימות glucosylsphingosine בשיטת LC-ESI-MS/MS
הסמן האמור עבר מיצוי בשיטת Bligh ו-Dyer ביעילות של 89%. בקצרה, 0.5 מ"ל של תערובת כלורופורם/מתנול הוסף ל-10 מיקרוליטר של פלזמה, והתערובת סורכזה משך 3 דקות במהירות 16,000g להרחיק משקעי חלבון. בהמשך, 100 מיקרוליטר של כלורופורם ו-260 מיקרוליטר של MQ-H2O הוספו לצורך הפרדת פאזות. לאחר ערבול ב-vortex וסרכוז נוסף ב-16,000g הפאזה האורגנית התחתונה נאספה, והפאזה העליונה עברה מיצוי נוסף עם 0.3 מ"ל כלורופורם. הפאזות התחתונות עברו תהליך ייבוש בעזרת זרם חנקן וזאת בטמפרטורה של 37 מעלות. הפרקציות המיובשות הומסו מחדש ב-0.1 מ"ל מתנול, ומתוך תמיסה זו 10 מיקרוליטר עברו אנליזה על ידי LC-ESI-MS/MS, תוך שימוש בעמודת BEH C18.
הוראות לביצוע הבדיקה
הבדיקה מתבצעת על טיפת דם יבשה על נייר פילטר Whatman Protein Saver 903, או על נייר פילטר Ahlstrom 226, או על נייר פילטר Munktell. הדם נלקח במבחנת ספירת דם (EDTA, פקק סגלגל) או במבחנת הפארין (פקק ירוק), ללא סרכוז, ומטפטפים שתי טיפות ב-2 העיגולים על נייר הפילטרים. יש לתת לדם להתייבש למשך 3 שעות כאשר הנייר מונח אופקית. אין לחשוף את הנייר לחום או לקרינת שמש ישירה. אין לערום אחד על גבי השני ניירות פילטר עם דם רטוב. יש לשמור את הנייר במקום יבש. יציבות הדגימות היא כדלקמן: דם מלא בטמפרטורת החדר יציב משך 10 ימים כמו גם דם הנמצא בקירור (שהיא צורת האחסון המועדפת). לעומת זאת דם קפוא יציב למשך חודשיים. בדיקת רמת גלוקוזילספינגוזין מתבצעת על ידי Liquid Chromatography-Tandem Mass Spectrometry או LC-MS/MS.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות שונות
- בדיקות מעבדה - בדיקות ביוכימיות
- בדיקות מעבדה - מפגעי מערכת העצבים והמוח
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק