המופיליה סוג A - טיפול ב-Hemophilia A - emicizumab
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| המופיליה סוג A - טיפול ב-Emicizumab | ||
|---|---|---|
| ' | ||
| שמות נוספים | שינוי בפרדיגמה הטיפולית בחולי המופיליה מסוג A - אמיסיזומאב (HEMLIBRA) | |
| יוצר הערך | פרופסור גילי קנת | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – המופיליה
מחלת ההמופיליה ("דממת") מסוג A מאופיינת בחסר של גורם קרישה (פקטור 8) בדם החולים ושכיחותה 1:5000 לידות זכר. המחלה מתאפיינת בדימומים חוזרים לשרירים ומפרקים ועלולה לגרום נכות קשה. הטיפול המקובל היה מסוג "תחליפי" (replacement therapy) וחולי ההמופיליה נהגו להזריק לתוך הווריד את תרכיז הקרישה החסר מספר פעמים בשבוע. אצל כשליש מחולי ההמופיליה התפתחו נוגדנים לתרכיז הקרישה, ולפיכך הטיפול בהם (תוך שימוש בתרופות שהן תרכיזי "מעקף") הפך מאתגר וקשה במיוחד.
הבנה מתקדמת של תהליכי הקרישה יחד עם "חשיבה מחוץ לקופסה" העלו מנגנונים חליפיים לשיפור קרישת הדם, שאינם תלויים במתן טיפול לווריד בתרכיזי פקטור 8. לקבוצת טיפול זו שייכות מספר תרופות הנמצאות בהליכי ניסוי מתקדמים. מנגנוני הפעולה של תרופות אלו נשענים על חיקוי של תרכיזי קרישה קיימים או שיפור פעילות פקטורי קרישה אלטרנטיביים מחד, או אפשרות של דיכוי משמעותי בפעילות מעכבים טבעיים של מערכת הקרישה, מאידך. התרופות ניתנות בהזרקה תת-עורית ולפיכך נוחות ביותר לשימוש על ידי החולים (כולל ילדים), ניתן לטפל בהן החל מאחת לשבוע ועד אחת לחודש בלבד - תלוי בסוג התרופה ובמינון המומלץ[1].
פרופ׳ פייר מאנוצ'י, לשעבר מנהל מרכז המופיליה מוביל במילאנו, איטליה, התייחס בציטוט להתפתחויות האחרונות כשטח הטיפול כהמופיליה כ"התקדמות של מעשה ניסים"[2].
אמיסיזומאב - HEMLIBRA
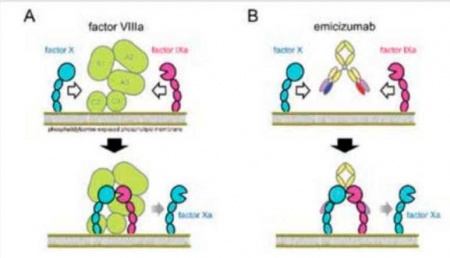
אמיסיזומאב (שם מסחרי: HEMLIBRA) הוא נוגדן לפקסור 9+10 בעל פעילות מימטית (מחקה פעילות) לפקטור 8.
מדובר במולקולה קטנה שהיא נוגדן כפול רגישות עם יכולת להתקשר לפקטור 9 פעיל ולפקטור 10, ובכך היא מחקה את פעילות פקטור 8 במערכת מסלולי קרישת הדם ויכולה לייתר לחלוטין את תפקידו. אמיסיזומאב מוזרק מתחת לעור ופעילותו בדם מוערכת במשך של 4–5 שבועות במתנדבים בריאים[3][4].
יעילותה של אמיסיזומאב כטיפול בחולי המופיליה A עם נוגדנים הודגמה באופן עקבי במחקר פאזה II ובשני מחקרי פאזה III[3][4][5][6][7]. מחקר 1 HAVEN שכלל חולים מבוגרים ומתבגרים[5]; ומחקר 2 HAVEN שכלל ילדים[7]; המפורטים להלן. בשלושת המחקרים השיגה אמיסיזומאב ברוב המטופלים מניעה מוחלטת של דימומים שדרשו טיפול, תוך הפחתה משמעותית ביותר בשיעור הדימומים לאורך זמן בהשוואה לחלופות הקיימות.
התוצאות שהושגו במחקרי אמיסיזומאב בחולים מבוגרים וילדים עם נוגדנים לפקטור קרישה (קבוצת החולים הקשה ביותר לטיפול) מעידות על יעילותה גם במטופלי המופיליה ללא נוגדן לפעילות פקטור 8. ניסויים מתקדמים רב-מרכזיים במטופלים ללא נוגדנים הוצגו בכנסי קרישה בינלאומיים ופורסמו ב-new England journal of medicine [8][9]. תהליך הרישום בישראל מתקדם במקביל למועמדות התכשיר להכללה בסל שירותי הבריאות לשנת 2019.
מעקב ארוך טווח אחרי קבוצת החולים שטופלו במחקר הראשון שפורסם הראה שימור של היעילות והבטיחות בטיפול לאורך זמן[6].
- להלן פירוט הניסויים הקליניים עם אמיסיזומאב שפורסמו והוצגו
מחקר פאזה III במבוגרים ומתבגרים (מעל גיל 12 שנים) חולי המופיליה A עם נוגדנים (HAVEN1)
מרובד במחקר פאזה III גלובלי, רב-מרכזי, רנדומלי, פתוח. במסגרת המחקר הושווה שיעור הדימומים במטופלים עם אמיסיזומאכ לשיעור הדימומים בחולים שקיבלו טיפול אפיזודי (לפי הצורך) בלבד עם תרופות מעקף, וכן לשיעור הדימומים בחולים שקיבלו טיפול מונע עם תרופות מעקף שניתן להם במהלך מחקר תצפיתי מקדים. למחקר גויסו 109 חולי המופיליה A זכרים עם נוגדנים, בגיל חציוני של 28 שנים. לרוב החולים הייתה המופיליה קשה ופגיעה מפרקית. בכל הזרועות שקיבלו אמיסיזומאב ניתן מינון התחלתי של 3 מ"ג/ק"ג פעם בשבוע למשך 4 שבועות ולאחריו 1.5 מ"ג/ק"ג פעם בשבוע, במתן תת-עורי.
אמיסיזומאב הדגימה מניעה מוחלטת של דימומים שדרשו טיפול ברוב המטופלים, הן בהשוואה לחולים שקיבלו טיפול אפיזודי עם תרופות מעקף והן בהשוואה לחולים שקיבלו טיפול מונע עם תרופות מעקף. מתן אמיסיזומאב הביא להפחתה משמעותית סטטיסטית וקלינית של 87% בשיעור השנתי של דימומים שדרשו טיפול בהשוואה לטיפול אפיזודי עם תרופות מעקף. שיעור הדימומים השנתי החציוני עם אמיסיזומאב היה 0 לעומת 18.8 עם טיפול אפיזודי של תרופות מעקף, יתרה מזאת, ברוב המטופלים עם אמיסיזומאב (62.9%) הושגה מניעה מוחלטת של דימומים שדרשו טיפול (קרי, 0 דימומים) ושיעור גבוה משמעותית של מניעת דימום הושג גם בהשוואה לקבוצת החולים שקיבלה טיפול מונע בתרופות מעקף. שיפור מובהק ומשמעותי הודגם גם בכל המדדים השניוניים במטופלים עם אמיסיזומאב ובכללם: הפחתת שיעור הדימומים הספונטניים, דימומים במפרקים ודימומים במפרקי מטרה שדרשו טיפול.
באנליזה נוספת נבדקו גם תוצאות כלל החולים שקיבלו אמיסיזומאב, בפרקי זמן של 24 שבועות לאורך תקופת המעקב הממושכת (25-48,1-24 ו־49-72 שבועות). נמצא ששיעור הדימומים המחושב השנתי יורד בבירור עם הזמן ל־0.5 וחציון הדימומים השנתי הוא 0.
בנוסף לשיפור המשמעותי בכל התוצאים הקליניים הודגם שיפור מובהק ומשמעותי גם בכל מדדי איכות-החיים במטופלים עם אמיסיזומאב.
מחקה פאזה III בילדים חולי המופיליה A עם נוגדנים (2 HAVEN)
במחקר פאזה III גלובלי, רב-מרכזי, חד-זרועי, פתוח, הודגמה יעילותה הגבוהה של אמיסיזומאב גם בילדים, שהייתה עקבית לתוצאות שהודגמו במחקר במתבגרים ומבוגרים. הטיפול עם אמיסיזומאב הביא למניעה מוחלטת של דימומים שדרשו טיפול ב־94.7% מהמטופלים, עם שיעור דימומים שנתי ממוצע של 0.2. אף מטופל לא סבל דימום במפרקים שדרש טיפול.
בהשוואה לטיפול בתרופות המעקף, הטיפול באמיסיזומאב הביא להפחתה של 99% בשיעור השנתי של דימומים שדרשו טיפול.
מחקרי פאזה III במתבגרים ומבוגרים חולי המופיליה 3 A Haven - ללא נוגדנים; 4 Haven עם או ללא נוגדנים
3 HAVEN הוא מחקר פאזה III גלובלי, רב-מרכזי, רנדומל׳, פתוח[8] שבמסגרתו הושווה שיעור הדימומים במטופלים עם אמיסיזומאב לשיעור הדימומים בחולים שקיבלו טיפול אפיזודי או טיפול מונע בפקטור 8. למחקר זה גויסו 152 חולי המופיליה A זכרים, בגיל חציוני של 38 שנים. לרוב החולים הייתה המופיליה קשה, ריבוי דימומים שנתי ופגיעה במפרקי מטרה טרם כניסתם למחקר.
בכל הזרועות שקיבלו אמיסיזומאב ניתן מינון התחלתי של 3 מ"ג/ק"ג פעם בשבוע למשך 4 שבועות ולאחריו 1.5 מ"ג/ק"ג פעם בשבוע או 3 מ"ג/ק"ג אחת לשבועיים, כמתן תת-עורי. הטיפול עם אמיסיזומאב הביא לירידת מספר הדימומים ב־97% מהחולים לעומת קבלת טיפול אפיזודי וב־68% מהחולים שקבלו טרם הניסוי טיפול מונע בתרכיזי פקטור -8 שיעור החולים ללא דימומים כלל היה כ־60%.
גם במחקר זה נמצא שיפור משמעותי באיכות חייהם של המטופלים באמיסיזומאב לעומת טיפול מונע מקובל בפקטור 8, והוכחה יעילות ובטיחות הטיפול בחולים שטופלו אחת לשבוע או אחת לשבועיים.
במחקר 4 HAVEN[9], קבוצת חולים קטנה עם המופיליה A עם וללא נוגדנים גויסו להדגמת יעילות הטיפול ובדיקות של פרמטרים פרמקוקינטיים (ריכוז התרופה בדם, היכולת להשרות קרישה בדם מלא ובדיקות חוזרות לאורך זמן) תוך קבלת אמיסיזומאב תת-עורי במינון 6 מ"ג לק"ג אחת ל־4 שבועות. נמצא כי התרופה שומרת היטב על פעילותה ההמוסטטית גם במתן תת-עורי אחת לחודש.
פרופיל הבטיחות של אמיסיזומאב
במחקרים של אמיסיזומאב הודגם כי לתרופה פרופיל בטיחות טוב. תופעות לוואי שיוחסו על ידי החוקרים לאמיסיזומאב דווחו ב־28.6% מהמטופלים המבוגרים ו־16.7% מהילדים. תופעות לוואי בדרגה 3 ומעלה דווחו ב־12.5% מהמבוגרים ו־6.7% מהילדים, כאשר אף אחת מהתופעות בילדים לא יוחסה לאמיסיזומאב. הפסקת טיפול כתוצאה מתופעות לוואי אירעה בפחות מ־3% מהמטופלים המבוגרים ולא דווחה הפסקת טיפול בילדים.
תופעת הלוואי השכיחה ביותר הייתה תגובה מקומית באזור ההזרקה, שדווחה ב־15% מהמטופלים המבוגרים וב־16.7% מהילדים. תופעות לוואי נוספות שאירעו ב־5% ומעלה מהחולים כללו כאבי ראש, עייפות, זיהום בדרכי הנשימה העליונות וכאבי מפרקים.
במחקר 1 HAVEN כמבוגרים אירע אירוע תרומבואמבולי בשני מטופלים ומיקרואנגיופתיה תרומבוטית (TMA) בשלושה מטופלים. כל האירועים התרחשו במטופלים שקיבלו בנוסף לטיפול עם אמיסיזומאב טיפול אפיזודי לדימום עם תרכיז מסוג aPCC כמינונים גבוהים במיוחד (> 100 יח'/ק"ג/ליום) ולמשך לפחות 24 שעות. בכל החולים התופעה חלפה או השתפרה תוך זמן קצר מהפסקת הטיפול עם aPCC, ובשניים מהם הטיפול עם אמיסיזומאב חודש ללא תופעות נוספות מסוג זה. מטופל אחד שסבל במקביל ל־TMA מדימום רקטלי נפטר לאחר שסירב לקבלת מנות דם מסיבות דתיות, והחוקרים ציינו שסיבת המוות אינה קשורה לאמיסיזומאב. כתוצאה ממקרים אלה הוגדרו הנחיות חדשות המתייחסות למתן aPCC במטופלים עם אמיסיזומאב ומאז יישומן לא היו מקרים נוספים.
בילדים לא אירעו אירועים תרומבואמבוליים או מקרי אנגיופתיה טרומבוטית, וכן לא דווחו כלל תופעות לוואי משמעותיות בחולי ההמופיליה ללא נוגדנים אשר טופלו בתרופה זו.
סיכום
נכון למועד כתיבת מאמר זה טופלו כ־1,100 חולי המופיליה A בעולם באמיסיזומאב - אשר נרשם לשימוש בחולי המופיליה עם נוגדנים בארצות הברית ובאירופה, התרופה אושרה לשיווק על ידי ה-FDA גם לחולי המופיליה ללא נוגדנים וצפויה להירשם ברשויות נוספות מסביב לעולם, במקביל לתהליך הרישום המתנהל בישראל ולמועמדות התכשיר להכללה בסל שירותי הבריאות לשנת 2019. האפשרות למתן טיפול יעיל במיוחד, בטוח ונוח לשימוש (הזרקה תת-עורית) לחולי המופיליה A עם וללא נוגדנים מהווה שינוי בפרדיגמה הטיפולית.
ביבליוגרפיה
- ↑ Franchini M. Mannucci PM Noh factor replacement therapy for hemophilia a current update Blood Transtus. 2018 Feb 14:1-5 dot: 10.2450/2018.0272-17.
- ↑ Mannucci PM Miracle of hemophilia drugs- personal views about a lew main players Haemophilia. 2010 May 29 do 10 1111/hae 13519 [Epub ahead of print] Review
- ↑ 3.0 3.1 Shima M. Hanabusa H, Taki M. Matsushita T. Sato T, Fukufake K. Fukazawa N Yoneyama K, Yashida H. NogarmK Factor VI11-Mimetic Function of Humanized Bispecilic Antibody in Hemophilia A N Engl J Med 2016 May 26:374(21)2044-53
- ↑ 4.0 4.1 Uchida N. Sam be T, Yoneyama K. Fukazawa N KawaniBhi T, Kobayash! S, Shima M. A lirsl-in-human phase 1 study of ACE910. a novel factor Vlll-mimelic bispecilm antibody in healthy subjects Blood 2016 Mar 31.127( 13): 1833-41
- ↑ 5.0 5.1 Oldenburg J. Mahlangu JN, Kim B, Schmitt C. Callaghan MU, Yoimg G. Saniagosiino E. Kru&e-Jarres H Negner C, Kessler C, VafenieN. Asrtamus E. Levy GG, Wmdyga J, Shima M. Enucizumab Prophylaxis in Hombphilia A wilh Inhibitors N Engl J Mad 2017 Aug 31:377(9) 809-B1B
- ↑ 6.0 6.1 Shima M, HanaDusa H. T3K1 M Matsushita T Sato T. Fukutake K, Kasai R. Yoneyama K, YoshidB H, Nogam K Long ietm safety and efficacy of enncizunab m a phase 1/2 study in patients with hemophilia A with 01 wiihoul inhibitors. Blood Adv 2017 Sep 27:1(22) 1891¬1899
- ↑ 7.0 7.1 Guy Young, Robert F Sidonlo. R1 Lesner. Johannes Oldenburg. Tiftany Chang, Marianne Uguen, Chnslophe Ohaliuin.Chnslophe Schmrtl.GaltiaG Levy, Midoti Shima, Johnny Mawangu HAVEN 2 Efficacy. Safety, and Pharmacokinetics ol Once Weekly Prophylactic Emlcizumab (ACE910) in Pediatric Patients (< 12 Years) with Hemophilia A wilh Inhibitors: Interim Analysis 01 Single-Ann. Mulncenler. Open-label. Phase 3 Study-presented al ISTH, Berlin, July 2017
- ↑ 8.0 8.1 Johny Malangu et al. Emicizumab prophylaxis administered cnce-weekly or every Iwo weeks provides effective bleed prevention in persons with haemophilia A without inhibitors Results from the phase III HAVEN 3 sludy, presented at WFH, Glasgow, May 2018
- ↑ 9.0 9.1 Steven Pipe er ai: Emeinenab subcutaneous dosing every 4 weeks is safe and efficacious in me control of bleeding in persons with haemophiliB A with and without inhibitors - Results from Ihe phase 3 HAVEN 4 study, presenied al WFH. Glasgow, May 201B
המידע שבדף זה נכתב על ידי פרופסור גילי קנט - מנהלת המכון הארצי להמופיליה והמכון לחקר קרישת דם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק