מחלות ראומטולוגיות וביטוייהן בכליה בילדים - Rheumatologic diseases and their renal expression in children
| מחלות ראומטולוגיות וביטוייהן בכליה בילדים | ||
|---|---|---|
| Rheumatologic diseases and their renal expression in children | ||
| יוצר הערך | אמיר אבירם, ד"ר לימור פרידנזון צוק, פרופ' יוסף עוזיאל, פרופ' אבישלום פומרנץ 
|
|
מחלות ראומטיות נובעות מתהליך חיסון עצמי (אוטואימוני) הגורם לתהליך דלקתי באיברי מטרה. היות ואיברי המטרה של תהליך דלקתי זה הם רבים, התסמינים הקליניים במחלות ראומטיות הם רבים ומגוונים.
הכליה מעורבת בכ-50% ומעלה ממחלות החיסון העצמי. למעורבות הכלייתית במחלות אלו יש חשיבות רבה בקביעת התחלואה והתמותה של חולים אלו.
המעורבות הכלייתית מצביעה על מחלה חיסון עצמי קשה יותר, ודורשת טיפול מדכא חיסון. לטיפולים אלו תופעות לוואי כולל תחלואה מוגברת מזיהומים, עקרות משנית ועוד.
אבחון מוקדם של קבוצת חולים זו באוכלוסיית הילדים יכול לשפר את תוצאות הטיפול התרופתי ולהקטין את הנזק הכלייתית ארוך הטווח.
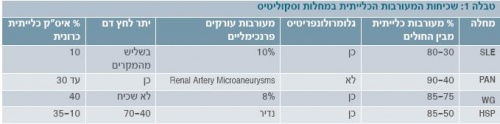
שכיחות המעורבות הכלייתית במחלות השונות
השכיחות של המעורבות הכלייתית במחלות ראומטיות משתנה במחלות השונות (טבלה 1). בחלק מהמחלות משפיעה המעורבות הכלייתית על התחלואה והתמותה של חולים אלו, ולכן חשוב לאבחן חולים הסובלים מפגיעה כלייתית ולטפל בהם. המחלות הראומטיות המפורטות לעיל הן מחלות בהן שכיחה התייצגות כלייתית, כתסמין מרכזי או בליווי תסמינים נוספים.
זאבת (לופוס)
האטיולוגיה המדויקת של מחלת הזאבת אינה ידועה. המחלה מתאפיינת בנוגדנים נגד אנטיגנים עצמיים, היוצרים תצמידים (קומפלקסים) אימוניים שנקשרים לרקמות וגורמים לנזק ישיר או מצטברים ושוקעים ברקמות. כך נגרם נזק דלקתי לאיברי מטרה רבים, כגון: מפרקים, כליות, מערכת הדם ומערכת העצבים המרכזית. המהלך הטבעי של המחלה קשה לחיזוי ונע בין התייצגות כרונית ארוכת שנים והופעה חדה מסכנת חיים.
היארעות המחלה השנתית היא 1.9-5.6 ל-100,000 ילדים בקרב ילדים שגילם צעיר מ-15 שנים, וההימצאות המדווחת היא של 4-250 ל-100,000. היחס בין גברים לנשים הוא 4:1 לפני גיל ההתבגרות, ו-8:1 אחריו[1]. בקרב 20% מהחולים תופיע המחלה במהלך העשור השני לחיים. דיווחים שונים מצביעים על כך שהמחלה יכולה להופיע גם בשנה הראשונה לחיים, אולם היא אינה נפוצה לפני גיל 8.
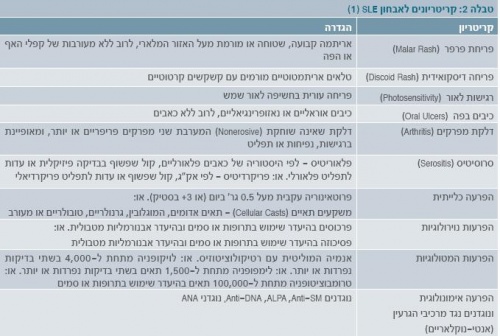
פרק הזמן הממוצע בין הופעת התסמינים לאבחנה הוא חודש אחד עד 3.3 שנים. התסמינים השכיחים בהתייצגות המחלה אינם כלייתיים. למטרת אבחנה, יש לזהות ארבעה תסמינים או יותר מתוך אחד עשר המקובלים בספרות (טבלה 2), המופיעים במקביל או בנפרד, במהלך תקופת המעקב. רוב מקרי המוות נובעים מזיהום, דלקת כליות (נפריטיס), אי ספיקה כלייתית, מחלה נוירולוגית או דימום ריאתי[1].
זאבת כלייתית
זאבת כלייתית מופיעה בקרב 29-80% מהמקרים[2],[3],[4],[5]. ב-90% מהמקרים של זאבת כלייתית המחלה מופיעה כהתייצגות ראשונית או במהלך השנה הראשונה למחלה.
מחלה כלייתית מתאפיינת בתסמונת נפריטית המתבטאת בלחצי דם גבוהים, בצקת בגפיים התחתונות, הפרעות אלקטרוליטרית ואי ספיקת כליות חריפה. מחלה כלייתית נפוצה יותר בילדים מאשר במבוגרים.
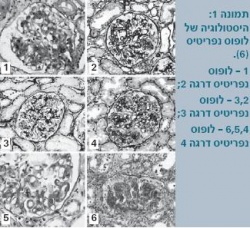
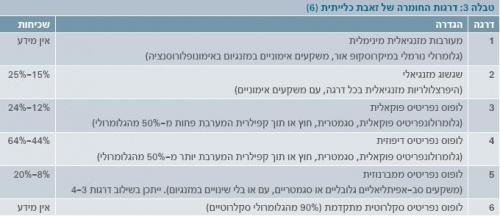
ארגון הבריאות העולמי (WHO - World Health Organization) הגדיר סיווג מורפולוגי המבוסס על ביופסיה כלייתית (תמונה 1), שעודכן בשנת 2003 על ידי החברה הבין-לאומית לנפרולוגיה ופתולוגיה כלייתית[6]. טווח הסיווג ההיסטולוגי הוא מכליה נורמלית במיקרוסקופ אור (דרגה 1) עד דלקת כליה טרשתית מתקדמת (דרגה 6) (טבלה 3).
במקרים קיצוניים ניתן לחזות את דרגת הסיווג המורופולוגית, בייחוד כאשר החולה מתייצג עם מספר אפיזודות של אי ספיקה כלייתית קשה ויתר לחץ דם משמעותי. עם זאת, במקרים קלים יותר קשה לחזות את רמת הפגיעה הכלייתית על בסיס מאפיינים קליניים ומעבדתיים.
ראוי לזכור כי גם מטופלים עם דלקת כליות בדרגה הגבוהה ביותר יכולים להיות בשלבים הראשונים של המחלה עם תפקוד כלייתי תקין וערכים תקינים של לחץ דם. בכל התייצגות עם אי ספיקה כלייתית, הפרעה בתפקודי הכליה או משקע שתן פתולוגי יש לבצע ביופסיה כלייתית כדי לבסס את הסיווג שעל פיו יוחלט על טיפול.
קליניקה
טווח ההופעה הקלינית של דלקת כליות קרומית (ממברנוזית) הוא מדרגה קלה של חלבון בשתן (עם או בלי דם בשתן) ועד תסמונת נפרוטית. יש לחשוד בזאבת כלייתית בכל מתבגר שמתייצג עם תסמונת נפרוטית אידיופתית, תסמונת נפרוטית עם דם בשתן או תסמונת נפרוטית עמידה לטיפול.
רוב החולים עם זאבת כלייתית מתייצגים עם תסמינים מערכתיים, הכוללים חום, הרגשה כללית רעה, חוסר תאבון ואיבוד משקל. בשליש מהמקרים ניתן למצוא לחצי דם גבוהים. הופעת לחץ דם גבוה בשילוב בצקת פריפרית קשורה לרוב לדרגות 3 או 4. לחץ הדם נוטה גם לעלות בהתחלת טיפול בסטרואידים. בדיקות השתן יכולות לגלות חלבון ו/או דם בשתן עם או בלי אזוטמיה (Azotemia). רוב החולים עם תפקוד כלייתי לקוי הם חולים בדרגות 3 או 4.
התלקחויות של מחלה כלייתית נפוצות במהלך המחלה, ולרוב ניתנות לזיהוי על ידי התגברות החלבון בשתן עוד לפני הישנות תסמינים קליניים במערכות נוספות.
רוב הנגעים (לזיות) המשמעותיים כרוכים במשקעים תת-אפיתליאליים נרחבים ושגשוג (פרוליפרציה) של המזנגיום (Mesangium). רוב המטופלים המפתחים אי ספיקת כליות סופנית הם בדרגות 3 או 4 לפי ביופסיה.
דרגה 2 מצביעה על מחלה קלה יחסית, הדורשת טיפול מועט ביחס לדרגות הגבוהות יותר, עם שרידות גבוהה יותר ותפקוד כלייתי מצוין. ב-20-30% מהמקרים, עם זאת, חולים יכולים לעבור התמרה לדרגות 3 או 4 אחרי חודשים ואף שנים. במקרים אלו הישרדותם של החולים והתפקוד הכלייתי שלהם זהים לאלו שאובחנו מלכתחילה בדרגות 3 או 4[7] [8].
פרוגנוזה
סיכויי השרידות למשך 5 שנים לזאבת כלייתית בדרגה 4 הם 88-93%, ולמשך 10 שנים - 85%. גורמים פרוגנוסטיים שליליים כוללים מציאת זאבת כלייתית בדרגה 4 בביופסיה, עדויות לתסמונת נפרוטית בהופעה הראשונית וגזע שאינו לבן.
טיפול
הטיפול מבוסס על הממצאים בביופסיה כלייתית [1]:
- דרגה 1 - ללא טיפול.
- דרגה 2 - קורס קצר של סטרואידים במינון נמוך (0.1-0.5 מ"ג לק"ג Prednisone ביום), עם הפחתה הדרגתית במהלך מספר חודשים. הפרוגנוזה של חולים אלו מצוינת.
- דרגות 4-3 - קורס ארוך של סטרואידים במינון גבוה (2 מ"ג לק"ג Prednisone ליום, עד מקסימום 80-60 מ"ג ביום, במנות מחולקות). לרוב מוסיפים טיפול נוסף, כגון פעימה (Pulse) חודשיים של Endoxan (Cyclophosphamide) או טיפול יומי ב-Azathioprine. ייתכן שגם Mycophenolate mofetil יכול להיות אפקטיבי, כמו Endoxan. Mycophenolate mofetil ו-Azathioprine בטוחים יותר לשימוש מ-Endoxan.
- דרגה 5 - רוב החולים בדרגה 5 נדרשים לקורסים קצרים של סטרואידים במינון נמוך. רק מיעוטם נדרש לקורס ארוך או לשימוש בטיפול נוסף.
ארגמנת על-שם שונליין-הנוך (Henoch-Schönlein purpura)
ארגמנת על-שם שונליין-הנוך היא אחת הצורות הנפוצות ביותר של דלקת כלי דם (וסקוליטיס) מערכתית בילדים. ההיארעות של דלקת כליות עקב ארגמנת על-שם שונליין-הנוך היא 20.4 ל-100,000 בשנה[9].
קליניקה
מרכיביה של מחלה זו הם, לרוב:
- תסמינים עוריים - תפרחת ארגמנית על הגפיים התחתונות
- תסמינים של מערכת העיכול, כמו כאבי בטן
- תסמינים מפרקיים
- תסמינים כלייתיים - התסמינים הכלייתיים מופיעים ב-50% מהמקרים[10].
בחלק ניכר מהחולים יש עדות לזיהום בדרכי הנשימה בטרם הופעת המחלה[11].
הקריטריונים לאבחנה מפורטים בטבלה 4.
המעורבות הכלייתית
התסמינים הכלייתיים מופיעים בדרך כלל 3 ימים עד 17 חודשים לאחר הופעת התסמינים הראשונים, אף על פי שלרוב הם מופיעים תוך שלושה חודשים מההתייצגות הראשונית[12].
טווח ההופעה הראשונית הכלייתית הוא מהופעה מיקרוסקופית חולפת של דם בשתן ודרגה קלה של חלבון בשתן (ברוב המקרים) עד תסמונת נפרוטית, דלקת סוערת של פקעיות הכליה (Rapidly progressive glomerulonephritis - RPGN) ואי ספיקה כלייתית[13],[14]. רובם המוחלט של המקרים חולף ספונטנית ללא נזק שארי. הסיכון לפיתוח דלקת סוערת של פקעיות הכליה עומד על 3% בקירוב[15].
תחלואה ארוכת טווח מופיעה רק ב-2-5.5% מהמקרים[16],[17].
טיפול
Zaffanello וחב' [10] סקרו את הספרות ואספו מחקרים הנוגעים לטיפול בפגיעה הכלייתית בארגמנת על-שם שונליין-הנוך. מספר מחקרים בחנו את ההשערה שטיפול בסטרואידים בזמן אבחנת ארגמנת על-שם שונליין-הנוך בילדים ללא עדות לפגיעה כלייתית בעת ההתייצגות, יכול למנוע את הפגיעה הכלייתית. לאחר בחינת המחקרים סוכם כי אין די נתונים לתמוך בהמלצה לטיפול סטרואידלי מניעתי[10].
מחקרים אחרים בסקירה של Zaffanello וחב' ניסו לבחון טיפולים ספציפיים למעורבות כלייתית בינונית, כגון אימונוגלובולינים (Intravenous immunoglobulin - IVIg), מעכבי ACE (Angiotensin converting enzyme inhibitor), שמן דגים וכריתת שקדים. רוב המחקרים הורכבו מאוכלוסיית מחקר מצומצמת, לרוב הטרוגנית, עם דרגות שונות של תסמינים כלייתיים. אי לכך, לא ניתן היה לבסס המלצות לטיפולים ספציפיים על פיהם [10].
מחקרים רבים נערכו גם לגבי הטיפול בדלקת סוערת של פקעיות הכליה. נבחנו טיפולים מדכאי-חיסון רבים הכוללים סטרואידים, Ciclosporin, Azathioprine, Mycophenolate mofetil, ועוד. מחקרים אלו לא הציגו די נתונים כדי לבסס המלצה לגבי טיפול ספציפי[10] [18].
דלקת רב-עורקית קשרירית (Polyarteritis nudosa - PAN)
דלקת רב-עורקית קשרירית (Polyarteritis nudosa - PAN) היא דלקת כלי דם נמקית שפוגעת בעורקים קטנים ובינוניים, ועלולה לגרום להתפתחות של מפרצות וקשריות לאורך העורקים הפגועים. אף על פי שהמחלה נחשבת נדירה בילדים, מדובר בדלקת כלי הדם המערכתית השלישית בשכיחותה לאחר ארגמנת על-שם שונליין-הנוך ומחלת קוואסקי (Kawasaki disease)[19],[20]. המחלה מופיעה לרוב בגילים 7-11, ופוגעת יותר בבנים[21].
הקריטריונים לאבחנת דלקת רב-עורקית קשרירית מפורטים בטבלה 5. הרגישות והסגוליות של קריטריונים אלו הם 73% ו-100%, בהתאמה[22].
קליניקה
התסמינים העיקריים של דלקת רב-עורקית קשרירית הם רב מערכתיים וכוללים בין השאר חולשה, חום, כאבי בטן, איבוד משקל, פריחה, כאבי שרירים (מיאלגיה) או הפרעות מפרקיות.
איסכמיה כלייתית בשל הפגיעה בעורקים היא המנגנון האחראי לפגיעה הכלייתית. התסמינים הכלייתיים במחלה כוללים כאב במפשעות, דם ו/או חלבון בשתן, אי ספיקה כלייתית המתקדמת באיטיות ויתר לחץ דם[11],[21]. במהלך השלב החריף יתכן מיעוט שתן (אוליגוריה) או חוסר שתן (אנוריה), אך אי ספיקה כלייתית חדה אינה נפוצה[23].
אין בדיקות מעבדה סגוליות לדלקת רב-עורקית קשרירית. ניתן להבחין בממצאים המעידים על דלקת כרונית, כגון שקיעת דם מוחשת או חלבון מגיב עם סי (CRP - C-reactive protein) גבוה, עלייה בפיברינוגן ומרכיבי המשלים, אנמיה וריבוי כדוריות לבנות (לויקוציטוזיס).
ב-10-20% מהמקרים ניתן לזהות נוגדן אנטי-ציטופלזמי של נויטרופיל מסוג P (p-ANCA) בדם. ב-39% מהמקרים ניתן לזהות גורם שגרוני (Rheumatoid factor - RF) וב-10% ניתן למצוא נוגדנים לדנ"א דו גדילי (Anti-ds-DNA). נוגדנים למרכיבי הגרעין (Antinuclear antibody - ANA) אינם נפוצים[11]. אנגיוגרפיה כלייתית יכולה להדגים הימצאות היצרויות או מיקרואנוריזמות[11].
העדות התומכת העיקרית לקיום דלקת רב-עורקית קשרירית היא ביופסיה, לרוב מהעור, מהשלד, מהשריר, מעצב הסוראלי (Sural nerve) או מהכבד. אין מקום לביצוע ביופסיית כליה, היות שהפרוצדורה טומנת בחובה סיכון גבוה מהרגיל לדימום ואינה עוזרת בקביעת האבחנה[11],[21].
פרוגנוזה
כרבע מהחולים יפתחו מהלך של הידרדרות מהירה עם מעורבות רב מערכתית ותמותה גבוהה ב-3-6 החודשים הראשונים. כ-50% מהחולים יפתחו מחלה בדרגת חומרה בינונית עם תנודות רבות במהלך המחלה. כ-25% מהחולים יימצאו ברמיסיה ארוכה לאחר המהלך הראשוני החריף ללא קשר לטיפול [24].
השרידות הממוצעת עומדת על 55-76% ל-5 שנים לחולים המטופלים בסטרואידים[25], ו-64-80% לחולים המטופלים בסטרואידים ובתכשירים מדכאי חיסון[26],[27].
טיפול
הטיפול בדלקת רב-עורקית קשרירית כולל Prednisone במינון גבוה ו-Endoxan במינון של 2 מ"ג לק"ג ליום למשך 2-3 חודשים. לאחר שהושגה רמיסיה, יש להמשיך את הטיפול במינונים הולכים ופוחתים של Prednisone ו-Azathioprine עד 18 חודשים. ניתן להיעזר בשחלוף פלזמה (פלסמפרזיס) במצבי חירום.
גרגירומת על שם וגנר (Wegener’s granulomatosis)
גרגירומת על שם וגנר (Wegener’s granulomatosis) מאופיינת בדלקת נמקית גרנולומטוטית בדרכי הנשימה העליונות והתחתונות, בדלקת כלי דם של כלי דם קטנים ובינוניים ובדלקת נמקית של פקעיות הכליה.
שיעור ההימצאות של הגרגירומת על שם וגנר מוערך כ-3 מקרים ל-100,000 איש, ובקרב מבוגרים שכיחותה שווה בין המינים [28]. בילדים המחלה נדירה יותר, ושכיחותה בקרב בנות גבוהה פי 3 משכיחותה בקרב בנים.
קליניקה
טווח ההתייצגות הקלינית במחלה רחב, החל מצורות המערבות רק את דרכי הנשימה, כמו: דלקת גת (סינוסיטיס) או דלקת אוזן תיכונה, ועד לצורות היכולות להיות קטלניות, הכוללות דימום ריאתי ואי ספיקת כליות בשל דלקת סוערת של פקעיות הכליה. הקריטריונים לאבחנה מפורטים בטבלה 6.
לרוב תחילת המחלה מאופיינת בתסמינים נשימתיים (80-94% מהמקרים). ככל שמהלך המחלה הופך לכרוני, כך מופיעים תסמינים המערבים מערכות נוספות, כגון[29],[30],[31],[32],[33]:
- חום (בשליש מהמקרים)
- איבוד משקל (15% מהמקרים)
- תסמינים במערכת אף-אוזן-גרון (75-90% מהמקרים)
- תסמינים כלייתיים (77-85% מהמקרים)
- תסמינים עיניים (77-85% מהמקרים)
המחלה מסווגת לשני תת-סוגים: הצורה הקלאסית (המערבת את הכליה) והצורה שאינה מערבת את הכליה. שתי הצורות שונות בהתייצגות ובפרוגנוזה. עם זאת, התייצגות שאינה קלאסית יכולה להפוך להתייצגות קלאסית.
המחלה מאופיינת בתחילתה בחום, בהרגשה כללית רעה, בירידה במשקל, בכאבי שרירים ומפרקים. בהמשך מתפתחים תסמינים נשימתיים: שיעול, נזלת ודלקת גת, כמו גם קוצר נשימה ושיעול דמי (המופטיזיס).
מעורבות כלייתית
מעורבות כלייתית בתחילת המחלה אינה באה לידי ביטוי כתסמינים כלייתיים קליניים אלא בממצאים פתולוגיים בביופסיה של הכליה. בהמשך המחלה, הקליניקה הכלייתית באה לידי ביטוי כדלקת פקעית הכליה בדרגות חומרה שונות.
התקדמות המחלה מהשלב הלא-תסמיני לדלקת פקעית הכליה סוערת ואי ספיקה כלייתית יכולה להימשך ימים עד שבועות. לכן, חיוני לזהות אם יש מעורבות כלייתית בתחילת המחלה. בדיקות שתן יעילות בהערכת המצב הכלייתי ובמעקב אחריו. נוכחות משקעים של תאי דם אדומים היא בעלת ערך מנבא חיובי להתפתחות דלקת פקעית הכליה[33].
המאפיין הפתולוגי של הגרגירומת על שם וגנר הוא הדלקת הגרנולומטוטית הנמקית. ברם, מאפיין זה כמעט אינו ניתן לגילוי בכליה. הממצאים הכלייתיים בביופסיה הם דלקת פקעית הכליה, סהרונים, ודלקת נמקית של פקעיות הכליה דלת משקעים אימונופלורסנטיים (Pauci immune necrotizing glomerulonephritis). באימונופלורוסנציה ניתן לזהות הצטברות משקעים אימוניים המכילים C3, IgM, IgG ו-IgA במזנגיום[24] [27] [34] [35].
אבחנה
האבחנה מבוססת על שילוב של קליניקה, היסטולוגיה, דימות וממצאים מעבדתיים. יש לחשוד בגרגירומת על שם וגנר בכל ילד עם דלקת גת כרונית וממצאים בצילום חזה המתאימים לגרנולומות. 90% מהמטופלים עם מחלה קלאסית יפגינו ANCA חיובי (ב-75-80% יימצא c-ANCA וב-10-15% יימצא p-ANCA)[36].
לעומת זאת, במחלה ממוקמת שאינה מערבת את הכליה, לא ניתן יהיה למצוא ANCA בסרום. הסגוליות של c-ANCA לגרגירומת על שם וגנר היא 88-100% והרגישות – 34-92%[37],[38],[39],[40],[41]. נוסף על כך, מדדי דלקת, כגון שקיעת דם וחלבון מגיב סי, כמו גם אנמיה של מחלה כרונית, נפוצים בגרגירומת על שם וגנר.
פרוגנוזה
בעבר עמדה התמותה בשנתיים הראשונות לאחר גילוי המחלה על 80%. הטיפול בסטרואידים שיפר במעט את הפרוגנוזה[24]. לעומת זאת, הטיפול מדכא החיסון (ובעיקר Endoxan) שיפר את הפרוגנוזה באופן משמעותי. בטיפול משולב של סטרואידים ודיכוי חיסוני 91% מהמטופלים משיגים רמיסיה חלקית ו-75% מהמטופלים משיגים רמיסיה מלאה. הישנות מתרחשת ב-20-46% מהמטופלים[42],[43],[44],[45].
אי ספיקה כלייתית כרונית מתפתחת ב-42% מהמטופלים, 1% מתוכם יזדקקו לדיאליזה, ו-5% יזדקקו להשתלת כליה[30]. אי ספיקה ריאתית או כלייתית, ותופעות לוואי או סיבוכים של הטיפול הם הגורמים העיקריים לתמותה מהמחלה [11].
ביבליוגרפיה
- Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides. Ann Rheum Dis 2006;65(7):936-941
- ↑ 1.0 1.1 1.2 Benseler SM, Silverman ED. Systemic Lupus Erythematosus. Pediatr Clin North Am 2005;52(2):443-467
- ↑ Barron KS, Silverman ED, Gonzales J, et al. Clinical, serologic, and immunogenetic studies in childhood-onset systemic lupus erythematosus. Arthritis Rheum 1993;36:348-354
- ↑ Hagelberg S, Lee Y, Bargman J, et al. Long-term followup of childhood lupus nephritis. J Rheumatol 2002;29:2635-2642
- ↑ Gupta KL. Lupus nephritis in children. Indian J Pediatr 1999;66:215-223
- ↑ Sumboonnanonda A, Vongjirad A, Suntornpoch V, et al. Renal pathology and long-term outcome in childhood SLE. J Med Assoc Thai 1998;81:830-834
- ↑ Weening JJ, D'Agati VD, Schwartz MM, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. J Am Soc Nephrol 2004;15:241-250
- ↑ Austin HA, Muenz LR, Joyce KM. Prognostic factors in lupus nephritis. Contribution of renal histologic data. Am J Med 1983;75:382-391
- ↑ Schwartz MM, Lan SP, Bernstein J. Irreproducibility of the activity and chronicity indices limits their utility in the management of lupus nephritis. Lupus Nephritis Collaborative Study Group. Am J Kidney Dis 1993;21:374-377
- ↑ Gardner-Medwin JM, Dolezalova P, Cummins C, et al. Incidence of Henoch–Schönlein purpura, Kawasaki disease, and rare vasculitides in children of different ethnic origins. Lancet 2002;360:1197-1202
- ↑ 10.0 10.1 10.2 10.3 10.4 Zaffanello M, Fanos V. Treatment-based literature of Henoch-Schönlein purpura nephritis in childhood. Pediatr Nephrol 2009;24(10):1901-1911
- ↑ 11.0 11.1 11.2 11.3 11.4 11.5 Samarkos M, Loizou S, Vaiopoulos G, et al. The Clinical Spectrum of Primary Renal Vasculitis. Semin Arthritis Rheum 2005;35(2):95-111
- ↑ Kaku Y, Nohara K, Honda S. Renal involvement in Henoch–Schönlein purpura: a multivariate analysis of prognostic factors. Kidney Int 1998;53:1755-1759
- ↑ Oner A, Tinaztepe K, Erdogan O. The effect of triple therapy on rapidly progressive type of Henoch-Schönlein nephritis. Pediatr Nephrol 1995;9:6-10
- ↑ Chang WL, Yang YH, Wang LC, et al. Renal manifestations in Henoch-Schönlein purpura: a 10-year clinical study. Pediatr Nephrol 2005;20:1269-1272
- ↑ Sanders JT, Wyatt RJ. IgA nephropathy and Henoch-Schönlein purpura nephritis. Curr Opin Pediatr 2008;20(2):163-170
- ↑ Stewart M, Savage JM, Bell B, et al. Long term renal prognosis of Henoch-Schönlein purpura in an unselected childhood population. Eur J Pediatr 1988;147:113-115
- ↑ Roberti I, Reisman L, Churg J. Vasculitis in childhood. Pediatr Nephrol 1993;7:479-489
- ↑ Chartapisak W, Opastiraku S, Willis NS, et al. Prevention and treatment of renal disease in Henoch-Schönlein purpura: a systematic review. Arch Dis Child 2009;94(2):132-137
- ↑ Dillon MJ. Classification and pathogenesis of arteritis in children. Toxicol Pathol 1989;17:214-218
- ↑ zen S, Bakkaloglu A, Dusunsel R, et al. Childhood vasculitides in Turkey: a nationwide survey. Clin Rheumatol 2007;26:196-200
- ↑ 21.0 21.1 21.2 Dillon MJ, Eleftheriou D, Brogan PA. Medium-size-vessel vasculitis. Pediatr Nephrol 2009. Epub ahead of print
- ↑ Ozen S, Pistorio A, Iusan MS, et al. The EULAR/PRINTO/PRES criteria for childhood polyarteritis nodosa. Ankara 2008. Ann Rheum Dis 2009;68(Suppl 3):713
- ↑ Ladefoged J, Nielsen B, Raaschou F, et al. Acute anuria due to polyarteritis nodosa. Am J Med 1969;46(5):827-831
- ↑ 24.0 24.1 24.2 Balow JE, Fauci AS. Vasculitic diseases of the kidney. In: Schrier RW, Grace WJ, Editors. Diseases of the Kidney, Little Brown, Boston 1997;1851-1878
- ↑ Cohen RD, Conn DL, Ilstrup DM. Clinical features, prognosis, and response to treatment in polyarteritis, Mayo Clin Proc 1980;55(3):146-155
- ↑ Leib ES, Restivo C, Paulus HE. Immunosuppressive and corticosteroid therapy of polyarteritis nodosa. Am J Med 1979;67(6):941-947
- ↑ 27.0 27.1 Fauci AS, Katz P, Haynes BF, et al. Cyclophosphamide therapy of severe systemic necrotizing vasculitis. NEJM 1979;301(5):235-238
- ↑ Cotch MF, Hoffman GS, Yerg DE, et al. The epidemiology of Wegener’s granulomatosis. Estimates of the five-year period prevalence, annual mortality, and geographic disease distribution from population-based data sources. Arthritis Rheum 1996;39(1):87-92
- ↑ Fauci AS, Haynes BF, Katz P, et al. Wegener’s Granulomatosis: prospective clinical and therapeutic experience with 85 patients for 21 years. Ann Intern Med 1983;98:76-85
- ↑ 30.0 30.1 Hoffman GS, Kerr GS, Leavitt RY, et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992;116(6):488-498
- ↑ Boki KA, Dafni U, Karpouzas GA, et al. Necrotizing vasculitis in Greece: clinical, immunological and immunogenetic aspects. A study of 66 patients. Br J Rheumatol 1997;36(10):1059-1066
- ↑ Anderson G, Coles ET, Crane M, et al. Wegener’s granuloma. A series of 265 British cases seen between 1975 and 1985. A report by a sub-committee of the British Thoracic Society Research Committee, Q J Med 1992;83(302):427-438
- ↑ 33.0 33.1 Duna GF, Galperin C, Hoffman GS. Wegener’s granulomatosis, Rheum Dis Clin North Am 1995;21:949-986
- ↑ Ronco P, Verroust P, Mignon F, et al. Immunopathological studies of polyarteritis nodosa and Wegener’s granulomatosis: a report of 43 patients with 51 renal biopsies. Q J Med 1983;52(206):212-223
- ↑ Horn RG, Fauci AS, Rosenthal AS, et al. Renal biopsy pathology in Wegener’s granulomatosis, Am J Pathol 1974;74(3):423-440
- ↑ Wiik AS. Clinical use of serological tests for antineutrophil cytoplasmic antibodies, What do the studies say? Rheum Dis Clin North Am 2001;27 (4):799
- ↑ Rao JK, Weinberger M, Oddone EZ, et al. The role of antineutrophil cytoplasmic antibody (c-ANCA) testing in the diagnosis of Wegener granulomatosis. A literature review and meta-analysis (see comments). Ann Intern Med 1995;123(12):925-932
- ↑ Venning MC, Quinn A, Broomhead V, et al. Antibodies directed against neutrophils (C-ANCA and P-ANCA) are of distinct diagnostic value in systemic vasculitis. Q J Med 1990;77(284):1287-1296
- ↑ Bosch X, Mirapeix E, Font J, et al. Anti-myeloperoxidase autoantibodies in patients with necrotizing glomerular and alveolar capillaritis. Am J Kidney Dis 1992;20(3):231-239
- ↑ Bindi P, Mougenot B, Mentre F, et al. Necrotizing crescentic glomerulonephritis without significant immune deposits: a clinical and serological study. Q J Med 1993;86(1):55-68
- ↑ Hagen EC, Andrassy K, Chernok E, et al. and EEC/BCR Group for ANCA Assay Standardization, The value of indirect immunofluorescence and solid phase techniques for ANCA detection. A report on the first phase of an international cooperative study on the standardization of ANCA assays. J Immunol Methods 1993;159(1-2):1-16
- ↑ Geffriaud-Ricouard C, Noel LH, Chauveau D, et al. Clinical spectrum associated with ANCA of defined antigen specificities in 98 selected patients. Clin Nephrol 1993;39(3):125-136
- ↑ Jayne DR, Gaskin G, Pusey CD, et al. ANCA and predicting relapse in systemic vasculitis, Q J Med 1995;88(2):127-133
- ↑ Westman KW, Bygren PG, Olsson H, et al. Relapse rate, renal survival, and cancer morbidity in patients with Wegener’s granulomatosis or microscopic polyangiitis with renal involvement. J Am Soc Nephrol 1998;9(5):842-852
- ↑ Nachman PH, Hogan SL, Jennette JC, et al. Treatment response and relapse in antineutrophil cytoplasmic autoantibody-associated microscopic polyangiitis and glomerulonephritis. J Am Soc Nephrol 1996;7(1):33-39
קישורים חיצוניים
- מחלות ראומטולוגיות וביטוייהן בכליה, מדיקל מדיה
המידע שבדף זה נכתב על ידי אמיר אבירם - היחידה למחלות כליה ויתר לחץ דם בילדים, מרכז רפואי מאיר, כפר סבא, ד"ר לימור פרידנזון צוק - היחידה למחלות כליה ויתר לחץ דם בילדים, מרכז רפואי מאיר, כפר סבא, פרופ' יוסף עוזיאל - היחידה לראומטולוגיה ילדים, מרכז רפואי מאיר, כפר סבא, פרופ' אבישלום פומרנץ - היחידה למחלות כליה ויתר לחץ דם בילדים, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק