נאופטרין - Neopterin
| מדריך בדיקות מעבדה | |
| נאופטרין | |
|---|---|
| Neopterin | |

| |
המבנה של neopterin
| |
| מעבדה | כימיה בדם, כימיה בשתן וב-CSF |
| תחום | סמן אבחוני ופרוגנוסטי למגוון מפגעים. |
| טווח ערכים תקין | בדם (מבוגרים)-פחות מ-2.5 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
רמות מוגברות של נאופטרין מופיעות בכשל של פעילות הכליות, ובהדבקות נגיפיות במטופלים מושתלים. רמות מוגברות של נאופטרין משמשות גם אינדיקציה לתרחישים הקשורים לפעילות פגומה של מערכת החיסון התאי.
הגילוי של neopterin
בשנת 1889 דיווח Hopkins ב-Nature על בידוד פיגמנט צהוב מכנפיים של פרפר מסוג lepidoptera. כמעט 50 שנה לאחר מכן פיגמנט זה זכה לשם pteridine שנגזר מהביטוי הלטיני של כנפיים (Schopf ו-Becker ב-Justus Liebigs Ann Chem משנת 1936). בשנת 1940 היה זה Purrmann שדיווח באותו כתב עת על פענוח המבנה של שלושה פיגמנטים ממשפחת ה-pterins, שהכילו מבנה טבעתי כפול, דמוי פירימידין. נאופטרין בודד מזחלים של דבורים על ידי Rembold ו-Buschmann בChem Ber- משנת 1963.
בשנת 1967 דיווחו Sakurai ו-Goto ב-J Biochemistry על בידוד 25 מיליגרם של נאופטרין מ-500 ליטר של שתן אדם. לאחר שזיהו pteridine כחומר הפלואורסצנטי שהיה מוגבר בשתן של עכברים עם Ehrlich ascites tumor בהשוואה לעכברים בריאים, וזוהה חומר זה שבודד משתן אדם עם מחלות ממאירות ונמצא זהה לנאופטרין. בהמשך נמצאה הפרשה מוגברת של נאופטרין בשתן של אנשים עם ממאירויות שונות, כמו גם אנשים עם מחלות נגיפיות (Wachter וחב' ב-Hoppe-Seyler's Z Physiol Chem משנת 1979). בשנת 1981 הועלתה ההשערה שהעלייה ברמת נאופטרין מקורה בתגובה חיסונית של הפונדקאי כנגד תאים סרטניים או כנגד תאים מותמרים על ידי נגיפים (Hausen וחב' ב-Clin Chim Acta). מחקרים נוספים in vitro גילו שמונוציטים ומקרופאגים באדם מייצרים נאופטרין לאחר גירוי על ידי interferon-γ. הציטוקין הזה מופרש מתאי T משופעלים. סוגי תאים אחרים אינם מייצרים כמויות ברות מדידה של נאופטרין לאחר גירויים שונים (Huber וחב' ב-J Exp Med משנת 1984).
הביולוגיה של neopterin
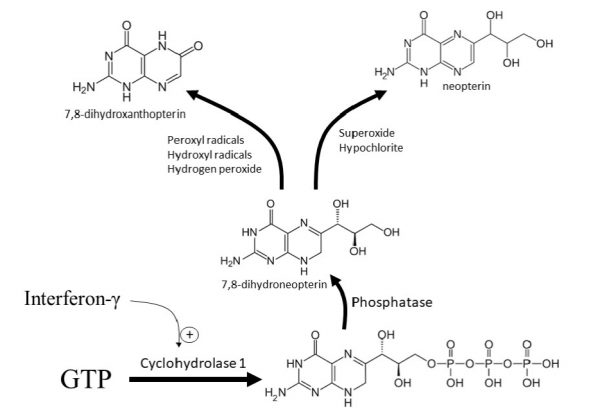
נאופטרין הוא תוצר קטבולי של guanosine triphosphate (GTP), שהוא נוקלאוטיד פּוּריני שבמבנהו הוא pyrazolopyridine. נאופטרין שייך לקבוצה כימית של חומרים הידועים כ-pteridines. נאופטרין מסונתז באדם על ידי מקרופאגים לאחר גירוי תאים אלה על ידי הציטוקין interferon-γ, והוא מהווה אינדיקציה לסטאטוס חיסוני קדם-דלקתי. נאופטרין משמש כסמן של שפעול מערכת החיסון תחת הבקרה של תאי T helper type 1 ( Murr וחב' ב-Curr Drug Metab משנת 2002). רמות ניתנות למדידה של נאופטרין התגלו בנסיוב וכן בשתן של נבדקים הלוקים בסוגים שונים של ממאירות (Sucher וחב' ב-Cancer Lett משנת 2010) וכן בזיהומים נגיפיים. שינויים ברמות של נאופטרין בנסיוב או בשתן עשויים לנבא סיבוכים כגון דחיית שתל. רמות מוגברות של נאופטרין מוצאים במפגעים אוטו-אימוניים כגון RA או לופוס. רמות נאופטרין יכולות לשמש לניבוי פרוגנוסטי של מספר ממאירויות. מדידת רמות נאופטרין היא בעלת ערך מיוחד לניטור נשאי HIV (Fuchs וחב' ב-Immunol Today משנת 1988). נאופטרין מורחק בעיקר בשתן, כך שמדידת רמתו בשתן יכולה להיות שימושית בהערכת השפעול של מערכת החיסון התאית, אפילו בהיעדר תסמינים קליניים אופייניים (Wachter וחב' ב-Adv Clin Chem משנת 1989).
מציאת רמות מוגברות של נאופטרין בנסיוב, בשתן או ב-CSF, כרוכה עם יצירה מוגברת של ROS (או reactive oxygen species) הקשורה לעקה חמצונית. ניתן למצוא רמות מוגברות גם במקרים של הפאטיטיס B ו-C, זיהומים בקטריאליים כגון Borrelia (מחלת Lyme), Mycobacterium tuberculosis ו-Helicobacter pylori, הדבקות טפיליות כגון פלסמודיום, וכן במצב של leukodystrophy (תסמונת Aicardi-Goutieres) וכן במצבי דיכאון. ריכוזי נאופטרין תואמים את דרגת הפעילות של המחלה, והם אף יעילים בניטור של מצב החולים במהלך טיפולים.
Neopterin ו-biopterin הם 2 מטבוליטים עיקריים במסלול ה-tetrahydrobiopterin (BH4). ה- BH4 מסונתז de novo מ-GTP על ידי פעילות האנזים GTP cyclohydrolase I (להלן GCH-1) על GTP. חסכים ב- BH4 גורמים למפגעים של neurotransmission, כיוון שמולקולה זו משמשת קו-פקטור של הידרוקסילאזות של חומצות אמינו ארומטיות הכרוכות בביו-סינתזה של דופאמין ושל סרוטונין. הפעילות של GTP cyclohydrolase I מושרית על ידי ציטוקינים דלקתיים כגון interferon-γ, כאשר מקרופאגים הם מהתאים הפעילים ביותר ביצירת נאופטרין. רמות נאופטרין ב-CSF מנוטרות במפגעים אוטו-אימוניים כמו גם בזיהומים והדבקות של ה-CNS, בנוסף למפגעים מטבוליים מולדים. בתינוקות מתחת לגיל שנה, רמות נאופטרין ב-CSF נורמלי הן בתחום שבין 12–35 ננומול לליטר, בעוד שרמות נאופטרין של ילדים מבוגרים יותר וכן של מבוגרים ב-CSF נורמלי, נעות בין 9–20 ננומול לליטר.
הפעילות של GCH-1 בתאי-דם מונו-נוקלארים של מטופלים עם מפגעים אוטו-אימוניים או עם זיהומים שונים, נמוכה ביותר מ-80% בהשוואה לעילות האנזים בביקורת בריאה. בנשאים א-תסמיניים פעילות GCH-1 היא בערך 30-40% מפעילותו הנורמלית.
ישנן ראיות בלתי ישירות הכורכות את המסלולים המטבוליים של BH4 ושל folate. למטופלים עם חסר מוחי של folate יש חסר רמות נמוכות של methyltetrahydrofolate-5 בתרחיש של רמות folate נורמליות בפלזמה. מפגע זה נובע מיצירה של נוגדנים עצמיים כנגד קולטני folate הקשורים לממברנה ב-choroid plexus במוח. מחקר עדכני דיווח על סטנדרטיזציה על ידי שימוש ב-HPLC של MTHF-5 בדגימות CSF של מטופלים ושל אנשים בריאים. במטופלים מתחת גיל שנה רמות MTHF-5 ב-CSF נקבעו כ-103 ± 20.4 ננומול לליטר; למטופלים בגיל 1–3 שנים רמות אלה נקבעו כ-72 ± 19.1 ננומול לליטר, ולמטופלים בגיל 4–18 שנה נקבעו רמות של 56 ± 10.7 ננומול לליטר.
מפגעים הקשורים לנירוטרנסמיטורים
האנזים Pyruvoyltetrahydropterin Synthase Deficiency-6 מקטלז את האלימינציה של פוספאט אנאורגני מ- dihydroneopterin triphosphate ליצירה של pyruvoyltetrahydropterin-6. למטופלים יש רמות מוגברות של היחס neopterin/biopterin בשתן ובפלזמה. פעילות מופחתת של pyruvoyltetrahydropterin synthase-6 מתועדת בתאי-דם אדומים. בצורה הקלאסית של מפגעים אלה, למטופלים יש רמות מופחתות של מטבוליטים של קטכולאמין וסרוטונין, ויחס מוגבר של רמות neopterin/biopterin ב-CSF. מטופלים אלה מתגלים כבר בלידתם במסגרת סקר היילודים, והם מדגימים מעורבות מתקדמת של חסכים נירולוגיים כבר בחודשי החיים הראשונים, הכוללים תסמינים אקסטרה-פירמידליים ואקסיאליים, כולל היפוטוניה והיפוקינזיה של המערכת השרירית, קשיי אכילה, תסמינים אוטונומיים, תנועות דיסטוניות עם מאפיינים choreoathetotic . רבים ממטופלים אלה, למרות אבחונם המוקדם והעובדה שהם מקבלים כתוספים BH4 וקודמנים של נירוטרנסמיטור, ממשיכים להפגין פיגור התפתחותי. צורה "היקפית" של מפגעים אלה, כרוכה עם בערך שליש של מוטציות ידועות בגן PTS, והן מאופיינות על ידי רמות נורמליות של נירוטרנסמיטורים מרכזיים. מטופלים עם צורת מפגעים היקפית, הם בעלי פרוגנוזה טובה לגבי התפתחות נירולוגית תקינה כאשר יש העשרת דיאטה ב-BH4.
ביוסינתזה של נאופטרין
נאופטרין ונגזריו מסונתזים in vivo מ-GTP על ידי האנזים GTP-cyclohydrolase, כאשר פעילות אנזימטית זו מוגברת באופן ניכר על ידי interferon-γ (Schoedon וחב' ב-Eur J Biochem משנת 1987). התרכובת dihydroneopterin triphosphate 7,8 (להלן NH2TP) נמצאת על המסלול הביו-סינתטי של tetrahydrobiopterin 5,6,7,8 (להלן BH4), כאשר האחרון מייצג את ספק האלקטרונים בהידרוקסילציה של פניל-אלנין לטירוזין בכבד, את ההידרוקסילציה של טירוזין ל-L-dopa, ואת זו של טריפטופן ל-hydroxy-tryptophan-5 ברקמות נוירו-אנדורקריניות בהן מסונתזים קטכולאמינים וסרוטונין (Kaufman ב-Function & Reg Monoamine Enzymes משנת 1981). בכבד ובלימפוציטים, רוב ה-NHTP עובר מטבוליזם ל-BH4. באדם, מונוציטים ומקרופאגים חסרים את האנזים pyruvoyl-tetrahydropterin synthetase 6, ההופך NH2TP ל- pyruvoyltetrahydropterin 6. כתוצאה מכך, מונוציטים ומקרופאגים, במקום לייצר BH4, אוגרים NH2TP, אשר לאחר הידרוליזה על ידי פוספטאזות, מופרש כ-dihydroneopterin או כ-neopterin (Blau וחב' ב-Eur J Cancer Clin Oncol משנת 1989, ו-Werner וחב' ב-Life Sci משנת 1987).
נראה שבתהליכים דלקתיים יש סינתזה מוגברת של נאופטרין בעיקר כתוצאה מהשפעת אינטרפרון-γ על מונוציטים ומקרופאגים. ייצור נאופטרין התאי THP-1 ממקור של ליקמיה באדם, התגבר על ידי אינטרפרון-γ ו-TNF-α, אך דוכא על ידי α-MSH.
תפקיד פיזיולוגי של neopterin
כיוון שהתפקיד הפיזיולוגי העיקרי של אינטרפרון-γ במקרופאגים יכול להיות השריית פעילויות אנטי-בקטריאליות, אנטי-פרוטוזואליות, ואנטי-פטרייתית, הוצע שנאופטרין עשוי לפעול כמעכב אנדוגני של סינתזת folate על ידי מיקרו-אורגניזמים פתוגנים תוך-תאיים. ב-pH מעט בסיסי של 7.5, נאופטרין מעודד פעילות של H2O2 ושל כלורמין-T. נתון זה מודגם על ידי הגברה של עוצמת האיתות במבדק luminol (יצירת פלואורסצנציה כחולה) וכן הגברת הטוקסיות כלפי חיידקים (Weiss וחב' ב-FEBS Lett משנת 1993). ראיות נוספות מרמזות על תפקיד פוטנציאלי של נאופטרין בתהליכים בהם מעורבים רדיקלים חופשיים של חמצן, שבאים לביטוי בריכוזים גבוהים של dihydroneopterin8 7,8 הגורמים להפרעה במאזן חמצון ואנטי-חמצון, שעלולה לגרום לאפופטוזיס בתאי-אדם (Mori וחב' ב-Mol Biol Int משנת 1996). בנוסף, dihydroneopterin 7,8 נמצא יעיל בשפעול של גורמי-שעתוק הרגישים ל-redox, ובהשריה של ביטוי הגן HIV-1. נאופטרין ו-dihydroneopterin 7,8 משרים של אפופטוזיס שלא בתווך של NO (Schobersberger וחב' ב-FEBS Lett משנת 1996).
במערכת in vitro, מגביר dihydroneopterin 7,8 את ה-lag time של חמצון LDL בתיווך יוני ++Cu. כמו כן, dihydroneopterin 7,8 מעכב את החמצון של חומצה לינולאית, הנעשה בתיווך של AAPH או 2-amino propane dihydrochloride. הקינטיקה של עיכוב זה מעידה על כך ש-dihydroneopterin 7,8 הוא נוגד חמצון רב-עוצמה המתפקד על ידי קליטה של רדיקלים של lipid peroxyl (Gieseg וחב' ב-Free Radic Res משנת 1995). נאופטרין מעודד ביטוי של הגן של NOS (או nitric acid synthetase) בתאי שירי חלק וסקולריים in vitro, כאשר הסבר אפשרי להשפעת נאופטרין על הגן iNOS הוא בכך שנאופטרין משפעל את הטרנסלוקציה של תת-היחידות של NF-κB לתוך גרעין התא על ידי מודולציה של ה-redox התוך-תאי (Hoffmann וחב' ב-FEBS Lett משנת 1996). פוטנציאל ההגברה של נאופטרין מחומצן בהשריית ציטוטוקסיות של גל אולטרה-סגול ארוך (UV-A), נבחן in vitro על תאי מלנומה (B-16) בעכברים. תוצאה זו מצביעה על כך שהגברת הטוקסיות של H2O2 בתיווך נאופטרין, יכולה לשמש לניצול הצורה המחומצנת של נאופטרין כמגבירה של UV-A בטיפול בגידולים סרטניים (Kojima וחב' ב-Anticancer Res משנת 1995). יתרה מכך, נאופטרין עשוי להשפיע בהגברת רמת סידן במונוציטים של אדם, על כל המשתמע מכך.
רמות נאופטרין באנשים בריאים
רמות נאופטרין הנמדדות בנסיוב בשיטות RIA או HPLC הן עקביות. Werner וחב' דיווחו בשנת 1987 ב-Clin Chem על מדידת ריכוזי נאופטרין בשיטת RIA ב-662 אנשים בריאים בטווח הגילים של 1–97 שנים, כאשר הגיל הממוצע היה 22 שנים. ממצאי מחקר זה הם שבשלוש קבוצות גיל, נמצאו הבדלים משמעותיים ברמות נאופטרין (p<0.0001), אך לא נמצאו הבדלים ברמות אלה בין גברים ונשים (0.05p<). בנבדקים בגילים שבין 18–75 שנה לא נמצאו הבדלים משמעותיים ברמת נאופטרין, לעומת זאת, בילדים מתחת גיל 18 שנה ובקשישים מעל גיל 75 שנה, רמות נאופטרין היו משמעותית גבוהים יותר מאשר בקבוצת גילאי הביניים. במחקר נוסף של אותם חוקרים, נדגם דם מ-1,837 תורמי-דם בריאים בגיל של 18–67 שנים, ובאלה נמצאה רמת נאופטרין ממוצעת של ±0.441.47 ננוגרם/מ"ל, בנשים בריאות בהיריון, יש מתאם משמעותי בין העלייה ברמת נאופטרין ו-kynunerine והירידה ברמת טריפטופן (Fuchs וחב' ב-Adv Exp Med Biol משנת 1996).
יישום של מדידות neopterin לניטור התגובה לטיפול במחלות מידבקות
- HIV בדגימת דם או ב-CSF רמה ממוצעת של 15.6 ננוגרם/מ"ל נאופטרין בחולים מטופלים, לעומת 22.3 ננוגרם/מ"ל בחולים שאינם מטופלים (Fuchs וחב' ב-Crit Rev Clin Lab Sci משנת 1992, Fuchs וחב' ב-AIDS משנת 1989, Yilmaz וחב' ב-J Neuroinflamm משנת 2013, Hagberg וחב' ב-AIDS Res Ther משנת 2010)
- נגיף הפטיטיס C- בדגימת דם שיעור התגובה לטיפול גבוהה פי-2 במטופלים עם רמות נאופטרין שלפני הטיפול הנמוכה מ-16 ננומול/ליטר, בהשוואה למודבקים עם נגיף זה עם רמת נאופטרין הגבוהה מ-16 ננומול/ליטר לפני הטיפול (Oxenkrug וחב' ב-Hepatitis Res Treatment משנת 2012)
- Mycobacterium tuberculosis בדגימות דם ו-CSF, רמות נאופטרין ירדו במדידות שלו פעמיים בשבוע במטופלים עם שחפת ריאתית המטופלים, וצנחו מאוד לאחר 10 שבועות של טיפול ב-60% מהמטופלים (Fuchs וחב' ב-Lung משנת 1984, Hosp וחב' באותו כתב עת משנת 1997, ו-Turgut וחב' ב-Tohoku J Exp Med משנת 2006)
- Plasmodium falciparum- דגימת שתן. כאשר התסמינים הקליניים התפוגגו תוך 3–7 ימים של טיפול, רמות נאופטרין עברו נורמליזציה במהירות (Wachter וחב' ב-Adv Clin Chem משנת 1989)
- Schistosoma mansoni – בדגימת דם. רמות נאופטרין בנסיוב עברו נורמליזציה עם הטיפול (Zwingenberer וחב' ב-Acta Tropica משנת 1988)
מחלות הכרוכות ברמות מוגברות של נאופטרין
רמות מוגברות של נאופטרין ושל דיהידרונאופטרין נמצאות בנסיוב, ב-CSF ובשתן של מטופלים עם מגוון רחב של מפגעים סרטניים ולא-סרטניים, בהם יש שפעול של מערכת החיסון התאי (Wechter וחב' ב-Biochem Clin Asp Pteridines משנת 1985, ו-Scott וחב' ב-Folates & Pterins משנת 1986). רמות נאופטרין בנסיוב או בשתן הן בעלות ערך שווה למטרות אבחוניות כל עוד תפקודי הכליות תקיניים (Fuchs וחב' ב-Kidney Int Suppl משנת 1994). כיוון שרמות נאופטרין יכולות להיות מוגברות באופן ניכר במספר מחלות, יש לבצע סדרת מדידות תקופתיות שלו, על מנת להתרשם ממהלך המחלה. כיוון שהפרשת נאופטרין תלויה בשפעול של מקרופאגים, הפרשה זו כרוכה במגוון של מצבים הקשורים לחסינות תאית (Fuchs וחב' ב-Crit Rev Clin Lab Sci משנת 1992).מדידה של רמות נאופטרין הוא אינדיקטור שימושי מוקדם לסיבוכים של מושתלים עם allografts כגון כליות, כבד, לבלב או לב, דחיית השתל מסתמנת כאשר רמות נאופטרין בשתן מוגברות (Margreiter וחב' ב-Transplantation משנת 1983), או שהן מוגברות בנסיוב (Schafer וחב' ב-Transplantation משנת 1986, Mueller וחב' ב-Transpl Int משנת 1996, ו-Platz וחב' ב-Transplantation משנת 1996). עליית רמת נאופטרין בנוזלי הגוף השונים מתחילה להיות מורגשת בממוצע יומיים לפני הופעת שינויים קליניים מחשידים. שינויים דומים ברמות נאופטרין מתרחשים גם במטופלים לאחר השתלת מח עצם (Niederwieser וחב' ב-Transplantation משנת 1984).
רמות NO ונאופטרין בשתן מוגברות משמעותית בתינוקות הניזונים מהנקה, כאשר הנשים המיניקות הכילו בשדיהן שתלי סיליקון, בהשוואה לנשים לא מושתלות. במחקר זה נמצא גם יחס של מתאם הופכי בין הפרשת נאופטרין בשתן וחומרת מפגעי תפקוד של הוושט. באופן כללי, הדבקות נגיפיות כגון הפאטיטיס, rubella, ומספר סוגי הרפס, EBV, ונגיף ציטומגלו, מלווים על ידי רמות נאופטרין גבוהות (Reibnegger וחב' ב-Biochem Clin Asp Pteridines משנת 1984). רמות מוגברות של נאופטרין מופיעות בפאזה החריפה של מחלת Kawasaki (על פי Pfleiderer וחב' באותו כתב-עת משנת 1987). רמות נאופטרין מוגברות מוצאים גם במטופלים בשלב מתקדם של טרשת נפוצה או במחלה עם relapses, לכן ניתן להשתמש במדד זה כעזר בהערכה של המרכיב הדלקתי של MS (על פי Giovani וחב' ב-Brain משנת 1997). בהדבקות שונות, רמות גבוהות של נאופטרין מתחילות בדרך כלל לרדת בשלב בו מופיעים נוגדנים כנגד הפתוגן, לדוגמה, בילדים לאחר חיסון עם תרכיב חי.
דרגת ההדבקה והפעילות של חיידקים (M. tuberculosis, M. laprae) או עם טפילי מלריה דוגמת פלסמודיום פלסיפרום או vivax), תואמות באופן משמעותי עם הרמות המוגברות של נאופטרין (Fuchs וחב' ב-Lung משנת 1984, ו-Reibnegger וחב' ב-Trans Soc Trop Med Hyg משנת 1984). ככל שרמות נאופטרין גבוהות יותר, כך הפרוגנוזה גרועה יותר במטופלים עם ספטיסמיה או במושתלים, במהלך הדבקה עם נגיף ציטומגלו. רמות מוגברות של נאופטרין, נמצאו גם כן ב-CSF של מטופלים זיהומים מוחיים ובמקרים מסוימים של MS. מדידת רמות נאופטרין ב-CSF עשויות להיות מועילות בהבדלה בין דיסטוניה מורשת מתקדמת המגיבה ל-L-dopa, לבין מחלת פרקינסון של הגיל הצעיר עם דיסטוניה (Furukawa וחב' ב-Ann Neurol משנת 1996).
במחלות אוטו-אימוניות אגרסיביות, כמו RA (Hannonen וחב' ב-Scand J Rheumatol משנת 1986, ו-Reibnegger וחב' ב-Arthritis Rheum משנת 1986), מחלת קרוהן (Prior וחב' ב-Clin Chim Acta משנת 1986), תירואידיטיס אוטו-אימונית (Schwedes וחב' ב-Acta Endocrinol משנת 1986), קוליטיס כיבית (Niederwieser וחב' ב-Immunobiol משנת 1985), לופוס (Samsonov וחב' ב-Lupus משנת 1995), והופעה מוקדמת של סוכרת אוטו-אימונית (Manna וחב' ב-Biochem Clin Asp of Pteridines משנת 1987), רמות נאופטרין נמצאו הגבוהות ביותר בפאזה החריפה של המחלה, ועומדות ביחס ישר לפעילות המחלה. ב-RA ניתן לגלות נאופטרין גם בנוזל הסינוביאלי (Maerker-Alzer וחב' ב-Rheumatol Int משנת 1986). מתאם דומה קיים גם במטופלים עם sarcoidosis (על פי Lacronique וחב' ב-Am J Resp Dis משנת 1986) ובילדים עם מחלת צליאק (Fuchs וחב' ב-Lancet משנת 1983).
במספר מחלות ממאירות, בגידולים המטולוגיים וגינקולוגיים (Reibnegger וחב' ב-Cancer Res משנת 1986), בגידולים של מערכת השתן בגברים (Aulitzky וחב' ב-Cancer משנת 1985), בסרטן בילדים (Reibnegger וחב' ב-Tumor Diagnost Ther משנת 1985), ובסרטן ריאות (Conrad וחב' ב- Biochem Clin Asp of Pteridines משנת 1987), רמות גבוהות של נאופטרין כרוכות באופן משמעותי עם פרוגנוזה גרועה. בחולי מלנומה יש עלייה בולטת בהפרשת נאופטרין, אך בניגוד לכך בחולי הודג'קין מוצאים ירידה בולטת בהפרשת נאופטרין. רמת אינטרפרון-γ בפלזמה וזו של נאופטרין בשתן, נמצאו מוגברים משמעותית בחולי סרטן (Melichar וחב' ב-Tumori משנת 1996). מספר מחקרים מצאו רמות מוגברות של נאופטרין בנשאי HIV (Perna וחב' ב-Lancet משנת 1985, Abita וחב' באותו כתב עת מאותה שנה, Lambin וחב' באותו כתב עת מאותה שנה ו-Wachter וחב' ב-Hoppe Seyler's Z Physiol Chem משנת 1983). רמות נאופטרין מוגברות מוצאים גם בפרטים עם נוגדנים כנגד HIV בהיותם עדיין א-תסמיניים. באוכלוסייה כפרית באפריקה, רמות מוגברות של נאופטרין נמצאות גם בפרטים לכאורה בריאים מבחינת ההדבקה ב-HIV, אך נושאים בחובם טפילים בשלב קדם-קליני. קיים מתאם משמעותי בין רמות נאופטרין לבין דרגת ההדבקה ב-HIV על פי מדרג הרכז הרפואי Walter Reed (Fuchs וחב' ב-Ann Intern Med משנת 1987).
הוראות לביצוע הבדיקה
יש ליטול דם במבחנה כימית (פקק אדום או צהוב), ולאחר סרכוז יש להקפיא מיד את הנסיוב ולשלוח למעבדה קפוא ובעיקר עטוף בנייר אלומיניום להגנה מפני חשיפה לאור. סיבות לפסילת הדגימות, נסיוב לא קפוא או מבחנה לא מוגנת מאור. דגימה מוקפאת יציבה למשך 180 יום, ואילו דגימה מקוררת יציבה למשך 72 שעות. יש להימנע מהפשרות והקפאות. מדידת נאופטרין מתבצעת בשיטת EIA (enzyme immunoassay ), ELISA, או על ידי HPLC. לנאופטרין יש פלואורסצנציה טבעית עם אקסיטציה באורך גל של ננומטר, ואמיסיה באורך גל של 438 ננומטר 353, וכך ניתן לזהותו בפלואורומטר. הפעילות הכימית של נאופטרין ושל נגזריו המחוזרים, ניתנת למדידה בדיוק סביר. דגימות נסיוב ושתן המשוגרות למעבדה חייבות להיות קפואות, שכן כדגימות מקוררות או אלה בטמפרטורת החדר, יש התמרה של נאופטרין לנגזרות כגון dihydroxyanthropterin, xanthopterin ו-ptrerin. בהקפאה נשמרת צורת הנאופטרין, ואין השפעה על ריכוזיו. יתרה מכך, מחקר שהשתמש בדגימות טריות של דם או שתן, הדגים שהיחס בין נאופטרין לבין סך-נאופטרין (neopterin פלוס dihydroneopterin 7,8) נשמר בעל ערך קבוע בשני נוזלי הגוף הנחקרים (Levine ו-Milstien ב-Aspects of pteridines משנת 1984).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק