נוהל לניסויים רפואיים בבני-אדם - תוכן הבקשה לניסוי רפואי
מתוך ויקירפואה
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
|
| ||
|---|---|---|
| נוהל לניסויים רפואיים בבני-אדם - חוזר משרד הבריאות | ||
| תחום | מנהל רפואי | |
| מספר החוזר | נוהל מס' 14, עדכון 2016 | |
| סימוכין | נכתב בהתאם לתקנות בריאות העם (ניסויים רפואיים בבני אדם) התשמ"א 1980 | |
| קישור | באתר משרד הבריאות | |
| תאריך פרסום | 1 בפברואר 2016 | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – זכויות החולה
בקשה לניסוי קליני תכיל טפסים, פרוטוקול ניסוי וכן מסמכים נלווים נוספים כגון חוברת לחוקר, מידע על תהליך הייצור ואיכות המוצר וספרות תומכת, בהתאם לסוג הניסוי ומאפייניו.
סוגי הניסויים הם: ניסוי בתכשיר רפואי; ניסוי באמ"ר; ניסוי בתרפיות מתקדמות; ניסוי גנטי; ניסוי ללא מוצר מחקר; ניסוי משולב; מחקר בנתונים קיימים ושאלונים[1].
לכל סוג של ניסוי קיימת חבילת הגשה נפרדת, כמפורט בטבלה להלן.
| סוג ניסוי / מסמכים |
תכשיר | אמ"ר | תרפיות מתקדמות | גנטי[2] | ללא מוצר מחקר | משולב [3] | מחקר בנתונים קיימים ושאלונים |
| חבילת הגשה מסוג | א | ב | ג | ד | ה | ו | |
| טופס בקשה (1) | 1א | 1ב | 1ג | 1ד | 1ה | 1 | 1ו |
| טופס הסכמה - משתתף (2) | 2א | 2ב | 2ג | 2ד | 2ה | 2 | 2ו |
| טופס הסכמה - אפוטרופוס (3) | 3א | 3ב | 3ג | 3ד | 3ה | 3 | 3ו |
| התחייבות יזם הניסוי (4) | 4א | 4ב | 4ג | 4ד | 4ה | 4 | |
| הצהרת היזם לגבי זהות המסמכים | 5 | 5 | 5 | 5 | 5 | 5 | |
| רשימת מסמכים | 9 | 9 | 9 | 9 | 9 | 9 | 9 |
| מודעת גיוס משתתפים | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
| מכתב לרופא משפחה מטפל | 11 | 11 | 11 | 11 | |||
| פרוטוקול ניסויי | סעיף 3.2.1 | סעיף 3.2.2 | סעיף 3.2.3 | סעיף 3.2.4 | סעיף 3.2.5 | סעיף 3.5.4 | סעיף 3.2.6 |
| חוברת לחוקר | סעיף 3.3.1 | סעיף 3.3.2 | סעיף 3.3.3 | לכל מוצר | |||
| איכות המוצר | סעיף 3.4.2 | סעיף 3.4.2 | סעיף 3.4 | ||||
| ספרות רלוונטית | סעיף 3.3.4ב | סעיף 3.3.4ב | לפרוצדורות | סעיף 3.3.4ב |
- הערות
- יש לעיין בדברי ההסבר של חבילת ההגשה לפני מילוי הטפסים.
- בבקשות המוגשות לוועדת הלסינקי, הטפסים, פרוטוקול הניסוי, חוברת לחוקר, תיק איכות המוצר והספרות התומכת ייכרכו כל אחד בנפרד, למעט בקשות שאינן עולות על 40 עמודים.
- בקשות הנדרשות לאישור הוועדה העליונה ייכרכו בתיקיה חצי שקופה.
- טפסים
- טופס בקשה (טופס 1):
הטופס מכיל את פרטי מגיש הבקשה, פרטי מוצר המחקר, תקציר פרוטוקול הניסוי (בעברית), הצהרת החוקר הראשי ודף חתימות. - טופס הסכמה מדעת לבגירים (טופס 2);
טופס הסכמה מדעת להורים / לאפוטרופוס (טופס 3):
טופס הסכמה מדעת מורכב מחלק קבוע שבא לעגן את זכויות המשתתף וחלק משתנה שמכיל את תמצית המידע על הניסוי הרפואי כפי שנמסר למשתתף, בהתאם לסעיפים 2.4 ו-2.5 לעיל; חתימות של החוקר המסביר, המשתתף / אפוטרופוס. החתימות צריכות להיות מתוארכות. תוכנו של הטופס ייכתב בשפה תקנית, ברורה ובהירה המובנת לכל אדם ובשפתו של המשתתף, במידת האפשר.
במחקרים גנטיים, לטופס הסכמה מדעת יצורפו דפי הסבר למשתתף על המחקר, כחלק בלתי נפרד מהליך קבלת ההסכמה. דפי ההסבר יינתנו למשתתפים בטרם יחתמו על טופס ההסכמה מדעת על מנת לאפשר להם להתייעץ עם גורמים נוספים, להפנות שאלות ולקבל תשובות. - טופס התחייבות היזם (טופס 4):
הטופס מכיל את חובות יזם הניסוי. היזם יחתום על התחייבות זו והחוקר הראשי יאשרה בחתימתו. התחייבות זו תצורף גם להסכם של היזם עם החוקר הראשי / המוסד הרפואי. במקרה של יזם-חוקר, הוא יחתום על התחייבות זו ומנהל בית החולים, או מי שהסמיכו, יאשרה בחתימתו. - טופס הצהרת היזם או נציגו בארץ (טופס 5)[4]: הצהרה לגבי זהות המסמכים המוגשים לוועדת הלסינקי.
- רשימת המסמכים - CHECK LIST (טופס 9)[4]:
החוקר הראשי ימלא ויאשר בחתימתו את רשימת המסמכים אותם הוא מגיש לוועדת הלסינקי של המוסד הרפואי. - מודעת גיוס משתתפים (טופס 10):
החוקר יצרף למסמכי הבקשה נוסח של מודעת גיוס משתתפים למחקר הרפואי. אם החוקר מבקש לחרוג מנוסח זה, עליו לבקש אישור לכך מוועדת הלסינקי המוסדית. במקרים בהם גיוס המשתתפים אינו נעשה ע"י מודעות גיוס, ועדת הלסינקי רשאית לפטור מהגשת מסמך זה. - מכתב לרופא המשפחה בקופת חולים (טופס 11):
במקרים בהם הניסוי הרפואי כרוך בביצוע בדיקות רפואיות או באספקת תכשירים, אביזרים או משתלים, החוקר ימלא טופס זה וידאג להעברתו לרופא המשפחה. - מסמכים נוספים (לפי דרישת הוועדה המוסדית):
- החוקר יוסיף מסמך עדכני של קורות חיים לחבילת המסמכים, למעט במקרים בהם ועדת הלסינקי פוטרת אותו מכך.
- החוקר יוסיף תיעוד על הכשרה ב-GCP.
- במקרה של מחקר הנעשה במסגרת לימודים אקדמיים, יצורף לבקשה אישור המוסד האקדמי על כך שהמחקר מתבצע במסגרת לימודים. האישור יכלול את שם מנחה המחקר.
- טופס בקשה לשינויים (טופס 12)
החוקר יגיש טופס זה בהתאם לדרישות הוועדה ו/או משרד הבריאות. טופס זה משמש לריכוז שינויים במסמכי הבקשה הן לפני מתן האישור והן לאחריו.
- טופס בקשה (טופס 1):
- פרוטוקול הניסוי
פרוטוקול הניסוי הוא מסמך המתאר את תכנית המחקר ויכלול את הנושאים המפורטים בהנחיות הנהלים הבינלאומיים.- פרוטוקול של ניסוי רפואי בתכשיר
- דף כותרת המכיל את הפרטים הבאים:
כותרת הפרוטוקול, סימון, תאריך וגרסה;
שם וכתובת יזם המחקר ונציגו בארץ;
שם ותפקיד החותם על הפרוטוקול; - תקציר הפרוטוקול (SYNOPSIS).
- רקע ורציונל הניסוי הרפואי, כולל סקירת ספרות מדעית וביבליוגרפיה.
- שם ותיאור התכשיר, ההתוויות הקליניות וסיכום הידע הפרה-קליני והקליני הקיים לגביו.
- מטרות הניסוי הרפואי.
- מדדים לפיהם תוערכנה התוצאות (ENDPOINTS).
- סך כל המשתתפים, ומספר המרכזים המתוכננים להשתתף, מספר הפאזה ומתכונת הניסוי הרפואי - פתוח, סמוי וכד'.
- אופן גיוס המשתתפים לניסוי הרפואי.
- קריטריונים להכללה, לאי-הכללה ולהפסקת השתתפות בניסוי הרפואי.
- תכנית הטיפול בתכשיר (כולל: מינון, דרך מתן, משך הטיפול ומספר הטיפולים).
- תכנית המעקב הקליני.
- לוח זמנים ו/או תרשים זרימה של הניסוי.
- בדיקות מעבדתיות וכל בדיקה רלוונטית אחרת האמורות להתבצע במהלך הניסוי ובתקופת המעקב.
- אם רלוונטי: איסוף, אחסון, בדיקת הדגימות הביולוגיות ואופן הטיפול בהן בתום המחקר.
- הוראות בדבר דרכי השמירה על פרטיות המשתתפים וסודיות המידע שנאסף.
- תנאים להפסקת הניסוי הרפואי.
- שיטות להערכת בטיחות התכשיר ואופן הדיווח על תופעות לוואי רציניות (הדיווח יהיה בהתאם לכללי נוהל זה).
- שיטת ניתוח ועיבוד תוצאות.
- סוגיות אתיות של הניסוי.
- דוגמאות של CASE REPORT FORMS (לפי הצורך).
- בדיקות קליניות, שאלונים (לפי הצורך).
- דף כותרת המכיל את הפרטים הבאים:
- פרוטוקול של ניסוי רפואי באמ"ר
- דף כותרת המכיל את הפרטים הבאים:
כותרת הפרוטוקול, סימון, תאריך וגרסה;
שם וכתובת יזם המחקר ונציגו;
שם ותפקיד החותם על הפרוטוקול; - תקציר הפרוטוקול (SYNOPSIS).
- רקע ורציונל הניסוי הרפואי, כולל סקירת ספרות מדעית וביבליוגרפיה.
- שם היצרן, שם הדגם, העזרים הנלווים, מספר מזהה של גרסת התוכנה ואופן השימוש בניסוי.
- שם ותיאור קצר של האמ"ר, ההתוויות הקליניות וסיכום הידע הפרה-קליני והקליני הקיים לגביו.
באמ"ר מוכר - פירוט ההתוויות המאושרות ואופן השימוש. - תיאור החומרים הבאים במגע עם הגוף.
- מטרות הניסוי הרפואי.
- מדדים לפיהם תוערכנה התוצאות (ENDPOINTS).
- סך כל המשתתפים, ומספר המרכזים המתוכננים להשתתף ומתכונת הניסוי הרפואי - פתוח, סמוי וכד'.
- אופן גיוס המשתתפים לניסוי הרפואי.
- קריטריונים להכללה, לאי-הכללה ולהוצאה מהניסוי הרפואי.
- תכנית הטיפול באמ"ר (כולל: אופן השימוש, משך הטיפול ומספר הטיפולים).
- תכנית המעקב הקליני.
- לוח זמנים ו/או תרשים זרימה של הניסוי.
- בדיקות מעבדתיות וכל בדיקה רלוונטית אחרת האמורות להתבצע במהלך הניסוי ובתקופת המעקב.
- אם רלוונטי: איסוף, אחסון, בדיקת הדגימות הביולוגיות ואופן הטיפול בהן בתום המחקר.
- דף כותרת המכיל את הפרטים הבאים:
- הוראות בדבר דרכי השמירה על פרטיות המשתתפים וסודיות המידע שנאסף.
- תנאים להפסקת הניסוי הרפואי.
- שיטות להערכת בטיחות ואופן הדיווח על תופעות לוואי רציניות (הדיווח יהיה בהתאם לכללי הנוהל).
- שיטת ניתוח ועיבוד תוצאות.
- RISK ANAYLSIS.
- סוגיות אתיות של הניסוי.
- דוגמאות של CASE REPORT FORMS (לפי הצורך)
- בדיקות קליניות, שאלונים (לפי הצורך).
- פרוטוקול של ניסוי רפואי בתרפיות מתקדמות
הפרוטוקול יהיה דומה לזה של ניסוי רפואי בתכשיר (סעיף 3.2.1 לעיל). ב-2 תת-הסעיפים הבאים של הפרוטוקול יש להרחיב כמפורט להלן:- שם ותיאור המוצר; בין היתר, יש להתייחס (אם רלוונטי) ל-
- מקור התאים והליך הסכמה מדעת של התורם.
- מספר התאים שניתן להזריק לחולה וחיותם בזמן ההזרקה.
- במוצר רפואי לטיפול גני: מידע על viral shedding ואמצעי זהירות הנדרשים לגבי המוצר.
- תכנית המעקב הקליני, תוך התאמה למאפייני המוצר.
- שם ותיאור המוצר; בין היתר, יש להתייחס (אם רלוונטי) ל-
- פרוטוקול של ניסוי גנטי
דף כותרת המכיל את הפרטים הבאים:
כותרת הפרוטוקול, סימון, תאריך וגרסה;
שם וכתובת יזם המחקר ונציגו;
שם ותפקיד החותם על הפרוטוקול;- מטרות הניסוי.
- הרקע המדעי, הרציונל לביצוע הניסוי וסקירת ספרות מדעית (בקצרה).
- הנמקה בצורך בניסוי, שכולל איסוף ו/או אחסון ו/או בדיקת DNA.
- לוח זמנים למחקר.
- מידע על משתתפי הניסוי.
- איסוף, אחסון ובדיקת דגימות DNA.
- המידע הגנטי.
- זכויות המשתתפים.
- הערה:
- כלל המידע הנדרש בפרוטוקול הניסוי הגנטי מפורט בנספח 6 (חלק ב) בנוהל זה.
- פרוטוקול של ניסוי רפואי ללא מוצר מחקר
- דף כותרת המכיל את הפרטים הבאים: כותרת הפרוטוקול, סימון, תאריך וגרסה; שם וכתובת יזם המחקר ונציגו; שם ותפקיד החותם על הפרוטוקול;
- רקע ורציונל המחקר הרפואי, כולל סקירת ספרות מדעית וביבליוגרפיה.
- מטרות המחקר הרפואי.
- מדדים לפיהם תוערכנה התוצאות (ENDPOINTS).
- מספר המשתתפים, ומספר המרכזים המתוכננים להשתתף במחקר.
- אופן גיוס המשתתפים.
- קריטריונים להכללה ולאי-הכללה במחקר.
- לוח זמנים של המחקר.
- שיטות והליך המחקר.
- אם רלוונטי: איסוף, אחסון, בדיקת הדגימות הביולוגיות ואופן הטיפול בהן בתום המחקר.
- הוראות בדבר דרכי השמירה על פרטיות המשתתפים וסודיות המידע שנאסף.
- אם רלוונטי: בדיקות מעבדתיות וכל בדיקה רלוונטית אחרת האמורות להתבצע במהלך המחקר ובתקופת המעקב, ומקום הביצוע של הבדיקות.
- שיטת ניתוח ועיבוד תוצאות.
- סוגיות אתיות של הניסוי.
- פרוטוקול של מחקר רפואי בנתונים קיימים או בשאלונים
- דף כותרת המכיל את הפרטים הבאים:
כותרת הפרוטוקול, סימון, תאריך וגרסה;
שם וכתובת יזם המחקר ונציגו;
שם ותפקיד החותם על הפרוטוקול; - רקע ורציונל המחקר הרפואי, כולל סקירת ספרות מדעית וביבליוגרפיה.
- מטרות המחקר הרפואי.
- מדדים לפיהם תוערכנה התוצאות (ENDPOINTS).
- מספר המשתתפים, ומספר המרכזים המתוכננים להשתתף במחקר.
- אופן גיוס המשתתפים.
- קריטריונים להכללה ולאי-הכללה במחקר.
- לוח זמנים של המחקר.
- שיטות והליך המחקר.
- הוראות בדבר דרכי השמירה על פרטיות המשתתפים וסודיות המידע (נתונים שנאסף.
- שיטת ניתוח ועיבוד תוצאות.
- סוגיות אתיות של המחקר.
- דף כותרת המכיל את הפרטים הבאים:
- פרוטוקול של ניסוי רפואי בתכשיר
- חוברת לחוקר
- חוברת לחוקר הוא מסמך המתאר את המידע העדכני על מוצר המחקר בהתאם להנחיות הנהלים הבינלאומיים.
- חוברת לחוקר נדרשת למוצר מחקר שאינו רשום.
- חוברת לחוקר של ניסוי רפואי בתכשיר כמפורט בנוהל הבינלאומי (ICH-GCP)
- דף כותרת הכולל: שם ו/או קוד מוצר המחקר, תאריך ומספר מהדורה / גרסה, פרטי יזם המחקר.
- תוכן העניינים.
- מבוא הכולל רציונל מדעי.
- נתונים פיזיקליים, כימיים ופרמצבטיים של התכשיר המוגמר, נשוא הניסוי.
- נתונים פרה-קליניים: פרמקולוגיה, פרמקוקינטיקה, פרמקודינמיקה, פרמקולוגיה לבטיחות, טוקסיקולוגיה.
- נתונים קליניים עדכניים.
- סיכום הנתונים, סיכום הסיכונים הצפויים למשתתף והוראות שימוש במוצר המחקר.
- הפניות (References) לפרסומים ולדוחות וצירופם במקומות הרלוונטיים.
- חוברת לחוקר של ניסוי רפואי באמ"ר כמפורט בנוהל הבינלאומי (14155 ISO)
- דף כותרת הכולל: פרטי יזם המחקר, שם ו/או קוד האמ"ר, מספר / שם הדגם, גרסת התוכנה, פרטי היצרן, תאריך ומספר מהדורה, פרטי יזם המחקר.
- תוכן העניינים.
- מבוא הכולל רקע ורציונל לשימוש המיועד של האמ"ר בניסוי ולפיתוח הטכנולוגיה (תקציר).
- מידע טכני על האמ"ר, לרבות:
- תיאור כללי של האמ"ר, העזרים הנלווים ומרכיביהם הפעילים, בציון הדגמים; מספר הגרסה של התוכנה (אם יש). התיאור יכלול סכימות ו/או תמונות של האמ"ר.
- מידע לגבי החומרים מהם עשוי האמ"ר והתאמתם לייעודם. (כל אמ"ר נדרש לעמידה בדרישות לביוקומפטיביליות לפי תקן 10993 ISO).
- אם האמ"ר מחדיר או מוציא אנרגיה לגוף או ממנו - סוג האנרגיה, תיאורה וכמותה במדדים פיזיקליים, קצב זרימתה.
- אם מוחדרים לגוף חומרים או מוצאים ממנו - תיאורם, תיאור הכמויות, תיאור קצב זרימתם. במקרה של איזוטופים - כמות הקרינה שמקבל המשתתף בניסוי הרפואי, והתייחסות לתקנים מקובלים.
- אם האמ"ר הוא מכשיר מדידה - יפורטו הפרמטרים הנמדדים ומידת הדיוק.
- בכל מקרה של אמ"ר שהוא תוכנה, או שמובנית בתוכו תוכנה, יצוינו פרטים מזהים של הגרסה: תיאור קצר של האלגוריתם, לרבות תרשים זרימה ברמת פונקציות ורוטינות ראשיות. יצורף אישור חתום של ולידציה. יוסבר כיצד מתמודדים (בתוכנה ו/או בחומרה) עם מצבים שבהם תקלה בתוכנה יכולה לסכן את המשתתף בניסוי.
- תיאור הפעולה הקלינית וההתוויות. בהתאם לצורך, הוראות היצרן בקצרה לשימוש / הפעלה / התקנה / אחזקה.
- במקרים בהם האמ"ר הוא שינוי / מודיפיקציה של "ציוד רפואי מוכר" או אמ"ר שאושר בעבר לניסוי קליני:
- שם האמ"ר המקורי (כולל הדגם), שם האמ"ר החדש (כולל הדגם) ושם היצרן.
- הסטטוס הרגולטורי של האמ"ר המקורי והחדש בצרוף אישורים.
- תיאור מפורט של השינוי באמ"ר.
- ההשלכות האפשריות של השינוי על הביצועים של האמ"ר, בטיחותו, יעילותו, אופן השימוש בו ופעולתו הקלינית.
- לפי הצורך, תצורפנה אסמכתאות מהספרות, הוכחות חישוביות ודיווח על ניסויים פרה-קליניים.
- תהליכי הייצור, לרבות:
- עמידה בתקני ISO לאמ"ר מסוגו.
- ולידציה של התהליכים.
- מידע לגבי הסטריליזציה, אם רלוונטי (שימוש חד-פעמי או שימוש חוזר, מקום ואופן הסטריליזציה), ועמידה בדרישות חוזר המנהל הכללי "הוראות לעיקור אביזרים ומכשור רפואי".
- ניסויים פרה-קליניים:
סיכום המחקרים הפרה-קליניים והתוצאות: ניסויי מעבדה וכן ניסויים בבעלי חיים הרלוונטיים להוכחת בטיחות של האמ"ר ויעילותו למטרה לה נועד. - ניסויים קליניים:
סיכום הניסיון הרפואי הקיים עם האמ"ר, לרבות ניסויים קודמים בבני-אדם, היסטוריה שיווקית ודיווח על אירועים חמורים חריגים בבני-אדם / תקלות באמ"ר. - אישורים רגולטורים: האישורים הרלבנטיים לפי רשימת התקנים (שם התקן, סמל / מספר, מחברו), הדרישות הרגולטוריות לפיהן תוכנן / נבנה / טופל / נבדק האמ"ר.
- RISK ANALYSIS.
- הפניות (References) לפרסומים ולדוחות וצירופם בסוף כל פרק.
- חוברת לחוקר בניסוי רפואי בתרפיות מתקדמות
החוברת תכלול סיכום של המידע העדכני על המוצר והוכחות התומכות ברציונל של הניסוי הקליני, בבטיחות וביעילות של המוצר:- דף כותרת הכולל: פרטי יזם המחקר, שם ו/או קוד מוצר המחקר, תאריך ומספר מהדורה / גרסה.
- תוכן העניינים.
- מבוא הכולל רציונל מדעי.
- פרטי היצרן (במקרים בהם היצרן הוא החוקר - יצוינו פרטי החוקר): שם, כתובת, מספר טלפון, מספר פקס, שם איש הקשר לנושא ניסויים רפואיים.
- אפיון המוצר, הכולל:
- תיאור ביולוגי של המוצר הסופי והספציפיקציות שלו, ייעודו הקליני (התוויה);
- מקור ותיאור התאים / הרקמה, כגון: אוטולוגי (ממקור עצמי), אלוגנאי (ממקור הומאני שאינו עצמי);
- הנחיות אחסון;
- דרך מתן ומינון;
- תהליך הייצור: תקציר של המידע על איכות המוצר והשלבים העיקריים של תהליך הייצור ואתר הייצור.
- נתונים פרה-קליניים: מנגנון פעולה, Bio-distribution וטוקסיקולוגיה.
- נתונים קליניים עדכניים.
- סיכום הנתונים, סיכום הסיכונים הצפויים למשתתף והוראות שימוש במוצר המחקר.
- מידע הנדרש במקרים של מוצר רשום
- יש להגיש מידע על כל מוצר המשמש בניסוי (כולל מוצר השוואתי).
- להלן המידע הנדרש במקום החוברת לחוקר:
- מחקרים בתכשירים ואמ"ר הרשומים בישראל
- הניסוי בתכשיר רשום המאושר לשיווק בישראל ומתייחס להתוויה הרשומה. במקרה זה יש להגיש עלון לרופא של התכשיר.
- ניסוי של זמינות ביולוגית השוואתית: לתכשיר ההשוואה (הרשום) יש לצרף עלון לרופא; לתכשיר הנבדק יש לצרף נתונים פיזיקליים, כימיים ופרמצבטיים של התכשיר.
- הניסוי נערך בציוד רפואי מוכר ו/או רשום בפנקס האמ"ר, ומתייחס להתוויה הרשומה; יש להציג אישורים הרלוונטים לאמ"ר מסוגו
- ניסוי בציוד רפואי מוכר ו/או רשום בפנקס האמ"ר ומתייחס להתוויה חדשה; יש לצרף תקציר של המידע הרלוונטי, בחוברת לחוקר, התומך בהתוויה הנבדקת.
- הניסוי נערך בציוד רפואי שאושר בעבר לניסוי קליני בישראל לאותה התוויה; החלטה על המידע הנדרש תתקבל לאחר התייעצות עם היחידה לניסויים קליניים באמ"ר.
- במחקרים בתכשירים ובאמ"ר רשומים בארץ, היזומים על-ידי החוקר, יש לצרף לבקשה פרסומים רלוונטיים - מאמרים מהספרות המקצועית התומכים ברציונל של הניסוי הרפואי.
- במחקרים בתכשירים שאינם רפואיים המותרים לשיווק בישראל - מזון, תוסף מזון, תכשיר הומיאופתי, או צמח מרפא, יש להגיש את המסמכים הבאים (בהתאם לתקנות תוספי תזונה של שרות המזון הארצי):
- תעודת אנליזה (הרכב המוצר) חתומה ממעבדה מוכרת - בישראל או בחו"ל.
- מונוגרף עבור כל אחד מהמרכיבים.
- מידע על פעילות כל מרכיב וכיצד תורם להתוויה המיועדת.
- אישורי GMP (מזון) ליצרן.
- ספציפיקציות של כל אחד מהמרכיבים והתחייבות לכך שהם נמצאים בטווח המוגדר בספציפיקציות.
- במחקרים בתכשירים קוסמטיים, יש להגיש את המידע והמסמכים הבאים:
- רשימת המרכיבים של הפורמולה למוצר הקוסמטי.
- הוראות שימוש במוצר הקוסמטי.
- ייעוד המוצר הקוסמטי (קרם פנים / גיל רחצה, האם נשטף וכוי).
- Risk Assessment of Toxicology
- שם יצרן / משווק.
- איכות ותנאי ייצור של מוצר המחקר
- תיק איכות בתרפיות מתקדמות
תיק איכות יוגש במתכונת Investigational Medicinal Product Dossier) IMPD) או במתכונת תואמת.
המידע הנדרש בפרקים השונים ב- IMPD הוא עפ"י הדרישות בהנחיות הרלוונטיות בהתאם לסוג המוצר) רוה מסמכים ישימים). - תנאי ייצור נאותים
- תכשירים
- על פי תקנות הרוקחים, תנאי ייצור נאותים לתכשירים תשס"ט- 2008, סעיף 18א וכן על פי נוהל ייצור וייבוא תכשירים ניסיוניים במדינת ישראל, העדכני, תקנות תנאי ייצור נאותים ( Good anufacturing Practice - GMP) יחולו על תכשירים ותרפיות מתקדמות ניסיוניות, בהתאמה להתקדמות שלבי הפיתוח והניסוי הקליני. לפיכך, בפאזה 1 ו-2 יש להמציא הצהרה על עמידה בתנאי ייצור נאותים.
- בפאזה 3 יש להמציא אישור GMP ממדינה מוכרת (עפ"י תקנות הרוקחים -תנאי ייצור נאותים לתכשירים) או, לחלופין, אישור GMP ישראלי בתכשיר המיוצר בישראל.
- בניסויים לא מסחריים, של יזם-חוקר:
- כאשר נדרשים תהליכים של אריזה, תיווי או ייצור מיוחד כולל סמיות, הללו יבוצעו באתר בעל אישור יצרן / יבואן.
- יש לצרף למסמכי הבקשה לוועדת הלסינקי את פירוט תהליכי הייצור (האריזה, הסמיות או התיווי) של מוצר המחקר ולציין את האתר בעל אישור יצרן / יבואן שבו יתבצעו תהליכים אלו.
- אמ"ר
- בהתאם לתקן 1SO13485 ו-1SO9001, יש לצרף אישור ISO לבקשות לניסויים בשלבי מחקר מתקדמים (המקבילים לפאזה 3 בתכשיר)
- תיק איכות בתרפיות מתקדמות
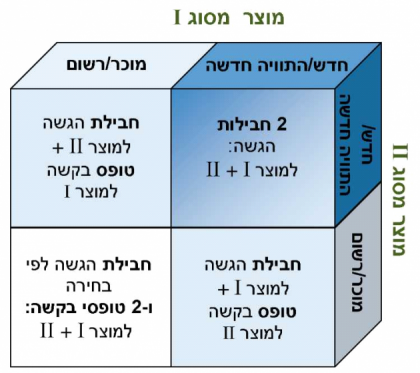
- ניסוי משולב
ניסוי משולב הוא ניסוי שבו נבדקים שניים או יותר סוגים של מוצרי מחקר, בהתאם לאפשרויות הבאות:- מוצרי מחקר נפרדים מסוגים שונים, לדוגמא: תכשיר ואמ"ר;
- מוצר מחקר אחד המורכב מכמה סוגי מוצרים, לדוגמא: סטנט המכיל תרופה.
- החוקר הראשי יבחר את חבילות המסמכים עליהן יגיש את בקשתו לוועדת הלסינקי בהסתמך על חדשנות מוצרי המחקר (ראו איור 1 המתאר דוגמא לשילוב 2 סוגים של מוצרי מחקר).
- בקוביה המודגשת באיור המתייחסת למחקר בו 2 מוצרי מחקר חדשים, יש למלא 2 חבילות הגשה מלאות כ"א עבור סוג מוצר מחקר.
- במקרים האחרים המתוארים באיור, יש למלא חבילת הגשה אחת לפי סוג מוצר המחקר החדש יותר.
- הערה: במקרה של ספק, ניתן להתייעץ מראש עם משרד הבריאות.
- בקשה אחת למחקר משולב תכיל את כל המסמכים הדרושים למחקר רגיל, בתוספת השינויים הבאים:
- טופס בקשה (טופס 1): לאחר בחירה של חבילת ההגשה יש למלא בטופס את פרטי כל המוצרים המשמשים במחקר (פרק "פרטי התכשיר/האמ"ר/המוצר" של טופס הבקשה לסוג המוצר הנוסף).
- טופס הסכמה מדעת (טופס 2 ו/או 3): יוגש טופס הסכמה אחד[5] שיכיל מידע על כל מוצרי / רכיבי המחקר. במקרה של חבילות נפרדות, טופס הסכמה יהיה זהה.
- טופס התחייבות היזם (טופס 4): טופס זה יורחב ויחול על כל מוצרי / רכיבי המחקר. היזם יחתום על התחייבות זו והחוקר הראשי יאשרה בחתימתו. התחייבות זו תצורף גם להסכם של היזם עם החוקר הראשי / המוסד הרפואי. במקרה של יזם-חוקר, הוא יחתום על התחייבות זו ומנהל בית החולים, או מי שהסמיכו, יאשרה בחתימתו.
- פרוטוקול הניסוי - מדובר במחקר אחד העושה שימוש במספר סוגים של מוצרי מחקר, לכן יוגש פרוטוקול ניסוי אחד. כל המסמכים בהם נכתבים פרטי הפרוטוקול יתייחסו למסמך אחד בלבד.
- יתר מסמכי הבקשה (חוברת לחוקר, תיק איכות מוצר וכולי) יהיו בהתאם לסוגי המוצרים ומידת החדשנות שלהם (למוצרים רשומים ראו סעיף 3.3.4).
- תת-מחקר גנטי של ניסוי רפואי בתכשיר
בקשה לתת-מחקר גנטי של ניסוי רפואי בתכשיר (ניסוי פרמקו-גנטי) תכיל את המסמכים הבאים:- טופס בקשה לניסוי גנטי (טופס 1ד).
- טופס הסכמה מדעת של הניסוי הגנטי.
- דפי הסבר למשתתף.
- פרוטוקול של ניסוי גנטי, כמפורט בסעיף 3.2.4 לעיל. הפרוטוקול יקבל מספר ייחודי שיורכב ממספר הפרוטוקול של המחקר הראשי + האותיות GN ויישא מס' גרסה ותאריך.
- מפרוטוקול הניסוי הרפואי בתכשיר - צילום של דף הכותרת ושל תקציר הפרוטוקול (SYNOPSIS).
- הערה כללית
משרד הבריאות / ועדת הלסינקי של המוסד הרפואי רשאים, כל אחד, לדרוש מסמכים או נתונים נוספים לאלה הנזכרים לעיל - במידת הצורך ולפי העניין.
הערות שוליים
- ↑ ראו פרק הגדרות בנוהל זה.
- ↑ מסמכים לתת-מחקר גנטי של ניסוי רפואי בתכשיר (ניסוי פרמקו-גנטי) - ראו בסעיף 3.6.
- ↑ בהתאם להחלטה של סוג החבילה, בהסתמך על חדשנות מוצרי המחקר - ראה סעיף 3.5.
- ↑ 4.0 4.1 אין חובה לשלוח טופס זה למשרד הבריאות. ועדת הלסינקי תקבע בנוהל העבודה אם לדרוש טופס זה.
- ↑ בהתאם לאוכלוסיית המחקר, יתכן ויוגשו שני טפסים, למשל טופס 2 וגם טופס 3.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק