נוהל מוצרים הומאופתיים - חוזר משרד הבריאות
|
| ||
|---|---|---|
| נוהל מוצרים הומאופתיים | ||
| תחום | תרופות, פרמקולוגיה קלינית , רפואה משלימה | |
| מספר החוזר | 10, עדכון מס' 7 | |
| תאריך פרסום | עודכן ב-10 באוגוסט 2014 | |
הנוהל שבנדון עודכן בשיתוף ובתיאום עם האיגוד לרפואת ילדים, האיגוד לפרמקולוגיה קלינית והחברה הישראלית לטוקסיקולוגיה במטרה להסדיר את תחום המוצרים ההומאופתיים בשורה של היבטים למען שמירה על בריאות הציבור והמטופלים.
- פרסום של מוצרים הומאופתיים
- ייעודם לתינוקות וילדים
- מעקב אחר תופעות לוואי
- בקרת איכות הכנות הומאופתיות
- הגברת בקרה ומסירת מידע לגבי תכשירים המיובאים ע"י בית מרקחת
- להלן העדכונים העיקריים
בהגדרות - תוספת הגדרת מעקב יזום אחר תופעות לוואי או חשד לתופעות לוואי
סעיף 3.1 - ייעוד תכשיר הומאופתי לתינוקות וילדים יחייב הגשת נתונים קליניים בתינוקות וילדים אשר ייבדקו במסגרת וועדה מקצועית.
סעיף 3.6 - תכשיר הומאופתי יאוחסן מאחורי דלפק הרוקח בנפרד מתרופות.
סעיף 3.7 - הוסף סעיף המחייב בעל אישור מוצר הומאופתי במעקב ודיווח תופעות לוואי או חשד לתופעות לוואי.
סעיף 3.7 – הוספו כללים להחזרה מהשוק של תכשיר הומאופתי.
סעיף 3.9 – הוספו קריטריונים לבדיקות יציבות, קביעת תאריכי תוקף של מיהולי ביניים והכנות מוגמרות. ניפוק, הובלה ומסירה של הכנה הומאופתית שהוכנה בבית-מרקחת אחר יהיה בהתאם לנוהל 128- נוהל שירותי הובלה ומסירת תכשירים מביתהמרקחת, זאת מלבד מרשם רופא עבור הכנות שאינן דורשות מרשם רופא.
סעיף 3.10 – מובהר כי אין לייחס סגולת ריפוי לתכשיר הומאופתי בפרסום לציבור הרחב בכל מדיה שהיא.
סעיף 3.11 – על אריזת תכשיר הומאופתי יופיע גם מספר האישור שלו.
סעיף 3.13 – שונו הדרישות לטיפות עיניים הומאופתיות באופן שידרוש בין השאר CPP של תרופה.
סעיף 3.15 – הוספו דרישות המחייבות את הרוקח לצרף מידע לתכשיר הומאופתי המיובא לבית מרקחת שלא עבר הליך אישור ע"פ הנוהל. כמו-כן, הוספו דרישות לתקינות אצווה עבור תכשירים המיועדים להזרקה. הוראת רופא QP להצהרת לשימוש בתכשיר הומאופתי שלא עבר הליך רישום תהיה באמצעות נספח 2 של הנוהל , בחתימת הרופא המטפל, הרוקח האחראי והרוקח המחוזי.
אישור היבוא יינתן ע"י אגף הרוקחות.
בברכה
ד"ר טל לביא
מנהל המחלקה לאבטחת איכות ובקרה רוקחית
- כותב העדכון
ד"ר טל לביא - מנהל המחלקה ליבוא פרמצבטיקה וסמים
מגר' אלי מרום - סגן מנהל אגף הרוקחות
דר' דורית דיל נחליאלי - מנהלת המחלקה לניהול סיכונים ומידע תרופתי
- מאשר העדכון
ד"ר איל שוורצברג - מנהל אגף הרוקחות
כללי
גישת משרד הבריאות לשימוש בתכשירים הומאופתיים מושתתת על העיקרון שהטיפול בתכשירים הומאופתיים אינו מהווה תחליף לטיפול הרפואי המקובל, וזאת בהתבסס על הקביעה כי יעילותם של התכשירים ההומאופתיים לא הוכחה בשיטות המקובלות ברפואה ולכן לא ניתן לרשמם כתכשיר רפואי על כל המשתמע מכך. ככל שתכשירים הומאופתיים נצרכים על ידי מטופלים ישנה חשיבות לעקוב אחר בעיות אפשריות שעלולות להיגרם מנטילתם בשל תקלות איכות ובטיחות וכחלק מניהול סיכונים הנגזר משימוש בהם.
בספטמבר 1996 נכנס לתוקף הנוהל לפיו הותרו לשווק תכשירים הומאופתיים מוגמרים בטיפות או גלובולים לשימוש פומי במיהולים המדוללים מעבר ל-D6. תכשירים אלה משווקים אך ורק בבתי מרקחת ללא חובת מרשם רופא. בנוסף מותר להכין הכנות הומאופתיות בבתי-המרקחת על-פי מרשמי רופאים, ועל-כן הותר הייבוא של חומרי גלם הומאופתיים / תרכיזים הומאופתיים.
במסגרת עדכון מספר 1 מספטמבר 1998 - הותרו לשווק בארץ גם תכשירים הומאופתיים מוגמרים בצורות מתן נוספות: אבקות ללקיחה דרך הפה, טיפות עיניים, טיפות אוזניים, טיפות אף, פתילות רקטליות, משחות ונוזלים לשימוש על פני העור. נקבע שהתכשירים ההומאופתיים המוגמרים יהיו במיהולים המדוללים מעבר ל-D4 (כולל) ויאושרו על-סמך הרשימות המופיעות בפרמקופיאות ההומאופתיות ובלבד שאינם טעונים מרשם רופא לפיהן. כמו-כן יילקחו בחשבון שיקולי בטיחות המבוססים על מידע ממקורות מהימנים אחרים.
עדכון מספר 2 - בא להרחיב את תחום התכשירים ההומאופתיים לשימוש חיצוני לתכשירים בריכוזים גבוהים יותר, ולהוסיף כללים לביצוע הכנות הומאופתיות והעברתן מבית-מרקחת אחד לאחר וכן לאפשר ייבוא חריג בכמות קטנה במקרים מיוחדים.
עדכון מספר 3 - בא לאפשר אישורם של תכשירים הומאופתיים לשימוש בבעלי חיים וניפוקם בבתי מרקחת או במקומות מורשים לניפוק תכשירים וטרינריים כמוגדר בתקנות הרוקחים (ניפוקם של תכשירים וטרינריים, התשמ״ט 1988) בהתאם לסוג בעל החיים לו התכשיר מיועד.
עדכון מספר 4 - בא להוסיף סימון אחיד לאריזות מוצרים הומאופתיים מוגמרים ולפרסומים למוצרים הומאופתיים, להבהיר כללי חישוב של ריכוזים סופיים של מרכיבים הומאופתיים וכללי תיעוד של ניפוק הכנות הומאופתיות.
עדכון מספר 5 - בא להבהיר מיהו מבקש אישור השיווק למוצר הומאופתי, להוסיף נתונים לצורך אישור של מוצרים הומאופתיים מוגמרים, להגביל את הריכוז של תכשיר הומאופתי מוגמר המיועד לשימוש חיצוני, לשנות תנאי השיווק של הכנות הומאופתיות בבית מרקחת ותנאי ייבוא חריג של מוצר הומאופתי על-ידי בית מרקחת.
עדכון מספר 6 - בא לאפשר לבעל אישור מוצר הומאופתי לייבא ולשווק מוצרים הומאופתיים עבורם קיבל אישור, באמצעות בית מסחר לתרופות שלא בבעלותו וכן להוסיף הוראה לצרכן להיוועץ ברופא או ברוקח במידה וסימני המחלה נמשכים או מוחמרים.
עדכון מספר 7 - בא להסדיר את נושא המעקב אחר תופעות לוואי בתכשירים הומאופתיים, פרסום וייעוד תכשירים הומאופתיים לתינוקות, מניעת פרסום סגולות ריפוי, החזרת מוצר הומאופתי מהשוק, ייבוא חריג של מוצר הומאופתי, דרישות איכות לגבי מוצרים הומאופתיים וכן תוקנו הדרישות עבור טיפות עיניים הומאופתיות.
הגדרות
- בית מרקחת - כהגדרתו בפקודת הרוקחים (נוסח חדש), התשמ"א - 1981.
- בעל אישור - תושב ישראל או תאגיד רשום בישראל שקיבל אישור שיווק מוצר הומאופתי לפי נוהל זה.
- חומר גלם הומאופתי - חומר המופיע בפרמקופיאה הומאופתית רשמית עדכנית של אחת המדינות הבאות (להלן: פרמקופאיה מוכרת): ארה"ב, אנגליה, גרמניה, צרפת (להלן: חומר גלם). חומר גלם הומאופתי יכול להיות חומר גלם ראשוני או תרכיז הומאופתי (תמיסת אם).
- מוצר הומאופתי - תכשיר הומאופתי או חומר גלם הומאופתי.
- מעקב יזום - מעקב פרואקטיבי של בעל אישור תוך יצירת קשר עם הרופא או בית המרקחת וכן קיום קו מידע למטופל באמצעותו ניתן לדווח על תופעת לוואי או חשד לתופעת לוואי.
- מרשם רופא - בהתאם לתקנות הרופאים (מתן מרשם) התשמ"א - 1981.
- פנקס הכנות הומאופתיות - ספר או מחברת או אוגדן או תוכנת מחשב שניתן לשנות רק כאשר כל שינוי בה יהיה ניכר.
- רוקח ממונה למוצר הומאופתי - בעל רישיון ישראלי לעסוק ברוקחות שמונה ע"י מבקש אישור ע"מ לייצג אותו בכל הנוגע לבקשת האישור למוצר הומאופתי והאחראיות לתוכנה.
- ריכוזים הומאופתיים - בספרות ההומאופתית מסומנים ריכוזים באופן הבא: ריכוז הומאופתי D4 מקביל למיהול של 1:10,000 (0.01%); ריכוז הומאופתי D6 מקביל למיהול של 1:1,000,000 ; ריכוז הומאופתי D8 מקביל ל - 1:108 וכן הלאה.
- תכשיר הומאופתי - מוצר הומאופתי מוגמר לשימוש באדם או בבעלי חיים, המכיל דילול של חומר גלם אחד או מספר חומרי גלם כפי שמופיע באחת הפרמקופיאות בסעיף 3 (להלן: התכשיר).
תוכן הנוהל
אישור
- מוצר הומאופתי יאושר לאחר שהוכחה בטיחותו. במקרים מסוימים יידרש מגיש הבקשה לצרף נתונים טוקסיקולוגיים לגבי התכשיר ההומאופתי בריכוז המוצע.
- תכשיר הומאופתי המיועד לשימוש מתחת לגיל שש לא יאושר אלא על בסיס נתונים קליניים ובטיחותיים המתייחסים לילדים. מוצרים שלא יעמדו בדרישות אלו, ייפסק שיווקם תוך שנה מתאריך פרסום נוהל זה.
- נתוני בטיחות ונתונים קליניים בילדים מתחת לגיל 6 יש לשלוח לאגף הרוקחות למנהל המחלקה לייבוא, והם ידונו בוועדה שתתכנס אד-הוק וחבריה יהיו: יו"ר - מנהל המחלקה לייבוא, מנהלת המחלקה לניהול סיכונים, נציג מחלקת רישום, נציג מחלקת ניסויים קליניים, ורופא ילדים שהוא פרמקולוג קליני.
- לא יאושרו מוצרים לתינוקות המכילים אלכוהול ותוך שנה יופסק שיווקם בארץ.
- מרכיבים הומאופתיים חייבים להימצא בתכשיר המוגמר בריכוז מרבי של 1:10,000 או 0.01% (מקביל לריכוז הומאופתי D4).
- תכשיר המכיל שילוב של תכשיר הומאופתי עם תכשיר רפואי או חומר אחר לא יחשב כתכשיר הומאופתי.
- חומר גלם הומאופתי יאושר על-פי הכללתו בפרמקופיאה הומאופתית מוכרת.
- האישור יינתן לכל חומר גלם או תכשיר מוגמר באופן פרטני לתקופה של עד 5 שנים.
- מוצר הומאופתי ייובא וישווק ע"י בעל אישור ובאמצעות בית מסחר לתרופות.
- בקשה לחידוש אישור יש להגיש שלושה חודשים לפני מועד פקיעת תוקף האישור.
- תכשיר הומאופתי לשימוש בבעלי חיים יאושר לאחר שתתקבל חוות דעת כתובה מהממונה על התרופות בשירותים הוטרינריים במשרד החקלאות.
צורות מינון
תכשיר הומאופתי ניתן לשווק באחת מצורות המינון הבאות בלבד:
- מתן דרך הפה: טיפות, כדוריות (גלובולים) שהוספגו בנוזל, טבליות למציצה או אבקה לנטילה פומית
- משחות ונוזלים לשימוש על פני העור.
- פתילות רקטליות.
- טיפות אף.
- טיפות אוזניים.
- טיפות עיניים.
ייבוא
- ניתן לייבא מוצרים הומאופתיים שקיבלו אישור כאמור, המיוצרים במפעלים אשר עומדים בתנאי ייצור נאותים על-פי אישור מהרשויות המוסמכות בארץ בה התכשיר מיוצר ובלבד שיהיו מהמדינות החברות באיחוד האירופאי, שוויץ, נורבגיה, איסלנד, ארה"ב, קנדה, אוסטרליה, יפן וישראל.
- הייבוא יותר רק למפעלים פרמצבטיים מאושרים ולבתי מסחר לתרופות.
- לרשויות המכס יינתן אישור מיוחד לייבוא על-ידי מדור הייבוא באגף הרוקחות.
- האישור יינתן על-פי צו יבוא חופשי לשנה.
ייצור בארץ
ניתן לייצר חומרי גלם הומאופתיים ותכשירים הומאופתיים במפעלים המקיימים תנאי ייצור נאותים, שקיבלו אישור על-כך מהמכון לביקורת ולתקנים של חומרי רפואה - משרד הבריאות, ירושלים.
שיווק לבתי מרקחת
חומרי גלם הומאופתיים / תכשירים הומאופתיים ישווקו לבתי-המרקחת על-ידי בתי-מסחר לתרופות בלבד. חומרי גלם / תכשירים הומאופתיים יאוחסנו ויובלו ע"פ הנחיות היצרן.
אחסון וניפוק בבית המרקחת
תכשיר הומאופתי מוגמר יאוחסן מאחורי דלפק הרוקח בנפרד מהתרופות וינופק לצרכן על-ידי רוקח בבית-מרקחת, וזאת ללא חובת מרשם רופא.
הכנה הומאופתית תנופק בבית-מרקחת על-פי מרשם רופא בלבד במקרים הבאים:
- הכנה הומאופתית ה מכילה מרכיב הומאופתי בריכוז גבוה מ -D10 (1:1010), מלחי שוסלר בריכוז גבוה מ -D6 (1:106) .
- הכנה הומאופתית המכילה מספר מרכיבים הומאופתיים שסה"כ הריכוז שלהם עולה על D6.
- במקרים מסויימים רשאי אגף הרוקחות מטעמים שינמק לחייב עוד סוגי הכנות הומאופתיות במרשם רופא.
- תכשירים הומאופתיים המיועדים לחיות מחמד ינופקו בבית מרקחת בלבד.
- תכשירים הומאופתיים המיועדים לחיות משק ינופקו גם במקומות ניפוק מורשים כמוגדר בתקנות הרוקחים (ניפוקם של תכשירים וטרינריים, התשמ"ט 1988) ע"פ מרשם רופא וטרינר.
מעקב אחר תופעות לוואי
- בעל אישור ידווח למחלקה לניהול סיכונים באגף הרוקחות על כל תלונה או חשד לתופעת לוואי בתכשיר הומאופתי.
- בעל אישור יבצע מעקב יזום מדי חצי שנה ויגיש הממצאים לאגף הרוקחות.
- בעל אישור יעמיד לרשות המטופלים את פרטיו לצורך דיווח על תופעות לוואי.
החזרה מהשוק
- אין לשווק מוצרים שהוחזרו מהשוק במדינה מוכרת שבה היו משווקים.
- בעל אישור או בית מרקחת מייבא יודיע למשרד הבריאות על כל בעיה שהתגלתה במוצר בחו"ל.
- בית מסחר לתרופות או בית מרקחת המייבא תכשיר הומאופתי יבצע החזרה מהשוק בכל עת שיידרש, על-פי נוהל 3.
הכנות הומאופתיות
- הכנות הומאופתיות תבוצענה בפיקוחו של רוקח מורשה ובאחריותו להיבט האיכות והבטיחות.
- חומרי הגלם בהם נעשה שימוש הם חומרי גלם הרשומים במשרד הבריאות ע"פ פרמקופיאות הומאופתיות מוכרות. במקרים מיוחדים ניתן יהיה לייבא חומרי גלם הרשומים בפרמקופיאות אחרות המוכרות באנגליה, צרפת, גרמניה, ארה"ב.
- תמיסות האם יעברו בדיקות יציבות ע"פ הנחיות CPMP/QWP/122/02) EMA) למעט יציבות חומרים פעילים בתמיסות המדוללות לרמות שבהן לא ניתן לזהות חומרים פעילים (בדרך-כלל בתמיסות המדוללת יותר מ - 1:10,000).
- תאריכי תוקף של תמיסות/טריטורציות ביניים מדוללות ייקבע ע"פ בדיקות היציבות של המונוגרף הרלוונטי בפרמקופאיה או בהיעדרה מונוגרף IN-HOUSE , ובלבד שיסופק תימוכין לולידיות של הבדיקה.
- תאריכי תוקף של הכנות מוגמרות יהיו בהתאם לבדיקות יציבות כאמור בסעיף 3 לעיל או בהתאם להשוואה עם תכשירים אקויולנטיים ע"פ הנחיות HMA מיולי 2009 או עדכון שלהן.
- תיעוד: הכנה הומאופתית תתועד בבית-המרקחת המכין בפנקס ההכנות ההומאופתיות כמפורט להלן:
- מספר סידורי של ההכנה.
- תאריך ההכנה ותוקף ההכנה.
- שם המטופל.
- שם הרופא רושם מרשם או שם מזמין ההכנה.
- הרכב ההכנה (כולל דילולים הומאופתיים).
- מאפייני הרכיבים - מספר אצווה ותאריך תפוגה.
- חומרי עזר בתכשיר.
- שם הרוקח האחראי על ההכנה וחתימתו.
- סימון: הכנה הומאופתית תסומן על-גבי האריזה בבית המרקחת המכין כדלקמן:
- שם וכתובת בית המרקחת המכין.
- תאריך ההכנה.
- המספר הסידורי של ההכנה.
- שם המטופל.
- שם רושם המרשם או שם המזמין.
- הוראות שימוש ואחסון (יכולות להופיע גם בעלון מצורף).
- ניפוק, הובלה ומסירה של הכנה הומאופתית שהוכנה בבית מרקחת אחר:
- ניפוק, הובלה ומסירה של הכנה הומאופתית שהוכנה בבית מרקחת אחר תתבצע בהתאם לסעיפים 3.6, 3.7 בנוהל 128 של אגף הרוקחות כאשר בית המרקחת המבצע את ההכנה הוא בית המרקחת המנפק.
- חובת מרשם רופא תחול על ההכנות ההומאופתיות החייבות מרשם על-פי נוהל זה. הסבר כאמור בסעיף 3.10.4 יינתן ע"י בית המרקחת המוסר או יינתן בכתב בצמוד לתכשיר ההומאופתי.
- שמירת מסמכים להכנה הומאופתית:
- בית המרקחת מוסר ההזמנה ובית המרקחת המכין ישמרו את מרשם הרופא עבור הכנה הדורשת מרשם רופא (או העתקו), ההזמנה ותעודת המשלוח לתקופה של שנה. ספר המרשמים או רשימת ההכנות במחשב ישמרו לתקופה של 7 שנים.
- אחריות על ההכנה וניפוקה:
- האחריות על הכנה הומאופתית חלה על הרוקח בבית המרקחת המכין לרבות התיעוד, אופן המשלוח והסימון כאמור. האחריות לניפוק הכנה הומאופתית חלה על הרוקח המנפק אותה.
פרסום ואיסור ייחוס סגולות ריפוי
- אין לייחס התוויה רפואית או סגולת ריפוי, מניעה או אבחון של מחלות לחומר גלם ו/או תכשיר הומאופתי מוגמר על-גבי אריזת המוצר ועל גבי כל חומר פרסומי לציבור בכל מדיה שהיא.
- בעל אישור המעוניין לפרסם/ לציין על גבי התכשיר כי הוא נטול תופעות לוואי/ אינו פוגע בערנות / בטוח לשימוש ארוך טווח / בטוח / בטוח בנשים בהריון או נשים מניקות או כל הצהרה אחרת הנוגעות לבטיחות תכשיר הומאופתי, עליו להציג נתונים קליניים התומכים בכך ולקבל על כך אישור מקדים.
- בעל אישור יוודא כי כל פרסום תכשיר הומאופתי לקהל הרחב לא יטעה את הציבור ולא ייחס לו סגולות ריפוי, מניעה או איבחון מחלות וכן יוסיף בכל פרסום את הכיתוב הבא באופן מודגש וברור בגודל שלא יופחת משני שליש משם התכשיר "תכשיר הומאופתי ללא התוויה רפואית מאושרת" אם הפרסומת הנה למספר מוצרים יופיע הכיתוב בסמוך לכל מוצר המוצג בפרסומת.
- רוקח המנפק תכשיר הומאופתי יסביר למטופל כי הטיפול ההומאופתי אינו מחליף טיפול תרופתי מאחר ותכשיר הומאופתי לא הוכיח יעילות רפואית. כמו כן יוודא כי המטופל אינו מפסיק את הטיפול תרופתי ככל שניתן לו. כמו כן ידגיש הרוקח בפני המטופל כי התכשיר מכיל לקטוז, אלכוהול או חומר עזר אחר בהתאם לעניין.
סימון מוצרים הומאופתיים:
- חומר גלם הומאופתי:
- על גבי האריזה הפנימית והחיצונית יצויין:
- "חומר גלם הומאופתי".
- שם החומר באותיות לטיניות.
- כמות באריזה.
- מספר אצווה ותאריך תפוגה.
- שם היצרן , היבואן בעל האישור והמפיץ וכתובותיהם.
- הוראות לאחסון חומר הגלם.
- תכשיר הומאופתי:
- על גבי האריזה הפנימית והחיצונית יצוינו הפרטים הבאים:
- מספר האישור של התכשיר.
- הכיתוב: "תכשיר הומאופתי ללא התוויה רפואית מאושרת", "יש להיוועץ ברופא או ברוקח טרם השימוש בתכשיר ובמידה שסימני המחלה אינם עוברים או מוחמרים". הכתובית תודפס באופן מודגש וברור באותיות שגודלן לא יפחת משני שליש (2/3) גודל אותיות שם התכשיר.
- שם התכשיר באותיות לטיניות, הזהה לשם המופיע בפרמקופיאה ההומאופתית. הרלוונטית ודרגת המיהול (לפי השיטה ההומאופתית). בתכשיר המכיל שילוב של מרכיבים הומאופתיים, יש לסמן את כל שמות המרכיבים כאמור.
- פירוט חומרי העזר בתכשיר.
- שם היצרן, היבואן, בעל האישור והמפיץ וכתובותיהם (בעברית).
- כמות באריזה.
- מספר אצווה ותאריך תפוגה.
- הוראות מיוחדות לגבי שימוש בתכשיר (בעברית).
- הוראות לאחסון התכשיר (בעברית).
- שמות המרכיבים ההומאופתיים באותיות לטיניות הזהים לשמות המופיעים בפרמקופיאה ההומאופתית הרלוונטית ודרגת המיהול (לפי השיטה ההומאופתית).
- שמות חומרי העזר.
- בתכשיר שמכיל שילוב מרכיבים הומאופתיים, אין מניעה בהוספת שם נוסף (להלן: שם מסחרי) ובתנאי שלא תהיה משום רמיזה להתוויה רפואית. השם המסחרי של התכשיר יופיע באותיות לטיניות ובעברית.
- על-גבי האריזה הפנימית והחיצונית של תכשיר הומאופתי לשימוש בבעלי חיים תופיע הכתובית הבאה באותיות שגודלן כמפורט בסעיף 2.2 : "לשימוש בבעלי חיים בלבד".
הוראות להגשת הבקשה לאישור / חידוש אישור חומר גלם הומאופתי / תכשיר הומאופתי מוגמר
- בקשות לאישור מוצר הומאופתי, חידושו או שינוי בו (להלן בקשות) יגיש רוקח ממונה למוצר הומאופתי לאגף הרוקחות, משרד הבריאות, ירושלים.
- בקשה אחת יכולה לכלול מספר תכשירים המכילים את אותם חומרי גלם במיהולים שונים ובצורות מינון שונות.
- כל החומר יוגש בשפה עברית ו/או אנגלית. מסמכים רשמיים יוגשו בשפה המקורית בצירוף תרגום לעברית או אנגלית המאושר על-ידי נוטריון.
פרטי הבקשה לאישור חומר גלם / תכשיר הומאופתי
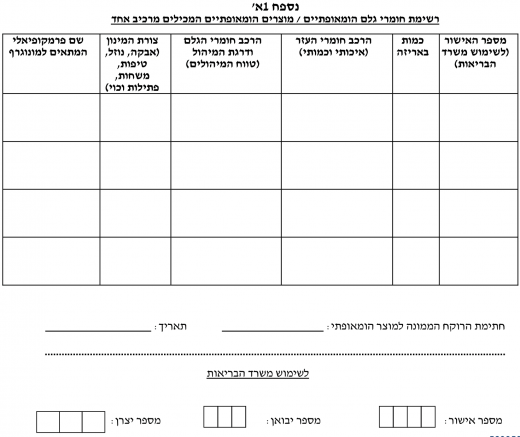
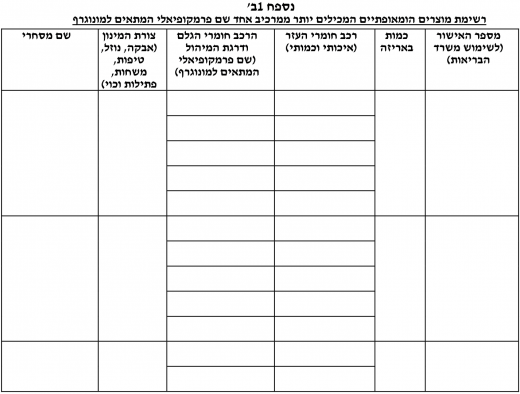
- טופס בקשה לאישור חומר גלם / תכשיר הומאופתי (נספח 1).
- קבלה מקורית על תשלום האגרה הנהוגה על-ידי משרד הבריאות בעת ההגשה עבור כל בקשה אשר תשולם לזכות אגף הרוקחות, חשבון מספר 0-03807-9, בבנק הדואר.
- אישור עדכני מרשות מוסמכת בארץ הייצור על קיום תנאי ייצור נאותים במפעל .
- צילום מונוגרף מהפרמקופיאה ההומאופתית הרלוונטית לכל חומר גלם / תכשיר הומאופתי.
- תעודת אנליזה עבור חומר/י הגלם ההומאופתי/ים הראשוני/ים (התרכיז/ים ההומאופתי/ים) המופיע/ים בהרכב התכשיר ההומאופתי.
- ספציפיקציות ותעודת אנליזה של המוצר המוגמר של היצרן נדרשים לתכשיר הומאופתי שהוא טיפות עיניים, טיפות אף, טיפות אוזניים, פתילות רקטליות, משחה או נוזל לשימוש על פני העור.
- בנוסף, נדרשת תעודת בדיקה לסטריליות ו - PH
- וכן נדרש CPP (Certificate of Pharmaceutical Product) ממדינה מוכרת עבור תכשיר הומאופתי בצורת טיפות עיניים.
- נתונים טוקסיקולוגיים, במידה ונדרשו על-ידי אגף הרוקחות.
- סקיצה של האריזה המוצעת ונוסח מדויק של התווית על האריזה כפי שמבוקשת לשיווק בישראל (לפי סעיף 3.11). במקרים מיוחדים יידרש תכשיר עם האריזה כפי שמבוקשת לשיווק בארץ.
- המוצר עצמו באם נדרש על-ידי אגף הרוקחות.
- תעודת מכירה חופשית עדכנית (מהשנה האחרונה) מהרשויות המוסמכות בארץ הייצור, או בארץ בה משווק התכשיר אשר תכלול את שם התכשיר, שם היצרן, כתובת אתר הייצור, הצהרה לגבי שיווק התכשיר כתכשיר הומאופתי וללא מרשם רופא.
- דוגמא של האריזה המקורית בלועזית (פנימית וחיצונית) של התכשיר כפי שהוא משווק בארץ הייצור או במדינה שממנה התקבלה תעודת המכירה שצוינה לעיל בסעיף הקודם.
שמירת מסמכים לתכשיר הומאופתי ושינויים במוצר הומאופתי
על מקבל האישור לשמור אצלו את תיק המוצר ובתוכו כל המסמכים הרלוונטיים לרבות תעודת אנליזה לחומר הגלם עבור כל אצווה של חומר גלם הומאופתי / תכשיר הומאופתי.
כל שינוי שיעשה במפרט המוצר ההומאופתי ידווח לאגף הרוקחות לא יאוחר מ- 30 ימים מיום ביצועו.
כל שינוי באריזת התכשיר ההומאופתי מחייב אישור מוקדם של אגף הרוקחות.
ייבוא חריג של מוצר הומאופתי
הוראות אלה לא יחולו על מוצר הומאופתי שיובא באריזתו המקורית על-ידי בית-המרקחת בכמות קטנה באישור הרוקח המחוזי, ללקוחות של אותו בית מרקחת בלבד.
- הרוקח המחוזי יאשר הנ"ל בהתקיים תנאים אלה
- התכשיר מאושר לשיווק בארצות המפורטות בסעיף 3.3.1.
- התכשיר ינופק אך ורק למי שבידו מרשם רופא.
- כמות הצריכה לא תעלה על 6 חודשים.
- תוקף חיי המדף של התכשיר לא יפוג תוך 6 חודשים לפחות מתאריך הנפקתו לצרכן.
- חומר גלם הומאופתי או תכשיר הומיאופתי מוגמר שישמש אך ורק כחומר גלם לא ישווק לצרכן ויסומן על-ידי תווית "חומר גלם לא למכירה".
- התכשיר המיובא מיועד לטיפול בלקוח בית המרקחת המבקש בלבד.
- הרוקח מתחייב ליידע את המטופל כי התכשיר ההומאופתי לא עבר את הליך האישור על-פי נוהל מוצרים הומאופתיים בישראל ולצרף מידע והוראות שימוש בעברית בהתאם למידע המופיע על תווית המוצר בחו"ל ועלון המידע המצורפים אליו.
- בנוסף לגבי תכשירים המיועדים להזרקה
- יש לצרף אישור על קיום תנאי יצור נאותים מהרשויות בארץ הייצור.
- ש לצרף תעודת מכירה חופשית עדכנית (מהשנה האחרונה) מהרשויות המוסמכות בארץ הייצור או בארץ בה משווק התכשיר אשר תכלול את שם התכשיר, שם היצרן, כתובת אתר הייצור, הצהרת QP לגבי התרת האצווה לשיווק במדינה מוכרת.
- אישור הייבוא החריג של מוצר הומאופתי יינתן ע"י אגף הרוקחות, לאחר שמולאו התנאים ונחתם נספח מס' 2 של הנוהל.
פיקוח
דיווח תופעות לוואי ע"י בעל האישור וכן פרסום תכשיר הומאופתי ייבדקו ע"י ביקורות של הרוקחות המחוזית וכן ע"י אגף הרוקחות.
אחריות לביצוע
אגף הרוקחות - משרד הבריאות
המכון לביקורת ולתקנים של חומרי רפואה - משרד הבריאות
רוקחים מחוזיים: ירושלים, תל-אביב, חיפה, מרכז, צפון, דרום
השירותים הווטרינריים
תחולה
תחולתו של עדכון זה 30 ימים מיום פרסומו למעט הכללים לגבי מוצרים המיועדים לילדים מתחת לגיל 6 ושינויי אריזות - הוספת מסי אישור תכשיר הומאופתי, אשר יחולו כעבור שנה מפרסום עדכון זה לנוהל.
נספחים:
טופס בקשה לאישור חומר גלם / תכשיר הומאופתי - (נספחים 1, 1א', 1ב'). טופס הוראת רופא עבור יבוא חריג של מוצר הומאופתי - (נספח 2).
מסמכים ישימים
הפרמקופיאה ההומאופתית האמריקאית, האנגלית, הצרפתית והגרמנית.
תקנות הרוקחים (תנאי פתיחה וניהול של בתי מסחר לתרופות, (התשנ"ג-1993).
צו יבוא חופשי (התשל"ח 1978).
נוהל מספר 3 - הודעה על פגם; החזרת תכשיר מן השוק.
נוהל מספר 6 - דיווח תופעות לוואי ומידע בטיחות חדש.
נוהל מספר 128 - שירותי הובלה ומסירת תכשירים מבית מרקחת.
נספחים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק