סרטן הריאה - רפואה מותאמת אישית - Lung cancer - personalized medicine
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| סרטן הריאה - רפואה מותאמת אישית | ||
|---|---|---|
| Lung cancer - personalized medicine | ||
| שמות נוספים | רפואה מותאמת אישית בסרטן הריאות | |
| יוצר הערך | ד"ר מירה וולנר, ד"ר מור מושקוביץ |
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן ריאה
סרטן ריאה מהווה את גורם המוות מסרטן הראשון בקרב גברים והשני בקרב נשים בישראל, למרות שהוא הסרטן השלישי והרביעי בשכיחותו בקרב גברים ונשים בישראל, בהתאמה[1]. מעל 70% מחולי סרטן הריאה מאובחנים עם מחלה מתקדמת מקומית או גרורתית וניתן להציע להם טיפול להארכת חיים והקלה על התסמינים בלבד[2].
תוחלת החיים בסרטן ריאה מתקדם בשלב IIIB או IV היא 8 עד 10 חודשים. בעבר, כל חולי סרטן הריאה מסוג תאים לא קטנים (NSCLC, Non Small Cell Lung Cancer) טופלו באותו אופן - על ידי משלב של תרופות כימותרפיות, המבוסס בדרך כלל על תרופות ממשפחת הפלטינום (Platinum), ולא היה משלב כימותרפי שהראה יתרון על משלבים אחרים[3].
הטיפול בתרופות ממשפחת הפלטינום - Carboplatin או Abiplatin (Cisplatin), ניתן בשילוב עם אחת התרופות הבאות - Gemcitabine, Vinorelbine, Irinotecan, Topotecan, Paclitaxel או Docetaxel. שיעור התגובה למשלב כימותרפי זה הוא כ-30-40%.
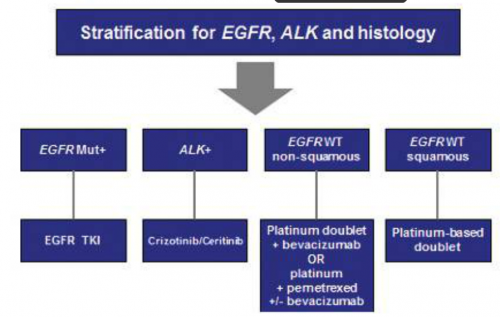
עד העשור הראשון של המאה ה-21, נדרש הפתולוג לציין בדגימה הפתולוגית כי מדובר בסרטן הריאה מסוג תאים לא קטנים ולא נדרשה הבחנה בין ממאירות בלוטית (אדנוקרצינומה - Adenocarcinoma) לקשקשית (Squamous), מכיוון שלא הייתה חשיבות לאבחנה ההיסטולוגית בבחירת הטיפול. מאז התגלו מספר מוטציות המניעות את התפתחות סרטן הריאה - כמו מוטציה בקולטן לגורם הגדילה האפידרמלי (Epidermal Growth Factor Receptor ,EGFR) ו-ארגון מחדש (Rearrangemenr) של הגנים EML4-ALK (Echinoderm Microtubule-associated protein-like 4 - Anaplastic Lymphoma Kinase), וטיפולים מכוונים כנגד המוטציות הללו הראו יעילות בהארכת חיים והקלה על תסמינים בחולים הנושאים את המוטציות. בנוסף נכנסו לשימוש קליני מספר תרופות חדשות כמו התרופה הכימותרפית ממשפחת האנטי-מטבוליטים Alimta (Pemetrexed) ותרופות המכוונות כנגד היווצרות כלי דם חדשים (Angiogenesis). תרופות אלו יעילות בטיפול בתת קבוצות מסויימות של סרטן הריאה ולכן עלתה החשיבות של האבחנה ההיסטולוגית המדוייקת של הגידול ושל המאפיינים המולקולריים שלו. כך ניתן להתאים את הטיפול אישית לכל חולה סרטן הריאה.
טיפול כימותרפי
במחצית שנת 2008 פרסמו Scagiiotti וחבריו מחקר שבדק תשלובת של Abiplatin ו-Alimta, תרופה השייכת לקבוצה האנטי-מטבוליטים, בהשוואה לתשלובת הידועה של Abiplatin ו-Gemcitabine בחולים עם סרטן הריאה מסוג תאים לא קטנים מתקדם או גרורתי כקו טיפולי ראשון. Alimta חוסמת אנזימים התלויים בפולאט (Folate), ובעיקר Tymidyiate synthase. מחקר זה הראה שיפור בהישרדות בשתי התשלובות מעל 10 חודשים. בחולים עם אדנוקרצינומה וסרטן ריאה מסוג תאים גדולים (Large cell carcinoma) התשלובת המועדפת הייתה השילוב עם Alimta, ובקבוצת חולים עם סרטן ריאה מסוג תאים קשקשיים (Squamous cell carcinoma), התשלובת הטובה יותר היתה השילוב עם Gemcitabine. מחקר זה הדגים את החשיבות של איבחון היסטולוגי ספציפי יותר בסרטן הריאה[4].
טיפול ביולוגי
גורם הגדילה של כלי הדם (VEGF)
בשנות ה-70 של המאה הקודמת הדגיש החוקר Judah Folkman את היווצרות כלי הדם החדשים של הגידולים כמטרה נוספת בטיפול בסרטן ריאה. אחת מהתרופות היא Avastin (Bevacizumab), נוגדן חד שבטי (Monoclonal) הנקשר לגורם הגדילה של כלי הדם (Vascular Endothelial Growth Factor ,VEGF), חלבון המופרש ביתר בגידולים שונים ומעודד צמיחה ושגשוג של כלי דם. עיכוב חלבון זה על ידי Avastin מוביל לנסיגת כלי הדם ומונע יצירת כלי דם חדשים, ובכך מעכב את צמיחת הגידול והתפשטותו[5].
Reck ו- Sandier הראו בשני מחקרים בחולי סרטן ריאה לא קשקשי מסוג תאים לא קטנים (Non-squamous NSCLC), את היעילות בהוספת Avastin לתשלובות הכימותרפיות המקובלות[6],[7]. במחקרים אלו נמצא כי הוספת Avastin שיפרה באופן מובהק את שיעורי התגובה לטיפול ואת הזמן עד להתקדמות המחלה וכן האריכה את הישרדות המטופלים מעבר לשנה בהשוואה לטיפול כימותרפי לבד. בעבודות אלו ונוספות נראה כי התרופה יעילה יותר בחולים עם אדנוקרצינומה, והביאה להארכת חיי המטופלים מעבר ל-20 חודשים. כמו כן, הבטיחות של הטיפול טובה יותר באדנוקרצינומה. בחולים עם ממאירות קשקשית נצפו שיעורים גבוהים יותר של דימום ריאתי תחת הטיפול ב-Avastin, לכן התרופה לא מאושרת לשימוש בחולים עם היסטולוגיה זו, כמו גם בחולים עם שיעול דמי (Hemoptysis), גידול קביטרי (Cavitary) או גידול המערב כלי דם ריאתיים גדולים. בטיחות התרופה נבדקה במעל 4,000 חולים וקיימות הנחיות ברורות למתן התרופה. בנוסף ל-Avastin, תרופות שונות כנגד גורמי צמיחת כלי דם נבדקו במחקרים שכללו אלפי חולים, כאשר רובם לא הראו יעילות בנוסף לטיפול כימותרפי.
התרופות המכוונות כנגד גורמי גדילה לכלי דם והקולטן שלהם, Nintedanib ו-Ramucirumab, (מחקרי 1 REVELS LUMELUNG) הדגימו שיפור בהישרדות בחולים כקו טיפול שני עם תוספת לתרופה הכימותרפית Docetaxel בחולים עם סרטן ריאה מסוג תאים לא קטנים גרורתי בכל הסוגים ההיסטולוגים[8],[9].
קולטן לגורם הגדילה האפידרמלי (EGFR)
משפחת הקולטנים לגורם הגדילה האפידרמלי מונה ארבעה קולטנים מסוג טירוזין קינאז (Tyrosine kinase receptors) - (EGFR (HER1/ErbB1, (HER2 (ErbB2, (HER3 (ErbB3 ו-HER4 (ErbB4). קולטנים אלו הם אונקוגנים (Oncogenes), שעם הפעלתם יוצרים הומודימרים (Homodimers) והטרודימרים (Hetrodimers), המפעילים מסלול העברת אותות המוביל לגדילה והתמיינות של התא[10]. שני מסלולים אונקוגנים מוכרים מופעלים על ידי גורם הגדילה האפידרמלי - מסלול ה-PIK3CA/AKT1 ומסלול ה-RAS-RAF MEC-ERK, וכאשר מסלולים אלו מופעלים ביתר בשל מוטציה בקולטן עולה קצב התרבות התאים והישרדותם ומתאפשרת יצירת גרורות[11].
באוכלוסיה המערבית, כ-15-20% מממאירויות הריאה מסוג תאים לא קטנים נושאות מוטציה בגן לקולטן גורם הגדילה האפידרמלי, כאשר 95% מהמוטציות נמצאות בממאירויות עם היסטולוגיה בלוטית. באוכלוסיה האסייתית, שיעור המוטציות עולה ל-50% מממאירויות הריאה[12].
שתי המוטציות הנפוצות ביותר בגן לקולטן לגורם הגדילה האפידרמלי הן מוטציית מחיקה באקסון 19 ומוטציה נקודתית באקסון 21 הגורמת להחלפה של החומצה האמינית לוצין (Leucine) בארגינין (Arginine) בקודון 858 (L858R)[13]. המוטציות נפוצות יותר בקרב נשים, בקרב חולים שלא עישנו או מעשנים קלים ובקרב אסייתים. בדיקת הבחירה לאיתור המוטציה היא בדיקת ריאקציית שרשרת של פולימרז (PCR, Polymerase Chain Reaction) המבוצעת בתאי הגידול[14].
מולקולות קטנות המעכבות את מרכיב הטירוזין קינאז של הקולטן לגורם הגדילה האפידרמלי הראו יעילות רבה בטיפול בחולי סרטן הריאה מסוג תאים לא קטנים הנושאים מוטציה בגן. קיימות שלוש תרופות פומיות המאושרות לטיפול כקו ראשון בסרטן ריאה מתקדם מקומי או גרורתי הנושא מוטציה בגן הקולטן לגורם הגדילה האפידרמלי - Iressa (Gefitinib) ו-Tarceva (Erlotinib) - מעכבים הפיכים של הקולטן, ו-Giotrif (Afatinib) - מעכב בלתי הפיך של הקולטן.
מספר מחקרי פאזה שלישית אקראיים הדגימו את יעילות הטיפול במעכבי טירוזין קינאז לעומת הטיפול הכימותרפי המקובל. המחקר הגדול הראשון שהראה את יעילות הטיפול הוא IPASS, מחקר בפאזה 3 שבוצע באסיה, בו נבחן הטיפול ב-Iressa לעומת טיפול כימותרפי ב-Carboplatin ו-Paclitaxel כקו טיפול ראשון בחולי סרטן ריאה בלוטי, שאינם מעשנים או מעשנים קלים לשעבר. מחקר זה הראה כי הזמן עד להתקדמות המחלה היה ארוך יותר באופן משמעותי ומובהק סטטיסטית בתת הקבוצה של החולים הנושאים מוטציה בגן הקולטן לגורם הגדילה האפידרמלי, ואילו חולים שאינם נושאים מוטציה בגן זה הרוויחו יותר מהטיפול הכימותרפי[15]. מחקרים נוספים שבדקו את הטיפול ב-Iressa לעומת טיפול כימותרפי, בהם השתתפו רק מטופלים הנושאים מוטציה בגן, חיזקו את הממצאים הללו, ומצאו כי הזמן להתקדמות המחלה ארוך יותר עם טיפול ב-Iressa ב-3-5 חודשים[16],[17].
במחקר הראשון שבדק את הטיפול במעכבי הקולטן לגורם הגדילה האפידרמלי באוכלוסייה המערבית (EURTAC)[18], בדקו רוסל וחבריו את הטיפול ב-Tarceva בשילוב עם Docetaxel או Gemcitabine לעומת טיפול כימותרפי על בסיס פלטינום ב-Abiplatin ו-Docetaxel, כטיפול קו ראשון בחולי סרטן הריאה מסוג תאים לא קטנים הנושאים מוטציה בקולטן לגורם הגדילה האפידרמלי. גם במחקר זה נמצא כי הזמן עד להתקדמות המחלה היה ארוך יותר עם טיפול ב-Tarceva - 9.7 חודשים, לעומת טיפול כימותרפי - 5.2 חודשים.
תרופה נוספת, Giotrif, מולקולה קטנה המעכבת באופן בלתי הפיך את הקולטן לגורם הגדילה האפידרמלי, נבדקה מול טיפול כימותרפי בשני מחקרים גדולים, האחד בין לאומי והשני אסייתי[19],[20]. במחקרים נמצא יתרון של 4 ו-5 חודשים בזמן עד להתקדמות המחלה בטיפול ב-Giotrif, כמו גם יתרון של 3 חודשים בהישרדות הכללית של החולים עם מוטציה באקסון 19 של הקולטן המטופלים ב-Giotrif כטיפול ראשון (הישרדות כללית 27.3 עם Giotrif לעומת 24.3 חודשים עם טיפול כימותרפי, 0.81=HR). תופעות הלוואי של התרופות כוללות בעיקר תפרחת עורית אקניפורמית ושילשולים, וכן רעילות עינית, דלקת ברקמת הריאה (Pneumonitis) ועליה באנזימי כבד.
מחקרים אלו הביאו לאישור שלוש התרופות ברוב מדינות העולם ולשימוש קליני נרחב בהן בחולי סרטן ריאה מסוג תאים לא קטנים עם מוטציה בקולטן לגורם הגדילה האפידרמלי.
המכשול העיקרי בטיפול במעכבי טירוזין קינאז בקולטן לגורם הגדילה האפידרמלי היא העמידות הנרכשת לטיפול, המתפתחת ברוב המוחלט של המטופלים. הגורם העיקרי לעמידות הוא מוטציה שנייה בגן, לרוב מוטציה באקסון 20, T790M, המתרחשת בכ-60% מהחולים. מנגנוני עמידות נוספים הם הפעלת מסלולי הולכת אותות נוספים, כמו אמפליפיקציה (Amplification) של MET ,HER 2 או MAPKI, מוטציה ב-PI3K או PTEN, או שינוי היסטולוגי לסרטן ריאה מסוג תאים קטנים[16].
תרופות נוספות, 1686-CO ו- AZD9291, מולקולות קטנות המעכבות באופן בלתי הפיך את הקולטן לגורם הגדילה האפידרמלי, הדגימו במחקר פאזה 1 פעילות כנגד המוטציות השכיחות של הקולטן, כמו גם נגד מוטציה נרכשת ב-T790M. תרופות מסוג זה יכולות להוות פתרון לעמידות הנרכשת לטיפול[21],[22].
מחקר בפאזה שנייה שבדק השפעת מתן נוגדן כנגד MET (מסלול עמידות נוסף לתרופות המעכבות את הטירוזין קינאז) - Onartuzumab (MetMab) בשילוב עם Tarceva, הראה שיפור בהישרדות לעומת חולים שטופלו רק ב-Tarceva כקו טיפולי מתקדם[23]. מחקר המשך של פאזה שלישית בחולים המבטאים את החלבון MET, לא חזר על התוצאות של המחקר שקדם לו.
אירגון מחדש של ALK
Anaplastic Lymphoma Kinase) ALK) הוא קולטן טירוזין קינאז, חלק ממשפחת הקולטנים לאינסולין (Insulin), המקודד על ידי גן ה-ALK על כרומוזום 2p239. טרנסלוקציה (Translocation) של גן זה נמצאה במספר סוגי סרטן, כמו לימפומה (Lymphoma) ונוירובלסטומה (Neuroblastoma). ב-2007, Soda וחבריו מצאו כי אירגון מחדש של גן זה יחד עם EML4 (Echinoderm Microtubule-associated protein-Like 4) מתרחש בכ-4-7% מחולי סרטן ריאה מסוג תאים לא קטנים בלוטי, וטרנסלוקציה זו משחקת תפקיד מרכזי בהתפתחות הגידול בחולים אלו[23]. טרנסלוקציה זו שכיחה יותר בגברים צעירים והיסטולוגיה של אדנוקרצינומה מסוג אצינרי (Acinar) או תאי חותם (Signet ring)[24].
לאחר שלא נמצאה מוטציה בבדיקת הקולטן לגורם הגדילה האפידרמלי בגידול, ניתן לבצע בדיקה לטרנסלוקציית EML4-ALK. בדיקה זו מבוצעת על ידי FISH assay Break-Apart (Fluorescent In-Situ Hybridization), אולם גוברות העדויות כי ניתן לאתר את הטרנסלוקציה גם בבדיקת אימונוהיסטוכימיה (Immunohistochemistry) זולה ופשוטה יותר.
Xalkori (Crizotinib), מולקולה קטנה המעכבת את מרכיב הטירוזין קינאז של קולטן ה-ALK (וכן מעכבת MET ו-ROS), הראתה יעילות רבה בטיפול בסרטן ריאה מסוג תאים לא קטנים עם ארגון מחדש של ALK, ובמחקר PROFILE1007, הטיפול ב-Xalkori העלה את שיעור התגובה ושיפר את הזמן להישנות המחלה ב-4 חודשים לעומת טיפול כימותרפי[25].
תופעות הלוואי העיקריות של התרופה הן בחילות, שלשולים, הפרעה בתפקודי כבד, רעילות עינית ודלקת ברקמת הריאה.
כמו במעכבי הקולטן לגורם הגדילה האפידרמלי, גם בטיפול במעכבי ALK, אבן הנגף העיקרית בטיפול היא העמידות לתרופה, המתפתחת בדרך כלל בשנה הראשונה לטיפול במספר מנגנונים - אמפליפיקציה של ALK, מוטציה שנייה ב-ALK או הפעלה של מסלולי הולכת אותות נוספים - כמו KRAS והקולטן לגורם הגדילה האפידרמלי.
תרופות נוספות מעכבות ALK מנסות לתת מענה לעמידות לטיפול - Ceritinib היא מולקולה קטנה המעכבת את מרכיב הטירוזין קינאז ב-ALK, שהראתה פעילות בחולי סרטן ריאה מסוג תאים לא קטנים עם ארגון מחדש של ALK שפיתחו עמידות לטיפול ב-Xalkori, כמו גם בחולים נאיבים ל-Xalkori[26]. Alectinib היא מולקולה נוספת המעכבת את מרכיב הטירוזין קינאז ב-ALK, שהדגימה פעילות בחולים שטופלו ב-Xalkori וכן בחולים נאיבים לטיפול.
הערות:
- WT=Wild Type, no mutation found
- TKI- Tyrosin Kinase Inhibitor
מוטציית שיפעול של KRAS
מוטציה באונקוגן KRAS היא המוטציה השכיחה ביותר בסרטן הריאה, כ-30%, ובדרך כלל מופיעה ללא מוטציות אחרות, כמו ארגון מחדש של ALK או מוטציה בקולטן לגורם הגדילה האפידרמלי (Mutual exclusivity). Selumetinib (AZD6244; ARRY-142686), תרופה פומית המעכבת את אנזים ה-MEK שהוא חלק ממסלול RAS-RAF MEC-ERK pathway נבדקת בשילוב עם Docetaxel במחקר פאזה שלישית, לאחר שהפאזה השנייה של המחקר הראתה יעילות של הטיפול[27].
טיפול אימונולוגני
ההתפתחויות בהבנת המסלולים האימונולוגיים (Immunology) ופיתוח תרופות אימונומודולטוריות (Immunomodulators) הובילו לתקווה לשינוי מהלך המחלה במספר רב של מחלות ממאירות, כולל בסרטן ריאה. טיפול מסוג זה הדגים יעילות בטיפול במלנומה וסרטן הכליה.
בתהליך החיסוני כנגד תאים זרים, כולל תאי הסרטן, משתתפים מספר גורמים של מערכת החיסון, כולל תאי T שונים (CD4, CD8, NKC, CDTL4, TIL) קולטנים שונים על גבי התאים (PDI, PDLIJ, PDL2) וחלבונים [ציטוקינים (Cytokines), אימונוגלובולינים (Immunoglobulins)].
הקולטן 1-Programmed Death-1) PD) נמצא על פני תאי T ואחראי לסילוק של תאי גידול, כאשר הליגנדים שלו - 1 PDL-2 + PDL (Programmed Death Ligand-1 and 2), נמצאים על פני תאי הגידול והקשירה ביניהם גורמת לעיכוב פעילות המערכת החיסונית כנגד תאי הגידול. נוגדנים חד שבטיים כנגד חלבונים אלו מונעים את העיכוב ומאפשרים למערכת החיסון של החולה לפעול כנגד הגידול. טיפול זה יעיל יותר כאשר קיים ביטוי מולקולרי חזק של החלבון 1-PD בתאי הגידול. קיימים מספר נוגדנים מונוקלונליים כנגד 1-PD - BMS-936558/MDX-1106, ONO-4538, CT-011 ו-MK-3475[28] או כנגד PDL-1 - MDX-1105/BMS-936559, Medl-4736, ו-MPDL-3280A. התכשירים נמצאים בשלבים שונים של מחקר, מפאזה ראשונה ועד שלישית, כאשר MK-3475 (Pembrolizumab) ו-BMS-936558 (Nivolumab) הראו יעילות בטיפול במלנומה[29],[30]. תרופות אלו הראו יעילות בסרטן הריאה במחקרים מוקדמים, בעיקר בחולים מעשנים וחולים עם ממאירות קשקשית.
ביבליוגרפיה
- Shaw etal.Ceritinib in ALK-Rearranged Non-Small-Cell Lung Cancer. N Engl J Med 2014; 370:1189-1197
- ↑ http://www.health.gov.il/PublicationsFiles/Trends_cancer1990-2010.pdf
- ↑ Schrump DS, Altorki NK, Henschke CL, et al. Non-small cell lung cancer. In; (ed.) DeVita VT. Cancer: Principles and Practices of Oncology. Philadelphia: Lippincott Williams & Wilkins. 2005:753-810
- ↑ Schiller JH, Harrington D, Belani CP, etal. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N Engl J Med 2002;346:92-8.
- ↑ Scagliotti GV, Parikh P, von Pawel J, Biesma B, Gandara D, et al Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol. 2008 Jul 20;26(21):3543-51.
- ↑ Folkman J. Anti-angiogenesis: new concept for therapy of solid tumors. Ann Surg. 1972 Mar;175(3):409-16.
- ↑ Sandler A, Gray R, Perry MC, Brahmer J, Schiller JH, Dowlati A, Lilenbaum R, Johnson DH. Paditaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer.N Engl J Med. 2006 Dec 14;355(24):2542-50. N Engl J Med. 2007 Jan 18;356(3):318
- ↑ Reck M, von Pawel J, Zatloukal P, Ramlau R, Gorbounova V, Hirsh V, Leighl N, Mezger J, Archer V, Moore N, Manegold C. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil.J Clin Oncol. 2009 Mar 10;27(8):1227-34.
- ↑ Reck M, Kaiser R, Mellemgaard A, Douillard JY, Orlov S, Krzakowski M, von Pawel J, Gottfried M, Bondarenko I, Liao M, Gann CN, Barrueco J, Gaschler-Markefski B, Novello S; LUME-Lung 1 Study Group. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer (LUME-Lung 1):a phase 3, double-blind, randomised controlled trial. Lancet Oncol. 2014 Feb;l5(2):143-55.
- ↑ Maurice Perol, Tudor-Eliade Ciuleanu, Edward B. Garon etal. REVEL: A randomized, double-blind, phase III study of docetaxel (DOQand ramucirumab(RAM;IMC-1121B) versus DOC and placebo (PL) in the second-line treatment of stage IV non-small cell lung cancer (NSCLC) following disease progression after one prior platinum-based therapy. ASCO 2014, LBA8006
- ↑ Normanno N, De Luca A, Bianco C. etal. Epidermal growth factor receptor (EGFR) signaling in cancer. Gene. 2006;366:2-16
- ↑ Pao W, Girard N. New driver mutations in non-small-cell lung cancer. The Lancet Oncology.20l1;12:175-180
- ↑ Sequist LV, Bell DW, Lynch TJ. etal. Molecular predictor of response to epidermal growth factor receptor antagonists in non-small-cell lung cancer. J ClinOncol. 2007;2 5:587-595.
- ↑ Shigematsu H, Lin L, Takahashi T. etal. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancer. J Natl Cancer Inst. 2005;97:339-346
- ↑ Keedy VL,Temin S, Somerfield MR, Beasley MB, Johnson DH, McShane LM, Milton DT, Strawn JR, Wakelee HA, Giaccone G. American Society of Clinical Oncology Provisional Clinical Opinion: Epidermal Growth Factor Receptor (EGFR) Mutation Testing for PatientsWith Advanced Non-Small-Cell Lung Cancer Considering First-Line EGFR Tyrosine Kinase Inhibitor Therapy J Clin Oncol. 2011 May 20; 29
- ↑ MokTS, Wu YL.Thongprasert S. etal. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med. 2009;361:947-957
- ↑ 16.0 16.1 Maemondo M, Inoue A, Kobayashi K. et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010;362:2380-2338
- ↑ Mitsudomi T, Morita S, Yatabe Y, Negoro S, Okamoto l,Tsurutani J, SetoT, Satouchi M.Tada H, Hirashima T, Asami K, Katakami N.Takada M, Yoshioka H, Shibata K, Kudoh S, Shimizu E, Saito H, Toyooka 5, Nakagawa K, Fukuoka M; West Japan Oncology Group. Gefitinib versu5 cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010 Feb;11
- ↑ Rosell R, Carcereny E, Gervais R, et al, Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC):a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012;13:239-246
- ↑ Sequist LV, Yang JC, Yamamoto N, et al.(2013
- ↑ Wu YL, Zhou C, Hu CP, Feng J, Lu S, Huang Y, Li W, Hou M, Shi JH, Lee KY, Xu CR, Massey D, Kim M, Shi Y, Geater SL. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol, 2014 Feb;15(2);213-22
- ↑ Sequist etal First-in-human evaluation of CO-1686, an irreversible, highly selective tyrosine kinase inhibitor of mutations of EGFR (activating and T790M). ASCO MEETING ABSTRACTS 2014:8010
- ↑ Pasi A. Janne, et al. Clinical activity of the mutant-selective EGFR inhibitor AZD9291 in patients (pts) with EGFR inhibitor-resistant non-small cell lung cancer (NSCLC) ASCO MEETING ABSTRACTS 2014:8009
- ↑ 23.0 23.1 Spigel DR1, et al. Randomized phase II trial of Onartuzumab in combination with erlotinib in patients with advanced non-small-cell lung cancer. J Clin Oncol. 2013 Nov 10;31(32):4105-14.
- ↑ Soda M, Choi, Enomoto M, etal. Identification of the transforming EML4-ALK fusion gene in non-small cell lung cancer. Nature 2007;448:561-6
- ↑ Shlomi et al.Better Selection Model for EML4-ALK Fusion Gene Test in Patients with Non-Small-Cell Lung Cancer.Journal of Cancer Therapy, 2013,4,54-58
- ↑ Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus Chemotherapy in Advanced ALK-PositiveLung Cancer. N Engl J Med; Jun 1,2013
- ↑ Janne PA1, Shaw AT, Pereira JR, Jeannin G, Vansteenkiste J, Barrios C, Franke FA, Grinsted L, Zazulina V, Smith P, Smith I, Crino L 5elumetinib plus docetaxel for KRAS-mutant advanced non-small-cell lung cancer: a randomised, multicentre, placebo-controlled, phase 2 study _ancet Oncol. 2013 Jan;14(1 ):38-47
- ↑ Cancer Control. 2014 Jul;21(3):231-7. PD-1 Pathway Inhibitors: Changing the Landscape of Cancer Immunotherapy, Dolan DE, Gupta S. 28. Brahmer JR.TykodiSS, Chow LQ, etal: Safety and activity olanti-PD-L1 antibody in patients with advanced cancer. N Engl J Med 366:2455-65, 2012
- ↑ Deeks ED.Nivolumab; a review of its use in patients with malignant melanoma. Drugs. 2014 J ul;74(11 ):1233-9
- ↑ Richard Wayne Joseph etal Baseline tumor size as an independent prognostic factor for overall survival in patients with metastatic melanoma treated with theanti-PD-1 monoclonal antibody MK-3475 ASCO MEETING ABSTRACTS 2014:3015
קישורים חיצוניים
- רפואה מותאמת אישית בסרטן הריאות, TheMEDICAL
המידע שבדף זה נכתב על ידי ד"ר מירה וולנר, מנהלת שירות גידולי ריאה, הקריה הרפואית רמב"ם, חיפה ד"ר מור מושקוביץ, שירות גידולי ריאה, הקריה הרפואית רמב"ם, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק