תרופות לטיפול בהפטיטיס B ו-Hepatitis B and C treatment - C
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תרופות לטיפול בהפטיטיס B ו-C | ||
|---|---|---|
| ' | ||
| יוצר הערך | ד"ר מריוס בראון | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפטיטיס
בכל דיון על טיפול תרופתי, יש לקחת בחשבון שהתפתחותו תלויה קשר הדוק באיתור ואפיין מחולל המחלה ובהבנת המנגנונים בהם מחולל זה גודם לפגיעה במאחסן.
התסמונת הקלינית של הפטיטיס עם צהבת תוארה כבר על ידי היפוקרטס.
המונחים הפטיטיס A ו-B נקבעו ב־1947 על מנת להבדיל בין הפטיטיס זיהומית מועברת בהדבקה פומית (A) והפטיטיס המועברת דרך הדם (B). הנגיפים שגורמים להפטיטיס נתגלו מאוחר יותר: נגיף ההפטיטיס HBV-B ב-1960, הפטיטיס HAV-A ב-1973, הפטיטיס דלטא-HDV ב־1977 והפטיטיס C־HCV רק ב־1987[1][2][3][4].
טרום עידן זיהוי הנגיפים, הטיפול בהפטיטיס כלל המלצות למנוחה, כלכלה מזינה ותרופות לטיפול בתסמינים.
בשנות ה־50 של המאה ה-20, החלו להשתמש בטיפול בהפטיטיס בתרופות נוגדות הדלקת הפוטנטיות ביותר- קורטיקוסטרואידים. חלק מהמקרים השתפרו בעקבות טיפול זה, רמת אנדמי הכבד והבילירובין ירדו. לאחר גילוי נגיף ההפטיטיס B הסתבר שאותם מקרים שסבלו מהפטיטיס B לא השתפרו ולמרות שבתחילה נצפתה תגובה טובה, לאחר הפסקת התרופה התלקחה המחלה, לעיתים בצורה קשה בהרבה[5].
גילוי HBVאפשר איתור סמנים לאבחון ומעקב אחר שלבי הזיהום. ועריכת מחקרים לקביעת המהלך הטבעי של המחלה. הראשון להתגלות היה HBs Antigen, אנטיגן חלבון המעטפת המעיד על זיהום בנגיף. המצאות האנטיגן HB e בניסיוב מעידה על רפליקציה גבוהה של הנגיף. הופעה של נוגדנים נגד anti HBeAb -e, מעידה על מעבר לשלב רפליקציה נמוך יותר, לפעמים בדרך להבראה מלאה ולפעמים המשך זיהום כרוני, אבל ברמה נמוכה יותר ופחות נזק לרקמת הכבד. הופעה של נוגדנים נגד anti HBsAb -HBsAg מעידה על הבראה מהפטיטיס B.
הנוגדנים anti HBsAb מגנים מפני זיהום בהפטיטיס b (ראו טבלה 1).
HBVהוא נגיף המורכב מגדיל DNA ומוקף מעטפת.
- טבלה 1 - סמנים של זיהום בהפטיטיס B בנסיוב
| HBsAg | אנטיגן על חלבון המעטפת הסמן הראשון של זיהום כשנמצא בניסיוב מעל 6 חודשים מעיד על מחלה כרונית כמותו מנבאת את הסינוי של מטופל להבריא - הסיכוי להבריא גדול יותר ככל שכמותו נמוכה יותר |
| HBeAj | מעיד על רפליקציה גבוהה של נגיף לא מבוטא אצל נגיפים שעברו מוטציה באזור ה- PRE CORE |
| Anti HBcAb IgG | מעיד על חשיפה לנגיף ולא מקנה חסנות |
| Antl HBcAb IgM | מופיע בעת חשיפה לנגיף לאחרונה |
| Anti HBcAb | מופיע לאחר הבראה מהפטיטים B מושרה על ידי חימון פעיל מקנה חסינות |
| HBVDNA | מעיד על רפלקציה של הנגיף כשמתפתחת עמידות לתרופה רמתו עולה לפני העלייה באנזימ׳ הכבד במקרים מאד נדירים יכול להופיע ללא HBSAG |
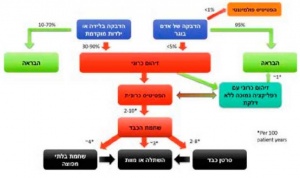
הנגיף אינו גורם נזק ישיר לתאי הכבד. זיהום נגרם כתוצאה מהיחס בין הנגיף למערכת החיסון. תגובה יעילה תוביל להשמדת תאי הכבד המכילים את הנגיף והבראה מלאה, קרי שליטה אימונולוגיה בזיהום, תפקוד כבד תקין והיעדר נגיף מהדם, היסטולוגיה תקינה של הכבד, אך לאו דווקא סילוק הגנום של הנגיף מתאי הכבד. אי לכך, גם באנשים שהבריאו מהפטיטיס B, המחלה עלולה להתעורר במצב של דיכוי חיסוני עמוק. שיתוק חלקי של מערכת החיסון כלפי הנגיף יוביל לזיהום כרוני ודלקת כרונית בכבד בדרגות שונות - מדלקת קלה ביותר ועד דלקת כרונית קשה שגורמת לפיברוזיס בכבד ומתקדמת לשחמת. הנגיף הוא נגיף DNA שעובר אינטגרציה לתוך הגרעין של תאי הכבד ועלול לגרום לסרטן כבד (איור 1). הסיכון לסרטן עולה ככל שהרפלקציה של הנגיף גבוהה יותר (כפי שנמדדת בכמות חומצות הגרעין של הנגיף בניסיוב HBVDNA), משך המחלה ממושך ככל שדרגת הפיברוזיס קשה יותר, אך יכול להופיע גם בנשאי HBV ללא פיברוזיס מתקדם.
בשנת 1957 גילו שני חוקרי חיידקים, Alick Isaacs ו-jean Lindenmann, חומר מופרש מתאים שמגן עליהם מפני זיהום בנגיפים וקראו לו אינטרפרון. בהמשך נתגלה שהחומר יכול לשמש גם לטיפול בממאירויות. היכולת לייצר אינטרפרון באופן תעשייתי הובילה לניסויים קליניים במחלות רבות, והגיוני היה לנסותו כטיפול נגד דלקת נגיפית של הכבד. בניסויים קליניים שנעשו ב-1976 נמצא שטיפול באינטרפרון אלפא יכול לדכא את כל הסמנים של זיהום HBVבסרום ושטיפול מעל חודש יכול להוביל לתגובה ממושכת[6].
אינטרפרון אלפא היה לתרופה הראשונה היעילה בטיפול בהפטיטיס B כרונית. מנגנון הפעולה כולל שפעול מערכת החיסון כדי להשיג שליטה ממושכת בזיהום בהפטיטיס B. הטיפול מוביל להיעלמות HBeAg והופעה של נוגדנים antiHBeAb ולעיתים רחוקות אף היעלמות HBsAg מהדם והופעה של נוגדנים מחסנים anti HBsAb[7]. התוצאות הטובות ביותר מושגות במטופלים עם HBeAg בדם שיש להם עלייה באנזימי הכבד ורפליקציה יחסית נמוכה של הנגיף. היעלמות HBsAg כרוכה בשיפור הפרוגנוזה של המטופלים לטווח רחוק[8].
לטיפול באינטרפרון אלפא מספר חסרונות, חלקם קשורים במבנה וזמן מחצית החיים של החומר המחייב מתן זריקה תת-עורית כל יום או כל יומיים, ותופעות הלוואי הקשורות לפעילות הביולוגית אשר מחקות תופעות שנצפות בזמן תחלואה במחלות נגיפיות כגון שפעת. אינטרפרון הוא ציטוקין שמפעיל Interferon response genes וגורם לשפעול תאי דלקת והפרשה של ציטוקינים וכימוקינים נוספים. תופעות הלוואי הנפוצות הן חום, כאב שרירים, שינוים התנהגותיים, דיכאון, ירידה בספירת הדם ובעיקר טסיות עקב דיכוי מח העצם. תופעות נוספות הנובעות מעצם מנגנון הפעולה הן החמרה במחלות אוטואימוניות ובעיקר לופוס (SLE) והחמרה בדלקת הכבד ודחיית איברים מושתלים, ולכן קיימות התווית נגד לשימוש בטיפול באינטרפרון בחולים הסובלים ממחלות אוטואימוניות ובמושתלי איברים. חולים הסובלים משחמת מתקדמת או דלקת כבד קשה עלולים לסבול מהתלקחות קשה של הפטיטיס עקב טיפול באינטרפרון ולהתדרדר קשות, לכן גם במקרים אלו יש להימנע משימוש בתרופה.
הנגיף עובר רפליקציה על ידי Reverse transcriptase שהוא מייצר בעצמו ולא קיים בבני אדם. עד לשנות ה-90 נוסו מעכבים רבים של רפליקציה וירלית כגון: ,adenine arabinoside, acyclovir zidovudine ribavirine, כולם ללא תועלת משמעותית. היה רושם כי foscarnet שיפר הישרדות במקרים בודדים של דלקת פולמיננטית.
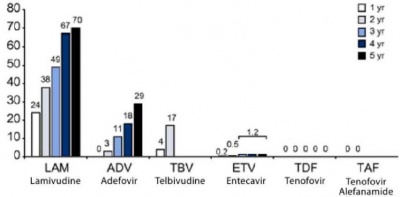
המהפכה האמיתית חלה כשמחקרים קליניים גדולים אישרו יעילות הטיפול הפומי כמעכבי פרוטיאזה נגיפית של HBV, חומרים השייכים לקבוצת ה-Nudeoside/nucleotide inhibitors. טיפול ב-lamivudine למשך שנה הוביל לנורמליזציה של אנזימי הכבד ושיפור במדדי הדלקת בביופסיה של הכבד ב-68% מהמטופלים. בחלק מהמטופלים נצפתה גם השפעה חיובית על הפיברוזיס. הטיפול גרם להופעה של antiHBeAb ב-16% מהמטופלים (טיפול באינטרפרון באוכלוסייה דומה גורם ל־20% מהפך מ-HBeAg ל-HBeAb). השיפור ההיסטולוגי ובאנזימי כבד נצפו אצל כל החולים עם ירידה ב־ HBVDNA. הופעה של מוטציות מסוג ymdd בנגיף מובילה לעמידות ללמיבודין ועלייה ב-hbv-dna ובהמשך באנזימי הכבד למרות המשך הטיפול בתרופה.
מחקרי המשך הראו שחולים שלא פיתחו נוגדנים נגד הנגיף סבלו מהתלקחות של הפטיטיס B לאחר הפסקת הטיפול ב-Lamivudine[8]. מאידך, טיפול ממושך מוביל לשיפור מתמיד, כל עוד לא מופיעה עמידות לתרופה[9][10][11][12]. עד כ-70% מהמטופלים בלמיבודין מפתחים עמידות כעבור 5 שנים, ולכן היה צורך ליצור תרופות עם סף עמידות גבוה יותר (כלומר נדרשות יותר מוטציות כדי שהתרופה לא תהיה יעילה).
מבחינה היסטורית, אחרי למיבודין הוכנס לשימוש adefovir, עם פרופיל עמידות שונה מלמיבודין, ויש חולים המטופלים בהצלחה במשלב של 2 התרופות. telbivudine[13][14][15][16][17] עם עמידות זהה ללמיבודין אבל פוטנטיות רבה יותר בדיכוי הנגיף. התרופות המאוד פוטנטיות בדיכוי הנגיף המומלצות הן entecavir (נדרשות 3 מוטציות) ו-tenofovir (עדיין לא תוארה עמידות)[18][19][20][21],. ב-2017 אושר לשימוש tenofovir alefatenamid שנועד בעיקר למטופלים בסיכון לסבול מאי ספיקת כליות[22]. אלו התרופות היחידות המומלצות כיום על ידי האיגודים המקצועיים הבינלאומיים, אך כל עוד תרופה ותיקה יעילה אין להחליף אותה (טבלה 2).
- טבלה 2 - תרופות פומיות להפטיטיס B
טרם נמצאו מוטציות שמקנות עמידות ל-Tenofovir
| oral drug | antiviral potency | pgrmacologic barrier | genetic barrier | adverse events |
|---|---|---|---|---|
| lamivudine | + | + | 1 | -- |
| adefovir | ++ | + | 1 | nephrotoxicity שווה או גדול מ-1% לשנה |
| entecavir | ++++ | ++++ | 3 | -- |
| telaprevir | ++ | ++ | 1 | myalgia, myositis, neuropathy |
| tenofovir | ++++ | ++++ | ? | cardiac arrhythmia (rare) |
| tenofovir alafenamide | ++++ | ++++ | ? | nephrotoxicity |
- עקרונות הטיפול בהפטיטיס B על ידי מעכבי הטראנסקריפטזה הם
- יש לטפל בחולים הסובלים מהפטיטיס b כרונית עם דלקת ופיברוזיס
- להשתמש כבר בתחילת הטיפול בתרופה פוטנטית עם סף עמידות גבוה
- המשך טיפול עד השגת תגובה חיסונית ועוד 6 חודשים לאחר מכן (הופעה חדשה של anti HBcAB, או anti HBsAB או לצמיתות)
- מעקב אחרי HBVdna כדי לזהות את יעילות הטיפול ובדיקת עמידות במקרה של כישלון טיפולי למרות היענות טובה
- סבילות מצוינת ותופעות לוואי דומות לקבוצות הביקורת
- מאחר שהתרופות אינן מחמירות דלקת משתמשים בהן גם במקרים של דלקת חריפה קשה מאוד וגם למניעת התפרצות המחלה אצל חולים מושתלי איברים ומדוכאי חיסון כגון חולי סרטן, עם תוצאות מצוינות[23][24]
- מאחר שהטיפול הפומי נח רעיל עולה השאלה האם יש עדיין מקום לאינטרפרון
בתחילת שנת 2000 יוצרה מולקולה הכוללת אינטרפרון אלפא המחובר ל-peg (polyethylene glycol). תכשיר זה מוזרק תת-עורית ומאפשר השגת רמות קבועות וגבוהות בהרבה לאורך שבוע ימים בנסיוב[25]. חולים אשר משיגים תגובה ויראלית בעקבות טיפול באינטרפרון זוכים לשיפור היסטולוגי וביוכימי ממושך לאחר טיפול של שנה ב- peginterferon[26]. תופעות הלוואי דומות לטיפול באינטרפרון אלפא, אך טיפול מוגבל בזמן עם אפשרות להשגה של תגובה אימונולוגית ממושכת מהווה יתרון חשוב[27][28][29][30], על מנת להימנע מטיפול מיותר בתרופה נקבעו גורמים מנבאים סיכוי להצלחה לפני תחילת הטיפול - עומס נגיפי נמוך ואנזימי כבד מוגברים ותוך כדי הטיפול ירידת HBVdna ו-hbsag כמותי.
Peginterferon הוא התרופה היחידה לטיפול בזיהום משולב בהפטיטיס D ו-B.
הדרך הטובה ביותר לטיפול במחלה היא למנוע אותה.
הפטיטיס C
עור בטרם נתגלה נגיף ההפטיטיס C, חוקרים ב-NIH השתמשו באינטרפרון כדי לטפל במקרים של non-A non-B) NANB) הפטיטיס, אשר בדיעבד הסתברו רובם כזיהומים בהפטיטיס C[31]. עם גילוי הנגיף הסתבר שמדובר בנגיף ARN, אשר אינו גורם נוק ישיר לתאי הכבד. בדומה לזיהום בהפטיטיס B, הנגיף פיתח מנגנונים לחמוק מהמערכת החיסונית. הנגיף עובר רפליקציה ללא בקרה ותיקון ולכן נוצרים הרבה מאוד תת-זנים. השוני הרב בחלבון המעטפת בין נגיף אחד למשנהו מונע היווצרות חיסון על ידי נוגדנים. הנגיף מעכב גם את שפעול מערכת החיסון התאית לאחר הדבקה. 20%-50% מהחולים יבריאו מהזיהום, כאשר האחרים יסבלו מזיהום כרוני, דלקת כרונית בכבד שהתקדם עם הזמן לשחמת וסרטן כבד, בהפטיטיס C יתפתח סרטן רק במקרים של פיברחיס מתקדם. הפמיטיס C מתאפיינת בשיעור גבוה של מחלות נלוות באיברים אחרים: תופעות אוטואימוניות, פגיעה בבלוטת התריס ובכליות, מחלות ראומטיות, קריאוגלובולינמיה, מחלות עור, מעורבות של המח ומערכת העצבים וגם הפרעות מטבוליות כגון סוכרת. עם זיהוי הנגיף נקבעו גם דרכים לאבחנה: נוגדנים נגד הנגיף בדם (anti HCV) משמשים לבדיקת סקר ומעידים על ויהום בעבר. הימצאות RNA של הנגיף בדם מעידה על זיהום בהווה. היעלמות הנגיף מהדם תוך כדי טיפול נקראת תגובה וירלית, והעדר נגיף מהנסיוב 12 שבועות מתום הטיפול נקראת תגובה וירלית ממושכת (SVR) ומסמלת הבראה לצמיתות מהמחלה. תגובה וירלית כרוכה בדרך כלל בשיפור באנזימי הכבד. SVR מוביל לשיפור היסטולוגי מתמיד לאורך שנים, והקטנת הסיכון להתדרדרות ולסרטן.
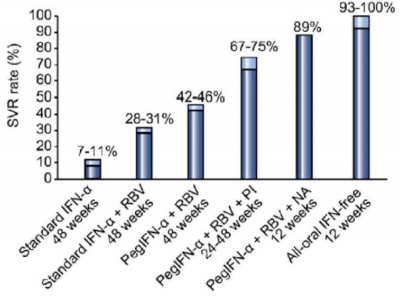
ההצלחה של טיפול באינטרפרון אלפא שניתן 3 פעמים בשבוע נעה נין 6% ל-24 שבועות טיפול ועד ל־16% לאחר 48 שבועות.
Ribavirine הוא חומר הפועל עד מספר נגיפים. בניסויים קליניים הוא הוריד רמות אנזימים אך לא הביא לירידה בעומס הנגיפי כשניתן כטיפול יחיד. הוספה של ריבבירין לאינטרפרון העלה SVR ל־34% ו-42% אחרי 24 או 48 שבועות של טיפול. עם זאת, ריבבירין כרוך בתופעות לוואי מרובות: כאב ראש, פריחה והמוליזה המתווספות לתופעות הלוואי של אינטרפרון וגורמות לנשירה גבוהה במהלך הטיפול.
המצאת Pegylated interferon alpha הובילה לשיפור קטן בסבילות הטיפול ולשיפור משמעותי ביעילותו. היכולת לבדוק כמותית את כמות הנגיף בדם הובילה להבנה של חשיבות התגובה הווירלית המוקדמת בשבוע 4 ו-12 בקביעת הצלחת הטיפול והובילה לפיתוח אלגוריתמים: טיפול של 48 שבועות אם יש ירידה של פי 100 בשבוע 12 (EVR-early viral response) ומניעת המשך טיפול מיותר אס אין ירידה לאחר 12 שבועות של טיפול בזיהום עם גנוטיפ 1. גנוטיפ 2–3 הגיבו לטיפול של 24 שבועות ב-76%-82% SVR. טיפול בגנוטיפ 1 השיג 42% SVR, אבל אם העומס הנגיפי לפני תחילת הטיפול היה נמוך, ה-SVR הגיע עד 78%. היעלמות הנגיף מהסרום לאחר 4 שבועות טיפול (RVR-rapid viral response) בחולים עם פרוגנוזה טובה מאפשרת קיצור טיפול.
השילוב של ribavirine+pcginterferon זכה לכינוי SOC) standard of care).
ההתקדמות במחקר הבסיסי, זיהוי הגנים של הנגיף ופיתוח מודלים בתאים וחיות מעברה אפשרה לעבוד לדוד הבא של התרופות אשר פועלות באופן ישיר על הנגיף (DAA direct acting antivirals) ולא באופן עקיף (על ידי השפעה על מערכת החיסון) (איור 2).
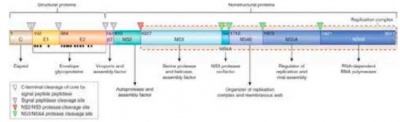
הראשונים שהיו בשימוש קליני הם מעכבי הפרוטיאזה של הנגיף (Pi-protease inhibitors). שתי התרופות הראשונות, boceprevir ו-telaprevir היו מסוגלות להקטין את העומס הנגיפי במהירות אך לזמן קצוב בשל הופעה של מוטציות בנגיף, ולכן היו חייבות להינתן אך ורק כתוספת לאינטרפרון וריבבירין. לצד הישגים בשיפור הצלחת הטיפול, תרופות אלו הגבירו תופעות לוואי כגון פריחה ועקצוץ, אנמיה ואינטראקציות בין תרופתיות מרובות.
הטיפול המשולש הביא לירידה מהירה בעומס הנגיפי, הצלחה טיפולית גם בחולים שנכשלו בטיפול קודם ואפשרות לקיצור הטיפול בחולים שהשיגו RVR, אך הוא יעיל אך ורק נגד גנוטיפ 1 .
גם אינטרפרון ונם PI עלולים לגרום לדקומפנסציה קשה מאח־ אצל חולים עם שחמת מתקדמת.
לאחר 2011 חלה התפתחות אשר שינתה את כל התפיסה של הטיפול בהפטיטיס C.
DAA נוספים נכנסו לניסוי קליני: sofosbuvir -מעכב פולימרזה של הנגיף (NS5B) בשילוב עם soc הביא ל-90% Sofosbuvir (SOF) .SVR פועל בעד כל הגנוטיפים, מאוד פוטנטי ועמידות מאוד נדירה, וזה אפשר מתן שילוב של תרופות פומיות בלבד ללא אינטרפרון - תחילה שילוב של SOF עם ribavirine ובהמשך עם P1[33].
מעכבי הפרוטיאזה (P1) שופרו עד כי הם מאוד פוטנטיים ויעילים כנגד כל הננוטיפים (פאנגנוטיפיים). קבוצה נוספת של DAA היא מעכבי NS5B.
ההצלחה של טיפול במשלב של 2 או DAA3 לתקופה שבץ 8–24 שבועות היא 95%-100% בכל הגנוטיפים ובכל האוכלוסיות חולים מנוסים ב-soc, חולים נאיביים, חולים עם שחמת מפוצה וחולים מדוכאי חיסון (איור 3).
קיים קושי לטפל בחולים עם שחמת מתקדמת הסובלים מזיהום בגנוטיפ 3. יש אחוז נמוך של כשלונות טיפול ומוטציות המקטינות יעלות טיפול. למקרים אלו קיימים משלבים של 3 תרופות מאוד פוטנטיות: מעכבי NS5A NSSB, P1[34] (סיכום טיפולים מומלצים להפטיטיס C בטבלה 3).
כל התרופות נמצאות בסל התרופות הישראלי. ההבדל בץ הטיפולים השונים הוא בהשפעה על גנוטיפים מסוימים או פאנגנוטיפיים, אורך הטיפול, אינטראקציות בין תרופתיות, בטיחות במקרים של שחמת מאוד מתקדמת ותלות בתפקוד כליית׳.
הטיפל כל כך יעיל וצפוי שאין צורך בבדיקת HCV RNA במהלך הטיפול וניתן לצפות שאם כל החולים יאותרו ויטופלו, הפטיטיס C תהיה המחלה הראשונה שתוכחר על ידי טיפול ולא על ידי חיסון. אכן, ארגון הבריאות העולמי קבע את הכחדת הפטיטיס C כיעד עד שנת 2030[35].
טבלה 3.
| Drug/ Site of action | Harvoni | Exviera + Viekirax | Zepatier | Maviret | Epclusa | (*) Vosevi |
|---|---|---|---|---|---|---|
| NS5B polymerase | Sofosbuvir | Dasabuvlr | Sofosbuvir | Sofosbuvir | ||
| NS5A replicase | Ledipasvir | Ombitasvir | Elbasvir | Glicaprevir | Velpatasvir | Velpatasvir |
| NS4-3 protease | Paritaprevirt-ritonavir | Grazoprevir | Pibentasvir | Voxylaprevir | ||
| HCV Genotype | + | + | + | |||
| la | + | + | + | + | + | |
| lb | + | + | + | + | + | + |
| 2 | + | + | + | |||
| 3 | + | + | (*) + | |||
| 4 | + | + | + | + | + | |
| 5 | + | + | + | + | ||
| 6 | + | + | + | + |
(*) VOSEVI מומלץ כקו ראשון אצל חולי שחמת עם גנוטיפ 3, בכל שאר המקרים בקו שני אחרי כישלון טיפולי בתרופות האחרות.
ביבליוגרפיה
- ↑ Blumberg, B. S., Alter, K J.StVisnich, 5. A 'NEW ANTIGEN IN LEUKEMIA SERA. JAMA 191, 541-546 (1965).
- ↑ Prince, A. M. An antigen detected in the blood during the incubation period of serum hepatitis, Proc. Natl. Acad. Sci. U. S. A. 60,814-821 (1968).
- ↑ Feinstone. S. M., Kapikian, A. Z. & Purceli, R. H. Hepatitis A: detection by immune electron microscopy of a viruslike antigen associated with acute illness. Science 182, 1026-1028(1973).
- ↑ A. Choo, Q. L. et al. Isolation of a cDNA clone derived from a blood-borne non-A, non־B viral hepatitis genome. Science 244, 359-362 (1989).
- ↑ Ferenci, P. Historical treatment of chronic hepatitis B and chronic hepatitis C. Gut 34, S69-73 (1993).
- ↑ Greenberg, H. B. et al. Effect of human leukocyte interferon on hepatitis B virus infection in patients with chronic active hepatitis. N.Engl. J. Med. 295, 517-522 (1976(.
- ↑ Niederaa C.et al. Long-Term Follow-up of HBeAg Positive Patients Treated with Interferon Alfa for Chronic Hepatitis B, N, Engl. J. Med. 334,1422-1427(1996],
- ↑ 8.0 8.1 Wang, J״ Wang,M,& Huang, Y. Acute liver failure resulting from discontinuation of nucleoside analogues in chronic hepatitis 8 patients; A report of two cases. Scand. J. infect. Dis. (2012). doi:10.3109/00365548.2012.704152
- ↑ Lai,C.-L. et al, A One-Year Trial of Lamivudine for Chronic Hepatitis B. N. Engl. J. Med. 339.61-68 (1998),
- ↑ Liaw, Y. F״ Chien, R. N.. Yeh, C.T,,Tsai, S. L.& Chu, C. M Acute exacerbation and hepatitis B virus clearance after emergence of YMDD motif mutation during lamivudine therapy. Hepatol. Baltim. Md 30. 567-572 (1999).
- ↑ Had2iyannis, S.J., Papatheodoridis, G. V., Dimou, E., Laras, A, & Papaioannou, C, Efficacy of long-term lamivudine monotherapy in patients with hepatitis & e antigen-negative chronic hepatitis B. Hepatol. Baltim. Md 32,847-851 (2000).
- ↑ Santantonio, T. et al_ Lang-term follow-up of patients with anti-HBe/HBV DNA-positive chronic hepatitis JJ treated for 12 months with lamivudine J. HepatoL 32, 300-306 120001
- ↑ Delaney, W. E,, Yang. H.״ Miller, M. D., Gibbs, C. 5. & Xiong, 5. Combinations of Adefovir with Nucleoside Analogs Produce Additive Antiviral Effects against Hepatitis B Virus In Vitro. Antlmicrob. Agents Chemother. 48,3702-3710 (2004).
- ↑ Gaia. S. et al. Lamivudine resistant chronic hepatitis B: An observational study on adefovir in monotherapy or in combination with lamivudine. J. Hepatol. 48,540-547 (2008).
- ↑ Yeon J E. Resistance toadefovir dipivoxrl m lamivudine resistant chronic hepatitis B patients treated with adefovirdlpivoxil. Gut 55,1488-1495 (2006).
- ↑ Hadziyannis. S. J. et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-negative chronic hepatitis B. N. Engl. J. Med. 348,800-807 (2003).
- ↑ Marcellin. P. et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B. N, Engl. J. Med. 348,80B-816 (2003).
- ↑ Parallel 34: Hepatitis B: Outcomes of Approved Therapy. Hepatology 60,313A 317A (2014).
- ↑ vanBdmmel. F. et al. Long-term efficacy of tenofovir monotherapy for hepatitis B viros-monoinfected patients after failure of nucleoside/nucleotide analogues. Hepatology 51.73-80 (2010).
- ↑ Heathtote, E. J.et al. Three-Year Efficacy and Safety of TenofovirDlsop/oxil Fumarate Treatment for Chronic Hepatitis B. Gastroenterology 140,132-143 (2011),
- ↑ Reijnders, J. G. et al. Antiviral effect of entecavir in chronic hepatitis B: influence of prior exposure to nucleos (t) Ide analogues. J. Hepatol. 52. 493-500 (2010).
- ↑ Byrne, R.. Carey. I.& Agarwal, K, Tenofovir alafenamide in the treatment of chronic hepatitis B virus infection: rationale and clinical trial evidence. Ther. Adv. Gastroenterol. 11. 1756284818786108 (2018).
- ↑ Lampeitito, K et al, t A5L 201I Clinical Practice Guidelines an the management ol hepatitis U virus infection. J. Hepatol. 6/, 370 39a (2U1 ׳׳).
- ↑ Terrault, N. A. et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AA5LD 20 IB hepatitis 6 guidance. Hepatology 67,1560-1599 [2018).
- ↑ Bailon, Retal Rational design of a potent, long-lasting form of interferon: a 40 kDa branched polyethylene glycol-conjugated interferon alpha 2a for the treatment of hepa-litis C. Btoconjug. Chem. 12,195-202 (2001).
- ↑ Cooksley, W. G. E.et al Peginterferon alpha 2a (40 kDa):an advance in the treatment of hepatitis B e antigen-positive chronic hepatitis B. J. Viral Hepat. 10, 298-305 (2003)..
- ↑ Lampertlco, P. et al. Long-term suppression of hepatitis B eantigen-negative chronic hepatitis Bby 24-month Interferon therapy. Hepatol. Baltim.Md 37, 756-763 (2003).
- ↑ Papatheodoridis, G. V_, Manesis, E. & Hadsiyannis, 5. J. The long-term outcome of interferon-alpha treated and untreated patients with HBeAg-negative chronic hepatitis B. J-Hepatol. 34,306-313(2001).
- ↑ Marcellin, P. et al. Peginterferon Alfa 7a Alone, Lamivudine Alone, and the Two in Combination in Patients with HBeAg-Negative Chronic Hepatitis B. N. Engl. J. Med. 351, 1206-1217(2004].
- ↑ Janssen, H. L. A. et al. Pegylated interferon alfa-2b alone or in combination with lamivudine for HBeAg-positive chronic hepatitis B a randomised trial. Lancet Lond. Engl. 365, 123-129 (2005).
- ↑ Hoofnagle, J. K. et al. Treatment of chronic non-A,non-B hepatitis with recombinant human alpha interferon. A preliminary report. N. Engl. J. Med. 315,1575-1578 (1986).
- ↑ Scheel,T. K. & Rice,C. M. Understanding the hepatitis C virus life cycle paves the way for highly effective therapies. Nat. Med. 19, S37 (2013).
- ↑ 33.0 33.1 Pawlotsky, J. M., Feld, J.J., Zeuzem, 5. & Hoofnagfe, J. H. From non-A, non-B hepatitis to hepatitis C virus cure. J. Hepatol. 62,587-99 (2015).
- ↑ Pawlotsky, J.-M. et al. EASL Recommendations on Treatment of Hepatitis C 2018. J. Hepatol. 69. 461-511 (2018).
- ↑ WHO.Combating hepatitis B and C to reach elimination by 2030.
המידע שבדף זה נכתב על ידי ד"ר מריוס בראון, מנהל מכון הכבד, בית חולים בילינסון, פתח תקווה
פורסם ב-חוברת סל הבריאות עמ' 37


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק