חסר חמור בפקטור Severe factor XI deficiency - XI
הופניתם מהדף חוסר פקטור 11 לדף הנוכחי.
| חסר חמור בפקטור XI | ||
|---|---|---|
| Severe factor XI deficiency | ||
| יוצר הערך | ד"ר אופירה סלומון
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפרעות קרישה
גורם קרישה XI נתגלה ב-1953 על ידי רוזנטל וחב'. בעבר נקרא חסר בגורם קרישה XI המופיליה C (Hemophilia C). רמת גורם קרישה XI נמוכה בדם גורמת לדימום לאחר חבלה או לאחר התערבות פולשנית, במיוחד באזורים פיברינוליטיים (Fibrinolytic). אולם, רמה גבוהה גורמת לעלייה בשכיחות אירועי הפקקת הן במערכת הוורידית והן במערכת העורקית. ייתכן שלחסר חמור בגורם קרישה XI יש יתרון אבולוציוני (Evolutionary) לנוכח ירידה בשכיחות אירועים מוחיים איסכמיים ופקקת ורידים עמוקה. הבנה של תפקוד גורם קרישה XI כמייצב הקריש וכמונע את פירוקו הביאה למחקרים קליניים העוסקים בפיתוח נוגדנים לגורם קרישה XI, באירועים שבהם קיימים סיכונים לאירועי תסחיפים פקקתיים. פותח נוגדן, שמטרתו לנטרל את גורם קרישה XI ובכך למנוע המשך יצירת הקריש, מבלי שייגרם דימום. עד כה תכשיר זה ניתן לחיות מעבדה בלבד.
אפידמיולוגיה
בישראל שכיחות חסר מלא בגורם קרישה XI בקרב יהודים אשכנזים היא 1:400 ושכיחות לנשאים 1:10. השכיחות בעולם לחסר מלא היא 1:1,000,000.
אטיולוגיה
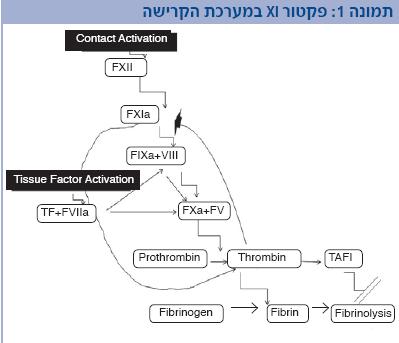
גורם קרישה XI הוא מרכיב חשוב בהמשך יצירת הקריש ויציבותו. גורם קרישה XI משופעל על ידי תרומבין (Thrombin), שהוא האנזים (Enzyme) הגורם להפיכת פיברינוגן (Fibrinogen) לפיברין. בהמשך, התרומבין ממשיך להיות משופעל גם על ידי גורם קרישה XI משופעל ולאחר התהוות קריש ראשוני על ידי גורם קרישה VIIa וגורם רקמתי (Tissue factor) בנוכחות גורם קרישה V וגורם קרישה X פעיל [במערכת מסלול קרישה חיצוני (Extrinsic pathway)], או על ידי גורם קרישה VIII וגורם IX בנוכחות גורם V וגורם X פעיל [במערכת מסלול קרישה פנימי (Intrinsic pathway)] (תמונה 1). יציבות הקריש מיוחסת באופן בלתי ישיר לגורם קרישה XI ונובעת מעלייה בפעילות TAFI (Tissue Activatable Fibrinolysis Inhibitor) (בשל המשך ייצור התרומבין, המונע קישור הפלזמינוגן לפיברין והפיכתו לפלזמין ומכאן ירידה בפיברינוליזיס). הגן לגורם קרישה XI נמצא בכרומוזום 4, מיוצר בכבד כקדם-אנזים ומחצית חייו כ-52 שעות (2,1).
בחולים עם רמות גבוהות של גורם XI נמצא סיכון כפול לפתח פקקת ורידית (16), אולם בספרות הדעות חלוקות לגבי קשר בין רמות גבוהות של הגורם לאוטם שריר הלב. כמו כן, נמצא קשר בין רמות גבוהות של גורם XI לאירוע מוחי (17). כידוע, רמות גבוהות של FXIa מגבירות את יצירת התרומבין באופן משמעותי, וייתכן שזו הסיבה לעלייה בשכיחות אירועי התסחיפים הפקקתיים.
בדרך כלל חסר בגורם קרישה XI הוא תורשתי, ועד כה תוארו 180 מוטציות בגן לגורם XI ([1]). אולם, בשונה מהמופיליה A (חסר בגורם קרישה VIII) או המופיליה B (חסר בגורם קרישה IX), מועבר חסר גורם קרישה XI כתכונה אוטוזומלית נסגת (Autosomal recessive trait). מסיבה זאת, זכרים ונקבות חולים במידה שווה. ייתכן חסר נרכש בגורם קרישה XI הנגרם על ידי התפתחות נוגדן המנטרל את פעילות הגורם. תוארו חולים שפיתחו נוגדנים לגורם XI בעקבות מחלת זאבת ובסרטן. ניתן לחשוד בקיומם של נוגדנים כאשר מיהול עם פלזמה (Plasma) רגילה לא יתקן את רמת הגורם (1).
כיום זוהו כ-180 מוטציות בעולם, מתוכן 5 מוטציות נמצאו כ"אב קדמון" (Founder effect) באוכלוסיות, שתיים מהן בקרב היהודים. במצב שווה אללים (Homozygous) במוטציה Glu117stop המכונה סוג II, לא ייווצר חלבון, ולכן רמת גורם XI לא ניתנת למדידה. המוטציה נמצאת בקרב יהודים ממקור אשכנזי ובשכיחות קטנה יותר ביהודים ממקור עיראקי וכן, בשכיחות נמוכה יותר, גם בקרב פלסטינאים. המוטציה השנייה השכיחה היא Phe283Leu, המכונה סוג III. במוטציה זאת במצב שווה אללים נוצר חלבון לא פעיל והפרשתו לפלזמה נמוכה. רמת גורם XI במצב זה הוא בממוצע 10%. מוטציה זו זוהתה רק ביהודים ממקור אשכנזי. במצב של שונות-אללים מורכבת (Compound heterozygote) (סוג II/III) רמת גורם XI בדם בממוצע היא כ-3%-2% (6). בישראל קיימות מוטציות נוספות בשיעור של כ-3% מבין חסרי גורם XI. המוטציה הבולטת היא סוג I. שתי מוטציות "אב קדמון" אותרו בצרפתים ממקור בסקי - Cys38Arg, מננט - Gln88stop ומבריטניה - Cys128stop (1).
קליניקה
בשונה מההמופיליה הרגילה (A ו-B) החולים אינם מדממים עצמונית, אלא לאחר חבלה או לאחר התערבות כירורגית ובעיקר בהליכים המערבים אזורים פיברינוליטיים (לאחר כריתת שקדים, עקירת שן וניתוחים במערכת השתן) (3). כמו כן, בקרב אוכלוסייה עם חסר חמור בגורם XI נמצא, לאחרונה, שיש ירידה בשכיחות תחלואה בשבץ מוחי איסכמי (7) וירידה בשכיחות לפקקת ורידים עמוקה (8). אולם, נמצא כי אוכלוסייה זו אינה מוגנת בפני אוטם שריר הלב (9). אחד ההסברים לכך הוא השינוי בכלי דם ברקמות שונות (Vascular beds) (10). לנוכח האמור לעיל, לא מפתיע איפה, שחסר קשה ברמת הגורם יקנה יתרון אבולוציוני.
בעכברים מושבתי (Knock-out) גורם XI בדגם ברזל תלת-כלורי (Ferric chloride) לפקקת בווריד הנבוב התחתון נמצאה עמידות להתפתחות פקקת לעומת עכברים רגילים (11). תופעה דומה נראתה גם בדגם עורקי (12). בארנבות האיצה הזרקת נוגדן מול-קריא (Antisense) לגורם קרישה XI פירוק קריש בווריד הצווארי (Jugular vein) (13).
אבחנה
חשד לחסר בגורם קרישה XI מתגלה כיום לאחר שנמצאת הארכה בזמן תרומבופלסטין חלקי (aPTT, Activated Partial Thromboplastin Time). הארכה גבולית חשודה לחסר חלקי, אולם הארכה משמעותית מצביעה על חסר מלא. יש לוודא שאכן מדובר בחסר בגורם XI ולא בחסרים אחרים, כחסר בגורמי קרישה VIII, IX, גורם וון וילברנד (vWF, Von Willebrand Factor) או גורם XII, שגורמים גם הם להארכה ב-aPTT. כיום, רוב החולים עם חסר בגורם XI מתגלים לאחר שנמצאה הארכה ב-aPTT בבדיקת דם, המתבצעת לפני התערבות כירורגית. בעבר, הסיבה השכיחה לאבחון חסר בגורם XI נבעה מדימומים בעת התערבות כירורגית או אחריה, כמו גם לאחר עקירת שן.
מגדירים חסר חמור בגורם XI כרמת פעילות של הגורם בפלזמה לא גבוהה מ-15%. מבחינת שכיחות הדמם, אין הבדלים בשכיחות זאת, אם מדובר ברמת פעילות בפלזמה של 1% ואם מדובר ב-15% (3).
חולים עם רמת גורם XI מתחת ל-1% עלולים לפתח נוגדנים נגד הגורם לאחר טיפול בפלזמה, לאחר קבלת תרכיז גורם XI4 או לאחר חשיפה ל-Anti-D immunoglobulins (5).
טיפול
כיום, הטיפול בחולים עם חסר מלא בגורם XI ניתן לפני התערבות ניתוחית. הטיפול בפלזמה ניתן לחולים ללא נוגדן או חסר חמור ב-IgA (אם אין פלזמה חסרת IgA) או בתרכיז גורם XI (טרם אושר על ידי מנהל המזון והתרופות האמריקאי). יש לציין, שאומנם טיפול בתרכיז בטוח יותר מבחינת זיהומים, אולם קיימת עלייה בהישנות אירועי תסחיפים פקקתיים עם השימוש בו ולכן התכשיר לא ניתן בישראל.
בחולים עם נוגדן לגורם XI ניתן לתת Novoseven RT (rFVIIa ,Recombinant Factor VIIa) במינונים נמוכים ביותר ושונים מאוד מהמינון הנהוג לתת בחולים עם המופיליה רגילה (14) מאחר שאירועי תסחיפים פקקתיים נצפו בחולים עם חסר מלא בגורם XI בעת מתן מינונים גבוהים של Novoseven. ואכן, ההסבר לתופעה זו מבוסס על מודל במבחנה (In vitro) של יצירת תרומבין, המראה שבחולים הלוקים בחסר גורם XI רמות נמוכות של Novoseven יתקנו יצירת תרומבין בהשוואה להיעדר תגובה במינון זהה בחולי המופיליה רגילה (15).
מאחר ש-Novoseven מפעיל את התרומבין במסלול הקרישה החיצוני, כלומר מבצע מעקף על מסלול קרישה פנימי, בעתיד ועם הכנסת rFVIIa סוגני (Generic) ייתכן שהתוויה לשימוש ב-rFVIIa תינתן לכל החולים עם חסר קשה בגורם XI גם ללא נוגדנים ובכך ניתן יהיה למנוע אירועי נזק ריאתי חד לאחר עירוי תוצרי דם (TRALI, Transfusion Related Acute Lung Injury), זיהומים, העמסת נפח ואלרגיות למוצרי דם.
באשר לחולים עם חסר חלקי בגורם קרישה XI, בדרך כלל חולים אלו אינם מדממים, ולעתים קשה לאבחן אותם, מאחר שה-aPTT יכול להיות בטווח התקין. תיתכן שכיחות לדמם אם יש לחולים אלה הפרעה קרישה נוספת. לכן, מומלץ לבצע הערכת מערכת קרישה מלאה חד-פעמית בחולים עם חסר חלקי בגורם הזקוקים לניתוח. כיום, מומלץ לבדוק רמת גורם וון וילברנד, תפקודי טסיות ורמת פיברינוגן.
חשוב לציין, שלאחרונה נמצאו רמות גבוהות של גורם XI פעיל באחד מתכשירי האימונוגלובולינים (Omrigam) שהורדו מהמדף.
נמצא בפיתוח הנוגדן נגד גורם XI מסוג מול-קריא שעד כה נוסה בחיות מעבדה (18) ומנע אירועי פקקת. כמו כן, התכשיר אף האיץ פירוק של קריש לאחר שניתן, אחרי שנוצר קריש ראשוני, הן במערכת הוורידית והן במערכת העורקית, ללא התגברות הדמם.
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- Duga S, Salomon O. Factor XI Deficiency. Semin Thromb Hemost 2009;35(4):416-425
- von dem Borne PA, Meijers JC, Bouma BN. Feedback activation of factor XI by Thrombin in plasma results in additional formation of Thrombin that protects fibrin clots from fibrinolysis. Blood 1995;86:3035-3042
- Salomon O, Steinberg DM, Seligshon U. Variable bleeding manifestations characterize different types of surgery in patients with severe factor XI deficiency enabling parsimonious use of replacement therapy. Haemophilia 2006;12:490-493
- Salomon O, Zivelin A, Livnat T, et al. Prevalence, causes, and characterization of factor XI inhibitors in patients with inherited factor XI deficiency. Blood 2003;101:4783-4788
- Zucker M, Zivelin A, Teitel J, et al. Induction of an inhibitor antibody to factor XI in a patient with severe inherited factor XI deficiency by Rh immune globulin. Blood 2008;111:1306-1308
- Asakai R, Chung DW, Ratnoff OD, et al. Factor XI (plasma thromboplastin antecedent) deficiency in Ashkenazi Jews is a bleeding disorder that can result from three types of point mutations. Proc Natl Acad Sci USA 1989;86:7667-7667
- Salomon O, Steinberg DM, Koren-Morag N, et al. Reduced incidence of ischemic stroke in patients with severe factor XI deficiency.Blood. 2008;111:4113-7.
- Salomon O, Steinberg DM, Zucker M, et al. Patients with severe factor XI deficiency have a reduced incidence of deep-vein thrombosis. Thromb Haemost 2010 in press
- Salomon O, Steinberg DM, Dardik R, et al. Inherited factor XI deficiency confers no protection against acute myocardial infarction. J Thromb Haemost 2003;1:658-661
- Rosenberg RD, Aird WC. Vascular-bed--specific hemostasis and hypercoagulable states. NEJM 1999;340:1555-1564
- Wang X, Smith PL, Hsu MY, et al. Effects of factor XI deficiency on ferric chloride-induced vena cava thrombosis in mice. J Thromb Haemost 2006;4:1982-1988
- Minnema MC, Friederich PW, Levi M, et al. Enhancement of rabbit jugular vein thrombolysis by neutralization of factor XI. In vivo evidence for a role of factor XI as an anti-fibrinolytic factor. J Clin Invest 1998;101:10-14
- Wang X, Cheng Q, Xu L, et al. Effects of factor IX or factor XI deficiency on ferric chloride-induced carotid artery occlusion in mice. J Thromb Haemost 2005;3:695-702
- Livnat T, Tamarin I, Mor Y, et al. Recombinant activated factor VII and tranexamic acid are haemostatically effective during major surgery in factor XI-deficient patients with inhibitor antibodies. Thromb Haemost 2009;102:487-492
- Livnat T, Zivelin A, Martinowitz U, et al. Prerequisites for recombinant factor VIIa-induced Thrombin generation in plasmas deficient in factors VIII, IX or XI. J Thromb Haemost 2006;4:192-200
- Meijers JC, Tekelenburg WL, Bouma BN, et al. High levels of coagulation factor XI as a risk factor for venous thrombosis. NEJM 2000;342:696-701
- Yang DT, Flanders MM, Kim H, et al. Elevated factor XI activity levels are associated with an increased odds ratio for cerebrovascular events. Am J Clin Pathol 2006;126:411-415
- Zhang H, Löwenberg EC, Crosby JR, et al. Inhibition of the intrinsic coagulation pathway factor XI by antisense oligonucleotides: a novel antithrombotic strategy with lowered bleeding risk. Blood 2010;In press
קישורים חיצוניים
- חסר חמור בפקטור XI: האם הוא יתרון אבולוציוני?, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר אופירה סלומון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק