חלבון - Protein - C
הופניתם מהדף חלבון C-Protein לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| חלבון C | |
|---|---|
| C Protein | |
| שמות אחרים | autoprothrombin IIA, autoprothrombin XIV |
| מעבדה | מעבדת קרישה |
| תחום | תרומבופיליה, נטייה לקרישיות-יתר |
| טווח ערכים תקין | במבוגרים – 70-150% או 65–135 IU/dL; או בצורת ביטוי אחרת 70 ננומולר (או 4 מיקרוגרם/מ"ל). תינוקות בלידתם-40 IU/dL; תינוקות בגיל 6 חודשים 60 IU/dL. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הבדלה בין חוסר מולד של חלבון-C (type I) לבין חוסר של type II. הערכה של משמעות הירידה בתפקוד של חלבון-C, בעיקר כאשר חוסר בחלבון זה יכול להיות מולד, בניגוד לחוסר נרכש (כאשר נלקח פומית תכשיר נוגד קרישה, או כאשר יש חוסר בוויטמין K, או במחלת כבד, או בתרחיש של intravascular coagulation and fibrinolysis/disseminated intravascular coagulation). הבדיקה נדרשת גם לסרוק בני-משפחה של מאובחנים עם חוסר ידוע של חלבון-C, או במקרים של נשים עם הפלות חוזרות מסיבה לא ידועה. הבדיקה חיונית להערכת אפיזודות פקקתיות (VTE) בלתי מוסברות בעיקר במצבים הבאים: מטופלים צעירים יחסית בגיל שמתחת ל-50 שנה, פקקת במיקום בלתי רגיל כמו בוורידים המובילים לכליות או לכבד, או בכלי דם במוח. דרישה לבדיקה תיעשה לנבדקים עם סיפור משפחתי של יצירת קרישים, יילודים עם אפשרות של מפגע קרישיות חמור (DIC או purpura fulminans). הבדיקה חיונית גם באנשים שסבלו מקרישי דם בעבר, או באלה שדמם אינו נקרש כראוי.
חלבון-C
חלבון-C הוא זימוגן, שצורתו המשופעלת חיונית בוויסות של מניעת קרישה, דלקת ומות תאים כמו גם שמירה על שכבת האנדותל במניעת מעבר דו-צדדי של חומרים לתוך כלי הדם ומחוצה להם. חלבון-C משופעל (להלן APC), מבצע את פעילויותיו על ידי ביקוע פרוטאוליטי ואינאקטיבציה של פקטורי קרישה Va ו-VIIIa. APC מוגדר כ-serine protease שכן הוא מכיל שייר serine באתר הפעל שלו. הצורה הזימוגנית של חלבון-C היא גליקופרוטאין התלוי בוויטמין K הנעה בפלזמה. המבנה של צורה זו הוא של פוליפפטיד דו-שרשרתי כאשר אחת השרשרות כבדה והאחרת קלה, והן מחוברות בקשר דיסולפידי. הזימוגן של חלבון-C משופעל בהיקשרו לתרומבין, כאשר השפעול נתמך על ידי נוכחות של thrombomodulin ושל endothelial protein C receptors (או EPCRs). מפני ש-EPCR חיוני לשפעול חלבון-C, ניתן למצוא את APC בעיקר בסמוך לתאי אנדותל.
חלבון-C מכונה גם autoprothrombin IIA (Hall ו-Morton ב-Kluwer Academic משנת 1999) וכן blood coagulation factor XIV (mather וחב' ב-EMBO J משנת 1996). הגן המקודד לחלבון-C הוא PROC הממוקם בכרומוזום 2 בעמדה 2q13-q14) על פי Foster וחב' ב- Proc Natl Acad Sci U S A משנת 1985. הגן PROC מורכב מ-9 exons ורצף הנוקלאוטידים שלו אורכו בערך 11,000 בסיסים (Mosnier ו-Griffin ב- Frontiers in Bioscience משנת 2006).
ההיסטוריה של גילוי חלבון-C
תפקידו של חלבון-C כנוגד קרישה באדם התגלה על ידי Seegers וחב' בשנת 1960 והתפרסם ב- Thrombosis Et Diathesis Haemorrhagica. בשנת 1976 היה זה Johan Stenflo שבודד וניקה את חלבון-C מפלזמה של בקר ואפיין את תכונותיו באופן פרלימינרי תוך שמצא שחלבון זה פועל בתלות בוויטמין K, ופרסם את ממצאיו ב-J Biol Chem. למעשה גם השם Protein C נטבע על ידי Stenflo שכן החלבון היה השלישי ("peak C") שעבר אלוציה בכרומטורפיה על עמודת מחליף-יונים DEAE-Sepharose. במקביל, Seegers ניסה לאתר גורמי-קרישה התלויים בוויטמין K שלא ניתן לגלות על ידי בדיקות קרישה המודדות תפקוד קרישה גלובאלי. עד מהרה הכיר Seegers בכך שתגליתו של Stenflo למעשה זהה לממצאיו שלו. מאוחר יותר באותה שנה התגלה חלבון-C המשופעל על ידי Kisiel וחב' ב-Biochemistry משנת 1976, ובשנת 1977 נמצא לראשונה ש-APC גורם לאינאקטיבציה של גורם-קרישה Va (Kisiel וחב' ב-Biochemistry משנת 1977).
בשנת 1980 התגלה ש-APC גורם גם לאינאקטיבציה של גורם-קרישה VIIIa (Behar ו-Davie ב-Biochemistry משנת 1980), ומיד לאחר מכן התגלה ש-protein S פועל כקו-פקטור (Walker ב- J Biol Chem משנת 1980). בשנת 1981, במשפחה אחת עם תסמינים של פקקת ורידית שנלמדה על ידי Griffin וחב' (J Clin Investi), זוהה חוסר של חלבון-C. חוסר הומוזיגוטי של חלבון-C עם תוצאות בריאותיות חמורות תואר בשנת 1984 על ידי מספר חוקרים (Goldenberg ו-Manco-Johnson ב- Hemophilia משנת 2008). השיבוט של cDNA של חלבון-C התבצע לראשונה ב-1984 על ידי Beckmann וחב' שיצרו מפה של הגן האחראי ליצירת חלבון-C בכבד (ב-Nucleic Acids משנת 1985). בשנת 1987 התבצע ניסוי מכונן, בו הודגם ש-APC מנע קרישיות ומוות בקופי בבון שעברו עירוי בריכוז ממית של E. coli (על פי Taylor וחב' ב-J Clin Invest משנת 1987). בשנת 1993 אותרה משפחה עם פרטים הלוקים ב-thrombophilia עם עמידות מורשת לפעילות APC (על פי Dahlbäck וחב' ב-Proc Natl Acad Sci USA משנת 1993). בשנת 1994 המוטציה השכיחה יחסית הגורמת ל-Factor V Leiden העמידה לפעילות APC תוארה (Bertina וחב' ב-Nature משנת 1994).
שנתיים מאוחר יותר התגלה חלבון-C פגום עם חוסר של המקטע Gla (חומצות אמינו 43–88) בשרשרת הקצרה של החלבון באנליזת קריסטלוגרפיה ברזולוציה של 2.8 אנגסטרום. בשנת 2001, עם התחלת פרויקט הניסוי הקליני PROWESS (או PROtein C Worldwide Evaluation of Severe Sepsis) על ידי Bernard וחב' ב-N Eng J Med משנת 2001), בו נבחנו היעילות והבטיחות של טיפול ב-APC ריקומביננטי במצבי ספסיס, נמצא שחלק מתסמיני הספסיס עשויים להשתפר על ידי עירוי של APC, ושיעור התמותה בתרחיש זה פחתו משמעותית. בנובמבר שנת 2001 הטיפול ב-Drotrecogin alfa משופעל, שהוא רקוביננט אנושי של APC משופעל, אושר כתרופה הראשונה ש-FDA אישר לתרחיש חמור של ספסיס (Hosac במסמך ה-FDA משנת 2002, ו-Abraham וחב' ב-N Eng J Med משנת 2005). התכשיר משווק על ידי Eli Lilly & Co בשם המותג Xigris. שנה לאחר מכן, התפרסם מחקר שהראה לראשונה שחלבון-C משפעל את PAR-1 או protease activated receptor-1, מה שמסביר של יכולת המודולציה של APC על מערכת החיסון (Riewald וחב' ב-Science משנת 2002).
התכשיר Xigris עמד במרכזו של פולמוס לוהט. חברת Eli Lilly ניהלה משא שיווקי אגרסיבי לעודד את השימוש בתכשיר זה בקרב מטופלים עם ספסיס חמור או עם הלם ספטי (Eichacker וחב' ב-N Eng J Med משנת 2006). עם זאת, סקירת Cochrane מצאה שטיפול זה אינו משפר הישרדות ואף מגביר את הסיכון של דימום (Marti-Carvajal וחב' ב-Cochrane Database Sys Rev משנת 2012). אכן, באוקטובר 2011 הפסיקה Eli Lilly של שיווק Xigris בגלל תמותה מוגברת של המטופלים בתכשיר במבוגרים.
המבנה של חלבון-C
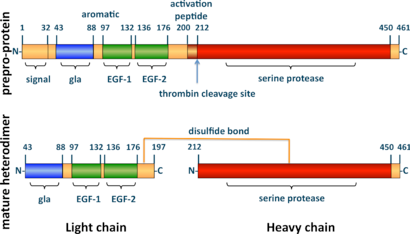
חלבון-C הוא גליקופרוטאין התלוי בוויטמין K אשר מבנהו דומה לזה של חלבונים אחרים התלויים בוויטמין K המשפיעים על קרישת הדם כגון פרותרומבין, וגורמי קרישה 7, 9 ו-10 (על פי Wildhagen וחב' ב-Thromb Hemost משנת 2011). הסינתזה של חלבון-C מתרחשת בכבד, ומתחילה עם מולקולת קודמן מונומרית (preproprotein) המורכבת מ-461 חומצות אמינו, כאשר בקצה ה-N טרמינלי שלו מופיע signal peptide בעל 32 חומצות אמינו. צמוד למקטע זה מופיע מקטע קצר בן 11 חומצות אמינו (33–43) שביקועם מביא ליצירת propeptide (על פי D'ursi וחב' ב-BMC Bioinformatics משנת 2007). חלבון-C נוצר כאשר הדו-פפטיד המורכב מ-Lys198 ו-Arg199 מורחק, מה שגורם להתמרה ליצירת הטרו-דימר עם קרבוהידרט בקשר N על של אחד משני חלקי הדימר. חלבון-C בצורתו הבשלה מכיל שרשרת קצרה עם חומצות אמינו 43–197 שמשקלה המולקולרי הוא 21,000 דלטון, ושרשרת ארוכה עם חומצות אמינו 212–461 שמשקלה המולקולרי 41,000 דלטון. שתי השרשרות מחוברות בקשר דיסולפידי בין שיירי ציסטאין 183 ו-319 Beckmann וחב' ב-Nucleic Acids Res משנת 1985).
חלבון-C לא-פעיל מורכב מ-419 חומצות אמינו במספר מקטעים (domains): מקטע Gla אחד (שיירים 43–88), סגמנט סלילני ארומטי קצר (שיירים 89–96), שני מקטעים דמויי-EGF (שיירים 97–132, ו-136–176), פפטיד השפעול (שיירים 200–211), ומקטע serine protease דמוי-טריפסין (שיירים 212–450) על פי Mosnier ו-Griffin ב-Front Biosci משנת 2006). השרשרת הקלה מכילה את מקטעי Gla ואת המקטעים דמויי-EGF ואת הסגמנט הארומטי. השרשרת הכבדה מכילה את מקטע הפרוטאזה ואת פפטיד השפעול. בצורה זו 85-90% מחלבון-C נע בפלזמה כזימוגן, מצפה לשפעול שלו, המתרחש כאשר מולקולת תרומבין מבקעת את פפטיד השפעול מהקצה ה-N-טרמינלי של השרשרת הכבדה. האתר הפעיל מכיל את טריאדה קטליטית האופיינית לסרין פרוטאזות (His253, Asp299 ו-Ser402). מקטע Gla שימושי במיוחד להתקשרות לפוספוליפידים טעונים שלילית למניעת קרישה, וכן להתקשרות ל-EPCR (endothelial protein C receptor) לצורך הגנה על תאים. מבנה זה מתאים ליכולת חלבון-C לגרום באופן יעיל לאינאקטיבציה של של גורם קרישה Va, וכן לאינטאקציה של חלבון-C עם thrombomodulin.
הפיזיולוגיה של חלבון-C
השפעול של חלבון-C נעזר באופן פעיל על ידי thrombomodulin ועל ידי EPCR, כאשר הקולטן האחרון מופיע בעיקר על תאי אנדותל. הנוכחות של thrombomodulin מחישה את השפעול במספר סדרי-גודל (Nicolaes ו- Dahlbäck ב- Semin Vasc Med משנת 2003), ואילו EPCR מחיש את השפעול פי-20. אם אחד משני הגורמים האחרונים חסר בעכברים טרנסגניים, הם מתים מעודף קרישת-דם עוד בשלב העוברי (Weiler-Guettler וחב' ב-J Clin Invest משנת 1998, ו-Gu וחב' ב-J Biol Chem משנת 2002). על האנדותל, APC הוא בעל תפקיד מרכזי בקרישת דם, דלקת ואפופטוזיס (Esmon ב-Chest משנת 2003). בצורתו המשופעלת, APC יכול להיות קשור אך גם לא להיות קשור ל-EPCR, וזיקתו לקולטן זה דומה לזו של הזימוגן (Mosnier וחב' ב-Blood משנת 2007).
חלבון-C בצורת הזימוגן שלו, נמצא בפלזמה של אנשים בוגרים בריאים בריכוזים של 65–135 IU/dL, ואילו APC נמצא בפלזמה בריכוזים שהם בקירוב פי-2,000 נמוכים יותר. חוסר מתון של חלבון-C מתאים לריכוז של למעלה מ-20 IU/dL; שהוא נמוך משמעותית התחום הנורמה. חוסר חמור-מתון של חלבון-C הוא בטווח הריכוזים של 1–20 IU/dL. חוסר חמור של החלבון הוא בריכוז שמתחת ל-1 IU/dL או שהוא בלתי ניתן לגילוי. רמות חלבון-C ביילודים בריאים שנולדו בעיתם, הוא40 IU/dL ; ריכוזי החלבון ממשיכים לעלות עד גיל 6 חודשים ומגיעים ל-60 IU/dL. בשנות הילדות (מעל גיל 6 חודשים) ריכוזי חלבון-C נותרים נמוכים עד שהם משיגים את ערכי בוגרים לאחר שנות הנעורים. תקופת מחצית החיים של APC היא בערך 15 דקות.
מסלולי פעילות של חלבון-C
רמת הביטוי של APC ופעילותו בגוף מסובכת ביותר. חלבון-C הוא חלבון פליאוטרופי עם שני תפקידים עיקרים: נוגד קרישה ומגן על תאים. הפונקציה המתבצעת על ידי חלבון-C תלויה באם APC נשאר קשור ל-EPCR לאחר שפעולו: ההשפעות נוגדות הקרישה של APC פעילות כאשר APC אינו קשור ל-EPCR. חלבון-C פועל כאנטי-קואגולנט על ידי אינאקטיבציה פרוטאוליטית בלתי-הפיכה של הפקטורים Va ו-VIIIa, והפיכתם ל-Vi ול-VIIIi, בהתאמה. אם APC נותר קשור לEPCR הוא ממלא תפקיד הגנתי על תאים בפעולתו על PAR-1 או protease-activated receptor-1. שתי הפעילויות הללו של APC אינן תלויות זו בזו.
הפעילות של חלבון-C יכולה להיות משוככת על ידי הפחתת הכמות של תרומבומודולין זמין, או של ה-EPCR. זאת ניתן להשיג על ידי ציטוקינים דלקתיים כגון IL-1β ו-TNF-α. ליקוציטים משופעלים מפרישים ציטוקינים דלקתיים אלה במצבי דלקת, תוך עיכוב של יצירת תרומבומודולין ו-EPCR, תוך השריית נשירתם משטח הפנים של תאי אנדותל. כך נוצר שיכוך השפעול של חלבון-C. תרומבין גם כן עשוי להיות בעל השפעה על רמת EPCR. בנוסף, חלבונים המופרשים מתאים יכולים למנוע שפעול חלבון-C, לדוגמה אאוזינופילים, מה שיכול להסביר מצבי פקקת במחלת לב אאוזינופילית. לעומת זאת, חלבון-C יכול להיות משודרג על ידי platelet factor 4. ציטוקין זה משפר את שפעול חלבון-C על ידי יצירת גשר אלקטרוסטטי בין מקטע Gla בחלבון-C לבין מקטע GAG (או glycosaminoglycan) במולקולת תרומבומודולין, ובכך מושגת הפחתת קבוע Michaelis (Km) לפעולתם. במצבי היפר-אאוזינופיליה החלבונים הספציפיים המופרשים מהגרנולות התאיות כגון major basic protein, erythropoietin ו-eosinophil cationic protein, נקשרים לתרומבומודולין ומעכבים את השתתפותו בשפעול חלבון-C.
השפעות נוגדות-קרישה של חלבון-C
חלבון-C הוא מרכיב עיקרי כאנטי-קואגולנט בגוף האדם, ופועל כ- serine protease zymogen. APC מבקע קשרים פפטידיים בגורמי הקרישה המשופעלים Va ו-VIIIa. שני גורמי הקרישה המשופעלים האחרונים הם סייעי קרישה מאוד יעילים על ידי יצירת תרומבין. קו-פקטורים באינאקטיבציה של שני פקטורים משופעלים אלה, כוללים protein S, פקטור V, HDL ופוספוליפידים וגליקוספינגוליפידים אניוניים. פקטור Va נקשר לפרותרומבין ולפקטור Xa, ומגדיל את הקצב של ייצור תרומבין ב-4 סדרי גודל (x10,000). לכן אינאקטיבציה של פקטור Va עוצרת את יצירת תרומבין. מנגד, פקטור VIII הוא קו-פקטור ביצירה של פקטור Xa, אשר הופך פרותרומבין לתרומבין. פקטור VIIIa מגביר של השפעול של פקטור X בערך פי-200,000. בגלל חשיבותו בתהליך הקרישה, פקטור VIII ידוע כגורם אנטי-המופילי, ואכן חוסר פקטור VIII גורם להמופיליה A.
APC גורם לאינאקטיבציה של פקטור Va על ידי שהוא גורם לשלושה ביקועים בחומצות האמינו Arg306, Arg506 ו-Arg679. הביקוע ליד Arg306 ו- Arg506 מפחית את הזיקה של APC לפקטור Xa, כאשר protein S מסייע לתהליך הזה על ידי שהוא מקטלז את הפרוטאוליזה ליד Arg306, אתר בו מקטע A2 של פקטור V נפרד משאר החלבון (Nicolaes וחב' ב-J Biol Chem משנת 1995). Protein S גם נקשר לפקטור Xa תוך שהוא מעכב את האחרון בפעילותו להפחית את האינאקטיבציה של פקטור Va. האינאקטיבציה של פקטור VIIIa אינה ברורה במלואה. תקופת מחצית החיים של פקטור VIIIa היא בערך 2 דקות, אלא אם כן יש נוכחות של פקטור IXa לייצב את פקטור VIIIa. יש המעלים את השאלה מהי משמעות האינאקטיבציה של APC, ולא ידוע מהי דרגת המעורבות של פקטור V ו-protein S בפרוטאוליזה של חלבון-C. ידוע ש-APC פועל על פקטור VIIIa על ידי ביקועו ליד השיירים Arg336 ו-Arg562, כאשר הביקוע של אחד מהם בלבד מספיק לנטרל את פעילות פקטור VIIIa, ולהמיר אותו לפקטור VIIIi.
השפעות להגנת תאים של חלבון C
כאשר APC נקשר ל-EPCR, הוא מבצע מספר תפקידים חשובים להגנת תאים, שרובם דורשים מעורבות של EPCR ושל PAR-1. פעילויות אלו כוללות בקרה של ביטוי גני, השפעות נוגדות-דלקת, השפעות אנטי-אפופטוטיות והגנה על תפקוד האנדותל כמחסום המונע כניסה או יציאה בלתי מבוקרת של מרכיבי דם חשובים או של חדירה של מולקולות חוץ-וסקולאריות. טיפול של תאים עם APC, מדגים שהביטוי הגני של APC משפיע על מספר מסלולים עיקריים המשתתפים בתהליכי דלקת ואפופטוזיס. ישנם כ-20 גנים המשודרגים על ידי חלבון-C, ובנוסף עוד 20 גנים שחלבון-C מדכא: הגנים הראשונים הם בדרך כלל נוגדי מסלולים דלקתיים ואפופטוטיים, ואילו הגנים האחרונים הם סייעים לפעילות דלקתית ולאפופטוזיס. המנגנונים בהם פועל APC לשינוי הביטוי הגני אינם ברורים בשלמות, וההשערה היא שלפחות באופן חלקי יש מעורבות של השפעה מעכבת של גורם שעתוק (transcription factor). חלבונים חשובים ש-APC משדרג הם Bcl-2, eNOS ו-IAP. לעומת זאת יש ל-APC השפעה מדכאת על p53 ועל Bax .
ל-APC השפעות נוגדות-דלקת על תאי אנדותל ועל ליקוציטים. APC משפיע על תאי אנדותל על ידי עיכוב שחרורם של תווכי דלקת (ציטוקינים) וצמצום פעילות של מולקולות ספיחה וסקולריות. פעילות זו מפחיתה את יכולתם של ליקוציטים להיספח ולהסתנן לתוך רקמות, ובכך להגביל נזק רקמתי. APC מגן על תפקוד ה-barrier של האנדותל על ידי שהוא משרה את השפעול של PAR-1 dependent sphingosine kinase-1, ומשדרג את פעילות sphingosine-1-phosphate וכן את sphingosine kinase. APC תומך בתפקוד הסינון של האנדותל ומניעת זליגה או חדירה של מולקולות לא-רצויות למערכת הדם, וכן מחליש את ה-chemotaxis. נראה ש-APC מפחית את התגובה הדלקתית הסיסטמית כגון זו שרואים בספסיס. מחקרים בחולדות ובאדם הראו ש-APC מפחית נזק ריאתי המושרה על ידי אנדוטוקסינים. נראה ש-APC הוא בעל השפעה אנטי-אפופטוטית, אך אין ידע לגבי מנגנון השפעה זו. אנטי-אפופטוזיס מסתייע על ידי שפעול מופחת של האנזימים caspase 3 ו-caspase 8, על ידי שיפור היחס Bax/Bcl-2, והחלשת הפעולה של p53, אך לא ברור באיזה ממנגנונים אלה תומך APC (Bertina וחב' ב-Nature משנת 1994). ידוע גם ש-APC מגן על מערכת העצבים. מספר מחקרים הצביעו על כך שהפעילות הפרוטאוליטית של APC תורמת לתכונותיו המגינות על תאים, אך וריאנטים שאינם פעילים פרוטאוליטית מסוגלים גם כן לווסת את יצירתם של תרומבון ופקטור Xa המשפעלים את PAR בגוף החיה וכן in vitro (Nicolaes וחב' ב-J Biol Chem משנת 2010, ו-Wildhagen וחב' ב-PLos One משנת 2014).
תפקידו של APC במחלה
חוסר גנטי של חלבון-C בצורתו המתונה הכרוכה בהטרוזיגוטיות פשוטה, מגביר את הסיכון של פקקת ורידית במבוגרים. בעובר הומוזיגוטי, או מוגדר כ-compound heterozygous לחוסר חלבון-C, עלולה להתרחש disseminated intravascular coagulation חמורה, וכן VTE כבר ברחם (Goldenberg וחב' ב-Hemophilia משנת 2008), מצב שעלול להיות קטלני טרם הלידה. (Ansell וחב' ב-Chest משנת 2008). שכיחותו של חוסר חלבון-C בקרב פרטים א-תסמיניים היא 1 ל-200–500 איש, כאשר תסמינים חמורים של חוסר זה מתגלים ב-1 ל-20,000 פרטים, ללא כל העדפה אתנית.
עמידות ל-APC מתרחשת כאשר APC אינו מסוגל לתפקד. לעמידות ל-APC יש תסמינים דומים לאלה הנצפים בחוסר חלבון-C. המוטציה השכיחה ביותר הגורמת לעמידות ל-APC בקרב לבנים, היא בנקודת הביקוע של פקטור V לגבי APC. בנקודה זו Arg506 מותמר על ידי גלוטמין, ליצירה של פקטור 5 ליידן. מוטציה זו ידועה כ-R506Q. המוטציה הגורמת לאובדן של אתר ביקוע זה, מונעת למעשה מ-APC להביא לאינאקטיבציה יעילה הן של פקטור Va כמו גם של פקטור VIIIa. לכן הדם נוטה לקרישה מהירה יותר ונטייה מוגברת לפקקת (Dahlbäck ב- J Thromb Haemost משנת 2003). אלה שהם הטרוזיגוטיים למוטציית פקטור 5 ליידן, הם בסיכון הגבוה פי-5–7 לפקקת ורידית מזה שבאוכלוסייה הכללית, ואילו פרטים הומוזיגוטיים למוטציה זו הם בעלי סיכון הגבוה פי-80 (Gillrie וחב' ב-Am J Pathol משנת 2012).
נמק מצריכת קומאדין נובע אף הוא מחוסר APC, הנובע מטיפול בקומאדין. עם זאת, טיפול בקומאדין יכול לייצר באופן פרדוקסאלי נגעי עור הדומים לאלה שמוצאים ב.-purpura fulminans. וריאנט של תגובה זו בא לביטוי כנמק בוורידי הגפה, כאשר קומאדין משמש לטפל ב-DVT הכרוך בממאירות. במוטציות אלו, יש להתחיל בטיפול במינון נמוך של קומאדין, כדי לוודא שחוסר חלבון-C אינו קיים לפני הדיכוי של גורמי הקרישה התלויים בוויטמין K, שהם פקטורים II, IX ו-X. הופעה של purpura fulminans קשורה בדרך כלל לריכוזי חלבון-C בפלזמה שמתחת ל-5 IU/dL. הריכוז הנורמלי של חלבון-C בפלזמה הוא 70 ננומולר (4 מיקרוגרם/מ"ל) עם תקופת מחצית חיים של 8 שעות (Griffin וחב' ב-J Clin Invest משנת 1981). בתינוקות בריאים בהיוולדם לאחר היריון מלא רמות חלבון-C נמוכות יותר ובעלות טווח רחב יותר שנע בין 15–55 IU/dL, בהשוואה לתינוקות בוגרים יותר או למבוגרים. ריכוזי חלבון-C עולים בהדרגה ב-6 חודשי החיים הראשונים. רמות חלבון-C יכולות להיות נמוכות מ-10 IU/dL ביילודים הנולדים טרם-עת, או בתאומים, או בתינוקות הסובלים ממצוקה נשימתית, ללא הופעה של purpura fulminans או של disseminated intravascular coagulation (Chalmers וחב' ב-Arch Dis Child משנת 2011).
משמעות APC בקליניקה
APC נחקר גם כאמצעי לטיפול בפגיעה ריאתית, לאחר שנמצא שבאלה עם פגיעה ריאתית. רמות מופחתות של APC באזורים ספציפיים של הריאות היו כרוכים בתוצאים חמורים יותר. APC נחקר גם בהקשר לטיפול עם APC במקרים של שבץ מוחי איסכמי, מצב חירום בגלל חסימה עורקית במוח. מחקרים הנראים מבטיחים מרמזים לכך שטיפול משולב של APC עם tPA עשוי להגן על המוח מתופעות לוואי מאוד מזיקות העלולות להופיע מטיפול יחידני עם tPA, בנוסף למניעת מות תאי מוח כתוצאה מהיפוקסיה (Griffin וחב' ב- Blood Cells, Molecules & Diseases משנת 2006).
קיימות 2 תת-צורות של חוסר מולד של חלבון-C:
- Type 1 הוא פגם כמותי המאופיין על ידי הפחתה במקביל הרמות האנטיגניות והתפקודיות של חלבון-C ל-50% של הנורמה
- Type 2 הוא פגם איכותי עם הפחתות ברמת חלבון-C ללא פגיעה בתפקודו.
השכיחות של חוסר חלבון-C באוכלוסייה הכללית מוערכת כ- 0.2-0.4%, ואילו החוסר שלו בקרב אלה עם VTE מוערך כ-3-5%.
שלוש תסמונות כרוכות עם חוסר חלבון-C:
- VTE בבני-עשרה ובמבוגרים
- purpura fulminans סב-לידתית, ביילודים הומוזיגוטיים או הטרוזיגוטים-כפולים
- נמק עורי המושרה על ידי קומאדין
חוסר נרכש של חלבון-C מופיע במגוון של תרחישים קליניים, כולל מחלות כבד, זיהומים, הלם ספטי, disseminated intravascular coagulation, תסמונת של מצוקה נשימתית חריפה (ARDS), מצבי עקה שלאחר ניתוחים, או בהקשר של נטילת תרופות כימותרפיות. האבחון של חוסר חלבון-C מתבצע על ידי בחינה תפקודית המבוססת על שפעול עם תרומבין-thrombomodulin או עם ארס נחשים. היריון, או נטילה פומית של גלולות למניעתו או צריכת stanozol, יכולים להגביר רמות חלבון-C בפלזמה. לעומת זאת, רמות חלבון זה פוחתות באירועים פקקתיים חריפים, או כתוצאה מנטילת קומאדין. בהיעדר טיפול בקומאדין או מצבים רפואיים ידועים הגורמים לחוסר נרכש של החלבון, אלה עם רמות חלבון-C הנמוך מ-55% מרמתו הנורמלית סובלים בסבירות גבוהה מאי-תקינות גנטית. כאשר רמות החלבון הן 55-65% מרמת הנורמה, נראה שמדובר ברמות נורמה נמוכות יחסית באותם נבדקים.
חוסר בחלבון-C
חלבון-C משופעל (APC) הוא נוגד קרישה טבעי הנכנס לפעולה עם יצירת תרומבין. שפעול הזימוגן של חלבון-C מסתייע על ידי הגליקופרוטאין thrombomodulin הנוצר בתאי האנדותל. תחילת היצירה של תרומבין מביאה להשפעה נוגדת-קרישה על ידי שפעול חלבון-C, כיוון שהזיקה של תרומבין לשפעל את חלבון-C גבוהה יותר כאשר יש נוכחות thrombomodulin, מאשר הזיקה של תרומבין וגרימת ביקוע פרוטאוליטי לפיברינוגן ולחלבוני קרישה אחרים. הגורם המגביל את שפעול חלבון-C בהשפעה של תרומבין, יכול לנבוע מהמספר המוגבל של אתרי קישור ל-thrombomodulin על פני האנדותליום. הקולטן האנדותליאלי של חלבון-C או EPCR, הקושר את חלבון-C תורם למיקום של הקומפלקס תרומבין-thrombomodulin וכך משופעל חלבון-C ליצירת APC. ביחד עם הקו-פקטור protein S, APC נקשר לאנדותליום וממברנות משופעלות של טסיות-דם פועלות כנוגדי-קרישה על ידי על ידי פקטור Va ו-VIIIa ששופעלו לאחר ביקוע פרוטאוליטי של תרומבין, ובכך הוחלשה יצירה נוספת של תרומבין.
השכיחות של חוסר חלבון-C באלה עם סימנים קליניים מוערכת כ-1 מתוך 20,000 (Dahlback ב-Thromb Res משנת 1995. אלה שהם הטרוזיגוטים לחוסר החלבון מהווים 0.14-0.50% מהאוכלוסייה הכללית (Miletich וחב' ב-N Eng J Med משנת 1987, ו-Tait וחב' ב-Thromb Hemost משנת 1995). בהתבסס על שיעור נשאים מוערך של 0.2%, ניתן לצפות לשיעור חוסר הומוזיגוטי של חלבון-C של מקרה אחד לכל 4 מיליון לידות, למרות שזוהו פחות מקרים במציאות, שכן תאורטית עוברים הומוזיגוטים לחוסר זה מתים ברחם, או שהם מתים בגיל של מספר שבועות לפני אבחון המפגע.
חוסר חלבון-C יכול להיות מולד או נרכש (Miletich ב-Semin Thromb Hemost משנת 1990). חוסר נרכש של חלבון-C יכול להיגרם על ידי סינתזה מופחתת שלו בגלל מחלת כבד, ניצול מוגבר של החלבון ב- disseminated intravascular coagulation, או איבוד שלו בשתן בתסמונת נפרוטית. חוסר תפקודי של חלבון-C גורם בעיקר לפקקת ורידית, ורק באחוז קטן מהמקרים לפקקת עורקית. חוסרים בחלבון-C מוצאים בפחות מ-5% של מטופלים עם נטייה לקרישיות-יתר. כ-75% מאלה עם חוסר הטרוזיגוטי של חלבון-C, יסבלו במהלך חייהם מ-VTE. כאשר VTE מתרחש, ב-30% מהקרים הוא נכרך עם היריון, נטילת גלולות למניעת היריון, מצבי דלקת או זיהומים, טראומה של ניתוח וכו'. חוסר הומוזיגוטי של החלבון כרוך ב- neonatal purpura fulminans ועלול להסתיים במוות אם אינו מטופל תוך 3 ימים מהלידה. לפני שנת 1999 תוארו רק 16 מקרים של חוסר הומוזיגוטי של חלבון-C.
הקולטן האנדותליאלי של חלבון-C
הקולטן endothelial protein C receptor או EPCR, מקודד באדם על יד הגן PROCR. קולטן זה קיבל את השם CD201 (או cluster of differentiation 201). הקולטן EPCR הוא חלבון ממברנלי type 1 אליו קשורים קרבוהידרטים בקשרי N, והוא מחיש כאמור את השפעול של חלבון-C. קולטן זה שייך למשפחת חלבוני MHC class I/CD1, המאופיינת על ידי שקע מבני עמוק המשמש בקולטנים בני משפחה אחרים (אך לא ב-EPCR) לצורך קישור אנטיגן. בדומה לחלבוני CD1, גם EPCR מכיל ליפיד בשקע אליו נקשר חלבון-C, ליפיד שהוא בדרך כלל phosphatidylcholine, אך יכול להיות גם phosphatidylethanolamine (Fukudome ו-Esmon ב-J Biol Chem משנת 1994, Rothbarth וחב' ב-FEBS let משנת 1999, ו-Esmon ב-Crit Care Med משנת 2004).
בדיקות למדידת רמת חלבון-C
אנשים עם חוסר של חלבון-C או כאלה עם פגם בשפעול של חלבון זה נמצאים בסיכון מוגבר לפקקת (Esmon ב-Chest משנת 2003). הצורה הלא-פעילה של חלבון-C נעה בדם ודומה במבנה שלה לחלבונים אחרים תלויי-ויטמין K המשפיעים על קרישת הדם, כגון פקטורים IX, VII ו-X, כמו גם פרותרומבין. כאשר חלבון-C בלתי פעיל נקשר לתרומבין, החלבון משופעל. APC הוא בעל תקופת מחצית חיים של 15 דקות (Hezard וחב' ב-Thromb Hemost משנת 2007). חוסר של APC נכרך עם 160 מוטציות בגן PROC שהתגלו (Manco-Johnson וחב' ב-J Pediatr משנת 1991), לכן בדיקות DNA להבנת החוסר בחלבון-C מוגבלות למעבדות המתמחות בביולוגיה מולקולרית (Khor ו-Van Cott ב-Am J Hematol משנת 2010).
המבדק הידוע כ-aPTT-based functional protein C assay עלול להביא לתוצאות מטעות של רמות נמוכות של חלבון-C בנוכחות של:
- מוטציית Leiden בפקטור V ומספר גורמים נוספים לעמידות ל-APC
- רמות מוגברות בפלזמה של פקטור VIII
- היפרליפידמיה
בנוסף, בנבדקים עם lupus anti-coagulant או בנבדקים המטופלים עם מעכבים ישירים של תרומבין, עלולה להתקבל תוצאה נורמלית כזובה של רמת חלבון-C במבדק התפקודי המבוסס על aPTT. חוסר של גורמים אחרים - אנטי-תרומבין נמוך, ומצבים מורשים כמו factor V Leiden או מוטציה 20210 ב-prothrombin, יכולים להחמיר את ההשפעה של חוסר בחלבון-C.
מבדקים אבחוניים
ישנם 2 סוגים עיקריים של מבדקים למדידת חלבון-C, מבדק של פעילות החלבון, או מבדק כמותי להערכת כמותו בגישה אימונולוגית (D'Ursi וחב' ב-BMC Bioinformatics משנת 2007). זמינות ערכות מסחריות למדידת פעילות החלבון, המבוססות על גישה כרומוגנית, המשתמשות בשפעול על ידי ארס נחש מסוג Agkistrodon contortrix, בגישת ELISA (על פי Rovida וחב' ב-Hum Mutat משנת 2007). חזרה על מבדקים אלה לאחר פרקי זמן, מאפשרים הערכה האם בין חוסר בר-חלוף של חלבון-C או שמדובר בחוסר קבוע מולד (Williams וחב' ב-Br J Hematol משנת 2002). במבדק הכרומוגני, פלזמה דלה בטסיות-דם עוברת הדגרה למשל 5 דקות בטמפרטורה של 37°C עם protein C activator (Protac). בתום ההדגרה מוסיפים מצע כרומוגני ל-APC, ונמדד השינוי ב-OD, ומשווים אותו לשינוי המופיע בעקומת כיול של סטנדרט, וכך נקבעת רמת חלבון-C.
בתחילה, נהוג לבצע את המבדק התפקודי של פעילות חלבון-C, ואם התוצאה מתקבלת נמוכה יש לשקול את ביצוע הבדיקה לבחינת החוסר הכמותי של חלבון זה, להערכה האם מדובר איזה משני תת-הסוגים 1 ו-2 חסר. בחוסר של type 1, בדרך כלל מדובר בחוסר כמותי של החלבון, ואילו בחוסר של type 2, בדרך כלל מדובר בסינתזה של חלבון לא פונקציונאלי.
אינטרפרטציה של התוצאות
רמות מוגברות של חלבון-C הן חסרות משמעות קלינית, ואינן כרוכות בבעיות רפואיות. רמה נמוכה של חלבון-C עלולה לגרום לקרישיות-יתר. אם חלבון-C נמצא ברמה תקינה אך פעילותו לקויה, הביקורת על תהליך הקרישה אינה מספקת מה שעלול לגרום להופעת קרישי-דם ולחסימת ורידים. הבדיקות המשמשות לבחינת חלבון-C יכולות לכלול בדיקות ELISA, בדיקות כרומוגניות, ובדיקת aPTT או activated partial thromboplastin time. מבחן להערכת יצירה של תרומבין מסוגל אף הוא לזהות חוסר של חלבון-C. עם זאת, אין שום בדיקה יחידנית שהיא ספציפית או רגישה דייה לגלות אי-סדירות של חלבון-C.
בדיקת ELISA מודדת רמות חלבון-C ברגישות מאוד גבוהה, אך אינה מסוגלת לזהות פגם תפקודי של החלבון. מבחני ELISA מסוימים מסוגלים לזהות חלבון-C שנמצא בקומפלקס עם המעכב שלו, אך מבחני ELISA אחרים אינם מסוגלים לכך. בדיקות כרומוגניות יכולות לגלות רמות נמוכות של חלבון-C ברגישות גבוהה, ויכולה גם את רוב הפגמים התפקודיים של החלבון. הפגמים שאינם ניתנים לגילוי כוללים קישור לקוי לפוספוליפידים כתוצאה ממוטציה במקטע Gla, כיוון שהבדיקה הכרומוגנית אינה תלויה בפוספוליפידים.
הוראות לביצוע הבדיקה
לפני ביצוע הבדיקה צריך להמתין לפחות 10 ימים מהאירוע הפקקתי האחרון. במידת האפשר הנבדק צריך להפסיק נטילה פומית של נוגדי-קרישה למשך שבועיים לפני ביצוע הבדיקה. הדם נלקח במבחנת סודיום-ציטראט (פקק תכלת) לקבלת פלזמה דלת טסיות-דם. לצורך זה לאחר סרכוז ראשון, מופרדת הפלזמה מכדויות הדם האדומות, ועוברת סרכוז נוסף להפחית במידת האפשר את מספר הטסיות בנוזל. יש להקפיא מיד את הפלזמה-דלת-הטסיות בטמפרטורה של מינוס 40 מעלות צלזיוס, או אף נמוכה מזאת אם מקפיא כזה זמין. נוכחות טסיות דם עלולה לתת תוצאה מעוותת לכן יש צורך בשני סרכוזים. אם הנבדק מטופל באופן שגרתי בקומאדין, עובדה זו צריכה להילקח בחשבון שכן קומאדין מפחית את רמת חלבון-C. דגימות פלזמה מאוד המוליטיות או ליפמיות צריכות להיפסל, אם כי דגימות המוליטיות או ליפמיות באופן מתון יכולות להתקבל לביצוע הבדיקה. הפלזמה הקפואה יכולה להישמר עד 14 יום. הבדיקה מתבצעת על ידי ELISA.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק