הבדלים בין גרסאות בדף "פירובאט קינאזה - Pyruvate kinase"
| שורה 12: | שורה 12: | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | מטרת הבדיקה: בירור מקרים מולדים של nonspherocytic hemolytic anemia. סריקה של משפחות עם חסר באנזים pyruvate kinase כדי לקבוע בהן את סוג המפגע לצורך ייעוץ גנטי. | + | '''מטרת הבדיקה''': בירור מקרים מולדים של nonspherocytic hemolytic anemia. סריקה של משפחות עם חסר באנזים pyruvate kinase כדי לקבוע בהן את סוג המפגע לצורך ייעוץ גנטי. |
==בסיס פיזיולוגי== | ==בסיס פיזיולוגי== | ||
גרסה אחרונה מ־14:39, 2 במרץ 2015
| מדריך בדיקות מעבדה | |
| פירובאט קינאזה | |
|---|---|
| pyruvate kinase | |
| שמות אחרים | PK, RBC pyruvate kinase |
| מעבדה | כימיה בדם, המטולוגיה בדם או בכדוריות דם אדומות |
| תחום | בירור אנמיה המוליטית לא ספרוציטית |
| טווח ערכים תקין | מדידת האנזים בנסיוב - בגברים ונשים ביחידות של U/L: 46±15; ביחידות של μmol/h/ml - בתינוקות עד גיל שנתיים - 5.8±2.1; בילדים עד גיל 10 שנים - 4.1±1.2; במבוגרים - 1.9±0.3. מדידת האנזים בהמוליזאט - בגברים ונשים ביחידות של U לכל גרם המוגלובין - 15.0±1.99; ביחידות של U לכל 10 בחזקת 12 אריתרוציטים - 435±57.7; ביחידות של U למ"ל של אריתרוציטים - 5.10±0.68. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה: בירור מקרים מולדים של nonspherocytic hemolytic anemia. סריקה של משפחות עם חסר באנזים pyruvate kinase כדי לקבוע בהן את סוג המפגע לצורך ייעוץ גנטי.
בסיס פיזיולוגי
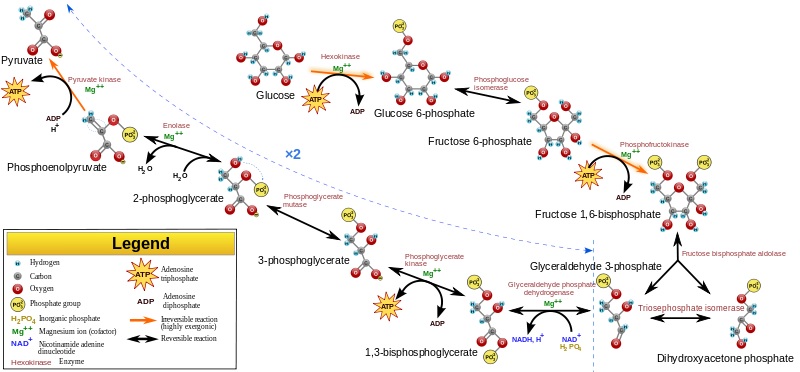
האנזים פירובאט קינאז (להלן פ"ק) הוא אחד מאנזימי מסלול הגליקוליזה, והוא מקטלז את הטרנספר של קב' פוספאט מ-PEP או phosphoenolpyruvate ל-ADP, ליצירת מולקולת פירובאט ומולקולה אחת של ATP. ריאקציה דורשת יון מגנזיום כקו-פקטור, והיא מהווה את השלב העשירי והאחרון במסלול הגליקוליטי האירובי. לעומת זאת בתהליך גליקוליזה אנאירובי, האנזים lactate dehydrogenase ישתמש במולקולת NADH המיוצרת כתוצאה מפעילות האנזים glyceraldehyde phosphate dehydrogenase על מנת לחזֵר פירובאט ליצירת לקטאט. פ"ק מכיל 4 איזואנזימים: שני איזואנזימים (PKM1 ו-PKM2) מקודדים על ידי גן הממוקם באתר הכרומוזומאלי 15q22, וניתן למצאם בשריר מפוספס, במוח, בעובר, בלויקוציטים, בטסיות-דם, בריאות ובטחול, בכליות, וברקמת שומן. שני האיזואנזימים האחרים (PKL ו-PKR) מקודדים על ידי האתר הכרומוזומאלי 11q2, והם נמצאים בנורמובלסטים ברטיקולוציטים, באריתרוציטים ובכבד (Berghout וחב' ב-Genes Immun משנת 2012). הריאקציה של האנזים פ"ק, היא אחת מ-3 ריאקציות אנזימטיות במהלך הגליקוליזה עם מאזן אנרגיה חופשית שלילית, ואכן שלושת השלבים הללו מווסתים את סך המהלך הגליקוליטי והם בלתי-הפיכים.
תפקידו של פ"ק בגלוקונאוגנזה
פעילות האנזים פ"ק מווסתת על ידי מספר גורמים: א. רמת הסובסטרט PEP, וכן רמת תוצר הביניים של הגליקוליזה fructose 1,6-bisphosphate, מחישות את פעילות האנזים. ב. מולקולות דוגמת ATP ו-acetyl CoA הנוצרות במהלך הגליקוליזה משמשות כמעכב אלוסטרי שלילי. גם אלנין שהוא תוצר ביוסינטתי של פירובאט משמש לעיכוב אלוסטרי שלילי של פ"ק. ג. בכבד עובר האנזים פ"ק אקטיבציה על ידי אחד מתוצרי הגליקוליזה, fructose-1,6 biphosphate.
בכבד, פ"ק מווסת ישירות גם על ידי אפינפרין דרך פעילות האנזים protein A kinase. אנזים אחרון זה מזרחן בכבד את פ"ק וגורם לו לאבד פעילותו. האנזים פ"ק בשריר אינו מעוכב על ידי האקטיבציה של protein kinase A על ידי אפינפרין. גם גלוקגון מעכב פעילות פ"ק בכך שהוא מעודד הפרשת גלוקוז האגור בתאי הכבד לזרם הדם, ובכך מפחית בכבד את זמינות גלוקוז ואת הפעילות הגליקוליטית. עליה ברמת סוכר בדם, גורמת להפרשת אינסולין, המשפעל את האנזים phosphoprotein phosphatase I, מה שגורם לדה-פוספורילציה לשפעול האנזים פ"ק. גורמים מווסתים אלה מונעים את פעילות האנזים פ"ק בעת ובעונה אחת עם אנזימים המקטלזים את הריאקציה ההפוכה (pyruvate carboxylase ו-phosphoenolpyruvate carbokinase, מה שמונע מעגל מטבולי חסר תוחלת (futile cycle).
האנזים פ"ק משמש גם כאנזים רגולטורי בתהליך הגלוקונאוגנזה בכבד, בו הכבד מייצר גלוקוז מפירובאט ומסובסטרטים נוספים. כאשר פירובאט קינאז מעוכב על ידי זרחון, נמנע מהסובסטרט שלו-PEP, להפוך לפירובאט. לחילופין, מוסב PEP לגלוקוז בסדרה של ריאקציות במסלול הגלוקונאוגנזה, שהן למעשה פועלות בכיוון הפוך לגליקוליזה. הגלוקוז שנוצר בדרך זו מורחק מהכבד, מה שמספק אנרגיה לרקמות חיוניות במצבי צום.
חסר של האנזים פ"ק
חסר באנזים זה הוא אחד הפגמים האנזימטיים השכיחים ביותר באריתרוציטים. פגם זה מתבטא קלינית כאנמיה המוליטית בגין חסר ATP באריתרוציטים, כאשר חומרתו הקלינית נעה בין אנמיה מתונה לאנמיה חמורה בגיל הילדות. יחד עם זאת במפתיע התסמינים הקליניים חמורים פחות ממה שהיה צפוי על בסיס מה שמצביעים המדדים ההמטולוגיים. זאת כנראה בגין העברה מוגברת של חמצן כתוצאה מהפגם באריתרוציטים (Kedar ב-Clin Genet משנת 2009). רוב הסובלים מפגם אנזימטי זה אינם זקוקים לטיפול, אם כי ברוב המקרים החמורים אנמיה קשה בעוברים עלולה לגרום למותם ברחם. לעתים יהיה צורך בניתוח להסרת הטחול או בעירויי-דם, אך רוב התסמינים כאמור מוגבלים לגיל מאוד צעיר או למקרים של תרחישי עקה פיזיולוגית או זיהומים.
האפידמיולוגיה של חסר פ"ק
חסר של פ"ק היא הסיבה האנזימטית השכיחה השהייה במעלה לאנמיה המוליטית כתוצאה מחסר G6PD. חסר של פ"ק נחשב לתרחיש האנזימופתי השכיח ביותר של גליקוליזה אנארובית. השכיחות של הטרוזיגוטים נשאים של גן אחד פגום של פ"ק, היא כ-1% בסקר אוכלוסייה בארה"ב. Beutler ו-Gelbart העריכו שהומוזיגוטיות לפגם זה מופיעה ב-1 ל-20,000 פרטים באוכלוסייה הלבנה בארה"ב. ידוע יחד עם זאת שהשכיחות של חסר פ"ק, גדולה בהרבה בקבוצות אוכלוסייה אקסקלוסיביות כמו כת ה-Amish בפנסילבניה ובאוהיו, כמו גם במספר אזורים מבודדים בדרום יוטה. Beutler ו-Gelbart השתמשו בשיטה של allele-specific oligonucleotide hybridization לסרוק 3,785 פרטים מקבוצות אתניות שונות לגבי 4 מוטציות השכיחות ביותר: C1456T ,T1468C ,C1484T ו-G1529A. מספר מקרי חסר באנזים פ"ק שהתגלו בשיטה המולקולארית, היה גדול בהרבה ממספר המקרים שהתגלו באופן קליני, מה שמצביע על כך שמפגע אנזימטי זה ברובו הגדול נותר בלתי מאובחן קלינית.
למרות שחסר פ"ק נפוץ בעולם כולו, רוב המקרים המדווחים מתרחשים בצפון אירופה וביפאן, בנוסף לארה"ב. מחקר סקר שנערך בהודו לאיתור מקרים של חסר פ"ק בתינוקות שנולדו עם צהבת, מצא ש-3.2% מכלל התינוקות שנולדו עם צהבת אמנם היו עם חסר ממוצע של 30-40% בפעילות האנזים (Kedar וחב' ב-Indian J Pediatr משנת 2006). יחד עם זאת על פי Carey וחב' במאמר ב-Blood משנת 2000, ההשערה שמספר המקרים של חסר בפ"ק במדינות צפון אירופה, נולדה על רקע הנגישות הגדולה יחסית לבדיקת המעבדה של פעילות אנזים זה בארצות אלה, ואינה משקפת שכיחות גבוהה יותר באופן משמעותי על מה שמקובל במדינות אחרת. ואכן, השכיחות של נשאים הטרוזיגוטים של חסר הגן עם אלל פגום אחד, מוערכת כיום כ-1% בגרמניה, 6% בסעודיה ו-3% בהונג-קונג.
השכיחות של מוטציות שונות בגן לפ"ק באוכלוסיות שונות
במגזרים אתניים שונים יש שונות במוטציות האחראיות לחסרים בפ"ק. לדוגמה, המוטציה G1529A נחשבת למוטציה הדומיננטית בקרב הפרטים באוכלוסייה הלבנה בארה"ב ובאירופה. בקרב פרטים בפורטוגל, ספרד ואיטליה עם חסר באנזים זה, שולטת יותר המוטציה C1456T, מוטציה הפוגעת בקינטיקה של האנזים אך עם דרגת חסר מתונה יותר מבחינה קלינית. התגלו כמו כן מקרים של compound heterozygosity, בהם מעורבת המוטציה G1529A, בהם התסמינים הקליניים מתונים בחומרתם, והפגם הגנטי נגרם בנוכחות של שני אללים הטרוגניים רצסיביים בלוקוס הרלוונטי. כמו כן תוארו מקרים עם פגיעה קלינית מתונה בגין המוטציה, 1573delT, בהם היה חסר של חומצת האמינו threonine בעמדה 1573. בקרב אסייאתים בארה"ב הסיבה לחסר האנזים מקורה במוטציה C1468T.
אריתרוציטים בחסר האנזים פ"ק
כיוון שאריתרוציטים אינם מסוגלים לסנתז ATP, הם תלויים באופן מוחלט בגלוקוז כמקור אנרגיה. בדרך כלל גלוקוז מתפרק ליצירת פירובאט ההופך ללקטאט במסלול Embden-Meyerhof, שהוא המסלול האנארובי העיקרי. בתהליך זה נוצרות 2 מולקולות של ATP החיוניות כאמור לאריתרוציטים כמקור אנרגיה. ATP משחק תפקיד מרכזי בשמירה על גרדיאנט הקטיונים בממברנת האריתרוציטים מה ששומר עליהם מתמותה מוקדמת.
בחסר פ"ק מצטברים באריתרוציטים תוצרי ביניים ומטבוליטים של הגליקוליזה בגין הפגם באנזים האחרון בשרשרת הריאקציות במסלול זה, כאשר האריתרוציט נמצא בחסר של לקטאט ושל ATP. חסר ה-ATP מפריע ליצירת גרדיאנט הקטיונים החוצה את ממברנת תאים אלה, מה שגורם לאיבוד אשלגן ומים, מה שגורם לתא לעבור דהידרציה, להתכווץ לצורה של echinocytes או Burr cells, ובדיעבד למות. למרות יצירה של אנמיה חמורה, הרמה הגבוהה של 2,3DPG או 2,3diphosphoglycerate מגבירה באדם עם ליקוי זה את כושר הפעילות הגופנית על ידי שנגרמת סטייה לימין בעקומת הדיסוסאציה של המוגלובין-חמצן. פיצוי זה הוא בעיקר בעל יתרון בעת הריון, כיוון שהוא גורם להגברת הטרנספר של חמצן לדמו של העובר, ולכן הוא מסייע למהלך השפיר יחסית שאנו מוצאים בחסר פ"ק בהרבה מהלוקים בפגם זה. נשים עם חסר פ"ק באופן אופייני אינן זקוקות לעירויי דם בשעת ההיריון.
רטיקולוציטים בחסר פ"ק יכולים להימנע מהשפעות פגם זה, על ידי ניצול של מסלול הזרחון החמצוני (oxidative phosphorylation) ליצירת ATP. אך יכולת זו של הרטיקולוציטים נחלשת כאשר תאים אלה נחשפים למצבי היפוקסיה, או כאשר הם מתבגרים לשלב האריתרוציט הבוגר. זה יכול להסביר א) את האריתרופויאזה הלא יעילה בטחול של אנשים עם חסר פ"ק, ב) מדוע רוב ההמוליזה מתרחשת כאשר רטיקולוציטים נלכדים בסביבה ההיפוקסית של הטחול, ג) את העלייה הפרדוקסאלית במספר הרטיקולוציטים לאחר פרוצדורה של כריתת הטחול.
איזואנזימים של פ"ק במצבי חסר של האנזים
באנשים עם חסר של פ"ק, הגן הממוקם ב-11q2 פגום, מה שגורם לפגיעה באיזואנזים של פ"ק שנמצא בכבד ובאריתרוציטים. הכבד יכול לפצות על פגיעה אנזימטית זו ב-2 דרכים: ראשית, כיוון שמדובר באנזים עם יעילות אנזימטית מוגבלת, ולא באנזים שאינו פעיל לחלוטין, הכבד יכול לייצר כמות גדולה של אנזים עם "פעילות חלקית" זו. בנוסף, הכבד יכול להשתמש בפעילות חלקית של האיזואנזים PKM2. בשלב מוקדם של הבשלתם, תאים קודמנים אריתרואידים אמנם משתמשים באיזואנזים PKM2, וככל שתאים אלה מתקדמים לקראת הבשלה, האנזים PKR בא במקום PKM2. אך כיוון שאריתרוציט אינו מסוגל לייצר חלבון חדש, הוא אינו מסוגל לפצות על ידי הגברת הכמות של האיזואנזים או על ידי השימוש באיזואנזים PKM2. פגמים אנזימטיים בפ"ק יכולים להיות בעלי צורות שונות: זיקה נמוכה של האנזים לסובטרט שלו, השפעה מעכבת גדולה יותר של תוצר הריאקציה על פעילות האנזים, תגובה מופחתת של האנזים למולקולות האמורות לשפעל אותו, וכן אי יציבות בחימום. מוטציות הפוגעות בעיקר בקינטיקה של האנזים הפגום, הן אלו הקשורות לשינוי ביציבותו לחימום (Valentini וחב' ב-J Biol Chem משנת 2002). צורה חמורה אחת של המחלה, ידועה כ-pyruvate kinase Beppu, והיא כרוכה בנוכחות עיקשת של האיזואנזים PKM2.
שכיחות חסר פ"ק בתלות בגיל
הגיל בו מתחילים תסמיני החסר המולד של פ"ק, נמצא במתאם עם חומרת החסר. באלה עם חסר חמור באנזים, התסמינים יופיעו כבר בשלב העוברי או לאחר הלידה, וברוב המקרים התסמינים יופיעו בגיל הילדות, אם כי באלה עם חסר מתון ייתכן שהופעת התסמינים תתעכב עד לגיל מבוגר. מקרים של מחלת חסר נרכש של פ"ק (acquired pyruvate kinase deficiency), מתרחשים לרוב באופן שניוני למחלה מסוימת (בדרך כלל בעת הדבקות בנגיף) או בעת של עקה פיזיולוגית או בתקופת הריון. במקרים אלה גיל הופעת התסמינים של חסר האנזים תלוי ומשתנה עם התרחשות המחלה הראשונית.
אבחון מצב של חסר פ"ק
המבדקים העיקריים הנדרשים לכוון את אבחון חסר אנזימטי זה כוללים: ספירת דם כללית (CBC), ספירת דם מבדלת, ספירת רטיקולוציטים, מדידת רמת בילירובין בנסיוב, בחינה מורפולוגית של משטח דם היקפי. אנמיה נורמוכרומית, נורמוציטית או מאקרוציטית, ביחד עם רטיקולוציטוזיס מרמזים על המוליזה. תוצאת מבחן Coombs שלילי מסייעת לשלול המוליזה על רקע אימוני.
שיעור הפעילות האנזימטית ברוב הלוקים בחסר פ"ק, הוא 5-25% מרמתו הנורמאלית, כאשר מדידה של תוצרי הביניים כמו גלוקוז-6-פוספאט ו-2,3diphosphoglycerol נוצרים לפני שלב המעורבות של פ"ק, עוזרים לאשש את אבחון חסר האנזים. יש לקחת בחשבון שעלולות להופיע תוצאות שליליות כזובות (false-negative) באשר לפעילות האנזים בעיקר כאשר החסר שלו נובע ממוטציות שהן compound heterozygous, שאז מדידת הקינטיקה של האנזים אינה מדויקת.
ממצאים נוספים שעלולים להופיע בחסר פ"ק כוללים: אנמיה נורמוכרומית ונורמוציטית מתונה עד חמורה, רטיקולוציטוזיס, פיגור התפתחותי סימטרי, כשל שגשוגי (FTT), אבנים בכיס המרה, עיבוי בולט של המצח (frontal bossing), היפר-בילירובינמיה של היילוד, הצהבה של לובן העין (icteric sclera), הגדלה מתונה עד ניכרת של הטחול, סימן Murphy חיובי, כיבי רגליים כרוניים במבוגרים, וכן רגישות ב-upper-right quadrant.
כמו כן ניתן למצוא היפרפלזיה נורמובלסטית אריתרואידית במח העצם, הגדלת המאגרים של ברזל, היפרלזיה רטיקולואנדותליאלית, אריתרופגוציטוזיס, המאטופויאזה אקסטרה-מדולארית (דהינו המאטופויאזה המתרחשת מחוץ למדולה של מח העצם באתרים כמו הכבד או הטחול), הצטברות של החלבון קושר הברזל המוסידרין בכבד ובטחול, והגדלת הטחול (splenic congestion). רמה מוגברת של בילירובין בנוכחות היפר-בילירובינמיה בלתי-ישירה, יכולה להופיע בנבדקים עם חסר פ"ק, והיא אינה בדרך כלל מעידה בהכרח על כולסטאזיס, או על מחלת כבד ראשונית, או על מחלת חסימה של דרכי המרה.
חסר האנזים פ"ק אמור להיות מאובחן על ידי מדידת פעילותו באריתרוציטים או בנסיוב, וכן על ידי בחינת DNA בשיטת PCR. יש להתחשב בכך שמדידות אנזימאטיות אינן תמיד מדויקות, שכן המבדק האנזימטי עלול להיות מושפע מהעובדה שפעילות פ"ק נותרת נורמאלית בלויקוציטים וכן בטסיות דם, מה שעלול לגרום לתוצאה מוגברת כזובה בגלל הכישלון בהרחקת תאים אלה מדגימת התאים הנמדדת לפעילות האנזים. גם אנליזה של DNA עלולה להיפגם כתוצאה מהמספר הגדול של מוטציות שעלולות לגרום לחסר פ"ק.
חסר מולד של פ"ק
מעל 180 פגמים גנטיים התגלו עד כה שעלולים לגרום חסר זה (Kedar וחב' ב-Clin Genet משנת 2009 ו-Berghout וחב' ב-Genes Immunol משנת 2012). רוב המוטציות הללו הם מסוג missense, אך זוהו גם מוטציות מסוג splicing ,insertion ו-deletion. למרות שהורשת פגם זה היא אוטוזומאלית-רצסיבית, רוב הלוקים בחסר האנזים הם compound heterozygous ל-2 אללים מוטנטיים שונים. אנשים עם חסר פ"ק על בסיס הומוזיגוטי הם בדרך כלל צאצאים של הורים בקרבה משפחתית מובהקת. בהטרוזיגוטים מוצאים רמה חלקית של פעילות האנזים, והם בדרך כלל א-תסמיניים, כאשר בהומווזיגוטים התסמינים הקליניים של חסר בפ"ק באים לביטוי.
חסר נרכש של פ"ק
מצבים קליניים כגון לויקמיה חריפה, קדם-לויקמיה, אנמיה סידרובלסטית רפרקטורית העמידה לטיפולים המקובלים, וכן סיבוכים הנגרמים לעתים מכימותרפיה, עלולים לגרום לחסר נרכש של פ"ק. זוהי צורת מפגע מתונה יותר מהחסר המולד של אנזים זה.
מדדים תאיים
ערך המאטוקריט בחסר פ"ק נע בין 17-37%. ערכים נמוכים יותר יכולים להופיע בשלבי ילדות מוקדמים וכן בתקופה הנאונטלית. האריתרוציטים הם לרוב נורמוציטים, ונורמוכרומיים. ספירה מוגברת של רטיקולוציטים הכרוכה בנפח תאים מוגדל, ועלולה לתת את הרושם שמדובר באנמיה מאקרוציטית. ספירת רטיקולוציטים בחסר פ"ק, יכולה להיות מוגברת ב-5-15%. באופן פארדוקסאלי דווקא לאחר כריתת הטחול, הספירה הרטיקולוציטית יכולה להגיע כדי 70%. הספירה של לויקוציטים ושל טסיות-דם יכולה להיות תקינה או מוגברת מעט בחסר פ"ק, אלא אם כן המטופל מפתח טחול מוגדל.
מדדים מורפולוגיים
אי-סדירות מורפולוגית אינה יכולה להיחשב ממצא בולט בחסר פ"ק, אך ניתן למצוא בתרחיש זה את המאפיינים המורפולוגיים הבולטים של אריתרופויאזה מואצת, כמו תאי דם אדומים מגורענים, anisocytosis, פויקילוציטוזיס ו-polychromatophilia או נוכחות תאי דם אדומים מסוימים שנצבעים בכחול בצבעי רומנובסקי. התאים הכחולים הם תאי דם אדומים צעירים (רטיקולוציטים). בדרך כלל לאחר כריתת הטחול ניתן למצוא סידרוציטים, תאי-דם אדומים משוננים (crenated), גופיפי Howell-Jolly וכן גופיפי Pappenheimer.
מדדי המוגלובין
במקביל לנתוני ההמאטוקריט, ריכוזי המוגלובין בחסר פ"ק משתנים בתחום שבין 6-12 גרם לדציליטר, עם ריכוזים נמוכים יותר בשלבי החיים המוקדמים. אלקטרופורזה של המוגלובין מראה המוגלובין תקין, כמו גם רמות תקינות של המוגלובינים מסוג F או A2.
מדדי מטבוליזם של המוגלובין
ממצא מעבדתי של רמה גבוהה של בילירובין בלתי-ישיר (indirect bilirubin) יכולה לשקף את חומרת התהליך ההמוליטי בחסר פ"ק. רמת בילירובין בלתי ישיר של 6 מיליגרם/ד"ל היא בהחלט לא בלתי-שכיחה, והיו דיווחים אף על רמות הגבוהות מ-20 מיליגרם/ד"ל. חומרת התרחיש ההמוליטי יכולה להשתקף גם ברמות haptoglobin (החלבון הקושר המוגלובין) שרמתו יורדת בנסיוב ככל שרמת ההמוגלובין המשתחרר מאריתרוציטים פגועים גדולה יותר.
עודף ברזל
אחד הסיבוכים שאינם נדירים כלל בתרחיש של חסר פ"ק, הוא של הצטברות ברזל, בעיקר במטופלים המקבלים עירויי דם כרוניים. מטופלים אלה אינם שונים ממטופלים אחרים עם המוליזה כרונית, הנוטים לספוג יותר ברזל בלי קשר למאגרי הברזל שלהם, זאת בגלל התהליך הפעיל של אריתרופויאזה. מטופלים עם עודף ברזל שאינו קשור להמוליזה כרונית, כמו אלה עם המוכרומטוזיס, בדרך כלל מוגנים מפני ספיגת-יתר של ברזל. הסיבה לסתירה זו לא הייתה ברורה עד לגילוי של הפפטיד ההפאטי hepcidin המהווה רגולטור שלילי לספיגת ברזל. במצבי דלקת, שדרוג פעילותו של hepcidin, מונעת ספיגת ברזל, ואילו down-regulation של hepcidin מאפשר ספיגה של ברזל. אובדן ההגנה בפני ספיגת ברזל במטופלים עם יתר ברזל הסובלים גם מהמוליזה כרונית, נמצא כתוצאה מפעילות GDF15 או growth differentiation factor 15 שהוא גורם במח העצם המווסת של השפעת hepcidin (על פי Finkenstedt וחב' ב-Br J Hematol משנת 2009). במחקר זה נמצא שרמת hepcidin במטופלים עם חסר פ"ק, הייתה פי-13 יותר נמוכה מאשר בקבוצת ביקורת, בה בשעה שרמת GDF15 הייתה גבוהה יותר משמעותית במטופלים עם חסר פ"ק בהשוואה לנבדקים בקבוצת הביקורת.
מבדקים לאישוש אנמיה המוליטית
בתלות בחומרת האנמיה בחסר פ"ק, אריתרוציטים הם בעלי אורך חיים מופחת באופן מתון עד חמור. ניתן לגלות את הרס כדוריות הדם הללו באופן מיידי על ידי שיטה של סימון עם כרום רדיואקטיבי: תוצאת מבחן זה עשויה לסייע בקביעה האם המטופל מועמד ראוי לכריתת טחול, כיוון שקצב גבוה של הרס אריתרוציטים מרמז על פעילות משמעותית של הטחול.
ממצאים מעבדתיים נוספים בתרחיש של אנמיה המוליטית הם כדלקמן: השבירוּת (fragility) האוסמוטית של האריתרוציטים תקינה; תוצאת מבחן Coombs מתקבלת שלילית; לא נמצאים cold agglutinins; יש חסר של נוגדני Donath-Landsteiner, שנוהגים למצוא במצב הנדיר של paroxysmal cold hemoglobinuria; יצירת גופיפי Heinz בדרך כלל לא סדירה; מבחן Ham מתקבל שלילי (מבחן זה שימש לאבחון של PNH או paroxysmal nocturnal hemoglobinuria, והוא התבצע על ידי הדגרת אריתרוציטים בתמיסה חומצית מתונה כאשר שבירות מוגברת של הכדוריות מצביעה על PNH על פי Ham משנת 1937 ב-N Eng J Med).
סיבוכים הכרוכים עם חסר פ"ק כוללים את המקרים הבאים: אנמיה חמורה העלולה לגרום לאי-ספיקת לב; שבץ מוחי איסכמי דווח באנשים צעירים שלא היו מאובחנים קודם לכן עם חסר פ"ק (על פי Pincus וחב' ב-Intern Med J משנת 2003); יצירת אבנים בכיס המרה (cholecystolithiasis) שכיחה בעשור הראשון לחיים בילדים עם חסר פ"ק ואנמיה חמורה; כריתת טחול מגדילה את הסיכון של ספסיס בקטריאלי בילדים ואת הסיכון לתרחישים פקקתיים-תסחיפיים במבוגרים (Chou ו-DeLoughery ב-Am J Hematol משנת 2001); עלולה להופיע החמרה פתאומית באנמיה הכרוכה בהדבקות נגיפיות (לדוגמה עם parvovirus B19) מה שעלול לגרום להפחתה זמנית ביצירת אריתרוציטים ולמשבר אפלסטי; עירויי דם מרובים עלולים לגרום להעמסת יתר של ברזל (Andersen וחב' ב-Hematol J משנת 2004 ו-Marshall וחב' ב-Br J Hematol משנת 2003); מתן עירויי דם בתקופת הריון מגביר את הסכנה של alloimmunization מה שעלול לגרום סיבוכים לעובר. תגובה חיסונית אחרונה זו נוצרת על ידי עירוי חוזר של תאי דם אלוגנאיים וחשיפת מקבל העירויים ל-alloantigens מופיעים על פני כדוריות הדם שהוא מקבל בעירוי.
תחלואה ביילודים עם חסר פ"ק נגרמת בדרך כלל כתוצאה מאנמיה חמורה, מהיפר-בילירובינמיה, או משילוב של השניים. דיווח מהולנד תאר 2 מקרים עם תוצאה קטלנית של יילודים עם כשל כבד חמור כתוצאה מאנמיה המוליטית בגין חסר מאוד חמור של פ"ק (על פי Raphaël וחב' ב-Am J Hematol משנת 2007). אחד הסיכונים ביילודים עם רמת בילירובין גבוהה (מעל 15 מיליגרם לד"ל) שאינה מטופלת בהקדם על ידי פוטותרפיה היא הופעת kernicterus.
ביילודים עם צהבת ואנמיה, ניתן לזהות בקלות המוליזה על רקע אימוני (כגון בחסר התאמה של ABO או של Rh). אבחון של חסר פ"ק ייעשה על בסיס תוצאה שלילית של מבחן Coombs, על פי בחינה של משטח דם היקפי בו לא ניתן למצוא ספרוציטים, אך הופעה של אכינוציטים (תאי Burr) שצורתם אינה סדורה והם בעלי שלוחות דקות ואחידות המופיעים באיבוד נפח של אריתרוציטים.
מבדק שתוצאותיו תקינות של osmotic fragility עשוי לסייע להבדיל בין חסר פ"ק לבין ספרוציטוזיס מולדת. סוגים אחרים של אנמיה המוליטית מולדת מהסוג הלא ספרוציטי, מפגעי המוגלובין למיניהם, מפגעים אנזימטיים אחרים ותסמונות תלסמיה אחדות, כל אלה חייבים להיות מובדלים מחסר פ"ק. מבדקים ספציפיים וסיפור משפחתי עשויים לסייע בכך. בילדים מבוגרים יותר התרחיש של אנמיה המוליטית אוטואימונית יכול לבוא לביטוי באופן הדומה למצב של חסר פ"ק, וניתן להבדיל בין השניים על פי מבחן Coombs חיובי, נוכחות של ספרוציטים וחסר בתאים אופייניים לחסר פ"ק במשטח של דם היקפי.
באופן כללי ניתן להזכיר את התרחישים הבאים ככאלה שיש להבדיל בינם לבין מצב של חסר בפ"ק: אנמיה חריפה, אנמיה כרונית, חסר קרניטין, מחלת אגירת גליקוגן type III, מחלת המוגלובין H, חסר באנזים pyruvate carboxylase, תלסמיה, חסר באנזים pyruvate dehydrogenase, ו-hydrops fetalis או בצקת כללית של העובר, אשר יכולה לנבוע במנגנון אימונוגני כתוצאה מאי התאמת גורם Rh (ב- 15% מהמקרים), או במנגנון שאינו אימונוגני שאחראי ל – 75% מהמקרים.
הוראות לביצוע הבדיקה
את דגימת הדם יש ליטול במבחנת ספירת-דם (EDTA, פקק סגלגל) שהיא צורת הלקיחה המועדפת, במבחנת ציטראט (פקק תכול) או במבחנת הפארין (פקק ירוק) או גם במבחנה כימית (פקק צהוב). יש להכניס את הדם מיידית למקרר אך לא לסרכז (אם הבדיקה מתבצעת בהמוליזאט של כדוריות הדם האדומות) או להקפיא. הדגימה תהיה ראויה גם לאחר 20 יום ב-4 מעלות צלזסיוס, או 5 ימים ב-25 מעלות. אך כאמור אין להקפיאה אם הכוונה לבדוק את רמת פ"ק בהמוליזאט. אם מדובר בדגימת נסיוב הוא יציב למשך 6 שעות הטמפרטורה של 4 מעלות, או למשך 8 חודשים בהקפאה במינוס 70 מעלות.
לצורך מדידת רמת האנזים בשיטה קינטית ספקטרו-פוטומטרית בנסיוב או בפלזמה יש ליטול את הדם במבחנה כימית או במבחנת ספירת-דם, בהתאמה, ולהקפיד שהדם לא יהיה המוליטי במיוחד. הסרכוז צריך להיות במהירות 10,000g למשך 10-15 דקות, כדי להימנע מזיהום הנסיוב עם טסיות-דם או עם לויקוציטים בהם רמת פ"ק גבוהה במיוחד. יש להדגיש לויקוציטים מכילים את האנזים שרמתו בהם אינה פוחתת גם במקרים של חסר-מולד של האנזים באריתרוציטים, לכן יש להקפיד על כך שהתאים המשמשים ליצירת ההמוליזאט כמו גם הנסיוב לצורך מדידת רמת האנזים, יהיו חופשיים מתאי-דם לבנים.
מדידה אנזימטית כמותית: המוליזאט של אריתרוציטים עובר הדגרה עם פוספואנולפירובאט או PEP ועם ADP. כמות התוצר פירובאט הנוצר נמדדת כמותית על ידי הוספה של האנזים LDH בנוכחות הקו-פקטור המחוזר nicotinamide adenine dinucleotide או NADH, תוך מדידה של הדעיכה בבליעה באורך גל 340 ננומטר. זו השיטה הקלאסית על פי Erenst Beutler במהדורה ה-III של Biochemical Methods משנת 1984 עמ' 68-71.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק