אקוופורין - Aquaporin
| מדריך בדיקות מעבדה | |
| אקוופורין | |
|---|---|
| Aquaporin | |
| שמות אחרים | AQP |
| מעבדה | כימיה בדם |
| תחום | הדינמיקה של קליטת והפרשת מים על ידי תאים |
| טווח ערכים תקין | מתחת לסף הגילוי בנסיוב |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
אבחון של neuromyelitis optica spectrum disorder (להלן MNOSD),
אבחון של autoimmune AQP4 channelopathy,
אבחון של neuromyelitis optica (להלן NMO),
אבחנה מבדלת בין NMOSD מטרשת נפוצה (MS) בשלביה הראשונים.
גילוי ה-aquaporins
המנגנון שמאפשר טרנספורט של מים והאפשרות המשוערת של "נקבוביות מים" ריכזו עניין כבר משנת 1957 (על פי Parisi וחב' ב-J Biol Phys משנת 2007).
ברוב התאים, מים חודרים אל תוך התאים ויוצאים מהם על ידי אוסמוזה דרך שכבת הפוספוליפידים בממברנה. בגין החדירות הגבוהה למים של מספר סוגי תאי אפיתל, שררה זמן רב הסברה שקיים מנגנון נוסף המעביר מים דרך ממברנות ומעביר אותו על ידי דיפוזיה בשכבת הפוספוליפידים הממברנלית. בשנות ה-50 המאוחרות התבצע מחקר חלוצי על חדירות מים דרך ממברנות על ידי Solomon ואנשיו (Paganelli ו-Solomon ב-J Gen Physiol משנת 1975, ו-Goldstein ו-Solomon באותו כתב עת משנת 1960). במרוצת 20 השנים הבאות, הדגישו מחקרים לא רק את חשיבות תעלות המים אלא אף יצרו תאוריות מגוונות על מנגנוני פעילות אפשריים של תעלות אלו (Edelman ב-Biochim Biophys Acta משנת 1965, Carvounis וחב' ב-Kidney Inter משנת 1979, ו-Parisi ו-Bourguet ב-Am J Physiol Cell Physiol משנת 1984). בשנת 1990 הייתה פריצת דרך של Verkman וחב' בהדגמה שהמרכיבים העיקריים של תעלות המים הם למעשה חלבונים (Zhang וחב' ב-J Biol Chem משנת 1990, וב-J Clin Invest משנת 1991).
רק בשנת 1992 דיווח Peter Agre מאוניברסיטת Johns Hopkins על ה-aquaporin הראשון, AQP1 (שכונה במקור chip 28 (על פי Agre וחב' ב-Am J Physiol משנת 1993). בשנת 1999 פרסם Agre לראשונה תמונות ברזולוציה גבוהה של המבנה התלת-ממדי של AQP1 (על פי Mitsuoka חב' ב-J Struct Biol משנת 1999, ו-Walz וחב' ב-Handb Exp Pharmacol משנת 2009), ומחקרים בהמשך תוך שימוש בסימולציות על-מחשביות זיהו את המסלול של מים העוברים דרך התעלה והדגימו כיצד הנקב (pore) מאפשר למים לעבור דרך הממברנה ללא הזדקקות למעבר של מומסים קטנים (de Groot ו- Grubmüller ב-Curr Opin Struct Biol משנת 2005). המחקר החלוצי וגילוי תעלות המים זיכה את Agre בפרס נובל לכימיה בשנת 2004. על פי עדותו של Agre עצמו גילוי ה-aquaporin היה מקרי לחלוטין: הוא היה שקוע במחקר על האנטיגנים של קבוצת הדם Rh, ובעת בידוד מולקולת Rh נספחה תמיד מולקולה שנייה בת משקל מולקולארי של 28,000 דלטון. בתחילה היו סבורים שמדובר בפרגמנט של Rh או בזיהום, אך הסתבר שמדובר במולקולה חדשה שלא היה ידוע תפקידה (Agre ב-Proc Am Thorac Soc משנת 2006). היא הופיעה תמיד במבנים של אבוביות הכליה, או בתאי-דם אדומים, והיא הופיעה במגוון של רקמות כגון מוח של זבוב הפירות, בחיידקים, ובעדשת העין כמו גם בצמחים (Mitsuoka וחב' ב-J Struct Biol משנת 1999). הדיווח הראשון על הטרנספורט על ידי חלבון של מים דרך ממברנות היה של החוקר הרומני Benga וקבוצתו ב-Biochemistry משנת 1986 אשר הדגים תהליך זה בכדוריות אדומות.
המיקום הרקמתי של AQPs ביונקים
קיימים 13 סוגים של AQPs ביונקים, כאשר 6 מתוכם ממוקמים בכליות (Nielsen וחב' ב-Physiol Rev משנת 2002). ה-AQPs הנחקרים ביותר ומיקומם בכליה הוא (Noda וחב' ב- Nat Rev Nephrol משנת 2010):
| סוג ה-AQP | מיקום | תפקיד |
|---|---|---|
| AQP1 | כליה (קודקודי) ,PCT PST, tDLH | ספיגה מחדש של מים |
| AQP2 | כליה (קודקודי) ICT, CCT, OMCD, IMCD | ספיגה מחדש של מים בתגובה ל-ADH [1] |
| AQP3 | כליה (וזו-לטראלי) צינורות מאספים מֶדוּלאריים | ספיגה מחדש של מים וחדירות לגליצרול |
| AQP4 | כליה (וזו-לטראלי) צינורות מאספים מדולאריים | ספיגה מחדש של מים |
- מקרא
- PCT-proximal convoluted tubule
- PST-proximal straight tubule
- tDLH-thin descending limb of Henle
- ICT-initial collecting tubule
- CCT-collecting cortical tubules
- OMCD-outer medullary collecting ducts
- IMCD-inner medullary collecting ducts
Aquaporins התגלו גם בחיידקים מסוימים בשמרים ממשפחת ה,saccharomyces- בפטרייה דוגמת קנדידה, ובפרוטוזואה דוגמת טריפנוזומה, דיקטיוסליום ופלסמידיום (Kruse וחב' ב-Genome Biol משנת 2006).
משמעות קלינית
פגיעה גנטית בגנים המקודדים ל-AQPs כרוכה במספר תסמונות באדם כגון חסר ב-AQP2 הגורם ל-nephrogenic diabetes insipidus (Bichet ב- Adv Chronic Kidney Dis משנת 2006 ו-neuromyelitis optica (Agre ו-Kozono ב-FEBS let משנת 2003, Schrier ב-News Perspect Drug משנת 2007, ו-Khanna ב-Sem Nephrol משנת 2006). מוטציות בגן המקודד ל-aquaporin 0 בעכברים גורמות לקטרקט דו-צדדי (Okamura ב-Genomics משנת 2003). מוטציות ב-AQP0 קשורות לקטרקט מוּלָד, אם כי המנגנון לפגיעה זו אינו ברור, כיוון שאין ודאות האם התפקיד העיקרי של AQP0 קשור למבנה העדשה, או לחדירות למים של תאים סיביים בעדשה (Verkman וחב' ב-Prog Retin Eye Res משנת 2008).
מספר קטן של בני-אדם זוהה עם חסר חמור או מוחלט ב-AQP1. אנשים אלה בדרך כלל בריאים, אך לוקים ביכולת לרכז מומסים בשתן, ולאצור מים כאשר מקורות מי השתייה מוגבלים (King וחב' ב-N Eng J Med משנת 2001). בעכברים טרנסגניים עם פגיעה יזומה הגורמת בהם לחסר של aquaporin-1 יש פגיעה בספיגה מחדש של נוזלים באבוביות הקריבניות (Schnermann וחב' ב- Proc Natl Acad Sci USA משנת 1998). בנוסף לתפקידם של AQPs בסוכרת תפלה הנקבעת גנטית, הם גם משחקים תפקיד בצורות הנרכשות של nephrogenic diabetes insipidus עם הפרשה מוגברת מאוד של שתן (Christiansen וחב' ב-J Clin Invest משנת 1985 ו-Ma וחב' ב- Proc Natl Acad Sci USAמשנת 2000), כאשר האחרונה יכולה להיגרם בחולדות מפגיעה ב-AQP2 על ידי הזרקת מלחי ליתיום, אך גם כתוצאה מהיפוקלמיה והיפרקלצמיה (Marples ב-J Clin Invest משנת 1996).
תרחיש של neuromyelitis optica או NMO, הקרוי לעיתים מחלת Devic וכן opticospinal multiple sclerosis: זו מחלה דלקתית אוטו-אימונית חמורה בעלת אופי משברי-הפוגתי, עם תהליכי דה-מייאלינציה במערכת העצבים המרכזית הפוגעת בעיקר בעצבי הראייה ובעמוד השדרה (Wingerchuk וחב' ב-Lancet Neurol משנת 2007). מחלה זו כ-NMO spectrum disorders או NMOSD) הפוגעת ב-AQP4 או בתעלת המים של התאים האסטרוציטים-AQP4 (Lennon וחב' ב-Lancet משנת 2004). נגעים מוחיים מאובחנים בלמעלה מ-60% מאלה עם NMOSD, ו-10% ידמו לטרשת נפוצה (Pittock וחב' ב-Arch Neurol משנת 2006). לילדים יש נטייה להראות מעורבות מוחית גדולה יותר מאשר למבוגרים, והנגעים המוחיים בהם הם יותר תסמיניים מאשר במבוגרים על תסמונת זו (McKeon וחב' ב-Neurology משנת 2008).
התנפחות המוח
AQP4 מבוטא באסטרוציטים ב-CNS, במיוחד בשטחי הביניים בין הפרנכימה המוחית ונוזל ה-CSF בחלקי המוח הוונטריקולארי והתת-עכבישי. יש 2 סוגים של בצקת מוחית שיכולים להתרחש באופן בלתי-תלוי או יחדיו. בבצקת מוחית תאית ציטוטוקסית, מים חודרים למוח דרך מחסום דם-מוח (BBB) בתגובה לכוחות אוסמוטיים. עכברים החסרים AQP4, מראים תוצאה קלינית משופרת והצטברות מופחתת של מים במוח, בהשוואה לעכברי-בר עם הרעלת-מים כאשר בצקת מוחית בולטת כמו במקרי שבץ איסכמי או במנינגיטיס חיידקי (Manley וחב' ב-Nat Med משנת 2000, ו-Papadopoulos ו-Verkman ב-J Biol Chem משנת 2005). ביטוי-יתר של AQP4 בעכברים טרנסגניים מחמיר את התנפחות המוח בהרעלת מים (Yang וחב' ב-J biol Chem משנת 2006, Bloch וחב' ב-J Neurochem משנת 2005, ו- Papadopoulosוחב' ב-FASEB J משנת 2004).
עכברים חסרי AQP4 מדגימים התנפחות מואצת של המוח בתרחיש של הידרוצפלוס חסימתי. כתעלת מים דו-כיוונית, AQP4 מסייע להצטברות מים בבצקת ציטוטוקסית, אך חיוני בפינוי עודף מים במוח בבצקת וָזוֹגֶנית או אינטרסטיציאלית. בעמוד השדרה, חסר של AQP4 כרוך בהפחתת נפיחות ושיפור קליני במודל של פגיעת דחיסה בה שולטת בצקת ציטוטוקסית (Saadoun וחב' ב-Brain משנת 2008), אך עם נפיחות ניכרת יותר במודל של פגיעת חַבָּלָה בה שולטת בצקת וָזוֹגֶנית (Kimura וחב' ב-Ann Neurol משנת 2010).
פעולת AQPs ברמה המולקולארית
התפקיד הראשוני של רוב ה-AQPs הוא להעביר מים דרך ממברנות תאים בתגובה לגרדיאנטים אוסמוטיים הנוצרים על ידי טרנספורט אקטיבי של מומסים. כיוון שיכולת טרנספורט המים של מונומרים של AQP נמוכה, ממברנות תאים מכילות לרוב צפיפות גדולה של AQPs, המגיעה עד 10,000 מולקולות/מיקרון2, על מנת להגדיל את חדירותן למים. נראה שגם אינטראקציות אלקטרוסטטיות בתוך הנַקְבּוּבִיות (pores) אחראיות לסלקטיביות של AQP למים. תת-קבוצה של AQPs הקרויה aquaglyceroporins, אחראית לטרנספורט של גליצרול, וקוטר הנַקְבּוּבִית של aquaglyceroporin מעט גדול יותר מזה של אלה המשמשות AQPs להעברת מים. בנוסף למים ולגליצרול ישנן גם ראיות (אם כי שנויות במחלוקת) שחלק מה-AQPs מעבירות מולקולות גזים כמו CO2, O2, NH3 ו-NO, וכן מומסים קטנים שונים כמו H2O2 וארסניט (Miller וחב' ב- Proc Natl Acad Sci USA משנת 2010, Musa-Aziz וחב' ב- Proc Natl Acad Sci USAמשנת 2009, Wang ו-Tajkhorshid ב-Proteins משנת 2010), וכן מספר יונים כמו +K ו--Cl. מספר פונקציות שאינן קשורות לטרנספורט יוחסו אף הן ל-AQPs כגון ספיחה בינתאית, פולריזציה של ממברנות וכן וויסות של חלבונים מגיבים כמו תעלות יונים.
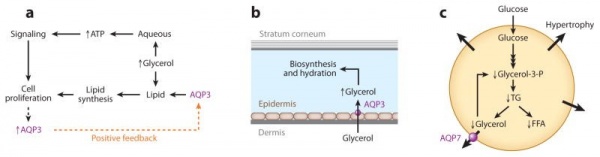
(a) שגשוג תאים-AQP3 שומר על רמה גבוהה של גליצרול תאי ליצירת ATP ותהליכי ביוסינתזה.
(b) הידרציה של העור-AQP3 שומר על רמה גבוהה של גליצרול ב-stratum corneum האוצר מים בעור.
(c) מטבוליזם של אדיפוציטים-AQP7 מסייע להוצאת גליצרול מאדיפוציטים, ועל ידי כך מונע הצטברות תאית של גליצרול וטריגליצרידים
ממברנות שונות זקוקות לחדירות גבוהה של מים או של גליצרול
רוב התאים אינם מכילים AQPs, ולמעשה כל הממברנות הביולוגיות חדירות למים כתוצאה מהדיפוזיה של מים דרך הליפידים בממברנה, כך שנפח התא מגיע לשיווי משקל תוך דקות או אף פחות בתגובה לגרדיאנט האוסמוטי. אם כך, מדוע מספר תאים נזקקים לחדירות גבוהה במיוחד של מים? אחת הדוגמאות היא של הפרשה וספיגת נוזלים דרך הממברנה של תאי אפיתל באבוביות הכליה או בבלוטות האקסוקריניות, בתוכן תפקוד תקין של הכליה, והפרשה של נוזלי-גוף כגון רוק, דורשים חדירות טרנס-אפיתליאלית מוגברת של מים המסתייעת על ידי AQPs.
ביטוי ה- AQPs
ה-AQPs השונים ביונקים שיש כ-13 כמותם, מבוטאים בסוגי תאים רבים הקשורים לטרנספורט של נוזלים, כמו האפיתל והאנדותל בכליה, בריאות, בבלוטות האקסוקריניות, בעיניים ובאיברי מערכת העיכול. אך AQPs מבוטאים גם בתאים חסרי תפקיד בהעברת נוזלים כמו אריתוציטים, חלק מהלויקוציטים, אדיפוציטים ותאי שריר. AQPs מבוטאים גם באסטרוציטים ב-CNS, וכן בתאי-תֶמֶך באיברים תחושתיים כגון תאי Müller. בעין מופיעים AQPs ברשתית, בעדשה ובתאי האפיתל הציליאריים.
חסר של AQPs שונים באבוביות הכליה, גורם להפרשה מוגברת של שתן ולפגיעה ביכולת הריכוז של השתן. ה-AQPs מוגדרים כאחראיים על הצַנֶּרֶת של התאים. מים נעים דרך התא בדרך מאורגנת, ומהירה ביותר ברקמות המכילות תעלות מים המכילות AQPs. משך שנים רבות חוקרים שיערו שמים דולפים דרך ממברנת התא, ואמנם יש תאים בהם מים עוברים בדרך זו. עם זאת, היה צריך להסביר כיצד מים עוברים כה מהר בתאים אחרים. AQPs מפקחים באופן סלקטיבי על נדידת מים אל תוך תאים ומחוצה להם, תוך שהם מונעים מעבר של יונים ומומסים אחרים. AQPs הם חלבונים אינטגרלים של נקבוביות בממברנה, כאשר חלקם הידועים כ-aquaglyceroporins, מעבירים מולקולות מסיסות בלתי-טעונות נוספות, כגון אמוניה, CO2, גליצרול ו-urea. לדוגמה, תעלת AQP3 היא בעלת רוחב נקבובית של 8–10 אנגסטרום, מה שמאפשר מעבר של מולקולות הידרופיליות עם משקל מולקולארי עד 150–200 דלטון.
המבנה של AQPs
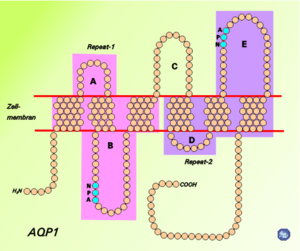
חקר מבנה של AQPs אחדים נעשה לאחר גיבושם בעזרת קרני-X. כל ה-AQPs יוצרים טטרמרים בממברנה, כאשר כל מונומר הוא בעל משקל מולקולארי של 30,000 דלטון במקורב. חלבוני ה-AQP מורכבים מ"חבילה" של 6 מקטעי α-helix טרנס-ממברנאליים. הקצוות ה-N וה-C טרמינאליים נעוצים בתוך התא (Gonen ו-Walz ב-Q Rev Biophys משנת 2006, ו-Fu ו-Lu ב-Mol Membrn Biol משנת 2007). בין ששת ה-helices, ישנם חמישה אזורים (A-E) המופיעים מחוץ לתא או בתוכו, כאשר שניים מהם הידרופוביים (B ו-E) המכילים -"NPA motif" של aspargine-proline-alanine, ליצירה של תעלת מים צרה במרכזה ורחבה בשני קצותיה (תרשים למטה). אזור שהוא אף צר יותר של תעלת המים ידוע כ-"at/R selectivity filter", שהוא צבר של חומצות אמינו המאפשרות ל-AQP לאפשר מעבר או לחסום מעברן של מולקולות שונות. AQPs שונים הם בעלי תעלות מים בגדלים שונים, כאשר התעלות הקטנות ביותר מאפשרות מעבר של מים בלבד.
המסנן הסלקטיבי ar/R
הארגינין הארומטי או ar/R הוא מסנן סלקטיבי הבנוי מצֶבֶר של חומצות אמינו המסייעות ל-AQP לקשור מולקולות מים ולמנוע כניסת מולקולות אחרות לתעלה. מסנן ar/R בנוי מ-2 קבוצות של חומצות אמינו מגדילי HB ו-HE, ומ-2 קבוצות של לולאת E (הידועות כ-LE1 ו-LE2) הממוקמות ב-2 צידי NPA motif . המיקום הרגיל של ar/R הוא ברצועה של 8 אנגסטרום בצידו האחר של ה-NPA motif. שהוא באופן אופייני החלק הצר ביותר של התעלה. היצרות זו של התעלה מחלישה את קשרי המימן בין מולקולות המים, מה שמאפשר לשיירי הארגינין הטעונים חיובית, להגיב עם מולקולות המים ולעכב מעבר של פרוטונים לא רצויים.
ה-NPA motif
כאשר מולקולות מים נכנסות לתעלת המים, בהשפעת השדה האלקטרי של AQP החמצן של מולקולת המים הפונה בתחילה קדימה אל תוך התעלה, מבצע כחצי פנייה ומשקיף לאחור אל פתח התעלה (de Groot ו-Grubmüller ב-Science משנת 2001). הסיבה לרוטציה זו אינה ברורה עדיין, ויש המייחסים זאת לשדה החשמלי הנוצר על ידי 2 הגדילים HB ו-HE. אחרים מציעים שקשרי המימן בין שיירי aspargine לבין אזורי NPA והחמצן של מולקולת המים גורמים לרוטציה, אם כי עדיין לא ברור אם לרוטציה יש משמעות קלינית. מתחזקת הדעה שהרוטציה של מולקולת המים היא תופעת לוואי של המחסום האלקטרוסטטי.
חדירות גבוהה למים נחוצה באבובית הקריבנית של הכליה, לצורך ספיגה כמעט איזוֹ-מולארית של נוזלים בחלק הדק היורד של לולאת Henle, ובצינור המאסף לצורך ספיגת מים. AQPs מסייעים להפרשת נוזלים דרך האפיתל של בלוטות הרוק ושל הבלוטות התת-ריריות של דרכי האוויר בריאות, וכן מההכורואיד פלקסוס, שהיא רשת צפופה של כלי דם קטנים הנמצאת בחדרי המוח הצדדיים, מהם מופרש ה-CSF, וכן מהאפיתל הציליארי המפריש את נוזל העין. למרות ש-AQPs מבוטאים ומתפקדים באפיתל של הריאות, המעי ובלוטות הזיעה, אין להם ברקמות אלה תפקיד פיזיולוגי משמעותי. זאת כיוון ששיעור הפרשת הנוזלים מהאפיתל של הריאות והמעי נמוך בהרבה מזה שמתרחש דרך האפיתל של האבוביות הקריבניות בכליה (Tradtrantip וחב' ב-J Med Invest משנת 2009).
בעכברים טרנסגניים בהם לא פעיל AQP5 יש פגיעה בהפרשת נוזלים מבלוטות הרוק (Ma וחב' ב-J Biol Chem משנת 1999), ומתת-הרירית של בלוטות דרכי האוויר (Song ו-Verkman ב-J Biol Chem משנת 2001), עכברים טרנסגניים מהם נשלל AQP1 הם בעלי לחץ תוך-גולגלתי מוגבר שכן הפרשת הנוזל הצרברו-ספינאלי מהכורואיד פלקסוס מואטת בהם (Oshio וחב' ב-FASEB J משנת 2005), ומוגבר בהם הלחץ התוך-עיני בגין האטת הפרשת נוזל מהאפיתל הציליארי (Zhang וחב' ב-J Gen Physiol משנת 2002).
אקווה-פורינופתיות
מוטציות loss-of-function ב-AQPs למרות הנדירות הרבה שלהן עלולות לגרום תחלואה באדם. מוטציות ב-AQP2 גורמת לסוכרת תפלה נפרוגנית שאינה בתאחיזה לכרומוזום X, (על פי Deen וחב' ב-Science משנת 1994, ו-Bichet ב-Semin Nephrol משנת 2006). סוכרת תפלה נפרוגנית הנגרמת על ידי מוטציה ב-AQP2 (המתרחשת ב-1 מתוך 20 מיליון לידות), מתאפיינת על ידי polyuria חמורה ועל ידי polydipsia (צימאון-יתר), העמידוֹת להורמון האנטי-דיורטי (ADH). בכל הקשור ל-AQPs אחרים זוהו רק מספר זעיר של בני-אדם עם מוטציות loss-of-function. במספר מקרים החסרים תפקוד של AQP1, נמצא שהם פנוטיפית נורמאליים, אך הם לוקים ביכולת לרכז שתן בהיותם שותים מעט מים (King וחב' ב-N Eng J Med משנת 2001) בדומה לעכברים טרנסגניים החסרים AQP1. כיוון שבאדם החסר של AQP3, AQP1 ו-AQP7 מאוד נדירים, יש רק מידע מוגבל על תפקידי AQPs אלה באדם.
המעורבות של AQP4 ו-neuromyelitis optica
מעורבות AQP4 ב-NMO שהיא מחלה נוירו-דלקתית עם תהליך דה-מייאלינציה, הייתה בלתי צפויה. NMO ו-MS משותפות במספר מאפיינים קליניים, אך NMO פוגעת בעיקר בעצב הראייה תוך גרימת עיוורון ושיתוק (Wingerchuk וחב' ב-Lancet Neurol משנת 2007). בלבנים NMO מחלה נדירה (1 ל-100,000 לידות), והיא שכיחה יותר באסייתיים. כמו במחלות אוטו-אימוניות אחרות, נשים פגיעות יותר מגברים (יחס של 7:1). המאפיין הקובע ב-NMO הוא נוכחות של נוגדנים המכוונים כנגד האֶפּיטוֹפּים החוץ-תאיים של AQP4 (על פי Lennon וחב' ב-J Exp Med משנת 2005). עכברים שהוזרקו לתוך גולגלתם נוגדנים עצמיים של NMO-IgG של אדם בתוספת משלים (complement), פיתחו נגעים אופייניים של NMO, עם דלקת עצבית, איבוד של חלבון GFAP, פעילות anti-AQP4, דלדול שכבת המיאלין, ושקיעת משלים משופעל סב-וסקולארי (Saadoun וחב' ב-Brain משנת 2010). סבורים שקישור IgG ל-AQP4 באסטרוציטים מאתחל רצף התרחשויות (cascade) דלקתיות כגון גיוס גרנולוציטים, מקרופאגים, תאי NK ולימפוציטים, הפרשת ציטוקינים וגרימת נזק לאסטרוציטים על ידי משלים ותאי NK, לא ברור עדיין מדוע הפתולוגיה של NMO מודגשת יותר בעצבי הראייה ועמוד השדרה מאשר במוח, ומדוע הנזק לא בא לביטוי באיברים היקפיים המבטאים AQPs. נמצא שנוגדנים חד-שבטיים רקומביננטים בעלי זיקה גבוהה (aquaporumabs) יכולים לחסום את הקישור של NMO-IgG הנקשרים ל- AQP4 ולמנוע המשך הרג תאים והתפתחות נגעים של NMO במודלים של חיות ex vivo ו-in vivo.
המשמעות של טרנספורט של גליצרול על ידי aquaglyceroporins
ה-aquaglyceroporins ביונקים כוללים את AQP7, AQP3 ואת AQP9.AQP3 המבוטאים בשכבת הבסיס של קרטינוציטים המשגשגים באפידרמיס. עכברים החסרים AQP3 הם בעלי הידרציה מופחתת וגמישות של העור, זאת כתוצאה מפגיעה בטרנספורט של גליצרול מהדם אל האפידרמיס ולתכולה מופחתת של גליצרול באפידרמיס ובשכבת ה-stratum corneum (Hara וחב' ב-J Biol Chem משנת 2002, ו-Ma וחב' ב- J Biol Chemמשנת 2002 ו- Chikuma ו-Verkman ב-J Invest Dermatol משנת 2008). גליצרול הוא האוסמוליט העיקרי האוצר מים. תכולה מופחתת של גליצרול פוגעת גם בשגשוג של האפידרמיס, שכן גליצרול הוא מטבוליט חשוב בתאי האפידרמיס, הכורך סינתזה של ATP וביוסינתזה של הליפידים בממברנה. לכן יש גם עניין גובר ב-AQP3 בתעשייה הפרמצבטית הקוסמטית, עם שיווק תכשירים האמורים להגביר את ביטויו של AQP3. מחקרים עדכניים מציעים תפקיד חשוב של AQP3 בתפקוד של תאי T ומקרופאגים ייתכן על ידי טרנספורט של H2O2 המתווך על ידי AQP3.
תצפית מעוררת סקרנות נוספת נעשתה בעכברים משוללי AQP7, בהם נגרמה היפרטרופיה של אדיפוציטים והשמנה מוגזמת הנגרמת מיציאה (efflux) פגומה של גליצרול מתאים אדיפוציטים, מה שגורם להצטברות באדיפוציטים של גליצרול ושל טריגליצרידים. ממצאים אלה מרמזים לאפשרות של מעורבות AQP7 בהגברת המסה השומנית (Hara וחב' ב-J Biol Chem משנת 2005). לבסוף, הביטוי של AQP9 בהפאטוציטים הוצע כגורם המחיש קליטת גליצרול בתאי הכבד, אם כי משמעות התרחיש האחרון אינה ברורה.
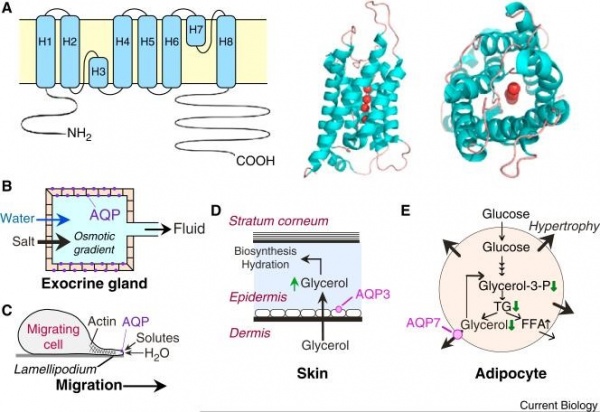
(A) הטופוגרפיה הממברנלית של מונומר של AQP1 והמבנה השלישוני שלו בהכילו 4 מולקולות מים (באדום). הגדילים (helices) מסומנים כ-H1-H8).
(B) הפרשת נוזל אפיתליאלי מבלוטות אקסוקריניות.
(C) נדידת תאים-מסתייעת בחדירת מים לתוך ה-lamellipodia המשתרבבים מחוץ לתאים נודדים.
(D) הידרציה של העור-AQP3 שומר על רמת גליצרול גבוהה ב- stratum corneum לצורך אצירת מים.
(E) מטבוליזם של אדיפוציטים-AQP7 מסייע ליציאת גליצרול מתוך תאים אדיפוציטים למניעת הצטברות וגליצרידים בתאים אלה.
(לקוח מ-Verkman ב-J Cell Sci משנת 2011)
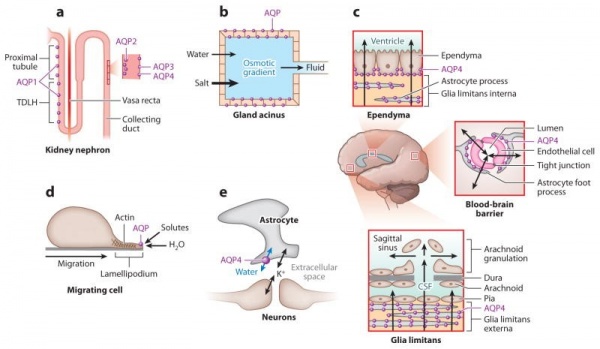
(a) הנפרון הכלייתי-חדירות גבוהה של מים דרך האפיתל באבובית הקריבנית, בקטע הצר היורד של לולאת Henle (TDLH) ובצינור המאסף, חיונית לריכוז השתן.
(b) הפרשת נוזל אפיתליאלי מבלוטות אקסוקריניות (ICP או intracranial pressure, IOP או intraocular pressure).
(c) מאזן מים במוח-בצקת ציטוטוקסית ווזוגנית-חדירות מים גבוהה דרך BBB, ודרך מחסום דם-CSF, מעודדת יציאה וכניסה של מים למוח.
(d) נדידת תאים (אנגיוגניות, גרורות סרטניות, הצטלקות גליאלית וכו'). נדידת תאים בתיווך AQP כרוכה בחדירת מים לתוך ה-lamellipodia שמחוץ לתאים הנודדים.
(e) גירוי עצבי- טרנספורט של מים בתיווך AQP4 באסטרוציטים במהלך קליטה מחדש של K+, לאחר גירוי עצבי, גורם להתכווצות של המרווח החוץ-תאי, ומתחזק את הקליטה מחדש של K+
דיאגנוסטיקה של AQPs
הדוגמה הבולטת ביותר של דיאגנוזה על בסיס נוגדנים ל-AQP היא המדידה של נוגדנים עצמיים כנגד AQP4 בנסיוב (NMO-IgG). נתונים עדכניים מצביעים על מציאת NMO-IgG בנסיוב שהיא 100% רגישה וספציפית במקרי NMO (Mader וחב' ב-PLos One משנת 2010). נוגדנים עצמיים בצירקולציה יכולים להיות שימושיים באבחון של מחלות אחרות, כגון נוגדנים עצמיים כנגד AQP3 במחלות אוטו-אימוניות של העור, או מציאות של נוגדנים עצמיים כנגד AQP5בתסמונת Sjögren. בדיקה של חלבון AQP בנוזלי גוף ובדגימות רקמתיות, עשויה להיות בעלת ערך אבחוני. הדוגמה הטובה ביותר היא גילויAQP2 בשתן, להבדלה בין אטיולוגיות שונות של nephrogenic diabetes insipidus (להלן (NDI (Ishikawa ב-Ann Med משנת 1982). הרציונל למדידת AQP2 בשתן הוא בהפרשתו מהממברנה הלומינאלית של הצינורות המאספים בכליות. דוגמאות נוספות, הן ביטוי של AQP לצורך קביעת דרגת התהליך הסרטני (Verkman וחב' ב-J Mol Med משנת 2008), הערכת מחלת עיניים ואקזמה אטופית עם הפרשה מוגברת של AQP3 (Olsson וחב' ב-Allergy משנת 2006).
AQPs וסרטן - הקשר לנדידת תאים ולשגשוגם
המעורבות של AQPs בנדידת תאים היא משמעותית לתהליכי אנגיוגניות, התפשטות מקומית של הגידול הסרטני וגרורתיות. כלי-דם זעירים הסמוכים לגידול הראשוני מבטאים את AQP1, וביטוי ה-AQPs קשור לדרגת סוגי הסרטן השונים כגון גליובלסטומות (Saadoun וחב' ב-Nature משנת 2005). הגילוי ש-AQP קשור לנדידת תאים נבע מהממצא של עיכוב תהליך סרטני ואנגיוגניות בעכברים החסרים AQP1, כמו גם עיכוב נדידה בתרבית של תאי אנדותל ממקור הוותין (Loitto וחב' ב- Cell Motil Cytoskeleton משנת 2009). חדירת מים (influx) לתאים גורמת להתפשטות ממברנת התא בסמוך לנקודה של חדירת המים על ידי הגברת הלחץ ההידרוסטטי, המלווה על ידי רה-פולימריזציה של actin, לייצוב ההִזְדַּקְּרוּת של הממברנה. תמיכה במנגנון זה מגיעה מהתצפית לפיה שינויים בלחץ ההידרוסטטי האזורי יכולים לגרום להִזְדַּקְּרוּיות של ממברנת התא (Charras וחב' ב-Nature משנת 2005). ללא כל קשר למנגנון הביופיסי המדויק, נראה ש-AQPs מסיעים לנדידת תאים, שאינה קשורה רק לאנגיוגניות, אלא גם להתפשטות הנגע הסרטני, הצטלקות גליה, ריפוי פצעים, וכנראה לעוד תופעות הכוללות כמוטקסיס של תאי חיסון.
הביטוי של AQP1 בתאי סרטן, מגביר את יכולתם לחדור מבעד לדופן כלי-דם ולפלוש לסביבתם הקרובה (Hu ו-Verkman ב-FASEB J משנת 2006). הביטוי של AQP4 באסטרוציטים במוח מגביר את יכולת נדידתם לכיוון של גירוי כמוטקטי ולהגביר את ההצטלקות הגליאלית (Auguste וחב' ב-FASEB J משנת 2007, ו-Saadoun וחב' ב-J Cell Sci משנת 2005). ביטוי של AQP3 בעור ובקרנית העין, מסייע לתהליך ריפוי פציעה (Levin ו-Verkman Invest Ophthalmol Vis Sci משנת 2006). עכברים החסרים AQP3 סובלים מהאטה של ריפוי פצעי עור וקרנית (Thiagarajah וחב' ב-Gut משנת 2007).
AQPs ופגיעה בעיניים
בעין, מציאות של AQPs בקרנית, בעדשה, באפיתליום הציליארי וברשתית, קשורה להידרציה של מעטה העין, לשקיפוּת של הקרנית והעדשה, לוויסות הלחץ התוך-עיני, ולהעברת סיגנלים ויזואליים. מוטציות ב-AQP0 קשורות לקטרקט מוּלָד, אם כי המנגנון לפגיעה זו אינו ברור, כיוון שאין ודאות האם התפקיד העיקרי של AQP0 קשור למבנה העדשה, או לחדירות למים של תאים סיביים בעדשה (Verkman וחב' ב-Prog Retin Eye Res משנת 2008). תפקוד רשתית בלתי סדיר באופן מתון נמצא בעכברים טרנסגניים בהם חסרות תעלות המים AQP4 בתאי Müller (Li וחב' ב- Invest Ophthalmol Vis Sci משנת 2002).
הוראות לביצוע הבדיקה
לקיחת הדם במבחנה כימית (פקק אדום או צהוב). מתקבלות גם דגימות נסיוב מאוד המוליטיות, מאוד ליפמיות או מאוד איקטריות. בטמפרטורת החדר הדגימה יציבה למשך 72 שעות, בהקפאה היא יציבה למשך 60 יום וכדגימה מקוררת (מועדפת)-28 יום. שיטת הבדיקה-flow cytometry.
ביבליוגרפיה
- ↑ Sands וחב' ב-J Am Soc Nephrol משנת 2002
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - בדיקות ביוכימיות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק