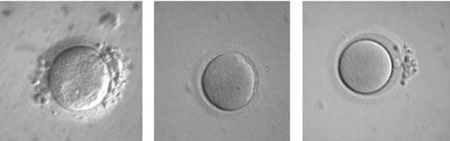
הבשלת ביציות חוץ גופית - In vitro maturation
| הבשלת ביציות חוץ גופית | ||
|---|---|---|
| In vitro maturation | ||
| שמות נוספים | IVM | |
| יוצר הערך | ד"ר אריאל הורביץ, ד"ר אתי ממן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפריה חוץ גופית
הבשלה חוץ גופית של ביציות (IVM In vitro maturation), היא שיטת טיפול חדישה ומבטיחה בתחום ההפריה החוץ גופית ((In vitro fertilization (IVF). בנוסף לשימושים רבים ומגוונים שיטה זו מהווה פתרון לאחת הבעיות העיקריות בתחום טיפולי הפוריות והיא גירוי היתר השחלתי. בעקבות כך טובה שיטה זו במיוחד למטופלות הסובלות מתסמונת השחלה הפוליציסטית.
הבשלת הביציות הפיזיולוגית מתרחשת בשני מישורים - הבשלת גרעין הביצית והבשלת הציטופלסמה. מטרת ההבשלה החוץ גופית הוא להביא לתהליך הבשלה דומה של הביציות במעבדה. ביציות בלתי בשלות נשאבות מהמטופלות ובמעבדה מסייעים בהבשלתן הסופית עד שיהיו בשלות להפריה. תהליך שאיבת ביציות בלתי בשלות מזקיקים קטנים ולא מפותחים דורשת הערכות ומיומנות מתאימה. תהליך ייחודי זה דורש הבנה מעמיקה בתחום התפתחות זקיקים וביציות, ניסיון טכני, ציוד מתאים ובעיקר יכולת מעבדתית מקצועית.
מטרת הטיפול
הפריה חוץ גופית, התפתחה מאוד מאז לידת התינוקת הראשונה ב-1978 והוכיחה עצמה כשיטת טיפול יעילה לזוגות עקרים רבים. יחד עם זאת, לשיטה זו עדין חסרונות משמעותיים, הכוללים את הצורך בטיפול בזריקות הורמונים משך מספר ימים, תופעות הלוואי של התרופות, הצורך במעקב קפדני ואי הנוחות הנובעת מכך והעלות הגבוהה של הטיפול. אחת מתופעות הלוואי המרכזיות של טיפול IVF הנה עדיין תופעת גירוי היתר השחלתי. שכיחות התופעה בדרגות חומרה שונות הנה כ-6% מכלל מחזורי ה-IVF, בעיקר בקרב נשים צעירות עם שחלות פוליציסטיות. למרות שמרבית המקרים הנם בדרגה קלה חלקם אף עלולים להסתיים במוות. אחד הפיתרונות שהוצעו כדי להתגבר על חסרונות אלו הנה ההבשלה החוץ גופית של ביציות. בשיטה זו עושים שימוש בביציות לא בשלות שהוצאו משחלה שלא עברה גירוי הורמונאלי. הביציות עוברות תהליך הבשלה במעבדה ומופרות רק לאחריו. ההיריון הראשון מהבשלה חוץ גופית של ביצית לא בשלה, דווח רק בשנת 1991 לאחר איסוף ביצית לא בשלה בניתוח קיסרי[1]. מאז, חלה התקדמות רבה בתחום זה, וכיום שיטה זו מקובלת במספר מרכזים בעולם, עם אחוזי הצלחה טובים.
יתרונות ה-IVM
לשימוש בטכניקת ה-IVM מספר יתרונות:
- אין צורך בגירוי שחלתי בגונדוטרופינים ולכן עלות הטיפול נמוכה יותר, ונמנעות מרבית תופעות הלוואי
- הטיפול קצר יותר, נוח יותר ופחות מפריע לאורח החיים
- נמנע לחלוטין הסיכון של גירוי יתר שחלתי
- אין צורך בהמתנה בין המחזורים
- שימוש במחט שאיבה דקה מפחיתה כאבים ואי נוחות לאחר השאיבה
פיזיולוגיה
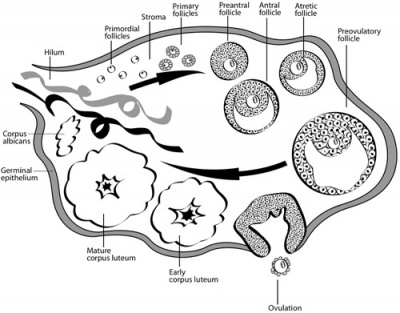
ביציות האישה נוצרות כולן במהלך החיים העובריים. עם הלידה מצויות בזקיקי השחלה כ-500,000 ביציות בלתי בשלות.
- אנו מבחינים במספר שלבים בגדילת הזקיקים
- Primordial Follicle - ביצית קטנה המוקפת בשכבה חד תאית של תאי פרה-גרנולוזה שטוחים. זקיקים אלו נמצאים בקליפת השחלה. קל להקפיאם, אך קשה להוציא ביצית בשלב זה מהשחלה ללא פגיעה בזקיק, וקשה לגדלה במעבדה.
- Primary Follicle - תאי הגרנולוזה הופכים לבשלים, בעלי מבנה קובייתי. זהו שלב הגדילה הראשון והנו למעשה יותר הבשלה מגדילה. בשלב הזה גם מתפתחים הקשרים בין הביצית לתאי הגרנולוזה, המאפשרים מעבר חומרים ומסרים.
- Pre-antral Follicle - ביצית שגדלה חלקית, מוקפת בתאי גרנולוזה והאנטרום (זקיקים קטנים מ-3 מ"מ). גודל הביצית בשלב זה כ-80-120 מיקרון וגודל הזקיק כ-2 מ"מ.
- Antral Follicles - שלב זה מתאפיין בביצית בגודל מלא והאנטרום מלא בנוזל. גודל הביצית בשלב זה נשאר ללא שינוי כ-120 מיקרון וגודל הזקיק כ-5 מ"מ
כאמור הביציות השמורות בשחלה אינן בשלות כיון שחלוקת הביצית נעצרת בחיים העובריים בפרופאזה של המיוזה הראשונה. תהליך הבשלת ביציות בנוי משלבי הבשלה של הגרעין והבשלה של הציטופלסמה. הבשלה של גרעין הביצית מוגדרת כשבירה של ה-Germinal Vesicle (GV), המתבטאת בהעלמות הממברנה של הגרעין, השלמת החלוקה המיוטית הראשונה ושחרור ה-Polar Body הראשון. בהמשך מתחילה החלוקה המיוטית השנייה, והביצית נעצרת שוב בשלב המטפאזה השנייה (M II) לפני הביוץ. במקביל להבשלת הגרעין, מתרחש תהליך ההבשלה של הציטופלסמה, הכולל ייצור חלבונים, החיוניים להבשלה והשלמת חלוקת ההפחתה של הגרעין וכן לקיום הראשוני של החיים העובריים באם הביצית תופרה.
במהלך המחזור החודשי זקיקים אנטרלים מגיבים לגירוי הורמונאלי על ידי FSH (Follicle-stimulating hormone) ומגויסים להתפתחות וגדילה. בהמשך, בהשפעת ה-FSH מתרחש תהליך בחירת הזקיק המוביל וגדילתו עד לשלב טרום ביוצי. עם הופעת פיק ה-LH (Luteinizing hormone)(LH SURGE) מבשיל גרעין הביצית כמתואר והביצית מוכנה להפריה.
הפיזיולוגיה של IVM
הרעיון בביצוע IVM הנו שאיבה של ביצית מזקיקים אנטרלים בהם מצויות ביציות אשר השלימו את מרבית ההבשלה שלהן. אחד היתרונות בשאיבת זקיקים אלו הנה הימצאותם הקבועה בשחלה, כך שניתן לבצע את השאיבה ללא קשר למחזור, ללא צורך בגירוי שחלתי ואף מספר פעמים במהלך מחזור אחד[2]. שאיבת הביצית גם בשלב של זקיק קטן, מאפשרת קבלת ביצית שלאחר הבשלה בת כ-36 שעות במעבדה, תניב ביצית בשלה. ביצית זו איננה שונה מבחינה מורפולוגית, לא בגודלה ולא במאפייניה החיצוניים מביצית הנשאבת מזקיק טרום ביוצי. לביצוע IVM ניתן לשאוב ביציות מזקיקים אנטרלים בגודל 2 מ"מ ומעלה [2].
- זמינות הזקיקים - ההערכה היא כי כ-10-20 זקיקים אנטרלים גדלים לשלב טרום ביוצי בכל מחזור[3]. לאחרונה דווח כי בכל מחזור באישה קיימים 2-3 גלים של התפתחות פוליקולרית, על פי עדויות שנמצאו במעקב על שמע יומי. ממצא זה מעלה את מספר הזקיקים אנטרלים הזמינים לשאיבה [5, 4]. השערה זו מתבססת על העובדה כי ביציות לא בשלות אשר נשאבו מזקיקים לא דומיננטיים, הבשילו במעבדה, הופרו, ואף הובילו להריון ולידה [6]. יחד עם זאת, במחזורי IVM חשוב למנוע את הביוץ של הזקיק המוביל, ולכן הניסיון מראה כי ניתן לתת hCG כאשר הזקיק המוביל מגיע ל-12 מ"מ, כדי למנוע את האטרזיה של הזקיקים הקטנים. חלק מהביציות הנשאבות בשלב זה מהזקיק המוביל יהיו בשלות. חשוב להדגיש כי הבשלת ביציות עד לשלב האנטרלי המוקדם מתרחשת כל הזמן וללא תלות בגונדוטרופינים. לכן ניתן למצוא ולשאוב זקיקים אלו ללא קשר למחזור, ואף מספר פעמים באותו מחזור [7].
התוויות לשימוש בהבשלה חוץ גופית
כמו בכל התערבות רפואית הצלחת הטיפול תלויה בבחירה נכונה של המטופלות. קיים קשר ישיר בין הצלחת הטיפול למספר הביציות הלא בשלות הנשאבות. אחד הפרמטרים המשמשים לניבוי ההצלחה הינו מספר הזקיקים בתחילת המחזור - AFC (Antral follicular count). נשים עם 20 זקיקים או יותר בתחילת המחזור הינן בעלות סיכוי טוב להצלחת התהליך.
- נשים עם שחלות פוליציסטיות - זו הקבוצה המרכזית היכולה ליהנות מטיפולי IVM. מקובל להציע לאישה ביצוע IVM כאשר יש לה AFC של 20 זקיקים ומעלה.
- נשים עם גורמי סיכון לתסמונת גירוי יתר שחלתי - בעיקר נשים אשר סבלו במחזורים קודמים מגירוי יתר שחלתי הנן מועמדות טבעיות לתהליך. לפי המידע הקיים, תופעת גירוי היתר נמנעת לחלוטין בעת שימוש בטכניקת ה-IVM.
- חשד להתפתחות תסמונת גירוי יתר שחלתי במהלך מחזור IVF רגיל - מניעת התפתחות גירוי יתר שחלתי בנשים אשר יש חשש שיפתחו את המחלה על ידי מתן hCG כאשר הזקיק המוביל הגיע לגודל של 12-14 מ"מ. למרות שגירוי יתר שחלתי נקשר ל-hCG, הרי שנשים אלו שהיו בקבוצת סיכון לא פיתחו את המחלה [8]. מתן hCG בשלב מוקדם של הגירוי שחלתי בשילוב עם IVM, מהווה תחליף לביטול המחזור.
- שימור פיריון - לנשים המעוניינות בשימור פריון טרם טיפולים כימותרפיים או הקרנות, הקפאת ביציות הנו אחד הטיפולים המוצעים. יתרונות ה-IVM במקרי שימור פוריות הנן האפשרות לבצע שאיבה ללא תלות במועד המחזור החודשי וכן האפשרות להימנע מטיפול הורמונאלי אשר הינו אסור בחלק מהגידולים הסרטניים.
- מקרים בהם קיימת מניעה מטיפול הורמונאלי - נשים הזקוקות לטיפולי פוריות אך עקב מצבן הבריאותי מנועות מלקבל טיפול הורמונאלי (לדוגמא נשים עם מצבי קרישיות יתר כדוגמת תסמונת APLA (Antiphospholipid syndrome)) יכולות ליהנות מגישה טיפולית זו.
- כישלונות חוזרים ב-IVF - שיטת ה-IVM יכולה להוות כלי נוסף בידו של רופא הפריון לטיפול באותן נשים אשר ה שיטות האחרות נכשלו.
אופן הטיפול
- פרוטוקולים להכנת השחלות לשאיבת הזקיקים - ניתנת לביצוע במספר דרכים. בכל המקרים מוזמנת המטופלת לביצוע בדיקות דם ובדיקת על קול (אולטראסאונד) בימים 2-3. למחזור. בעל קול זה מבוצעת הערכת מספר הזקיקים האנטרלים (AFC) וגודלם. בשלב זה ניתן להתחיל גירוי הורמונלי קל בעזרת FSH למשך 3 ימים או להימנע ממתן הורמונים כלל. בימים 6-8 מבוצע על קול שני, בו נבדקים שוב כל הפרמטרים שהוזכרו לעיל. נהוג לתת hCG כאשר הזקיק המוביל בגודל של 12-16 מ"מ כדי להגדיל את הסיכויים לקבלת ביצית בשלה. בכל מקרה תנאי למתן הכוריגון הנו עובי רירית של 6 מ"מ ומעלה. במידה והרירית איננה בעובי המתאים, מחכים 3 ימים וחוזרים על העל קול כעבור 3 ימים. ניתן להוסיף אסטרוגן או HMG (Human menopausal gonadotropin) בשלב זה על מנת לעזור בבניית הרירית. במחקר רנדומלי שפורסם לאחרונה [9] וכלל 400 מטופלות, בוצעה השוואה בין פרוטוקולי טיפול שונים. במחקר זה נבדקו תוצאות הטיפול ב-4 קבוצות שונות: קבוצה ללא טיפול כלל ב-FSH ו-hCG, קבוצה שטופלה ב-hCG בלבד, קבוצה שטופלה ב-FSH בלבד וקבוצה שטופלה ב-FSH ו-hCG. תוצאות המחקר הראו יתרון ברור ומובהק בשיעור ההריונות בנשים שטופלו ב-FSH ו-hCG ביחס לכל הקבוצות האחרות. כמו כן נצפתה עליה בשיעור הביציות הבשלות בכל הקבוצות שטופלו ב-hCG. תרומת מתן hCG לעליה בשיעור ביציות בשלות נצפתה גם במחקרים נוספים. כאשר לא ניתן גירוי הורמונלי מקדים עם FSH, אחוז ההריונות היה גבוה יותר בקבוצה שלא קיבלה hCG
- פעולת שאיבת הביציות - השאיבה מבוצעת בד"כ בין ימים 10-14 למחזור, בהרדמה מקומית, ספינלית או כללית. הזרקה מקומית של מאלחש מקומי לקירות הנרתיק מפחיתה את אי הנוחות של הדקירות החוזרות. השאיבה מבוצעת תחת הנחיית על שמע עם מחט 19G, כאשר את תת הלחץ מורידים ל- 7.5kPa (85-100 מ"מ כספית). הנוזל הפוליקולרי נשאב למבחנות המכילות 0.9% Saline, עם IU/mL 2 הפרין. בכדי לשפר את יכולת איתור הביציות מבצעים סינון של נוזל השאיבה לאיתור ביציות נוספות. משך השאיבה ארוך יותר משאיבה ממוצעת של IVF כיוון שחשוב מאוד להקפיד לשאוב את כל הזקיקים הנצפים בעל שמע. שימוש במכשיר על שמע בעל דיוק גבוה תורם לשיפור ההצלחה
- הכנת הרחם - במחזור IVM אין הפרשת אסטרוגן מהזקיק המוביל, ולכן יש חשיבות למתן אסטרוגן להכנת רירית הרחם, ויש לתאם את חלון ההשרשה עם ההתפתחות העוברית. מקובל להתחיל לתת אסטרוגן (E2-17β) ביום השאיבה, במינון של 6-12 מ"ג בהתאם לעובי רירית הרחם. מוסיפים פרוגסטרון (תוך שרירית או טבליות לדניות) ביום בו מאובחנות ביציות בשלות
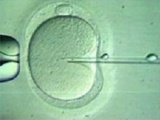
- הבשלת הביציות - הביציות שנשאבו מאובחנות כבשלות (M II) או בלתי בשלות (GV, MI). חשוב להדגיש כי אבחנה זו הנה חשובה ודורשת מיומנות, שכן הביציות אינן מופשטות בשלב זה ועטופות בתאי הקומולוס. הביציות הבשלות עוברות הפריה תוך כשלש שעות (IVF או ICSI (Intracytoplasmic sperm injection)). הביציות הלא בשלות עוברות הדגרה בצלחת תרבית המכילה 1 מ"ל מצע מועשר ב-75IU של FSH ו-LH. הביציות נבדקות לאחר 24 ו-30 שעות. במידה והביצית בשלה היא מועברת להפריה. אין הוכחה ודאית כי יש לבצע ICSI ב-IVM לצורך ההפריה (כאשר נתוני הזרע תקינים). בעבר היו עבודות שהראו כי ביצוע ICSI בביציות שעברו IVM העלה את שעורי ההפריה [10,11]. לאחרונה נראה שאין זה חיוני לבצע ICSI, גם כאשר הבשלת הביצית בוצעה במעבדה [12]. למרות זאת בכדי להימנע מכישלונות עדיין מקובל היום לבצע ICSI בכל מקרי IVM [13]. זמן ההפריה אף הוא בעל חשיבות ומקובל לבדוק את הביציות לאחר 24 שעות ולאחר 30 שעות כדי להימנע ממצב בו ביציות שהבשילו מהר יישארו זמן רב מדי בהמתנה ב-Metaphase Arrest. ההפריה נבדקת לאחר 18 שעות כמקובל. ההחזרה מבוצעת ביום 2 או 3 לאחר ההפריה. מקובל לבצע Assisted Hatching כדי לשמור על אחוזי ההשרשה בשל התקשות הזונה פלוצידה, יחד עם זאת אין לכך הוכחה מדעית
- מדיום הגידול - המדיום בו נעשה שימוש להבשלת הביצית הנו גורם מרכזי בהצלחה להבשלת הביצית במעבדה. המדיום בו משתמשים הנו מורכב וכולל מרכיבים שונים: Tissue Culture 199 ,Ham's F-10 ו-Chang's Medium buffered with bicarbonate or N-2-hydroxyethy-piperazine-N-2-ethanesulfonic acid. יש הנוהגים להוסיף לנוזל הגידול מספר מרכיבים נוספים בניסיון לשפר את התוצאות כדוגמת FSH, סרום, גלוקוז, חומצות אמינו או ויטמינים [13,14]
תוצאות
ההצלחות כיום עומדות על השגת ביציות ב-60% מכלל הזקיקים הנצפים באולטראסאונד, 90% מהביציות מבשילות, וכ-75% עוברות הפריה. שיעור ההריונות עומד על 35% למחזור. אין הרבה מחקרים אשר השוו את תוצאות ה-IVM למחזור IVF רגיל. במחקר רטרוספקטיבי בנשים עם שחלות פוליציסטיות [15] נמצא כי מספר הביציות ומספר העוברים שהתקבלו במחזור היה גדול יותר בקבוצת ה-IVF בהשוואה ל-IVM. גם שיעור ההריונות הקליניים היה 26.2% בקבוצת ה-IVM לעומת 38.3% בקבוצת ה-IVF. יחד עם זאת היו 12 מקרים (11.2%) של גירוי יתר שחלתי בינוני או קשה בקבוצת ה-IVF, ואף מקרה בקבוצת ה-IVM. על סמך נתונים אלו ובהעדר מחקר פרוספקטיבי ניתן לסכם ולומר כי שיעור ההריונות למחזור טוב יותר ב-IVF לעומת IVM במחיר של סיכון לגירוי יתר שחלתי. ההשערות המקובלות להסבר אחוזי ההצלחה הנמוכים יותר במחזורי IVM לעומת IVF, הנם כי ההבשלה החוץ גופית של הביצית איננה מיטבית עדיין ומקובל כי הסיכוי לקבל הריון גבוה יותר כאשר הביצית הנשאבת בשלה (גם במחזור IVM). כמו כן ב-IVM יש הפרעה בהתפתחות רירית הרחם ובתאום הסנכרון שבין הרחם לעובר. בשל כך מקובל היום להחזיר במחזור IVM עובר אחד יותר מאשר במחזור IVF (בדומה למה שנהוג בהחזרת עוברים במחזור של מוקפאים).
סיבוכים
- סיבוכים אמהיים - שיעור הסיבוכים למטופלות הנו נמוך. קיים חשש לאחוז גבוה יותר של זיהומים בשל משך הפעולה והדקירות החוזרות ולכן יש הנותנים טיפול אנטיביוטי מניעתי לכל הנשים. גם החשש לדימומים עקב הדיקורים החוזרים, למעשה לא נצפה.
- סיבוכים עובריים - מספר עבודות סקרו את תוצאות טיפולי IVM מבחינת סיבוכי ההיריון ובריאות הילודים. בעבודה שהשוותה 55 ילדים שנולדו לאחר IVM , 217 ילדים שנולדו לאחר טיפול IVF ו-160 ילדים שנולדו לאחר IVF+ICSI לקבוצות ביקורת של הריונות ספונטניים נמצא כי כל טכנולוגיות ה-ART (Assisted reproductive technology) נמצאו קשורות בעלייה בסיכון למומים מולדים לעומת קבוצת הביקורת אך ללא הבדל בין הקבוצות השונות. מסקנת המחברים אם כן הייתה כי IVM אינו גורם לסיכון יתר בהשוואה לטכנולוגיות הרבייה האחרות [16]. עבודה אחרת שעקבה אחרי 46 ילודים מטיפולי IVM עד גיל שנתיים הראתה כי בגיל שנה, לשמונה ילדים (19%) היו בעיות התפתחותיות קלות אך בגיל שנתיים ההתפתחות הנוירופסיכולוגית בילדים אלו הייתה תקינה [17].
המידע הציטוגנטי על עוברים שנוצרו לאחר IVM עדיין מצומצם מאוד. DeScisciolo וחבריו הראו כי שיעור העוברים בעלי מורפולוגיה תקינה של הגרעין ובעלי כרומוזומים תקינים נמוך יותר בקבוצה של העוברים מביציות שעברו IVM בהשוואה לביציות בשלות [18]. הבעיה המרכזית בעבודה זו נבעה מהעובדה כי ה-IVM נעשתה לביציות לא בשלות שהתקבלו במחזור IVF רגיל. יתכן וביציות אלו שלא מבשילות למרות הגירוי שחלתי מהוות קבוצה נפרדת המיועדת לאפופטוזיס ואטרזיה, ואינן דומות לביציות בלתי בשלות ששואבים במחזור טבעי של IVM. בעבודה שבוצעה בביציות שהתקבלו מעכברות ועברו הבשלה במעבדה נמצא שינוי בסטטוס המתילציה של מספר גנים הקשורים בפלוריפוטנטיות. החוקרים טענו כי למרות שאין כל מידע לגבי המשמעות הביולוגית של הממצאים, הדבר מצריך המשך מחקר ובדיקה [19].
לסיכום, קשה להסיק מסקנות סופיות על בטיחות השיטה בשל המיעוט היחסי של המקרים שדווחו עד כה, אך חשוב להדגיש כי בכל הסדרות שדווחו עד כה לא דווח על עליה בשכיחות המלפורמציות הגנטיות.
פרוגנוזה
ה-IVM עם יתרונותיו ואחוזי ההריונות המתקרבים לאחוזי ההריונות המדווחים ב-IVF, הנו שיטת טיפול יעילה ובטוחה, המהווה תחליף טוב ל-IVF וכלי טיפולי נוסף בארגז הכלים של הרופא לטיפול בעקרות בכלל ובנשים הסובלות מתסמונת השחלות הפוליציסטיות בפרט. עדיין יש לחקור את מנגנון ההבשלה של הביצית כדי לשפר את תנאי הגידול ומצע הגידול, ולהעלות את שעורי ההשרשה של ביציות שהבשילו במעבדה. חשוב מאוד להמשיך ולעקוב אחר ילדים שנולדו ב-IVM, כדי לצבור מידע ולהעריך טוב יותר את בטיחות השיטה.
ביבליוגרפיה
- Cha KY, Koo JJ, Ko JJ, et al., Pregnancy after in vitro fertilization of human follicular oocytes collected from nonstimulated cycles, their culture in vitro and their transfer in a donor oocyte program. Fertil Steril, 1991; 55(1): 109-113.
- Chian RC. Personal Communication. 2005.
- Hillier SG, Current concepts of the roles of follicle stimulating hormone and Luteinizing hormone in folliculogenesis. Hum Reprod, 1994; 9(2): 188-191.
- Baerwald AR, Adams GP, Pierson RA, A new model for ovarian follicular development during the human menstrual cycle. Fertil Steril, 2003; 80(1): 116-122.
- Baerwald AR, Adams GP, Pierson RA, Characterization of ovarian follicular wave dynamics in women. Biol Reprod, 2003; 69(3): 1023-1031.
- Thornton MH, Francis MM, Paulson RJ, Immature oocyte retrieval: lessons from unstimulated IVF cycles. Fertil Steril, 1998; 70(4): 647-650.
- Chian RC. Unpublished Work. 2005.
- Chian RC, Lim JH, Tan SL, State of the art in in-vitro oocyte maturation. Curr Opin Obstet Gynecol, 2004; 16(3): 211-219.
- Fadini R, Dal Canto MB, Mignini Renzini M, Brambillasca F, Comi R, Fumagalli D, Lain M, Merola M, Milani R, De Ponti E. Effect of different gonadotrophin priming on IVM of oocytes from women with normal ovaries: a prospective randomized study. Reprod Biomed Online. 2009 Sep;19(3):343-51
- Barnes FL, Crombie A, Gardner DK, et al., Blastocyst development and birth after in-vitro maturation of human primary oocytes, intracytoplasmic sperm injection and assisted hatching. Hum Reprod, 1995; 10(12): 3243-3247.
- Hwang JL, Lin YH, Tsai YL, In vitro maturation and fertilization of immature oocytes: a comparative study of fertilization techniques. J Assist Reprod Genet, 2000; 17(1): 39-43.
- Soderstrom-Anttila V, Makinen S, Tuuri T, Suikkari AM, Favourable pregnancy results with insemination of in vitro matured oocytes from unstimulated patients. Hum Reprod, 2005; 20(6): 1534-1540.
- Rao GD, Tan SL, In vitro maturation of oocytes. Semin Reprod Med, 2005; 23(3): 242-247.
- Chian RC, Buckett WM, Too LL, Tan SL, Pregnancies resulting from in vitro matured oocytes retrieved from patients with polycystic ovary syndrome after priming with human chorionic gonadotropin. Fertil Steril, 1999; 72(4): 639-642.
- Child TJ, Phillips SJ, Abdul-Jalil AK, et al., A comparison of in vitro maturation and in vitro fertilization for women with polycystic ovaries. Obstet Gynecol, 2002; 100(4): 665-670.
- Buckett WM, Chian RC, Holzer H, Dean N, Usher R, Tan SL. Obstetric outcomes and congenital abnormalities after in vitro maturation, in vitro fertilization, and intracytoplasmic sperm injection. Obstet Gynecol. 2007 Oct;110(4):885-91.
- Soderstrom-Anttila V, Salokorpi T, Pihlaja M, et al., Obstetric and perinatal outcome and preliminary results of development of children born after in vitro maturation of oocytes. Hum Reprod. 2006 Jun;21(6):1508-13. Epub 2006 Jan 31
- DeScisciolo C, Wright DL, Mayer JF, et al., Human embryos derived from in vitro and in vivo matured oocytes: analysis for chromosomal abnormalities and nuclear morphology. J Assist Reprod Genet, 2000; 17(5): 284-292.
- Milroy C, Liu L, Hammoud S, Hammoud A, Peterson CM, Carrell DT. Differential methylation of pluripotency gene promoters in in vitro matured and vitrified, in vivo-matured mouse oocytes. Fertil Steril. 2011 May;95(6):2094-9. Epub 2011 Apl 1
המידע שבדף זה נכתב על ידי ד"ר אריאל הורביץ, ד"ר אתי ממן, היחידה להפרייה חוץ גופית, אגף נשים ויולדות, המרכז הרפואי ע"ש ח. שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק