לקטין קושר מאנוז - Mannose-binding lectin
| מדריך בדיקות מעבדה | |
| לקטין קושר מאנוז | |
|---|---|
| Mannan-binding lectin | |
| שמות אחרים | Mannose-binding lectin, MBL, MBL2, Mannose-binding protein, Collectin-1, MBP-C, MBP1, mannan-binding protein. |

| |
| מעבדה | כימיה בדם |
| תחום | מעורבות מערכת החיסון הטבעית (innate immunity) בתרחישים פתולוגיים. |
| טווח ערכים תקין | מעל 500 ננוגרם/מיליליטר |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מערכת המשלים
מטרת הבדיקה
קביעת ריכוז MLB בנסיוב עשויה להיות שימושית בבירור חשד של פגמים חיסוניים, כמדד פרוגנוסטי המצביע על הצורך לנקיטת אמצעים טיפוליים או פרופילקטיים במטופלים עם מערכת חיסון כושלת, כולל חולי סרטן מטופלים על ידי כימותרפיה, חולים עם cystic fibrosis, SLE או rheumatoid arthritis.
לקטין הקושר מאנוז
Mannose-binding lectin (להלן MLB) הוא חלבון של מערכת החיסון הטבעית, השייך למשפחת collectin (שמבנה החלבון שלהם מכיל גם אזור קולאגני וגם מקטע בעל פעילות לקטין, ומכאן שמם), והוא בעל יכולת להפגין מספר פעילויות אנטי-מיקרוביאליות. הוא מזהה ונקשר למספר פתוגנים כולל חיידקים, נגיפים, פטריות וטפילים, תוך מתן הגנה מפני פלישת פתוגנים אלה לגוף פונדקאי (Kilpatrick ב-Biochim Biophys Acta משנת 2002). למרות שההשפעה הקלינית של חסר MBL הכרוכה במגוון גדול של מחלות נלמדה באופן אינטנסיבי, המשמעות הקלינית של רמות MBL נמוכות באנשים בריאים עדיין לא ברורה. בשנות החיים המוקדמות נראה חסר MBL רלוונטי במצבים של מערכת חיסון לקויה (Sumiya וחב' ב-Lancet משנת 1991). ייתכן של-MBL יש תפקיד של קו הגנה ראשון בתקופה הנאו-נטלית, כאשר מערכת החיסון של היילוד עדיין אינה בשלה (Scorza וחב' ב-Clin Chim Acta משנת 2015).
בה בשעה שרמות נמוכות של MBL בנסיוב נכרכו בסיכון מוגבר לאירועי ספּסיס הנגרמים במהלך אשפוז (De Benedetti וחב' ב-Pediatr Res משנת 2007, ו-Auriti וחב' ב-Hum Immunol משנת 2010), וכן בסיכונים נוירולוגיים בפגים (Auriti וחב' ב- Pediatr Res משנת 2014), הראו מחקרים במכרסמים את חשיבות חסר MBL בהחמרת הנזקים ברמות הלב, המעי, המוח והכליות במהלך של איסכמיה וזילוח מחדש על ידי שפעול של מערכת המשלים. לעומת זאת, נמצא שרמות גבוהות של MBL בנסיוב, מגבירות את הסיכון של necrotizing enterocolitis בפגים (Prencipe וחב' ב-J Pediatr Gastroenterol & Colitis משנת 2012). אי ההסכמה לגבי המשמעות הקלינית של רמות נמוכות או גבוהות של MBL בנסיוב, מקרינה גם על השאלה האם הזרקה חיצונית של MBL תשרה הגנה על הגוף, או תגרום לו נזק (Turner ב-Immunology משנת 1998).
שלוש מוטציות נקודתיות באקסון 1 של הגן MBL2, בקודונים 52, 54 ו-57, הן בעלות ההשפעה הגדולה ביותר על הרמה ועל התפקוד של MBL (על פי Garred וחב' ב-Mol Immunol משנת 2003). שלוש מוטציות אלו גורמות ליצירת וריאנטים B, D ו-C בהתאמה. חסר ב-MBL נחשב לחסר האימוני הנגרם על ידי מוטציה B ומופיע ב-26% של האוכלוסייה הלבנה (Steffensen וחב' ב-J Immunol Meth משנת 2000). רמות MBL בלידה הן בערך 65% מרמות חלבון זה במבוגרים, רמות המושגות כבר כחודש לאחר הלידה, וידוע שיש ירידה קלה של MBL בגיל המתקדם מעל 70 שנה (Ytting וחב' ב-Scand J Immunol משנת 2007). באוכלוסייה הנורמלית רמות נמוכות של MBL מופיעות בפחות מ-40% מהפרטים, ואילו רמות חסר של MBL מוצאים ב-8-10% מהפרטים (Worthley וחב' ב-Intern Med J משנת 2005, ו-Sorensen וחב' ב-Clin Exp Immunol משנת 2006).
בהפטוציטים של חולדה, MBL מסונתז ב-rough endoplasmic reticulum, ואילו ב-Golgi הוא עובר 2 שינויים לאחר שלב התרגום, והוא מתכנס לקומפלקסים מולטימריים עם משקל מולקולארי גבוה. השינויים האמורים מייצרים MBL בצורות אחדות עם מסות מולקולריות שונות, וערכי pI בטווחים שבין 5.7 ל-6.2 (Colley ו-Baenziger ב- Biol Chem J משנת 1987). ביקוע פרוטאוליטי הביא להסרת 20 חומצות אמינו מהקצה ה-N טרמינלי של ה-peptide signal, וכן התגלו שלבים של הידרוקסילציה וגליקוזילציה. מספר שיירים של ציסטאין יכולים לעבור התמרה ל-dehydroalanin (Jensen וחב' ב-Biochim Biophys Acta משנת 2007).
התכונות הביולוגיות של החלבון MBL
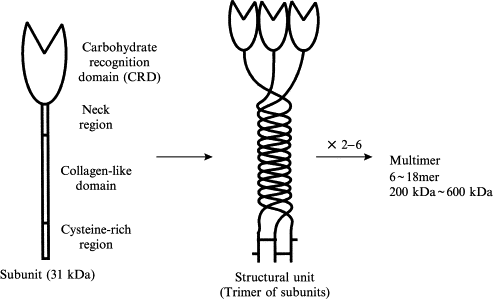
התוצר של הגן MLB2 הוא פוליפפטיד במשקל מולקולרי של 24 קילו-דלטון, המכיל 248 חומצות אמינו ומורכב מארבעה אזורים: אזור עשיר בציסטאין, מקטע קולאגני, מקטע קצר α-הליקאלי, אזור המוגדר כמקטע צווארי ומקטע המזהה פחמימות כאשר החלבון מסתיים בראש גלובולארי בולט. שלוש שרשרות פוליפפטידיות יוצרות סליל משולש דרך המקטע הקולגאני, כאשר סליל שלישוני זה מיוצב על ידי אינטראקציות הידרופוביות וקשרים די-סולפידים באזור הקצה ה-N-טרמינלי העשיר בציסטאין. צורה טרימרית זו היא המבנה הבסיסי של כל צורות MBL בצירקולציה. מולקולות גדולות יותר יכולות להתקבל על ידי אוליגומריזציה של תת-יחידות הומו-טרימריות (Kawasaki ב-Biochim Biophys Acta משנת 1999, ו-Kilpatrick ב-Biochem Soc Trans משנת 1999)
המבנה האוליגומרי המוקפד מאוד, ובמיוחד האזור המזהה סוכרים, מגדירים את אופי ומבנה הסוכרים אליו נקשר זה לקטין זה, כגון mannose או N-acetylglucosamine או fucose החשופים על פני שטח הפנים של הרבה חיידקים, נגיפים, פטריות וטפילים (Klein ב-Mol Immunol משנת 2005, Worthley וחב' ב-Intern Med J משנת 2005, ו-Eisen ו-Minchinton ב-Clin Infec Dis משנת 2003). מסיבה זו ה-MBL שייך לקבוצה של מה שמוגדר כ-"מולקולות מזהות מבנים" (Takahashi וחב' ב-Curr Opin Immunol משנת 2006) המתווכות בשפעול התגובה החיסונית.
MBL מיוצר בעיקר בכבד (Mori וחב' ב-Arch Biochem Biophys משנת 1984, ו-Bouwman וחב' ב-Gastroenterology משנת 2005), ומופרש לנסיוב במצבי עקה כחלבון acute phase התלוי בסידן (Collard וחב' ב-Mol Immunol משנת 1999). באופן משמעותי, רמות מוגברות של MBL דווחו כתגובה לזיהומים. בתרחישים דלקתיים, MBL יכול לעזוב את זרם הדם על ידי דליפה מכלי הדם, וניתן למצוא אותו ברירית האוזן התיכונה, ברירית דרכי הנשימה בנוזל סינוביאלי "מודלק" ובנוזל שלייה נורמלי (Malhotra וחב' ב- Imunology משנת 1994, ו-Garred ב-Clin Exp Immunol משנת 1993). MBL משפעל מקרופאגים (Bohlson ב-Frontiers Immunol מנת 2014), מחיש פגוציוזה (Fraser ו-Tanner ב-Curr Drug Targets משנת 2008, ו-Nadesalingam וחב' ב- J Immunol משנת 2005). הוא משחק תפקיד בשפעול משלים (Neth וחב' ב-J Immunol משנת 2002, ו-Matsushita ו-Fujita ב-Immunobiology משנת 1992, Thiel וחב' ב-Nature משנת 1997, ו-Casanova ו-Abel ב- J Exp Med משנת 2004).
קומפלקסים שיוצר MBL עם חלבונים אחרים
MBL בדם יוצר קומפלקסים עם שלושה serine proteases הידועים כ-MASPs או MBL-associated serine proteases, ליצירה של MASP1, MASP2 ו-MASP3, שמסוגלים לאתחל את מסלול הלקטין לשפעול משלים, לשחרור של ציטוקינים ושל גורמי קואגולציה. שני חלבונים נוספים איתם יוצר MBL קומפלקסים, ידועים כ-MAp19 ו-MAp44, שאינם מכילים מקטעים בעלי פעילות פרוטאזה, נחשבים כמולקולות רגולטוריות של MASPs. ה-MASPs יוצרים גם כן קומפלקסים עם Ficolins, הדומים ל-MBL במבנה וגם בתפקוד, עם ההסתייגות ש-ficolins מזהים את היעד שלהם על ידי המקטע דמוי-פיברינוגן שלהם, שלא בדומה ל-MBL. על מנת לשפעל את מערכת המשלים כאשר MBL נקשר למולקולת היעד שלו, כגון לסוכר mannose על פני חיידק פולש, ה-MASP פועל על מנת לבקע את חלבון הדם C4 ולהפכה ל-C4a ול-C4b. הפרגמנטים של C4b יכולים להיקשר אל פני החיידק, ולאתחל את יצירת C3 convertase. ה-cascade המאותחל של המשלים, המזורז על ידי C-3 convertase. יוצר קומפלקס התוקף את הממברנה הגורם לליזיס של הפתוגן או לאפופטוזיס ונמק של תאים. לקומפלקס MBL/MASSP-1 יש פעילות דמוית-תרומבין ביצירת פקקת של פיברין. לפיכך, עכברים טרנסגניים החסרים MBL, או חסרים MASP1/3, הם בעלי זמן קרישה ארוך, במודלים של פציעה מכוונת.
ישות בודדת של MASP זוהתה במקור ואופיינה כפרוטאזה עם יכולת לבקע את חלבוני המשלים C4, C2 ו-C3 (Matsushita ו-Fujita ב-Immunobiology משנת 1995). מקובלת ההשערה ש-MASP-2 מאתחל את המסלול לקטין-משלים, כאשר התפקיד של ה-MASPs עדיין לא ברור (Degn וחב' ב- J Immunol משנת 2012). בנוסף, MASPs יוצרים קומפלקסים פעילים עם Ficolin-1 (אוM-Ficolin ), עם Ficolin-2 (או L-Ficolin) ו-Ficolin-3 (או H-Ficolin) (Lin וחב' ב-J Immunol משנת 2005, Matsushita וחב' ב-J Immunol משנת 2000).
במקרה של נזק רקמתי לאחר נזק איסכמיה וזילוח מחדש, מתמקם MBL במהירות על תאי היעד ויוצר קומפלקס IgM-MBL במקביל לביקוע של C3 (Zhang וחב' ב-J Immunol משנת 2006). כמויות קטנות של MBL מיוצרות באיברים מחוץ לכבד, כגון המוח (Kuraya וחב' ב-Inter Immunol משנת 2003), כליות (Morio וחב' ב-Eur J Biochem משנת 1992, ו-Vorup-Jensen וחב' ב-Inter Immunopharmacol משנת 2001), טחול (Wagner וחב' ב-J Immunol משנת 2003), שקדים (Crasso וחב' ב-J Pediatr Otorhinolaryngology משנת 2009), תימוס ומעי דק (Seyfarth וחב' ב-Mol Immunol משנת 2006, אשכים, שחלות והנרתיק ( Babula וחב' ב-Clin Infect Dis משנת 2003). נפיצות רחבה זו של MBL ברקמות רבות כל כך, מרמזת שהביטוי המקומי של MBL יכול להיות רלוונטי לתגובת חיסון הגנתית מקומית.
גנים ופולימורפיזמים של הגן MBL2
הגן של MLB באדם ממוקם על כרומוזום 10 בעמדה 10q11.2-q21.1 (Sastry וחב' ב-J Exp Med משנת 1989). לעכברים יש 2 גנים הומולוגיים, באדם, אחד מ-2 גנים אלה אבד. בכבד התגלה ביטוי נמוך של MBL1P1 או MBL1 pseudogene 1. הפסבדוגן מקודד לחלבון קָטוּם (truncated) בן 51 חומצות אמינו, שהוא הומולוגי לאיזופורם MLBA במכרסמים ובמספר פרימטים (Guo וחב' ב-Mamm Genome משנת 1998).
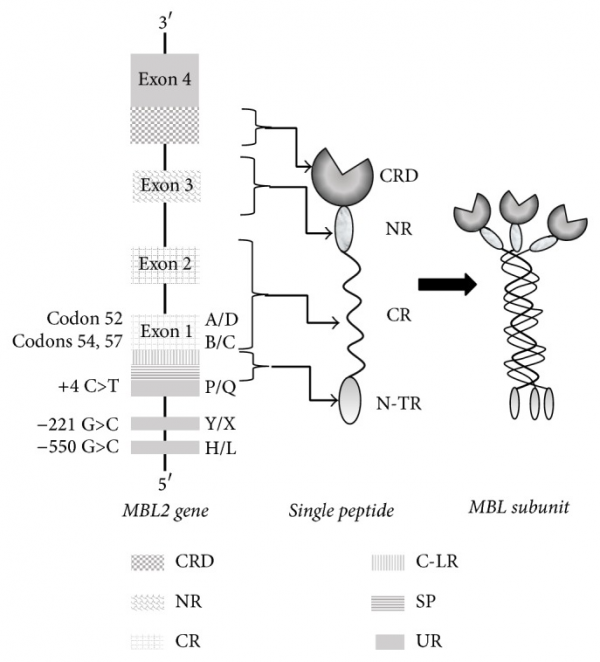
מוטציות מבניות ב-exon 1 של הגן האנושי MLB2, בקודון 52 (Arg to Cys, allele D), בקודון 54 (Gly to Asp, allele B) ובקודון 57 (Gly to Glu, allele C), מפחיתות באופן בלתי תלוי את רמת התפקוד של MLB בנסיוב, על ידי הרס המבנה הקולאגני של החלבון (Seyfarth וחב' ב-Hum Mol Genet משנת 2005). יתרה מכך, מספר שחלופים של נוקלאוטידים אותרו באזור ה-promoter של הגן MLB2 בעמדות 550, 221, 427, 349 ו-336, כמו גם שמט (deletion) בין עמדות 324–329, משפיעים אף הם על ריכוז MBL בנסיוב.
תדירות המוטציות המבניות, וכן הפולימורפיזמים ב-promoter, שונים בין קבוצות אתניות בהן נמצאו 7 haplotypes עיקריים: HYPA, LYQA, LYPA, LXPA, LYBP, LYQC ו-HYPD. הבדלים בתפוצה של haplotypes אלה הם הגורם העיקרי לווריאציות הבין-אתניות ברמות MLB בנסיוב. ה-HYPA ו-LYQA הם haplotypes שהם יצרנים חזקים של MBL, כאשר LYPA יצרן בינוני של MBL ואילו LXPA יצרן שולי של MLB, כאשר LYPB, LYQC ו-HYPD הם haplotypes פגומים שגורמים לחסר חמור ב-MLB.
הנוכחות של אללים וארינטיים של הגן MBL2 תורמת לקידוד של שלושה וארינטים מבניים שונים, הכרוכים עם חסר MBL. חמישה פולימורפיזמים של נוקלאוטידים בודדים (SNPs) בגן MBL2 מובילים לווריאציות בכמות או בתפקוד של MBL בנסיוב. שני SNPs ממוקמים באזור ה-promoter בעמדות 550- (וריאנט H/L) ו-221- (וריאנט X/Y), ו-SNP נוסף ממוקם בנקודה 4+ (וריאנט P/Q) (Madsen וחב' ב-J Immunol משנת 1995). פולימורפיזמים אלה משפיעים על הביטוי של הגן MBL2. ההפּלוֹטיפים LY, HY ו-LX, תואמים פעילות גבוהה, בינונית ונמוכה של ה-promoter, בהתאמה עם רמות MBL בנסיוב. שלושת ה-SNPs המתפקדים הנוספים ממוקמים באקסון 1, ובאופן מדויק יותר בקודון 52 (אלל D), בקודון 54 (אלל B), ובקודון 57 (אלל C) (Lipscombe וחב' ב-Hum Mol Genet משנת 1992), מה שגורם להרס המבנה החוזר על עצמו Gly-X-Y בסליל השלישוני הקולאגני, על ידי שחלוף של שייר גליצין החיוני, על ידי שיירים של ציסטאין, חומצה אספרטית או חומצה גלוטמית, בהתאמה (Steffensen וחב' ב-J Immunol Methods משנת 2000). כל שלושת הווריאנטים מונעים את ההתחברות של תת-היחידות של MBL, ליצירת המבנה הטרימרי הבסיסי, מה שמפחית את כמות חלבון MBL.
האללים הווריאנטים שכיחים מאוד באוכלוסיות נורמליות ובריאות, בהן הם מהווים 20-50% מהפרטים, כאשר האחוז הגבוה ביותר נמצא באפריקאים. אלל B שכיח בלבנים, סינים ואסקימואים, עם שכיחות גנית של 0.11-0.17%, בעוד שאלל C נמצא באופן כמעט בלעדי בקרב אפריקאים, עם שכיחות גנית שבין 0.23-0.29%. אלל D נמצא הן בקרב לבנים כמו גם בקרב אפריקאים, אם כי בשכיחות נמוכה יותר בשתי אוכלוסיות אלו (0.05% בשתיהן) מחקרים באוכלוסיות מצאו השפעה דומיננטית משמעותית של האללים B, C ו-D. רמות MBL בנסיוב נקבעות באופן גנטי, כפי שקבעו Sorensen וחב' ב-Genet Epidemiol משנת 2007. חוקרים אלה העריכו את הרקע הגנטי של רמות MBL בנסיוב, ואת הפעילות של MASP-2, בתאומים מבוגרים. מחקר זה הצביע על השפעה גנטית חדשה על רמות MBL בנסיוב ועל פעילות MASP-2. אכן, ההתאמה בין תאומים זהים של רמות MBL ושל פעילות MASP-2 הייתה משמעותית גבוהה יותר מאשר בין תאומים לא זהים.
MBL ואוטו-אימוניות
היצירה של MBL על ידי הפטוציטים מוגברת על ידי גירוי דלקתי. MBL הומולוגי מבחינת המבנה שלו ל-C1q, והוא נקשר לשיירים סוכריים על פני הדופן של מיקרו-אורגניזמים תוך הגברת האופסוניזציה והפגוציטוזה שלהם. כמו כן MBL משמש במודולציה של תהליכי דלקת, ומסייע לפינוי של תאים מתים בתהליך אופופטוטי (Ogden וחב' ב-J Exp Med משנת 2001, ו-Satomura וחב' ב-Nephron משנת 2002). רוב התאים מוגנים מפני קישור של MBL ומפני שפעול של המשלים דרך שיירי חומצה סיאלית, מה שמונע את זמינותם של שיירים סוכריים ל-MBL. תאים אפופטוטיים מאבדים את שיירי חומצה סיאלית שלהם, ועל ידי כך, חשיפת שיירים סוכריים ל-MBL. בהיקשרו לשיירים אלה, מגיב MBL עם הקולטן של calreticulin על פני פגוציטים, להחשת הפינוי של תאים מתים.
MBL מורכב מתת-יחידות טרימריות עם מקטעי-קצה קולאגניים הכרוכים באינטראקציה שלו עם הקולטן. על ידי התקשרות לשייר mannose ו-N-acetylglucosamine או fucose על פני מיקרו-אורגניזמים שונים, ל-MBL יש תפקיד מרכזי של מולקולת זיהוי ב"מסלול הלקטין" של שפעול המשלים. בנוסף, MBL נקשר לתאים אפופטוטיים, ודרך הקצה דמוי הקולאגן שלו נקשר לפגוציטים, ואלה מרחיקים תאים אפופטוטיים. הגברה משמעותית ברמות MBL בנסיוב נמצאו בנבדקים עם כשל כרוני של הכליות (Garred וחב' ב-J Infect Dis משנת 2003), ורמות נמוכות של MBL כרוכות בזיהומים מוגברים, בספסיס ובמוות (Turner ב-Mol Immunol משנת 2003, ו-Ip וחב' ב-Arthritis Rheum ב-1998). ל-MBL מיוחס גם תפקיד מודולטורי במחלה אוטו-אימונית, כאשר אללים וריאנטיים במספר קבוצות אתניות מובילים לרמות מופחתות של MBL ול-SLE (Sullivan וחב' ב-Arthritis Rheum משנת 1996, ו-Garred וחב' ב-Genes Immun משנת 2001), כאשר חסר של MBL עלול להחמיר מחלות כמו rheumatoid arthritis ו-SLE (Mok וחב' ב-Lupus משנת 2004, ו-Jacobsen וחב' ב-J Rheumatol משנת 2001, Graudal וחב' ב-Arthritis Rheum משנת 2000, ו-Saevarsdottir וחב' ב-J Rheumatol משנת 2001). במטופלים עם rheumatoid arthritis, נמצא שחסר MBL גרם לפרוגנוזה גרועה בהקשר של הופעת תסמיני המחלה בגיל מוקדם, רמות מוגברות של rheumatic factor, שחיקה משמעותית של המפרקים, ותגובה מעטה לתרפיה. חסר ב-MBL הוא גם גורם סיכון חזק ל-SLE, רמות נמוכות או תפקוד לקוי של MBL יכולים לנבוע מפולימורפיזמים של הגן, מניצול חלבון זה במהלך מחלה, או בנטרולו על ידי נוגדנים עצמיים כנגד MBL שמוצאים ב-8-24% מחולי SLE (Seelen וחב' ב-Clin Exp Immunol משנת 2003). לא נמצא כל קשר בין טיטר גבוה של נוגדנים עצמיים כנגד MBL ומהלך המחלה, או עם התבטאות קלינית ספציפית.
הגנטיקה של MBL
בשנת 1989 התגלו הגן המקודד ל-MBL ואת החלבון עצמו על ידי Taylor ו-Sastry (Taylor וחב' ב-Biochem J משנת 1989, ו-Sastry וחב' ב-J Exp Med מאותה שנה). הגן באדם MBL2 שובט, רוצף ומוקם על כרומוזום 10 בעמדה 10q11.1-q21.1. נמצא שהאזור על פני גן זה המקודד ל-MBL, מכיל ארבעה אקסונים המופרדים על ידי שלושה introns, באורך של bp600, 1,350bp ו-800bp, בהתאמה. אקסון 1 מקודד ל-signal peptide, למקטע העשיר בציסטאין, ול-7 עותקים של motif החוזר על עצמו של glycine-X-Y החיוני ליצירת הסליל השלישוני של מבני הקולאגן. דפוס זה נמשך על ידי 12 עותקים חוזרים של glycine-X-Y באקסון 2. אקסון 3 מקודד את האזור הצר (neck region) ואילו אקסון 4 מקודד את האזור הנקשר לפחמימות. החלבון הנוצר מורכב מאוליגומרים שכל אחד מהם מורכב מכיל שלושה פוליפפטידים זהים, של 32 קילו-דלטון הכבד מסנתז את החלבון כמבנים המורכבים מ-3–6 אוליגומרים (Garred וחב' ב-Mol Immunol משנת 2003).
התפקיד של MBL בשפעול של משלים בפציעה רקמתית על ידי איסכמיה וזילוח מחדש
מחקרים רבים הראו שלמערכת המשלים תפקיד מרכזי בפציעת הרקמה באדם ובחיות. אכן, במהלך איסכמיה והזילוח מחדש (reperfusion) שמתלווה אליה, יש למסלול הלקטין תפקיד מסוים. מולקולות IgM טבעיות הספציפיות לאנטיגנים עצמיים, יכולות להיקשר לאנטיגנים הנחשפים על ידי האיסכמיה. האינטראקציה עם האנטיגנים מאתחל את המסלול הקלאסי של C1 ושל מרכיבי המשלים C3, C2 ו-C4. האינטראקציה בין IgM לבין האנטיגנים האיסכמיים מובילה לחשיפת אנטיגנים אלה להתקשרות MBL, דרך הפחמימות על פני IgM, מה שמשפעל את ה-MASPs, המבקעים את המצע הרלוונטי ומשפעלים על ידי כך את מסלול הלקטין. MASP-2 המשופעל, מבקע באופן מאוד יעיל את מרכיבי המשלים C4 ו-C2 ליצירת הפרגמנטים C4b ו-C4a, כמו גם C2b ו-C2a בהתאמה, כאשר C4b ו-C2b חוברים יחד ליצירת C3 convertase (Matsushita וחב' ב-J Immunol משנת 2000). MASP-1 מבקע את הקומפלקס C2-C4b אך לא את C4 (Ambruse וחב' ב-J Immunol משנת 2003).
לכן דרך השפעול של מסלול הלקטין לא מסתייעת בחסר של MASP-2. נראה ש-MASP-1 יכול להגדיל את הפעילות התפקודית על ידי ביקוע C2 ואולי הגברת השפעול של המשלים על ידי המרה של MASP-2 לצורה פעילה אנזימטית, אך היא אינה יכולה לפצות על אובדן הפעילות התפקודית של MASP-2 (Farrar וחב' ב-Frontiers Immunol משנת 2012, ו-Zhang וחב' ב-J Immunol משנת 2006). הדרך לשפעול המשלים הוצעה כחיונית בפּתו-פיזיולוגיה של התקפי-לב (Jordan וחב' ב-Circulation משנת 2001) או של איסכמיה של מערכת העיכול (Hart וחב' ב-J Immunol משנת 2005), או איסכמיה וזילוח חדש של הכליות (De Vries וחב' ב-J Pathol משנת 2004). מחקר עדכני מראה את היתרונות של הזרקת מעכב של C1 במודל עכברים של איסכמיה וזילוח מחדש של המוח, ומרמז ש-MLB קשור להשפעה זו (Gesuete וחב' ב-Annals Neurol משנת 2009).
משמעות קלינית של MBL
MBL והרגישות לזיהומים: MBL מזהה ונקשר לשיירים סוכריים על פני שטח הפנים של חיידקים, נגיפים, פטריות וטפילים. ההתקשרות של MBL גורמת למיקרואוגניזמים אלה לעבור צימות (agglutination) ולאפשר פינוי פגוציטי של הפתוגנים, כמו גם שפעול מסלול של לקטין-משלים ופעילות של פרוטאזות הכרוכות עם MBL (Lau וחב' ב-Clin Exp Immunol משנת 1995). הצטברו ראיות התומכות בתפקיד קריטי של MBL בתגובה של החסינות הטבעית, מספר מחקרים התמקדו בקשר בין הביטוי של MBL וריכוזיו בנוזלי-גוף והמצג הקליני. בדומה לחלבוני acute phase במצבי דלקת, רמות MBL בגוף מוגברות בתגובה לזיהומים. במבוגרים בריאים רמות MBL הן בדרך כלל מעל 1,000 ננוגרם/מ"ל, כאשר רמות אלו אינן תלויות בגיל, במחזור צירקדיאני, או בפעילות גופנית. במהלך דלקת, רמות MBL גדלות פי 3–4 בהשוואה לרמות הבסיס (Dean וחב' ב-J Clin Immunol משנת 2005).
חסר של MBL במבוגרים הוגדר כערכי MBL בפלזמה הנמוכים יותר מערך של 500 ננוגרם/מ"ל, (Eisen וחב' ב-Clin Infect Dis משנת 2008). רמות MBL גדלות תחת עקה לרמתן התקינה, באלה עם רמות חסר של MBL. בדרך כלל תגובת acute phase חיובית נמצאה בפרטים עם גנים (wild type) של MBL2. מבוגרים עם חסר של MBL מאופיינים על ידי משמעות קלינית שאינה ברורה (Eisen וחב' ב-FEMS Immunol Med Microbiol משנת 2006, ו-De Psacale וחב' ב-Mediators of Inflamm משנת 2013). יתרה מכך, הסיכון לפיתוח זיהומים בגין רמות נמוכות של MBL נראה מודגש במיוחד אם הוא מתרחש עם מצבים כגון cystic fibrosis (Gravina וחב' ב-J Cystic Fibrosis משנת 2015, ו-Garred וחב' ב-J Clin Invest משנת 1999), או לאחר כימותרפיה (Neth וחב' ב-Lancet משנת 2001, Peterslund וחב' באותו כתב עת ובאותה שנה, ו-Chalmers וחב' ב-Glycobiol משנת 2011), או לאחר השתלת איבר (Moreto וחב' ב-BMC Immunol משנת 2014, Wan וחב' ב-Transplant Proc משנת 2013, Stevenson וחב' ב-Transplant Immunol משנת 2013, Damman וחב' ב-Kidney Int משנת 2013, ו-Budd וחב' ב-Respir Res משנת 2012).
אף על פי כן, ולמרות הממצאים המוזכרים למעלה המרמזים להשפעה מגינה של MBL, נראה שעודף שפעול של MBL עלול להזיק, כתוצאה מחוסר איזון של תגובה מעודדת דלקת שמובילה ליתר נזק רקמתי. רמה גבוהה של MBL, נכרכה עם תחלואה דלקתית אוטו-אימונית, כמו SLE (Pradhan וחב' ב-J Assoc Physicians India משנת 2010). יתרה מכך, ריכוזים מוגברים של MBL בנסיוב נכרכו בתרחישים נוספים כולל דחיית שתל (Eurich וחב' ב-Transplant Infect Dis משנת 2012, Carroll וחב' ב-Transplantion משנת 2011, Fildes וחב' ב-J Heart & Lung Transplant משנת 2008, ו-Fiane וחב' ב-Eur Heart J משנת 2005), נפרופתיה סוכרתית (Zhao ו-Hu ב-J Clin Lab Anal משנת 2016, Guan וחב' ב-PLos One משנת 2015, Zhang וחב' ב-PLos One משנת 2013, ו-Saraheimo וחב' ב-Diabetologia משנת 2005), דלקות מוגברות של mycobacteria (wierzkoŚ וחב' ב-Int J Med Microbiol משנת 2016, Singla וחב' ב-Int J Immunogenet משנת 2012, ו-Søborg וחב' ב-J Infect Dis משנת 2003), Leishmania (Mishra וחב' ב-Parasitol Int משנת 2015, De Araujo וחב' ב-Genes Immunity משנת 2015, Alonso וחב' ב-J Infect Dis משנת 2007, ו-De Miranda Santos ב-Infect Immunity משנת 2001), ו-שחמת מרתית ראשונית (Matsushita וחב' ב- Autoimmunity J משנת 2001, ו-Bouwman וחב' ב-Hum Immunol משנת 2006).
באשר לאוכלוסיות מבוגרות, רמות נמוכות של MBL מייצגות גורם סיכון להתפתחות זיהומים ביילודים (Fidler וחב' ב-Intensive Care Med משנת 2004 ו- Gordon וחב' ב-Shock משנת 2006), ואילו רמות נמוכות במיוחד של MBL נמצאו בפגים (Dzwonek וחב' ב-Pediatr Res משנת 2008). רמות נמוכות של MBL בדם הטבורי נמצאו במתאם עם ספסיס עם חיידקים גראם-שליליים. רמות נמוכות של MBL בנסיוב באשפוז ביחידות טיפול נמרץ נאונטליות, כרוכות בסיכון מוגבר של ספסיס נוזוקומיאלי, ללא קשר לגיל היילוד, ונראה שמדידת MBL יכולה להיות מדד של יילודים בסיכון לזיהום (Wahab ו-Saeed ב-J Material Fetal Neonat Med משנת 2012, ו-Swierzko וחב' ב-Hum Immunol משנת 2009). מחקר פרוספקטיבי-תצפיתי שכלל 365 יילודים במצב קריטי, מצא שהרמה הממוצעת של MBL בנסיוב של ילודים עם זיהום הייתה נמוכה משמעותית מזו של יילודים לא מזוהמים. עם זאת, רמות MBL בהגעה ליחידת טיפול נמרץ יילודים, ואף רמות השיא של MBL במהלך הזיהום לא היו כרוכות עם תמותה. נטייה למוגברות של תסמינים נשימתיים חמורים ביילודים עם ערכים נמוכים של MBL נמצאה על ידי Schlapbach וחב' ב-Pediatr Allergy Immunol משנת 2009, אם כי קשר זה היה נמוך מהצפוי. מחקרים אחרים מצאו שיילודים עם חסר ב-MASP-2 היו צעירים יותר בלידתם ובמשקל לידה נמוך יותר. יתרה מכך, נטייה לערכי MASP-2 גבוהים יותר נמצאה ביילודים עם זיהום (Swierzko ב-Mol Immunol משנת 2009). נמצא שרק 13.8% מהפגים שנולדו טרם-עת והגיעו ליחידת טיפול נמרץ, הכילו הפּלוֹטיפ החסר גנטית של MBL2, ואילו 43.1% של פגים אלה היו ברמות חסר של MBL (פחות מ-700 ננוגרם/מ"ל בהגעתם ליחידה). אי ההַתְאָמָה בין הגנוטיפים של MBL ורמת חלבון זה בנסיוב של יילודים, תומכת בתפקיד של אי הבשלות של הפגים-ילודים בגרימת רמה נמוכה של MBL בתינוקות אלה (Oudshoorn וחב' ב-Hum Immunol משנת 2008).
MLB נוצר בכבד בתגובה לזיהום, ובכך ניתן להגדירו כ-acute phase protein (Herpers וחב' ב-Clin Exp Immunol משנת 2009), השייך למשפחת ה-collectin. הוצע ביטוי ותפקוד של MLB באיברים אחרים גם כן ( Worhtley וחב' ב-World J Gastroenterol משנת 2006). שלושת הפולימורפיזמים המבניים של ה-exon 1 דווחו כגורמים לרגישות לזיהומים שכיחים, כולל מחלה מנינגו-קוקאלית (Hibberd וחב' ב-Lancet משנת 1999, ו-Faber וחב' ב- Pediatr Infect Dis J Pediatr Infect Dis J משנת 2007). עם זאת, יש ראיות לכך שווריאנטים אלה הם בעלי השפעות מזיקות בהקשר של מחלה מנינגו-קוקאלית (Bradley וחב' ב-Int J Immunogenet משנת 2012).
MBL ותוצאים נוירולוגיים שליליים ביילודים טרם-עת
במודל של נזק מוחי טראומטי בעכברים, מצאו Yager וחב' (Cerebral Blood Flow Metab J משנת 2008) שחסר של MBL מחמיר מצב של מות תאים (Cornu Ammonis) ופגיעה בתפקוד קוגניטיבי ללא תלות בשפעול המשלים. ממצא זה מרמז לתפקיד הגנתי של MBL במערכת העצבים, וקשר תפקודי בין החסינות הטבעית ותוצאים נוירולוגיים לאחר נזק מוחי טראומטי. Yager וחב' חקרו את הגנוטיפ של MBL2 בעכברים ובמבוגרים מעל גיל 70 שנה שחוו שבץ מוחי. Cervera וחב' אישרו ב-PLos One משנת 2010 במודל עכברים של חסימת העורק המוחי האמצעי את ההשפעות המגינות של חסר גנטי של MBL, לאחר שבץ מוחי חריף, אך לא ניכר שיפור בנפח האוטם או בתפקודים נוירולוגיים 7 ימים מהשריית החסימה. תוצאה אחרונה זו עומדת בסתירה עם מחקרים אחרים. לא ברור אם כך האם ל-MBL יש תפקיד המגן או פוגע בפתו-פיזיולוגיה של הנזק המוחי כתוצאה מאיסכמיה וזילוח מחדש. לפי Zanetta ב-Prog Mol Subcell Biol משנת 2003 ניתן לייחס ל-MBL השפעה מגינה בהתפתחות המוח. גליקופרוטאינים עשירים ב-mannose מצטברים באופן בולט בשבועות השני והשלישי לאחר הלידה, בהשוואה לחד-סוכרים אחרים ולכן הם נהרסים. גליקופרוטאינים אלה מרוכזים על פני האקסונים. ביילודים טרם-עת, MBL עשוי לסייע בנדידה העצבית המודרכת על ידי מגע, וכן בהכרה הבין-עצבית, ביצירת גשרים בין נוירונים נודדים וסיבים של אסטרוציטים רדיאליים, במייאלינציה, בחיזוק המחסום של תאים אפנדימאליים, במהלך ההתפתחות האונטוגנית של המוח.
MBL ו-necrotizing enterocolitis (NEC)
באשר לאוכלוסיות מבוגרות, לא רק חסר של MBL אלא גם יצירת-יתר של חלבון זה היא בעלת פוטנציאל של גרימת נזק. נערכת החיסון של הפונדקאי תלויה בשימור האיזון המתאים בין תהליכים תומכי-דלקת לבין אפופטוזיס. אי-בשלות של המסלולים הדלקתיים יכול להגביר את הרגישות לשפעול האפופטוזיס ולפגוע באותו איזון ולהגברת הנזק הרקמתי האפופטוטי בעת הזיהום הבקטריאלי. ההתחלה של תגובה דלקתית מוגזמת ובלתי מבוקרת על ידי המעיים של היילודים, מאתחלת את תחילת תהליך ה-NEC. למרות שרוב ה-MBL מסונתז בכבד, אך גם ברקמות מחוץ לכבד נרשמו רמות נמוכות של mRNA של MBL-2, עיקר במעי הדק. בשנת 2012 דווחו Prencipe וחב' על גילוי MBL במעיים החולים של פגים הלוקים ב-NEC: MBL מבוטא בחוזקה בתאים אנטרוציטים, בתאי אנדותל ובהיסטיוציטים במעי הדק, ובמעי הגס של יילודים עם NEC.
MBL ואוטו-אימוניות
בנוסף להתקשרות של MBL לשיירים סוכריים על פני פתוגנים פולשנים, מה שמקנה למולקולה זו שפעול המשלים במסלול הלקטיני, נקשר MBL גם כן לתאים אפופטוטיים, ודרך קולטנים ספציפיים במקטע הקולאגני של MBL, יכול האחרון להיקשר גם לפגוציטים הבולעים את התאים האפופטוטיים (Tsutsumi וחב' ב-Autoimmun Rev משנת 2005). עליות משמעותיות ברמות MBL בנסיוב, דווחו באלה הסובלים מאי-ספיקת כליות כרונית (Garred וחב' ב-J Infect Dis משנת 2003), וחסר של MBL נכרך עם סיכון גבוה של זיהום, ספסיס ומוות (Ip וחב' ב-Arthritis Rheum משנת 1998). ההשערה היא שיש ל-MLB תפקיד מודולטורי במחלות אוטו-אימוניות: אמנם, אללים וריאנטים שגורמים לרמה מופחתת של MBL במספר קבוצות אתניות מגבירות את התחלואה ב-SLE (על פי Sullivan וחב' ב-Arthritis Rheum משנת 1996, ו-Garred וחב' ב-Genes Immun משנת 2001). דיווחים אחדים מראים שחסר MBL עלול להחמיר מחלות כ-RA ו-SLE (על פי Saevarsdottir וחב' ב-J Rheumatol משנת 2001, Jacobsen וחב' באותו כתב מאותה שנה, Graudal וחב' ב-Arthritis Rheum משנת 2000, ו-Mok וחב' ב-Lupus משנת 2004). בחולים עם RA, חסר MBL נכרך עם פרוגנוזה גרועה בהקשר של תחילת תסמינים בגיל צעיר, רמות גבוהות של המדד RF, שחיקה משמעותית של המפרקים ותגובה גרועה לתרופות.
רמות נמוכות או תפקוד לקוי של MBL יכולים לנבוע מפולימורפיזם של הגן, מניצול חלבון זה במהלך מחלה, או על ידי נטרולו עם נוגדנים עצמיים, כאשר נוגדנים אלה נמצאים ב-8-24% של החולים עם SLE (על פי Seelen וחב' ב-Clin Exp Immunol משנת 2003, ו-Pepys ו-Hirschfeld ב-J Clin Invest משנת 2003). לא נמצא כל מתאם משמעותי בין רמות גבוהות של נוגדנים עצמיים כנגד MBL לבין פעילות מחלה או התבטאויות קליניות ספציפיות. נמצא שנוגדנים עצמיים כנגד MBL נמצאים ב-15% של חולי SLE בשלב שקט של המחלה (Szyper-Kravitz ו-Shoefeld, תוצאות לא מפורסמות). בניגוד לתוצאות קודמות נמצא מתאם חיובי בין טיטר גבוה של נוגדנים עצמיים כנגד MBL, וטיטר גבוה של נוגדנים עצמיים כנגד nuclear factor וכן נוגדנים עצמיים כנגד DNA דו-גדילי, אך מתאם שלילי בין רמות C4 לבין טיטר הנוגדנים העצמיים כנגד MBL.
חסר MBL כרוך במחלת קרוהן מסתבכת באנשים, ובקוליטיס כיבית חמורה יותר בעכברים
מחקרים אחדים הציעו שמסלול MBL יכול להיות כרוך בהתפתחות של מחלות אוטו-אימוניות של המעיים כגון קרוהן וקוליטיס כיבית (Bowmann וחב' ב-Hum Immunol משנת 2006, ו-Boniotto וחב' ב-J Mol Med משנת 2005). למרות שנמצא קשר בין חסר MBL לנוכחות נוגדנים כנגד Sacchromyces cerevisiae במחלת קרוהן, התפקיד של MBL בפתוגנזה של מחלה זו אינו ברור. מתאם אפשרי עם פנוטיפים של המחלה, כמו גם התוצאות של חסר MBL עם קוליטיס המושרה בעכברים אינו ברור. Seibold וחב' מאוניברסיטת ברן, מדדו רמות MBL בשיטת ELISA ב-164 חולי קרוהן, ב-32 מאובחנים עם קולטיס כיבית, וב-51 נבדקים בריאים כקבוצת ביקורת. חולי קרוהן הוגדרו על פי סולם Montreal. חסר MBL נקבע כרמת החלבון שמתחת ל-100 ננוגרם/מ"ל, רמה נמוכה של החלבון נקבעה בריכוזים שבין 100–500 ננוגרם/מ"ל, וריכוז נורמלי-עד-גבוה נקבע ברמות מעל 500 ננוגרם/מ"ל. כמו כן נמדד MBL בדגימות שנאספו במהלך אנדוסקופיה ומדגימות המעי הדק ברקמה בעובי מלא. נעשה שימוש בהזרקת החומר משלשל dioctyl sulfosuccinate (או DSS) להשריית קוליטיס ניסויי בעכברים. עכברים (wild type) וכן עכברים החסרים MBL, חוסנו עם שמרים כדי להעריך הופעת ASCA או anti-Saccharomyces cerevisiae antibodies שהם נוגדנים שמוצאים בדרך כלל במחלות דלקתיות של המעיים.
תוצאות מחקר זה היו כדלקמן: רמות נמוכות של MBL היו במתאם חיובי עם מחלת קרוהן מסובכת (p<0.001), אך היו במתאם שלילי עם מחלה דלקתית טהורה (p<0.0001). החלבון MBL כמו גם ה-m-RNA של חלבון זה, בקושי התגלו ורמותיהם היו נמוכות מאוד גם בדגימות שנלקחו מרקמות המעי. ASCA ניסויי היה בעל תקופת מחצית-חיים ממושכת בעכברים מחוסרי-MBL בהשוואה לעכברים עם רמות MBL תקינות. יתרה מכך, בעכברים חסרי-MBL, התפתחה קוליטיס חמורה יותר לאחר הזרקת DSS, בעיקר כאשר עכברים אלה אותגרו סימולטנית עם זן פולשני ונקשר לרקמת המעי של E.coli, זן שבודד מה-ileum של חולה עם מחלת קרוהן. מסקנת מחקר זה היא ש-MBL בנסיוב, אך לא MBL שנוצר באופן מקומי במעיים, משחק תפקיד בפנוטיפ של מחלת קרוהן. רמות שמורות של טיטר ASCA בעכברים חסרי MBL, ביחד עם רגישות מוגברת לקוליטיס המושרית על ידי DSS והמוגברת על ידי הפתוגן, מצביעות על כך שנוכחות מתמשכת של פתוגנים פולשנים במעיים, בהיעדר MBL, יכולים לשחק תפקיד בתרחישי דלקת במעי.
עם זאת התפקיד של MBL במחלות מעי דלקתיות שנוי במחלוקת. Rector וחב' דיווחו על ירידה משמעותית בתדירות של וריאנטים של MBL בחולי קוליטיס כיבית ב-Genes Immun משנת 2001. לעומתם, Sivaram וחב' דיווחו ב-Innate Immun משנת 2010, על כך שיש עלייה משמעותית בתדירות של מוטציות בקודון 54 בחולים עם קוליטיס כיבית בהשוואה לאנשים בריאים, שהייתה מלווה על ידי רמות נמוכות של MBL. במחקרים אחרים, התדירות של הפולימורפיזם של MBL, חסר של MBL והרמות הממוצעות של MBL בחולי קרוהן או באלה עם קוליטיס כיבית, אינם שונים משמעותית בהשוואה לאנשים בריאים (Wang וחב' ב-J Clin Biochem Nutr משנת 2008, ו-Papo וחב' ב-Hum Immunol משנת 2010).
Kovacs וחב' דיווחו ב-Crohn's & J Colitis משנת 2013, על כך שרמות נמוכות של MBL כרוכות במחלות מעי דלקתיות בילדים, ובחולי קרוהן עם מעורבות של ה-ileum. במחקרם הפרוספקטיבי השתתפו 159 ילדים-נערים בגיל ממוצע של 14 שנה עם IBD (מתוכם 107 חולי קרוהן ו-52 מאובחנים עם UC, בנוסף ל-95 ילדים תואמי-גיל בריאים. רמות MBL בנסיוב נמדדו, בנוסף לסמנים סרולוגיים דוגמת ASCA והמרכיבים הסב-נוקלאריים של נויטרופילים (pANCA). . תוצאות המחקר היו כדלקמן: רמת MBL בנסיוב הייתה משמעותית נמוכה יותר בילדים עם IBD בהשוואה לבריאים (p=0.007). השכיחות של רמות נמוכות של MBL (מתחת ל-500 ננוגרם/מ"ל), הייתה משמעותית גבוהה יותר באלה עם IBD בהשוואה לנבדקי ביקורת (p=0.004). יתרה מכך, רמה נמוכה של MBL נכרכה עם מעורבות של ה-ileum (p=0.01), וחסר של MBL (פחות מ-100 ננוגרם/מ"ל) נכרכה במגדר הזכרי באלה עם מחלת קרוהן (p=0.004).
למרות ש-MBL מיוצר בעיקר בכבד, Seyfarth וחב' ב-Mol Immunol משנת 2006 גילו ביטוי של הגן MBL2 במעיים, על ידי שימוש בספריה מסחרית של cDNA. לעומת זאת, מחקר עדכני יותר לא הצליח למצוא ביטוי של הגן MBL2 ברקמת המעי (Muller וחב' ב-Gut משנת 2010).
רמות מוגברות משמעותית של MBL במחלת לב ריאומטית
מחקרים הדגימו ש-MBL יכול להיקשר לתאי אנדותל ולגרום לעודף של שפעול המשלים ולנזק רקמתי (Jordan וחב' ב-Circulation משנת 2003). לעומת זאת, חסר של MNL עשוי להיות בעל יתרון במספר מצבים, בכך שהוא מעודד הפרשה של ציטוקינים על ידי מקרופאגים (Takahashi וחב' ב-Microbes Infect משנת 2002). במחקר של Schafranski וחב' ב-Clin Exp Immunol משנת 2004, נמדדו רמות MBL במאובחנים עם מחלה ריאומטית של הלב (להלן RHD). במחקר השתתפו 100 חולים (77 נשים, 23 גברים) בגיל ממוצע של 45.8 שנים, עם RHD כרונית ואבחון מוקדם של rheumatoic fever (להלן RF). כמו כן נכללו במחקר 99 אנשים בריאים תואמי-גיל ומגדר.
תוצאות מחקר זה היו כדלקמן: רמות MBL היו משמעותית גבוהות יותר בחולים עם RHD מאשר בקבוצת הביקורת: בממוצע 298.9±3036.2 ננוגרם/מ"ל, לעומת 185.5±1942.6 ננוגרם/מ"ל, בהתאמה (0.003p<). בנוסף, חסר MBL היה שכיח יותר בקבוצת הביקורת מאשר בין אלה עם מחלת לב ריאומטית (17.1% לעומת 9.0%, בהתאמה, 0.09p<). לא נמצא כל מתאם בין רמות MBL בנסיוב לבין שטח המסתם הלבבי, או בין סוג הפרוצדורה הכירורגית. הרמות המוגברות משמעותית של MBL בחולים עם RHD, ביחד עם השכיחות הגבוהה יותר של חסר MBL באנשים בריאים, מצביעות על כך ש-MBL עלול לגרום לשפעול בלתי רצוי של המשלים מה שעלול לתרום לפתו-גנזה של RHD.
הוראות לביצוע הבדיקה
אין צורך בצום או בהכנות מיוחדות. את הדם יש ליטול במבחנה כימית (פקק צהוב או אדום) או מבחנת ג'ל. לאחר סרכוז יש להקפיא את הנסיוב המוקפא שהיא צורת האחסון המועדפת והיציבה למשך שנה. אין לקבל דגימות פלזמה. כאשר הנסיוב נשמר בקירור הדגימה יציבה למשך 14 יום, כאשר בטמפרטורת החדר יציבות הדגימה נשמרת למשך 48 שעות. סיבות לפסילת הדגימה: המוליזה או ליפמיה בולטות (כאשר ניתן לקבל דגימות נסיוב המוליטיות או ליפמיות באופן מתון). אין לקבל דגימות פלזמה שנלקחו במבחנות ספירת-דם (EDTA, פקק סגלגל) או במבחנת ציטראט (פקק תכול). אין לקבל דגימות שעברו למעלה מ-3 מחזרים של הקפאה והפשרה. הבדיקה מתבצעת באופן כמותי בשיטת ELISA.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - מחלות אוטו-אימוניות
- בדיקות מעבדה - מחלות ריאומטיות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)
.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק