אדיפונקטין - Adiponectin
| מדריך בדיקות מעבדה | |
| אדיפונקטין | |
|---|---|
| Adiponectin | |
| מעבדה | אנדוקרינולוגיה בדם |
| תחום | הערכת תסמונת מטבולית, ומצבי השמנת-יתר, עמידות לאינסולין, סוכרת type 2, ומחלות וסקולאריות הקשורות להשמנה. |
| טווח ערכים תקין | 5-10 מיקרוגרם למ"ל, כאשר בנשים ריכוז אדיפונקטין בדם גבוה מזה שבגברים. |
| יוצר הערך | פרופ' בן עמי סלע |
בסיס פיזיולוגי
היבטים מבניים של אדיפונקטין
אדיפונקטין (להלן ADN) הוא הורמון חלבוני המכיל 244 חומצות אמינו, המקודד על ידי הגן ADIPOQ המופרש באופן בלעדי על ידי תאי שומן (אדיפוציטים), ותפקידיו העיקריים הם בוויסות רמות הסוכר בדם בהגבירו את רגישות תאי הגוף לפעילות אינסולין, וכן בתהליך החמצון של חומצות שומן. במבנה של החלבון ADN מבחינים ב-4 קטעים מוגדרים: הראשון הוא רצף אמינו-טרמינאלי קצר המכוון את ההורמון להפרשה אל מחוץ לתא השומן (signal sequence); הקטע הבא (variable region) אף הוא קצר ובו באים לביטוי השינויים הבולטים ברצף חומצות האמינו בין המינים השונים; הקטע השלישי מורכב מ-65 חומצות אמינו עם דמיון לחלבונים קולאגניים; הקטע הרביעי הקרבוקסי-טרמינאלי הוא חלבון גלובולארי, בעל דמיון בולט במבנהו התלת-ממדי ל-TNF-α, מה שמרמז לקשר אבולוציוני בין משפחת TNF-α ו-ADN. על בסיס רצף חומצות האמינו שלו, וכן על בסיס מבנה ארבעת קטעיו, ADN דומה במיוחד ל-C1q, חבר משפחת החלבונים הקשורה למשלים.
גילוי הגן ל-ADN והבקרה על ביטויו
ADN זוהה לראשונה כחלבון המופרש מאדיפוציטים תוך שימוש בתרביות תאי עכבר מסוג 3T3-L1. המקביל האנושי של ADN תואר לראשונה כתעתיק הנפוץ ביותר המופרש מרקמת השומן ונקרא APM1. התיאור הראשון של cDNA המקודד ל-ADN ניתן בשנת 1995 על ידי Scherer. לאחר הסינתזה שלו, עובר ADN סדרה של שינויים כגון הידרוקסילציה וגליקוזילציה, מה שמביא ליצירת 8 איזופורמים של החלבון, כאשר שישה מתוכם מכילים שייר סוכרי: בחמישה מתוך הקשרים ה-O גליקוזידים, השרשרת הסוכרית היא דרך שיירי ליזין בעמדות 68, 71, 80 ו-104, ושייר פרולין בעמדה 94, כולם במקטע הקולאגני של ADN.
בנוסף, יש ראיות לכך ששרשרות הסוכרים מכילות באופן ספציפי לאדיפוציטים שיירים המכילים 2 שיירים של חומצה סיאלית בכל שרשרת, תופעה ייחודית בגליקופרוטאינים. באנליזה של המולקולה השלימה של ADN עם מטען מלא של שרשרות סוכריות, נמצא שזו יותר פעילה באופן משמעותי בהגברת הרגישות לאינסולין מאשר מולקולות ADN ריקומביננטיות ממקור חיידקי, שאינן מכילות כלל את מטען השרשרות הסוכריות. נראה אם כן, שהמודיפיקציה ה-post-translational של ADN, חיונית לפעילות האופטימאלית של חלבון זה. יש הומולוגיה משמעותית בין ADN לקולאגנים III, I ו-X (שנמצאים בשכבת האינטימה בדופן כלי-דם), ובאדם הגן ל-ADN מורכב מ-3 axons ו-2 introns.
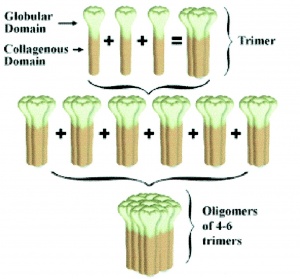
מונומרים של ADN בפלזמה נוטים להתגבב לצברים של מבנים מורכבים יותר, כאשר בשלב הראשון נוצר homo-trimer שהוא המבנה הבסיסי, המתקבל על ידי התחברות של 3 מונומרים (משקל מולקולארי 30,000 דלטון) באזור המקטע הגלובולארי שלהם. מונומרים של ADN מוצאים רק בתוך האדיפוציטים אך לא בפלזמה. נמצא שהמקטע (domain) הקולאגני של ADN חיוני ליצירת הצברים הגבה-מולקולאריים של 6-12 מונומרים של ADN, אך אינו חיוני ליצירת המבנים הטרימריים. כמו ריכוזי ADN בפלזמה, הריכוזים היחסיים של צברים גבה-מולקולריים מראים דימורפיות מגדרית, כאשר בנשים מוצאים צברי ADN גבוהים יותר מאשר בגברים.
נמצא שהצברים הגבה-מולקולאריים של ADN, הם בעלי פעילות ביולוגית מוגברת בכל הקשור להומאוסטאזיס של גלוקוזה. כן נמצא שהצברים הגבה-מולקולאריים כרוכים בהפחתת הסיכון לסוכרת בדומה לסך רמת ADN בפלזמה; לעומת זאת, דווקא מחלת לב כלילית (CAD) נמצאת במתאם חיובי עם רמת ADN גבה-מולקולארי, אך לא עם רמת ADN קטן-מולקואלרי. סבורים שהשפעת ADN בהורדת משקל, מושגת דרך המוח, בדומה להשפעת לפטין.
קולטנים של ADN
ההורמון ADN נקשר לשלושה סוגי קולטנים, כאשר שניים מהם (ADIPOR1 ו-ADIPOR2) הומולוגים לקולטנים מצומדים ל-G protein, ואילו השלישי (CDH13) דומה לקולטני משפחת T-cadherin. קולטנים אלה מראים פיזור רקמתי מוגדר בגוף, והם מראים זיקות שונות לסוגי ADN שונים. קולטנים אלה משפיעים על אנזים המטרה AMP kinase, אנזים ציטופלזמי מרכזי בבקרת הקצב המטבולי של תאים. ביטוי קולטני ADN נמצא במתאם עם רמות אינסולין, ובמודלים בעכברים נמצא ביטוי קולטנים מופחת בסוכרת, בעיקר בשרירי השלד וברקמת השומן. הקולטנים ל-ADN מבוטאים בתאי גזע המטופוייטיים וכן על ידי אדיפוציטים המופיעים במח העצם.
פעילויות פיזיולוגיות של אדיפונקטין
מחקרים עדכניים מצביעים על כך שרקמת שומן אינה כלל ועיקר רקמה אינרטית, אלא רקמה אנדוקרינית המשחקת תפקיד מרכזי בהעברת איתותים אנדוקריניים, מטבוליים ודלקתיים לבקרה על מאזן האנרגיה בגוף. האדיפוציט מפריש מגוון של חלבונים פעילים למחזור הדם, שכונו באופן קולקטיבי אדיפו-ציטוקינים הכוללים לפטין, TNF-α, רזיסטין, adipsin, וכן PAI-1 או plasminogen-activator inhibitor type 1 ו-ADN. אדיפונקטין הוא חלבון דמוי-קולאגן, הנוצר בלעדית ברקמת השמן הלבנה בעת התמיינות אדיפוציטים. במרוצת השנים כונה ADN בשמות שונים כגון AdipoQ ו-Acrp30 או adipocyte component-related protein of 30 kD כאשר ה-ADN בודד מעכברים, וכן GBP28 או gelatine binding protein of 28 kD כאשר ADN בודד מבני-אדם.
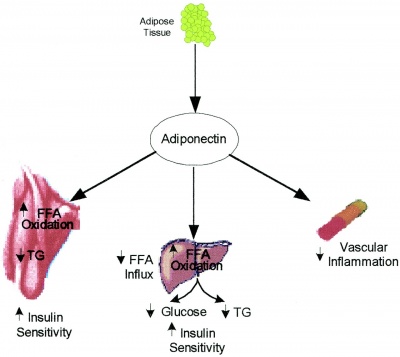
חלבון זה הוא בעל פעילות מטבולית ונוגדת דלקת המגנה מפני התפתחות של סוכרת, ומשפר את חילוף החומרים של הליפידים. רמותיו של ADN בנסיוב נמוכות מהתקין במצבים של תנגודת לאינסולין, השמנה בטנית, סוכרת ומחלת לב כלילית.
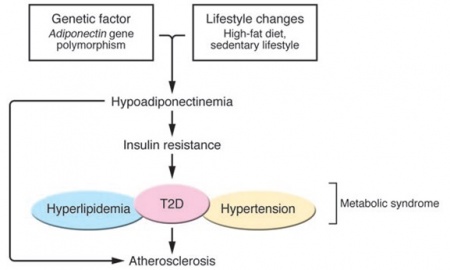
ביטויו הגנטי של ADN מופחת במצבים של עלייה במשקל ועלייה ברמות TNF-α, ומוגבר במצבים של ירידה במשקל. מחקרים מראים שהסיכון לסוכרת עולה ככל שרמת AND פוחתת, וזאת לאחר תיקון לגיל, מין, למוצא האתני, סיפור משפחתי של סוכרת, יתר לחץ דם, BMI, יחס מותן-ירך, רמות גלוקוזה בצום, רמת אינסולין ו-6 סמנים דלקתיים.
ADN מופרש באופן בלעדי מרקמת השומן הלבנה, אם כי גם מהשליה בעת הריון, וריכוזו בדם גבוה במיוחד בהשוואה להורמונים רבים. בבקרה על ביטויו משתתפים מספר הורמונים וגורמים סביבתיים. מחקרים הראו כי הביטוי הגנטי של אדיפונקטין מופחת ברקמת שומן זו על ידי עלייה במשקל, TNF-α, גלוקוקורטיקואידים ואגוניסטים β אדרנרגים. לעומת זאת מוגבר הביטוי הגנטי של AND בעת ירידה במשקל, בחשיפה לקור, בהסרת בלוטת האדרנל וכן על ידי IGF-1 .
רמת הורמון זה בדם, נמצאת במתאם הופכי לרמת שומני הדם במבוגרים, אם כי יחסי ADN ורמת ליפידים בדמם של ילדים צעירים פחות ברורה. הורמון זה משחק תפקיד בדיכוי פגמים מטבוליים שעלולים לגרום לסוכרת type 2, להשמנת יתר, לטרשת עורקים למחלת כבד שומני לא-אלכוהולי (NAFLD), כמו גם לתסמונת מטבולית. ADN בשילוב עם לפטין, נמצא כבעל השפעה המונעת עמידות לאינסולין בעכברים.
התבטאות אדיפונקטין במצבים פיזיולוגיים וקליניים שונים
ADN הוא הורמון נוסף המופרש מרקמת השומן ופועל כנגד השמנה בעיקר על-ידי הגברת הוצאת אנרגיה. בנוסף הוא פועל למניעת סוכרת וטרשת עורקים. בניגוד ללפטין, ADN נמצא במתאם שלילי עם אחוז השומן בגוף. כלומר, בבני אדם שמנים רמות ADN נמוכות יחסית. בכבד, ADN מדכא ייצור סוכר ומעכב הצטברות שומן. בנוסף, ל-ADN השפעה נוגדת דלקת (בניגוד ללפטין) על-ידי דיכוי TNF-α , המעודד התקדמות מחלות כבד וביניהן כבד שומני. בחולי NAFLD נמצאו רמות נמוכות יותר של ADN בדם לעומת ביקורת תואמות בגיל, מין ומשקל. כמו כן בקרב חולי NAFLD, נמצא כי ככל שרמות ADN נמוכות יותר כך יש הצטברות שומן חמורה יותר ודרגה גבוהה יותר של דלקת בכבד.
נמצא שרמות ADN הן ביחס הפוך לרמת הסמן הדלקתי CRP, להשמנת-יתר ולרמות HbA1c, ומתאם חיובי לרגישות לאינסולין. בשנת 2003 התפרסם ב-Eur J Endocrinol מחקר שהדגים את יכולת ADN להגביר את רגישות הכבד כמו גם את זו של תאי השריר להשפעת אינסולין. ADN מגביר את פעילות האינסולין על ידי הפעלת מסלול IRS ועוד חלבונים הכרוכים לקישור אינסולין לקולטן על קרום התא, ובצורה זו מגביר את כניסת גלוקוזה לתאי השריר. כמו כן, נמצא בעכברים ש-ADN מגביר את חמצון חומצות השומן בתאי השריר על ידי הפעלה של 5AMP-kinase, ומדכא את ייצור גלוקוזה בכבד. במחקרים אלה, שפעול 5AMP-kinase בתאי שריר שלד מושג הן על ידי ADN שלם והן על ידי המקטע הגלובולארי שלו. לעומת זאת, רק ADN בשלמותו משרה זרחון ושפעול של 5AMP-kinase בכבד. מטפורמין, וייתכן שאף תרופות אגוניסטיות ל-PPAR-γ כמו רוזיגליטזון, פועלות על ידי הפעלה של 5AMP-Kinase ותורמות בכך לדיכוי תהליך הגלוקונאוגנזה בכבד.
הורמון זה התגלה לראשונה בעכברים כתעתיק (transcript) המבוטא בעיקר בתאים קדם-אדיפוציטים המתמיינים בהמשך לאדיפוציטים. ההומולוג האנושי של ADN זוהה כתעתיק השכיח ביותר ברקמת השומן, אם כי בניגוד לציפיות למרות היותו מסונתז ברקמת השומן, נמצא שרמת ADN דווקא מתמעטת במצבי obesity מאשר באנשים רזים, וממצא פרדוקסאלי זה עדיין לא הוסבר במלואו. ממצא זה מנוגד למה שמקובל ברוב האדיפוציטוקינים האחרים, שרמתם מוגברת במצבי obesity במתאם מלא להגדלת מסת השומן בגוף. יצוין שבעוד שהשמנה נמצאת במתאם עם רמת אדיפונקטין נמוכה בפלסמה, ירידה במשקל גורמת לעלייה ברמתו.
מחקרים ביפאן על ידי Arita וחב', הדגימו מתאם שלילי בין רמות ADN בפלזמה לבין ערכי BMI בשני המינים, ומתאם שלילי דומה דווח על ידי Weyer גם באינדיאנים משבט Pima, כמו גם בלבנים. ייתכן שלמרות שביטוי ADN משופעל במהלך של יצירת שומנים, מתקיים מנגנון של משוב המעכב את יצירת ADN בהתפתחות של השמנת-יתר (obesity). לדוגמה, נמצא שהפרשת ADN על ידי אדיפוציטים מופחתת על ידי TNF-α, וייתכן שגם אדיפו-ציטוקינים אחרים המוגברים ברמתם בתרחיש של obesity, אחראים חלקית להפחתת יצירת ADN.
רמות ADN נמוכות גם באנשים עם יתר לחץ-דם ובחולי סוכרת, ונמוכות במיוחד באלה עם מחלת עורקים כליליים. נמצא שהתרחשות מוות קרדיו-וסקולארי גבוהה יותר במטופלים עם כשל כליות הסובלים גם מרמות ADN נמוכות. רמות נמוכות של ADN נמצאו במחקר שנערך בקרב אינדיאנים משבט ה-Pima אך גם בלבנים, כקשורות באופן הדוק לדרגת התנגודת לאינסולין, וממילא להיפר-אינסולינמיה ולעמידות לגלוקוזה. באינדיאנים משבט Pima, רמת חסר של ADN היא גורם מנבא משמעותי להתפתחות עתידית של סוכרת. הרקע האתני משחק כנראה תפקיד ולפחות מחקר אחד מראה רמות ADN גבוהות יותר בלבנים בהשוואה להינדו-אסייתים עם BMI דומה.
במודל של עכברים נמצא שתוספי ADN שיפרו את בקרת אינסולין, את רמת גלוקוזה בדם ואת רמת טריגליצרידים. נמצא ש-berberine, מותג מרפא צמחי מגביר רמת ADN, ואילו עכברים שהוזנו עם חומצות אומגה-3 כגון EPA ו-DHA, הגבירו אף הם רמת ADN בדם.
ריכוזי ADN בפלזמה מראים דימורפיזם מגדרי כאשר רמתו בנשים גבוהה מזו שבגברים, כנראה כתוצאה מהשפעה אנדרוגנית. רמות ADN נמוכות יותר באנשים עם סוכרת מאשר באלה ללא סוכרת, רמתו נמוכה באלה עם obesity והפחתת משקל מעלה משמעותית את רמת ADN.
גם חולים נגועים ב-HIV מתאפיינים ברמות נמוכות של ADN ובאחדים מהם יש דלדול מאגרי שומן אופייניים לליפו-דיסטרופיה. בחולים אלה נמצא שרמת ADN כמו גם רמת mRNA של AND, נמצאות במתאם עם תנגודת לאינסולין, ונראה שייצור מופחת של ADN ברקמת השומן עלולה לתרום להתפתחות התנגודת לאינסולין במטופלים אלה.
רמות של mRNA כמו גם של ADN עצמו נמצאו מופחתות בשומן של הפּדר (omentum) בהשוואה לשומן התת-עורי. יש ראיות לכך ששומן ויסצראלי מייצר אף הוא גורמים בלתי-מזוהים עדיין הפוגעים ב-mRNA של ADN, וקיים אמנם מתאם שלילי חזק בין מסת השומן הביטני ורמות ADN, שיכול להיות קשור גם לתאחיזה בין שומן ביטני לבין התנגודת לאינסולין.
במחקר בו בוצעה השוואה בין רמות ADN בפלסמה בשלוש קבוצות אוכלוסייה:סוכרתיים, לא-סוכרתיים עם מחלת לב כלילית וסוכרתיים ללא מחלת לב כלילית. רמות ADN בפלסמה נמצאו נמוכות בסוכרתיים בהשוואה ללא-סוכרתיים (באופן בלתי תלוי ברמת BMI), ורמות נמוכות במיוחד נמצאו בבעלי מחלת לב כלילית.
משמעותו של אדיפונקטין כתווך בפעילות אינסולין או בתנגודת לאינסולין
ADN משפר את הפרשת האינסולין מתאי β בלבלב על ידי שהוא מנטרל את דיכוי הפרשת אינסולין בהשפעת ציטוקינים וחומצות שומניות. רמות ADN מושפעות ממידת ההפעלה של קולטנים מסוג PPAR-γ או Peroxisome Proliferator-Activated Receptor על גרעין התא. קולטנים אלה, שבאים לביטוי בעיקר ברקמת השומן, הם גורמי שעתוק ממשפחת הקולטנים של הגרעין המופעלים על ידי קישור ליגנד. תרופות ממשפחת הגליטזונים, כגון רוזיגליטזון, משפרות את הרגישות לאינסולין על ידי פעילות הדדית עם הקולטן של גרעין התא. פעילות הגליטזונים מגבירה את ניצול גלוקוזה בתאי השומן והשריר, מגבירה את הקליטה של FFA, מפחיתה את הליפוליזה בתאי השומן, ומפחיתה במידת מה גם את הגלוקונאוגנזה. הפעלת קולטני PPAR-γ מפחיתה את ביטויים של גורמים שונים התורמים להיווצרות התנגודת לאינסולין, כגון רזיסטין. קולטני PPAR-γ קשורים במטבוליזם השומנים ובהתמיינות האדיפוציטים, והפעלתם על ידי הגליטזונים מכוונת ליצירת אדיפוציטים קטנים ורגישים יותר לאינסולין.
שיפור ברגישות לאינסולין על ידי הפחתת משקל בבני אדם שמנים שעברו ניתוח של מעקף הקיבה, נמצא קשור לעלייה ברמות ADN. יחד עם זאת, הצטברו נתונים ניסויים סותרים ביחס לשאלה האם השיפור ברגישות לאינסולין הנגרם כתוצאה מפעילות גופנית מאומצת, קשורה לעליה ברמות ADN בפלזמה. מחקר אחד מצא שאכן העלייה ברגישות לאינסולין במהלך ניסוי של eugycemic-hyperinsulinumic clamp ורמות ADN, קשורה פעילות גופנית אירובית בעצימות גבוהה. לעומת זאת, מחקר אחר לא מצא כל עליה ברמות ADN אפילו לאחר 6 חודשים של פעילות גופנית מאומצת, למרות שיפור משמעותי שנמדד בהשפעת אינסולין. ההבדל במסקנות המחקרים השונים, יכול להיות בחלקו בגלל העובדה שנמצא שיפור מבחינת המסה השומנית במחקר הראשון, ולא נרשם שיפור דומה של הפחתת רקמת השומן בניסוי השני. מסקנת הניסויים האחרונים, היא ש-ADN נראה כמאפנן (modulator) מרכזי של פעילות אינסולין, ושרמתו המופחתת בסוכרת type 2 יכולה לתרום לתנגודת היקפית לאינסולין במפגע זה.
קיימים דיווחים בלתי אחידים באשר להשפעת אינסולין על הביטוי הגנטי של ADN. מחקרים אחדים מצאו עלייה בביטוי הגן לאדיפונקטין בתאי רקמת שומן מסוג 3T3-L1 לאחר חשיפה קצרה לאינסולין, כאשר אחרים הראו ירידה בביטוי הגן לאחר חשיפה ממושכת יותר לאינסולין. משתמע מכך שאינסולין מהווה לכאורה מווסת חשוב של ביטוי הגן לאדיפונקטין, אם כי השפעתו יכולה להשתנות בהתאם למינון של אינסולין ולמשך פעולתו.
נמצא שרמות ADN בפלזמה פוחתות במקביל להתקדמות תופעת התנגודת לאינסולין, במהלך התפתחות סוכרת type 2 בקופי Rhesus הנוטים גנטית להשמנה וליצירת תנגודת לאינסולין, שהוזנו בדיאטה עתירת שומן. במחקר זה נמצא מתאם שלילי בין רמות ADN לבין משקל הגוף ולרמות אינסולין הנמדדות בצום, לעומת מתאם חיובי עם קליטת גלוקוזה על ידי תאים בהשפעת אינסולין. בקופים אלה, הדעיכה ברמות ADN הקדימה את הירידה ברגישות לאינסולין ואת הופעת היפרגליקמיה גלויה. התפתחות של היפר-אינסולינמיה היא אחד המנגנונים האפשריים לדיכוי רמות ADN שנצפה בניסויים אלה. במחקר שבוצע על ידי Weyer ושותפיו נמצא מתאם חיובי בין רמת ADN למספר מדדים של רגישות לאינסולין: רמת ADN נמצאה במתאם חיובי עם מידת פינוי הגלוקוז התלויה באינסולין שנמדדת בשיטת ה-euglycemic hyperinsulinemic clamp, ונמצאה במתאם שלילי עם רמות האינסולין בפלסמה.
יחד עם זאת, היפר-אינסולינמיה כשלעצמה לא נראית כתווך להופעת רמות נמוכות של ADN, שהרי רמות ADN נותרות נמוכות בשלבים מאוחרים יותר של סוכרת type 2, במתאם עם ירידה ברמות אינסולין בפלזמה. נראה שפעילות אינסולין על האדיפוציטים והעברת איתותים תאיים, מווסתים את הפרשת ADN מתאים אלה, ולא בהכרח הרמות המוחלטות של אינסולין. תמיכה באפשרות האחרונה מתקבלת ממחקריהם של Lodish ו-Bogan, שהראו שהפרשת ADN בתרבית מאדיפוציטים מסוג 3T3-L1 של עכברים, דורשת פעילות של האנזים PI-3K או phosphatidylinositol-3-kinase, המשמש תווך מרכזי בפעילות של אינסולין והחדרת גלוקוזה לתאים. נמצא שגירוי אינסולין על ידי פעילות PI-3K על הקולטן insulin receptor substate 1 פוחת באדיפוציטים של חולים בסוכרת type 2, וייתכן שהירידה בפעילות PI-3K באדיפוציטים בחולי סוכרת type 2 יכולה לתרום להפחתת רמות ADN.
נתונים מחקריים נוספים הצביעו על המתאם השלילי בין ADN ופעילות אינסולין. ניסויים באדם וכן בחולדות בשיטת euglycemic-hyperinsulinemic clamp אינסולין הראו שעירוי אינסולין מביא להפחתת רמות ADN בפלזמה, מה שתואם את ההערכה שאינסולין הוא בעל השפעה ניכרת על אדיפוציטים להפחת הייצור או ההפרשה של ADN.
האפשרות ש-ADN משפיע במנגנון של השריית תנגודת לאינסולין על ידי קטכולאמינים, הוצעה על ידי Fasshauer וחב', שגילו שטיפול באדיפוציטים מסוג 3T3-L1 בתרבית עם האגוניסט ה-β אדרנרגי isoproterenol, הפחיתה את כמות ה-ADN mRNA ב-75%. השפעה מעכבת זו של isoproterenol התבטלה כמעט לחלוטין על ידי טיפול מוקדם של תאים אלה עם האנטגוניסט ה-β אדרנרגי propranolol, ועל ידי התכשיר H-89 שהוא מעכב של האנזים protein kinase A. מסקנת החוקרים הייתה שקטכולאמינים יכולים להשרות תנגודת לאינסולין לפחות באופן חלקי על ידי דיכוי של התבטאות הגן המקודד ל-ADN. החוקר היפאני Kubota וחב' יצרו זן של עכברים טרנסגניים החסרים את הגן ל-AND, ואלה התגלו ככאלה עם תנגודת מוגברת משמעותית לאינסולין, בהזנתם בדיאטה רגילה, כאשר נעשתה השוואה עם עכברי wild type או עם עכברים הטרוזיגוטים לחסר של ADN. ניסויים אלה מדגימים לכאורה ש-ADN אמנם נחוץ לרגולציה תקינה של רגישות לאינסולין ולהומאוסטאזיס של גלוקוזה in vivo.
הזרקת אינסולין לעכברי ob/ob המשמשים מודל לסוכרת type 2, גם כן הפחיתה רמות גלוקוזה. למרות הבדלים ניכרים ברמות אינסולין בזני העכברים השונים, נראה שמנגנון מרכזי משותף נראה אחראי לירידה ברגישות הכבד לגלוקוזה בפלזמה, באופן בו הכבד הגיב להשפעת האינסולין בהפרשת גלוקוזה לדם. מחקרים של Yamauchi הראו השפעות דומות, דהינו שיפור ברגישות לאינסולין והפחתת היפר-גליקמיה במודלים של השמנת-יתר, סוכרת וליפואטרופיה בעכברים, למרות שתוצאות אלה הושגו בעירוי סיסטמי של המקטע הגלובולארי של ADN ולא בעירוי של ההורמון השלם.
סוכרת type 2 נובעת משילוב של גורמים גנטיים וסביבתיים. בסריקה של רצפי גנום ממדגם גדול של בני-אדם, מיפה את האתר הקשורים לסוכרת type 2, לתסמונת מטבולית ולמחלת לב כלילית לכרומוזום q273 בו ממוקם גם הגן המקודד ל-ADN. מחקריו של Hara וחב', הראו שהשינויים הגנטיים הגורמים לרמה נמוכה של ADN, כרוכים בהגדלת הסיכון לסוכרת type 2 באוכלוסיה ביפאן, ואילו מחקר נוסף ביפאן הראה שפרטים הנושאים מוטציית missense בגן ל-ADN הגורמת להיפו-אדיפונקטינמיה, היו בעלי פנוטיפ של תסמונת מטבולית, כולל תנגודת לאינסולין, ומחלת לב כלילית. פולימורפיזם גנטי זה של הגן ל-ADN, הכרוך ברמות מופחתות של הורמון זה, יכול להיות אחראי לפחות באופן חלקי לפתוגנזה של עמידות לאינסולין, כמו גם לסוכרת.
בתאי שריר שלד של עכברים נמצא ש-AND מגביר את פעילות גנים המקודדים לחלבונים הקשורים לטרנספורט של חומצות שומן ולחמצון שלהן, כגון CD36 והאנזים acyl-CoA oxidase, מה שמחיש "שריפת" חומצות שומן אלה וניצול אנרגטי יעיל. בכבד, מינונים נמוכים של AND הפחיתו את ביטויו של CD36, מה שגורם להפחתת הקליטה של חומצות שומן לתוך הכבד ולהקטנת ריכוז הטריגליצרידים בו. שיפור רגישות הכבד לאינסולין הביא להשערה שההשפעות העיקריות של AND על רקמת השריר הן בהגברת קליטת וניצול חומצות שומן חופשיות, בה בשעה שהפחתת ריכוז טריגליצרידים בכבד נובע מהפחתות שניוניות ברמת הטריגליצרידים וחומצות השומן החופשיות בפלזמה.
התפקיד של ADN בהחלשת התנגודת לאינסולין זכה גם לאישוש במחקרים באנשים ובעכברים הלוקים בליפו-דיסטרופיה (lipodystrophy), פגם המתאפיין על ידי איבוד סלקטיבי של שומן מרקמות שונות בגוף, כמו גם על ידי תנגודת לאינסולין. רמות ADN נמוכות במיוחד באלה עם lipodystrophy, ומחקר של Yamaguchi הראה שטיפול של עכברים המראים מפגע זה עם מינונים פיזיולוגיים של ADN, שיפר בהם משמעותית את התופעות המקובלות של היפרגליקמיה והיפר-אינסולינמיה.
תפקידו של ADN בהתפתחות רגישות או תנגודת לאינסולין
מתברר מניסויים במודלים של עכברים טרנסגניים הפגומים בגן המקודד ל-ADN, בהם הדגימו Maeda וחב' שקיים פינוי מאוחר של חומצות שומן חופשיות מהפלסמה, מופיע ביטוי נמוך של ה-mRNA של חלבון הנושא חומצות שומן חופשיות בשריר, נרשמות רמות גבוהות של ה-mRNA ל-TNF-α ברקמת השומן, כמו גם רמות גבוהות של TNF-α בפלסמה. כן דיווח Maeda שבעוד שבמשטר דיאטה רגילה לעכברים אלו נרשמת סבילות תקינה לגלוקוזה, הרי שעם דיאטה עתירת שומן מפתחים העכברים תנגודת לאינסולין עם ירידה בפעילות האנזים inositol 3-kinase phosphatidyl הקשור ב-insulin receptor substrate 1 בשריר, בהשוואה לעכברים רגילים. תופעה זו מתבטלת עם החדרת וקטור של adenovirus עם הגן ל-ADN.
ADN מעורר ברקמות המטרה תהליכים כעליה ברגישות לאינסולין וקליטת גלוקוזה בתאים, עליה בחמצון β של חומצות שומן להפקת אנרגיה, ועליה בפעילות של האנזים HSL כחלק מתהליך הפירוק של טריגליצרידים בתאי השומן. לעומת זאת ADN יכול לעכב גלוקונאוגנזה, או קליטת LDL מחומצן על ידי קולטן SR של המקרופאגים.
השפעת תרופות ממשפחת thiazolidinedione על רמות אדיפונקטין ועל השפעתו הפיזיולוגית
הקשר בין רמות ADN והתנגודת לאינסולין זכה לאישור נוסף על ידי נתונים שהתקבלו מטיפול בתכשירים ממשפחת- thiazolidinedione (להלן TZD), המשמשים כיום נדבך חשוב בטיפול בסוכרת type 2. ידוע כבר ש-PPAR-γ הוא גורם שעתוק המופעל על ידי התקשרות ליגנד, הנחשב כווסת חשוב של פעילות גנים באדיפוציטים ותהליך ההתמיינות של תאי שומן אלה. הפעלת PPAR-γ מפחיתה את ביטויים של גורמים שונים התורמים להיווצרות התנגודת לאינסולין כגון resistin ו-TNF-α. תכשירי TZD הם משפעלים סינתטיים ספציפיים של PPAR-γ, המשפרים את העמידות לגלוקוזה ואת הרגישות לאינסולין באלה עם סוכרת type 2. רוזיגליטזון ופיוגליטזון, שניהם תכשירים המשמשים ליגנדים של PPAR-γ ומגבירים את כניסת גלוקוזה לתאים בהשפעת אינסולין, דהיינו מגבירים את הרגישות לאינסולין ברקמה.
מתן TZDs נמצא מגביר את ריכוזי ADN בפלזמה של אנשים עם תנגודת לאינסולין וכן במכרסמים, כמו גם באלה עם סוכרת type 2. מתן רוזיגליטזון לתאי שומן מסוג 3T3-L1 הגביר את רמת ה-mRNA של ADN. מחקרים של Combs מצאו עליה ברמות ADN באנשים בריאים לאחר טיפול של 12 יום בלבד ב-rosiglitazone, וממצא זה נמצא גם בחולדות בהן שבועיים של טיפול ב-TZDs הביא לעליה בריכוזי ADN. תמיכה נוספת למשמעות תפקידו של PPAR-γ בוויסות הסינתזה של ADN, מצא Combs בעובדה שרמת ADN בפלזמה נמוכה פי-5 במטופלים עם תנגודת ניכרת לאינסולין על רקע מוטציות ב-PPAR-γ.
PPAR-γ בא לביטוי באופן בולט יותר ברקמת השומן בהשוואה לרקמות אחרות בגוף. מתן TZDs לחולדות סוכרתיות מסוג Zucker, שינה בהן את הביטוי של כ-10% מהגנים ברקמת השומן, וליגנדים ל-PPAR-γ מגבירים את ההתמיינות של תאי שומן וכניסת חומצות שומן חופשיות לתוכם. כיוון ש- PPAR-γ בא לביטוי בולט ברקמת השומן, הדבר מכתיב את הרגישות לאינסולין המתקבלת במתן של הליגנד לרצפטור זה.
TNF-α מפחית ביטוי של ADN בתאי שומן, אך מתן של TZDs מבטל השפעה זו של TNF-α ומעלה את רמת ADN. מחקרים בבני אדם מחזקים את הממצאים בחיות מעבדה באשר להשפעת TZDs על רמת ADN בפלסמה. במחקר אחד מתן רוזיגליטזון לששה חודשים גרם להכפלה ברמת AND בפלסמה. ממצאים אלו מחזקים את ההשערה כי הגדלת הרגישות לאינסולין המתקבלת על ידי TZD מתווכת לפחות חלקית על ידי ADN.
Iwaki וחב' מצאו שקישור רוזיגליטזון לרצפטור PPAR-γ, מביא להפעלת PPRE או peroxizome proliferators response element על הגן של ADN ובכך מתקבלת עלייה בביטויו. כמו כן, גורם נוסף הידוע בשם liver receptor homolog-1 נקשר ל-response element נוסף המפקח על הגן ל-ADN, מה שמגביר את ביטוי ADN בתיווך PPAR-γ. בכך ניתן להסביר את השפעת רוזיגליטזון בהפעלת PPAR-γ ברקמת השומן המביאה להגברה של רמת ADN.
אדיפונקטין ו-atherosclerosis
ל-ADN יש תכונות נוגדות טרשת עורקים, המתבטאות ביכולתו לדכא היצמדות של מונוציטים לתאי האנדותל. דיכוי זה מבוצע על ידי הפחתת הביטוי של מולקולות הדבקה באנדותל, הפחתה של ייצור תאי קצף במקרופגים, הפחתת ביטוי הקולטן בתאים אלה, דיכוי שגשוג ונדידה של תאי שריר חלק בשכבת ה-intima והפחתת השפעתם של גורמי גדילה שונים.
ניסוים שונים מצביעים על הפוטנציאל האנטי-טרשתי והאנטי-דלקתי של ADN. מחקריו של Ouchi ביפאן, התמקדו בהשפעת ADN על יכולת המונוציטים להיספח לאנדותל הוסקולארי, וההתמיינות מייאלואידים בהמשך למקרופאגים ולתאי קצף על ידי הפחתת הביטוי של macrophage class A scavenger receptor. נמצא ש-ADN משפיע על כל השלבים הללו כולל יצירת ציטוקינים על ידי מקרופאגים ותהליך הפאגוציטוזה. Ouchi דיווח ש-ADN מעכב יצירת ופעילות TNF-α (בה במידה ש- TNF-α משפיע בהפחתת רמת ADN), תוך שהוא אחראי למודולציה של גורם השיעתוק הגרעיני NFkB, וכן ש-ADN מדכא התמרה של מקרופאגים לתאי קצף in vitro. מחקר קודם הראה ש-ADN עשוי להחליש תהליכי דלקת הקשורים לטרשת עורקים, על ידי יכולתו לדכא מולקולות ספיחה אנדותליאלית כגון VCAM-1 או vascular cell adhesion molecule 1, וכן לדכא את פעילותו של selectin E.
יתרה מכך, נראה ש-ADN מעכב את השגשוג של תאי שריר חלק ונדידתם בשכבת ה-intima של דופן כלי הדם, מה שגורם להיצרותם. בעכברי knock-out ללא יכולת לסנתז ADN, נמצאה התעבות בולטת של שכבת ה-intima, כאשר אספקת ADN לעכברים אלה החלישה את שגשוג תאי השריר החלק בשכבת האינטימה.
בשנים האחרונות הולך ומתברר תפקידו של C-reactive protein כגורם סיכון למחלת לב כלילית. כן נמצא ביטוי של CRP mRNA ברקמת השומן באדם. נמצא מתאם הופכי בין רמות mRNA של ADN ושל CRP ברקמת השומן התת-עורית, באנשים עם מחלת כלי-דם טרשתית. אותו מתאם שלילי נמצא גם בין רמות ADN ו-CRP בפלזמה של אנשים אלה. מתאם הופכי זה בין ADN ו-CRP הן ברקמת השומן כמו גם בפלזמה, תומך בתפקידו האנטי-טרשתי של ADN.
היפו-אדיפונקטינמיה כרוכה גם בהתפתחות של דיסליפידמיה . Hotta וחב' מצאו מתאם שלילי משמעותי בין רמות ADN לבין רמת טריגליצרידים בפלסמה, לעומת מתאם חיובי בין רמות ADN לבין רמות HDL-כולסטרול בסוכרתיים. Matsubara וחבריו הדגימו גם בנשים בריאות מתאם שלילי בין רמות ADN לרמות טריגליצרידים. גם לאחר תיקון ל-BMI, גיל, מסת שומן בגוף, ולחץ דם דיאסטולי, עדיין הודגמו רמות ADN נמוכות במצבים הדיסליפידמיים שתוארו.
שימוש פרמקולוגי-טיפולי ב-ADN
כיוון שגילוי ADN הוא חדש יחסית, לא פותחה עדיין גישה טיפולית עם הורמון זה, אם כי ניסויים בעכברים במתן ADN הולידו ממצאים מבטיחים. נראה שמחקר עתידי בגישה טיפולית בבני-אדם תתמקד בהיבטים של השפעת טיפול כזה ב-obesity, סוכרת type 2 ובמחלת הכבד השומני.
הוספת ADN עשויה לייצג אסטרטגיה טיפולית חדשה באלה עם עמידות לאינסולין, או במטופלים עם סוכרת type 2. ל-ADN עשויים להיות מספר יתרונות על פני תרופות אנטי-סוכרתיות המשמשות בשגרה הקלינית, שכן בנוסף להשפעות נוגדות הסוכרת והאנטי-ליפידמיות יש ל-ADN השפעות נוגדות דלקת בעלות השפעה חיובית במניעת תהליכי טרשת עורקים. בנוסף, ADN אינו מעלה את משקל הגוף כתופעת לוואי.
ל-ADN עשויות להיות השלכות טיפוליות כתכשיר נוגד-השמנה, אם כי ניסויים בבני-אדם לא יצאו לפועל עד כה. מחקר של Yamauchi הראה שמתן ADN לא הפחית משקלם של עכברים שהוזנו בדיאטה עתירת-שומן.
הקשר ההדוק בין ADN לבין רגישות סיסטמית לאינסולין הודגם הן בתרביות תאים והן in vivo בעכברים, בחיות אחרות ואף באדם. Berg הראה שהזרקה תוך-צפקית של מוליקולת ADN בשלמותה לעכברי wild-type הנמצאים בצום, או לשני זני מודל של עכברים, האחד של עכברים לא-שמנים עם סוכרת type 1 על רקע חסר באינסולין, והאחר של עכברים בהם הושרתה סוכרת על ידי מתן streptozotocin, הביאה לירידה זמנית משמעותית ברמת גלוקוזה. מניסויים אלה לא השתמע ש-ADN פועל באופן עיקרי בהשריה של הפרשת אינסולין, שכן רמות אינסולין נותרו נמוכות גם לאחר הזרקת ADN לעכברים האמורים. כן הראה Berg שמתן ADN ריקומביננטי הפחית בפלזמה של עכברים בריאים או סוכרתיים את רמת גלוקוזה, זאת ללא העלאת מידת הפרשת אינסולין. בנוסף, השתפרה יכולת האינסולין לדכא ייצור גלוקוזה בתאי כבד מבודדים.
ניסויים בשיטת euglycemic-hyperinsulinemic clamp, הראו שעירוי של ADN ריקומביננטי במלוא אורכו, שהביא לעליה חדה ברמתו בפלזמה, משפר את דיכוי הגלוקונאוגנזה של גלוקוזה בכבד המושרה על ידי אינסולין. ממצא זה היה כרוך בהפחתת הביטוי של האנזימים המשרים גלוקונאוגנזה בכבד, דוגמת PEPCK או phosphoenolpyruvate carboxy kinase ו-glucose-6-phosphatase, מה שמצביע על כך שבקרת השעתוק של 2 אנזימים אלה עשויה לתרום למנגנון הפעולה של ADN. הזרקת החלק הגלובולארי של ADN לעכברים שניזונו מדיאטה עשירת שומן וסוכרוז, היה מלווה בירידה במשקלם, כמו גם ירידה ברמות גלוקוזה, חומצות השומן חופשיות וטריגליצרידים בפלסמה.
ההשפעות הפרמקולוגיות של ADN נלמדו בבעלי חיים, ובתאים בתרבית רקמה תוך שימוש במגוון של תוצרים ריקומביננטיים של ההורמון. ניסויים בהם עשו שימוש במולקולת ההורמון המלאה בהשוואה לשימוש במקטע הראש הגלובולארי של ההורמון, הולידו תוצאות בלתי פסקניות. המקטע (domain) הגלובולארי נמצא יעיל יותר מאשר מולקולת ההורמון השלימה בהפחתת תהליכי היפר-גליקמיה והיפר-אינסולינמיה בעכברים בהם הושרו תופעות אלה אם על ידי דיאטה מתאימה או בזני עכברים עם נטייה גנטית ל- obesity או בעכברים מוזרקים עם ליפידים ישירות לווריד, בהפחתת רמות מוגברות של חומצות שומן חופשיות (FFA). יחד עם זאת ממצאים אלה סותרים את ממצאיו של Berg וחב', לפיהם דווקא ההורמון ADN בשלמותו הביא להפחתת רמת גלוקוזה בעכברים עם סוכרת type 1 או type 2, בעוד שהמקטע הגלובולארי לא השפיע באופן דומה.
קיימת עדיין אי-ודאות לגבי השפעה של הזרקת ADN לחיות בתרחישים קליניים שונים. הזרקת ההורמון למכרסמים נמצאה מגבירה את תהליכי הזרחון של טירוזין בקולטן לאינסולין בשרירי השלד, וממילא מגבירה את הרגישות לאינסולין בגוף כולו. ממצא זה אושר לאחרונה גם בניסוי קליני מקדמי בבני-אדם. הפוטנציאל במתן של AND רקומביננטי לשיפור התנגודת לאינסולין, למניעת סוכרת type 2, להפחתת לחץ-דם לשיפור תפקוד האנדותל ומניעת טרשת עורקים, כמו גם בטיפול נוגד השמנה עדיין לא הגיע למיצוי.
אדיפונקטין והשפעתו על לחץ הדם
לחץ הדם אינו מושפע על ידי ADN באופן מובהק, ורמת ADN במטופלים עם יתר לחץ-דם עדיין שנויה במחלוקת. כאשר השוו בין אוכלוסיות נורמו-טנסיביות והיפר-טנסיביות עם ערכי BMI דומים, נמצא שרמות ADN בהיפטנסיבים היו נמוכות באופן משמעותי. לאחרונה, Fasshauer וחבריו הראו כי גירוי β אדרנרגי מביא לירידה בביטוי הגן ל-ADN בתרבית תאי שומן מסוג T3-L13. מאחר שהגברת פעילות סימפתטית מהווה מנגנון חשוב התורם ליתר לחץ-דם, הועלתה ההשערה על פיה גירוי יתר סימפתטי, אחראי לפחות חלקית, להתפתחות של היפו-אדיפונקטינמיה באלה עם יתר לחץ-דם.
אך בניגוד לנתונים אלה פרסמו Mallamaci וחב' בשנת 2002 שרמות ADN דווקא מוגברות בגברים היפרטנסיביים בהשוואה לנורמוטנסיביים עם משקל תואם. Furuhashi וחב' בדקו את הקשר בין רגישות לאינסולין לבין רמות ADN בחולים עם יתר לחץ-דם להם דרגות שונות של תנגודת לאינסולין. נמצאו רמות ADN נמוכות יותר בהיפרטנסיביים עם תנגודת לאינסולין, בהשוואה לנורמוטנסיביים, וכן בהשוואה להיפרטנסיביים בעלי תגובה תקינה לאינסולין. טיפול משך 14 יום עם מעכב ACE או עם חוסמי הקולטן לאנגיוטנסין, הפחית משמעותית את לחץ הדם, הביא לשיפור ברגישות לאינסולין, וגרם לעלייה ברמת ADN, מבלי הייתה השפעה על ה-BMI.
אדיפונקטין כסמן אפשרי לסוכרת type 2
מחקר של Heidemann וחב' שהתפרסם בשנת 2008 ב-Annals of Internal Medicine, מצביע על כך ש-ADN קשור במתאם הופכי לסיכון לפתח סוכרת type 2בנשים. במחקר זה השתתפו 1038 נשים שהשתתפו במחקר בריאות האחיות, שכלל נשים שהיו בריאות בתחילתו ופיתחו בהמשך סוכרת type 2. ריכוזים כוללים בפלזמה של ADN ושל ADN במשקל מולקולארי גבוה בנשים עם סוכרת, הושוו ל-1136 נבדקות ביקורת בריאות.
נמצא במחקר זה שרמות ADN היו כרוכות בסיכון נמוך יותר משמעותית לפתח סוכרת type 2 במודלים רבי משתנים, שתוקננו ל-BMI. עבור האחוזונים הגבוהים ביותר לעומת האחוזונים הנמוכים ביותר, נמצא סיכון המוצלב של 0.17 עבור ADN כולל, לעומת סיכון מוצלב של 0.10 עבור ADN במשקל מולקולארי גבוה. גם לאחר תקנון ל-ADN כולל, יחס גבוה יותר של ADN במשקל מולקולארי גבוה ל-ADN כולל, היה קשור עם סיכון מובהק נמוך יותר לפתח סוכרת type 2. היחס של ADN במשקל מולקולארי גבוה ל-ADN כולל מצביע על תפקיד חשוב של הפרופורציה היחסית של ADN במשקל מולקולארי גבוה בפתוגנזה של סוכרת.
אדיפונקטין וסוכרת הריון
מדידת רמת ADN מסוגלת לזהות נשים המצויות בסיכון ללקות בסוכרת היריון לפני שהרו. סוכרת היריון פוגעת בכ- 5% מהנשים ההרות וכמעט אחת מתוך שלוש מהנשים הללו תפתח בהמשך חייה סוכרת מסוג 2. החוקרים ניתחו בדיקות דם של כ- 4,000 נשים שהרו בין השנים 1985 ו-1996. במהלך התקופה נצפו 256 מקרים של סוכרת היריון. נשים עם עודף משקל ורמות נורמאליות של ההורמון הציגו סיכון גבוה פי 1.7 לסוכרת היריון בהשוואה לנשים עם משקל תקין. נשים במשקל תקין ועם רמות נמוכות של ADN הציגו סיכון גבוה פי 3.5 לפתח סוכרת היריון, ובנשים עם רמות נמוכות של ADN נמצא סיכון גבוה פי-6.8.
הוראות לביצוע הבדיקה
את הדם יש ליטול בצום של 12 שעות במבחנה כימית (פקק אדום או צהוב).
ראו גם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק