ליזופוספטידילכולין - Lysophosphtidylcholine
| מדריך בדיקות מעבדה | |
| ליזופוספטידילכולין | |
|---|---|
| Lysophosphtidylcholine | |
| שמות אחרים | LPC, lysoPC, lysolecithin |
| מעבדה | כימיה בדם |
| תחום | פוספוליפיד המגביר תחלואות מסוגים שונים. לאבחון Adrenoleukodystrophy. |
| טווח ערכים תקין | בדם: 125-143nmole/ml |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – בדיקות סקר
מטרת הבדיקה
בדיקת סקר-יילודים לאבחון של Adrenoleukodystrophy.
תכונות כלליות של LPC
LPC הקרוי גם lysolechitin, היא מולקולה שומנית הנוצרת על ידי ביקוע של phosphatidylcholine (להלן PC) על ידי phospholipase A2 (להלן Ridgway) (PLA2 ו-McLeod ב-Biochem Lipids משנת 2016, ו-Gauster וחב' ב-J Lipid Res משנת 2005), ו/או על ידי טרנספר של חומצות שומן לכולסטרול חופשי על ידי lecithin-cholesterol acyltranferase (או LCAT) על פי Dullaart וחב' ב-Kidney Int משנת 2003). באנשים בריאים רמת LPC בפלזמה היא בתחום של 125–143 nmole/ml, אך רמה זו עולה במחלות קרדיו-וסקולריות, בסוכרת, בסרטן השחלות, ובכשל של הכליות (Okita וחב' ב-Int J Cancer משנת 1997, ו-Sasagawa וחב' ב-J Nutr Sci Vitaminol משנת 1998). בשנת 1847 פרסם Nicolas Gobley לראשונה את המבנה הכימי של לציטין (Zeisel ב-Ann Nutr Metab משנת 2012). PC הוא מרכיב עיקרי בממברנות ביולוגיות של בעלי חיים וצמחים (Watson ב-Assays Biochem משנת 2015). אף על פי ש-LPC יכול להיות מיוצר בצירקולציה כאשר PLA2 מבקע PC, הוא יכול להיות מותמר ל-PC על ידי האנזים LPC acyltransferase (להלן LPCAT) בנוכחות acyl-CoA. שני מסלולים אלה, הם חלק מ-Lands cycle (Wang וחב' ב-Plant Cell משנת 2012), שהוא אחד מהמנגנונים בגוף לסינתזה מעגלית ופירוק של PC. ה-LPCAT הוא אנזים תוך-תאי הנמצא ברקמות גוף כגון ריאות (Chen וחב' ב-Proc Natl Acad Sci USA משנת 2006), כבד (Zhou וחב' ב-J Biol Chem משנת 2008), ורקמת שומן (Moessinger וחב' ב-J Biol Chem משנת 2011), אך אנזים זה אינו מסוגל להגיב ישירות עם LPC חוץ-תאי בצירקולציה.
בכבד, LPC משדרג גנים הכרוכים בחמצון של חומצות שומן הפאטיות (Hollie וחב' ב-Biochim Biophys Acta משנת 2014). ריכוזים מוגברים של LPC פוגעים בשלמות של המיטוכונדריה, ומחישים שחרור של ציטוכרום C מהפאטוציטים. במערכת הווסקולרית, LPC משרה שפעול מתמשך של האנדותל ושל אתרוגנזה (Li וחב' ב-J Biol Chem משנת 2018, ו-Wong וחב' באותו כתב-עת משנת 1998). ל-LPC השפעה מודולטורית על ביטוי של ציטוקינים דלקתיים בתאי אנדותל (Takahara וחב' ב-Metabolism משנת 1996), הוא מפריע להתרחבות עורקים (Kugiyama וחב' ב-Nature משנת 1990), מגביר עקה חמצונית (Kim וחב' ב-J Matern Fetal Neonat Med משנת 2009, ו-Li וחב' ב-Food Funct משנת 2015), וכן מעכב את הנדידה של תאי אנדותל ושגשוגם (Chaudhuri וחב' ב- Arteriosclr Thromb Vasc Biol משנת 2003, ו-Rikitake וחב' באותו כתב-עת משנת 2000). פרט להיות LPC מעורב בפתוגניות של טרשת עורקים (Schmitz ו-Ruebsaamen ב-Atherosclerosis משנת 2010), הוא מעורב במחלות דלקתיות אחרות כגון טרשת נפוצה (Zahednasab וחב' ב-J Neuroimmunol משנת 2014). יצירת-יתר של LPC מגבירה של הפעילות של Lp-PLA2 בצירקולציה (Packard וחב' ב-N Eng J Med משנת 2000, ו-Thompson וחב' ב-Lancert משנת 2010).
LPCs מיוצרים בתוך התאים בעיקר על ידי האנזים phospholipase A2 המסיר את אחת משתי חומצות השומן מפוספטידילכולין ליצירת LPC (Li וחב' ב-J Biol Chem משנת 2018). בין התכונות של LPC, שפעול של תאי אנדותל בשלבים המוקדמים של טרשת עורקים (Li וחב' ב- Artheriosclr Thromb Vasc Biol משנת 2018). LPC מופרש מתאים אפופטוטיים לגיוס של פגוציטים שיכולים בהמשך לבלוע את התאים המומתים באפופטוזיס (על פי Lauber וחב' ב-Cell משנת 2003). ידוע גם ש-LPC יכול לעודד פגוציטוזיס של שכבת המיאלין, והוא יכול גם לשנות את תכונות שטח הפנים של אריתרוציטים (Munder וחב' ב-Semin Immunopathol משנת 1979). דה-מיאלינציה מושרית על ידי LPC, מתרחשת דרך פעולותיהם של מקרופאגים ותאי מיקרוגליה מגויסים המפעילים פגוציטוזה של ממברנות מיאלין סמוכות. חיידקים כגון Legionella pneumophila עושים שימוש בתוצרי פעולת האנזים phospholipase A2, חומצות שומן וליזופוספוליפידים לגרום לאפופטוזיס של מקרופאגים תוך שחרור של ציטוכרום C.
LPC מהווה רק פחות מ-3% מהפוספוליפידים בממברנת התא, והוא מהווה 8–12 אחוזים מהפוספוליפידים בפלזמה. כיוון ש-LPC עובר מטבוליזם על ידי lysophospholipase ועל ידי LPC-acyltransferase, יש לו תקופת חיים קצרה בגוף. תהליך המטבוליזם של LPC הוא מרכיב חשוב בהתפתחות הנורמלית של מוח האדם, ואלה עם פגם גנטי בקליטה מוחית של LPC מתים בינקותם ממיקרוצפלוס (Guemez-Gamboa וחב' ב-Nature Genet משנת 2015). נמצא ש-MFSD2a מסייע לטרנספורט של LPC עם חומצות שומן רב-בלתי-רוויות כגון EPA ו-DHA דרך מחסום דם-מוח ומחסום דם-רשתית (Nguyen וחב' ב-Nature משנת 2014, ו-Wong וחב' ב-J Biol Chem משנת 2016). היכולת האנטי-סרטנית של וריאנטים סינתטיים של LPC אינה מכוונת כנגד ה-DNA התאי, אלא נגרמת מחדירת וריאנטים אלה לממברנת התא וגרימת אפופטוזיס בגין ההפרעה לקבלת והעברת איתותים. LPC נמצא כמשפעל של מערכת החיסון בהתמיינות של מונוציטים לתאים דנדריטים בשלים. שכבת intima-media מעובה עלולה להפחית את מהירות זרימת הדם במעשנים צעירים. מסתבר שעישון הוא גורם סיכון עיקרי לרמה מוגברת של phospholipase A2, כתוצאה מהשפעת מרכיבי הטבק על החמצון של LDL בשכבת האינטימה בעורק הקרוטידי (Frotta-Pasini וחב' ב-PLos One משנת 2013).
LPC הוא פוספוליפיד אנדוגני הנמצא בריכוזים מיקרו-מולריים בדם וב-ascites. ההשפעות של LPC כוללות שפעול של פוספוליפאז C, שפעול של protein kinase C, שפעול או עיכוב של MAP kinase וגיוס של סידן תוך-תאי, כאשר כל הפעילויות הללו קשורות עם עובדת היות LPC משפעל של קולטנים הקשורים עם protein G. משערים ש-LPC הוא אגוניסט אנדוגני של הקולטנים ל-PAF, ל-G2A sphingophosphrylcholine- ול-GPR4 shingophosphorylcholine.
דה-מיאלינציה מושרית על ידי LPC
דה-מיאלינציה מושרית על ידי LPC נחקרה רבות בהקשר למחלות מיאלין. נמצא שהרס מיאלין המושרה על ידי LPC תלוי ב-+Ca2. בניסוי אחד החומר הלבן בחוט השדרה של נקבות חזירי-ים, בודד והוכנס לתרבית ex vivo. חמש דקות לאחר הזרקת LPC, שכבת המיאלין החלה לתפוח. באתר ההזרקה של LPC, המיאלין המתפרק יצר נגע מקומי, ותהליך דומה התרחש in vivo כאשר LPC הוזרק לעצב השת (sciatic nerve) של עכבר. אם חוט שדרה מוזרק על ידי LPC מודגר בתרבית נטולת סידן, בתוספת של 0.5mM של EGTA להרחקת סידן חוץ-תאי, חלה הקטנה ניכרת בנגע במיאלין. בנוסף, שני אנזימים התלויים בסידן cPLA2 ו-calpain משתתפים בתהליך הדה-מיאלינציה, מה שמדגיש את מעורבות סידן בתהליך זה.
טרנספורטציה של LPC בצירקולציה
LPC מתפנה במהירות מהפלזמה לכבד על ידי טרנספורטרים דוגמת אלבומין ו-Glycoprotein α-1 acid (להלן AGP) שם הם מתפרקים לפוספטידיל-כולין (להלן PC) (Ojala וחב' ב-Biochemistry משנת 2006), או עובר למוח ליצירת אצטיל-כולין (Spanner ו-Ansell ב-Biochem Soc Trans משנת 1979). בנוסף, LPC יכול להצטבר בחלקיקי LDL מחומצן וכך הוא כרוך בדלקת וסקולרית (Takeshita וחב' ב-J Atherosclr Thromb משנת 2000, ו-Uchida וחב' ב-Circ J משנת 2010). כ-80% מה-LPC נקשר לאלבומין (Switzer ו-Eder ב-J Lipid Res משנת 1965, ו-Kugiyama וחב' ב-Circ Res משנת 1993). במצב של היפו-אלבומינמיה הנגרם כתוצאה מפרוטאינוריה, מופחת קישור LPC לאלבומין ומוגברות רמות LPC ב-VLDL וב-LDL (Vuong וחב' ב-Kidney Int משנת 1999). רמות מוגברות של LPC ב-LDL במטופלים היפר-ליפידמיים כרוכים בתסמונת נפרוטית (Koomans ו-Rabelink ב-Kidney Int משנת 1995). הריכוז של AGP בפלזמה מוגבר במצבי דלקת. בדומה לתפקוד של anti-trypsin יש ל-AGP השפעות נוגדות דלקת על ידי עיכוב צימות של טסיות, מניעת יצירה של superoxide והחלשת ההשפעה של TNF-α על תאים (Van Molle וחב' ב-J Immunol משנת 1997).
חלבון טרנספורטר טרנס-ממברנלי
P4-ATPases הם flippases המבוטאים על הממברנה של תאים ב-eukaryotes. הם פועלים לטרנסלוקציה של פוספוליפידים מאקסופלזמה לציטופלזמה כנגד גרדיאנט הריכוזים על ידי הידרוליזה של ATP (Lopez-Marques וחב' ב-Pflug Arch משנת 2014, ו-Andersen וחב' ב-Front Physiol משנת 2016). בתהליך הפוך, LPC יכול להיות מוצא מהתאים על ידי פעילות של ATP-binding cassette transporter A7 (להלן ABCA7) בנוכחות apolipoprotein AI (להלן apoAI) ו-apoE (Linsel-Nitschke וחב' ב-J Lipid Res משנת 2005). מוטציות ב-ABCA7 כרוכות במחלות נוירו-דגנרטיביות (Tomioka וחב' ב-Biochim Biophys Acta Acta משנת 2017). המנגנון האפשרי יכול להיות קשור לתרחיש בו עודף של LPC מעודד באופן סינרגיסטי אפופטוזיס בתאי עצב המושרה על ידי Aβ1-42 (Aikawa וחב' ב-Braun Sci משנת 2018, ו-Qin וחב' ב-Acta Pharmacol Sin משנת 2009).
האיתות של LPC דרך קולטניו
LPC משפעל מסלולי איתות רבים הקשורים בעקה חמצונית ובתגובות דלקתיות. קסקדת האיתותים מסתייעת על ידי הקשר בין G protein לבין הקולטן G2A (Yang וחב' ב-Blood משנת 2005, Radu וחב' ב-Proc Natl Acad Sci USA משנת 2004, Tan וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2009, ו-Peter וחב' ב-J Biol Chem משנת 2008), וכן דרך קולטני Toll-like (Carneiro וחב' ב-PLoS One משנת 2013). אך קיים ויכוח האם G2A הוא הקולטן הקָנוֹנִי של LPC. מתן אקסוגני של LPC משרה השפעות תומכות-דלקת, כמו גם משרה יצירת חלבוני ספיחה בתאי אנדותל (Kume ו-Gimbrone ב-J Clin Invest משנת 1994), מגביר את הפרשת IL-1β, IL-6 ו-TNF-α מאדיפוציטים (Sato וחב' ב-Drug Dev Res משנת 2014, ו-Kuniyasu וחב' ב-Biochim Biophys Acta משנת 2011), מגביר את הפרשת אינטרפרון-γ מלויקוציטים היקפיים חד-גרעיניים (Hoang וחב' ב-Clin Exp Immunol משנת 1999), ומגביר את השפעול של תאי B ושל מקרופאגים (Yamamoto וחב' ב-J Immunol משנת 1991). בנוסף, LPC מגביר את הביטוי של Foxp3, ומדכא את התפקוד של תאי T (להלן nTregs ) (Hasegawa וחב' ב-Biochem Biophys Res Commun משנת 2011). כל הפעילויות הללו מסתייעות לכאורה על ידי איתות דרך G2A. nTregs אחראיים למניעת תגובות חיסוניות, בין השאר על ידי יצירה של ציטוקינים אנטי-דלקתיים (Shevach ב-Immunity משנת 2009). במערכת העצבים המרכזית, LPC משרה דה-מיאלינציה בחומר הלבן בחוט השדרה על ידי שפעול האיתות דרך הקולטן 17 הקשור ל-G protein (להלן Gpr17) קולטן המבוטא מאוד ברקמת המוח, מפחית רמת cAMP בתוך התאים, ומשרה את הביטוי של הגן המקדם אפופטוזיס, XIAP-associated factor 1 להלן (Xaf1) המעכב הישרדות של אוליגודנדרוציטים (Ou וחב' ב-J Neurosci משנת 2016). מחקר אחר מצא ש-LPC פוגע בפעילות המחסום של האנדותליום במוח, ומשרה דלקת דרך ה-G-protein-coupled receptor 4 (להלן Gpr4) (Qiao וחב' ב-Am J Physiol Lung cell Mol Physiol משנת 2006). LPC מתווך באובדן של פריציטים, בפגיעה במחסום וסקולרי, בדה-מיאלינציה, ובפגיעה בתפקוד מוטורי: כל המפגעים הללו יכולים להימנע על ידי iloprost שהוא אנלוג של prostacyclin (Muramatsu וחב' ב-J Biol Chem משנת 2015).
המנגנון המגביר רמות LPC בצירקולציה
- פירוק מוגבר של PC על ידי Lipoprotein-Associated Phospholipase A2:
- פוספטידילכולין המסונתז בכבד הוא המרכיב הליפידי של VLDL בפלזמה, והוא אף מהווה 40% מה-nascent HDL (Agren וחב' ב-Biochim Biophys Acta משנת 2005, ו-Skipski וחב' ב-Biochem J משנת 1967). לאחר הפרשתו לזרם הדם, PC על חלקיקי ליפופרטאין עובר פירוק בעמדה Sn-2 של חומצת שומן מחומצנת על ידי Lp-PLA2. LPC נוצר במצבים פיזיולוגיים ופתולוגיים. ראיות קליניות מראות שהפעילות של Lp-PLA2 נמצאת במתאם חיובי עם אירועים קרדיו-וסקולריים (Lehto וחב' ב-Front Neurosci משנת 2017, Li וחב' ב-Clin Chim Acta משנת 2017, Esenwa ו-Elkind ב-Nat Rev Neurol משנת 2016, ו-Talmud ו-Holmes ב- Arteriosclr Thromb Vasc Biol משנת 2015). מדידה כמותית של LP-PLA2 בפלזמה שימושית לזיהוי אי-יציבות של הרובד הטרשתי, תסמונת כלילית חריפה, ותרחישים קרדיו-וסקולריים אחרים (Chen וחב' ב-Clin Chim Acta משנת 2019, Lu וחב' ב-Biomed Rep משנת 2018, ו-Lyngbakken וחב' ב-Crit Rev Clin Lab Sci משנת 2018). יתרה מכך, Lp-PLA2 הוא מנבא של חומרת שבץ איסכמי והתדרדרות נוירולוגית בעקבותיו, וכן של איסכמיה מוחית במטופלים עם שטף-דם מוחי תת-עכבישי כתוצאה ממפרצת (Zhou וחב' ב-Neurol Sci משנת 2018, Wang וחב' ב-Neurol Res משנת 2018, ו-Ding וחב' ב-J Neurosurg משנת 2019). עם זאת, עיכוב של Lp-PLA2 על ידי darapladib שהוא מעכב סינתטי קטן-מולקולרי של platelet-activating factor-acetylhydrolase (להלן PAF-AH) לא הביא לתוצאות מבטיחות בניסויים קליניים (Wilensky וחב' ב-Nat Med משנת 2008, ו-Serruys וחב' ב-Circulation מאותה שנה). אף על פי ש-Lp-PLA2 הוא בעל תפקיד אנטי-דלקתי בפירוק PAF (Chen וחב' ב-Curr Opin Lipidol משנת 2004, ו-Marathe וחב' ב-J Lipid Res משנת 2014), ובכך להפחית את שפעול הטסיות, יש לו גם את התכונות מקדמות הדלקת, בהגברת הרמות של LPC ושל חומצות שומן מחומצנות שלא עברו אסטריפיקציה, מה שעלול להביא להתפתחות טרשת עורקים (Benitez וחב' ב-Atherosclerosi משנת 2004).
- פירוק מוגבר של LPC על ידי לציטין-כולסטרול-אצילטרנספראז (להלן LCAT):
- האנזים LCAT מופרש מהכבד ומקטלז את הטרנספר של חומצות שומן מעמדה sn-2 של PC לכולסטרול חופשי בפלזמה, מה שמביא ליצירת כולסטרול-אסטר ו-LPC על פני HDL ו-LDL (Jonas ב-Prog Lipid Res משנת 1998, ו-Calabresi וחב' ב-Atherosclerosis משנת 2012). במוח, LCAT מסונתז על ידי אסטרוציטים והוא משופעל על ידי apolipoprotein E להלן (apoE) המופרש על ידי תאי glia (Hirsch-Reinshgen ב-J Lipid Res משנת 2007). אך ההשפעה של LCAT על התהוות טרשת עורקים באדם שנויה במחלוקת (Calabresi ו-Franceschini ב-Trends Cardiovasc Med משנת 2010, ו-Kunnen ו-Van Eck ב-J Lipid Res משנת 2012).
ממצאים קליניים הקשורים ל-LPC
LPC מסוגל לשנות את הפיזיולוגיה של האנדותל הווסקולרי, הפריציטים ותאי העצב in vivo ו-in vitro, ויכול לשחק תפקיד במחלות קרדיו-וסקולריות, אך מחקרים עדכניים סותרים הנחות אלו. לדוגמה, LPC בפלזמה הראה מתאם הופכי עם מחלות קרדיו-וסקולריות (Stegemann וחב' ב-Circulation משנת 2014, Ganna וחב' ב-PLoS One משנת 2014, ו-Lee וחב' ב-J Korean Med Sci משנת 2013). במחקרים אחרים, היחס LPC/PC פחת בפלזמה או ב-CSF בחולי אלצהיימר (Klavins וחב' ב-Alzheimers Dement משנת 2015).
LPC ומחלות באדם
LPC ותחלואה קרדיו-וסקולרית: מחלות אלו כוללות טרשת עורקים, סוכרת, תסמונת מטבולית, אוטם שריר הלב ותעוקת החזה. על פי נתוני ה-WHO מחלות קרדיו-וסקולריות אחראיות ל-17.7 מיליון מקרי מוות בעולם מדי שנה (שהם 31% מכלל התמותה הגלובלית) (על פי Khan וחב' ב-Glob Heart משנת 2018). רמות LPC בצירקולציה כרוכות בהתפתחות של רבדים טרשתיים ובתפקוד לקוי של תאי האנדותל (Li וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2016, Goncalves וחב' באותו כתב-עת משנת 2012, Lavi וחב' ב-Circulation משנת 2007, ו-Mannheim וחב' ב-Stroke משנת 2008). מספר סוגים של LPCs יכולים לשמש סמנים לאוטם שריר לב (Ward-Caviness וחב' ב-Heart משנת 2017). תכולת LPC מוגברת בחלקיקי LDL שעברו מודיפיקציה בצירקולציה (Zakiev וחב' ב-Lipids Health Dis משנת 2016), בחלקיקי LDL שפורקו באופן אנזימטי (Orso וחב' ב-Biochim Biophys Acta משנת 2015), ובחלקיקי LDL מחומצנים (Stubiger וחב' ב-Atherosclerosis משנת 2012). בנוסף, LPC מסייע להופעת עמידות לאינסולין מושרית על ידי חומצות שומן (Han וחב' ב-J Lipid Res משנת 2011), ומעכב את הרה-ויטליזציה של הפרוגניטור האנדותליאלי (Hong וחב' ב-Heart Vessel משנת 2015). LPC בדומה ל-LDL מוגבר בפלזמה של מטופלים עם היפר-ליפידמיה משפחתית או עם סוכרת (Iwase וחב' ב-Atherosclerosis משנת 2008, ו-Sonoki ב-Diabetes Res Clin Pract משנת 2009), וטיפול עם simvastatin מפחית את Lp-PLA2 ואת ריכוז LPC. באשר לסוכרת, מספר מחקרים סותרים פורסמו באשר לקשר בין LPC ומחלות (Rabini וחב' ב-Diabetes משנת 1994, Petersen וחב' ב-World J Diabtes משנת 2017, Wang-Sattler וחב' ב-Mol Syst Biol משנת 2012, Barber וחב' ב-PLoS One משנת 2012, ו-Kopprasch וחב' באותו כתב-עת משנת 2016).
אוליגודנדרוציטים הם תאים המייצרים מיאלין ומספקים תמיכה מטבולית לנוירונים תוך מניעת ניוון עצבי (Lee וחב' ב-Nature משנת 2012). פגמים במיאלין נראים במחלות מוחיות רבות כגון טרשת נפוצה, שבץ מוחי, סכיזופרניה ומחלת אלצהיימר (Lu ב-Sci Rep משנת 2018). LPC מסייע לאובדן של פריציטים, לפגיעה במחסום הווסקולרי, לדה-מיאלינציה ופגמים בתפקוד מוטורי. בנוסף, LPC מגביר את הנוירו-טוקסיות של הפפטיד העמילואידי β1-42 על ידי יצירת אוליגומר וצימות של פפטיד זה, מה שמרמז שעיכוב יצירת LPC עשוי לסייע בטיפול במחלות נוירו-ניווניות (Sheikh וחב' ב-Neuroscience משנת 2015, ו-Kaya וחב' ב-ACS Chem Neurosci משנת 2017). לעומת זאת, מחקרים אחדים דווקא דיווחו על ירידה בריכוזי LPC בפלזמה של חולי אלצהיימר, וכן שהיחס LPC/PC אף הוא ירד בפלזמה או ב-CSF של חולים אלה (Mulder וחב' ב-J Neural Transm משנת 2003).
LPC כסמן ל-Adenoleukodystrophy (להלן ALD)
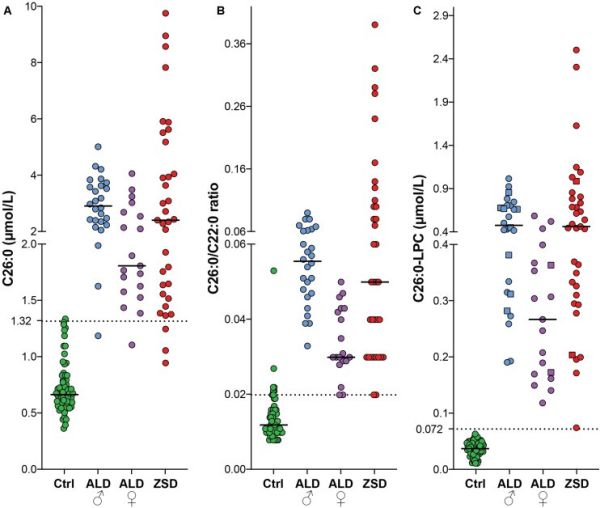
פרוקסיזומים, הם גופיפים תוך-תאיים הכרוכים בתהליכים פיזיולוגיים חשובים כגון חמצון חומצות שומן, וביוסינתזה של חומצות מרה ופלזמלוגנים. "מדד הזהב" באבחון של מטופלים עם מפגעים פרוקסיזומליים, היא האנליזה של VLCFA בפלזמה. לחלופין, C26:0-lysophosphatidylcholine ניתן למדידה בטיפות דם יבשות, בשיטת liquid chromatography tandem mass spectrometry (להלן LC-MS/MS). Jaspers וחב' בחנו את המתאם בין רמות C26:0-LPC הנמדדות בטיפות דם יבשות לבין מדידת חומר זה בפלזמה (Front Bell Dev Biol משנת 2020). במחקרם נכללו 43 דגימות ביקורת מנבדקים בריאים, ו-38 נבדקים עם ALD (21 זכרים ו-17 נקבות), וכן 38 דגימות של מאובחנים עם מפגע Zellweger (להלן ZSD). נמצא מתאם חיובי חזק בין רמת C26:0-LPC בטיפות היבשות או בפלזמה, על די Spearman's rank correlation coefficient עם r=0.962, ו-p < 0.001. בהמשך, בחנו Jaspers וחב' כיצד אנליזה של VLCFA ו-C26:0-LPC נוהגים באבחון של 67 דגימות ביקורת, 26 זכרים ו-19 נקבות עם ALD, ו-35 חולי ZSD. לגבי C26:0-LPC כל הדגימות של חולי ALD ו-ZSD נמצאו עם רמות מעל סף הנורמה העליון. באשר ל-C26:0, רמתו בדגימה אחת מתוך 67 דגימות הביקורת נמצאה מעל סף הנורמה העליון, כאשר בדגימה אחת מתוך 26 הדגימות של גברים עם ALD, ובדגימה אחת מתוך 19 דגימות של נשים עם ALD, וב-3 דגימות מתוך 35 דגימות של מאובחנים עם ZSD, הייתה בתחום הנורמה. נתונים אלה מצביעים על היתרון של מדידת C26:0-LPC על פני מדידת C26:0 לצורך אבחון המפגעים הפרוקסיזומליים האמורים.
הוראות לביצוע הבדיקה
מדידת רמות C24:0 LPC ו-C26:0 LPC יכולה לסייע באבחון של ALD, כמו גם אבחון של מחלות פרוקסיזומליות אחרות. הבדיקה מתבצעת על טיפת דם יבשה המוטבעת של נייר פילטר # 336 של PerkinElmer או על נייר פילטר # 903 של Munktell או Whatman. יש להטביע 2 טיפות דם (כ-100 מיקרוליטר לטיפה) מעקב הרגל או מהאצבע, באופן שהן ממלאות את כל העיגול. לאחר ייבוש הטיפות למשך 3 שעות בטמפרטורת החדר, כאשר דפי הפילטר במצב אופקי, כאשר ניירות הפילטר מוגנים מפני חום ומפני חשיפה לאור. אין לערום ניירות פילטר עם דם מיובש בערימות, ויש לשמור את ניירות הפילטר עד העברתם למעבדה במקום חשוך ויבש. הדגימות יציבות בטמפרטורת החדר למשך 7 ימים, כהקפאה למשך 56 יום ובקירור (צורה מועדפת) למשך 56 יום. לאחר מיצוי הדם מהפילטר מדידת LPC מתבצעת בשיטת LC MS/MS. יש לפסול דגימות בהן טיפות הדם המיובשות מראות טבעות נסיוב, כאשר הטיפות אינן ממלאות את כל העיגול, או דגימות ששהו בטמפרטורה של 37 מעלות ומעלה.
אינטרפרטציה של התוצאות
בנשים: רמות מוגברות של C24 LPC או של C26 LPC יכולות להיות אינדיקציה להטרוגניות של X-linked Adrenoleukodystrophy (להלן XALD) או לצורות אחרות של מפגעים פרוקסיזומליים.
בגברים: רמות מוגברות של C24 LPC או של C26 LPC יכולות להיות אינדיקציה ל-XALD או לצורות אחרות של מפגעים פרוקסיזומליים. תוצאות לא נורמליות אינן מספיקות לקבוע באופן מוחלט אבחון של מחלה מסוימת. על מנת לאשש אבחון המבוסס על אנליזה, נדרשות אנליזות ביוכימיות כגון מדידת פעילות אנזימטית, או אנליזות גנטיות-מולקולריות (Huffnagel וחב' ב- Mol Genet Metab משנת 2017, Klouwer וחב' ב- J Inherit Metab Dis משנת 2017, ו-Sandlers וחב' ב- Mol Genet Metab משנת 2012).
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - מפגעי מערכת העצבים והמוח
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 