סכיזופרניה - טיפול בתכשירים המשפיעים על הקולטנים המטבוטרופיים לגלוטמט - Schizophrenia - treatment with drugs affecting metabotropic glutamate receptors
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סכיזופרניה
גלוטמט (Glutamate) הוא המוליך העצבי (Neurotransmitter) המעורר הנפוץ במערכת העצבים המרכזית. מקובל כיום לחשוב, כי חלק מהתהליך הפתולוגי העצבי (Neuropathology) בסכיזופרניה, קשור בהפרעה במערכת הגלוטמט, בעיקר בתיווך הקולטן ל- NMDA (N-Methyl-D-aspartate). זאת בעקבות המידע על הופעת תופעות פסיכוטומימטיות (Psychotomimetic), לאחר חסימת הקולטן באמצעות תכשירים, כגון Sernyl (Phencyclidine), Dizocilpine (MK801) או Ketamine. על כן, התאוריה המקובלת כיום גורסת, כי יש אפשרות של ירידה בפעילות הגלוטמט במוח בחולי סכיזופרניה [1]. לנוכח זאת פותחו תכניות טיפוליות המיועדות לשפעל את הקולטן ל-NMDA, כגון מתן המסייע-שותף (Co-agonist) לקולטן, גליצין (Glycine) או די-סרין (D-Serine) [2]. ברם, מכיוון שמחלת הסכיזופרניה מתבטאת במספר מישורים, מעבר לממד הפסיכוטי, כגון: סימנים שליליים וליקוי הכרתי (Cognitive), נראה שהתמונה מורכבת יותר בכל הנוגע להשפעת גלוטמט.
משפחת הקולטנים לגלוטמט
משפחת הקולטנים לגלוטמט [3] כוללת קולטנים אינוטרופיים (Inotropic) [NMDA, AMPA (Alpha-amino-3-hydroxy-5-Methyl-4-isoxazole-Propionic Acid), Kainate] המשפעלים תעלות יוניות על גבי קרום התא, ומובילים לכניסה או ליציאה של יונים. קולטנים אלה הם בתר-מצמדיים (Postsynaptic) ומבוטאים על ידי כל תאי העצב. קישור של גלוטמט לקולטנים אלה, מוביל לעירור עצבי מהיר בכל המוח. על כן, התערבות תרופתית בפעילות קולטנים אלו, עלולה להתבטא בהשפעה מוחית כללית ותופעות לוואי משמעותיות. קבוצה שנייה היא הקולטנים המטבוטרופיים לגלוטמט (mGluRs, Metabotropic Glutamate Receptors), כאלה שבהפעלתם, משופעלת תגובה תוך-תאית באמצעות שליח משני (Second messenger). עדויות הנוגעות למעורבות הקולטנים המטבוטרופיים לגלוטמט בסכיזופרניה [4], או הפרעות פסיכיאטריות אחרות, מתחילות להצטבר ולהוביל לפיתוח תכשירים, לטיפול דרך הפעלה או חסימה של קולטנים אלה.
הקולטנים המטבוטרופיים לגלוטמט (קמ"ג)
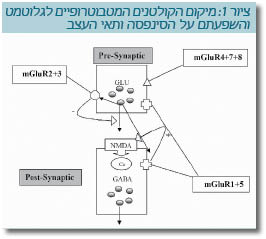
קבוצה זו כוללת, נכון לכתיבת מסמך זה, שמונה קולטנים (ציור 1) המקובצים בשלוש קבוצות:
- 1 ו-5 נקראים קבוצה I;
- 2 ו-3 מכונים קבוצה II;
- 4, 6, 7 ו-8 הם קבוצה III.
כל קבוצה מאופיינת במבנה ראשוני שונה, שליח משני שונה, ומתאר תרופתי ייחודי [5]. כל הקולטנים שובטו והמיקומים של הגנים שלהם זוהו. השליח המשני מופעל בקבוצה I באמצעות חלבוני Go/G11 והפעלת פוספוליפאזה סי (Phospholipase C). השליח המשני בקבוצות II ו-III מופעל באמצעות חלבוני Gi/Gq, ומוביל לעיכוב האנזים אדניליל-ציקלאז (Adenylyl cyclase). ככלל, תפקידם של קולטנים אלה הוא יותר אפנוני (Modulatory) בפעילות החשמלית של מערכת העצבים, בגמישות עצבית ובהולכה עצבית. הקולטנים המטבוטרופיים לגלוטמט נמצאים כולם, למעט הקולטנים המטבוטרופיים לגלוטמט 6 שנמצא ברשתית בלבד, על תאי עצב וגליה (Glial), בפיזור אופייני לכל קבוצה. קבוצה I נמצאת בדרך כלל בקצה בתר-מצמדי באזורים סומטודנדריטיים (Somatodendritic), ואילו הקולטנים המטבוטרופיים לגלוטמט מקבוצה II ו-III, לרוב בתר-מצמדיים, בקצות יציאון עצבי (Axon), שם הם מעורבים בהסדרת המוליכות העצבית.
באשר למיקומם של הקולטנים המטבוטרופיים לגלוטמט במוח: קבוצה I נפוצה יותר בקרן אמון (Hippocampus), שקד המוח (Amygdala), רמה (Thalamus), עקד גחוני (Ventral striatum), קליפה קדם-מצחית (Prefrontal cortex) (הקולטנים המטבוטרופיים לגלוטמט 1), גרעין אקומבנס (Nucleus accumbens), גבשושית חוש הריח (Olfactory tubercle) (הקולטנים המטבוטרופיים לגלוטמט 5).
קבוצה II נפוצה בעיקר בקליפת המוח ובפיתול המשונן (Dentate gyrus) (הקולטנים המטבוטרופיים לגלוטמט 2), רמה, עקד, שקד המוח, קרן אמון ותאי גליה (הקולטנים המטבוטרופיים לגלוטמט 3).
קבוצה III נפוצה בעיקר ברמה וברשתית (הקולטנים המטבוטרופיים לגלוטמט 6).
Gupta וחבריו [6] מצאו כי בקליפה הקדם-מצחית (אזורי ברודמן 9, 11, 32, 46) יש עלייה משמעותית בביטוי של הקולטנים המטבוטרופיים לגלוטמט 1, 2 ו-3, אך לא של 4 ו-5.
- מעורבות הקולטנים המטבוטרופיים לגלוטמט בהולכת גלוטמט (ציור 1)
הקולטנים המטבוטרופיים לגלוטמט 1 ו-5 (קבוצה I), ממוקמים בקצה הקדם-מצמדי והבתר-מצמדי. פעולתם המשוערת היא שפעול הקולטן ל-NMDA, אך יש להם גם השפעה על קולטני AMPA. הקולטנים המטבוטרופיים לגלוטמט 2 ו-3 (קבוצה II) ממוקמים בקצה הקדם-מצמדי, והפעלתם מעכבת את שחרור הגלוטמט. ההשערה היא, שתת-פעילות של קולטני ה-NMDA מובילה להפחתה בהפרשת GABA (Gamma-Aminobutyric Acid) מתאי עצב. תאי עצב אלה נקשרים דרך מצמד לתאים מפרישי גלוטמט. משערים שהקולטנים המטבוטרופיים לגלוטמט 2/3 ממוקמים בקצה הקדם-מצמדי של תאי עצב אלה, והפעלתם מפחיתה את שחרור הגלוטמט העודף, הרעיל לתאי עצב. קבוצה III היא הפחות נחקרת מבין הקולטנים המטבוטרופיים לגלוטמט. הקולטנים המטבוטרופיים לגלוטמט 6 ממוקמים בעיקר ברשתית, כאמור, ולכן מעורבותם בסכיזופרניה היא מועטה. לקולטנים המטבוטרופיים לגלוטמט 7 יש רגישות מעטה מאוד לגלוטמט ולמסייעים נוספים.
נראה כי לתכשירים המשפיעים על פעילות הקולטנים המטבוטרופיים לגלוטמט, יש תפקיד באפנון של הפעילות של גלוטמט במוח.
מחקרים בתכשירים המשפיעים על הקולטנים המטבוטרופיים לגלוטמט
רוב המידע הקיים כיום על קולטנים אלו מגיע מניסויים בבעלי חיים. שיטות המחקר כוללות עכברים טרנסגניים (Transgenic), שעברו הסרה של גנים לקולטנים המטבוטרופיים לגלוטמט השונים, מחקרים גנטיים, שבהם נבדקת שכיחות אללים מועמדים (של גנים לקולטנים מטבוטרופיים לגלוטמט), באוכלוסייה רגילה לעומת חולי סכיזופרניה, ומערכות התנהגותיות, המדמות רכיבים שונים של סכיזופרניה בכלל, ובעיקר את המצב הפסיכוטי. "עיכוב של קדם-דופק" (PPI, Pre-Pulse Inhibition), משמעו בחינה של התגובה לצליל לאחר שמיעה קודמת של אותו צליל. חיה לקויה (וגם חולי סכיזופרניה), תגיב בצורה שונה לעומת חיה תקינה. במודל השני נבדקת התנועתיות של החולדה (Locomotion), שנמצאה מוגברת בדומה לחולי סכיזופרניה. במודל השלישי נבחנות תנועות הֶטְפֵּסִיות (Stereotypical) המאפיינות מצב פסיכוטי, המתבטאות בחולדה בהתנהגויות כגון: תנועה מעגלית אופיינית ותנועות ראש. ניתן להשרות ליקוי כזה באמצעות תכשירים מעכבי NMDA, כגון: Ketamine, Sernyl או Dizocilpine, ולבדוק את השפעתם של תכשירים שונים, המשפיעים על הקולטנים המטבוטרופיים לגלוטמט. תכשירים אלו מוגדרים כאורתוסטריים (Orthosteric) אם אתר הקישור שלהם הוא ישירות באתר הפעיל של הקשיר (Ligand), או אלוסטריים (Allosteric), אם אתר הקישור שלהם מרוחק מהאתר הפעיל, אך בכל זאת משפיע עליו. לתכשירים אלוסטריים יתרון בכך שהשפעתם מתונה יותר, וכן מובילים להרבה פחות ויסות כלפי מעלה או מטה של הקולטנים. למרבית הקולטנים המטבוטרופיים לגלוטמט, יוצרו תכשירים מעכבים או משפעלים.
תוצאות מחקרים בבעלי חיים
- הקולטנים המטבוטרופיים לגלוטמט 1
משערים כי לקולטנים המטבוטרופיים לגלוטמט 1, יש תפקיד בשפעול הקולטן ל-NMDA. בעכברים ללא הגן לקולטנים המטבוטרופיים לגלוטמט 1, נראתה הפרעה בתפיסה החושית, כפי שהתבטאה בעיכוב של קדם-דופק לא תקין, תוצאה שלא הוחמרה בתוספת Sernyl [7]. על אף זאת, מתן תכשירים נוגדי (Antagonist) קולטנים מטבוטרופיים לגלוטמט 1, לא הובילו לתמונה דומה בעיכוב של קדם-דופק, גם לא לתיקון עיכוב של קדם-דופק לקוי, בחיות שקיבלו לפני כן Sernyl או Dizocilpine [8]. מעכב הקולטנים המטבוטרופיים לגלוטמט 1, הוביל לשיפור בתנועות ההטפסיות בחיות שטופלו לפני כן ב-Dizocilpine. בבחינת ההשפעה של מעכבי הקולטנים המטבוטרופיים לגלוטמט 1 על התנועתיות, נראתה אפילו השפעה ממתנת בחיות לקויות.
- הקולטנים המטבוטרופיים לגלוטמט 5
בעכברים ללא הגן לקולטנים המטבוטרופיים לגלוטמט 5, נראתה תגובה לקויה בעיכוב של קדם-דופק [9]. משערים שפעילות הקולטנים המטבוטרופיים לגלוטמט 5, משפעלת את הקולטן ל-NMDA, בעיקר באזורי מוח הקשורים לסכיזופרניה. מעכבי הקולטנים המטבוטרופיים לגלוטמט, אינם מובילים להפרעה בתנועתיות או להופעת תנועות הטפסיות. מתן מעכב הקולטנים המטבוטרופיים לגלוטמט 5, הוביל להגברה בהפרעה בעיכוב של קדם-דופק לאחר מתן Sernyl, כמו גם להחמרה בשאר המדדים כגון תנועתיות והטפסיות. על כן, משערים כי מסייע לקולטנים המטבוטרופיים לגלוטמט 5, עשוי להיות בעל סגולות נוגדות פסיכוזה בחולדות. ואכן, מחקרים ראשונים מראים, כי תכשיר משפעל הקולטנים המטבוטרופיים לגלוטמט 5, הוביל לשיפור בתנועתיות ובעיכוב של קדם-דופק, בחולדות שטופלו לפני כן באמפטמינים (Amphetamines). השיפור שהתקבל היה בצורה תלוית מינון [10].
- מסייעים לקבוצה II (הקולטנים המטבוטרופיים לגלוטמט 2/3)
משערים כי קולטנים אלה, הממוקמים בקצה הקדם-מצמדי, מעכבים שחרור גלוטמט מקצה העצב למצמד, ובכך משתתפים בבקרה על כמות הגלוטמט המצמדית [11]. תאי העצב המבטאים את הקולטנים הללו הם תאי ביניים עצביים מסוג GABA (GABA interneurons), כלומר תאים מתווכים, שבהפעלתם (בקישור לקולטן ל-GABA) יש ירידה בהפרשת גלוטמט במצמד. מחקרי חיות הראו השפעה מהפכת של מתן תכשירים מסייעים אורתוסטריים לקבוצה II, על ליקוי כתוצאה ממתן Sernyl או אמפטמינים. נוסף על כך, נראתה ירידה בשחרור גלוטמט בקליפה הקדם-מצחית וכן שיפור בזיכרון עבודה.
- הקולטנים המטבוטרופיים לגלוטמט 2
נראה כי למסייעים של הקולטנים המטבוטרופיים לגלוטמט 2, יש השפעה דומה כמו למסייעים של הקולטנים המטבוטרופיים לגלוטמט 2/3, דבר שמוביל להשערה, כי עיקר השפעתם של האחרונים היא דרך הקולטנים המטבוטרופיים לגלוטמט 2. התכשיר LY487379 בעל השפעה אלוסטרית חיובית על הקולטנים המטבוטרופיים לגלוטמט 2 באופן סגולי. לתכשיר יכולת לשפר הפרעה בתנועתיות בעכברים שטופלו ב-Sernyl ואמפטמינים לפני כן, אך במידה פחותה ממסייעים לקולטנים המטבוטרופיים לגלוטמט 2/3 [12]. עם זאת, לתכשיר זמן פעילות קצר, דבר שלא מאפשר מחקר יישומי איתו. תכשיר חדש, BINA (Biphenylindanone A) - מסייע לקולטנים המטבוטרופיים לגלוטמט 2 [13], הראה שיפור בתנועתיות ובעיכוב של קדם-דופק בחיות שטופלו ב-Sernyl, אך לא באמפטמינים. לתכשיר זה אף נצפה זמן פעולה ארוך של עד 8 שעות.
- הקולטנים המטבוטרופיים לגלוטמט 3
לא יוצרו תכשירים המשפיעים על הקולטנים המטבוטרופיים לגלוטמט זה. אולם, יש בגוף קשיר טבעי לקולטן, NAAG (N-Acetyl-Aspartate-Glutamate). החומר הוא מסייע/נוגד חלקי, כלומר, בריכוז נמוך הוא מעכב את הקולטן ל-NMDA, ובריכוזים גבוהים מפעיל את הקולטן ל-NMDA. נוסף על כך, החומר מעכב קולטנים עצמיים מסוג הקולטנים המטבוטרופיים לגלוטמט 3, האחראים על שחרור גלוטמט מהמצמד. בהתאם, הוצעה תאוריה לסכיזופרניה [14] שבה מעורבת רמה נמוכה של NAAG, המובילה לעודף בהפרשת גלוטמט, עקב ההשפעה על הקולטנים העצמיים. Olszewki וחבריו [15] דיווחו על תכשיר שכונה ZJ43, מעכב חזק של האנזים Glutamate Carboxypeptidase II & III. אנזים האחראי על הוצאה של NAAG מכלל פעולה לאחר שחרורו למצמד. התכשיר ZJ43 אינו מגיב ישירות עם הקולטן ל-NMDA או עם הקולטנים המטבוטרופיים לגלוטמט. ואכן, מתן התכשיר, שיפר הפרעה בתנועתיות בחולדה שקיבלה Sernyl.
מחקרי אנוש בתכשירים מסייעים לקולטנים המטבוטרופיים לגלוטמט
התכשיר LY354740, שהינו מסייע לקולטנים המטבוטרופיים לגלוטמט 2/3 (לא מבדיל בין הקולטנים), נבדק בניסויי אנוש, כקדם-טיפול במתנדבים שנטלו Ketamine. לא נמצאה השפעה של התכשיר על תסמיני הסכיזופרניה, כפי שנבדקו במבחן הסרגל של התסמינים החיוביים והשליליים (PANSS, Positive And Negative Syndrome Scale), עם זאת, כן נמצא שיפור מה בזיכרון עבודה [16]. לעומת זאת, Patyl וחבריו [17] בדקו את התכשיר LY404039, גם הוא מסייע לקולטנים המטבוטרופיים לגלוטמט 2/3, כטיפול יחידי בחולי סכיזופרניה כרוניים. הם מצאו שיפור משמעותי בכל מדדי ה-PANSS לעומת אינבו. עוצמת השיפור הייתה דומה לזו שהתקבלה בקבוצה שטופלה ב-Olanzapine. יתר על כן, התכשיר לא גרם לעלייה במשקל ורמת פרולקטין (Prolactin), (בשונה מ-Olanzapine) או לתופעות לוואי חוץ-פירמידליות (Extra-pyramidal).
משמעותם הקלינית של תכשירים המשפיעים על ויסות הפרשת הגלוטמט, עוד צריכה להתברר בניסויי אנוש רחבים, המתוכננים עם תכשירים המשפיעים על הקולטנים המטבוטרופיים לגלוטמט בחולי סכיזופרניה. עם זאת, כבר כעת ניתן להניח, כי השפעתם של קולטנים אלה עשויה להיות על כל קשת התסמינים בסכיזופרניה, ובכללם הממד הפסיכוטי, הסימנים השליליים והליקוי ההכרתי. יש לצפות, כי בעתיד נראה דיווחים על תכשירים המשפיעים על הקולטנים המטבוטרופיים לגלוטמט שנבחנו בניסויים קליניים בחולי סכיזופרניה.
ביבליוגרפיה
- ↑ Farber NB. The NMDA receptor hypofunction model of psychosis. Ann NY Acad Sci 2003;1003:119-130
- ↑ Heresco-Levy U, Ermilov M, Shimoni J, et al. Placebo-controlled trial of D-cycloserine added to conventional neuroleptics, olanzapine, or risperidone in schizophrenia. Am J Psychiatry 2002;159:480-482
- ↑ Kew JN, Kemp JA. Ionotropic and metabotropic glutamate receptor structure and pharmacology. Psychopharmacology (Berl) 2005;179:4-29
- ↑ Krivoy A, Fischel T, Weizman A. The possible involvement of metabotropic glutamate receptors in schizophrenia. Eur Neuropsychopharmacol 2008;18:395-405
- ↑ Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol 1997;37:205-237
- ↑ Gupta DS, McCullumsmith RE, Beneyto M, et al. Metabotropic gluta- mate receptor protein expression in the prefrontal cortex and striatum in schizophrenia. Synapse 2005;57:123-131
- ↑ Brody SA, Conquet F, Geyer MA. Disruption of prepulse inhibition in mice lackingmGluR1. Eur J Neurosci 2003;18:3361-3366
- ↑ De VJ, Horvath E, Schreiber R. Neuroprotective and behavioral effects of the selective metabotropic glutamate mGlu (1) receptor antagonist BAY 36-7620. Eur J Pharmacol 2001;428:203-214
- ↑ Kinney GG, Burno M, Campbell UC, et al. Metabotropic glutamate subtype 5 receptors modulate locomotor activity and sensorimotor gating in rodents. J Pharmacol Exp Ther 2003;306:116-123
- ↑ Kinney GG, O'Brien JA, Lemaire W, et al. A novel selective positive allosteric modulator of metabotropic glutamate receptor subtype 5 has in vivo activity and antipsychotic-like effects in rat behavioral models. J Pharmacol Exp Ther 2005;313:199-206
- ↑ Schoepp DD, Jane DE, Monn JA. Pharmacological agents acting at subtypes of metabotropic glutamate receptors. Neuropharmacology 1999;38:1431-1476
- ↑ Johnson MP, Barda D, Britton TC, et al. Metabotropic glutamate 2 receptor potentiators: receptor modulation, frequency-dependent synaptic activity, and efficacy in preclinical anxiety and psychosis model(s). Psychopharmacology (Berl) 2005;179:271-283
- ↑ Galici R, Jones CK, Hemstapat K, et al. Biphenyl-indanone A, a positive allosteric modulator of the metabotropic glutamate receptor subtype 2, has antipsychotic- and anxiolytic-like effects in mice. J Pharmacol Exp Ther 2006;318:173-185
- ↑ Tsai SJ. Central N-acetyl aspartylglutamate deficit: a possible pathogenesis of schizophrenia. Med Sci Monit 2005;11:39-45
- ↑ Olszewski RT, Bukhari N, Zhou J, et al. NAAG peptidase inhibition reduces locomotor activity and some stereotypes in the PCP model of schizophrenia via group II mGluR. J Neurochem 2004;89:876-885
- ↑ Krystal JH, bi-Saab W, Perry E, et al. Preliminary evidence of attenuation of the disruptive effects of the NMDA glutamate receptor antagonist, ketamine, on working memory by pretreatment with the group II metabotropic glutamate receptor agonist, LY354740, in healthy human subjects. Psychopharmacology (Berl) 2005;179:303-309
- ↑ Patil ST, Zhang L, Martenyi F, et al. Activation of mGlu2/3 receptors as a new approach to treat schizophrenia: a randomized Phase 2 clinical trial. Nature Med 2007;13:1102-1107
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר אמיר קריבוי - מתמחה, המרכז לבריאות הנפש גהה, פתח תקווה, ד"ר צבי פישל - מ"מ מנהל מחלקה ג, המרכז לבריאות הנפש גהה, פתח תקווה, פרופ' אברהם ויצמן - מנהל יחידת המחקר, המרכז לבריאות הנפש גהה, פתח תקווה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק