סרטן ערמונית מקומי בסיכון נמוך - טיפול פוטודינמי ממוקד - TOOKAD
| TOOKAD Soluble VTP: טיפול פוטודינמי ממוקד, מוכוון כלי-דם, לסרטן ערמונית מקומי בסיכון נמוך | ||
|---|---|---|
| ' | ||

| ||
| יוצר הערך | פרופ׳ אבישי סלע | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן ערמונית
ה-TOOKAD Soluble VTP (Vascular-Targeted Photodynamic) הוא טיפול תרופתי משולב עם פחצדורה זעיר-פולשנית לטיפול בסרטן ערמונית מקומי בדרגת סיכון נמוכה.
הטיפול הומצא ופותח בישראל, במכון ויצמן למדע. זהו הטיפול התרופתי היחיד המאושר לטיפול בסרטן ערמונית מוקדם בדרגת סיכון נמוכה, והיחיד שיעילותו ובטיחותו הוכחו במחקר פאזה שלישית מבוקר ורנדומלי, עבור אוכלוסיית חולים זו. הטיפול גורם להרס ממוקד של הרקמה הסרטנית על ידי חסימת כלי דם בסביבת הגידול, ללא שימוש באנרגיה תרמית וללא צורך בחימום או בקירור של הרקמה.
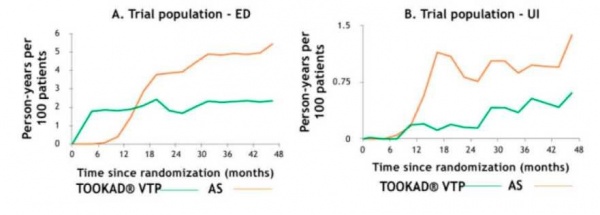
טיפול זה מפחית משמעותית את הסיכון להתקדמות סרטן הערמונית ואת הצורך בביצוע טיפולים רדיקליים (כריתת ערמונית רדיקלית, טיפולי קרינה לערמונית) בהשוואה למעקב פעיל. בניגוד לטיפולים הרדיקליים, TOOKAD VTP משמר את איכות החיים הגבוהה של המטופל, הוא בעל תופעות לוואי מינימליות ואינו גורם לתופעות לוואי בלתי הפיכות של פגיעה בזקפה או הפרעה במתן שתן.
הטיפול נותן מענה לצורך קיים של הפחתת הסיכון להתקדמות הסרטן, תוך הימנעות מטיפול-יתר אגרסיבי הפוגע קלינית במטופל. טכנולוגיית TOOKAD VTP נמצאת בהליט הכללה במספר בתי חולים, והוכנסה לשימוש במחלקה האורולוגית בבית החולים שיבא בתל השומר. אפשרויות הטיפול הנפוצות בסרטן ערמונית מקומי בדרגת סיכון נמוכה הן מעקב פעיל או טיפולים רדיקליים, הכוללים הסרה ניתוחית מלאה של בלוטת הערמונית או טיפולי קרינה. לטיפולים הרדיקליים תופעות לוואי קשות ובחלק ניכר בלתי הפיכות, כגון פגיעה בזקפה ואין אונות, אצירת שתן ואי שליטה בסוגרים. מאידך, באסטרטגיית המעקב הפעיל קיים סיכון של התפתחות סרטן בעל מאפיינים גרועים בכ-40 אחוזים מהחולים, חלקם בשל גידול משמעותי, וצורך בכריתת ערמונית מאוחרת[1].
TOOKAD Soluble (חומר פעיל: Padeliporlin) היא תרופה חדשה ומתקדמת, אשר פותחה בישראל על ידי פחפ׳ אביגדור שרץ ופרופ׳ יורם סלומון ממכון ויצמן למדע. התחפה רשומה ומאושרת בישראל ובאיחוד האירופי (EMA - European Medicines Agency) להתוויה של טיפול בסרטן ערמונית מקומי חד-צדדי (unilateral) בדרגת סיכון נמוכה (Gleason Score קטן מ-6 או שווה ל-6). Padeliporlin היא מולקולה רגישה לאור. חשיפה לאור באורך גל מתאים מאפשרת למולקולה להגיב עם חמצן בדם. רדיקלים חופשיים של חמצן הנוצרים בתגובה זו מניעים שרשרת תהליכים המביאים לחסימת כלי הדם המזינים את הגידול הסרטני ולהרעלת התאים, ובעקבות זאת להרס (אבלציה) של הרקמה הסרטנית, ללא צורך בחימום או בקירור של הרקמה.
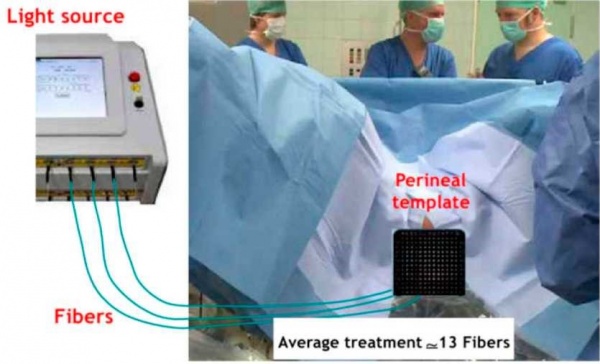
הפעלת מולקולת ה-Padeliporlin מתבצעת על ידי הארה באור באורך גל של 753 ננומטר באמצעות סיבים אופטיים ייעודיים, המוחדרים לאונת הערמונית המטופלת במהלך פרוצדורה זעיר-פולשנית המתבצעת בחדר ניתוח תחת הרדמה מלאה. במהלך פרוצדורת TOOKAD VTP (VTP - Vascular Targeted Photodynamie therapy) התרופה Padeliporfin ניתנת לחולה בעירוי לווריד הנמשך 10 דקות, ומיד לאחר מכן מתבצעת הארה נוספת של אונת הערמונית המטופלת במשך 22 דקות, דרך הסיבים האופטיים (ראו תמונה 1). לאחר הפעולה החולה בדרך כלל משתחרר לביתו בתוך מספר שעות.
במהלך ולאחר הפרוצדורה, נגרם הרס ממוקד (נקרוזיס) של אונת הערמונית הנושאת את הגידול הסרטני, וזאת ללא פגיעה ברקמות שמחוץ לאונה המטופלת, בקופסית האונה ובאלומת העצב הסמוכה לה, וללא צורך בהפעלת אנרגיה תרמית (חימום או קירור). אופייה הזעיר-פולשני והממוקד של פרוצדורת TOOKAD VTP מאפשר לטפל, תוך פולשנית מזערית, בגידולים הנמצאים עמוק בתוך רקמת הערמונית מבלי לפגוע בעצבי הזיקפה, ותוך שימור התפקוד הנורמלי של מערכת המין והשתן ושימור איכות החיים של המטופל.
יעילות ובטיחות הטיפול
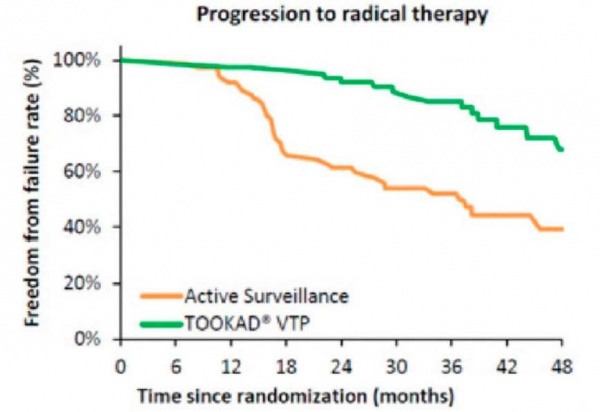
יעילות ובטיחות הטיפול עם TOOKAD VTP נבחנו במחקר פאזה 3 מבוקר ורנדומלי, אשר בוצע ב-47 מרכזים רפואיים ב-10 מדינות אירופאיות[2]. 413 חולי סרטן ערמונית מקומי בדרגת סיכון נמוכה עברו רנדומיזציה לטיפול באמצעות TOOKAD VTP או למעקב פעיל (Active Surveillance). במעקב של שנתיים 55 אחוזים מהחולים שהיו במעקב הפעיל הראו התקדמות במחלה לעומת 22 אחוזים בלבד אצל החולים שטופלו ב-TOOKAD VTP (p<0.0001; 0.34=HR - Hazard Ratio). בחולים שטופלו עם TOOKAD VTP נצפה שיעור גבוה יותר של חולים ללא עדות של סרטן ערמונית בביופסיה לעומת חולים שהיו במעקב פעיל: 49 אחוזים לעומת 14 אחוזים, בהתאמה (0.0001>P ;3.67 :Adjusted risk ratio). באונת הערמונית שטופלה עם TOOKAD VTP שיעור הביופסיות השליליות לגידול היה 75 אחוזים. בנוסף לכך, הטיפול עם TOOKAD VTP הפחית משמעותית את הצורך בטיפול רדיקלי של ניתוח להסרת הערמונית או טיפולי קרינה במעקב של שנתיים: 6 אחוזים מהחולים שטופלו עם TOOKAD VTP עברו ניתוח להסרה רדיקלית של הערמונית או טיפולי קרינה, לעומת 29 אחוזים מהחולים שהיו במעקב פעיל (0.0001>P).
תופעות לוואי
תופעות הלוואי היו ברובן קלות עד בינוניות ושככו במהירות לאחר הפרוצדורה. הטיפול עם TOOKAD VTP לא השפיע לרעה על התפקוד המיני ועל יכולת הזקפה של המטופלים ולא גרם לאצירת שתן או לתופעות לוואי אורולוגיות אחרות לטווח ארוך. במעקב של 4 שנים אחר משתתפי המחקר[3] נשמרה ההפחתה המובהקת בשיעורי התקדמות המחלה בקרב החולים שטופלו עם TOOKAD VTP בהשוואה לחולים שהיו במעקב פעיל. שיעור החולים שעברו טיפול רדיקלי (ניתוח להסרת ערמונית או טיפולי קרינה), רובם עקב התקדמות המחלה, היה 24 אחוזים בקבוצה שטופלה עם TOOKAD VTP לעומת 53 אחוזים בחולים שהיו במעקב פעיל (0.31=p<0.001; HR). מחקרים נוספים הראו כי הטיפול עם TOOKAD VTP אינו פוגע באפשרות לבצע טיפול רדיקלי עתידי בחולים שמחלתם התקדמה, וכי תוצאי הטיפולים הרדיקליים בחולים שטופלו קודם לכן עם TOOKAD VTP דומים לתוצאים המצופים בחולים שלא טופלו עם TOOKAD VTP[4][5].
בעקבות ממצאי המחקרים הקליניים, התרופה TOOKAD Soluble נרשמה ואושרה לשיווק במדינות האיחוד האירופאי (אישור EMA) ובישראל, בהתוויה של טיפול בסרטן ערמונית מקומי חד-צדדי, בדרגת סיכון נמוכה. בנוסף לכך, התרופה והפרוצדורה אושרו למימון ציבורי בגרמניה.
סיכום
TOOKAD VTP הוא טיפול חדשני, זעיר-פולשני וממוקד, אשר הוכח כיעיל ובטוח עבור חולי סרטן ערמונית מקומי חד-צדדי בדרגת סיכון נמוכה. טיפול זה מפחית משמעותית את הסיכון להתקדמות סרטן הערמונית בהשוואה למעקב פעיל ומפחית בלמעלה מ-50 אחוזים את הצורך בטיפול רדיקלי (כריתה רדיקלית של הערמונית או טיפולי קרינה) עקב התקדמות המחלה, כפי שהודגם במחקר עם תקופת מעקב של 4 שנים. הפחתת ביצוע טיפולים רדיקליים מאפשרת לשמר את איכות חיי החולים ולהימנע מתופעות לוואי קשות ובחלקן בלתי הפיכות (אין-אונות, אצירת שתן, אי שליטה בסוגרים), תוך מזעור הסיכון להתקדמות המחלה, ותוך הפחתת הוצאות מערכת הבריאות הציבורית בגין ביצוע טיפולים רדיקליים, טיפול בסיבוכים ובתופעות לוואי.
TOOKAD VTP נותן מענה לצורך קיים של הפחתת הסיכון להתקדמות המחלה בחולים עם סרטן ערמונית בסיכון נמוך, תוך הימנעות מטיפול-יתר אגרסיבי הפוגע קלינית במטופל, והוא הטיפול הזעיר-פולשני היחיד אשר נרשם כתרופה ואשר יעילותו ובטיחותו הוכחו במחקר קליני מבוקר ורנרומלי בפאזה שלישית, עם תקופת מעקב ארוכה.
לאור הנתונים הקליניים המבטיחים של TOOKAD VTP, יתרונותיו הרבים וחשיבותו עבור החולים כמפורט לעיל, הוגש טיפול זה להכללה בסל לשנת 2019 והוא נבחן לקראת הכנסתו לשימוש במספר בתי חולים, ואף הוכנס לשימוש במחלקה האורולוגית במרכז הרפואי שיבא.
ביבליוגרפיה
- ↑ Godtman L. 208ו) Long-term outcome after deferred radical prostatectomy in men initially treated with active surveillance. J Urol. 200: 779-785
- ↑ Azzouzr et al. Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CUNI00I PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncology 2017; 18(2): 181-191.
- ↑ Gill et al.The Journal of Urology. DOI: 10.1016/j.)uro.2018.05.121
- ↑ Pierrard V et al. Radical prostatectomy after vascular targeted photodynamic therapy Fookad* Soluble: Feasibility, short and long term results. 32nd Annual EAU Con¬gress, 24-28 March 2017, London, United Kingdom
- ↑ Lebadl S et al, Feasibility, safety, and efficacy of salvage radical prostatectomy after Fookad• Soluble focal treatment for localized prostate cancer. World J Urol. (20151; 33:965-971
המידע שבדף זה נכתב על ידי פרופסור אבישי סלע, מנהל המחלקה האונקולוגית, המרכז הרפואי שמיר (אסף הרופא), צריפין
פורסם ב-חוברת סל הבריאות עמ' 28


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק