הבדלים בין גרסאות בדף "פפסינוגן - Pepsinogen"
| שורה 83: | שורה 83: | ||
==המשמעות הקלינית של פפסינוגנים== | ==המשמעות הקלינית של פפסינוגנים== | ||
| − | פפסינוגנים נעלמים לאחר כריתה מלאה של הקיבה, ורמתם עולה באופן חד במקרים של כשל כלייתי, מה שפוגע את הפינוי שלהם מהדם. רמות הפפסינוגנים בנסיוב סימפטומטיות לאנמיה ממארת, בה רמותיהם נמוכות מאוד או אף חסרות, וכן הם סימפטומטיות לפתולוגיה של הקיבה. קצב ההפרשה של שני הפפסינוגנים גדל בתרחישי דלקת של רירית הקיבה, כמו במקרים של גסטריטיס שטחית (Sipponen וחב' ב-Gut משנת 1987), ובהדבקות עם H. pylori. רמות נמוכות של פפסינוגן A מוצאים בגסטריטיס אטרופית חמורה או כרונית, במטפלזיה של המעי, | + | פפסינוגנים נעלמים לאחר כריתה מלאה של הקיבה, ורמתם עולה באופן חד במקרים של כשל כלייתי, מה שפוגע את הפינוי שלהם מהדם. רמות הפפסינוגנים בנסיוב סימפטומטיות לאנמיה ממארת, בה רמותיהם נמוכות מאוד או אף חסרות, וכן הם סימפטומטיות לפתולוגיה של הקיבה. קצב ההפרשה של שני הפפסינוגנים גדל בתרחישי דלקת של רירית הקיבה, כמו במקרים של גסטריטיס שטחית (Sipponen וחב' ב-Gut משנת 1987), ובהדבקות עם [[H. pylori]]. רמות נמוכות של פפסינוגן A מוצאים בגסטריטיס אטרופית חמורה או כרונית, במטפלזיה של המעי, וב[[סרטן הקיבה]] (פחות מ-20 ננוגרם/מ"ל). כתוצאה מכך, היחס PGA/PGC נוטה להיות נמוך יותר, וערכי יחס זה הם 4.3 בגסטריטיס שטחית, 2.9 בגסטריטיס מתונה ו-0.7 בגסטריטיס חמורה. |
ערכי פפסינוגן A גבוהים, יכולים להיחשב כסימן תת-קליני לסיכון מוגבר של כיב בתריסריון וסיבוכיו (Samloff וחב' ב-Gastroenterology משנת 1986). Farinati וחב' דווחו ב-Italian J Gastroenterol משנת 1991, שהכפלת הערך של רמת פפסינוגן A בנסיוב בערך של רמת gastrin, מניבה סמן אמין של סרטן קיבה. בזיהומי הליקובקטר פילורי, רמות פפסינוגן A ו-C בנסיוב מוגברות, עם ערך יחס של PGA/PGC נמוך משמעותית. מספר מחקרים הצביעו על ירידה משמעותית ברמת פפסינוגן בנסיוב במטופלים בהם הודבר החיידק (Ohkusa וחב' ב-J Clin Gastroenterol משנת 1997, ו-Plebani וחב' ב-Lancet משנת 1992). | ערכי פפסינוגן A גבוהים, יכולים להיחשב כסימן תת-קליני לסיכון מוגבר של כיב בתריסריון וסיבוכיו (Samloff וחב' ב-Gastroenterology משנת 1986). Farinati וחב' דווחו ב-Italian J Gastroenterol משנת 1991, שהכפלת הערך של רמת פפסינוגן A בנסיוב בערך של רמת gastrin, מניבה סמן אמין של סרטן קיבה. בזיהומי הליקובקטר פילורי, רמות פפסינוגן A ו-C בנסיוב מוגברות, עם ערך יחס של PGA/PGC נמוך משמעותית. מספר מחקרים הצביעו על ירידה משמעותית ברמת פפסינוגן בנסיוב במטופלים בהם הודבר החיידק (Ohkusa וחב' ב-J Clin Gastroenterol משנת 1997, ו-Plebani וחב' ב-Lancet משנת 1992). | ||
| − | בדיקת פפסינוגן בנסיוב לגילוי מוקדם של סרטן הקיבה | + | ==בדיקת פפסינוגן בנסיוב לגילוי מוקדם של סרטן הקיבה== |
| − | |||
למרות שהשכיחות והתמותה מסרטן הקיבה נמצאים בקו ירידה ממחצית המאה הקודמת, סרטן זה הוא עדיין הרביעי במעלה בשכיחותו בין סוגי סרטן השונים, והשני במעלה מבחינת קטלניותו (Crew ו-Neugut ב-World J Gastroentelogy משנת 2006, Roder ב-Gastric Cancer משנת 2002). אין עדיין בנמצא בדיקת סקר לגילוי סרטן קיבה, וכדי להפחית את התמותה מסרטן זה, בדיקה פוטו-פלואורוגרפית הייתה מקובלת ביפן על בסיס מספר מחקרים מקומיים (Hamashima וחב' ב-J Clin Oncol משנת 2008, Inaba וחב' ב-Prev Med משנת 1999, Mizoue וחב' ב-Int J Cancer משנת 2003, ו-Lee וחב' באותו כתב-עת משנת 2006). שיטות אחרות כאנדוסקופיה ומדידת רמת פפסינוגן מקובלות יותר, כאשר הבדיקה האחרונה בטיחותית יותר, אינה כרוכה באי-נוחות או בתופעות לוואי, קלה וזולה לביצוע, ותוצאותיה ניתנות בזמן אמת (Yanaoka וחב' ב-Cancer Epidemiol Biomarkers Prev משנת 2008, Miki וחב' ב-Am J Gastroenterol משנת 2003, Yoshiara וחב' ב-Scand J Gastroenterol משנת 2007, Miki ו-Urita ב-J Dig Dis משנת 2007, Lee וחב' ב-Cancer Epidemiol Biomarkers Prev משנת 2007, ו-Mizuno וחב' ב-Gastric Cancer משנת 2009). | למרות שהשכיחות והתמותה מסרטן הקיבה נמצאים בקו ירידה ממחצית המאה הקודמת, סרטן זה הוא עדיין הרביעי במעלה בשכיחותו בין סוגי סרטן השונים, והשני במעלה מבחינת קטלניותו (Crew ו-Neugut ב-World J Gastroentelogy משנת 2006, Roder ב-Gastric Cancer משנת 2002). אין עדיין בנמצא בדיקת סקר לגילוי סרטן קיבה, וכדי להפחית את התמותה מסרטן זה, בדיקה פוטו-פלואורוגרפית הייתה מקובלת ביפן על בסיס מספר מחקרים מקומיים (Hamashima וחב' ב-J Clin Oncol משנת 2008, Inaba וחב' ב-Prev Med משנת 1999, Mizoue וחב' ב-Int J Cancer משנת 2003, ו-Lee וחב' באותו כתב-עת משנת 2006). שיטות אחרות כאנדוסקופיה ומדידת רמת פפסינוגן מקובלות יותר, כאשר הבדיקה האחרונה בטיחותית יותר, אינה כרוכה באי-נוחות או בתופעות לוואי, קלה וזולה לביצוע, ותוצאותיה ניתנות בזמן אמת (Yanaoka וחב' ב-Cancer Epidemiol Biomarkers Prev משנת 2008, Miki וחב' ב-Am J Gastroenterol משנת 2003, Yoshiara וחב' ב-Scand J Gastroenterol משנת 2007, Miki ו-Urita ב-J Dig Dis משנת 2007, Lee וחב' ב-Cancer Epidemiol Biomarkers Prev משנת 2007, ו-Mizuno וחב' ב-Gastric Cancer משנת 2009). | ||
גרסה מ־09:31, 18 במאי 2019
| מדריך בדיקות מעבדה | |
| פפסינוגן I ופפסינוגן II | |
|---|---|
| Pepsinogen I and II | |
| מעבדה | כימיה בדם |
| תחום | פירוק חלבונים בקיבה |
| טווח ערכים תקין | 28–90 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
היבטים ביוכימיים בסיסיים
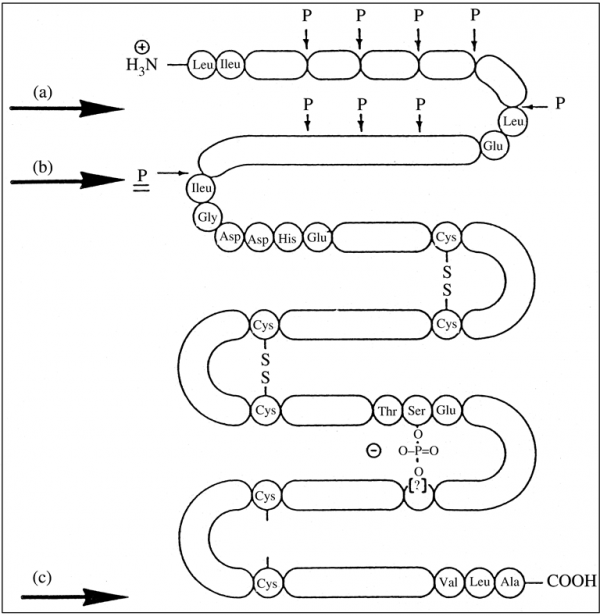
החלבון הבלתי-פעיל פפסינוגן מיוצר על ידי תאי chief בדופן הקיבה ומופרש את תוך הקיבה. תאי chief הידועים גם כתאים זימוגניים, הם תאי אפיתל בדופן הקיבה המפרישים פפסינוגן וכן chymosin. תאים אלה מפרישים גם אנזימי lipase וגם לפטין בתגובה לנוכחות מזון בקיבה. פפסינוגן, בנוכחות חומצת מלח, מומר לפפסין (תמונה למטה):
משקלו המולקולרי של פפסינוגן 42,000 דלטון, והוא מכיל שלושה קשרים די-סולפידיים, ויש לו נקודה איזואלקטרית של 3.7. פפסינוגן מסונתז כמולקולת קודמן (precursor), המכילה רצף של signal הידרופובי המורכב מ-15–16 חומצות אמינו בקצה ה-N טרמינלי, המסייע לטרנספורט של פפסינוגן. רצף אחרון זה אובד במהלך של תהליך עיבוד לאחר השעתוק. כאשר ה-pH יורד מתחת ל-5.0 פפסינוגן הופך לפפסין (Whitaker ב-Mol Cell Biochem משנת 1979). השפעול של ביקוע זה מתחיל בפּרוטונציה של חומצה קרבוקסילית, הגורמת לפפטיד של 44–47 חומצות אמינו בקצה ה--N טרמינלי (propart) להתנתק מהפפטיד השלם. פרוטאוליזה מוגבלת, המסלקת את ה-propart ונוצר אזור האתר הפעיל המכיל שני שיירים של aspartyl, בעמדות 32 ו-215. ב-pH נמוך מ-2.5, ה-propart מורחק על ידי המרכז הפעיל של אותה מולקולה, ואילו ב-pH גבוה מ-2.5 שולט מנגנון המקוטלז על ידי פפסין. הפפסין הנוצר עובר אף הוא שינויי מבנה החושפים את האתר הפעיל של פפסין, המסוגל להתאים עצמו למצע בעל רצף של בערך 8 חומצות אמינו (Tang ב-Mol Cell Biochem משנת 1979). במהלך ההמרה של פפסינוגן לפפסין, פוחת המשקל המולקולרי מ-42,000 ל-35,000 דלטון, ואילו הנקודה האיזואלקטרית משתנה מ-3.7 לפחות מ-1.0. הירידה הגדולה של ערך הנקודה האיזואלקטרית, נובעת מאיבוד של 9 שיירי ליזין מתוך 10 שיירים אלה, איבוד של שניים מתוך שלושה שיירי היסטידין, ואיבוד של שניים מתוך ארבעה שיירי ארגינין במהלך השפעול של פפסינוגן לאנזים הפעיל. כיוון שהפפסינוגנים מופרשים ביחד עם HCl לנהור הקיבה, כאשר ה-pH הוא בקירוב 2.0, הוצע שב-fundus של הקיבה, פפסינוגן מותמר לפפסין בתאים הפריאטליים הידועים גם כתאים אוקסינטיים, לפני ההפרשה של פפסין לנהור הקיבה.
פיזיולוגיה של התאים הפפטיים
רירית הקיבה באדם מייצרת ארבעה אנזימים ממשפחת ה-aspartic proteinase :
- פפסינוגן I (או PGA)
- פפסינוגן II (או PGC)
- cathepsin E
- cathepsin D
אנליזה היסטולוגית של רירית הקיבה באזור ה-fundus מראה שהפפסינוגנים נאגרים בצורת גרנולות בתאים אדלומורפיים, וגרנולות אלו יכולות להיות מופרשות לנהור הקיבה על ידי גירויים שונים (Plebani ב-Crit Rev Clin Lab Sci משנת 1993, ו-Ge וחב' ב-Cell Tissue Res משנת 1998). דווח שההופעה הראשונה של גרנולות או של פעילות פפסינוגן הניתנת למדידה בקיבת העובר, שונה באופן מהותי בין מינים שונים. באדם, גרנולות עובריות אלו מופיעות בשבוע ההיריון ה-32–36. נמצא תוך שימוש במיקרוסקופיית אור שתאי chief עוברים ליזיס ומשחררים את הגרנולות לתוך הרקמה האינטרסטיציאלית, מה שמסביר כנראה את הרמות הגבוהות של פפסינוגן בפלזמה ובשתן. סינתזה של פפסינוגן ויצירת גרנולות מושפעות פחות על ידי קרינה. למרות שתאי הרירית בצוואר הקיבה יכולים להביא לרגנרציה של תאים פפטיים לאחר פציעה, אין כל ראייה לכך שהם עושים זאת בהיעדר פציעה.
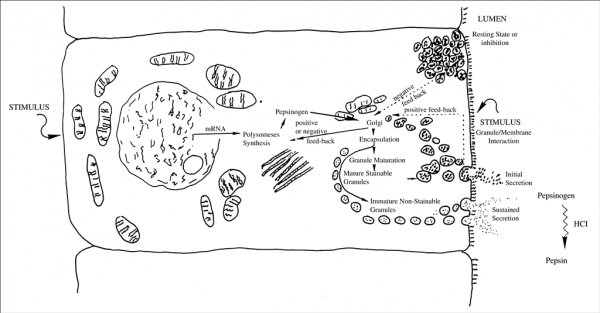
מודל בסיסי של הפרשת פפסינוגן
כבר בשנת 1881 יצר Langley ב- Phil Trans Royal Soc London מודל של הפרשת פפסינוגן. האירועים העיקריים של הפרשה זו כוללים את הסינתזה של פפסינוגן על יד מערכת פוליזומית של mRNA ברטיקולום האנדופלזמי, ואת הריכוז והאגירה של פפסינוגן בגרנולות המפרישות, לפני הביקוע של קודמן זה על ידי HCl ליצירת פפסין. במרוצת השנים עודכן מודל זה בהקשר של וויסות הפרשת פפסינוגן המושפע ממשובים חיוביים ושליליים. במצב רגיעה, פפסינוגן הנאגר בגרנולות מעכב של הסינתזה de novo של פפסינוגן. פירוט של הפרשת פפסינוגן נלמד מיקרוסקופית לאחר החדרת pilocarpine. בבעלי חיים בצום התאים הפפטיים עשירים בגרנולות, אך לאחר האכלת חיות אלו רוב הגרנולות הללו הנצבעות בצביעת Nissl נעלמות. ניתן להשיג עיכוב של הפרשת פפסינוגן על ידי atropine, היסטמין, טמפרטורת גוף גבוהה ופגיעה מוחית. גרנולות מפרישות פפסינוגן נוצרות ב-Golgi apparatus ונודדות אל מתחת לפני התאים המפרישים המכוסים על ידי רירית.
לאחר התרוקנותם, הגרנולות נעשות קטנות יותר ודחוסות פחות עם הופעה של vacuoles. כמו כן דווח שאובדן של גרנולות מעודד סינתזה מחודשת של פפסינוגן. אם הגירוי ליצירת פפסינוגן הוא חזק ומתמשך, הסינתזה של פפסינוגן מגיעה לשיאה תוך 45–60 דקות, ויכולה להתמשך שעות (Tao וחב' ב-American J Physiol משנת 1998, Gilbert ו-Hersey ב-Cell Tissue Res משנת 1982 ו-Helander באותו כתב עת משנת 1965). הפרשת פפסינוגן in vivo ו-in vitro מתרחשת ב-2 פאזות: לאחר הגירוי יש הפרשה מהירה של קודמן זה, שמשקפת כנראה את התמעטות הגרנולות הפפטיות. לאחר שחרור מהיר זה, מתרחש שלב הפרשה איטית ומתמשכת יותר שיכולה להתמשך שעות אחדות. הודגם ש-epidermal growth factor מעודד הפרשת פפסינוגן על ידי שפעול של טירוזין קינאזות, ניטריק אוקסיד (NO), cGMP, ו-Ca+2 (וחב' ב-Fiorucci Gastroenterology משנת 1996).
גירוי של הפרשת פפסינוגן
ברוב המינים המנגנונים הכולינרגיים הואגאליים הם הגירויים החזקים ביותר להפרשת פפסינוגן. מחקרים זיהו מגוון רחב של גורמים אנדוגניים או פרמקולוגיים, המשתתפים בהפרשת פפסינוגן.
השפעה כולינרגית-בכל המינים שנלמדו פפסין יכול להיות מגורה על ידי עצבי ה-vagus בדרך של גירוי חשמלי ישיר או על ידי גירוי עקיף של היפוגליקמיה הנגרמת על ידי אינסולין, על ידי 2-deoxyglucose, אלכוהול, על ידי היפר-ונטילציה, או על ידי רפלקסים של ה-vagus הנגרמים על ידי התרחבות הקיבה, ואפילו על ידי גירויים פסיכוטיים, או דיכוי פעילות מוחית. כל הגירויים הללו אינם יעילים לאחר vagotomy וניתן לחסום אותם גם על ידי atropine (Haukeland וחב' ב-Scand J Gastroenterol משנת 1982).
עיכוב של הפרשת פפסינוגן
הפרשת פפסינוגן פוחתת כאשר הסינתזה של האנזים מדוכאת במצבים של היברנציה, אטרופיה פתולוגית של רירית הקיבה, אספקת דם מופחתת או כתרחיש של כריתת העצב התועה (vagotomy). עיכוב של הפרשת פפסין על ידי מעכב, יכול להתרחש כתוצאה מחסימה של גריין ספציפי, אך יכול גם להיות משני לדה-הידרציה. נכון להיום, לא זוהה מעכב סלקטיבי של אנזימים ממשפחת ה-aspartic proteinases. Pestatin הוא המעכב הבולט והיעיל ביותר של aspartic proteinases, אך פעילותו המעכבת הגבוהה ביותר היא בעיכוב פפסין (Umezawa ב-Methods Enzymol משנת 1976, ו-Umezawa ב-Ann Rev Microbiol משנת 1982). יש אפשרות שפפסינוגנים עוברים דה-אקטיבציה על ידי carbenoxolone, לפני הפיכתו לפפסין בתאי רירית הקיבה (Roberts ו-Taylor ב-Clin Sci Mol Med משנת 1973).
מחקרים על תאי קיבה מסוג chief בתרבית הראו שאצטילכולין ותכשירים כולינרגיים מגבירים את הפרשת פפסינוגן. גירוי כולינרגי זה מעוכב על ידי אנטגוניסטים כולינרגיים, כגון atropine ו-pirenzepine, מה שמצביע על שתכשירים אלה פועלים דרך הקולטנים המוסקריניים M1 ו-M2, כאשר פעולתם ניכרת יותר דרך הקולטן M1, ובעיקר על כך ש-pirenzepine הוא מעכב חזק יותר כאשר פעולתו נעשית דרך הקולטן M1. דווח שעל ידי שימוש בבלוטות קיבה מבודדות של ארנבת, atropine ו-pirenzepine, יכולים בדרגות עוצמה שונות, לעכב את הפרשות HCl ופפסינוגן המושרות על ידי carbachol, ולאחר מכן הוצע שהממצא האחרון עשוי להיגרם על ידי פעילות תכשירים כולינרגיים על נוירונים כולינרגיים, ולא ישירות כתגובה של תאי הקיבה (Pagani וחב' ב-Trends Pharmachol Sci משנת 1984). פעילות בהשפעה כולינו-מימטית על הפרשת פפסינוגן כמו גם על הפרשת HCl (דרך קולטני M2), תואמת את המנגנונים המוצעים התוך-תאיים באשר להפרשת פפסינוגן ו-HCl. על פי מנגנון זה, הקולטנים מסוג M1 כרוכים עם העיכוב של cAMP, בעוד שהקולטנים מסוג M2 כרוכים עם הגיוס של Ca+2 (Harden וחב' ב-Trends Pharmachol Sci משנת 1986, ו-Blandizzi וחב' ב-J Pharmachol Exp Ther משנת 1997).
השפעה היסטמינרגית
מחקרים in vivo הראו שהיסטמין עשוי להשרות, אך בריכוזים גבוהים גם לעכב, הפרשת פפסינוגן. לכן הוצע שתגובות אלו מתווכות על ידי קולטני H2, וכן שהחמצה של נהור הקיבה עשויה לעודד הפרשת היסטמין, ובתגובה לכך לשפעל רפלקס כולינרגי מקומי שמביא להפרשת פפסינוגן (Johnson ב-Am J Physiol משנת 1972, Gibson וחב' ב-Gastroenterology משנת 1977, ו-Hirschowitz וחב' ב-Am J Physiol משנת 1977). לעומת זאת, מחקרים in vitro מציעים שהפרשות פפסינוגן ו-HCl מווסתות באופן בלתי-תלוי, למרות שמחקרים in vivo דווקא תומכים בכך שהפרשת שני חומרים אלה מגיבה לאותו גירוי. נראה אם כן, שעל פי הנתונים העכשוויים היסטמין אינו יכול להיחשב כווסת פיזיולוגי ישיר של הפרשת פפסינוגן על ידי תאי chief (Hersey וחב' ב-Am J Physiol משנת 1983, Koelz וחב' באותו כתב-עת משנת 1982, ו-Simpson וחב' באותו כתב עת משנת 1980).
השפעה אדרנרגית
תוצאות ניסויים in vivo נראות סותרות את תוצאות הניסויים in vitro. בתאי קיבה מבודדים בתרבית, האגוניסט ה-β-אדרנרגי isoproterenol, מסוגל לעודד הפרשת פפסינוגן באופן ישיר כיוון שהוא מעוכב על ידי propranolol אך לא על ידי אטרופין או על ידי cimetidine (Shirakawa ו- Hirschowitz ב-Gastroenterology משנת 1982). כיוון ש-isoproterenol אינו מסוגל לעודד הפרשת HCl מתאים פריאטליים, נראה שהפרשת פפסינוגן המושרית על ידי עירוי isoproterenol היא ספציפית. הוצע שההשפעה האדרנרגית על הפרשת פפסינוגן נגרמת משפעול של הקולטנים מסוג beta-1, אם כי ניסויים עדכניים יותר הראו שהאנגוניסט ICI-118551 הסלקטיבי לקולטן β-2, פוטנטי פי-100 יותר מהאנטגוניסט betaxolol הסלקטיבי לקולטן β-1 ( Skouho-Kristensen ו-Fryklund ב-Arch Pharmacol משנת 1985, Bliski וחב' ב-J Cardiovasc Pharmacol משנת 1983, Bojamic וחב' ב-Br J Pharmacol משנת 1983, ו-Bondot וחב' באותו כתב-עת משנת 1979).
לסיכום סעיף זה, תכשירים כולינרגיים מעודדים את הפרשת פפסינוגן וכן את הפרשת HCl. היסטמין מעודד הפרשת חומצה אך לא את הפרשת פפסינוגן. בניגוד לכך, isoproterenol, המעודד הפרשת פפסינוגן, אינו מעודד הפרשת חומצה. הוצע שתכשירים כולינרגיים וגם היסטמינרגיים, תורמים לגירוי תאי קיבה הקשורים להפרשת פפסינוגן, מתווכים על ידי הקולטן GABAb (Blandizzi וחב' ב-Eu J Pharmacol משנת 1995).
השפעה הורמונלית
Gastrin ו-pentagastrin מעודדים בחיות הפרשת פפסינוגן, אם כי לא הודגם גירוי ישיר של תאי chief. האוקטפפטיד cholecysochinin (הידוע כ-CCK-8), ופפטידים דומים אחרים, נמצאו משרים הפרשת פפסינוגן בתאי קיבה (Hersey וחב' ב-Am J Physiol משנת 1983). נראה ש-CCK-8 הוא בעל השפעה ישירה על תאי chief המעוכבת על ידי cGMP, ונראה שעוצמת גירוי זה תלויה בנוכחות של שיירי טירוזין מזורחנים במולקולה. המאפיינים של גירוי על ידי פפטידים של הפרשת פפסינוגן, שונים מאלה של השפעת פפטידים על הפרשת HCl. זאת כיוון שהגירוי של הפרשת החומצה אינה תלויה באופן יחסי בסולפציה של הפפטיד, וכן כיוון שהשפעת CCK-8 על הפרשת החומצה אינה מעוכבת על ידי dibutyryl cGMP. הבדלים אלה מרמזים על כך שתאי קיבה מכילים יותר מסוג אחד של קולטן לפפטידים דמויי-CCK-8, וכן לכך שהקולטן על פני תאי chief דומה מאוד לקולטן הפנקראטי של CCK-8.
החדרה של CCK-8 מגרה הפרשת פפסינוגן על ידי השפעול של הקולטנים ההיקפיים CCK-a ו-CCK-b, אך בעיקר על ידי הקולטן CCK-a (Blandizzi וחב' ב-Neurosci Lett משנת 1995, ו-Meyer וחב' ב-Pharmacology משנת 1996). גם secretin דווח כמעודד הפרשת פפסינוגן in vivo, אם כי התוצאות in vitro אינן מאששות זאת (Waldum ו-Burhol ב-Scand J Gastroenterol משנת 1980). ההורמון VIP נמצא מעודד הפרשת פפסינוגן בדרך קישור לקולטן זהה לזו של secretin. גם bombesin מעודד הפרשת פפסינוגן על ידי פעולה ישירה על תאי הקיבה, או באופן בלתי-ישיר על ידי מודולציה של הפרשת gastrin; לעומת זאת גלוקגון וסומטוסטטין מעכבים הפרשת פפסינוגן.
תווכים תוך-תאיים
הגירוי להפרשה של תאי chief נראה מתווך על ידי 2 מסלולים שונים, האחד כרוך בעלייה של cAMP תוך-תאי, והשני כרוך בעלייה ברמת הסידן בתא. כל המחקרים in vitro הראו ש-cAMP והנגזרות שלו מעודדים הפרשת פפסינוגן (Kitsukawa וחב' ב-Biochim Biophys Acta משנת 1996), זאת על ידי הגברת החדירות של התאים מפרישי החומר (Norris ו-Hersey ב-Am J Physiol משנת 1985, ו-Raufmann וחב' ב- J Cell Biochem משנת 1997). מחקרים in vitro הראו ש-forskolin, כולרה טוקסין, היסטמין, ,secretin VIP, פרוסטגלנדין ואגוניסטים β-אדרנרגיים, מגרים הפרשת פפסינוגן על ידי הגברת ריכוז cAMP (Wollin וחב' ב-Am J Physiol משנת 1979). גם gliquidone, שהוא sulphonylurea, נמצא מאוחר יותר מעודד הפרשת פפסינוגן דרך הגברת cAMP (על פי Del Valle וחב' ב-Eur J Pharmacol משנת 1998).
ניסויים עם בלוטות קיבה או עם תאי chief מבודדים, הראו שאגוניסט כולינרגי, פפטידים דמויי-CCK וכן substace P, מגבירים הפרשת פפסינוגן על ידי הגברת הריכוז של סידן תוך-תאי (Chew ו-Brown ב-Biochim Biophys Acta משנת 1986, ו-Raufmann וחב' ב-Am J Physiol משנת 1983). בהשוואה למערכות אחרות, נראה סביר שתחילת השחרור של סידן היא בשפעול של phospholipase C, המשרה את השחרור של inositol-1,4,5 triphosphate ליצירה של -diacylglycerol1,2 או DAG, שהוא משפעל חזק של האנזים protein kinase C או PKC (Streb וחב' ב-J Membr Biol משנת 1984, ו-Williamson וחב' ב-Am J Physiol משנת 1985). ידוע ש-PKC מעורב בהפרשת פפסינוגן (Matsumoto וחב' ב-Fed Proc משנת 1986, ו-Sakamoto וחב' ב-Biochem Biophys Res Commun משנת 1985). כמו כן הראו ש-A23187 שהוא ה-ionophore של סידן, מעודד אף הוא הפרשת פפסינוגן בבלוטות הקיבה.
מחקרם של Okayama וחב' ב-Biochim Biophys Acta משנת 1995, הראה שהאנזים/ calmodulin-dependent protein kinase II Ca+2 (או CAM-K-II), והאוטו-פוספורילציה שלו, מהווים צעד קריטי במסלול התוך-תאי בו Ca+2 משפיע על הפרשת פפסינוגן, מתאי chief. מחקר אחר הראה שתאי chief מבטאים פעילות האנזים Ca+2/ calmodulin-dependent protein oxide synthase, וכן ששחרור פפסינוגן על ידי אגוניסטים המושרים על ידי Ca+2, מבוקר על ידי nitric oxide (Fiorucci וחב' ב-Gastroenterology משנת 1995). לעומת זאת, פרוסטגלנדינים נמצאו מעכבים הפרשת פפסינוגן על ידי שפעול של G protein, המפחית את רמת cAMP בתא (Beinborn וחב' ב-Gastroenterology משנת 1989). כן נמצא ש-leukotrienes הקשורים לנזק בקיבה המושרה על ידי תכשירים נוגדי דלקת לא-סטראודליים (NSAIDs), הם גריינים חזקים של הפרשת פפסינוגן מתאי chief, על ידי שפעול של קולטנים ספציפיים של תאי chief, שמביאים להידרוליזה של inositol triphophate, לגיוס של Ca+2, ליצירת NO ולהצטברות של cAMP (Fiorucci וחב' ב-Gastroenterology משנת 1995).
גירויים נוספים להפרשת פפסינוגן
רפלקסים של ה-vagus מגיבים באופן תקין לארוחה ולהפרשה מוגברת של מיצי קיבה בעקבות היצרות הפילוריס. לחץ תוך-מוחי מוגבר, פגיעות ראש או ניתוחי מוח גורמים אף הם לגירוי משמעותי של הפרשת פפסינוגן, כנראה תוך מעורבות ה-vagus. גירוי של ההיפותלמוס הקדמי עשוי גם כן להגביר הפרשת פפסינוגן במיצי הקיבה, עם שני שיאים, לאחר 30 דקות ולאחר 120 דקות. לאחר sympathectomy נעלם השיא הראשון של הפרשה זו לאחר 30 דקות. גם צריכת אלכוהול מגבירה הפרשת פפסין בקיבה במסלול של ה-vagus, כיוון לניתן לעכב אותה על ידי atropine. היפר-ונטילציה, הזרקה בודדת של reserpine, קפאין ו-diamox, משפיעים אף הם להגברת הפרשת פפסינוגן, אם כי במסלול חוץ-וגאלי.
תרופות ופפסינוגנים
מחקרים מעטים על השפעתם של תכשירים פרמקולוגיים שונים על רמות פפסינוגן בנסיוב, מניבים תוצאות בלתי משמעותיות במידה מסוימת. תוצאות סותרות על השפעת תכשירים אלה התקבלו בהיבדק השפעתם על תאי chief בגוף החי או בתאים מבודדים in vitro. נראה שההשפעה של תרופות אחדות על ההפרשה הפפטית הם שניוניים לעיכוב הפרשת חומצת קיבה או למנגנונים מווסתים אחרים.
תכשירים אנטי-כולינרגיים: Pirenzepine, הפועל על קולטנים כולינרגיים של התאים הפריאטליים מעכב שחרור של פפסין באנשים בריאים, כמו גם במטופלים עם כיבי קיבה (Cesnik ב-Excepta Medica משנת 1982, ו-Gabryelewicz וחב' ב-Scand J Gastroenterol משנת 1980). עם זאת, תוצאות סותרות התקבלו בהקשר של השפעת תכשיר זה על רמות פפסינוגן בנסיוב (Vianello וחב' ב-J Res Lab Med משנת 1984).
אנטגוניסטים של H2: תכשירים כגון ranitidine ,nizatidine ,cimetidine ו-famotidine יכולים להפחית רמות פפסינוגן בהתאם למינון, בין אם צריכתם פומית או על ידי עירוי ורידי. אין ראיות ברורות לגבי רמות פפסינוגן כתוצאה מטיפול ב-cimetidine (Vianello וחב' ב-J Res Lab Med משנת 1982, ו-Sewing וחב' ב-Gastroenterology משנת 1978). ההשפעה של ranitidine על רמת פפסינוגן בנסיוב פחות ברורה (Di Mario וחב' ב-Gut משנת 1980).
מעכבים של proton pump H+/K+-ATPase : Omeprazole ו-lansoprazole קובעים את העיכוב הבררני הלא-תחרותי של proton pump H+/K+-ATPase בקיבה, הספציפי לתאים הפריאליים, אך ללא השפעה על תאי רירית קיבה אחרים (Lind וחב' ב-Gut משנת 1983). דווח ששני התכשירים האחרונים, משרים רק שינויים קלים בנפח מיץ הקיבה ובהפרשת פפסין, אך עם זאת omeprazole מגביר את ה-pH בקיבה לערך של מעל 4.0, מה שמגביר הפרשת פפסינוגן (Baak וחב' ב-Scand J Gastroenterol משנת 1991, ו-Fasten וחב' ב-Dig Dis Sci משנת 1986). הגברה עקבית ברמת פפסינוגן בנסיוב נצפתה לאחר טיפול מתמשך עם omeprazole (Jansen וחב' ב-Gastroenterology משנת 1990). רמות פפסינוגן גבוהות בנסיוב, יכולות לנבוע מהשפעה בלתי ישירה של omeprazole על קצב הסינתזה של פפסינוגן (Stoschus וחב' ב- Peptide Res J (משנת 1998).
תכשירים מסוג NSAIDs: נמצא ש-pyrazoles כגון Ca+2-lonazolac, אינם משפיעים על רמות פפסינוגן בנסיוב (Kullich וחב' ב-Wiener med Wochenshenschrift משנת 1996). Indomethacin, מחיש הפרשת פפסינוגן (Serrano-Aullo וחב' ב-Rev Espanola Enfer Digest משנת 1996). Indomethacin מעכב שחרור PGE2, אך מגביר ייצור של leukotriene B4, מה שתורם להפרשת פפסינוגן על ידי indomethacin בתאי chief מבודדים (Fiorucci וחב' ב-Am J Physiol משנת 1995).
רמות נורמליות של פפסינוגן בנסיוב אדם
בעוד שפפסינוגן C נספג מחדש ועובר מטבוליזם בכליות, רק שני שלישים של פפסינוגן A עוברים מטבוליזם דומה בכליות. לכן בדם ניתן למדוד את 2 סוגי הפפסינוגן, בעוד שבשתן רק פפסינוגן A נמצא בתנאים פיזיולוגיים. הפפסינוגנים יכולים לעבור ספיגה מחדש גם ברירית המעי. יש ראיות אחדות לכך שרמות פפסינוגן באנשים בריאים קבועות באופן יחסי אם כי הן משתנות עלפי הגיל מגדר, גובה, משקל, דיאטה, מוצא אתני ומחזור צירקדיאני (Knight וחב' ב-Eur J Gastroenterol Hepatol משנת 1995). תחום הרמה הממוצעת של פפסינוגן בנסיוב של אנשים בריאים נעה בין 36.3 ננוגרם/מ"ל (Ichinose וחב' ב-Clin Chim Acta משנת 1982) עד 84.5 ננוגרם/מ"ל (Axelsson וחב' ב-Prog Clin Biol Res משנת 1985). בבני-אדם בריאים רמת פפסינוגן A גבוהה תמיד מזו של פפסינוגן C, עם יחס נורמלי של 3:1. למעשה, יחס זה יכול להיחשב כחשוב יותר מאשר הערכים המוחלטים של שני סוגי הפפסינוגן למטרות אבחוניות, שכן פפסינוגנים אלה מיוצרים באזורים שונים של הקיבה ושל רירית התריסריון והם בעלי משמעות מטבולית שונה.
המשמעות הקלינית של פפסינוגנים
פפסינוגנים נעלמים לאחר כריתה מלאה של הקיבה, ורמתם עולה באופן חד במקרים של כשל כלייתי, מה שפוגע את הפינוי שלהם מהדם. רמות הפפסינוגנים בנסיוב סימפטומטיות לאנמיה ממארת, בה רמותיהם נמוכות מאוד או אף חסרות, וכן הם סימפטומטיות לפתולוגיה של הקיבה. קצב ההפרשה של שני הפפסינוגנים גדל בתרחישי דלקת של רירית הקיבה, כמו במקרים של גסטריטיס שטחית (Sipponen וחב' ב-Gut משנת 1987), ובהדבקות עם H. pylori. רמות נמוכות של פפסינוגן A מוצאים בגסטריטיס אטרופית חמורה או כרונית, במטפלזיה של המעי, ובסרטן הקיבה (פחות מ-20 ננוגרם/מ"ל). כתוצאה מכך, היחס PGA/PGC נוטה להיות נמוך יותר, וערכי יחס זה הם 4.3 בגסטריטיס שטחית, 2.9 בגסטריטיס מתונה ו-0.7 בגסטריטיס חמורה.
ערכי פפסינוגן A גבוהים, יכולים להיחשב כסימן תת-קליני לסיכון מוגבר של כיב בתריסריון וסיבוכיו (Samloff וחב' ב-Gastroenterology משנת 1986). Farinati וחב' דווחו ב-Italian J Gastroenterol משנת 1991, שהכפלת הערך של רמת פפסינוגן A בנסיוב בערך של רמת gastrin, מניבה סמן אמין של סרטן קיבה. בזיהומי הליקובקטר פילורי, רמות פפסינוגן A ו-C בנסיוב מוגברות, עם ערך יחס של PGA/PGC נמוך משמעותית. מספר מחקרים הצביעו על ירידה משמעותית ברמת פפסינוגן בנסיוב במטופלים בהם הודבר החיידק (Ohkusa וחב' ב-J Clin Gastroenterol משנת 1997, ו-Plebani וחב' ב-Lancet משנת 1992).
בדיקת פפסינוגן בנסיוב לגילוי מוקדם של סרטן הקיבה
למרות שהשכיחות והתמותה מסרטן הקיבה נמצאים בקו ירידה ממחצית המאה הקודמת, סרטן זה הוא עדיין הרביעי במעלה בשכיחותו בין סוגי סרטן השונים, והשני במעלה מבחינת קטלניותו (Crew ו-Neugut ב-World J Gastroentelogy משנת 2006, Roder ב-Gastric Cancer משנת 2002). אין עדיין בנמצא בדיקת סקר לגילוי סרטן קיבה, וכדי להפחית את התמותה מסרטן זה, בדיקה פוטו-פלואורוגרפית הייתה מקובלת ביפן על בסיס מספר מחקרים מקומיים (Hamashima וחב' ב-J Clin Oncol משנת 2008, Inaba וחב' ב-Prev Med משנת 1999, Mizoue וחב' ב-Int J Cancer משנת 2003, ו-Lee וחב' באותו כתב-עת משנת 2006). שיטות אחרות כאנדוסקופיה ומדידת רמת פפסינוגן מקובלות יותר, כאשר הבדיקה האחרונה בטיחותית יותר, אינה כרוכה באי-נוחות או בתופעות לוואי, קלה וזולה לביצוע, ותוצאותיה ניתנות בזמן אמת (Yanaoka וחב' ב-Cancer Epidemiol Biomarkers Prev משנת 2008, Miki וחב' ב-Am J Gastroenterol משנת 2003, Yoshiara וחב' ב-Scand J Gastroenterol משנת 2007, Miki ו-Urita ב-J Dig Dis משנת 2007, Lee וחב' ב-Cancer Epidemiol Biomarkers Prev משנת 2007, ו-Mizuno וחב' ב-Gastric Cancer משנת 2009).
נראה שגם במדינות אירופיות בהם שיעור התחלואה מסרטן הקיבה גבוהים, לא מקובל ביצוע בדיקות סקר לסרטן זה. פורטוגל היא המדינה האירופית עם שיעור התמותה הגבוה ביותר מסרטן הקיבה (31 מקרים/100,000 בשנת 2006), והסברה שבפורטוגל 84% מהמקרים מקורם בהדבקה מוקדמת עם הליקובקטר פילורי (Quina ב-Eur J Cancer Prev משנת 1994). בשנת 2005 החלו Lomba-Viana וחב' במחקר שפורסם ב-Eur j Gastroenterol Hepatol משנת 2012, ששילב בדיקת פפסינוגן מלווה על ידי אנדוסקופיה של החלק העליון של מערכת העיכול, לגילוי סרטן בקיבה במדגם אוכלוסייה גדול בצפון פורטוגל. בניסוי זה השתתפו 13,118 תושבי צפון המדינה בגיל שבין 40–79 שנים (גיל ממוצע 60 שנה). מדגם זה כלל 5,326 גברים (41%). רמת פפסינוגן בנסיוב נמדדה בשיטת ELISA (בערכת Biohit הלסינקי, פינלנד). הנבדקים חולקו ל-2 קבוצות: מקרים חיוביים עם רמות פפסינוגן I נמוכות מ-70 ננוגרם/מ"ל, ויחס פפסינוגן I/פפסינוגן II נמוך מ-3, ומקרים שליליים (כל השאר). כל הנבדקים עם תוצאה חיובית, ומדגם של נבדקים עם תוצאות חיוביות, עברו בחינה אנדוסקופית שכללה ביופסיה. כל משתתפי הניסוי שעברו אנדוסקופיה נמצאו במעקב עד 5 שנים.
תוצאות ניסוי זה היו כדלקמן: מבין כלל משתתפיו, התקבלה תוצאה חיובית ב-446 נבדקים (3.4%). מתוך האחרונים, 274 משתתפים (61%) עברו אנדוסקופיה. בקרב אלה, נמצאו 6 מקרים של סרטן קיבה, 5 מקרים של סרטן מעי, מקרה אחד של סרטן דיפוזי, ו-3 מקרים של שלב מוקדם של סרטן קיבה. כל המקרים הללו מייצגים מקרה אחד של סרטן לכל 2,200 בערך בדיקות פפסינוגן, או מקרה אחד של סרטן לכל 74 בדיקות פפסינוגן חיוביות. לעומת זאת, מבין 240 נבדקים עם תוצאת בדיקת פפסינוגן שלילית, נמצאו שלושה נבדקים עם סרטן קיבה, במהלך המעקב בין מאי 2005 למאי 2010. ניסוי זה קבע שלבדיקת פפסינוגן יש רגישות של 67%, ספציפיות של 47%, ערך ניבוי חיובי (ppv) של 2% אך ערך ניבוי שלילי (npv) של 99%. הערכת הדיוק באוכלוסייה הפורטוגלית באשר לבדיקת פפסינוגן לאבחון סרטן הקיבה, דומות לאלו שהתקבלו במחקרים מיפן, מה שמראה שבדיקה זו יכולה לשמש ביעילות גם באוכלוסיות מערביות עם שיעור גבוה של סרטן קיבה.
הדבקות בהליקובקטר פילורי מתחילות רצף של תרחישים החל מגסטריטיס שטחית, עבור דרך גסטריטיס אטרופית, מטפלזיה, דיספלזיה, ובדיעבד אדנוקרצינומה (Correa ב-Am J Surg Pathol משנת 1995). נמצא שרמות נמוכות של פפסינוגן בנסיוב, משקפות גסטריטיס אטרופית מפושטת, ועשויות לגלות סרטן קיבה בשלביו המוקדמים (Cao וחב' ב-J Dig Dis משנת 2007, Ohata וחב' ב-Cancer Sci משנת 2005, Miki ו-Fujishiro ב-Dig Endosc משנת 2009). בניסוי הנוכחי שנערך בפורטוגל, ערכי הרגישות, ספציפיות וערכי הניבוי החיובי והשלילי דומים לאלה שהתקבלו במחקרים אחרים ביפן (Kitihara וחב' ב-Gut משנת 1999, Oishi וחב' ב-Am J Epidemiol משנת 2006, ו-Watase וחב' ב-J Assoc Cancer Detect Diagn משנת 2004). גם Agkoc וחב' דווחו ב-Eurasian J Med משנת 2010, על ניסוי בו נדגמו 30 אנשים בריאים, 30 מאובחנים עם גסטריטיס לא ספציפית, 30 מטופלים עם גסטריטיס אטרופית ו-50 חולים עם סרטן קיבה, בהם בוצעה בדיקת פפסינוגן. ניסוי אחרון זה הגיע למסקנה שרמת פפסינוגן I בנסיוב גבוהה סטטיסטית בביקורת בריאה, או באלה עם גסטריטיס כרונית לא-ספציפית, בהשוואה לנבדקים עם גסטריטיס אטרופית כרונית או אלה עם סרטן קיבה (p<0.05). בניסוי זה נמצא שערכי הבדיקה הטובים ביותר לאבחון סרטן קיבה נמוכים מ-25 ננוגרם/מ"ל, בעוד שגם יחס של פפסינוגן I/פפסינוגן II הנמוך מ-3.0 ספציפי יותר לסרטן קיבה. ערכי סף אלה ראויים גם למאובחנים עם גסטריטיס אטרופי.
מטה-אנליזה של Miki ב-Gastric Cancer משנת 2006, שבחנה את הרגישות והספציפיות של בדיקת פפסינוגן לאבחון סרטן הקיבה, סקרה 42 מחקרים שכללו במקובץ 296,553 נבדקים. מסקנה בחינה זו הייתה שאם משתמשים בערך סף של 70 ננוגרם/מ"ל, רמות פפסינוגן I הנמוכות מערך סף זה, או תוצאות של יחס פפסינוגן I/פפסינוגן II הנמוכות מ-3.0, היו בעלות רגישות של 77%, עם ערך ניבוי חיובי (ppv) נמוך מאוד של 0.77-1.25%, אך עם ערך ניבוי שלילי (npv) גבוה מאוד של 99.08-99.9%. אכן אטרופיה של רירית הקיבה מביא להפחתה בסינתזה של פפסינוגן I ולירידה ברמתו בנסיוב. גסטריטיס אטרופית מתקדמת ו-achlorhydria, גורמות לרמה מאוד נמוכה של פפסינוגן I בניגוד לפפסינוגן II, שרמתו בנסיוב נותרת מוגברת בנסיוב (Samloff וחב' ב-Gastroenterology משנת 1982).
הוראות לביצוע הבדיקה:
הנבדק צריך להיות בצום של 10–12 שעות לפני נטילת הדם. במידת האפשר, יש צורך להפסיק 48 שעות לפני הבדיקה צריכת תכשירים antacids או תכשירים אחרים המשפיעים על חומציות הקיבה, או על התנועתיות (motility) של המעיים. את הבדיקה ניתן לבצע בנסיוב או בפלזמה: לצורך הבדיקה בנסיוב יש ליטול את הדם במבחנה כימית (פקק אדום) או במבחנת ג'ל (פקק צהוב), ולאחר הסירכוז יש להעביר את הנוזל העליון למבחנת פלסטיק ולהקפיא. לצורך ביצוע הבדיקה בפלזמה, יש לטיול את הדם במבחנת ספירת-דם המכילה EDTA (פקק סגלגל), להפריד מיד ולהקפיא. הדגימות הקפואות יציבות למשך שנה. יש לפלות דגימות המגיעות למעבדה במבחנות בטמפרטורת החדר, או כאלה שהוקפאו והופשרו. כמו כן אין לקבל דגימות עם נוגדי קרישה דוגמת הפארין או ציטראט. הבדיקה מתבצעת בשיטת ELISA.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק