קסנטין - Xanthine
| מדריך בדיקות מעבדה | |
| קסנטין | |
|---|---|
| Xanthine | |
| שמות אחרים | Xanthic acid |
| |
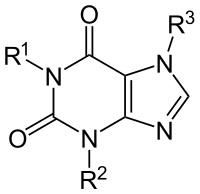
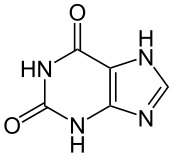
קסנטין - נוסחה אמפירית: C5H4N4O2
משקל מולקולארי: 152.11 | |
| מעבדה | כימיה בשתן |
| תחום | הערכת משק הפורינים בגוף, חסר חומצת שתן, קסנטינוריה ויצירת אבני קסנטין |
| טווח ערכים תקין | קסנטין: 20-60 מיקרומול' ל-24 שעות; היפוקסנטין: 20-100 מיקרומול' ל-24 שעות |
| יוצר הערך | פרופ' בן עמי סלע |
מטרת הבדיקה
מדידת רמת קסנטין והיפוקסנטין בשתן שימושית לאבחון ואישוש של קסנטינוריה. בדיקה זו תידרש במקרים בהם רמת חומצת שתן (uric acid) בדם ובשתן נמוכה במיוחד, מה שמחשיד לקסנטינוריה. מדידת קסנטין בשתן מתבצעת כדי להעריך את יעילות הטיפול ב-allopurinol במטופלים עם מפגעים של עודף ניכר של חומצת שתן בדם ובשתן כמו בתסמונת Lesch-Nyhan.
בסיס פיזיולוגי
Xanthine הוא בסיס פוריני שנמצא ברוב רקמות ונוזלי הגוף, ונראה שאין זה מקרה שכמה חומרים שהם נגזרים של קסנטין, הם בעלי תכונות מעוררות כגון Caffeine ו-theobromune. קסנטין הוא תוצר במסלול הקטבולי לפירוק פורינים: הוא נוצר מ-guanine על ידי האנזים guanine deaminase, אך גם הוא נוצר מ-hypoxanthine על ידי האנזים xanthine oxidoreductase, וכן נוצר קסנטין מ-xanthosine על ידי האנזים purine nucleoside phosphorylase, או PNP. קסנטין עצמו מוסב בהמשך ליצירת uric acid על ידי פעולת האנזים xanthine oxidase.
רמת קסנטין בשתן באופן נורמאלי נמוכה ביותר כיוון שהוא הופך מייד ל-uric acid, תוצר הקצה הנורמאלי באדם (לעומת יונקים אחרים בהם uric acid יכול להפוך לחומר המסיס allantoin) של מטבוליזם של פורינים על ידי פעולת קסנטין אוקסידאזה (XO). אנזים זה פועל באדם בעיקר בכבד ובשכבת החיפוי של המעי, בהקשר האבולוציוני העוזר להגן על הגוף בפני חומרים זרים דמויי-פורין במזון. פורינים הנוצרים אנדוגנית בגוף מנוצלים ליצירת ATP וצריכת אנרגיה, וכמובן לסינתזה של DNA. פורינים מתפרקים בדרך כלל ליצירת guanine או היפו-קסנטין, או שהם עוברים מיחזור. עודף פורינים שאינו ממוחזר מועבר לכבד ומתפרק שם לחומצת שתן המופרשת בשתן.
קסנטין הוא פחות מסיס מ-uric acid בנוזלי הגוף, כולל שתן. יתרה מכך, בניגוד לחומצת שתן שמסיסותה בשתן יכולה להיות מוגברת פי-10 על ידי הבססה של השתן, המסיסות של קסנטין אינה משתנה על ידי הפיכת השתן ליותר בסיסי. הבדל נוסף הוא בכך שבניגוד לחומצת שתן (ש-90% ממנה עוברים ספיגה מחדש באבוביות הכליה, ורק 10% מופרשים בשתן), קסנטין מורחק מהגוף לשתן ביעילות רבה על ידי הכליות,לכן רמת קסנטין בפלזמה נמוכה ביותר, ורמתו בשתן גבוהה, מה שמגביר הסיכון ליצירת אבנים בכליות או בדרכי השתן, בייחוד בתנאי חום או כאשר השתן מרוכז מדי.
מעניין לציין שקסנטין דווח לראשונה כמרכיב של אבני כליות על ידי הכימאי השוויצרי Marcet בכר ב-1817. שני הכימאים הגרמנים Liebig ו-Wöhler, השתמשו ב-1838 באותן אבנים אותן בחן Marcet, בחנו את הרכבן תוך שהשוו אותו עם זה של חומצת שתן, והציעו שמדובר בחומר קרוב יחסית לחומצה זו עם חסר של מולקולת חמצן אחת, שאמנם זוהה כקסנטין, והם אף טבעו את המושג "קסנטינוריה" כתרחיש לא שכיח בו רמות גבוהות של חומר זה בשתן יגרמו להופעת אבנים. בהמשך נעשה אבחון קסנטינוריה בבחינת שתן בשיטות מס-ספקטרומטריה, שלראשונה עשה בהן שימוש Richard Watts, במקרה של אתלט שסבל מהתכווצויות שרירים קשות, אשר בביופסיה של ה שריר שלו נמצאו גבישי קסנטין. למעשה, בעיות שריר או גבישי קסנטין בשריר נדירים בקסנטינוריה.
באופן בלתי תלוי, גם כן בסוף שנות ה-30, דווח בניו-זילנד על הופעת אבני קסנטין בכליות של כבשים, וייחסו ממצא זה לעובדה שהקרקע המקומית ענייה ביסוד מוליבדניום (MO), וכפי שנראה בהמשך יסוד זה חיוני כקו-פקטור לפעילות האנזים קסנטין אוקסידאזה (XO), מה שגרם בכבשים אלה להצטברות קסנטין על חשבון החומר allantoin, המופיע בכל היונקים פרט לבני-אדם, והוא תוצר פירוק של uric acid על ידי האנזים uricase שאינו קיים באדם.
תפקיד xanthine oxidase בתחלואה באדם
קיימים 3 סוגים של קסנטינוריה תורשתית: קסנטינוריה קלאסית המועברת בהורשה אוטוזומאלית-רצסיבית מופיעה בשני סוגים: Type 1-הסוג המבודד (Isolated XO deficiency) של חסר באנזים XO, או Type 2 בו קיים חסר כפול הן של XO וכן של האנזים aldehyde oxidase או AOX. שני סוגים אלה של קסנטינוריה זהים באופן הם באים לביטוי קליני, ושניהם נחשבים שפירים בהקשר של דרגת הסבל או ההישרדות במחלה. לעומת זאת, הסוג השלישי והנדיר של קסנטינוריה, Type 3, הידוע גם כ-Molybdenum co-factor deficiency (וכן Combined XO/SO deficiency), בו קיים חסר גם של אנזים נוסף-sulphite oxidase, בא לביטוי מיד לאחר הלידה עם תסמינים נוירולוגיים חמורים עד קטלניים כמו פרכוסים נאונטליים, מיוקלונוס, הסטת עדשת העין, פיגור שכלי חמור ואבני כליה כבר בגיל הרך. הקו-פקטור של מוליבדניום נחוץ לפעילותן של שני אנזימי אוקסידאזה האמורים. בשתן של אלה עם type 3, בנוסף להצטברות sulfite, נמצא גם מטבוליטים מכילי גפרית כגון taurine ,thiosulfate ו-S-sulfocysteine.
מטופלים עם חסר type 1 של XO, מסוגלים להפוך Allopurinol ל-oxipurinol, ואילו מטופלים עם חסר type 2 אינם מסוגלים לבצע היפוך זה. ההבדל נובע מנוכחות האנזים AOX במטופלים type 1, והחסר שלו במטופלים type 2 של XO.
מטופלים בהם באים לביטוי סוגים 1 ו-2 של קסנטינוריה, יכולים להתחיל להראות את תסמיני המפגע בכל גיל החל מגיל של חודשים אחדים ואפילו רק לאחר גיל 70 שנה. התסמין המרכזי הוא הופעת גבישי קסנטין בשתן או כשל כלייתי חריף. אבחון מאוחר של המפגע עלול לגרום למחלת כליות סופנית, והזדקקות לדיאליזה, או הרחקת הכליה. לעומת זאת, כמחצית המטופלים המאובחנים עם קסנטינוריה עשויים להיוותר ללא כל תסמינים לאורך כל חייהם, בתנאי שהם אינם מתגוררים באזורי אקלים חמים במיוחד. מטופלים עם קסטינוריה type 1 ו-type 2 עלולים גם להראות תסמינים של דלקת שרירים (myositis) כתוצאה משקיעת קסנטין ברקמת השריר.
הפגם המולקולארי בקסנטינוריה
הגן בבני-אדם המקודד ליצירת האנזים XO מופה בזרוע הקצרה של כרומוזום 2 באתר 2p22-p23. לעומת זאת, הגן המקודד ל-MOCO או molybdenium co-factor מופה בכרומוזום 18 באתר18q12.2 . קסנטינוריה על שני סוגיה (type 1 ו-type 2) הם מפגעים לא שכיחים ושכיחותם באוכלוסיות שונות נעה בין 1 ל6,000 עד 1 ל-69,000. באזור הים התיכון היא שכיחה יותר בגלל תנאי האקלים המדבריים למחצה.
הזיהוי הממשי הראשון של קסנטינוריה באדם תואר בלונדון רק בשנת 1954 על ידי Dent ו-Philpott. הייתה זו ילדה בת 4 שנים שהתגלתה בה אבן כליה במשקל 1 גרם, שהתבררה כמורכבת מקסנטין טהור. ולמעשה קסנטינוריה הייתה למחלה הגנטית הראשונה של מסלול המטבוליזם של purine שזוהתה 10שנים לפני הזיהוי בשנת 1964 של מחלת Lesch-Nyhan, המפגע הגנטי האחר של מטבוליזם של פורינים.
כיוון שבאדם האנזים XO נמצא אך ורק בכבד וברירית המעי, זיהוי מוחלט של חסר האנזים XO היה מחייב ביופסיה של הכבד או של שכבת החיפוי של המעי לבחינת פעילות האנזים ברקמות אלה. ביופסיות כאלה אינן מתבצעות בשגרת הרפואה, לכן האבחון תלוי בממצאים של רמות נמוכות במיוחד או אף חסר של חומצת שתן בפלזמה ובשתן, כאשר בשתן מופיעה רמה מוגברת של קסנטין והיפוקסנטין ביחס של 4 ל-1. ההצטברות המועדפת של קסנטין בשתן, נובעת מהרחקה נמרצת יותר של היפוקסנטין על ידי האנזים HPRT, שאינו משתמש בקסנטין כמצע ראוי. טעות באבחון יכולה להיגרם על ידי הדבקה מסיבית בחיידקים, שיכולה להביא להופעת ריכוז גבוה של uric acid בשתן’כתוצאה מפירוק קסנטין ליצירת uric acid על ידי האנזים הבקטריאלי המתאים.
אבחון מעבדתי של קסנטינוריה
אחת השיטות ההיסטוריות לגילוי אבני כליות מורכבות מקסנטין הייתה מבחן Murexide , שהוא חומר בצבע ארגמן שהתגלה בשנת 1776 על ידי השוודי Scheele, על ידי טיפול של uric acid על ידי וחומצה חנקנית ואמוניה, בסדר זה. כאשר אבני כליות הם על בסיס uric acid טיפול בשני החומרים האחרונים יהפוך את צבעם לארגמן כתוצאה מקבלת החומר Murexide. לעומת זאת, אם מדובר באבני קסנטין, הצבע המתקבל הוא אדום, אך רק לאחר חימום. כיום זיהוי קסנטין בשתן כבר לא מתבצע על ידי כרומטוגפיית-נייר, אלא על ידי HPLC שהיא שיטה רגישה בהרבה שהשימוש בה אפשר לגלות מפגעים גנטיים רבים במטבוליזם של purine, שמספר עומד כיום על 29. כיום כאמור מגלים קסנטין בשתן בשיטות של מס-ספקטרומטריה, כמו גם בטכנולוגיה של NMR או בשיטות של ביולוגיה מולקולארית.
למרות שקסנטינוריה יכולה להתגלות רק בשלב מאוחר של החיים או אפילו לא להתגלות כלל, ב-40% מהמקרים היא מתגלה כבר בילדות כתוצאה מכאבים הנגרמים מאבן חולפת (renal colic), חסימת דרכי שתן, דלקות בדרכי השתן, המאטוריה, או מתחושת אי-נוחות וחולי. בדרך כלל שתייה מרובה של נוזלים, דיאטה דלה בפורינים, או מעבר לאזורי אקלים יותר קרירים יכולה לסייע.
משמעות קלינית של נגזרות קסנטין
נגזרות קסנטין הם אלקלואידים המשמשים כתכשירים לגריינים מתונים או כמרחיבי דרכי אוויר (בעיקר בטיפול בתסמיני אסטמה). בניגוד לגריינים נמרצים יותר כגון אמינים סימפאטו-מימטיים, נגזרות קסנטין פועלות בעיקר בנטרול של פעילות משרי-שינה כמו adenosine (בהיותם אנטגוניסטים בלתי-בררניים של הקולטנים ל-adenosine), ולהגברת ערנות במערכת העצבים המרכזית. תכשירים אלה מגרים את מרכז הנשימה במוח, ונעשה בהם שימוש לטיפול במצבי apnea בילדים. אך כתוצאה מתחום פעילות צר של קסנטין, נגזרותיו משמשות רק כטיפולי קו-שני באסטמה.
נגזרות של קסנטין כוללות קפאין, aminophylline ,IBMX ,paraxanthin ,pentoxifylline ,theobromine ו-theophylline. תכשירים אלה משפיעים לא רק על דרכי האוויר אלא מעודדים את קצב הלב וכוח הכיווץ שלו, ומשפיעים בריכוז גבוה על אי סדירות קצב הלב, אם כי בריכוז גבוה הן עלולות לגרום לפרכוסים העמידים לתכשירים נוגדי פרכוסים. מתיל-קסנטינים משרים הפרשת האנזים פפסין בדרכי העיכול, והם עוברים מטבוליזם על ידי מערכת ציטוכרום P450 בכבד.
מתיל-קסנטינים פועלים כמעכבים תחרותיים בלתי-סלקטיביים של האנזים phosphodiesterase , מה שמעלה את רמת cAMP התוך-תאית, הם מעכבים את האנזים protein kinase A וכן את TNF-α ואת הסינתזה של leukotriene, ובכך מפחיתים תהליכי דלקת.
יצירה יאטרוגנית של קסנטינוריה
Allopurinol, הוא מעכב האנזים XO ומונע הפיכת קסנטין ל-uric acid ומשמש במפגעים כמו gout. כבר משנות ה-60 שמשה תרופה זו בחולים עם hyperuricaemia, הכרוכה במחלת כליות חמורה, ומשנות ה-70 שמשה לאלה עם gout. ל-allopurinol מבנה דומה מאוד לזה של היפוקסנטין, ובהתאם מסוגלת תרופה זו להיקשר לאתר הפעיל של האנזים XO, ממש כמו היפוקסנטין. יחד עם זאת, אנזים זה אינו מבחין ש-allopurinol אינו היפוקסנטין, אם כי ההבדל הקטן במבנה הכימי של השניים, מספיק לגרום לעיכוב פעילות האנזים. לכן XO מעוכב בדרגות עיכוב שונות בתלות בריכוז allopurinol, באופן הגורם להפחתת רמת uric acid בדם ובשתן. הבעיה עם חולי gout, שעיכוב כגון זה מביא להצטברות לא רק של החומר המסיס והבלתי מזיק היפוקסנטין, אלא גם להצטברות קסנטין, ליצירת אבני כליות ולגרימת נזק לכליות.
בעיות הנגרמות על ידי allopurinol במפגעים גנטיים של מטבוליזם של פורינים
מחלת Lesch-Nyhan, הכרוכה ביצירה מסיבית של uric acid בגין חסר באנזים HPRT, עודף uric acid מופרש בשתן. לכן נעשה שימוש ב-allopurinol להגביל את הפרשת uric acid במחלת Lesch-Nyhan, אלא שיש לצרוך תרופה זו בזהירות רבה, להימנע המצטברות יתר של קסנטין והופעת אבני כליות שעלולה להתרחש במצבי עודף יצירה של uric acid. אותה מידת זהירות נדרשת במחלת Familial juvenile hyperuricaemic nephropathy או FJHN, בה תפקוד הכליות כבר לקוי.
מטופלים עם מחלת כליות קיימת חייבים אף הם לנהוג בזהירות יתרה, שכן Allopurinol במינון גבוה מדי עלול להביא להצטברות של oxipurinol, המרכיב הפעיל אליו מוסב Allopurinol בעזרת האנזים XO באלה עם מחלת כליות חמורה. Oxipurinol עלול לעתים לגרום לדיכוי מח העצם. זאת כיוון ש-oxipurinol הוא בעל דמיון ל-hypoxanthine, ובריכוזים גבוהים שלו הוא עלול להפריע להשתלבות האחרון ב-DNA, מה שיפריע ליצירת תאים חדשים במח העצם.
Febuxotat, תכשיר המפחית רמת uric acid המעכב את פעילות האנזים קסנתין אוקסידאזה
בשנת 1993 סונתז ביפאן החומר febuxotat, והסתבר שהוא מעכב יעיל של האנזים XO. תכשיר זה הוא בעל מבנה כימי של thiazole, ללא כל דמיון למצע הטבעי של XO, היפוקסנטין. Febuxotat פותח כתכשיר להפחתת רמת uric acid , עם יעילות דומה לזו של allopurinol, אך עם פחות תופעות לוואי. למרות שהתכשיר החדש מביא להצטברות של קסנטין, הוא גורם פחות להופעת אבני כליות, ולכן הוא גם יכול להינתן לאלה עם פעילות מופחתת של הכליות באותו מינון כמו שהוא ניתן לאנשים ללא מחלת כליות, שכן הפרשתו בשתן תלויה אך מעט בדרגת תפקוד הכליות.
הנחיות דיאטה למאובחנים עם קסנטינוריה
סוגי מזון או משקאות שיש להימנע מהם: איברים פנימיים מן החי כמו לבבות, כבד, כליות. מזון מהים כמו סרדינים, שפרוטים, הרינג, דג שמך, סלמון, ביצי דגים (קוויאר), דג מלוח (מעושן), סרטנים, צדפות, רכיכות, שבלולים. יש להימנע מצריכת ירקות כמו אספרגוס, אבוקדו, תרד, פטריות, אפונים, כרובית. אין לצרוך מוצרי סויה וקטניות. יש להימנע ממשקאות אלכוהוליים כבירה, או משקאות אחרים עם תסיסת שמרים. כן יש להעדיף קפה ותה ללא קפאין, ולהימנע ממשקאות על בסיס קקאו, שוקולד, קוקה-ופפסיקולה.
סוגי מזון המותרים לצריכה מתונה (אחת ליום): בשר בקר, עגל, חזיר, מאכלי עוף נקניק, לשון, או מרקי בשר. בתחום הירקות ניתן לצרוך בכמויות לא גדולות גזר, תפוחי-אדמה, כרוב, שעועית, כרוב ניצנים, וכן דגים פרט לאלה שהוזכרו בסעיף הקודם.
הוראות לביצוע הבדיקה
חסר של uric acid בשתן הוא אמנם ממצא מרכזי באבחון של קסנטינוריה, אך יש להקפיד על חימום דגימת השתן, וטלטולה הנמרץ בעזרת shaker על מנת לפורר גבישים זעירים או גדולים יותר של קסנטין, שעלולים לתת מצג שווא של חסר ברמת קסנטין מומס בשתן. זהום בקטריאלי משמעותי של דגימת השתן עלול לגרום לרמות מאוד נמוכות שלuric acid בשתן, לכן מומלץ לבצע מדידת uric acid בשתן ובדם במקביל, כדי לאשש רמה נמוכה שלה בשתי הדגימות בהערכה אפשרית של קסנטינוריה.
בשליחת שתן לבדיקת קסנטין, יש להימנע 24-48 שעות קודם לנטילת הדגימה מצריכת קפה (המכיל קפאין) תה, שוקו, מוצרי שוקולד, ומשקאות קלים כמו קוקה-או פפסיקולה. כל מוצרי מזון ומשקאות אלה מכילים נגזרות מתיל של קסנטין, העלולות להשפיע על תוצאות הבדיקה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק