Alpha klotho
| מדריך בדיקות מעבדה | |
| Alpha klotho | |
|---|---|
| שמות אחרים | αKlotho |
| מעבדה | כימיה בדם |
| תחום | חלבון רב-תחומי הכרוך בתהליכים מגוונים בגוף |
| טווח ערכים תקין | בתלות בשיטת המדידה, רמת Klotho בנסיוב של אנשים בריאים גבוהה משמעותית כאשר המדידה נעשית בשיטת TRF (או time-resolved fluorescence immunoassay) בהשוואה לביצוע המדידה בשיטת ELISA. הרמה הממוצעת של Klotho בנסיוב הנמדדת בשיטת TRF היא 61 ננוגרם/מ"ל בגברים, ו-99 ננוגרם/מ"ל בנשים. כאשר רמת Klotho נמדדת בשיטת ELISA הריכוז הממוצע הוא 472 פיקוגרם/מ"ל ללא הבדל בין המגדרים. |
| יוצר הערך | פרופ' בן-עמי סלע |
Klotho הוא אנזים המקודד באדם על ידי הגן KL (Matsumura וחב' ב-Biochem Biophys Res Commun משנת 1998). ישנן 3 תת-משפחות של klotho המסומנות כ-α, β ו-γ ( Dolegowska וחב' ב-J Physiol Biochem משנת 2019), כאשר klotho-α משפעל את FGF-23 (גורם גידול פיברובלסטי-23), ו-klotho-β משפעל את FGF-19 ואת FGF-21 (Kuro-O ב-Nat Rev Nephrol משנת 2019). בדרך כלל כשמבטאים את המושג klotho ההתייחסות היא ל-α-klotho (Lim וחב' ב-Int J Mol Sci משנת 2019). Klotho יכול להופיע קשור לממברנה או בצורה מסיסה (הורמונלית) בצירקולציה (Buendia וחב' ב-Vit Horm משנת 2016). פרוטאזות יכולות להפוך את הצורה הממברנלית לצורה המסיסה (Martin-Gonzalez וחב' ב-Alcohol Alcoholism משנת 2019).
תפקוד
Klothoα הוא חלבון טרנס-ממברנלי, ובנוסף להשפעות נוספות שלו αklotho מספק שליטה מסוימת על הרגישות של הגוף לאינסולין, והוא נראה מעורב גם בתהליכי הזדקנות. Klotho התגלה בשנת 1997 על ידי Makoto Kuro-O וחב' (Nature משנת 1997). חלבון זה הוא ביסודו β-glucuronidase חדש, המסוגל לבקע steroid β-glucuronides. וריאנטים גנטיים של klotho נכרכו עם תהליכי הזדקנות באדם (Arking וחב' ב-Proc Natl Acad Sci USA משנת 2002, ו-Rodriguez ב- J Mol Biol Res משנת 2015). ריכוזי klotho בנסיוב הולכים ודועכים עם הגיל (Xiao וחב' ב-Chinese Med J משנת 2004). ההתקשרות של מספר FGFs (FGF23,FGF21 ו-FGF19 לקולטנים שלהם, נעזרת על ידי האינטראקציה של גורמי גדילה פיברובלסטיים אלה עם β-klotho כקו-קולטן (Helsten וחב' ב-Cancer Metast Rev שנת 2015, ו-Talukdar וחב' ב-Cell Metab משנת 2016). α-klotho משנה את ההומאוסטאזיס של סידן בתאים, הן על ידי הגדלת הביטוי והפעילות של TRPV5, (הפחתת הספיגה מחדש של פוספאט בכליות) והן על ידי הפחתת הביטוי והפעילות של TRPC6 (הפחתת הספיגה של פוספאט במעי) (Huang ב-Kidney Int משנת 2010). α-klotho מגדיל את הספיגה מחדש של סידן בכליות על ידי ייצוב של TPRV5 ( van Goor וחב' ב-Biochim Biophys Acta משנת 2017). TRPV היא משפחה של transient receptor potential cation channels בבעלי חיים, וכולם מאוד בררנים לסידן.
משמעות קלינית
αKlotho יכול לדכא עקה חמצונית ודלקת, ולפיכך הוא עשוי להפחית פגיעה בתפקוד האנדותל ותהליכי טרשת עורקית. הריכוז של αklotho בפלזמה על ידי פעילות גופנית אאירובית, מה שמפחית את השיבוש בפעילות האנדותל (Sagiv וחב' ב-J Circ Biomarkers, 2017 משנת 2017). השפעול של FGF21 על ידי βKlotho הוא בעל השפעה מגינה על שריר הלב (Olejnik וחב' ב-BioMed Res Int משנת 2018). השמנת-יתר (obesity) מאופיינת על ידי עמידות ל-FGF21, כנראה כתוצאה מהעיכוב של βKlotho על ידי הציטוקין TNFα. Klotho דרוש לבשלות של אוליגו-דנדרוציטים, לשלמות של מיאלין, ולהגנה על נוירונים מפני השפעות טוקסיות (Torbus-Paluszczak וחב' ב-Neurol Sci משנת 2018). עכברים נטולי Klotho הם בעלי מספר מופחת של סינפסות, וסובלים מחסכים קוגניטיביים, בעוד שעכברים המבטאים klotho ביתר, הם בעלי כושר למידה וזיכרון משופרים (Vo וחב' ב-Brain Plsticity משנת 2018). נמצא שירידה בביטוי של klotho יכולה להיגרם כתוצאה מהיפר-מתילציה של DNA, שיכלה לנבוע מביטוי-יתר של DMNT3α (Adhikari וחב' ב-Med Mol Morphol משנת 2017). עכברים נטולי klotho מבטאים תסמונת המדמה הזדקנות מוחשת באדם, עם מאפיינים של טרשת עורקים מואצת. בנוסף, פגיעה בהרחבת כלי-דם בתלות באנדותל, עכברים אלה מבטאים פגיעה בהרחבת כלי-דם התלויה באנדותל וכן בפגיעה באנגיוגנזה, מה שרומז לכך ש-Klotho עשוי להגן על המערכת הקרדיו-וסקולרית על ידי יצירה של nitric oxide (NO). Klotho עשוי להיות בעל השפעה מגינה מפני מחלת אלצהיימר (Paroni וחב' ב-Mol Neurobiol משנ 2019, ו-Lehrer ו-Rheinstein ב-World Acad Sci J משנת 2021).
הגן המקודד ל-Klotho התגלה באופן מקרי על ידי Kuro-o תוך יצירה של עכברים טרנסגניים שבדיעבד ביטאו פנוטיפ של הזדקנות מוקדמת. Kuro-o העריך שמדובר בגורם הפוגע בגן ה"מדכא הזדקנות". הוא טבע את שמו של גן זה כ-Klotho כשמה של אלה במיתולוגיה היוונית שהאריכה ימים, ובשנת 1997 הוא זיהה את הגן המקודד לחלבון טרנס ממברנלי החוצה את הממברנה פעם אחת בלבד, ומבוטא במיוחד באבוביות המפותלות הדיסטליות בכליה (Kuro-o וחב' ב-Nature משנת 1997). עשר שנים לאחר מכן הדגים חוקר זה ש-Klotho פועל כקו-קולטן אובליגטורי לגורם הגדילה הפיברובלסטי FGF-23 (על פי Kurasu וחב' ב-J Biol Chem משנת 2006), נתון שאושר בהמשך על ידי אחרים (Urakawa וחב' ב-Nature משנת 2006). פריצת הדרך שקשרה את Klotho ל-FGF-23 נעזרה בעובדה שעכברי knockout ל-FGF-23, היו בעלי פנוטיפ הזדקנות מורכב שבעיקרו אובחנה הזדקנות טרם-עת בדומה למה שנמצא בעכברים החסרים Klotho (Shimada וחב' ב-J Clin Invest משנת 2004). באותה עת, FGF-23 היה מוכר כהורמון שנובע מהעצם המעודד הפרשת פוספאט בשתן, ומפחית בנסיוב את רמת 1,25- . dihydroxyvitamin D3. עם זאת, הזהות של הקולטן של FGF-23 לא הייתה ידועה כיוון ש-FGF-23 הוא בעל זיקה נמוכה לכל האיזופורמים של הקולטן שלו (Yu וחב' ב-Endocrinology משנת 2003), והוא נקשר באופן מינימלי לקולטנים שלו בריכוזים פיזיולוגיים. ידוע ש-Klotho נדרש עבור הקשירה של FGF-23 לקולטנו בזיקה גבוהה, וקומפלקס בינארי זה של Klotho ושל הקולטן של FGF-23 (להלן FGFR) פועל כקולטן הפיזיולוגי של FGF-23.
המבנה של חלבוני Klotho
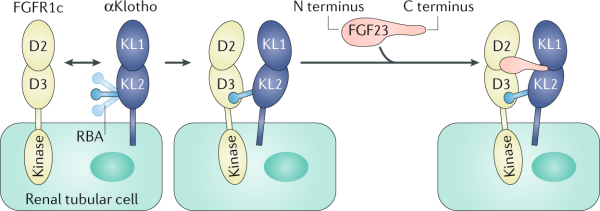
המבנה הגבישי של αKlotho ו-βKlotho זוהה. מחקרים מבניים של FGF-23 בקומפלקס עם Klotho מסיס ושל המקטע הקושר ליגנדים של GFGR1c (Chen וחב' ב-Nature משנת 2018), גילו ש-αKlotho נמתח כפְּתִיל ארוך (המוגדר כ-receptor-binding arm (או RBA) המגיב ישירות עם.FGR1c נמצא ש-FGF-23 מתאים עצמו למרווח הנוצר בין Klotho לבין FGFR1c, כאשר הקצה ה-N טרמינלי של FGF-23 מכוון אל FGFR1c ואילו הקצה ה-C טרמינלי שלו מכוון אל αKlotho.
הקומפלקס השלישוני של FGF-23 של αKlotho ושל FGFR1c דורש heparan sulfate על מנת לעבור דימריזציה ולשפעל את האנזים טירוזין קינאזה של הקולטן FGFR1c, אף על פי שהזיקה שלו ל-FGF-23 נמוכה, heparan sulfate מגיב עם FGFR1c כמו גם עם FGF-23.{{כ]] βKlotho גובש עם או בלי FGF-21 (Lee וחב' ב-Nature משנת 2018), ובדומה לאינטראקציה של αKlotho עם FGF-23, βKlotho מגיב ישירות עם הקצה ה-C טרמינלי של FGF-21. יש אפשרות שיש ל-αKlotho שותפים להתקשרות, השונים מקולטני FGF, מה שעשוי להסביר את הפונקציות המגוונות של αKlotho מסיס שאינן תלויות ב-FGF-23 (Kuro-o ב-Nature משנת 2018). אם לוקחים בחשבון את התפקיד של ה-FGFs האנדוקריניים במגוון של תגובות פיזיולוגיות, כולל המטבוליזם המינרלי והאנרגטי, תגובות עקה ותהלכי הזדקנות, אגוניסטים ואנטגוניסטים של הורמונים אלה הם מועמדים פוטנציאליים לתרפיה במפגעים שונים (Lan וחב' ב-Cell Metabolism משנת 2017, ו-Gaich וחב' באותו כתב עת משנת 2013).
הציר האנדוקריני -FGF-23 Klothoα
FGF-23 נקשר לקומפלקס αKlotho-FGFR ומתווך במגוון של תהליכים פיזיולוגיים על מנת לשמר את ההומאוסטאזיס של פוספאט ושל סידן, בעיקר על ידי וויסות תפקוד הכליות ושל בלוטות ה-parathyroid. כתוצאה מכך, שיבוש הציר האנדוקריני של הוא בעל תפקיד קריטי בפתו-פיזיולוגיה של מפגעי כליה ועצם.
הציר -FGF-23 ו- Klothoα בבריאות
FGF-23 כהורמון פוספאטורי: FGF-23 מופרש מאוסטאוציטים (Liu וחב' ב-Matabolism משנת 2006, ו-Feng וחב' ב-Nature Genet מאותה שנה), בתגובה לצריכת פוספאט. איבר היעד העיקרי של FGF-23 הן הכליות, בהן Klothoα מבוטא בשפע (Fon Tacer וחב' ב-Mol Endocrinol משנת 2010). למעשה, הקישור של FGF-23 לקומפלקס αKlotho ו-FGFR1c, FGFR3c או-FGFR4c, שכולם מבוטאים בכליות גורם להפרשה מוגברת של פוספאט בשתן תוך מספר שעות (Hu וחב' ב-Annu Rev Physiol משנת 2013). עכברים החסרים FGF-23 או αKlotho מפגינים אצירת פוספאט (Kuro-o ב-Kidney Int משנת 2011). בלוטת ה-parathyroid היא אחת הרקמות היחידות בהן מבוטא αKlotho, מה שמרמז על כך שבלוטה זו היא איבר יעד של FGF-23, המדכא את הביטוי ואת ההפרשה של PTH, כאשר הוא מוכנס לתרבית של תאי בלוטת ה- parathyroid בתנאי in vitro או כאשר הוא מוזרק לגופן של חולדות בריאות (Ben-Dov וחב' ב-J Clin Invest משנת 2007). עם זאת, בבלוטת parathyroid נטולת αKlotho באופן ספציפי, אין השפעה על היכולת שלFGF-23 לדכא PTH, מה שמוכיח שביטוי מקומי של αKlotho קשור לממברנה, ואינו נחוץ להשפעה זו של FGF-23.
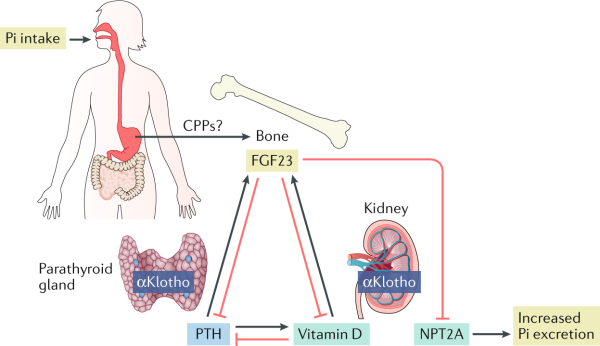
רגולציה של ביטוי FGF-23 ו-αKlotho
המנגנון דרכו אסטאוציטים מייצרים FGF-23 בתגובה לפוספאט אינו ידוע. אפשרות אחת היא שאוסטאוציטים מבטאים "קולטן החש בפוספאט", שכאשר הוא משופעל הוא משרה הפרשת FGF-23 באופן אנלוגי למסלול בו תאי parathyroid מבטאים קולטן החש בסידן. כאשר קולטן זה משופעל על ידי רמות מוגברות של סידן בנסיוב, הוא מדכא הפרשת PTH (Brown וחב' ב-Nephrol Dial Transplant משנת 1994). מספר גורמים המווסתים את הביטוי של FGF-23 יכולים גם לפקח על הביטוי של αKlotho. ויטמין D פעיל יכול להשרות באופן ישיר את הביטוי של αKlotho, שכן הפּרומוטר של αKlotho, בדומה ל- FGF-23 מכיל אלמנטים אחדים המגיבים לוויטמין D (Forster וחב' ב-Biochim Biophys Res Commun משנת 2011). בנוסף לוויטמין D, גם thiazolidinediones שהם ליגנדים של peroxisome proliferator-activated receptor-γ (להלן PPARγ), משרים את הביטוי של Klotho (Zhang וחב' ב-Kidney Int משנת 2008). הגן של αKlotho מכיל אלמנט תגובה באזור ה-5'-flanking שלו, והקישור של PPARγ לאלמנט זה משפעל את הביטוי שלαKlotho . בניגוד להשפעה שלו על FGF-23, אלדוסטרון מפחית בכליה את רמות αKlotho mRNA ואת רמות αKlotho עצמו (Tang וחב' ב-Kidney Blood Pressure Res משנת 2011), ובנוסף גם אנגיוטנסין מכווץ כלי הדם הוא בעל השפעה דומה לזו של אלדוסטרון (de Borst וחב' ב-J Am Soc Nephrol משנת 2011). היפוכו של דבר, כאשר מזריקים תכשירים החוסמים את II type 1 receptor angiotensin (להלן AT1 ) או תכשירים המעכבים את angiotensin-converting enzyme (להלן ACE) יש הגדלה של רמות αKlotho mRNA ושל αKlotho בחולדות, באופן שאינו תלוי ביכולת של חוסמים אלה של מערכת renin-angiotensin-aldosterone (להלן RAAS) להנמיך את לחץ הדם או להפחית פרוטאינוריה. בנוסף ל-RAAS, גם FGF-23 הוא מווסת שלילי פוטנטי של הביטוי של αKlotho . למעשה, αKlotho mRNA היה התעתיק שפחת באופן המשמעותי ביותר באנליזת microarray של ביטוי הגן בכליות של עכברים טרנסגניים המבטאים בעודף FGF-23 (Marsell וחב' ב-Nephrol Dial Transplant משנת 2008). לפיכך, כל הגורמים המגבירים את ביטוי FGF-23 הכוללים צריכה מוגברת של פוספאט, שפעול של NF-κB במהלך דלקת, כמו גם שפעול של HIF1α, יכולים באופן בלתי ישיר להפחית את הביטוי של αKlotho בתנאי in vivo. הפחתה זו של ביטוי αKlotho על ידי FGF-23 יכולה להיות חלק ממערכת רגולטורית שהמנגנון שלה עדיין ממתין להבהרה נוספת.
הציר αKlotho-FGF-23 בתחלואה
עודף ראשוני של FGF-23 בנסיוב, מופיע בחולים עם תסמונות של hereditary phosphate wasting כולל hypophosphatemic rickets אוטוזומלי-דומיננטי (להלן ADHR) (White וחב' ב-Nature Genet משנת 2000), וכן בחולים עם X-linked hypophosphatemia (להלן XLH) או עם hypophosphatemic rickets אוטוזומלי רצסיבי (להלן ARHR) (Kurasu וחב' ב-Biofactors משנת 2009, ו-Yu וחב' ב-Cytokine Growth Factor Rev משנת 2005). לחולים אלה יש בנסיוב רמות גבוהות במיוחד של FGF-23 הכרוכות בהיפופוספטמיה כמו גם רמות נמוכות בנסיוב של ויטמין D פעיל, מה שפוגע במינרליזציה של העצמות (גורם לרככת ולאוסטאומלציה) ומוביל לכאבי עצמות או לדפורמציות בגפיים התחתונות. תוארו מוטציות בשני מטופלים בגן או בקרבת הגן המקודד ל-αKlotho. באחד מהם, נמצאה מוטציה הומוזיגוטית (H193R) בגן של αKlotho (Ichikawa וחב' ב-J Clin Invest משנת 2007), שנראית כמוטציה של loss-of-function כאשר המטופל פיתח תסמינים הדומים לאלה של FTC (או Familial tumoral calcinosisl). המוטציה במטופל השני הייתה טרנסלוקציה עם breakpoint ליד הגן של αKlotho (Brownstein וחב' ב-Proc Natl Acad Sci USA משנת 2008), כאשר במטופל זה נתגלתה היפו-פוספטמיה ובנסיוב שלו היו רמות גבוהות של FGF-23 ושל PTH. יתרה מכך, במטופל השני היו בנסיוב רמות גבוהות של αKlotho, שנגרמו כנראה על ידי הפרשה של ectodomain של αKlotho.
פוספאט והשפעתו על תהליכי הזדקנות
עכברים החסרים FGF23 או klothoα מראים סימני הזדקנות מוקדמת, כתוצאה מהיפר-פוספטמיה (Huang ב-Kidney Int משנת 2010). על חלק מסימנים אלה ניתן להקל על ידי האכלת העכברים בדיאטה דלת-פוספאט. נמצא שביטוי-יתר של klotho בעכברים האריך את תוחלת חייהם ב-19%-31% בהשוואה לעכברים נורמליים (Kurosu וחב' ב-Science משנת 2005). בנוסף, וריאציות בגן של klotho באות לביטוי בתוחלת חיי האדם, מוטציות בחלבון klotho כרוכות בתוחלת חיים האדם ובשיפור קוגניטיבי (Dubal וחב' ב-Cell Rep משנת 2014). כאמור בהזדקנות טרם-עת, איבוד רקמת עצם וצריכת אלכוהול מוגברת (Schumann וחב' ב- Proc Natl Acad Sci USA משנת 2016). עכברים נטולי klotho מראים יצירה מוגברת של ויטמין D (Medici וחב' ב-J Cell boil משנת 2008, ו-Tsujikawa וחב' ב-Mol Endocrinol משנת 2003). Klotho הוא אנטגוניסט של מסלול ה-Wnt signaling, וגירוי כרוני של Wnt יכול לגרום לדִּלְדּוּל של תאי גזע ולהזדקנות (Liu וחב' ב-Science משנת 2007).
בעכברים החסרים αKlotho או FGF-23 יש לא רק חוסר איזון במאזן פוספאט, והיפר-פוספטמיה כתוצאה מהפרשה פגועה של פוספאט בשתן, אלא גם מתפתחים פנוטיפים מורכבים האופייניים להזדקנות טרם-עת, לגדילה אטית, אטרופיה של מספר איברים (כגון גונדות, תימוס ועור), הסתיידות כלי-דם, סקרופּניה, היפר-טרופיה ופיברוזיס לבביים (Faul וחב' ב-J Clin Invest משנת 2011, ו-Hu וחב' ב-J Am Soc Nephrol משנת 2015),) osteopenia Kawaguchi וחב' ב-J Clin Invest משנת 1999), אמפיזמה (Suga וחב' ב-Am J Respir Cell Mol Biol משנת 2000), הפרעות שמיעה (Kamemori וחב' ב-Hear Res משנת 2000), פגיעה קוגניטיבית (Nagai וחב' ב-FASEB J משנת 2003), ואורך חיים מקוצר. רוב התסמינים הללו של הזדקנות מוקדמת זוכים להקלה על ידי האכלת העכברים האלה בדיאטה דלת פוספאט על מנת לשקם את האיזון של פוספאט וויטמין D בנסיוב שלהם, ורמת ויטמין זה אף עולה כאשר הדיאטה דלה בפוספאט (Kuro-o ב-Aging Dev משנת 2010).
בבני אדם, אצירת פוספאט הכרוכה בביטוי נמוך של αKlotho, ברמות גבוהות של FGF-23 בנסיוב, ובהזדקנות מוקדמת, אובחנו באלה עם מחלת כליות סופנית, והגבלת פוספאט עשויה להיות גישה יעילה בשיפור תסמיני ההזדקנות המוקדמת. הדמיון בין עכברים החסרים αKlotho לבין אנשים עם מחלת כליות כרונית, מחזקת את ההשערה שמחלת כליות כרונית יכולה להיחשב כמודל קליני של הזדקנות מוקדמת (Stenvinkel ו-Larsson ב-Am J Kidney Dis משנת 2013).
Klotho מקשר בתהליכי הזדקנות של לימפוציטים מסוג +CD4 באדם הכרוכה בדלקת פרקים שגרונית (RA).
לימפוציטי-T מסוג +CD4 עוברים שינויים הקשורים להזדקנות, מה שגורם לירידה בחסינות, לזיהומים ולממאירויות, וכן להגברת השכיחות של מחלות אוטו-אימוניות (כולל RA) (Pawelec וחב' ב-Front Biosci משנת 2002, ו-Effros ב-Ann NY Acad Sci משנת 2004). חלק מהשינויים המאובחנים בתאי +CD4 של חולי RA, דומים לאלה שמוצאים במהלך הזדקנות פיזיולוגית, אך מופיעים בשלב מוקדם יותר. Witkowski וחב' מראים ב-J Immunol משנת 2007, שתוצר של הגן של Klotho הוא בעל פעילות בגן או בקרבת הגן המקודד ל-αKlotho. β-glucuronidase הוא אנזים ששינויים בפעילותו כרוכים בפנוטיפ ההזדקנות, עובר down-regulation ברמת ה-mRNA וברמת החלבון והפעילות האנזימטית באנשים מזדקנים ובעיקר בלימפוציטים מסוג +CD4 של אלה עם RA (Bryl וחב' ב-J Immunol משנת 2001).
הוראות לביצוע הבדיקה
אין צורך בהכנות מוקדמות דוגמת צום או דיאטה ספציפית, אם כי מומלץ להימנע מנטילת תרופות לא הכרחיות במהלך 72 שעות לפני הבדיקה. הנסיוב המבודד לאחר סרכוז של דם שנלקח במבחנה כימית (פקק צהוב או אדום), ונשמר בהקפאה עד 28 יום, בקירור עד 7 ימים ובטמפרטורת החדר עד 48 שעות. לצורך ELISA ניתן להשתמש בערכת IBL היפנית, בה ניתן להשיג מקדם שוֹנוּת בין הבדיקות שאינו עולה על 3.6%, כ-intra-assay CV או על 11.5% כ-inter-assay CV. רגישות השיטה היא 6.15 פיקוגרם/מ"ל. מומלץ לבצע את המדידה הקולורימטרית ב-Victor Multiplate Reader של חברת PerkinElmer כאשר הקריא באורך גל של 450 ננומטר.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק