חלבון קושר הפארין - Heparin-binding protein
| מדריך בדיקות מעבדה | |
| חלבון קושר הפארין | |
|---|---|
| Heparin-binding protein | |
| שמות אחרים | AZU1 HBP, azurocidin, CAP37 או Cationic Antimicrobial Protein of 37kDa |

| |
| מעבדה | כימיה בדם וכימיה בשתן |
| תחום | סמן לתרחישי ספסיס |
| טווח ערכים תקין | פחות מ-15 ננוגרם/מ"ל בדם; פחות מ-30 ננוגרם/מ"ל בשתן |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אלח דם
החלבון הקושר הפארין
החלבון הקושר הפארין (להלן HBP) הוא גליקופרוטאין עם משקל מולקולארי של 37 קילו-דלטון, המסונתז על ידי נויטרופילים והוא מאוחסן בתוך גרנולות אזורופיליות בתאים אלה (Tapper וחב' ב-Blood משנת 2002). גרנולות אלו מפרישות את ה-HBP בשעת גירוי של β2-integrins הממוקמים בממברנת הלויקוציטים. הגן המקודד ל-azurocidin ידוע כ-AZUI (Morgan וחב' ב- J Immunol משנת1991). גן ממוקם על כרומוזום 19 בעמדה 19p13.3, ויש בו 5 אֶקסונים. למרות ש-HBP משתייך למשפחת-על של סרין פרוטאזות, ולמרות שיש לו זהות בהומולוגיה של 45% ברצף חומצות האמינו עם האנזים human neutrophil elastase, אין HBP פעיל כפרוטאזה.
תפקודיו של HBP
אלח-דם או ספסיס מהווה את התגובה הדלקתית הסיסטמית של הגוף לזיהומים, תגובה שעלולה להתפתח לספסיס חמור, עד כדי הלם ספטי ובמצבי קיצון לכשל של מספר ניכר של איברים ולמוות (Martin וחב' ב-N Eng J Med משנת 2003, ו-Linder וחב' ב-Crit Care Med משנת 2016). אבחון מוקדם וטיפול הולם של ספסיס חמור חיוניים לשיפור סיכויי ההישרדות של המטופל (Dellinger ב-Nat Med משנת 2012). ספסיס הוא תרחיש הטרוגני עם התבטאויות קליניות בלתי ספציפיות, לכן קיים קושי בהבנה וביצירת כלים למדידת המצב הדלקתי במהלך הספסיס. התסמינים המוקדמים הם לרוב רַב-מַשְׁמָעִיים, כאשר 20-30% מהמטופלים עם ספסיס חמור אינם מראים סימנים של אי-תפקוד איברי בשעת אשפוזם, אך מתדרדרים לספסיס חמור במהלך ה-24 השעות הראשונות לאחר ההערכה הראשונית שלהם ביחידה לטיפול נמרץ (Glickman וחב' ב-Acad Energ Med משנת 2010, ו-Shapiro וחב' ב-Ann Emerg Med משנת 2006). מצב זה מוביל לאבחון וטיפול דחויים, ולעיתים אף לטיפול-יתר, מה שמדגיש את החיוניות של גילוי סמן לאבחון מוקדם.
למרות שלמעלה מ-100 סמנים פוטנציאלים עברו הערכה בספסיס, אף לא אחד מהם נמצא מתאים לשימוש בשגרה הקלינית (Pierrakos ו-Vincent ב-Crit Care משנת 2010). HBP הוא חלבון שמקורו בגרנולות הנויטרופיליות, שנחשב עשרות שנים ראוי לשמש כסמן מוקדם המבוקש (Shafer וחב' ב-Infect Immun משנת 1984). שתי סיבות לכישוריו של HBP בהקשר האמור:
- המיקום שלו בבועיות המפרישות בנויטרופילים היא ערובה לכך שהוא משתנח מוקדם בתגובה לזיהום;
- HBP משפעל מגוון של סוגי תאים ויכול לשמש כגורם פעיל בספסיס, ולכן מדידת רמתו עשויה לסייע באבחון תרחיש זה (ראו תרשים ).
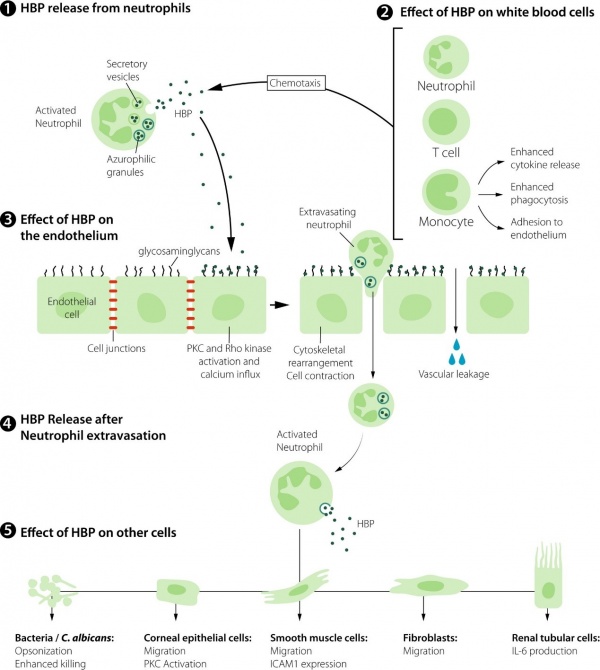
1. HBP מופרש מהגרנולות המפרישות של נויטרופילים משופעלים
2. HBP הוא chemoattractant של נויטרופילים, תאי T ומונוציטים, וכן הוא מעודד הפרשת ציטוקינים ממונוציטים, פגוציטוזה והספחות תאים לאנדותליום
3. HBP מגיב ישירות עם האנדותליום על ידי קישורו ל-GAGs. הוא משפעל את האנזימים PKC ו-rho kinase ומשרה חדירה של סידן לתוך תאים, מה שגורם לרה-ארגון של ה-cytoskeleton ולכיווץ התאים. תהליך זה גורם לבקיעים (gaps) בשכבת האנדותליום מה שגורם לדליפה וסקולארית ומאפשר יציאת נויטרופילים (extravasation) אל מחוץ לכלי הדם
4. לאחר יציאת נויטרופילים לרקמות, מופרש עוד HBP מהגרנולות האזורופיליות
5. ל-HBP יש השפעות שונות על מספר סוגי תאים אחרים. השפעות אלה כוללות אופסוניזציה (Soehnlein ב-J Mol Med משנת 2009) והרג חיידקים, השריית נדידה ושעול PKC בתאי אפיתל של קרנית העין, השריית נדידה וביטוי של ICAM1 בתאי שריר חלק, השריית נדידה של פיברובלסטים, והשריית יצירה של IL-6 בתאי האפיתל של אבוביות הכליה
שחרור HBP מנויטרופילים
נויטרופילים הם הלויקוציטים השכיחים ביותר בדם והם גם בין התאים המגיבים ומשופעלים מוקדם ביותר בתגובה לזיהום, ומכאן יכולתם להשפיע מוקדם על התגובה החיסונית ההתחלתית (Amulic וחב' ב-Annu Rev Immunol, ו- Kolaczkowskaוחב' ב-Nat Rev Immunol משנת 2013). בועיות מפרישות של נויטרופילים מגיבות מהר בשפעול תאים אלה, כאשר HBP מופרש גם מהנויטרופילים כאשר אלה באים במגע עם האנדותליום. בשעת הפרשת HBP, הוא משרה ארגון מחדש את ה-cytoskeleton של תאי האנדותל בתהליך התלוי בסידן, ומגביר את החדירות (permability) של שכבת האנדותל. HBP גם נקלט על ידי תאי האנדותל ומגן עליהם מפני אפופטוזיס. HBP מופרש גם כן מהבועיות התאיות כאשר הקומפלקסים של M protein/fibrinogen מגיבים עם β2-integrins על פני נויטרפילים. קומפלקסים אלה נוצרים כאשר M proteins שהם גורמים אלימים, מופרשים מהדופן של חיידקים דוגמת streptococcus הפולשים לגוף. באזור הזיהום, HBP מופרש גם מהגרנולות האזורופיליות במהלך פגוציטוזה, ואז מפגין HBP את פעילותו האנטי-חיידקית והוא אחראי לגיוס ולשפעול של מונוציטים ושל תווכי דלקת נוספים. HBP נקלט ומופנם גם על ידי מונוציטים להארכת הישרדות ולהחיש יצירת ציטוקינים (Heinzelmann וחב' ב-J Immunol משנת 1998). למעשה, תוך 30 דקות מתחילת הפגוציטוזים של חיידקים פולשנים מופרשת 89% מתכולת HBP בנויטרופילים, המהווה כמות גדולה בהרבה מהפרשת חלבונים אחרים מגרנולות בנויטרופילים (Pereira וחב' ב-J Clin Invest משנת 1990).
שפעול של נויטרופילים ושחרור HBP הם תגובה לזיהום. חומרים כימוטקטיים מופרשים באזור הזיהום (Morgensen ב-Clin Microbiol Rev משנת 2009).חומרים כימוטקטיים אלה דוגמת IL-8 משפעלים את הנויטרופילים ומביאים להפרשת HB (Chertov וחב' ב-J Biol Chem משנת 1996). חלבונים בקטריאליים יכולים גם כן לשפעל ישירות את הנויטרופילים ולהביא לשחרור HBP (Herwald וחב' ב-Cell משנת 2004, Chen וחב' ב-Front Microbiol משנת 2016, Li וחב' ב-Sci Rep משנת 2016, ו-Snall וחב' באותו כתב עת מאותה שנה). חלבונים אלה כוללים את חלבון M1 המופרש מ-Streptococcus pyogenes, את החלבון suliysin המופרש מ-Streptococcus suis והחלבון modulin α4 המופרש מ-Staphylococcus aureus. נויטרופילים משופעלים גם כן על ידי מגע עם מולקולות ספיחה תאיות על פני תאי אנדותל, וה-HBP המופרש מגביר את החדירות האנדותליאלית, מה שמסייע לאקסטרווזציה של נויטרופילים מכלי הדם לרקמה הסמוכה לאזור הזיהום (Gautam וחב' ב-Nat Med משנת 2001). הפרשת HBP מהגרנולות האזורופיליות מתגברת בעת יציאת תאים אלה לרקמות החוץ-וסקולאריות (Borregaard וחב' ב-Blood משנת 1997, ו- Faurschou וחב' ב-Microb Infect משנת 2003).
השפעות ישירות של HBP
ל-HBP מספר פעילויות שעשויות להיות חשובות בספסיס ובמצבים נוספים. HBP נקשר גם ל-LPS אך לא ברור אם אינטראקציה זו היא בעלת תוצאה פונקציונאלית בנטרול של LPS אם כי פפטידים שמקורם באתר הקושר LPS במולקולת HBP נמצאו מנטרלים את LPS. לכן, אפשרי ש-HBP משחק תפקיד בנטרול LPS בשעת זיהום (Gautam חב' ב-Net Med משנת 2001 ו- Pereira וחב' ב- J Clin Invest משנת 1990).
בנוסף לאינטראקציה שלו עם פתוגנים, HBP גם כן משפיע על מספר סוגי תאים בפונדקאי. HBP מגביר את התגובה החיסונית על ידי השפעתו על תאי דם לבנים. הוא משמש כ-chemattractant של מקרופאגים (Soehnlein וחב' ב-J Immunol משנת 2005). של תאי T (על פי Wang וחב' ב-Methods משנת 1996), ושל נויטרופילים, ובכך גורם להסננה מרובה של לויקוציטים לאזור הזיהום. הנוכחות של HBP על פני תאי אנדותל, משרה את כליאתם של מונוציטים (אך לא של נויטרופילים או לימפוציטים). במנגנון-תלוי-סידן, מה שמגרה מקרופאגים למקום הזיהום. HBP גם מעודד שפעול של מונוציטים, ומשדרג את היכולת הפגוציטית של מקרופאגים (Heinzelmann וחב' ב-Crit Care Med משנת 2000, וב-Inflamation משנת 1998). ל-HNP יש אותה השפעה על הפעילות הפגוציטית, על הכמוטקסיס ועל השפעול של תאי glia שהם תאי התמך במוח (Pereira וחב' ב-glia משנת 2003).
המחסום האנדותליאלי חייב להיסדק כדי לאפשר זליגה של לויקוציטים אל מחוץ לכלי הדם באזור הזיהום (Muller ב-Vet Pathol משנת 2013). הפגיעה בשלמות של המחסום האנדותליאלי היא גורם משמעותי בהתפתחות ספסיס (Opal וחב' ב-J Intern Med משנת 2015). ה-HBP משפיע על האנדותליום במספר דרכים: ראשית הוא משרה את הביטוי של ICAM1, של PECAM-1 ושל integrins α3 ו-β1 על תאי האנדותל מה שמסייע לספיחת נויטרפילים על תאי האנדותל (Ruan וחב' ב-Invest Ophthalmol Vis Scu משנת 2002). בכך HBP משרה רה-ארגון של ה-cytoskeleton של תאי האנדותל, להתכווצות תאים אלה וליצירת בקיעים בין תאי האנדותל (Ostergaard ו-Flodgaard ב-J leukoc Biol משנת 1992), ולהגברת החדירות של שכבת האנדותליום (Bentzer וחב' ב-Intensive Care Med Exp משנת 2016). הגברת החדירות הזו תלויה בחדירה (influx) של סידן לתוך תאי האנדותל ןלשפעול של האנזימים PKC או protein Kinase C, ו-Rho kinase (על פי Pereira וחב' ב-J leukoc Biol משנת 1996).
HBP מתכוונן גם למיטוכונדריה של תא אנדותל, תוך שהוא משרה שינויים במורפולוגיה התאית, ומפחית את הביטוי של cytochrome C oxidase subunit II וכן מפחית את הפוטנציאל של הממברנה המיטוכונדריאלית (Olofsson וחב' ב-J Clin Invest משנת 1999, ו-Wang וחב' ב-Exp Ther Med משנת 2014). פגיעה בתפקוד המיטוכונדריאלי משחקת תפקיד בכשל איברים המתרחש בספסיס (Singer ב-Virulence משנת 2014).
כיוון ש-HBP מופרש ברקמות כתוצאה מיציאת נויטרופילים מכלי הדם, יש לו אפשרות להגיב עם מספר סוגי תאים אחרים. HBP משרה את הנדידה של פיברובלסטים (Flodgaard וחב' ב-Eur J Biochem משנת 1991), החיונית לוויסות של תגובות דלקתיות בתהליך ריפוי מפציעה (Van Linthout וחב' ב-Cardiovasc Res משנת 2014). HBP משרה כמו כן את הנדידה של תאי שריר חלקים ברבדים טרשתיים (Gonzales וחב' ב-Microvasc Res משנת 2004), וכן את הנדידה של תאי אפיתל בקרנית (Griffith וחב' ב-Invest Ophthalmol Vis Sci משנת 2013). ולבסוף, נמצא ש-HBP משרה את השפעול של IL-6 בתאי אפיתל של האבוביות הקריבניות בכליה (Fisher וחב' ב-Shock משנת 2017).
HBP וניבוי מוקדם של ספסיס
כפי שתואר למעלה, ל-HBP ישנה סבירות ביולוגית להוות סמן חשוב בספסיס ממספר סיבות:
- היותו אגור בנויטרופילים
- הוא מופרש לסביבה מגרנולות מפרישות שהן הראשונות המגיבות ועוברות exocytosis
- הוא משרה עוצמתי של דליפה וסקולארית, וגורם למודולציה של תגובות דלקתיות של סוגי תאים רבים
- הפרשתו מושרית על ידי מולקולות בקטריאליות. מדידת HBP היא בעלת רגישות גבוהה (87.1%), ספציפיות גבוהה (95.1%) וערכי ניבוי חיוביים (PPV) ושליליים (NPV) גבוהים, 88.4% ו-94.5%, בהתאמה.
הפוטנציאל של HBP כסמן של ספסיס ושל כשל בתפקוד איברים שונים, עבר תיקוף על ידי מספר חוקרים באופן בלתי תלוי (Lin וחב' ב-Crit care משנת 2013, Linder וחב' ב-Crit Care משנת 2012, ו-Kaukönen וחב' ב-Clin Microbiol Infect משנת 2013). מחקר רב-מוסדי בינלאומי שנערך בשוודיה, ארצות הברית וקנדה, הדגים ש-HBP הוא הסמן האבחוני הטוב ביותר לאבחון וניבוי כשל בתפקוד איברים בהשוואה עם precalcitonin, CRP, ספירת תאים לבנים ורמת לקטאט (Linder וחב' ב-Crit Care Med משנת 2015).
הרמות של HBP בפלזמה בשעת זיהום נחקרו במחקר פרוספקטיבי של מטופלים עם חום שאושפזו בבית-חולים גדול. בסך הכול גויסו 233 מטופלים וחולקו באקראי ל-4 קבוצות על בסיס הגדרת חומרת מחלתם. 70 מטופלים קיימו את תנאי הגדרתם כסובלים מספסיס חמור (זיהום ותת לחץ-דם או אי-תפקוד איברי), 26 מהמטופלים עם כשל ציקולטורי חמור יותר שלא הגיב לטיפול בעירוי נוזלים והוגדרו לכן כאלה עם הלם ספטי. שאר 163 דורגו משתתפי המחקר שלא סבלו מספסיס או מכשל איברי דורגו למספר קטגוריות:
- זיהום ותסמונת תגובה דלקתית סיסטמית (SIRS) ללא כשל איברי
- זיהום ללא SIRS
- SIRS ללא אטיולוגיה זיהומית
רמות החציון של HBP היו גבוהות יותר בקרב המטופלים עם ספסיס חמור, בהשוואה לאלה עם ספסיס ממוצע, או באלה עם זיהומים מתונים יותר או באלה עם SIRS ללא זיהום. למעשה רמת החציון של HBP במטופלים ללא זיהום חמור נמצאה בהתאמה עם מדידות של HBP בתורמי דם בריאים (5.5 ננוגרם/מ"ל), ואילו רמת החציון של HBP באלה עם ספסיס חמור הייתה גבוהה משמעותית (44 ננוגרם/מ"ל).
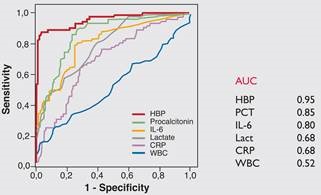
על מנת להעריך את הערך של HBP כסמן של ספסיס, הושוואה רמתו לאלה של סמנים קודמים שנחקרו, דהינו פרוקלציטונין, IL-6, CRP, ספירת תאי דם לבנים ולקטאט. נמצא שרמת HBP הייתה הפרמטר החזק ביותר להבדיל בין מטופלים עם ספסיס חמור, לבין אלה עם זיהום פחות בולט. כאשר נקבעה רמת-סף (cut-off) של 15 ננוגרם/מ"ל, הרגישות והספציפיות של HBP באבחון של ספסיס חמור נקבעו כ-87.1% ו-95.1%, בהתאמה. רמות HBP במספר מטופלים עם ספסיס חמור, היו מוגברות עוד לפני שהתגלה תת-לחץ-דם. באחדים מבין המטופלים האחרונים רמות HBP בפלזמה היו מוגברות כבר 12 שעות לפני מדידת לחץ הדם הנמוך. היכולת של ספירת תאים לבנים להבדיל בין ספסיס חמור לבין זיהום פחות רציני, הייתה מועטה (Davis וחב' ב-Arch Pathol Lab Med משנת 2006). נתוני המחקר של Linder וחב' ב-Clin Infect Dis משנת 2009 הראו נתונים כדלקמן באשר לעקומות ROC של הסמנים הפוטנציאליים המוקדמים לכשל צירקולטורי בספסיס: השטח תחת לעקומה (AUC) שנקבע לסמנים השונים שנמדדו היה: HBP-0.949; פרוקלציטונין-0.85; - IL-60.798; לקטאט-0.79; CRP-0.685; מספר הלויקוציטים-0.529 (ראו תרשים 2).
מחקרים בהמשך אישרו שרמות HBP בפלזמה היו מוגברות בתרחישים של ספסיס עם כשל בתפקוד איברי. במדגם גדול של מטופלים ביחידת טיפול נמרץ, רמות HBP היו גבוהות משמעותית בקרב מטופלים עם הלם ספטי בהשוואה לאלה עם מחלה קריטית שאינה קשורה לספסיס. יתרה מכך, רמות מוגברות של HBP היו כרוכות משמעותית עם תמותה בטווח הקצר, עם נתוני תמותה הגבוהים פי-4 בטווח של 28 יום באלה עם רמת HBP מעל הסף של 15 ננוגרם/מ"ל. בנוסף, הערך הפוטנציאלי של מדידות סדרתיות של רמת HBP מתבסס על העובדה שדעיכה ברמת HBP במרוצת הטיפול, כרוכה בהישרדות טוב יותר. לבסוף, המחקר הראה שבמטופלים עם לויקופניה חולפת מושרית על ידי ספסיס, בהם נמצאה רמה בתחילת הטיפול של פחות מ-4,000 לויקוציטים/ממ"ק, רמת HBP הייתה עדיין מוגברת.
ערכת מבחן מסחרית למדידת HBP בפלזמה משווקת ונבחנה כסמן של ספסיס עם כשל איברי במחקר רב-מוסדי שכלל מעל 800 מטופלים ב-6 בתי חולים בשוודיה, ארצות הברית וקנדה. מסקנות מחקר זה חזקו את הערך המשוער של HBP הן באבחון התרחיש וההתפתחות של כשל איברי (Linder וחב' ב-Crit Care Med משנת 2015). אך ייתכן שהממצא החשוב ביותר הוא בפוטנציאל של HBP לנבא התפתחות של כשל איברי: בסך הכול, 141 מתוך המדגם האמור (19%) לא הראו סימנים של ספסיס חמורה, ואף על פי כן פיתחו כשל צירקולטורי ו/או כשל איברי תוך 72 שעות מאשפוזם כאשר במחציתם כשל זה התרחש תוך 5–10 שעות מהאשפוז. בקבוצת המטופלים האחרונה, שימוש ברמה הגבוהה ביותר של HBP יכול היה לנבא את התפתחות התרחיש החמור המתואר עם AUC או area under the curve של 0.95.
כפי שצוין למעלה, מנגנון מולקולארי ספציפי המעודד הפרשה של HBP על ידי חיידקים, הודגם לגבי חיידקים גראם-חיוביים. האם מנגנון דומה פועל עם חיידקים גראם-שליליים לא ברור עדיין, אם כי endotoxemia הודגמה כמסוגלת להשרות הפרשת HBP בחזירים (Persson וחב' ב-Acta Anaesthesiol Scand משנת 2014). עם זאת, לפחות 15 זני חיידקים גראם-חיוביים ושליליים, כמו גם מקרה אחד של קנדידה, בּוּדדוּ ממטופלים עם רמות HBP מוגברות, אך לא נמצא הבדל משמעותי בין רמות HBP באלה עם הדבקת חיידקיים גראם-חיוביים לאלה על הדבקה בחיידקים גראם-שליליים. רמות מוגברות של HBP נמצאו גם במטופלים עם כשל איברי כתוצאה הזיהום חמור של מלריה או גם לפטוספירוזיס (Beran וחב' ב-Scand J Infect Dis משנת 2010).
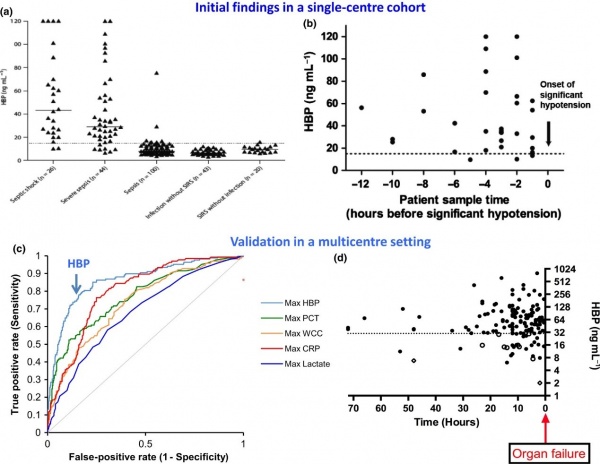
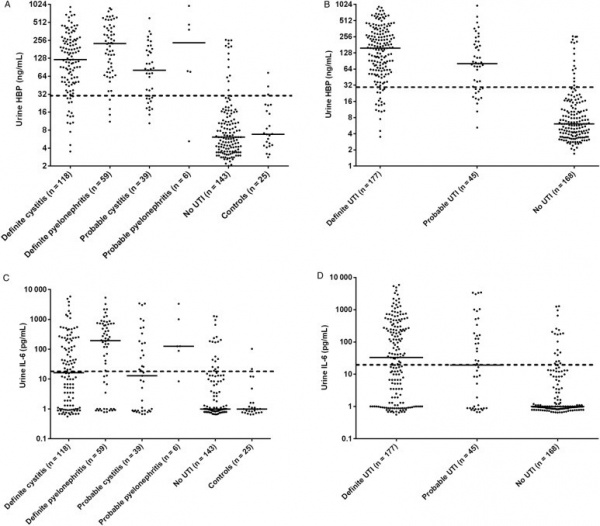
(a) רמות HBP בקבלה של 233 חולים עם חום וחשד לזיהום. כל ▲מייצג את רמת HBP בדגימת פלזמה אחת ב-5 קבוצות מטופלים;
(b) רמות HBP היו מוגברות ב-29 מתוך 32 מטופלים שבשעת אשפוזם לא הראו כשל איברי, אך פיתחו תרחיש זה תוך 12 שעות לאחר האשפוז;
(c) תוצאות ממחקר רב-מוסדי בשוודיה, ארצות הברית וקנדה שכלל 863 מטופלים. עקומת ROC מראה ש-HBP היה הסמן הטוב היותר לניבוי התפתחות של כשל איברי, בהשוואה לקלציטונין, CRP, ספירת תאים לבנים, ורמת לקטאט;
(d) במדגם תיקוף (validation), נמצא שרמות HBP מוגברות נמצאו בלמעלה מ-80% מהמטופלים שבשעת אשפוזם לא הראו כשל איברי אך כשל כזה התפתח אצלם תוך 72 שעות מעת האשפוז
רמות מוגברות של HBP נמדדות ביחידה לטיפול נמרץ במטופלים עם ספסיס חמור או בהלם ספטי
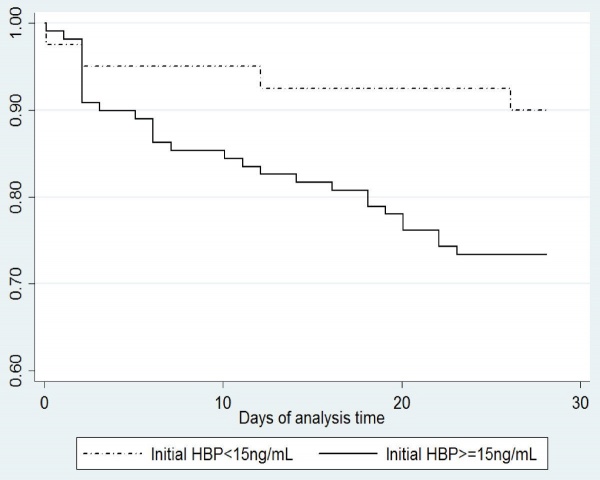
מטרת המחקר של Adam Liner וחב' שהתפרסם ב-Crit Care משנת 2012, הייתה לבחון את הדינמיקה של ההפרשה הסיסטמית של HBP במטופלים עם ספסיס חמור או בהלם ספטי. מדובר במחקר פרוספקטיבי שהתנהל ב-2 מדגמים של מאושפזים ביחידות לטיפול נמרץ של מרכז קרולינסקה בשוודיה. המחקר כלל 179 מטופלים כאשר ב-151 מתוכם אובחן ספסיס (126 עם הלם ספטי ו-25 עם ספסיס חמור), ועוד 28 מטופלים ללא ספסיס. דגימות דם נלקחו 5 פעמים מדי יום במהלך 6 ימים לאחר האשפוז. התוצאות היו כדלקמן: רמות HBP היו גבוהות משמעותית בקבוצת הספסיס מאשר בקבוצת הביקורת. בהגעה ליחידה לטיפול נמרץ, רמת HBP מעל 15 ננוגרם/מ"ל נמצאה ב-87.2% מקרב החולים הקריטיים, והיא באה לביטוי במהלך 28 ימי האשפוז, כפי שהממצא מתבטא בעקומת Kaplan-Meyer. (ראו תרשים 4 להלן)
HBP וכשל צירקולטורי
תאים אנדותליאליים הם היעד הראשון של HBP המופרש מבועיות מפרישות בנויטרופילים. HBP פוגע בשלמות של שכבת האנדותליום תוך שהוא עלול לגרום לדלף וליצירת בצקת האופיינית לראקציה הדלקתית (Gautam וחב' ב-J Exp Med משנת 2000). הממצא הקדם-קליני לפיו HBP גרם לדלף וסקולארי, ובעקבותיו לכשל צירקולטורי לירידה מסוכנת בלחץ הדם, נתמך על ידי מספר מחקרים קליניים (Chew וחב' ב-Inflamm Res משנת 2012). רק מחקר אחד נכשל להצביע על ההשפעה הזו של HBP (Liewelyn וחב' ב-Crit Care משנת 2013). עם זאת, הודגם הקשר בין רמות מוגברות של HBP לבין overload של נוזל במדגם של מטופלים עם הלם ספטי, בניסוי רב-מוסדי אקראי ומבוקר. במחקר עדכני נוסף, של Tylden וחב' שהופיע ב-PLos One משנת 2016, נמצא קשר בין רמות מוגברות של HBP בפלזמה לבין כשל צירקולטורי ונשימתי.
HBP וכשל נשימתי
סימנים של פגיעה ריאתית המושרים על ידי החלבון M1, ניתן לחסום על ידי הפפטיד Gly-Pro-Arg-Pro, פפטיד המונע הפרשת HBP מנויטרופילים (Soehnlein וחב' ב-Eur Respir J משנת 2008). כאשר הזריקו HBP ישירות לעכברים הופיעו בם סמנים של נזק ריאתי, שניתן היה לחסום אותם על ידי הפארין. בתרחישים קליניים חמורים של מטופלים עם ARDS רמות HBP בפלזמה נמצאו גבוהות באופן משמעותי בהשוואה לנבדקים ללא ARDS (Johansson וחב' ב- Acta Anaesthesiol Scand משנת 2013). Lin וחב' הראו ב-Crit Care משנת 2013 שבחולים עם ספסיס שפיתחו פגיעה ריאתית חריפה, רמת HBP הייתה גבוהה בהרבה בהשוואה לרמה זו בחולים ללא ספסיס שפיתחו אותה פגיעה ריאתית. במחקר אחר הראו שרמות מוגברות של HBP היו כרוכות ביחס נמוך בין לחץ חמצן עורקי חמצן עורקי (PaO2) לבין רמה מזערית מושרית של חמצן (FiO2).
HBP וכשל כלייתי
התפרסמה תאוריה על כשל כליות חריף המושרה על ידי ספסיס, הנגרם על ידי דלף וסקולארי, דלקת מקומית באבוביות וחסימת ה-cell cycle כמנגנונים הגורמים לנזק החריף בכליות (Gomez וחב' ב-Shock משנת 2014). ראיות נוספות ממעבדתם של Fisher ו-Linder מראות ש-HBP גם משרה דלקות של תאי אפיתל בכליות, ופגיעה כלייתית בעכברים.
רמות מוגברות של HBP במטופלים עם acute respiratory distress syndrome
מחקר של Lin וחב' ב-Crit Care משנת 2013, בחן את הערך של HBP באבחון ובהערכה הפרוגנוסטית של מטופלים עם פגיעה ריאתית חריפה/ARDS. במחקר השתתפו 78 מטופלים עם התרחישים הריאתיים האמורים, וכן 28 מטופלים עם cardiogenic pulmonary edema (להלן CPE) ו-20 מתנדבים בריאים. תוצאות מחקר זה היו כדלקמן: בקבוצת המטופלים עם פגיעה ריאתית חריפה/ARDS נמדדה רמת HBP של 17.15 ננוגרם/מ"ל) הגבוהה משמעותית בהשוואה לזו שנמצאה במאובחנים עם CPE (והיא 9.50 ננוגרם/מ"ל) (p<0.001) בעת הגיוס למחקר. לא נמצא כל הבדל משמעותי בערכי HBP בין אלה עם CPE לבין הנבדקים הבריאים (p=0.372). רמות HBP בין המטופלים שלא שרדו היו גבוהות משמעותית בהשוואה לרמות מדד זה בשורדים (23.90 לעומת 16.01 ננוגרם/מ"ל (p=0/012). רגרסיה לוגיסטית רב-משתנית הראתה ש-HBP היה מנבא בלתי-תלוי ( OR=1.52, P=0.034) של תמותה במהלך של 30 יום במטופלים עם פגיעה ריאתית חריפה/ARDS. מחקר זה מאשש את המשמעות האבחונית-פרוגנוסטית של HBP.
גם Tyden וחב' במחקר רב מוסדי בשוודיה, בחנו רמות HBP ואת ההיפותזה שירידה ברמות אלו בהגעה לאשפוז ביחידה לטיפול נמרץ, יכולה להיות כרוכה בכשל נשימתי עם רמת חמצון נמוכה של הדם, וכן בכשל צירקולטורי. במחקר נכללו 278 מאושפזים ביחידת טיפול נמרץ והתוצאות היו כדלקמן: במטופלים נמדדה דרגת SAPS או simplified acute physiology score של 3, ובמהלך האשפוז נפטרו 64 מתוך 278 משתתפי המחקר המהווים 23%. לאחר 48–72 שעות של שהייה ביחידת טיפול נמרץ נמצא מתאם בין רמה גבוהה של HBP לבין הירידה בחמצון הדם (0.001p<). כמו כן נמצא מתאם בין רמה מוגברת של HBP בהגעה לאשפוז, לבין שיעור התמותה במהלך 30 ימי אשפוז (p=0.002). עקומות ROC הראו שטח מחת לעקומה (AUC) של 0.62 באשר לירידה בחמצון הדם, 0.65 באשר לכשל צירקולטורי, ו-0.64 באשר לתמותה.
HBP כסמן אבחוני של UTI במבוגרים
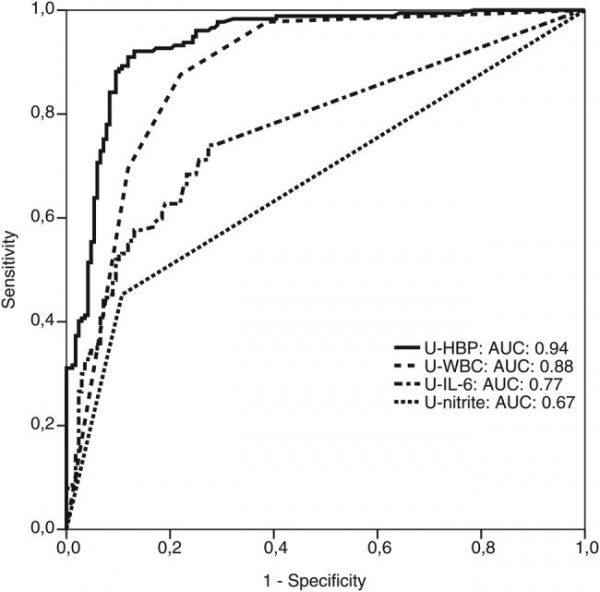
סקר פרוספקטיבי רב-מוסדי בשוודיה וקנדה נערך על ידי Kjövemark וחב' בשתי יחידות של טיפול ראשוני וב-2 יחידות טיפול נמרץ, לחקור את רמת HBP בשתן כסמן אפשרי של UTI. בנוסף, נמדדו בשתן גם רמות של IL-6, ספירת תאים לבנים, ורמת ניטריט, בהשוואה ל-HPV. בהתבסס על תסמיני UTI ועל הממצאים המיקרוביולוגיים, מוינו משתתפי הסקר למספר קבוצות - אלה עם UTI (ציסטיטיס ו-pyelonephritis) ואלה ללא UTI. בסקר השתתפו 190 מטופלים, ותוצאותיו הן כדלקמן: UTI אובחן ב-45.4% מהנבדקים, כאשר רמה מוגברת של HBP הצביעה על רגישות של 89.2% וספציפיות של 89.8%. ערך הניבוי החיובי (ppv) של HBP מוגבר נקבע כ-90.2%, ואילו ערך הניבוי השלילי של HBP מוגבר נקבע כ-88.8%. מבין הסמנים שנבחנו, HBP היה הסמן האבחוני הטוב ביותר ל-UTI, עם ערך AUC של 0.94. נמצא גם ש-HBP הבדיל טוב יותר בין ציסטיטיס ל-pyelonephritis בהשוואה לסמנים האחרים שנבחנו. על פי Kjölvmark וחב', רמת HBP בשתן היא סמן מבטיח של UTI בילדים (Kjölvmark וחב' ב-Pediatric Nephrol משנת 2012), ו-UTI במבוגרים (Kjölvmark וחב' ב-Open Forum Infect Dis משנת 2014).
מודולציה של HBP כיעד תרפויטי
שיטה אחת למודולציה של HBP היא במניעה של הפרשתו מנויטרופילים. זוהו מספר יעדים מולקולאריים על מנת להפריע להפרשת HBP. ההפרשה של HBP המושרית על ידי החלבון הסטרפטוקוקאלי M1 יכולה להיחסם על ידי אנטגוניסט של beta2-integrin, והפפטיד Gly-Pro-Arg-Pro המעכב את האינטראציה בין פיברינוגן ו-beta2-integrins. פפטיד זה יכול גם למנוע נגעים חמורים בריאות, שהתפתחו בעכברים שהוזרקו עם חלבון M1. הסטאטין simvastatin הידוע ביכולתו לעכב דה-גרנולציה של נויטרופילים (Al-Ani ב-Saudi Med J משנת 2013), הפחית את רמות HBP במטופלים עם פגיעה ריאתית חריפה, והיה כרוך בשיפור הישרדות (McAuley וחב' ב-BMC Pulm Med משנת 2013). ניסוי עם tezosentan, המעכב את הקולטן של endothelin-1, מצא שתכשיר זה מפחית גם כן רמות HBP, וכן הוא מפחית את החודרנות הווסקולארית במודל endotoxemia בחזירים. סוגי תאים רבים כולל נויטרופילים נושאים על פניהם את הקולטן של endothelin, כך שטיפול זה יכול לחסום ישירות שחרור HBP מנויטרופילים.
עם זאת, כיוון שנויטרופילים משחקים תפקידים חשובים רבים בתגובה החיסונית, חסימת שפעולם ופעילויותיהם, עלולה לגרום לתוצאות לא רצויות. לכן, תכשיר ריפויי המכוון לחסום את הקישור של HBP לקולטן שלו, עשוי להיות אפקטיבי יותר. אך למרבה האכזבה הקולטן של HBP על פני סוגי תאים רבים נותר מתעתע. מצופה מ-HBP לפעול דרך מספר קולטנים שונים לגרום להשפעות השונות שלו (Soehnlein ו-Lindbom ב-J Leukoc Biol משנת 2009). HBP משפעל מונוציטים דרך beta2-integrins (על פי Soehnlein וחב' ב-J Clin Invest משנת 2008), אך הוא משרה את ה-chemotaxis שלהם דרך משפחת קולטני ה-formyl peptide של הקולטנים הקשורים לחלבוני-G הידועים כ-GPCRs (על פי Soehnlein וחב' ב-Blood משנת 2008). אך HBP משרה גם נדידה של תאי אפיתל בקרנית העין דרך GPCR בלתי מזוהה. על האנדותליום, HBP נקשר לשיירי GAG (או glycosaminoglycan) של הפרוטאוגליקנים על פני התאים. קישור זה מסתייע על ידי המטען החיובי החזק של HBP שהוא בעל זיקה אלקטרוסטטית למטען השלילי של GAG (על פי McCabe וחב' ב-J Biol Chem משנת 2002), מה שמעלה אפשרות לחסום קישור זה על ידי מולקולות טעונות שלילית.
מספר מולקולות טעונות שלילית כאלה נבחנו ונמצא שה-polyanion דקסטרן סולפאט עיכב לחלוטין את השפעת HBP על החודרנות של של האנדותליום, כאשר הוא הוסף סימולטאנית עם HBP. גם הפארין שהוא GAG הטעון באופן מאוד שלילי, נמצא מגיב עם HBP. הפארין שלם והפארין שעבר פרקציונציה, חוסמים את החודרנות האנדותליאלית המושרית על ידי HBP במערכת in vitro, כמו גם במודל של מכרסמים הם חוסמים גם את ההשפעות המיטוכונדריאליות של HBP, וכן חוסמים את השחרור של IL-6 מתאי אבוביות בכליה (Fisher וחב' ב-Shock משנת 2017). ממצאים ממודלים בחיות ובאדם מרמזים שהפארין גורם למודולציה של קשת רחבה של תגובות לתרחישי זיהום (Griffin וחב' ב-Circ Shock משנת 1990, ו-Tanaka וחב' ב-Thromb Res משנת 1990, ו-Boldt וחב' ב-Shock משנת 1999, ו-Meyer וחב' ב-Crit Care Med משנת 1993).
אך טיפול בהפארין נושא בחובו סיכון גבוה של דימום, לכן מולקולות אחרות צריכות להיבחן בהקשר של נטרול HBP. מעכב ישיר יותר, נוגדן החוסם HBP, נמצא מונע חודרנות וסקולארית מושרית על ידי HBP במערכת in vitro. כיוון ש-HBP הוא הומולוג של serine-פרוטאזות, צפוי שפרוטאזות אלו יכולות להיקשר ולחסום את השפעותיו של HBP. מעכב אחד כזה, aprotinin, אכן נמצא כמעכב ביעילות HBP, במערכת in vitro, אלא ש-aprotinin אינו מאושר יותר לשימוש קליני. Bikunin הוא מעכב של סרין פרוטאזה ותכשיר מבטיח חדש בטיפול בספסיס (Karnad וחב' ב-Care Med משנת 2014), אך לא ברור עדיין האם יעילות תכשיר זה היא כתוצאה מחסימת HBP.

רמת HBP במטופלים עם הדבקה בנגיף (influenza A (H1N1
במטופלים מודבקים בנגיף influenza A (H1N1) מהלך המחלה בדרך כלל מתון. באלה המאושפזים עם סיבוכי H1N1, 6-31% נזקקים לטיפול במחלקת טיפול נמרץ (על פי Kumar וחב' ב-JAMA משנת 2009, ו-Jain וב' ב-N Eng J Med משנת 2009). רוב המאושפזים האחרונים סובלים מ-hypoxaemia הכרוכה בכשל נשימתי חריף ו-ARDS (על פי Estenssoro וחב' ב-Am J Respir Crit Care משנת 2010). המרכיב העיקרי בפתוגנזה של התפתחות ARDS הוא חדירות אלבאולרית מוגברת, כנראה בעקבות נזק לתאי אפיתל אלבאולריים או נזק לאנדותליום הקפילרי. תוצאה בולטת של אחד משני הנזקים האמורים היא דליפה של נוזל לאינטרסטיציום ולחלל האלבאולרי הפוגעת בתפקוד הנשימתי. ההצטברות של נוזל, תעודד נדידה של תאי דלקת לתוך החלל האלבאולרי ותעודד את המשך הראקציה הדלקתית (Ware ו-Matthay ב-N Eng J Med משנת 2000). מטרת המחקר של Kaukonen וחב' שהופיע ב-Clin Microbiol Infect משנת 2013, הייתה למדוד רמת HBP במטופלים עם הדבקה נגיפית חריפה ב-(influenza A (N1H1 ולבחון את המשמעות של רמה זו לתפקוד הנשימתי.
מדובר במחקר רב-מוסדי בהלסינקי, מלבורן, מכון קרולינסקה בסטוקהולם ו-Oulu בפינלנד. חולים קריטיים ב-4 יחידות טיפול נמרץ עם הדבקה ב-(influenza A (H1N1 המאושרת על ידי PCR, עברו הערכה פרוספקטיבית. במחקר השתתפו 29 מאושפזים. בהשוואה לרמות HBP באנשים בריאים, HBP במטופלים ביחידות טיפול נמרץ שנמדדו עם האשפוז וביום-2 לאשפוזם נקבעו כ-98 ננוגרם/מ"ל ו-93 ננוגרם/מ"ל, בהתאמה. נמצא שרמות HBP היו במתאם עם היחס הנמוך ביותר של הלחץ החלקי של חמצן בדם העורקי למקטע של החמצן הנשאף (PF ratio) במהלך השהייה ביחידה לטיפול נמרץ (p<0.05). במטופלים עם או בלי הצורך להנשמה מכנית, רמות הבסיס של HBP נקבעו כ-152 ו-83 ננוגרם/מ"ל, בהתאמה. רמות HBP ביום-2 של האשפוז בטיפול נמרץ, נקבעו כ-233 ננוגרם/מ"ל ו-81 ננוגרם/מ"ל, בהתאמה. במטופלים עם הלם ספטי או ספסיס חמור, לא נמצאו הבדלים ברמות HBP עם האשפוז או ביום-2 שלו. המחקר מצביע על כך ש-HBP מוגבר משמעותית בחולים קריטיים עם הדבקה ב-(influenza A (H1N1, ונראה ש-HBP מוגבר כרוך בכשל נשימתי חמור יותר.
HBP כסמן לזיהום חיידקי בנוזלי גוף
רמות HBP נמדדו בנוזלי גוף שונים מחוץ לפלזמה לאבחון של מספר מחלות בקטריאליות אחרות. Necrotizing fasciitis (להלן NF) הוא תרחיש חמור של הדבקה סטרפטוקוקלית של רקמה רכה המאופיין על ידי הרס מהיר ומתפשט של שכבות עור עמוקות ושל הרצועה החותלת של השריר (muscle fascia). בתרחישים המופיעים בדרך כלל כשל איברי או צירקולטורי, שנהוג להתייחס אליהם כאל Streotococcal toxic shock syndrome נמצא שקומפלקסים של חלבון M1 המופרש מהדופן של S. pyogenes, ושל פיברינוגן אנושי, נמצאים ברקמה של מטופלים עם NF. אותם קומפלקסים עצמם משפעלים נויטרופילים לעבור דה-גרנולציה ולהפריש HBP.
נמצא ש-HBP היה נוכח ברמות הרבה יותר גבוהות בנוזלי פצע מכיבים כרוניים בהשוואה לנוזלים מכיבים אקוטיים (Lundqvist וחב' ב-Thromb Haemost משנת 2004). ממצא זה מוכיח ש-HBP יציב בסביבה עם פעילות פרוטאוליטית גבוהה, וכן שההשפעה של HBP על החדירות האנדותליאלית ועל גיוס הנויטרופילים יכולה לייצג צעד פתוגני מוקדם בהתפתחות כיבים.
מנינגיטיס בקטריאלי הוא תרחיש מסכן חיים לגביו אבחון מהיר ומדויק חיוני ביותר. במחקר שכלל מבוגרים עם חשד קליני למנינגיטיס, נמדדה רמת HBP בדגימות CSF של 145 מטופלים (Linder וחב' ב-Crit Care Med משנת 2011). ארבעים ואחד איש מתוך מדגם זה הוגדרו ככאלה עם מנינגיטיס בקטריאלית חריפה, כתוצאה מזיהומים עם חיידקים שהבולטים בהם היו Strep. pneumoniae, עם Neisseria meningitidis או עם Listeria monocytogenes, ושיעור התמותה הגיע ל-16%. ריכוז HBP היה גבוה משמעותית (p<0.01) בקרב הנבדקים עם מנינגיטיס חריפה בהשוואה לאלה עם זיהומים נגיפיים של ה-CSF, או באלה עם neuroborreliosis, או אלה ללא תהליכי דלקת ב-CNS.
הוראות לביצוע הבדיקה
דגימות הדם נלקחות במבחנת ספירת דם (EDTA, פקק סגלגל), ולאחר הסרכוז הפלזמה המופרדת מאוחסנת בהקפאה בטמפרטורה של מינוס 80 מעלות עד לביצוע הבדיקה. מדידת HBP בשיטת ELISA מתבצעת על פי Tapper וחב' ב-Blood משנת 2002. בדיקת רמת HBP בשתן מתבצעת בדגימת שתן נקודתית (10 מ"ל) הנאספת במבחנת פלסטיק (Sarstedt). סרכוז השתן למשך 10 דקות במהירות 3,000 סל"ד חייב להתבצע לא יאוחר משעה אחת לאחר מתן השתן. אם הבדיקה אינה מתבצעת מיד יש להקפיא את השתן בטמפרטורה של מינוס 70 מעלות. בדיקת רמת HBP בשתן מתבצעת בשיטת ELISA על פי Lindmark וחב' ב-J Leukoc Biol משנת 1999.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק