חלבון קטיוני אאוזינופילי - Eosinophilic cationic protein
| מדריך בדיקות מעבדה | |
| חלבון קטיוני אאוזינופילי | |
|---|---|
| Eosinophilic cationic protein | |
| שמות אחרים | ECP, ribonuclease 3. |
| מעבדה | כימיה בדם |
| תחום | חלבון סמן דלקתי, בעיקר בהקשר של אסתמה. |
| טווח ערכים תקין | תחום הריכוזים התקין של ECP בדם הוא 2.3-16 מיקרוגרם/ליטר על פי נתוני מעבדת אוניברסיטת Uppsala. |
| יוצר הערך | פרופ' בן-עמי סלע |
Eosinophilic cationic protein (להלן ECP) הידוע גם כ-ribonuclease 3, הוא חלבון בסיסי הממוקם במשתית הגרנולות של אאוזינופילים (Boix וחב' ב-J Leukoc Biola משנת 2001). באדם הוא מקודד על ידי הגן RNASE3 הממוקם בזרוע הארוכה של כרומוזום 14 בעמדה q24-q31.
בכרומוזום 14 (Mastrianni וחב' ב-Genomics משנת 1992). ECP מופרש במהלך דה-גרנולציה של אאוזינופילים, והוא כרוך במצבי דלקת ובאסתמה, ואכן במצבים אלה מוגברת רמת ECP בגוף. ישנן 3 צורות של ECP עם מבנה סכרידים שונה, ולפיכך יש לו משקלים מולקולריים בין 18–22 קילו-דלטון.
ECP מורכב מ-133 חומצות אמינו עם נקודה איזואלקטרית של 10.8 בגין המספר הגדול של חומצות אמינו בסיסיות, ובעיקר ארגינין. בחלבון זה שלושה אתרי קשר גליקוזילציה: בין חומצות אמינו 57-59, 65-67 ו-92–94. בגלל התכולה השונה של הסוכרים חומצה סיאלית, גלקטוזה ו-N-אצטילגלוקוזאמין בשרשראות הקרבוהידרטיות של ECP, המשקל המולקולרי של ECP נע בין 16 ו-22 קילו-דלטון (Venge וחב' ב-Clin Exp Allergy משנת 1999). גודל הגן 1.2kb והוא מורכב משני אקסונים: exon 1 שאינו מקודד בגודל 1.2bp, ואקסון 2 מקודד בגודל של 667bp, וכן מורכב הגן מ-intron אחד בגודל של 230bp (Zhang ו-Rosenberg ב-Genetics משנת 2000). תוארו מספר פולימורפיזמים חד-נוקלאוטידיים (להלן SNPs בגן RNASE3) הקובעים את תכולת ECP בתאים ואת פעילותו הביולוגית (Trulson וחב' ב-Clin Exp Allergy משנת 2007).
התפקיד הפיזיולוגי של ECP
ECP והרצף הכרוך בו הידוע כ- eosinophil-derived neurotoxin (להלן RNASE2) הם חברים במשפחת העל Ribonuclease A (Hamman וחב' ב-Genomics משנת 1990). לשני חלבונים אלה יש פעילות נוירו-טוקסית, הלמינטו-טוקסית ו-ריבונוקלאו-ליטית. פעילות ה-ribonuclease של ECP אינה חיונית לפעילותו הציטוטוקסית (Rosenberg וחב' ב-J Biol Chem משנת 1995). כאשר שיירי האתר הפעיל של האנזים ריבונוקלאז עוברים מודיפיקציה למצב של אי-תפקוד שייר ליזין בעמדה 38 מותמר לארגינין, ושייר היסטידין בעמדה 128 מותמר לאספרטאט (Lehrer וחב' ב-J Immunol משנת 1989). בהשוואה לחלבון ECP התקין, ECP נושא המוטציות שומר אמנם על הציטוטוקסיות שלו אך מאבד את פעילות הריבונוקלאז. ECP הוא חלבון ציטוטוקסי פוטנטי המסוגל להרוג תאי אפיתל טרכאליים של חזירי-ים (Motojima וחב' ב-Am Rev Respir Dis משנת 1989), להרוג תאי לויקמיה ביונקים (Carreras וחב' ב-Mol Cell Biochem משנת 2005), להרוג תאי קרצינומה של השד (Ali וחב' ב- Am J Pathol משנת 2000), וכן הוא מסוגל להרוג טפילים, חיידקים ונגיפים. ECP ציטוטוקסי לתאי אפיתל ברונכיאלים באדם, על ידי התקשרות ספציפית ל-heparan sulfate שעל שטח פני התאים, וחדירה על ידי pinocytosis לתוך תאים (Fan וחב' ב-Traffic משנת 2007).
המשמעות הקלינית של ECP
ECP נכרך במספר מצבים פתולוגיים בעיקר במחלות אטופיות כגון אסתמה, נזלת אלרגית, ואקזמה אטופית (Peona וחב' ב-J Asthma משנת 2010, Koh וחב' ב-Respir Med משנת 2007, Kato וחב' ב-Int Arch Allergy Immunol משנת 2010, ו-Kampe וחב' ב-Clin Mol Allergy משנת 2011). רמות מוגברות של ECP בנסיוב נמצאות במתאם עם האינטנסיביות של הדלקת האלרגית ומעידות על חשיפה חריפה לאלרגן. בנוסף, התפקיד האבחוני והפרוגנוסטי של ECP נחקר גם במחלות אחרות בהן יש תפקיד לאאוזינופילים, כמו במפגעים נשימתיים, ציסטיק פיברוזיס, מחלות מעיים דלקתיות, מחלות סרטניות ואאוזינופיליה (Hogan ו-Rothenberg ב-Curr Allergy Rep משנת 2006, Bystom וחב' ב-Respir Res משנת 2011, Park וחב' ב-Ann Clin Lab Sci משנת 2006, Koller וחב' ב-Clin Exp Allergy משנת 1998, ו-Peterson וחב' ב-Am J Gastroenterol משנת 2002).
גרנולוציטים אאוזינופיליים מופיעים בכמויות גדולות באזורי דלקת ובתגובה להדבקות עם טפילים מסוימים. גרנולות ציטופלזמטיות מכילות חלבונים טעונים חיובית, ואחד מהם הוא ECP שהוא אחד מ-4 חלבונים מאוד בסיסיים המופרשים וחודרים לרקמות סמוכות כאשר אאוזינופילים משופעלים עוברים דה-גרנולציה. אף על פי שרמות ECP בצירקולציה יכולות להיות מאוד שונות במטופלים, מספר מחקרים מראים שמדידת רמת ECP בנסיוב יכולה לסייע בניטור של מחלות דלקתיות פעילות רבות (Wardlae ב-Postgrad Med J משנת 1994). רמות ECP בפלזמה ובנוזלי גוף אחרים עולות במהלך ריאקציות דלקתיות בעקבות שפעול אאוזינופילים (D'Amato וחב' ב-Allergy משנת 1996). רמות ECP בנסיוב שימושיות במדידות אובייקטיביות של חומרת אסתמה. רמות מוגברות שך ECP תואמות את תחילת התקפי אסתמה. במטופלים עם התקפי אסתמה עונתיים, מדידת ECP משקפת שינוים בפעילות המחלה במהלך השנה (Tomassini וחב' ב- J Allergy Clin Immunol משנת 1996). ישנם מנגנונים אחדים הקשורים להתקפי אסתמה כגון נוגדני IgE ספציפיים, תאי דלקת משופעלים, מנגנונים נוירוגניים, וכן תגובת-יתר וחוסר איזון של הורמונים מסוימים. ריאקציות אלרגיות בריאות מופיעות בשתי פאזות: הפאזה המאוחרת מופיעה מספר שעות לאחר החשיפה לאלרגן, כאשר אאוזינופילים מצטברים בסימפון (bronchus) ומפרישים את חלבוני הגרנולות שלהם המגרים את הסימפונות.
רמות ECP בנסיוב נכרכו עם atopic dermatitis (Czech וחב' ב-Br J Dermatol משנת 1992). כיוון ש-ECP טוקסי לנוירונים ולתאי אפיתל, זו יכולה להיות הסיבה לתחושת גרד בעור.
הסינתזה וההפרשה של ECP
ECP נמצא בגרנולות של אאוזינופילים ביחד עם major basic protein (להלן (MBP ו- eosinophil derived neurotoxin/eosinophil protein X (להלן EDN/EPX). כמויות קטנות מאוד של ECP נמצאות בנויטרופילים ובמונוציטים (Bystrom וחב' ב-Clin Exp Allergy משנת 2002). הסינתזה של ECP באאוזינופילים מתחילה בגרנולות כבר בשלב הפרומיאלוציטי (Egesten וחב' ב-Int Arch Allergy Immunol משנת 1997). נוירופילים בלתי-משופעלים אינם יכולים לסנתז ECP, אך מסוגלים לקלוט ECP מסביבתם. למרות זאת, ניתן לזהות mRNA של ECP בנויטרופילים לאחר שפעולם (Monteseirin וחב' ב-J Immunol משנת 2007). בניגוד להם, מונוציטים מסוגלים לסנתז ECP, אך יכולת זו אובדת במהלך ההתמיינות של מקרופאגים (Bystrom וחב' ב-APMIS משנת 2001).
ECP מופרש ברקמות על ידי אאזינופילים משופעלים, והפרשה זו יכולה להיות מושרית בשני אופנים; או בתלות ב-IgG או ב-IgA, או באופן שאינו תלוי בנוגדנים אלא ברכיבי משלים כ-C3 ו-C5 (Tomassini וחב' ב-J Allergy Clin Immunol משנת 1991, ו-Carlson וחב' ב-Allergy משנת 1993). גם לאינטרלויקינים IL-5 ו-IL-3 וכן ל-GM-CSF יש השפעה חיובית על הפרשה זו. רקמה אליה הסתננו אאוזינופילים מכילה 2 סוגים של גרנולות אאוזינופיליות ספציפיות: גרנולות ציטופלזמטיות תוך-תאיות וגרנולות חוץ-תאיות, והפרשת גרנולות אלו מתרחשת לאחר שפעול האאוזינופילים. ההפרשה מהגרנולות הציטופלזמטיות בררנית וזו מהגרנולות החוץ-תאיות אינה בררנית ונדירה יותר. הגרונולות החוץ-תאיות כנראה פועלות כחלקיקים בלתי-תלויים לחלוטין, והם מקדמים ריאקציות דלקתיות מקומיות (Neves ו-Weller ב-Curr Opin Immunol משנת 2009). במהלך ההפרשה של ECP מהגרנולות באאוזינופילים, מתרחשת דה-גליקוזילציה אנזימטית ההופכת את הצורה הבלתי פעילה של ECP הגבה-מולקולרי לוריאנט הציטוטוקסי הקטן-מולקולרי (Woschnagg וחב' ב-J Immunol משנת 2009). נמצא שציקלוספורין A הוא בעל השפעה מעכבת של הפרשת ECP, והשפעה מעכבת כזו יש גם ל-dexamethasone, ל-rapamycin, ל-formoterol שהוא אגוניסט ארוך-טווח של β2 וכן ל-pemirolast, שהוא תכשיר נוגד אלרגיה (Meng וחב' ב-Allergy משנת 1997, Eda וחב' ב-Int Arch Allergy Immunol משנת 1993 ו-Kawashima וחב' באותו כתב-עת משנת 1994).
מנגנון הפעולה של ECP
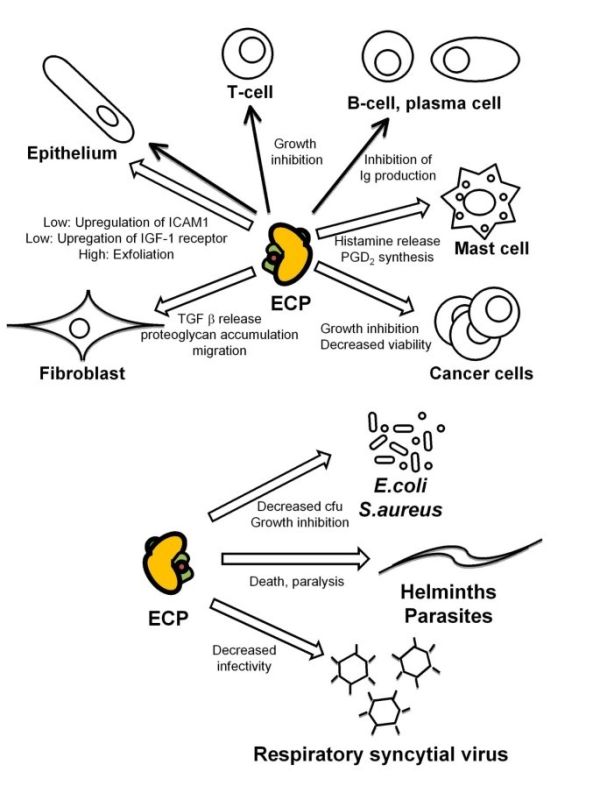
ל-ECP מספר פעילויות ביולוגיות, חלקן בעלות פעילות ציטוטוקסית ואחרות ללא פעילות ציטוטוקסית. הפעילות הציטוטוקסית של ECP אפקטיבית כנגד מגוון רחב של מיקרואורגניזמים: טפילים (McLaren וחב' ב-Parasitol משנת 1984), חיידקים גראם-חיוביים או גראם שליליים (Lehrer וחב' ב-J Immunol משנת 1989), וכנגד נגיפים (Domachowske וחב' ב-Nucl Acids Res משנת 1998).
אפופטוזיס מושרה על ידי ECP
ל-ECP רקומביננטי יש תפקיד בהשריית אפופטוזיס על ידי איתות של TNFα בכך שהוא מגביר בתאים אפיתליאליים ברונכיאליים באדם (BEAS-2B) יצירה והפרשה של TNF-α, מה שמשפעל את האנזים caspase-8. אפופטוזיס המושרה על ידי caspase-8, מה שיכול לגרות תגובה מיטוכונדריאלית או לגרום ישירות שפעול או ביקוע של PARP על ידי caspase-3. נראה ש-ECP רקומביננטי יכול גם להשרות אפופטוזיס שאינו תלוי במיטוכונדריה אלא תלוי בפרגמנטציה של Chang) DNA וחב' ב-BMC Cell Biol משנת 2010). מחקרים מראים ש-ECP לבדו או ביחד עם RNases אחרים, כולל EDN, משרה אפופטוזיס בתאים. נמצא גם ש-ECP גורם לציטוטוקסיות בתאי HeLa ובתאי HL-60, דרך פעילות caspase-3 (Navarro וחב' ב-Cell Mol Life Sci משנת 2008). מחקרים הראו שאאוזינופילים יכולים להשרות מוות בתאי אפיתל, דרך אפופטוזיס ונמק (Trautmann וחב' ב-J Allergy Clin Immunol משנת 2002).
פעילות אנטי-בקטריאלית: לצורך הפעילות האנטי-בקטריאלית של ECP, חיונית האינטראקציה האלקטרוסטטית בין ECP הטעון חיובית לבין הממברנה התאית או דופן החיידק הטעונים שלילית, מה שגורם לדה-סטביליזציה של ממברנת החיידק. מנגנון אחר כורך חדירה חלקית של ECP לתוך ה-lipid bilayer ויצירה של חרירים (pores) מה שמאפשר חדירת מים ו-lysis אוסמוטי של התא. אינטראקציה ספציפית של ECP עם ליפו-פוליסכרידים ופפטידוגליקנים על פני דופן החיידק עלולה לגרום לצימות חיידקים ולמותם (Young וחב' ב-Nature משנת 1986, Torrent וחב' ב-FEBS Journal משנת 2010, ו-Torrent וחב' ב-Biomacromolecules משנת 2010).
פעילות כנגד תולעים: הקשר בין ECP ופעילות אנטי-הלמינטית מבוסס על המידע שבמצבים של מחלות טפיליות מוצאים אאוזינופליה בדם ההיקפי, וכן שהסננות של אאוזינופילים התגלו ברקמות במצב זה על ידי ביופסיה. מספר מחקרים קבעו שאאוזינופילים פועלים על טפילים רק בשלבי ה-larva של ההדבקה, אך לא בצורתם הבוגרת (Kilon ו-Nutman ב-J Allergy Clin Immunol משנת 2004). נראה שבמחלות טפיליות, הנזק לרקמות נגרם לא כתוצאה מפעילות הטפיל עצמו, אלא מהתגובה החיסונית של הפונדקאי. אחת הצורות של תגובה חיסונית כזו היא הבידוד של הטפיל הפתוגני וסביבתו המיידית על ידי יצירת גרנולומה. תאי דם, ובעיקר אאוזינופילים הם חלק מהמבנה של גרנולומות אלו, כאשר לאחר זמן מספר מטופלים מפתחים רבדים פיברוטיים, עם ECP כמתווך ביצירתם. המנגנון לפיו ECPO מתווך ב-remodeling של המשתית (matrix) החוץ-תאית, מאותחל על ידי פעולה כמוטקטית של ECP על פיברובלסטים. בנוסף, ECP מעודד את ההפרשה של תווך פרופיברוטי מהפיברובלסטים, שהוא למעשה tumor growth factor β (להלן TGF-β) (Zagai וחב' ב-Scand J Immunol משנת 2010). הפפטיד 1–45 של ECP מכיל את הפעילות הציטוטוקסית של החלבון כנגד חיידקים (Torrent וחב' ב-Biochem J משנת 2009).
הפעילות האנטי-נגיפית של ECP: פעילות זו מתווכת על ידי פעילות ה-ribonuclease. כיוון ש-ECP משתייך למשפחת RNAse A הוא מבקע כאנדונוקלאז או כאקסונוקלאז מולקולות חד-גדיליות של RNA. פעילות הריבונוקלאז של ECP נמוכה משמעותית מזו של מולקולת EDN (Rosenberg ו-Domachowske ב- J Leukoc Biol משנת 2001). המספר הגדול ביותר של מחקרים על מנגנון הפעולה האנטי-נגיפי של ECP, התבצע על respiratory syncytial virus (להלן RSV). בגלל גודלו (kb15.2 ומבנה הגנום החד-גדילי שלו (Gorafalo וחב' ב-J Pediatr משנת 1992, ו-Domachowke ו-Roseberg ב-Clin Microbiol Rev משנת 1999). מחקרים in vitro הראו ש-ECP אמנם מפחית את האינפקטיביות הנגיפית, אך פעילות הריבונוקלאז עצמה אינה מספקת להשפעה האנטי-נגיפית המלאה, המיוחסת לאאוזינופילים. התכונות האנטי-נגיפיות של ECP, הופכות אותו לבעל פוטנציאל אפשרי בתעשיית התרופות.
פעילות ECP כנגד הפונדקאי עצמו
בנוסף לפעילותו החשובה בהגנה החיסונית של הפונדקאי, יש ל-ECP בגין פעילותו הציטוטוקסית השפעות לוואי לא-רצויות ברקמות הפונדקאי עצמו. תואר נזק נוירונלי (תופעת Gordon) ואף נזק לתאי שריר ולתאי אפיתל של מערכת הנשימה. נראה שהנזק האחרון נגרם על ידי התקשרות ECP ל-heparan sulfate על פני תאים. כמו כן חשובה הפעילות האפופטוטית של ECP בכך שהוא משפעל בתאים את מעגל ה-caspase (Trautmann וחב' ב-J Allergy Clin Immunol משנת 2002, Navarro וחב' ב-J Neuroimmunol משנת 2010, ו-Chang וחב' ב-BMC Cell Biol משנת 2010). לעומת זאת, ההצטברות התוך-תאית של מולקולות ECP קריטית בגרימת נזק לתאי עור במספר דרמטוזות, כאשר המנגנון הפתולוגי בנגעי עור מבוסס על פעילות RNAse וציטוטוקסיות תלויה בקטיונים של מולקולת ECP (Plager וחב' ב-J Immunol משנת 2009).
פעילות לא-טוקסית של ECP
הפעילות הלא-טוקסית של ECP כוללת מספר פעילויות אימונו-מודולטוריות כגון עיכוב של שגשוג תאי-T, שדרוג של קולטנים ומולקולות ספיחה על פני תאי אפיתל, וכן הפרשה של היסטמין על ידי בזופילים. פעילות ספציפית של ECP היא remodeling רקמתי שנלמד בעיקר במודל של אסתמה. פעילות ECP בתהליכים של תיקון רקמתי מתחילה עם פעילותו הכמוטקטית על פיברובלסטים. יתרה מכך, ECP מעודד הפרשה של TGF-β שהוא גורם בעל פעילות פרופיברוטית על ידי שינוי המטבוליזם התוך-תאי של פיברובלסטים. בנוסף להגברת הסינתזה של פרוטאוגליקנים, ECP מתווך בעיכוב הדגרדציה של פרוטאוגליקנים מה שגורם להצטברות תוך-תאית של פרוטאוגליקנים (Gomes וחב' ב-J Allergy Clin Immunol משנת 2005). ECP מעורב גם בתהליך הטרשתי, בכך שהוא מאפשר ספיחת מונוציטים על פני תאי אנדותל, וגם כרוך בקסקדת הקרישה, ובעל השפעה מייצבת של הרובד הטרשתי (Niccoli וחב' ב-Atherosclerosis משנת 2010).
ECP ואסתמה
ECP נחקר באופן אינטנסיבי כסמן אפשרי של אסתמה, כיוון שהפעילות ההפרשתית של אאוזינופילים היא מרכיב חשוב בפתו-פיזיולוגיה של אסתמה. חלבונים בסיסיים מהגרנולות באאוזינופילים משרות נזק רקמתי, דלקת בדרכי אוויר, ו-remodeling של דרכי האוויר. עם זאת, ECP חסר השפעה על ההפרשה של תווכים פעילים ברמת הסימפונות או על תגובת-יתר של דרכי האוויר (Venge ב-Allergy משנת 2004, ו-Joseph-Bowen וחב' ב-J Allergy Clin Immunol מאותה שנה). רמת ECP בנסיוב של חולים אסמתיים נמצאת במתאם עם ממצאי ביופסיה על אאוזינופילים ברירית דרכי האוויר ועם הנתונים הקליניים. אף על פי שמחקרים רבים הצביעו על הקשר בין ECP ואסתמה, קביעת רמת ECP אינה סמן אבחוני מתאים של אסתמה כיוון ששינויים ברמת ECP בנסיוב נרשמו גם במחלות אטופיות אחרות כגון נזלת אלרגית, אך גם במחלות אטופיות אחרות שאינן קשורות לדלקת אאוזינופילית כגון סינוסיטיס בקטריאלי. יתרה מכך, אאוזינופילים ו-ECP הם פרמטרים שהשימוש בהם מוגבל רק לסוג האלרגי של אסתמה.
עם זאת, כיוון שריכוז ECP ברקמות ובנוזלי-גוף תואם את פעילות המחלה, ECP עשוי לסייע בהערכה של חומרת המחלה ולהגיע להחלטה בדבר סוג הטיפול והאינטנסיביות שלו בעיקר בילדים, על ידי מעקב אחר שינויים ברמת ECP לאחר התחלת הטיפול, ניתן לנטר את יעילות מינונה של תרופה מסוימת, ולתקן בשעת הצורך את המינון כדי למנוע מינון-יתר, או למנוע התקף-אסתמה כתוצאה ממינון נמוך מדי. הגדלת הריכוז של ECP בנסיוב במהלך של התקף או החמרה במחלה, היא בעלת משמעות קלינית.
באסתמה, החמרה והתקפים עלולים להתרחש גם ללא עלייה ברמת ECP בנסיוב בחלק מהמטופלים האסתמטיים בגיל המתקדם עם מחלה ממושכת. בניגוד לכך, רמות מוגברות של ECP נרשמו במצבים בהם ההחמרה הושרתה על הדבקה נגיפית עם מספר תקין של אאוזינופילים בדם ההיקפי (Matsumoto וחב' ב-Clin Exp Allergy משנת 2001). מדידה של פעילות אאוזינופילית בגיל מאוד צעיר, עשויה לסייע בניבוי ההתפתחות של אסתמה בגיל בית הספר. לפיכך, ילדים בגיל הרך המאושפזים בגין נשימה שורקנית כתוצאה מזיהום בדרכי הנשימה, ואשר רמת ECP בנסיוב שלהם גבוהה מ-20 מיקרוגרם/ליטר, הם בעלי סיכון מוגבר משמעותית לסבול מאסתמה כרונית בגיל בית הספר (בספציפיות של 93%, ורגישות של 30%) (Hyvarinen וחב' ב-Pediatr Allergy Immunol משנת 2010).
ECP והיפר-אאוזינופיליה
היפר-אאוזינופיליה הוא ממצא מעבדתי שכיח המתרחש במקרים של פרזיטוזיס רקמתי, מצבים דלקתיים או אלרגיים, וכן בממאירויות, כמו גם בתרחיש של אאוזינופיליה שבטית האופיינית לממאירות המטולוגית, או מסיבות עלומות (מה שידוע כ-idiopathic eosinophilia syndrome (להלן IHES). מספר האאוזינופילים בדם ההיקפי משקף את סטאטוס המאזן העכשווי בין תאים המופרשים ממח העצם לבין תאים רקמתיים. עם זאת, מספר האאוזינופילים אינו מגלה דבר באשר להסננה הרקמתית של אאוזינופילים ופעילותם. קביעה של ריכוז ECP בפלזמה ושל היחס בין ECP לבין ספירת האאוזינופילים עשויה לסייע לאבחון המבדיל של היפר-אאוזינופיליה. נמצא שהערכים של ECP ושל היחס האמור, היו הגבוהים ביותר במטופלים עם IHES, וכן שערכים אלה במטופלים עם אאוזינופיליה פעילה וממאירות מאשר במטופלים עם אאוזינופיליה פעילה ודלקת. עם זאת, לא ניתן להבדיל בין אאוזינופיליה שבטית לבין אאוזינופיליה פעילה על בסיס הריכוז של ECP והיחס ECP/eosinophilic count.
רמת ECP בנסיוב ובפלזמה: רמת ECP בנסיוב גבוהה מרמתו בפלזמה כיוון שנוגדי-קרישה גורמים לאינאקטיבציה של אאוזינופילים וחוסמים על כן דה-גרנולציה ex vivo (Reimert וחב' ב-J Immunol Meth משנת 1993, ו-Venge ו-Peterson ב-Allergy משנת 2000). בצירקולציה, ECP מופיע כחלבון חופשי וגם בצורת קומפלקס. ECP נקשר ל-α2-macroglobulin ותקופת מחצית החיים של ECP בצירקולציה היא בערך 45 דקות (Peterson ו-Venge ב-Biochem J משנת 1987). רמת ECP בנסיוב מייצגת את פעילות ההפרשה של אאוזינופילים במהלך קרישת הדם, ולפיכך ריכוז ECP מעל 2–20 מיקרוגרם/ליטר, גבוהה עד פי-10 מריכוזו בפלזמה. רמת ECP בנסיוב מאפשרת הבדלה קלה יותר בין נבדקים בריאים וחולים בהשוואה לרמת ECP בפלזמה, כיוון שההשפעה של turnover של ECP in vivo מתבטלת בנסיוב. עם זאת, כדי לוודא פירוש נכון של רמת ECP בנסיוב, יש צורך להקפיד על תנאים תקניים בדגימת הדם למטרת קביעה זו (Pronk-Admiraal וחב' ב-Scand J Clin Lab Invest משנת 1994, ו-Hoekstra וחב' ב-Pediatr Allergy Immunol משנת 1998). למעשה, סוג מבחנת איסוף הדם, הטמפרטורה ומשך קרישת הדם, צנטריפוגציה והימוליזה, כל אלה עלולים לגרום לתוצאה מוגברת כזובה של רמת ECP בנסיוב.
רמת ECP באנשים בריאים מאופיינת על ידי מגוון תוצאות באותו נבדק עצמו שיכול להגיע עד 27% (Sjosward וחב' ב-Respiration משנת 2004). במהלך של 24 שעות, רמות ECP גבוהות יותר בשעות הלילה אם כי רמת השיא שלו נקבעת בשעה 6 בבוקר (Wolthers ו-Heuck ב-Pediatr Allergy Immunol משנת 2003). על מנת להפחית את ההשפעה של הווריאציות הצירקדיאניות על ריכוז ECP בנסיוב, מומלץ שבהשוואות ארוכות-טווח של רמתו, מדידת ECP תתבצע באופן עקבי באותה שעה משעות היום. בנוסף לשינויים היומיים ברמת ECP, ידוע גם על שינויים עונתיים בריכוז ECP שתוארו בילדים לא-אטופיים (Perdousi וחב' ב-Pediatr Allergy Immunol משנת 2001) יתרה מכך, פולימורפיזמים בגן המקודד ל-ECP, משנים את רמת ביטוי האנזים RNASE3, ואף הם אחראיים לשינויים בין-אינדיבידואליים בריכוז ECP בנסיוב (Munthe-Kaas וחב' ב-Allergy משנת 2007).
רמת ECP בכיח: קביעת ריכוז ECP בכיח, מספקת מידע מדויק על תהליך דלקת מקומית במטופלים עם אסתמה, באלה עם COPD או עם ציסטיק פיברוזיס (Haahtela ב-Ann Med משנת 2002, Bartoli וחב' ב-Respiration משנת 2009, Metsto וחב' ב-Thorax משנת 2002, ו-Keatings וחב' ב-Am J Respir Crit Care Med משנת 1997). יתרה מכל, ריכוז ECP בכיח (20-1,280 מיקרוגרם/ליטר) גבוה משמעותית מאשר ריכוזו בנסיוב. לפיכך, השימוש בכיח כחומר ביולוגי שגרתי כרוך בקשיים מסוימים: דגימה הכיח מיוצרת ספונטנית או מושרית באמצעים שונים, ההתנהלות הקדם-אנליטית על מנת להפריד תאים מהכיח, וההשפעה של זיהום כיח על ידי רוק, כל אלה עלולים להשפיע על הערכה מדויקת של ריכוז ECP (Simpson וחב' ב-Eur Respir J משנת 2004 ו-Kelly וחב' באותו כתב-עת משנת 2002).
רמת ECP ברוק: הריכוז של ECP ברוק הוא 250–450 מיקרוגרם/ליטר. דגימת הרוק פשוטה יחסית, וגם מתאימה לילדים. לא נמצא אישור למתאם בין ריכוז ECP ברוק ובנסיוב (Koh וחב' ב-J Asthma משנת 2010).
רמת ECP בנוזל שטיפת ריאות (BAL): הריכוז של ECP בנוזלי lavage אפיים וברונכו-אלבאולריים נמוך מאוד, ואיסוף הדגימות כרוך בשיטות חודרניות. יתרה מכך, נוזל השטיפה האפי מאופיין על ידי וריאציות משמעותיות באותו נבדק בשיעור של 123% (על פי Boot וחב' ב-J Investig Allergol Clin Immunol 2008 משנת 2008). שיטה חדשנית לאיסוף הפרשה אפית על ידי מכשיר איסוף ייעודי, היא בעלת יתרונות אחדים (Lu ו-Esch ב-J Immunol Methods משנת 2010). שיטה זו שימושית לאנליזה של דלקת אפית וכן כמעקב אחר מהלך הטיפולים (Rondon וחב' ב-J Allergy Clin Immunol משנת 2009).
רמת ECP בצואה: רמה זו נחקרה באופן אינטנסיבי כסמן חדש פוטנציאלי של מחלת דלקת במעיים (IBD) ובגסטרואנטריטיס אאוזינופילי. בעבר היה נהוג לאבחן IBD על בסיס היסטולוגיה קונבנציונלית שהדגימה נוכחות אאוזינופילים ברירית המעי, מה שחייב גישה חודרנית, מכאיבה, מגושמת ובלתי נעימה לנבדק. איסוף צואה אינו חודרני וזול לביצוע, ורמת ECP בדגימת הצואה, אינה תלויה במספר האאוזינופילים וברמת ECP בנסיוב, מה שהופך שיטה זו לסמן מעי פוטנציאלי. כמו כן רמות ECP בצואה, אינן משתנות בתלות בגיל ובמגדר, ואינן מושפעות מרמות IgE בנסיוב (Silva וחב' ב- Scand J Clin Lab Invest משנת 2007). נמצא שהרמה הממוצעת של ECP בצואה היא 1.93 מיקרוגרם/גרם צואה, כאשר סף הנורמה העליון הוא 2.80 מיקרוגרם/גרם צואה.
ECP ודגימות ביולוגיות
מוצאים ECP במספר נוזלי-גוף כגון פלזמה, נסיוב, כיח, שטיפת ריאות, bronchoalveolar lavage (להלן (BAL), רוק, נוזל אפי, דמעות, נוזל המעי הריק (jejunum), צואה ונוזל השדרה. הקשיים להשגה של חלק מדגימות נוזליות אלו גורמים לכל שהנסיוב הוא נוזל הגוף השימושי ביותר למדידת רמת ECP.
ECP ולימפוציטים
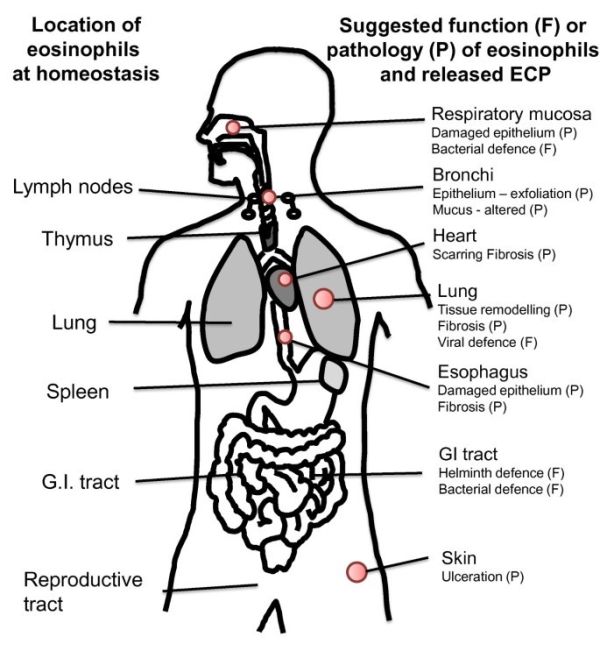
שפעול של לימפוציטים נמצא במתאם עם החמרה חריפה באסתמה (Kocak וחב' ב-Allergy Asthma Proc משנת 2006). רמת ECP בנסיוב יורדת במהלך תרפיה אימונית המדכאה פעילות לימפוציטים (Marcucci וחב' ב-Pediatr Allergy Immunol משנת 2005). אאוזינופילים נמצאו נודדים לבלוטות לימפה שם הם עשויים להגיב עם לימפוציטי-T. אאוזינופילים משדרגים את MHC class II (Yamamoto וחב' ב-Am J Respir Cell Mol Biol משנת 2000) לצורך הצגת אנטיגן, ובכך כנראה תורמים לשפעול של תאי-T ולהגברת התגובה הדלקתית בעת של דלקת אלרגית (Shi וחב' ב-J Clin Invest משנת 2000). אאוזינופילים מצויים גם באיברים עתירי-לימפוציטים כגון טימוס, טחול וב-lamina propria של המעיים (Kato וחב' ב-Anat Rec משנת 1998). במחקרים in vitro נמצא ש-ECP משפיע על השגשוג של לימפוציטי T ו-B in vivo (תמונה למטה).
ECP ותאי פיטום (mast cells)
תאי פיטום מצויים בעור ובכל הרקמות הריריות במצב של הומאוסטאזיס, ומספרם גדל בריאות של חולי אסתמה (Amin וחב' ב-Am J Respir Crit Care Med משנת 2000). המספרים של תאי פיטום ושל אאוזינופילים נמצאים במתאם עם היפר-אקטיביות ברונכיאלית (Sont וחב' ב-Thorax משנת 1996), אם כי ECP אינו משרה היפר-אקטיביות זו (Gundel וחב' ב-J Clin Invest משנת 1991). מספר ראיות מצביעות על "דו-שיח" בין אאוזינופילים ותאי פיטום (Minai-Fleminger ו-Levi-Schaffer ב-Inflamm Res משנת 2009), הקשור במידה מסוימת להפרשת ECP. תאי פיטום מייצרים ומפרישים IL-5 ,PAF ו-LTB4 הידועים בהגברתם את הפרשת ECP מאאוזינופילים. היסטמין ומעט tryptase מופרשים מתאי פיטום בלב אדם, כאשר אלה עברו גירוי על ידי רמות מתונות של ECP (4.7 מיקרוגרם/מ"ל). הפרשת היסטמין זו בהשריית ECP התרחשה תוך 60 שניות ונמצאה תלויה ב-+Ca2 ובטמפרטורה, ו-ECP לא היה טוקסי לתאים אלה. תוצר נוסף של תאי פיטום, prostaglandin D2 (להלן PGD2) סונתז de novo על ידי אותה כמות של ECP .PGD2 הוא גריין כימי של אאוזינופילים ולימפוציטי TH2 על ידי התקשרות לקולטן CRTH2 (Luster ו-Tager ב-Nat Rev Immunol משנת 2004). לפיכך, ממצאים אלה מרמזים שברקמות מסוימות האינטראקציות בין תאי פיטום ואאוזינופילים יכולות להיות מיוחסות למשוב חיובי של הפרשת ECP.
ECP ותאי אֶפִּיתֶל
ECP מתגלה ברירית האף בהקשר של נזק לאפיתליום (Amin וחב' ב-J Allergy Clin Immunol משנת 2001), כמו גם בנזק לאפיתליום הקרנית (Messmer וחב' ב-Am J Ophthalmol משנת 2002). התפקיד של ECP נבחן בגין נוכחות אאוזינופילים בדרכי האוויר, ונמצאו תוצאות של הרס אך גם של אי-הרס בהתאם לריכוזי ECP באינטראקציה עם האפיתליום. ריכוזי ECP גבוהים (103 מיקרוגרם/מ"ל) גרמו להתקלפות של תאי רירית לאחר 6 שעות של הדגרה עם האפיתל הטרכאלי בחזירי-ים (Motojima וחב' ב-Am Rev Respir Dis משנת 1989). תאי אפיתל של קרנית אדם המודגרים עם ECP בריכוזים של 0–100 מיקרוגרם/מ"ל. מראים שינויים מורפולוגיים בתלות בריכוז של ECP, כאשר הריכוז הגבוה ביותר של 100 מיקרוגרם/מ"ל הוא טוקסי לתאים אלה (Trocme וחב' ב-Invest Ophthalmol Vis Sci משנת 1997). ECP בריכוז של 2.5 מיקרוגרם/מ"ל, גרם להשפעה דומה על תאי טרכיאה באדם (Lundgren וחב' ב-J Allergy Clin Immunol משנת 1991). מחקר אחר הראה שתאי אפיתל מאדם עוברים נמק בריכוזי ECP גבוהים יותר (10 מיקרוגרם/מ"ל) (Trautmann וחב' באותו כתב עת משנת 2002). כן נמצא ש-ECP פועל in vitro ישירות על הרירית של דרכי האוויר. בריכוזים נמוכים (2.1 מיקרוגרם/מ"ל) ECP נמצא מגביר את הביטוי התוך-תאי של מולקולת הספיחה ICAM-1 בתאי אפיתל אפי (Altman וחב' ב-J Allergy Clin Immunol משנת 1993). הוצע גם ש-ECP יכול לתווך ב-remodeling רקמתי. כאשר ריכוזים נמוכים של ECP (20 מיקרוגרם/מ"ל) שימשו לגרות למשך 16 שעות את שורת התאים NCI-H292 שמקורה באפיתל הברונכיאלי, הקולטן של insulin growth factor-1 עבר שדרוג (Chihara וחב' ב-Int Arch Allergy Immunol משנת 1996).
ECP ופיברובלסטים: רמה הגבוהה באופן עקבי של אאוזינופילים ו-ECP בריאות של חולים עם אסתמה אלרגית, הולידה את המחשבה של השתתפות שני אלה ב-remodeling של רקמת הריאות, כמו גם ב-remodeling של רקמת הוושט במטופלים עם eosinophil esophagitis (Straumann וחב' ב-Gastroenterology משנת 2003). ה-remodeling בריאות אסתמטיות נגרם בחלקו על ידי הפרשת קולאגן ופרוטאוגליקן מפיברובלסטים אינטרסטיציאליים. הוצע שאאוזינופילים משתתפים בהפרשה של transforming growh factor β (להלן TGF-β) (Minshall וחב' ב-Am J Respir Cell Mol Biol משנת 1997, ו-Cho וחב' ב-J Clin Invest משנת 2004), והוצע ש-ECP יכול להשפיע על התפתחות פיברוזיס. גירוי של שורת התאים HFL1 שמקורה בפיברובלסטים עובריים של עובר אנושי, על ידי ECP בריכוז מתון/גבוה של 5-10 מיקרוגרם/מ"ל למשך 24–48 שעות, גרם להפרשת TGF-β (Zagai וחב' ב-Inflammation משנת 2007). בנוסף, כאשר ECP הודגר עם שורת תאים פיברובלסטים למשך 6 שעות, נגרמה עלייה של פי-6 בהצטברות התוך-תאית של פרוטאוגליקן (Hernnas וחב' ב-Eur J Cell Biol משנת 1992).
ECP ותאי שריר חלק ברונכיאליים
תאי שריר חלק ברונכיאליים מעורבים במהלך התקדמות התפתחות אסתמה, על ידי הפרשה של ציטוקינים. נמצא שאאוזינופילים ממוקמים בקרבה גדולה לתאי שריר חלק, ו-ECP בריכוזים גבוהים הוא ציטוטוקסי לרקמה זו, עד כדי גרימת מוות תאים על ידי נמק תוך שעה אחת. לעומתו, TNF-α גורם לאפופטוזיס של תאי שריר חלק (Solarewicz-Madejek וחב' ב-Clin Exp Allergy משנת 2009).
ECP בממאירויות
אאוזינופילים נמצאים מדי פעם מסתננים לתוך גידולים סרטניים מתפתחים וכנראה נלחמים בתאים אלה (Lowe וחב' ב-J Clin Pathol משנת 1981). מעורבות זו של אאוזינופילים הוצעה כתוצאה מהממצא של רמות מוגברות של ECP בנסיוב של חולים עם סרטן כליה (Trulson וחב' ב-Br J Haematol משנת 1997). מדידה של ECP בשתן של חולים עם סרטן שלפוחית השתן מצאה רמה מוגברת פי-2 של ECP בהשוואה לזו באנשים בריאים (Lose ו-Frandsen ב-Urol Res משנת 1989). רמות מוגברות אלו של ECP מצביעות על נוכחות של אאוזינופילים משופעלים בחולים עם סוגי סרטן אלה. באנליזה של המעורבות האפשרית של ECP בהגנה מפני ממאירות, בוצעה הערכה של ECP בהיבט של שגשוג משתנה של שורות תאים שונות. שורות התאים K562 ו-HL-60, הודגרו עם ECP בריכוז של 21 מיקרוגרם/מ"ל, ושורת התאים A431 הודגרה עם ECP בריכוז של 76 מיקרוגרם/מ"ל, מה שהביא לעיכוב של 50 אחוזים בשגשוג תאי סרטן אלה לאחר 4 ימים. על מנת לבחון האם עיכוב שגשוג התאים נובע מהמטען החיובי של ECP או בגלל פעילות RNAse, poly-lysine או RNAse נוסו אך ללא השפעה (Fan וחב' ב-J Biol Chem משנת 2008). ECP קיים בשתי צורות בתלות בפולימורפיזם, R97 ו-T97. נמצא שצורת ה-T97 היא בעלת יכולת מופחת להרוג תאי K562 ו-NCI-H69 (Yang וחב' ב-J Exp Med משנת 2008). נמצא ש-ECP נקשר לשטח הפנים של תאי HeLa וגרם למותם תוך 24 שעות על ידי הגברה של הריכוז התוך-תאי של רדיקלים חומציים (ROS) ופעילות דמוית-caspase-3 (Navarro וחב' ב-Cell Mol Life Sci משנת 2008). תערובת של ECP ו-EDN שבודדו משתן והודגרו עם שורת תאי KS Y-1 שמקורה בסרקומה ע"ש Kaposi למשך 16 שעות גרמו למוות מוחלט של תאים אלה בריכוז של 0.625 מיקרוגרם/מ"ל. לשם השוואה, 1 מיקרוגרם של ECP רקומביננטי שיוּצר בשמרים, והוּדגר למשך 16 שעות עם תאי KS Y-1 הפחית את חיוניות התאים ב-29%. חלבון ECP רקומביננטי המיוצר בשמרים משולל גליקוזילציה, מה שעלול להשפיע על פעילותו הביולוגית (Al-Oweis וחב' ב-Cancer Lett משנת 2002).
הוראות לביצוע הבדיקה
יש לדגום דם למבחנה כימית (פקק אדום או צהוב). יש להמתין לקרישת הדם בטמפרטורת החדר. כל מעלת צלזיוס מעל טמפרטורה זו עלולה להניב תוצאת ECP מוגברת ב-10-15%. זמן קרישה רצוי הוא 20-25 דקות, ואם משהים את דגימת הדם להיקרש למשך 60–120 דקות, הדבר עלול לתת תוצאות ECP מוגברות כזובות. יש לסרכז את דגימת הדם הקרוש בטמפרטורת החדר, ואת הנוזל העליון יש להעביר למבחנת פוליפרופילן או פולי סטירן לא יאוחר משעה אחת לאחר סיום הסרכוז. יש לפסול דגימת דם המוליטית. את הנסיוב ניתן לשמור עד 5 ימים בקירור או עד 90 יום בהקפאה במינוס 20 מעלות צלזיוס.
מדידת ECP יכולה להתבצע או על ידי radioimmunoassay תחרותי תוך שימוש בערכת ECP-RIA של Pharmacia-KABI או בשיטת inductively coupled plasma mass spectrometry שהיא צורה של מס ספקטרומטריה (ICP-iMS). מקובלת יותר שיטת ELISA.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק