פוליפפטיד לבלבי - Pancreatic polypeptide
| מדריך בדיקות מעבדה | |
| פוליפפטיד לבלבי | |
|---|---|
| Pancreatic polypeptide | |
| שמות אחרים | HPP |
| מעבדה | כימיה בדם, אנדוקרינולוגיה בדם |
| תחום | הערכה הורמונאלית של פעילות בלוטת הלבלב, גילוי גידולים נוירו-אנדוקריניים בבלוטה, והערכה של תפקוד הוואגוס לאחר ארוחה. |
| יחידות מדידה | פיקוגרם/מ"ל |
| טווח ערכים תקין | בדם - גיל 0-19 שנה: פחות מ-196; גיל 20-29 שנה: פחות מ-228; גיל 30 עד 39 שנה: פחות מ-249; גיל 40 עד 49 שנה: פחות מ-270; גיל 50 עד 59 שנה: פחות מ-291; גיל 60 עד 69 שנה: פחות מ-312; גיל 70 עד 79 שנה: פחות מ-332. על פי Tong וחב' ב-Diabetologia משנת 2007, רמת פ"פ של גברים גבוהה ב-20% בממוצע בהשוואה לרמתו בנשים. |
| יוצר הערך | פרופ' בן-עמי סלע |
ממצאים מוקדמים
פ"פ בודד לראשונה על ידי Kimmel וחב' בשנת 1968, ודווח ב-Endocriniology כ"פרקציה מזהמת" במהלך ניקוי אינסולין מבלוטת הלבלב של תרנגול, והוא למעשה הפפטיד הראשון שהתגלה השייך למשפחת הפוליפפטידים הפנקריאטיים. בשנת 1975 אותה קבוצת חוקרים תיארה באופן מדויק יותר ב-J Biol Chem את הרכב פפטיד זה. בהמשך, בודד פ"פ ממגוון בעלי חיים כולל חולדה, חזיר, חתול בקר ועופות, ונמצא שכל אלה זהים באורכם (36 חומצות אמינו), והם שונים ביניהם ב-1 עד 4 חומצות אמינו, כאשר פ"פ מעופות הוא השונה ביותר מזה של בני-אדם (שוני ב-17 חומצות אמינו). המשקל המולקולארי של פ"פ של רוב פ"פ מבעלי חיים שונים הוא כ-4,200 דלטון.
פעילותו הביולוגית של פ"פ נקבעת על בסיס 6 חומצות האמינו בקצה ה-C טרמינאלי שלו, ועל בסיס הטירוזין האמידי ה-C טרמינאלי. לגבי מבנה הפפטיד, מהקצה ה-N טרמינאלי מופיע סליל פוליפרוליני, β-turn וסליל-α, עד למבנה ה-hexa-פפטידי ה-C טרמינאלי. כאשר גיבשו את הפפטיד נמצא מבנה שלישוני גלובולארי, ממנו מזדקר החוצה המבנה ה-hexa-פפטידי ה-C טרמינאלי. לפ"פ יש הומולוגיה של 50% בערך עם 2 הפפטידים האחרים במשפחת פפטידים זו, PYY ו-NPY.
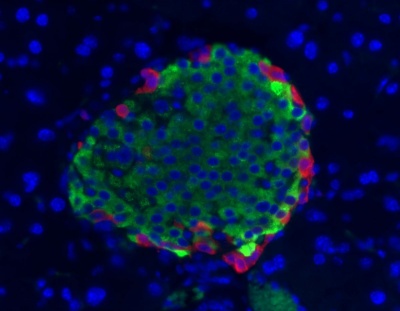
פ"פ הוא פפטיד אימונוגני וניתן על ידי גישה אימונו-היסטוכימית למקם אותו לתאים ספציפיים בשוליים של איי-לנגרהנס, כפי שהראו לראשונה Greider וחב' בפנקראס של כלב בו מוקם פ"פ בתאי F (J Histochem Cytochem, משנת 1978) מודגם בתמונה:
הגראנולות המפרישות פ"פ הן בדרך כלל קטנות יותר מהגראנולות המפרישות הורמונים פנקראטיים אחרים מאיי לנגרהנס. הן נראות דחוסות בכל נפח הגראנולה, בניגוד לגראנולות של תאי β המפרישים אינסולין ו-amylin, בהם נראית הילה מבהיקה העוטפת את ליבת הגראנולה. התאים מפרישי פ"פ זכו במרוצת השנים למספר שמות: תאי F, תאי גאמא, ותאי PP, אך הכוונה לאותם תאים עצמם. תאים אלה מפוזרים בפארנכימה האקסוקרינית ובאופן מקרי אף מוצאים אותם באפיתל של צינוריות הפנקריאס. כמות תאים אלה שמחוץ לאיי-לנגרהנס אופיינית יותר לתרנגולות, בהשוואה לתמונה ביונקים שונים, כאשר באדם יש רק מיעוט של תאים מפרישי פ"פ שאינם ממוקמים באי-לנגרהנס (Taylor וחב' ב-J Clin Endocrinol Metabol משנת 1982).
מאפיין נוסף של תאי PP הוא שהם מרוכזים בעיקר בראש הפנקריאס על פי Rahier וחב' ב-Cell Tissue Res מ-1979. כמויות קטנות של תאי PP נמדדו על ידי RIA בקיבה, במעי ובמעי הגס (Adrian וחב' ב-Gut משנת 1976), וכמובן שניתן למצוא תאים אלה במערכת העצבים המרכזית (Holzer וחב' ב-Neuropeptides משנת 2012 ו-Olschhowka וחב' ב-Peptides משנת 1981).
בסיס פיזיולוגי
פ"פ הוא חבר במשפחת הפוליפפטידים הפנקריאטיים הכוללת בנוסף גם את פפטיד-YY או PYY, וכן את נוירופפטיד-Y או NPY, שהתגלו על בסיס המאפיין הביוכימי שלהם (טירוזין אמידי בקצה ה-C טרמינאלי של הפפטיד) על ידי Tatemoto וחב', ותוארו ב-2 מאמרים ב-Nature וב-Proc Natl Acad Sci משנת 1982. משפחת פפטידים זו היא בעלת השפעה אנדוקרינית, פאראקרינית ונוירוקרינית, כאשר NPY הוא נוירוטרנמיטור אמיתי המופרש מקצות תאי עצב, בעוד ש-PYY ופ"פ הם הורמונים הפועלים באופן פאראקריני ואנדוקריני. הגן השייך למשפחת PPY/PP/NPY מקודד לחלבון קודמן בעל 95 חומצות אמינו בעל משקל מולקולארי של 8-10 אלף דלטון המסונתז בתאי ללנגרהנס, הידוע כ-preproPP, על פי Schwartz וחב' משנת 1980 ב-J Biol Chem. ביקוע מולקולת קודמן זו מהקצה ה-C טרמינאלי שלו, מביאה ליצירת 2 פוליפפטידים, ההורמון הפעיל עם 36 חומצות האמינו, ופפטיד בעל 20 חומצות אמינו (icosapeptide) שנוצר לאחר הביקוע שתפקידו אינו ברור.
הפעילות של פוליפפטיד פנקראטי
הפעילות הפיזיולוגית החשובה ביותר של פ"פ היא לכאורה בהקשר של צריכת מזון. במודל של בעלי-חיים, ביטוי יתר של פ"פ כרוך במשקל גוף מופחת ובצריכת מזון פחותה, וכך בהגנה מפני השמנת-יתר. הדיווחים על פעילויות ביולוגיות של פ"פ היו קשורים בעיקר לאלה של מערכת העיכול, אם כי החשיבות הפיזיולוגית לא תמיד ברורה. בנוסף לפעילותו בהקשר להפרשה פנקריאטית כפי שיפורט בהמשך, טיפול בפ"פ אקסוגני נמצא משפיע על הפרשות והתרוקנות הקיבה וכיס המרה, ועל התנועתיות של צינור העיכול. פ"פ נמצא מעכב או מעודד הפרשת חומצת קיבה בכלבים בתלות בתנאי הניסוי (Lin וחב' ב-Am J Physiol משנת 1977). בניגוד לכך, נמצא בניסוי בבני-אדם על ידי Greenberg וחב', שעירוי של פ"פ היה ללא כל השפעה על הפרשת חומצת קיבה או זו של פפסינוגן (Acta Hepatogastroenterol משנת 1978).
למרות שניסויים מוקדמים קבעו שפ"פ עיכב יצירת חומצת מרה בכבד, מחקרים מאוחרים יותר מצאו שהשפעה זו נבעה מהרפיה של כיס המרה באופן שהפחית הפרשת מיץ מרה (Adrian וחב' משנת 1982 ב-Am J Physiol). לא נמצאה השפעה של פ"פ על הפרשה או ספיגה במעיים. סקירה של Taylor משנת 1989, מצביעה על כך שההשפעות של פ"פ על התנועתיות בצינור העיכול, כוללות את הגברת הלחץ בספינקטר התחתון של הוושט, וכן זירוז התרוקנות הקיבה בחולדה אם כי לא באדם. בנוסף, לפ"פ השפעה מעכבת על תדירות גלי התכווצות הקיבה (gastric pacemaker activity), וכן השפעה המפחיתה את הלחץ בכיס המרה. מחקר עדכני יותר בעכברים משנת 2010 של Moriya וחב' ב-Eur J Pharm, הדגים שפ"פ מזרז את התכווצות שרירי המעי הגס, ומחיש את התרוקנות הצואה דרך פעילותו על הקולטן T4 של נוירופפטיד Y.
בשנת 2005 התפרסם ב-J Clin Endocrinol Metabol מחקרם של Schmidt וחב', בו הם בחנו במתנדבים בריאים את ההשפעה של עירוי פ"פ סינתטי על קצב התרוקנות הקיבה ממזון מוצק לאחר ארוחה. בניסוי זה קבלו 8 משתתפים עירוי של פ"פ במינון של 2.25 פיקומול'/ק"ג משקל/דקה, בעוד ש-6 משתתפים טופלו על ידי עירוי saline. נמצא שפ"פ שניתן בעירוי, גרם לעיכוב של 41 דקות בממוצע בהתרוקנות הקיבה, בהשוואה לעירוי saline, אם כי לא נמצא הבדל בתחושת השובע, הכמיהה למנת מזון נוספת לאחר הארוחה הראשונה, בין המוזרקים בפ"פ לעומת saline. יחד עם זאת, העלייה הצפויה ברמת גלוקוזה וברמת אינסולין לאחר הארוחה במטופלי saline, נשמרה לפרק זמן ממושך יותר כתוצאה מהטיפול ב-פ"פ.
בחולדות נמצאו אך השפעות מטבוליות מתונות של פ"פ, כולל הדיכוי של הפרשת אינסולין וסומאטוסטטין על ידי Arimura וחב' ב-Biochem Biophys Res Commun משנת 1979. לעומת זאת בעופות נמצאה השפעה של פ"פ בהתרוקנות מאגרי גליקוגן בכבד. בבני-אדם בריאים פ"פ הפחית מעט את רמתו הבסיסית של אינסולין בפלזמה, אך לא השפיע הפרשה של אינסולין או של גלוקאגון, מושרית על ידי גלוקוזה או על ידי ארגינין (Adrian חב' משנת 1980 ב-Eur J Clin Invest.
מחקרים בבני-אדם עם חסר בפ"פ כתוצאה מכריתת בלוטת הלבלב או בגלל פנקראטיטיס כרונית, הראו שעירוי של פ"פ אקסוגני יכול למנוע עמידות של הכבד לאינסולין ומשפר בהם את המטבוליזם של גלוקוזה (Brunicardi וחב' ב-J Clin Endocrinol Metabol משנת 1996, ו-Seymour ןחב' ב-Surgery משנת 1988). תוצאות אלה יכולות להסביר את העמידות המבודדת של תאי הכבד לאינסולין בחולי סוכרת הקשורה לפנקראטיטיס כרונית, לגידולי בלוטת הלבלב, לכריתת הלבלב, לטראומה של הלבלב ול-cystic fibrosis. Nguyen וחב' זיהו על פני תאי כבד חולדה אתרי קישור בזיקה גבוהה של פ"פ.
התפקיד הפוטנציאלי של פ"פ כגורם של שובע, החל מושך תשומת לב לאחר התצפית של Zipf וחב' משנת 1081 ב-J Clin Endocrinol Metabol על כך שהפרשת פ"פ נמנעת כמעט לחלוטין בילדים שמנים עם תסמונת Prader-Willi. גם Glaser וחב' הראו ב-Horm Metab Res משנת 1988, שרמת פ"פ בפלזמה של אנשים שמנים נמוכה. לעומת זאת נמצא שרמת פ"פ גבוהה בדמם של הסובלים מאנורקסיה נרבוזה (Fujimoto וחב' ב-Biol Psychiatry מ-1997 ו-Uhe וחב' ב-Am J Clin Nutr משנת 1992). הקשר של פ"פ לצמצום צריכת מזון התברר גם ממחקרם של Berntson וחב', בו הראו שעירוי של פ"פ באלה עם תסמונת Prader-Willi מפחיתה בהם את צריכת המזון (Peptides מ-1993), וכן ממחקרים המצביעים על כך שפ"פ מפחית את התיאבון ואת צריכת במזון בבני אדם בכלל (Batterham וחב' ב-J Clin Endocrinol Metabol משנת 2003, ו-Jesudason וחב' ב-Brit J Nuitrition משנת 2007).
בהקשר זה כדאי לצטט את Marco וחב' שדיווחו כבר ב-1980 ב- J Clin Encrindocrinol Metabol על הפרשה מופחתת של פ"פ נמוכים בפלזמה של אנשים כבדי-משקל. יצוין שהשערה מוקדמת עוד יותר של Malaisse-Lagae וחב' משנת 1077 ב-Experientia, על כך שלפ"פ יש תפקיד בהפחתת משקל גופם של עכברים שמנים עם הגנוטיפ ob/ob. בעכברים נורמאליים נמצא על ידי Asakawa וחב' שעירוי תוך-ורידי של פ"פ הפחית אצלם צריכת מזון (Peptides מ-1999). באותה שנה פרסמו Ueno וחב' ב-Gastroenterology, שעכברים טרנסגניים בהם קיימת הפרשה מוגברת של פ"פ, יש צריכת מזון מופחתת, והפחתת משקל בולטת.
פעילויות אלה של פ"פ כורכות הן פעילות של פפטידים מוחיים המשפיעים על צריכת מזון, והן פעילות של העצב הוואגאלי על פי Kojima וחב' ב-Peptides משנת 2007. אכן, קולטנים של פ"פ מופיעים במגוון של אזורי מוח של עכבר כפי שדיווחו Parker ו-Herzog ב-1999 ב-Eur J Neurosci. מחקרים עדכניים מראים שהשפעות על תחושת שובע של פ"פ קשורות לפעולתו של האחרון על קולטני Y4 בגרעיני ההיפותלמוס, כפי משתמע ממחקרם של Linוחב' משנת 2009 ב-PLos ONE, בו הדגימו בעכברים שהשפעת פ"פ בהפחתת צריכת מזון עוברת דרך קולטני Y4 ב-arcuate ומערכת ה-melanocortin. גם Sainsbury וחב' הדגימו במחקרם משנת 2010 ב-Neuropeptides שפ"פ משפיע דרך קולטני Y4 ומסלול ה-orexin בהיפותלמוס. יחד עם זאת, Shi וחב' הדגימו ב-Obesity משנת שפ"פ מפחית את צריכת המזון דרך מסלולים היפותלמיים שונים מאלה המתווכים בפעילותו של PYY.
פעילויות פיזיולוגיות
פ"פ הוא בעל מספר פעילויות מעכבות שחשיבותן הן בתפקוד הפנקריאטי והן בתפקוד מערכת העיכול, אך כיוון שרבות מפעילויות פ"פ הן מקומיות היה קשה בתחילה לעמוד על טיבן, והיו אלה Lin וחב' שעשו ניסויים חלוציים רבים בכלבים שפורסמו ב-1975 ב-Am J Physiol. בנוסף, לפ"פ יש השפעה מעכבת על כיווץ כיס המרה והפרשת מיץ מרה ועל תנועתיות המעי (עפ"י Hazelwood ב-Proc Soc Exp Biol Med משנת 1993 ו- Adrian וחב' ב-Am J Physiol, משנת 1992(, מה שמשפיע על צריכת המזון, ועל הביטוי של ההורמון ghrelin. באופן כללי ניתן לקבוע שפעילות חשובה של פ"פ היא באיתות למרכזי המוח להפחית את צריכת המזון.
התפקיד של פ"פ הוא בוויסות פעילויות ההפרשה האנדוקרינית והאקסוקרינית של בלוטת הלבלב, והוא משפיע גם על רמות הגליקוגן בכבד, ועל ההפרשות של מערכת העיכול. הפרשתו בבני-אדם גוברת לאחר ארוחה עתירת חלבון, במצבי לעיסת מזון ללא בליעתו (sham feeding), לאחר צום, באנורקסיה נרבוזה, כתוצאה מגירוי עצב הוואגוס, לאחר פעילות גופנית מאומצת, ובמצבים של היפוגליקמיה חריפה. לעומת זאת הפרשתו קטנה לאחר ארוחה דשנה, שבהשפעת סומאטוסטטין ועירוי תוך ורידי של גלוקוזה. נמצא שפ"פ מעכב התכווצויות של האילאום, אך מעודד התכווצויות של המעי הגס. בנוסף, פ"פ משפיע על תפקודים מטבוליים כולל גליקוגנוליזה, ומפחית רמות חומצות שומן בדם.
הגברה בולטת של הפרשת פ"פ נצפתה במקרים של גידולים פנקראטיים פעילים-הורמונאלית (אינסולינומה, גלוקאגונומה, גסטרינומה) ובתסמונת Vemer-Morrison. באנשים סוכרתיים תיתכן רמה מוגברת של פ"פ. גם בסוג נדיר של ממאירות בתאים מייצרים פ"פ באיי לנגרהנס (PPoma) יש הפרשה גדולה לדם של פ"פ. בשעת צום, רמת פ"פ בנסיוב היא כ-80 פיקוגרם/מ"ל, ולאחר ארוחה רמה זו עלולה לעלות פי-8 עד פי-10 כתוצאה מגירוי ואגאלי-כולינרגי. מתן atropine או ניתוק הוואגוס יחסמו את הפרשת פ"פ לאחר ארוחה. גלוקוזה ושומנים משרים עליה ברמת פ"פ, אך בעירוי של חומרים אלה אין שינוי ברמת פ"פ. כאמור, גירוי עצב הוואגוס, או מתן gastrin, וכן secretun או cholecystokinin, מגרה הפרשת פ"פ.
חסר תגובה של הפרשת פ"פ ל-sham feeding יכולה להצביע על נזק לוואגוס (או כתוצאה מפגיעה בניתוח או בעקבות מפגע עצבי אוטונומי). נזק לבלוטת הלבלב כתוצאה מפנקראטיטיס כרונית, או סרטן הבלוטה, עלולים אף הם להביא לרמות נמוכות של פ"פ בנסיוב, ולחסר תגובה ל-sham feeding. פ"פ מגרה הפרשת מיץ קיבה, אך מעכב הפרשת מיץ זה המושרית על ידי pentagastrine.
הפרשת פ"פ
מדידת רמת פ"פ בפלזמה בשיטת RIA מראה רמה בסיסית של 10-30 פיקומול/ליטר, ורמה זו עולה במהירות לאחר בליעת מזון, עלייה שמגיעה לשיאה תוך 15-30 דקות, ורמה זו נותרת מוגברת למשך 4-5 שעות באדם (Chen ב-J Physiol משנת 1983). בשנת 1978 הראו Wilson וחב' ב-Endocrinology, שבין אבות המזון, חלבונים נותנים את הגירוי החזק ביותר להפרשת פ"פ, ואחריהם שומנים, והכי פחות משפיעים על הפרשת פ"פ הם סוכרים.
השוואה של ריכוזי תאי פ"פ באיברים השונים מראה את הריכוז הגבוה ביותר במעי, לעומת הקיבה והמוח. עצב הואגוס הוא הגריין העיקרי להפרשת פ"פ, אך ניתן לחסום גירוי זה על ידי אטרופין (Feldman וחב' ב-J Clin Invest משנת 1979). בנוסף לגירוי "החשמלי" של עצב הואגוס (Bloom ו-Edwards ב-J Physiol מ-1981), גם לעיסה אך לא בליעה (sham chewing) יכולה להשרות הפרשת פ"פ (Koop וחב' -Digstion מ-1984), וכן גם 2-deoxyglucose, מה שעל פי Hedo וחב' מעיד על מעורבות כולינרגית (J Clin Endocrinol Metabol משנת 1978), ובנוסף גם היפוגליקמיה המושרה על ידי אינסולין משרה הפרשת פ"פ (על פי Schwartz משנת 1983 ב-Gastroenterology).
גם עירוי של תמצית מזון לקיבה או למעי, מעודד הפרשה של פ"פ במנגנון המושפע חלקית על ידי הואגוס. הורמונים של מערכת העיכול, בעיקר cholecystokinin או CCK (על פי Adler וחב' ב-Regul Pept מ-1990 ו-Lonovics וחב' ב-Gastroenterology משנת 1990), וכן גסטרין (Guzman וחב' ב-Endocrinology משנת 1980), נוטלים חלק בעידוד הפרשת פ"פ.
לגבי הורמונים אחרים של מערכת העיכול כגון GIP או gastric inhibitory peptide, וכן VIP וסומאטוסטטין, ייתכן שיש להם השפעה עקיפה על הפרשת פ"פ. מחקרים שניסו להעריך את הוויסות בתוך איי-לנגרהנס של הפרשת פ"פ על ידי אינסולין או גלוקאגון, הניבו תוצאות לא פסקניות, למרות שסומאטוסטטין מעכב הפרשת פ"פ in vivo, על ידי הזלפתו אל תוך הלבלב (Kayasseh וחב' ב-Scand J Gastroenterol משנת 1978). בעבודה in vitro עם תאי לנגרהנס מבודדים מהפנקריאס של עכברים וחולדות, הדגימו Qader וחב' ש-ghrelin מעכב הפרשה של פ"פ (ב-Regul Pept, משנת 2008). תקופת מחצית החיים של פ"פ בפלזמה היא של 6 דקות בלבד, אך במצבים של מחלת כליה מתארכת תקופת מחצית החיים של פ"פ באדם.
כאמור פעילויות פ"פ מתווכות על ידי קולטנים ספציפיים, וזוהתה משפחה של חמישה קולטנים אליהם נקשרים Neuropeptide Y, Peptide YY ו-פ"פ. כאשר הקולטנים Y1 ו-Y2 הם הקולטנים העיקריים של PYY ו-NPY, ואילו Y4 הוא ספציפי ובעל זיקה גבוהה לפ"פ (עם קבוע קישור הקטן מ-100pM, וזיקה נמוכה פי-100 ל-PYY (על פי Lundell וחב' ב-J Biol Chem משנת 1995). הקולטן Y4 נמצא במספר רקמות כולל המוח, אך הוא נפוץ בעיקר במעי הגס. זהו קולטן קשור לחלבון G, בעל מבנה של 8 סלילונים הפועל דרך החלבונים Gi/Go הקושרים- GTP וגורמים לעיכוב יצירת cAMP על ידי עיכוב האנזים adenylate cyclase. מחקר עדכני של Yulyaningsih וחב' ב-Cell Metab משנת 2014, מציע שפ"פ הוא גם ליגנד עיקרי הנקשר לקולטני Y6, המתווכים בוויסות ההומאוסטזיס האנרגטי.
השפעות הפוליפפטיד הפנקריאטי על הפעילות האקסוקרינית של בלוטת הלבלב
כבר ב-1977 הראה Lin שפ"פ אקסוגני טהור ממקור בקר מפחית את ההפרשה האקסוקרינית של הלבלב במגוון מינים. מחקרים ראשוניים בכלבים, הראו שהחדרת פ"פ בקצב של 10 מיקרוגרם/ק"ג משקל גוף/שעה, עיכב את ההפרשה של חלבון ושל ביקרבונאט מבלוטת הלבלב. ממצאים אלה אושרו על ידי Taylorוחב' שהראו ב-Gastroenterology משנת 1979, שעיכוב ההפרשה האקסוקרינית של הלבלב ניכר כבר במינוני פ"פ שהעלו את ריכוזו בפלזמה פחות ממה שניתן היה למדוד לאחר ארוחה. פעילות דומה בכלבים דווחה על ידי חוקרים נוספים (Beglinger וחב' ב-Am J Physiol משנת 1984, ו-Chance וחב' ב-J Physiol משנת 1981.
השפעה דומה של פ"פ סינתטי של אדם הניתנת בעירוי של 1 מיקרוגרם/ק"ג משקל/שעה, פורסמה על ידי Shiratory וחב' בשנת 1988 ב-Am J Physiol. כמו כן נמצאו השפעות דומות של עירוי פ"פ בעיכוב הפרשה לבלבית בתגובה למזון, ל-CCK או ל-secretin נמצאו בבני אדם על ידי Adrian וחב' ב-Gut בשנת 1978, ועל ידי Greenberg וחב' ב-Lancet באותה שנה. השפעות דומות נמצאו גם בעירוי פ"פ לחולדות, על ידי Putnam וחב' בשנת 1989 ועל ידי Louie וחב' בשנת 1985 כאשר שני המאמרים הופיעו ב-Am J Physiol .תמיכה נוספת בפעילות הפיזיולוגת של פ"פ ניתנה במאמרם של Shiratory וחב' בהדגימם שנטרול על ידי נוגדנים כנגד פ"פ אנדוגני עודד הפרשה פנקראטית הן במהלך הארוחה והן אחריה.
למרות שפ"פ פועל לעיכוב הפרשה פנקריאטית in vivo, השפעה זו מצטיירת בלתי-ישירה, שכן פ"פ אקסוגני חסר כל השפעה בהפרשת עמילאזה מתאי אציני בבלוטת הלבלב של עכברים או חולדות (Gettys וחב' ב-Pancreas משנת 1992, ו-Louie וחב' ב-Am J Physiol משנת 1985), וכן בתאי פנקריאס מבודדים של חתול (Kim וחב' ב-Yonsei Med J משנת (1980). אמנם, ניסויים של מדידת הזיקה של פ"פ מסומן ביוד-125 לא הדגימו זיקה גבוהה של הפוליפפאיד הפנקראטי לתאי אציני מהפנקריאס של חולדה. מנגד, Duan וחב' תוך שימוש בפ"פ הומאני בריכוז גבוה, כן הצליחו דווקא להדגים גירוי של הפרשה מתאי אציני של פנקריאס של חולדה (Regul Pept משנת 1985).
מחקרים עדכניים יותר, התרכזו ביעד העצבי של פעילות פ"פ לעיכוב ההפרשה האקסוקרינית מבלוטת הלבלב. רוב המחקרים מצביעים על גזע המוח כיעד לפעילות זו של פ"פ. קולטנים בזיקה גבוהה לפ"פ נמצאים על ידי Whitcomb וחב' באזור הפוסטרמה ובגרעיני ה-tractus solitarius במוח המוארך בחולדה, וכן בגרעין המוטורי הדורזאלי של הוואגוס (Brain Res משנת 1997). אכן, Okumura וחב' דווחו ב-1995 ב-Gastroenteroogy שהזרקה של פ"פ לתוך הגרעין המוטורי הדורזאלי של חולדה עיכב את הפרשת הפנקריאס במנגנון המתווך על ידי עצב הואגוס.
ממצאים אלה, מצביעים על כך שפ"פ בצירקולציה מגיע לגזע המוח דרך אזור הפוסטֶרמה ומגיעים לגרעינים הדורזאלים המוטוריים הסמוכים, שם הוא מעכב את הגירוי הוואגאלי הרלוונטי לבלוטת הלבלב (Mussa ו-Verberne ב-Exp Physiol מ-2013). כחלופה עצבית אפשרית של אתר יעד של פ"פ המעכב הפרשה פנקראטית, הציגו Jung וחב' נתונים ב- Am J Physiol בשנת 1987, לפיהם פ"פ של חולדה או ההקספפטיד ה-C טרמינאלי שלו, מעכבים הפרשת עמילאזה המושרית על ידי אשלגן בחתכי פנקריאס, אם כי להשערה זו לא נמצאה תמיכה במעבדות אחרות.
הוראות לביצוע הבדיקה
הנבדק צריך להיות בצום של 8 שעות, שכן נטילת דם שלא בצום תיתן תוצאות מוגברות-כזובות. הדם נלקח במבחנת ספירת דם (EDTA, פקק סגלגל). לאחר הסרכוז, הפלזמה יכולה להישמר בקירור עד 7 ימים, ובהקפאה עד 90 יום. ניתן לבצע את הבדיקה בדגימה המוליטית באופן קל אך לא בהמוליזה ניכרת. ניתן לבצע את הבדיקה בדגימה איקטרית גם ברמות בילירובין גבוהות. יש לפסול דגימות ליפמיות אפילו באופן מתון.
כיוון שהבדיקה מתבעת בשיטת RIA, אין לבצע מדידת פ"פ באלה שטופלו לאחרונה על ידי חמרים רדיואקטיביים לצורך טיפול או לצורך בדיקות הדמיה, שכן האיזוטופים המוחדרים לגוף בתרחישים אלה עלולים להפריע לביצוע בדיקת RIA. פרק הזמן הנדרש מאז חשיפת הגוף לרדיואקטיביות תלוי בסוג האיזוטופ, במינון שלו ובקצב הפינוי שלו מהגוף השונה בין אנשים.
ראו גם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק