קדמיום - Cadmium
| מדריך בדיקות מעבדה | |
| קדמיום | |
|---|---|
| Cadmium | |
| מעבדה | כימיה בדם וכימיה בשתן |
| תחום | זיהוי חשיפה לקדמיום, מתכת כבדה טוקסית. |
| טווח ערכים תקין | בשתן-פחות מ-0.7 מיקרוגרם באיסוף 24 שעות שתן; בדם-פחות מ-5 ננוגרם/מ"ל, כאשר ברוב המקרים ריכוז קדמיום בדם 0.5-2.0 ננוגרם/מ"ל (Moreau וחב' ב-Arch Environ Health משנת 1983). |
| יוצר הערך | פרופ' בן-עמי סלע |
קדמיום היא מתכת כבדה העלולה לגרום נזק טוקסי לבריאות האדם. עד היום לא נמצא שיש לקדמיום תפקיד פיזיולוגי כלשהו והעניין בו מתרכז בהיותו בעל פוטנציאל של biohazard. הראשון שתיעד את הנזק הטוקסי של קדמיום היה Friedrich Stromeyer מגטינגן כבר בשנת 1817, שהצביע על הנזק שעלול להיגרם לכליות, לעצמות ולמערכת הנשימה. קדמיום נמצא באופן שכיח בעפרות ביחד עם אבץ, נחושת ועופרת. פעילות וולקנית היא גורם טבעי לעלייה ברמות קדמיום סביבתי. קדמיום משמש בהרחבה בתהליכים תעשייתיים כחומר אנטי-מְאַכֵּל, כמייצב של מוצרי PVC, כפיגמנט צבע, כסופח נייטרונים בכורים גרעיניים, ובייצור של סוללות ניקל-קדמיום. גם דשנים פוספטיים מכילים כמות ניכרת של קדמיום. אחת הבעיות הגורמת לזיהום סביבתי של קדמיום, היא הנטייה להשליכו כפסולת למזבלות או לשרפו עד אפר (Jarup ב-Br Med Bull משנת 2003). בסקנדינביה לדוגמה, ריכוזי קדמיום באדמה חקלאית עולים מדי שנה ב-0.2%. הפליטה הגלובלית של קדמיום מגיעה ל-7,000 טון לשנה (Stoeppler ב-Verlag Chemie משנת 1991).
הספיגה לתוך גוף האדם
הערך המותר המקסימלי לעובדי תעשייה הנחשפים לקדמיום הוא על פי החוק הגרמני 15 מיקרוגרם/ליטר. לשם השוואה, באנשים שאינם מעשנים, רמת הקדמיום בדם היא 0.5 מיקרוגרם לליטר. באופן בסיסי קדמיום יכול לחדור לגוף האדם ב-3 דרכים: דרך מערכת העיכול, מערכת הנשימה והעור.
מערכת העיכול
קליטת קדמיום דרך מערכת העיכול מהווה בערך 5% מכמות קדמיום הנקלטת בגוף בתלות בהרכב המזון (Jin וחב' ב-Biometals משנת 2002). אזרח גרמני צורך ביום כ-30–35 מיקרוגרם קדמיום כאשר 95% מכמות זו מגיעה מהמזון וממשקאות. מעשן ממוצע קולט ביום 30 מיקרוגרם קדמיום (Schwarz ו-Hefte ב-WaBoLu משנת 1993). גורמים אחדים יכולים להגדיל את כמות קדמיום הנצרכת, כגון צריכה נמוכה של ויטמין D, של סידן ושל יסודות קורט כאבץ ונחושת. באשר לאבץ ולסידן, ההשערה היא שההומולוגיה המולקולרית שלהם יכולה לשמש פיצוי המביא לספיגה מוגברת של קדמיום (Taylor ב-J Physiol משנת 1988). ניתן היה להראות ספיגה תחרותית של קדמיום במודל של חיות: ב-jejunum של חולדה, ספיגת קדמיום דוכאה על ידי ריכוזים גבוהים יחסית של קטיונים פולי-ולנטיים אחרים, כולל עופרת, ניקל, +Cr3, מגנזיום וסטרונציום (Foulkes ב-Toxicology משנת 1985). יתרה מכך, דיאטה עשירה בסיבים מגבירה את הספיגה הדיאטתית של קדמיום (Jarup וחב' ב-Scand J Work Environ Health משנת 1998). הפרמטר המטבולי החשוב ביותר מבחינת ספיגת קדמיום, הוא חסר ברזל באדם. באנשים עם אספקה נמוכה של ברזל יש קליטת קדמיום הגבוהה ב-6% בהשוואה לאנשים עם מאזן ברזל תקין (Flanagan וחב' ב-Gastroenterology משנת 1978). זו הסיבה העיקרית לספיגת קדמיום מוגברת באנשים אנמיים על רקע חסר ברזל, לרוב בילדים ובנשים עם איבוד דם במחזור החודשי. דרגה נמוכה של ברזל בדם מעודדת את הביטוי של DCT-1 המשמש כטרנספורטר של יונים מתכתיים המעי, מה שמגביר את ספיגת קדמיום (Gunshin וחב' ב-Nature משנת 1997).
מערכת הנשימה
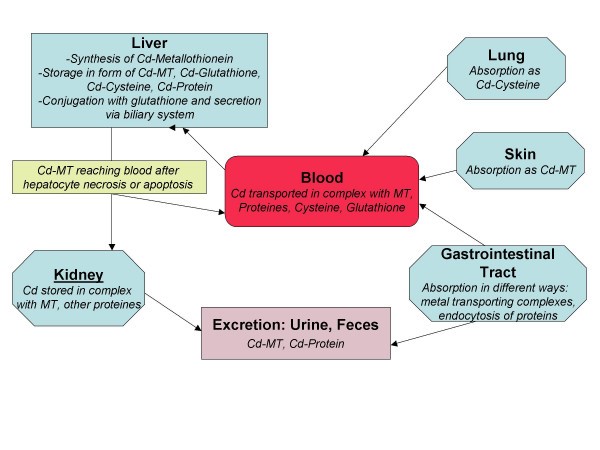
המקור העיקרי להרעלה נשימתית עם קדמיום הוא עישון סיגריות. ריאת האדם סופחת 40%-60% מהקדמיום בעשן הסיגריה (Elinger וחב' ב-Arch Environ Health משנת 1976). גבר לא מעשן בגיל 50 מכיל בגופו כמות של 15 מיליגרם של קדמיום, בעוד שגבר באותו גיל המעשן 30 שנה מכיל בגופו 30 מיליגרם קדמיום. מעשנים מכילים בדמם פי 4–5 יותר קדמיום מאשר לא-מעשנים. עובדים הנחשפים לאדי קדמיום נוטים לפתח תסמונת חריפה של מצוקה נשימתית (ARDS) (Barbee ו-Prince ב-South Med J משנת 1999). קדמיום הנשאף בריאות מגיע לדם בדרך כלל כקומפלקס של קדמיום-ציסטאין (Zalups ב-Toxicol Appl Pharmacol משנת 2003).
ספיחת קדמיום דרך העור
בשנת 1992 פרסמו Wester וחב' ב-Fundam Appl Toxicol ממצאים על ספיגת קדמיום מעפר מזוהם או ממים מוזהמים בקדמיום, על ידי עור מגוויות אדם. ממצאים אלה הדגימו חדירת קדמיום של 8.8% מהעפר, ו-12.7% מהמים לתוך העור, בעוד שספיחת קדמיום לפלזמת הדם מהעפר הייתה רק של 0.01%, ו-0.07% מהמים. ניסוי אחר, בו החדירו מדי יום תמיסת קלציום-כלוריד לעור מגולח של גב חולדות למשך 10 ימים, נמצא שהעור המטופל הראה היפר-קֶרטוֹזיס ו-acanthosis (התעבות והשחרה של העור), ולעיתים אף הופעת שינויים כיביים. בנוסף ניתן היה להדגים עלייה באינדקס המיטוטי של תאי עור (Lansdown ו-Sampson ב-Lab Anim Sci משנת 1996). שני מנגנונים מסייעים לספיחת קדמיום דרך העור: קישור של קדמיום חופשי לרדיקלים סולפהידריליים של ציסטאין בקרטין האפידרמלי, ויצירת קומפלקס עם metallothionein (Fasanya-Odewumi ב-Int J Mol Med משנת 1998).
המסלול של קדמיום בגוף
כאשר קדמיום מגיע לדם, רובו נע בצירקולציה קשור לחלבונים כאלבומין ו-metallothionein. האיבר הראשון אליו מגיע קדמיום דרך הדם הוא הכבד. כאן משרה קדמיום יצירה של metallothionein. בעקבות תהליכי נמק של הפאטוציטים ומות תאים אלה בתהליך אפופטוזיס, הקומפלקס של קדמיום-metallothionein נשטף אל תוך הדם הסינוסוידאלי ומשם חלקים של הקדמיום הספוח נכנסים לתוך המעגל האנטרו-הפאטי על ידי הפרשה לתוך צינור המרה בצורה של קוניוגטים של קדמיום-גלוטתיון. כאן חל פירוק אנזימטי לקומפלקס של קדמיום-ציסטאין במערכת המרה, וקדמיום נכנס מחדש למעי הדק. האיבר העיקרי להצטברות ארוכת טווח של קדמום היא הכליה (Orlowski ו-Piotrowski ב-Hum Exp Toxicol משנת 2003). כאן זמן מחצית החיים של קדמיום הוא בערך 10 שנים. תקופת שהות מאוד ממושכת זו של קדמיום בכליה עלולה לגרום לנמק בתאי האבובית. ריכוז קדמיום בדם משמש אינדיקטור אמין לחשיפה טרייה לקדמיום, בעוד שריכוזו בשתן משקף חשיפה לקדמיום בעבר כתוצאה מהצטברות שלו בכליה. הפרשת קדמיום מהגוף מתבצעת גם דרך הצואה.
הסכנות לבריאות האדם
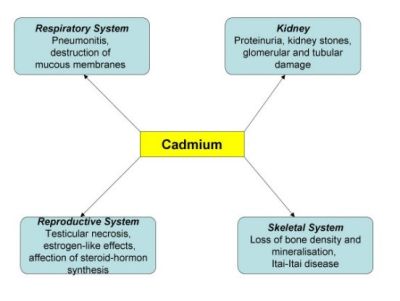
- רעילות חריפה: מערכת הנשימה נפגעת קשות משאיפת אוויר מזוהם בקדמיום, מה שבא לביטוי על ידי קוצר נשימה, בצקת ריאות והרס של ממברנות ריריות כחלק מפנאומוניטיס (Seidal וחב' ב-Scand J Work Environ Health משנת 1993). כפי שכבר דווח בשנת 1942, קליטה של מזון מזוהם בקדמיום, גורמת להשפעות חריפות של מערכת העיכול כגון הקאות ושלשולים (Nordberg ב-Biometals משנת 2004)
- נזק לכליות: נזק כלייתי תואר מזה זמן כבעיה החשובה ביותר באנשים החשופים באופן כרוני לקדמיום (Barbier וחב' ב-Nephron Physiol משנת 2005). כפי שכבר צוין קדמיום מגיע לכליה בקומפלקס של cadmium-metallothionein (להלן Cd-MT). הקומפלקס האחרון עובר פילטרציה בגלומרולוס, ובהמשך נספג מחדש באבובית הקריבנית. קדמיום נותר אז בתאי האבובית, כשהוא מהווה חלק ניכר מכלל הקדמיום בגוף. כמות הקדמיום בתאי האבובית של הכליה גדלה בהדרגה במהלך החיים. עדיין פתוחה השאלה האם הנתון האחרון מפריע למטבוליזם של זרחן ושל סידן (Svatengren וחב' ב-Environ Res משנת 1986). כמות גדלה של קדמיום בכליה, כנראה מביאה להפרשה מוגברת של סידן, מה שמגביר את הסיכון ליצירת אבני כליות. הפרשה בשתן של 2.5 מיקרוגרם קדמיום לכל גרם קראטינין, משקפת את הנזק באבוביות הכליה בשיעור של 4%. נזק זה בא לביטוי בהפרשה מוגברת בשתן של β2-microglobulin, של N-acetyl-D-glucosamine (להלן NAG) ושל retinol-binding protein (על פי Bernard ב-Biometals משנת 2004). מחקר ChinaCad מצא הפרשה של כמויות גדולות יותר של β2-microglobulin ושל retinol-binding protein בנבדקים עם ריכוזי קדמיום גבוהים בדמם, מאשר באלה עם רמות קדמיום נורמליות בקבוצת הנבדקים עם רמות קדמיום מוגברות בדם נמצא נזק לאבוביות כמו גם לפקעיות הכליה (glomeruli). הדעה השלטת היא שהנזק שנגרם לאבוביות הוא בלת הפיך (Hotz וחב' ב-Lancet משנת 1999).
השפעות קדמיום על מערכת הרבייה
נראה שקדמיום מפריע למסלול הסטרואידוגני בשחלות של חולדות. Piasek וחב' העריכו את ההשפעות הישירות של חשיפה לקדמיום in vitro של סטרואידוגנזה בשחלות חולדה, ומצאו שההשפעה הגדולה ביותר הייתה על יצירת פרוגסטרון וטסטוסטרון (Piasek וחב' ב-J Appl Toxicol משנת 1999). נמצא שמינונים נמוכים של קדמיום דווקא מעודדים ביוסינתזה של פרוגסטרון בשחלות, בעוד שמינוני קדמיום גבוהים מעכבים אותה (Henson ו-Chedrese ב-Exp Biol Med משנת 2004). חשיפה של נשים הרות לקדמיום כרוכה בלידת תינוקות במשקל נמוך, כמו גם בשיעור מוגבר של הפלות ספונטניות (Frery וחב' ב-Toxicology משנת 1993, ו-Shiverick ו-Salafia ב-Placenta משנת 1999). ישנן גם ראיות מסוימות שקדמיום הוא אסטרוגן לא-סטרואידלי פּוטנטי in vivo ו-in vitro. מחקרים בחולדות הראו שקדמיום מאיץ את ההתפתחות של בלוטות החלב ומגדיל את משקל הרחם (Johnson וחב' ב-Nature Med משנת 2003).
הנזק לעצמות
מספר מחקרים מצאו קשר בין רעילות קדמיום לבין נזק לעצמות בעובדי תעשייה שנחשפו לאדים או לאבק המכיל קדמיום (Kazantzis ב-Environ Health Perspect משנת 1979). כמו כן נמצא שקדמיום כרוך בהופעת תסמונת Itai-Itai בה ישנם ממצאים נרחבים של רמת מינרליזציה נמוכה של העצמות, שיעור מוגבר של שברי עצם, שיעור מוגבר של אוסטיאופורוזיס, וכאבי עצמות ניכרים. מגפה של מחלת Itai-Itai התגלתה באזור נהר Jinzu ביפן בשנות ה-40. אלה שנפגעו במגפה זו הראו תסמינים אופייניים לאחר שאכלו אורז, שגדל בשדות שעברו השקיה במים מזוהמים בכמות גבוהה של קדמיום. הנפגעים במגפה זו לקו גם בפסבדו-שברים, באוסטיאומלציה ובאיבוד ניכר של סידן מעצמותיהם. גם תופעות כמו אוסטיאופורוזיס יוחסו לטוקסיות של קדמיום (Kazantzis ב-Biometals משנת 2004, ו-Jarup וחב' ב-Occup Environ Med משנת 1998).
ראיות נוספות למעורבות של טוקסיות של קדמיום במפגעי עצם פורסמו בשנת 2003 על ידי Honda וחב' שתיארו מתאם הופכי בין מדד STIFF (שיטת אולטרה-סאונד למדידת צפיפות עצם) לבין ריכוזי קדמיום בשתן. תוצאות דומות הושגו במחקר OSCAR שכלל 1,021 נבדקים מדרום שוודיה. מחקר זה מצא מתאם שלילי משמעותי בין רמת קדמיום בשתן לבין צפיפות מינרלים נמוכה בעצם, בעיקר בקרב בני 60 שנה ומעלה. בעיקר נמצאו שברי עצם בזרועות של אלה עם רמת קדמיום גבוהה. המשתתפים במחקר זה היו מועסקים בתעשיית הסוללות, או אלה שהתגוררו ביישובים קרובים למפעלים לייצור סוללות. מחקר שנערך בבלגיה תחת הכותרת CadmiBel שהתנהל בין השנים 89–1985 הגיע למסקנות דומות: אפילו חשיפה מינימלית לקדמיום סביבתי, גרמה לדה-מינרליזציה בעצמות השלד (Staessen וחב' ב-Lancet משנת 1999). כמה מהמשתתפים במחקר CadmiBel נבדקו לאחר מכן לצפיפות עצם הזרוע במחקר ההמשך תחת הכותרת PheeCad שהתנהל בין השנים 95–1992. מחקר זה מצא צפיפות עצם נמוכה יותר באלה שנחשפו בעבר לקדמיום. ההיבט המעניין ביותר של המחקר האחרון, הייתה העובדה שתכולת קדמיום בגוף (שנקבעה על ידי הפרשת קדמיום בשתן) הייתה משמעותית נמוכה יותר מזו שנמצאה ביפנים עם מחלת Itai-Itai: במשתתפי מחקרים CadmiBel/PheeCad ההפרשה הממוצעת של קדמיום בשתן הייתה 1 מיקרוגרם/גרם קראטינין, בעוד שאלה עם מחלת Itai-Itai הפרישו בשתן בממוצע 30 מיקרוגרם/גרם קראטינין. המנגנון המדויק בין רמת קדמיום למינרליזציה נמוכה של העצם אינו ברור עדיין. יש סברה שהשפעת קדמיום על תפקוד של אוסטיאובלסטים ואוסטיאוקלסטים רלוונטית (Berglund וחב' ב-Toxicol Lett משנת 2000). הפרעה של קדמיום למטבוליזם של ויטמין D3 גם כן נלקחת בחשבון, ויש סבורים שעופרת וקדמיום מגיבים עם הידרוקסילאזות של ויטמין D3 במיטוכונדריה הכלייתית בקומפלקס האנדוקריני (Chalkley וחב' ב-Occup Environ Med משנת 1992).
קרצינוגניות
יש מספר ראיות לכך שקדמיום עלול להיות קרצינוגני. הזרקה תת-עורית של קדמיום כלוריד יכולה לגרום לסרטן הערמונית בחולדות Wistar (על פי Waalkes וחב' ב-Cancer Res משנת 1988). חוקרים אלה גם שיערו שמנות גבוהות של קדמיום יכולות לגרום נמק חמור באשכי חולדות, מה שהיה מלווה לאחר מכן על ידי שיעור גבוה יותר של גידולים אינטרסטיציאליים בחולדות. בניגוד לממצאי מעבדה אלה, מחקרים אפידמיולוגיים לא הצליחו למצוא קשר משכנע בין קדמיום לבין התרחשות סרטן הערמונית (Sahmoun וחב' ב-Cancer Invest משנת 2005). פרסומים מוקדמים דווקא כן הציעו קשר בין קדמיום לבין סרטן כליות באדם (Kolonel ב-Cancer משנת 1976). השערה זו זכתה לאישוש מאוחר יותר, על ידי סקירה סיסטמטית של 7 מחקרים אפידמיולוגיים ו-11 מחקרים קליניים (II'yasova וחב' ב-Toxicol Appl Pharmacol משנת 2005). כתוצאה מכך, החליט ה-IACR לסווג את קדמיום כקרצינוגן group I באדם. עם זאת, נתונים מעודכנים יותר תומכים בדעה שרק קליטת קדמיום דרך מערכת הנשימה היא בעלת פוטנציאל קרצינוגני.
אף על פי שמנגנונים מולקולריים של קרצינוגניות מושרית על ידי קדמיום עדיין לא קיימים, מספר גורמים יכולים לתרום לקרצינוגניות היפותטית זו: הגברת איתות מיטוגני, הפרעה למנגנון התיקון של נזקי DND והגברת העמידות לאפופטוזיס על ידי חשיפה לקדמיום (Goyer וחב' ב-Biometals משנת 2004). אפשרות נוספת נעוצה בשחלוף של אבץ על ידי קדמיום בחלבונים מווסתי שעתוק. יתרה מכך, נתונים חדשים מראים שקדמיום מסוגל לשנות את הקונפורמציה של E-Cadherin שהוא חלבון טרנס-ממברנלי הקושר סידן. חלבון אחרון זה משחק תפקיד חשוב בספיחת תאים, בעיקר תאים אפידרמליים (Prozialeck ו-Lamar ב-Biochim Biophys Acta משנת 1999). נתונים אלה תואמים את ההיפותזה לפיה E-Cadherin עשוי להיות יעד מולקולרי ישיר של טוקסיות של קדמיום.
השפעת פולי-פנולים על פעילות קדמיום
פוליפנולים מונעים את הנזקים הבריאותיים של קדמיום. פוליפנולים מהווים מרכיב מרכזי בצמחים עם מגוון פעילויות ביולוגיות בעיקר בגים פעילותם נוגדת החמצון. לפוליפנולים יש לפחות טבעת ארומטית אחת עם אחד או יותר שיירי הידרוקסיל. להלן מספר פריטי מזון ותכולת הפוליפנולים בהם (מבוטאת במיליגרמים/100 גרם): clove (תבלין צִפֹּרֶן, שֵׁן שׁוּם, בְּצַלְצוּל) - 15,200; נענע חריפה (peppermint) - 11,960; כמנון ירוק (anise) - 5,460; אבקת קקאו -3,450; שוקולד כהה - 1,660; פטל שחור - 1,700; ענבי שועל (black currants) -758; אָסְנָה (blackberries)- 260; תות שדה - 235; פטל אדום -215; שזיפים - 377; דובדבנים - 274; תפוחי עץ - 136; אגוזי לוז (hazelnuts) -495; פקאן - 493; שקד - 187; אגוז - 187; זיתים - 346; ארטישוק - 260; בצל - 168; עולש (Chicory) – 166; תרד - 120; 100 ספל קפה - 214; 100 מ"ל תה שחור - 102; 100 מ"ל יין אדום -100; 100 מ"ל תה ירוק - 100. מלטונין שהוא נוגד חמצון טבעי עשוי למנוע נזקי קדמיום in vitro וגם במודל חיות שהועמסו עם קדמיום (Carocci וחב' ב-Biometals משנת 2018).
השפעות של קדמיום על המיטוכונדריה ועל השריית אפופטוזיס
שרשרת הנשימה המיטוכונדריאלית מהווה חלק קריטי בהומאוסטזיס האנרגטי על ידי פוספורילציה חמצונית, ויצירת אנרגיה בצורת ATP החיוני לחיים. תפקוד לקוי של המיטוכונדריה כרוך בגיל המתקדם ובמחלות רבות כולל סרטן (Modica-Napolitano וחב' ב-Curr Mol Med משנת 2007). המיטוכונדריה בנויה מ-4 תת-מבנים: המממברנות החיצונית והפנימית, המרווח בין 2 הממברנות, והמטריקס. המיטוכונדריה מכילות את הגנום שלהן, המורכב מ-DND דו-גדילי צירקולרי. הכרומוזום המיטוכונדריאלי באדם מכיל 37 גנים (16,569bp), מתוכם 13 גנים המקודדים לחלבונים של השרשרת הנשימתית, כאשר 24 הגנים הנותרים מקודדים ל-rRNA ול-tRNA. גנים גרעיניים מקודדים לחלבונים אחרים של המיטוכונדריה כגון אנזימים וטרנספורטרים ממברנליים. בממוצע, המיטוכונדריה מכילים 5–7 גנומים, המיוצבים על ידי חלבונים הנקשרים ל-DNA השונים מההיסטונים הגרעיניים (Bogenhagen וחב' ב-Biol Chem משנת 2008). בהתחשב בפעילויות המוגבלות של תיקון DNA, וביצירה הגבוהה של מולקולות מחמצנות (ROS), ה-DNA המיטוכונדריאלי ביונקים חשוף לנזק חמצוני והוא נוטה יותר לשיעור מוטציות בהשוואה ל-DNA גרעיני (Venkatesh וחב' ב-Ind Med Res משנת 2009).
היעדים הקריטיים של קדמיום הם שיירי thiol (או SH-) של ציסטאין, בחלבונים. השפעול של שיירי סולפהידריל באנזימים יכולים לגרום לחסכים תפקודיים בגרעין, ברטיקולום האנדופלזמי ובמיטוכונדריה. ההשפעות הטוקסיות המיוחסות לקדמיום נגרמות בעיקר בגין החסימה של שרשרת מעבר האלקטרונים במיטוכונדריה, על ידי הפרעה לשטף האלקטרונים דרך ה-ubiquinone ולפעילות האנזים cytochrome C oxyreductase. קדמיום מעכב את הנשימה בתיווך ADP, ומשרה את הגברת החדירות דרך הממברנה הפנימית של המיטוכונדריה (Belyaeva וחב' ב-Toxicol Appl Pharmacol משנת 2008). קדמיום עשוי לשנות את הפעילות של חלבונים מיטוכונדריאליים רבים על ידי עיכוב של אנזימי השרשרת הנשימתית (Wang וחב' ב-Free Radic Biol Med משנת 2004), הרס הפוטנציאל של הממברנה המיטוכונדריאלית מה שמעכב את התהליך הנשימתי (Lee ו-Thevenhod ב-Arch Toxicol משנת 2020). קדמיום יכול להגדיל ישירות את החדירות של הממברנה המיטוכונדריאלית ולהפחית את הפוטנציאל שלה, מצב הגורם להפרשה של ציטוכרום C ולשפעל את מסלול ה-caspase. בנוסף, קדמיום מעכב את הפעילויות של ATPase, של לקטאט דהידרוגנאזה (LDH), של superoxide dismutase (או SOD ושל glutathione peroxidase (או GPx), ועל ידי כך להגביר רמת ROS ואת הפראוקסידציה של ליפידים (Cannino וחב' ב-Mitochondrion משנת 2009). קדמיום מעורב בריאקציות Fenton (בהן מי חמצן מומרים לרדיקלים חופשיים של הידרוקסיל בתהליך קטליטי). מי החמצן נוצרים בדרך כלל על ידי הנשימה החמצונית במיטוכונדריה. הרדיקלים ההידרוקסיליים החופשיים הנוצרים בריאקציית Fenton הם טוקסיים ביותר בגלל אי-יציבותם ואופיים הריאקטיבי). קדמיום יכול לשנות את סטאטוס ה-redox התאי, על ידי תגובתו עם נוגדי חמצון אקסוגניים ואנדוגניים כגון גלוטתיון (Cuypers וחב' ב-Biometals משנת 2010).
קדמיום עלול לגרום נזק למיטוכונדריה ולא רק להפריע לאיתותים של +Ca2 (על פי Biagioli וחב' ב-Cell Calcium משנת 2008), אלא גם להגביר יצירת ROS במיטוכונדריה (Belyaeva וחב' ב-Biochim Biophys Acta משנת 2006). יוני קדמיום פועלים כ-xenobiotics (שהם חומרים כימיים המופיעים באורגניזם שאינם אמורים להימצא בו או נוצרים בו באופן טבעי), על ידי שהוא מעכב את פעילות הקומפלקס II (succinate dehydrogenase) ואת פעילות הקומפלקס III (cytochrome bc I complex) של שרשרת הטרנספר של האלקטרונים, יותר מאשר הוא פועל על קומפלקס I ( NADH dehydrogenase או NADH: ubiquinone oxyreductase), וכן הוא פועל על קומפלקס IV (cytochrome oxidase). האתר המרכזי של יצירת ROS מצוי בקומפלקס III, וההצטברות של ROS משפיעה על הפוטנציאל של הממברנה המיטוכונדריאלית ומשפעלת רצף של אירועים, כולל אפופטוזיס שהוא תהליך ההשמדה העצמית של תאים מזדקנים, בתהליך גנטי מתוכנת (Chatterjee וחב' ב-Toxicol Lett משנת 2008).
קיימים 2 מסלולים שונים של אפופטוזיס: המסלול האקסטרינזי הידוע גם כמסלול המתווך על ידי קולטנים, והמסלול האינטרינזי או המסלול המתווך על ידי המיטוכונדריה. שני המסלולים כרוכים זה בזה: המסלול האקסטרינזי מפעיל את האפופטוזיס בתגובה לגירויים חיצוניים, בעוד שהמסלול האינטרינזי מופעל בתגובה לגירוי פנימי, כגון נזק ב-DNA. המסלול המיטוכונדריאלי מופעל על ידי גירוי טוקסי כגון ROS, קרינת UV, קרינה מייננת, +Ca2, וקדמיום. גירויי עקה אלה מגבירים את החודרנות של הממברנה החיצונית של המיטוכונדריה, עם שחרור של ציטוכרום C מהמרווח שבין שתי הממברנות אל תוך הציטוזול של התא, וכך חל שפעול של caspase-8 הגורם לאפופטוזיס. המסלול האינטרינזי מגורה על ידי איתות עקה הנובע מהנזק ל-DNA המשפעל את caspase-9. בנוסף לטוקסיות של קדמיום, אפופטוזיס יכול להיות מושרה על ידי אירועים שאינם תלויים ב-caspase, או על ידי תהליכים מצומדים של +Ca2 ו-calpane. עודף יצירה של ROS מוביל להתקפה של רדיקלים חופשיים על הפוספוליפידים בממברנת המיטוכונדריה ולדה-פולריזציה של ממברנה זו, שהיא צעד מרכזי במסלול האפופטוטי האינטרינזי (Ott וחב' ב-Apoptosis משנת 2007, ו-Gobe ו-Crane ב-Toxicol Lett משנת 2008).
כל אחד משני המסלולים משפעל את מאתחליו caspase-8 ו-caspase 9, ואלה בתגובה משפעלים את המוציאים לפועל, caspase-3 ו-caspase-7. הקספאזות, שהם cysteine-aspartic acid proteases, הם בעלי פעילות פרוטאוליטית עם ציסטאין באתר הפעיל שלהם, המבקעים חלבונים לאחר שייר חומצה אספרטית. בכך נוצרים שינויים ציטו-מורפולוגיים אופייניים כגון התכווצות התא, דחיסה של כרומטין, ויצירה של שַׁלְפּוּחִיות בציטופלזמה, הקרויות גופיפי אפופטוזיס. בתאים אפופטוטיים מתרחשים תהליכי ביקוע חלבונים, שבירת DNA והפיכתם מועדים לפגוציטוזה. קדמיום משרה אפופטוזיס in vivo במספר איברים כולל כבד וכליות. בתאים בתרבית, קדמיום משרה תגובה של עקה תאית שמגיעה לשיאה בשפעול של המסלול האפופטוטי המיטוכונדריאלי (Thevenod ו-Lee ב-Arch Toxicol משנת 2013). בתאים בלתי פגועים, קדמיום משרה את הנזק האפופטוטי המיטוכונדריאלי כתרחיש מאוחר יותר המתחיל 15–24 שעות לאחר חשיפת תאים אלה לקדמיום (Lee וחב' ב-Am J Physiol Renal Physiol משנת 2006).
הוראות למדידת קדמיום בשתן ובדם
בשתן: יש לאסוף שתן משך 24 שעות ולהעביר 10 מ"ל מהאיסוף למבחנת פלסטיק ללא פקק מתכתי. לאחר סיום איסוף 24 שעות שתן, יש להעביר את דגימת השתן לקירור תוך 4 שעות מסיום איסוף השתן. ידוע שגדוליניום ויוד מפריעים למדידת כל המתכות בנוזלי גוף. לפיכך, אם נעשה שימוש באחד משני חומרי ניגוד אלה, יש להמתין 96 שעות לפני איסוף השתן לבדיקה. דגימת השתן מקוררת (מועדפת) או בטמפרטורת החדר או בהקפאה יציבים למשך 28 ימים. איסוף של דגימות שתן דרך צנתר עלול לגרום לתוצאות מוגברות כזובות של קדמיום בשתן שכן הגומי של הצנתר מכיל כמויות זעירות של קדמיום. שיטת הבדיקה היא על ידי ICP-MS או inductively coupled plasma Mass Spectrometry.
מדידת קדמיום בדם: יש ליטול דם במבחנת ספירת דם (פקק סגלגל, (EDTA, ולהעביר את הדם למעבדה במבחנה המקורית ללא סרכוז או הפרדת הפלזמה. הדגימה יציבה בקירור (מועדף), בטמפרטורת החדר או בהקפאה למשך 28 יום. אין לפסול דגימות מאוד המוליטיות, ליפמיות או איקטריות. הבדיקה מתבצעת בשיטת ICP-MS.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק