אבחון וטיפול של מיוקרדיטיס חדה - נייר עמדה - Diagnosis and treatment of acute myocarditis
|
| |
|---|---|
| אבחון וטיפול של מיוקרדיטיס חדה - נייר עמדה של האיגוד הקרדיולוגי הישראלי | |
| תחום | קרדיולוגיה |

| |
| האיגוד המפרסם | האיגוד הקרדיולוגי הישראלי |
| תאריך פרסום | 2023 |
| יוצר הערך | פרופ' אנדרי קרן, פרופ' רביע עאסלה, פרופ' עידו י . בירתי, דר' טוביה בן גל, פרופ' מיכאל ארד |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – דלקת
מטרות
מיוקרדיטיס (Myocarditis) מהווה אתגר אבחוני וטיפולי עקב השונות באתיולוגיות (Etiologies) וההסתמנות שלה. אין אחידות בניירות העמדה וההנחיות של האיגודים הקרדיולוגיים השונים לגבי הגדרת המחלה, אופן האבחון (כולל מתי לבצע ביופסיה אנדומיוקרדיאלית (Endomyocardial biopsy)), והמלצות לטיפול, בפרט טיפולים מדכאי חיסון[1][2][3]. כמו כן, קיימת שונות בין המרכזים הרפואיים בישראל בגישות האבחוניות והטיפוליות לדלקת חריפה של שריר הלב. מטרת מסמך זה היא לנסח קריטריונים אבחוניים וגישות טיפוליות למיוקרדיטיס חדה, המתאימים למציאות של מערכת הבריאות הישראלית.
הגדרה
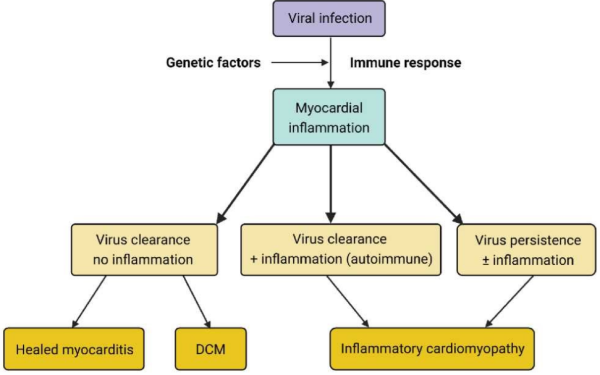
מיוקרדיטיס היא דלקת של שריר הלב הנובעת מזיהום, מחשיפה לחומרים רעילים או מתגובה אימונית ראשונית (primary immune response) או פוסט זיהומית. האטיולוגיה השכיחה ביותר היא נגיפית (Viral). ההתייצגות הקלינית יכולה להיות חריפה, תת-חריפה, או כרונית. התקופה החריפה של המחלה הוגדרה בעבר כעד שלושה חודשים[1][2] אך צומצמה לחודש אחד בלבד מתחילת התלונות[3]. מיוקרדיטיס תת-חריפה מתייחסת לתהליך דלקתי לבבי הנמשך בין 1–3 חודשים לאחר ההתייצגות הקלינית[3]. קרדיומיופתיה דלקתית כרונית (לשעבר "מיוקרדיטיס כרונית") מוגדרת כהמשך התהליך הדלקתי מעבר לתקופה החריפה (תרשים 1). לפיכך, תהליך דלקתי בלב הנמשך מעבר ל-3 חודשים, ומלווה בירידה בהתכווצות שריר הלב עם או ללא הרחבת חדרי הלב יקרא קרדיומיופתיה דלקתית[4].
במיוקרדיטיס, הגורם האטיולוגי יכול לגרום לדרגות שונות של נזק ישיר לשריר הלב. במקרים אחרים, מיוקרדיטיס היא תוצאה של תגובה אימונולוגית הפוגעת בשריר הלב, אם במבודד או כחלק ממחלה דלקתית רב מערכתית, דהיינו מחלה אוטואימונית[3][4] (תרשים 1).
קריטריונים לאבחון קליני ומעבדתי
אבחנה של מיוקרדיטיס חדה יכולה להיות מורכבת. אבחנה ודאית מסתמכת על ביופסיה אנדומיוקרדיאלית. אולם, עקב הסיכון הכרוך בביופסיה, המיומנות הנדרשת לביצועה ולפיענוח הממצאים, היא אינה מבוצעת במרבית החולים עם חשד קליני למיוקרדיטיס. על כן, חשד הקליני למיוקרדיטיס (clinically suspected myocarditis) מתבסס על שילוב של ממצאים קליניים ובדיקות עזר בהיעדר הסבר אלטרנטיבי לממצאים, כגון תסמונת כלילית חדה. על פי נייר העמדה של האגוד הקרדיולוגי האירופי מ-2013, חשד קליני למיוקרדיטיס חדה מתבסס על שילוב של הסתמנות קלינית (כאבים בחזה, קוצר נשימה, דפיקות לב, התעלפות, הלם לבבי או מוות פתאומי) ועדות לתהליך דלקתי או/ו נזק מיוקרדיאלי על פי אק"ג (Electrocardiogram), בדיקות מעבדה (בפרט טרופונין (Troponin)), ובדיקות הדמיה (טבלה 1). דרוש ממצא קליני 1 או יותר וממצא 1 או יותר בבדיקות עזר לבסס חשד למיוקרדיטיס. במטופל אי תסמיני נדרשים >2 ממצאים חיוביים בבדיקות העזר. פרודרומה (prodrome) המתאימה לזיהום ויראלי מחזקת את החשד[1].
מאז פרסום נייר עמדה זה ב-2013 חלה התקדמות בשימוש השגרתי בבדיקת טרופונין בעלת רגישות גבוהה וב- MRI לב (Cardiac Magnetic Resonance Imaging) עם שפור האמינות של האבחון הקליני של מיוקרדיטיס חדה. בעקבות זאת נוספה אבחנה של מיוקרדיטיס מוכחת קלינית (clinically confirmed myocarditis) המתבססת על שילוב של סימנים קליניים, עליה בטרופונין, ומילוי קריטריונים מקובלים למיוקרדיטיס חדה ב-MRI[5] (תרשים 2). האבחנה של מיוקרדיטיס וודאית (proven myocarditis) מבוססת על תוצאות ביופסיה אנדומיוקרדיאלית. לפי כך, לצורך בהירות, אנו ממליצים להשתמש בטרמינולוגיה של חשד קליני למיוקרדיטיס, מיוקרדיטיס מוכחת קלינית, ומיוקרדיטיס וודאית המוכחת בפתולוגיה [בביופסיה אנדומיוקרדיאלית, רקמת לב שהוצאה בעת השתלת לב/LVAD (Left Ventricular Assist Device) או בנתיחה לאחר המוות] (תרשים 2). הומלץ לנקוט בגישה דומה באבחון מיוקרדיטיס לאחר חיסון למניעת 19 COVID (Coronavirus disease 2019) [6] ולאבחון מיוקרדיטיס בילדים[5].
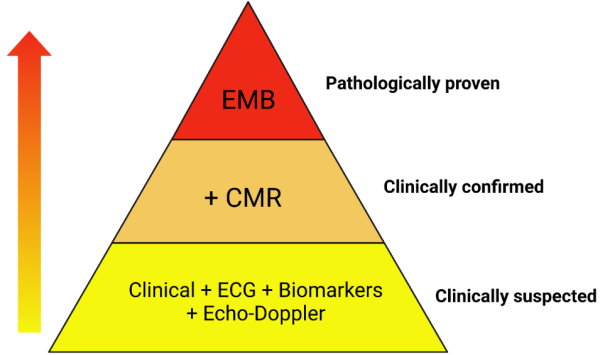
מקרא: Cardiac Magnetic Resonance = CMR
EndoMyocardial Biopsy = EMB ElectroCardioGraphy = ECG
התייצגות קלינית
|
בדיקות עזר
|
מרבית החולים המאובחנים עם מיוקרדיטיס חריפה סובלים מכאבים בחזה (עד 95 אחוזים מהמקרים) ומחציתם מתייצגים עם קוצר נשימה ו/או עייפות[1][2][3]. תסמינים אחרים כוללים דפיקות לב, התעלפות ואף מוות פתאומי. התלונות יכולות להימשך שעות עד מספר שבועות לפני פניה לקבלת סיוע רפואי.
התייצגות קלינית
חום הוא הפרודרום הנפוץ ביותר, המופיע בכ-65 אחוזים מהחולים, לצד תסמינים דמויי שפעת, תסמינים גסטרואינטסטינלים (gastrointestinal), כאבי גרון וכדומה. תסמינים אלה מחזקים את החשד לזיהום נגיפי אך עקב הסגוליות הנמוכה שלהם, הם אינם נכללים בקריטריונים לאבחון מיוקרדיטיס חדה[1].
בדיקות עזר
בדיקות מעבדה: יש לבצע בדיקות דם לכל חולה החשוד כסובל ממיוקרדיטיס כולל ספירת דם עם מבדלת, טרופונין בעל רגישות גבוהה, NTproBNP (N-Terminal pro-Brain Natriuretic Peptide), CK (Creatine Kinase), שקיעת דם ו- CRP (C-Reactive Protein). בנוסף יש לשקול בהתאם לנסיבות הקליניות ביצוע משטח גרון לווירוסים, PCR1 לווירוסים בדם (כגון, שפעת, COVID-19 ,CMV (Cytomegalovirus) ו-Parvo B19 (Parvovirus B19)), ובדיקות למחלות קולגן (Collagen) (בפרט ANA (AntiNuclear Antibody) ופאנל מורחב בהתאם לחשד קליני ספציפי הכולל אנטי DNA (Deoxyribonucleic acid), C3-4 (Complement), אנטי RNP (antinuclear RiboNucleoProtein), אנטי RO (anti–Sjögren's-syndrome-related antigen A autoantibodies) אנטי LA (Anti-Sjogren's Syndrome B), P-ANCA (Perinuclear Anti-Neutrophil Cytoplasmic Antibodies), C- ANCA (Cytoplasmic Anti-Neutrophil Cytoplasmic Antibodies), וראומטואיד פקטור (Rheumatoid Factor, RF)). היעדר אאוזינופיליה (Eosinophilia) אינה שוללת מיוקרדיטיס אאוזינופילית, והערכה היא שבעד 25 אחוזים מהמקרים עם אבחנה של מיוקרדיטיס אאוזינופילית בביופסיה אנדומיוקרדיאלית, לא הייתה אאוזינופיליה בספירת דם בזמן קבלה לבית החולים[7]. בדיקות סרולוגיה (Serology) לווירוסים הן בעלות רגישות נמוכה. תשובה שלילית אינה שוללת שהסיבה למיוקרדיטיס היא מחלה וירלית, ולא נמצאה התאמה בין הממצאים בסרולוגיה לזיהוי נגיפים בביופסיה אנדומיוקרדיאלית[1] . מאידך, בדיקות סרולוגיות להפטיטיס C, HIV (Human Immunodeficiency Virus), Borrelia burgdorferi, Q fever ו- Trypanosoma cruzi עשויים לתרום במקרים ספציפיים לביסוס האבחנה[8].
אק"ג: הממצאים במיוקרדיטיס יכולים לכלול עליות קעורות ומפושטות במקטע ST-T, ככלל ללא שינויים הופכיים (רציפרוקלים, reciprocal), ומעבר לאזור המסופק על ידי עורק כלילי ספציפי. גלי Q יכולים להופיע גם במיוקרדיטיס ולכן נוכחותם אינה שוללת אבחנה זו. הפרעות הולכה עלייתיות-חדריות והפרעות קצב חדריות מורכבות עלולות להופיע בשכיחות גבוהה יותר במיוקרדיטיס משני ל-Giant cell, מיוקרדיטיס אאוזינופילית, סרקואידוזיס (Sarcoidosis), מחלת Lyme ומיוקרדיטיס בעקבות טיפול בתכשירי ICI (Immune Checkpoint Inhibitors).
אקוקרדיוגרם: כל החולים עם חשד למיוקרדיטיס צריכים לעבור בדיקה אקוקרדיוגרפית בקבלתם. יש לחזור על הבדיקה במהלך האשפוז בהתאם למצב הקליני, במיוחד בחולים עם תפקוד לבבי ירוד בקבלה או עם החמרה קלינית באשפוז. מיוקרדיטיס יכולה להתייצג גם כעיבוי שריר לב, תפקוד סיסטולי תקין של חדר שמאל, ירידה גלובלית בתפקוד החדר או הפרעה אזורית בהתכווצות. ממצאי האקוקרדיוגרם עלולים לדמות לקרדיומיופתיה רסטריקטיבית (restrictive), היפרטרופית (hypertrophic), מורחבת (dilated) או ARVC (Arrhythmogenic Right Ventricular Cardiomyopathy).
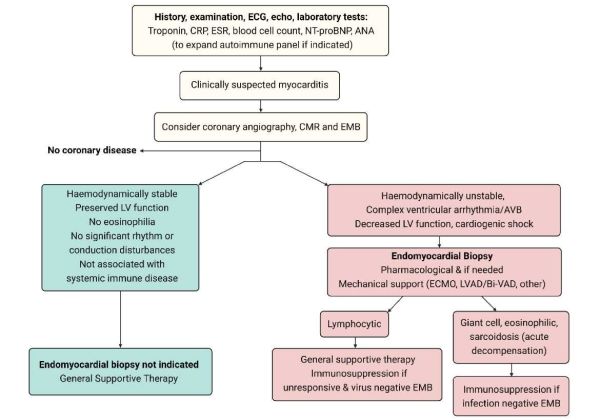
שלילת איסכמיה כגורם לתסמינים - בחולים עם מיוקרדיטיס, מומלץ לשלול מחלה כלילית חריפה בסמוך לקבלה, על ידי צנתור עורקים כליליים או טומוגרפיה ממוחשבת (CT, Computer Tomography) של העורקים הכליליים, אלא אם כן הסבירות לכך נמוכה ביותר (תרשים 3).
תהודה מגנטית של הלב (Cardiac MRI) - תהודה מגנטית של הלב מאפשרת זיהוי דלקת, פרפוזיה ובצקת בעזרת מיפוי T2 1T, הערכת נפח חוץ תאי, עם מידע על מיקום וחומרת השינויים וכן למדוד את מקטע הפליטה של חדר שמאל וחדר ימין. בנוסף, תהודה מגנטית מאפשרת בעזרת LGE (Late Gadolinium Enhancement) להעריך קיום נזק לרקמת שריר הלב והצטלקויות (פיברוזיס, Fibrosis). נקבעו קריטריונים לאבחון מיוקרדיטיס חריפה בתהודה מגנטית (Updated Lake Louise Criteria) בעלי רגישות של 87.5 אחוזים וסגוליות של 96 אחוזים[9]. הדיוק האבחנתי של MRI משתנה בהתאם לרקע הקליני. הרגישות הגבוהה ביותר מתקבלת בבדיקה הנעשית בתוך 2–3 שבועות מההתייצגות הקלינית[8]. המספרים המוזכרים למעלה טיפוסיים למיוקרדיטיס השכיחה שמתבטאת ככאב בחזה. הדיוק האבחנתי נמוך יותר במיוקרדיטיס המתבטאת כהפרעת קצב או כאי ספיקת לב[10].
לבדיקת ה MRI גם ערך באבחנה מבדלת[11] ומשמעות פרוגנוסטית[12]. סריקת MRI שלילית בחולה עם חשד קליני לדלקת שריר הלב קשורה לפרוגנוזה טובה. לעומת זאת, ממצא של- LGE בשכבה האמצעית של המחיצה הבין-חדרית ומקטע פליטה ירוד של חדר שמאל באשפוז זוהו כמנבאים החזקים ביותר לסיבוכים קרדיווסקולאריים, במיוחד כאשר הממצאים מתמידים בבדיקה חוזרת[12].
מומלץ לבצע MRI בכל החולים עם חשד קליני למיוקרדיטיס[3][13], במקרים קלים יש לבצע את הבדיקה תוך 2–3 שבועות מהתחלת התסמינים, במקרים קשים ובחולים מורכבים - במהלך האשפוז כשמצבם הקליני מתייצב[3][8]. אין לבצע בדיקת MRI בחולים לא יציבים המודינמית.
פירוט טכניקת ההדמיה הוא נושא בפני עצמו והקורא המעוניין מופנה להנחיות העדכניות בפרט רצפי המיפוי ושיטות הסריקה. חשוב שהבדיקה תתבצע תוך שימוש בטכנולוגיות מתקדמות, המספקות מידע אבחוני ופרוגנוסטי על פי אמות המידה המומלצות בהנחיות העדכניות[9][11].
הדמיה גרעינית: השימוש בהדמיה גרעינית (כגון PET-CT (positron emission tomography - computed tomography)) אינו מומלץ באופן כשגרה. הבדיקה יכולה לסייע במקרים בהם קיימת התוויית נגד לביצוע תהודה מגנטית ובמקרים החשודים לסרקואידוזיס. יש לבצע את בדיקת PET-CT תוך שימוש בפרוטוקול "לבבי", הכולל תזונה מיוחדת ולאחריה צום ממושך במטרה לדכא קליטה פיזיולוגית של גלוקוז על ידי תאים תקינים של שריר הלב.
ביופסיה אנדומיוקרדיאלית
ביופסיה אנדומיוקרדיאלית נחשבת לשיטת האבחון הדפיניטיבית של מיוקרדיטיס ויכולה לזהות את האתיולוגיה הבסיסית ואת סוג הדלקת ובכך לכוון לטיפולים אפשריים (תרשים 3). הביופסיה כרוכה בסיכונים באחוז אחד ועד שני אחוזים במרכזים רפואיים מנוסים ועד 9 אחוזים במרכזים בעלי נפח נמוך[3] ולכן מומלץ להגביל את השימוש בה למקרים בהם הטיפול תלוי באבחנה ההיסטולוגית ו/או הווירולוגית[15][16]. עם התקדמות שיטות הדמיה, במיוחד MRI לב, ביופסיית לב אינה נחוצה במקרים של מיוקרדיטיס "לא מסובכת", דהיינו במצב המודינמי יציב, ללא ירידה בתפקוד הלב (LVEF (Left Ventricle Ejection Fraction) מתחת ל-50 אחוזים) וללא הפרעות קצב/הולכה מסכנות חיים.
במטופלים בהם קיימת התוויה לביצוע ביופסיית לב, ההמלצה היא להעבירם למרכזים רפואיים בעלי יחידות לאי-ספיקת לב מתקדמת עם ניסיון בביצוע ביופסיות לב כדי למזער את שיעורי הסיבוכים הכרוכים בפעולה.
התוויות לביצוע ביופסיה אנדומיוקרדיאלית[1][2][3][12][13][15][16][17], (תרשים 3):
- מיוקרדיטיס חדה המתייצגת כאי ספיקת לב קשה או הלם קרדיוגני (מיוקרדיטיס פולמיננטית (fulminant))
- מיוקרדיטיס חדה המתייצגת כאי ספיקת לב בנוכחות ירידה משמעותית בתפקוד הלב הסיסטולי (LVEF מתחת ל-40 אחוזים) שאינה משתפרת תחת טיפול
- הפרעות קצב חדריות מורכבות (אריתמיה (arrhythmia) חדרית SUSTAINED או אירועים חוזרים של NSVT (Non-Sustained Ventricular Tachycardia)), או חסם הולכה עלייתי-חדרי בדרגה גבוהה, ללא קשר לדרגת הירידה בתפקוד הלב
- מיוקרדיטיס חדה הקשורה לטיפול ב-Immune checkpoint inhibitors (ICI) כאשר האבחנה אינה ודאית. במקרים אלה, לאבחנה השלכה על המשך הטיפול בסרטן
- קרדיומיופתיה מורחבת עם אי ספיקת לב שאובחנה, עם או ללא סיפור של מיוקרדיטיס, בנוכחות ירידה בינונית או קשה בתפקוד הלב שאינה מגיבה לטיפולים המקובלים למשך 3–6 חודשים. ביופסיה במקרים אלה עשויה לאבחן קרדיומיופתיה דלקתית כרונית שיכולה להגיב לטיפול אימונוסופרסיבי (immunosuppressive)[18]{{הערה|שם=הערה18|Chimenti C, Russo MA, Frustachi A. Immunosuppressive therapy in virus-negative inflammatory cardiomyopathy: 20-year follow-up of the TIMIC trial. Eur Heart J 2022;43:3463-3473})
- חשד לקרדיומיופתיה דלקתית עם נזק מתמשך לשריר הלב שביטוייה הפרשה מתמשכת של טרופונין בדם, במיוחד בקרב חולים עם אי ספיקת לב או בנוכחות של הפרעת הולכה עלייתית חדרית מתקדמת או הפרעות קצב חדריות. כמו כן, יש לשקול ביצוע ביופסיה בחשד למחלה אוטואימונית או אאוזינופיליה בלתי מוסברת
- יש לשקול ביופסיה במיוקרדיטיס חדה חוזרת[16]
שיטה ודגימות: ביופסיה מהלב מתבצעת בדרך כלל מחדר ימין אך ניתן לבצעה מחדר שמאל במקרים מסוימים וזאת בהתאם למידע הקליני וממצאי ההדמיה (כמו MRI או/ו PET-CT), וכן מיפוי אלקטרו-אנאטומי (electro-anatomical), אשר יכולים לכוון להיקף ומיקום המחלה בלב. מומלץ לבצע ביופסיית לב בשלב מוקדם של המחלה ולקחת מספר דגימות (רצוי 5–7 דגימות) על מנת להקטין את שגיאות הדגימה. יש לשמור את הדגימות לפתולוגיה בפורמלין (formaldehyde) 10 אחוזים בטמפרטורת החדר או במקרר (4 מעלות צלזיוס (Celsius)) ואת הדגימות לוירולוגיה יש להקפיא בחנקן נוזלי או לשמור במדיום של דגימות וירולוגיות מייד לאחר הלקיחה. במקרים מסוימים ניתן להקפיא דגימות טריות בטמפרטורה של 70- מעלות צלזיוס ובגלוטראלדהיד (glutaraldehyde) לצורך שימוש במיקרוסקופ אלקטרוני.
במסגרת העיבוד הפתולוגי נהוג לבצע תחילה צביעה של הרקמה על ידי המטוקסילין-אאוזין (Hematoxylin-Eosin). להגברת רגישות הבדיקה יש להוסיף צביעות אימונוהיסטוכימיות (Immunohistochemistry) על ידי נוגדנים ספציפיים נגד סמנים ייחודיים של תאי דלקת המסנינים את רקמת הלב ובפרט תאי CD3 (T (Lymphocytes)) ומקרופגים (CD68). סמנים אפשריים נוספים הם HLA DR (Human Leukocyte Antigen), תתי הסוגים של תאי T (CD4 ו-CD8), ותאי B (CD20). לאחר בדיקה ראשונית יש לשקול גם ביצוע צביעות נוספות כגון MASSON's TRICHROME לפיברוזיס ו-CONGO RED לעמילואיד (Amyloidosis).
בדיקת PCR לווירוסים מהרקמה היא כלי חשוב כדי לסייע בזיהוי האטיולוגיה במקרים של מיוקרדיטיס ויראלית, והרגישות של בדיקה זו גבוהה בהרבה מבדיקות PCR מהדם וממשטח גרון, בפרט כשמדובר בזיהום ויראלי המוגבל ללב (cardiotropic). מומלץ לבדוק הנגיפים הבאים: (Coxsackie, Echo) Enteroviruses ,Parvovirus B19 (PVB19), HHV6 (Human Herpesvirus 6) ולשקול במקרים ספציפיים גם CMV, EBV (Epstein-Barr Virus), HCV (Hepatitis C Virus), Influenza, HIV ו-Coronaviruses. PVB19 הוא הנגיף השכיח ביותר בביופסיות לבביות, אך הוא שכיח גם באוכלוסייה בריאה וכך גם HHV6. לכן, למספר ההעתקים של PVB19 ו- HHV6 בביופסיה יש משמעות קלינית: מקובל שמעל 500 עותקים למיקרוגרם חומצות גרעין של וירוסים אלה שהופקו מדגימת ביופסיה, מבטאים תהליך הדלקתי פעיל בשריר הלב[8][19][20].
הגדרת דרגות חומרה של מיוקרדיטיס
ניתן להעריך את רמת הסיכון של החולה עם מיוקרדיטיס לפי קריטריונים קליניים כמפורט בטבלה 2, כאשר הדגש הוא על שילוב של ההתייצגות הקלינית (תסמיני אי-ספיקת לב, הלם קרדיוגני וכדומה), הערכת תפקוד חדר שמאל באקו לב בקבלה, וקיום הפרעות קצב חדריות מתמשכות או הפרעות הולכה עלייתי-חדרי דרגה שנייה מסוג 2 Mobitz או דרגה שלישית.
| התייצגות קלינית | מקטע פליטה של חדר שמאל | הפרעות קצב חדריות (VF/VT) או חסם הולכה עלייתי-חדרי | |
|---|---|---|---|
| סיכון גבוה | הלם קרדיוגני | מתחת ל-30 אחוזים | +/- |
| תסמיני אי ספיקת לב חריפה | 40-30 אחוזים | + | |
| סיכון בינוני | תסמיני אי ספיקת לב חריפה | 40-30 אחוזים | - |
| תסמינים קלים של אי ספיקת לב חריפה | 49-41 אחוזים | + | |
| סיכון נמוך | ללא תסמיני אי-ספיקת לב עם לחצי דם תקינים | מעל 50 אחוזים | - |
טיפול במיוקרדיטיס לפי דרגות חומרה ואטיולוגיה
הטיפול במיוקרדיטיס מבוסס על דרגת חומרת המחלה, רמת הסיכון והאטיולוגיה.
עקרונות הטיפול לפי דרגות החומרה מוצגים בטבלה 3 ואילו אמצעי הטיפול לפי סוג המיוקרדיטיס מובאים בטבלה 4.
ברוב המקרים מיוקרדיטיס היא מחלה קלה ומוגבלת בזמן הדורשת טיפול תומך, מנוחה והשגחה באשפוז.
נוכח החשש מהפרעות קצב, בכל החולים מומלץ ניטור קצב לב, לכל הפחות במהלך היממה הראשונה.
במקרים הקשים, יש צורך בתמיכה המודינאמית פרמקולוגית ומכנית. במקרים אלה יש להעביר את החולה למרכז שלישוני המתמחה בביצוע ביופסיה אנדומיוקרדיאלית ויכולת לתמיכה המודינאמית/מכנית מתקדמת. כמו כן, יש לשקול מתן סטרואידים לווריד עוד לפני ביצוע הביופסיה או לפני קבלת תשובת ביופסיה, במיוחד כאשר קיים חשד לתהליך המושרה על ידי מערכת החיסון (immune-mediated)[3][17]. לאחר קבלת תשובת הביופסיה הטיפול יינתן בהתאם לאבחנה, ראה טבלה 4.
במטופלים עם מיוקרדיטיס מאנטרו-וירוס (EntreoVirus), CMV, או אדנו-וירוס (Adenovirus), יש להפסיק את הטיפול האימונוסופרסיבי. במטופלים עם מיוקרדיטיס מ-PVB19 או 6-HHV, המשך טיפול אימונוסופרסיבי יינתן בזהירות רבה ויהיה תלוי בתגובה ראשונית לסטרואידים (שביטוייה שיפור במקטע הפליטה או רמת הטרופונין) ולעומס הנגיפי[3][8][20].
במקרים בחומרה בינונית, לצד הטיפול התומך וההשגחה, יינתן טיפול באי ספיקת לב ובהפרעות קצב לפי ההנחיות הקיימות. כמו כן יש לשקול העברה למרכז שלישוני, ביצוע ביופסיה ותמיכה מכנית לפי מצב החולה והמהלך הקליני באשפוז.
תוצאות הביופסיה עוזרות בהגדרת האטיולוגיה של מיוקרדיטיס ובהתאם לכך בקביעת טיפול ופרוגנוזה. מיוקרדיטיס לימפוציטרית (lymphocytic myocarditis) מלווה ברוב המקרים בפרוגנוזה טובה. לעומת זאת הפרוגנוזה גרועה יותר במקרים של מיוקרדיטיס של תאי ענק (giant cell ,GCM) מיוקרדיטיס אאוזינופילית, סרקואידוזיס לבבית, מיוקרדיטיס הקשורה לטיפול ב-ICI או בנוכחות מחלה אוטואימונית, מצבים המחייבים טיפול בסטרואידים בלבד או בשילוב עם תכשירים אימונוסופרסיביים נוספים (ראו טבלה 4).
במיוקרדיטיס חדה שאינה מגיבה לטיפול קונבנציונלי או במקרים של קרדיומיופתיה דלקתית כרונית, כאשר בהיסטולוגיה קיימת דלקת לימפוציטרית, ניתן לשקול מתן טיפול אימונוסופרסיבי תוך מעקב קפדני כפי שמופיע בטבלה 4[1][3][8][21][18]. ככלל, הימצאות וירוס ברקמת הלב מהווה הוראת נגד לטיפול אימונוסופרסיבי. במיוקרדיטיס הקשורה למחלה דלקתית סיסטמית, הטיפול תואם על פי רוב את הטיפול במחלת הרקע ומתבסס לרוב על טיפול אימונוסופרסיבי (תרשים 3).
| 3א': טיפול ומעקב בחולי מיוקרדיטיס:
כל החולים החשודים למיוקרדיטיס יאושפזו וישהו במנוחה ותחת ניטור קצב לב לכל הפחות ביממה הראשונה. כל החולים החשודים למיוקרדיטיס יעברו בדיקות מעבדה ואקו לב בקבלתם לאשפוז. בכל החולים החשודים למיוקרדיטיס יש לשלול תסמונת כלילית חריפה באמצעות CT קורונרי או צנתור כלילי אלא אם כן הסבירות לכך נמוכה ביותר. יש לתת את הדעת לאטיולוגיה גנטית או אימונית. יש לתשאל לסיפור קודם של מיוקרדיטיס, סיפור משפחתי של מיוקרדיטיס, קרדיומיופתיה, מוות פתאומי או מחלה דלקתית סיסטמית. במקרים בהם יש חשד לרקע גנטי, מומלץ לבצע אקו לב ואק"ג בקרב בני משפחה מדרגה ראשונה ולשקול בירור גנטי- מולקולרי (genetic-molecular) לקרדיומיופתיה תורשתית שמתייצגת כמיוקרדיטיס. |
3ב': טיפול בחולה עם מיוקרדיטיס פולמיננטית (דהיינו חולה המתדרדר המודינאמית או המציג הפרעות קצב חדריות או הפרעות הולכה מסכנות חיים):
|
| לימפוציטרית[22][3][8] | GIANT CELL[23] | אאוזינופילית[7] | סרקואידוזיס לב[24] | קשור ל ICI[25][26] | קרדיומיופתיה דלקתית כרונית[22][18][21] | |
|---|---|---|---|---|---|---|
| טיפול בסיסי | טיפול תומך | סטרואידים + Cyclosporine או Tacrolimus + Imuran או Mycophenolate | Methylprednisolone תוך ורידי,
בהמשך Prednisone פומי |
סטרואידים | הפסקת מתן התכשיר הפוגע + Methylprednisolone תוך ורידי במינון 500–1000 מיליגרמים למשך 3 ימים לפחות | Imuran + Prednisone בחולים לאחר מיוקרדיטיס או DCM שאובחן, עם אי ספיקת לב ופגיעה משמעותית בתפקוד חלב למרות טיפול מיטבי לאי ספיקת לב, עם עליה כרונית ברמת טרופונין, עם סימני דלקת והעדר וירוס במיוקרד בביופסיה |
| טיפול קו שני | Prednisone +/- Imuran או בחולים Mycophenolate מדרדרים למרות טיפול מיטבי לאי ספיקת לב עם סימני דלקת והעדר וירוס במיוקרד בביופסיה | ATG or Alemtuzumab (antiCD52) | בהתאם לחומרת וסוג המחלה ניתן לשקול Cyclosporine תוך ורידי או Anti CD52 | Steroid sparing: Methotrexate או מיקופינולט | בחולה לא יציב ללא תגובה לטיפול ראשוני יש לעבור לקו שני - Mycophenolate, ATG, Immunoglobulin (IVIG) תוך ורידי וכדומה | |
| טיפול נוסף | IVIG? | Rituximab (antiCD20) | Anti TNF | תרופות ניסיוניות | ||
| משך טיפול | כנדרש | לפחות שנה, לרוב נדרש טיפול קבוע עם הקטנה הדרגתית במינונים | כנדרש | לפחות 1 שנה | ירידה הדרגתית במינון סטרואידים עד לרזולוציה של טרופונין ואריתמיות / הפרעות הולכה | 6 חודשים |
- Anti Tumor Necrosis Factor = Anti TNF
- Anti Thymocyte Globulin = ATG
- ICI = תכשירים ממשפחת Immune Check point Inhibitors
- IntraVenous ImmunoGlobulins= IVIG
שחרור ומעקב אחרי השחרור
במועמדים לשחרור מבית החולים יש לוודא יציבות המודינמית, מגמת ירידה בטרופונין, והעדר הפרעות קצב תסמיניות או מסוכנות.
מומלץ לבצע אקו לב חוזר לפני השחרור במקרים בהם הודגמה ירידה בתפקוד הסיסטולי באקו שנעשה בקבלה, ו/או אם הייתה החמרה במצב הקליני או סימני אי ספיקת לב במהלך האשפוז.
יש לשאוף לביצוע MRI לב במהלך האשפוז (במקרים בחומרה בינונית/קשה) או תוך 2–3 שבועות (במקרים קלים) מההסתמנות.
יש לשקול מתן VEST בשחרור בחולים עם ירידה קשה בתפקוד הסיסטולי של חדר שמאל באקו לפני השחרור ו/או בחולים שסבלו מהפרעות קצב חדריות מורכבות במהלך האשפוז. בחולים שסבלו מהפרעת קצב חדרית sustained וחוסר יציבות המודינאמית יש לשקול השתלת ICD (Implantable Cardioverter-Defibrillator) לפני השחרור[27].
בחולים עם ירידה בתפקוד הסיסטולי יש להתחיל טיפול בחוסם ביטא (beta blocker), מעכבי ACE (Angiotensin-Converting Enzyme)/חוסמי ARB (Angiotensin receptor blockers) ויתר הטיפולים המומלצים לפי הנחיות ה- ESC (European Society of Cardiology) וה-AHA (American Heart Association)[13][28]. בחולים בהם בתום השלב החד של המיוקרדיטיס נצפתה חזרה מלאה של התפקוד וממדי חדר שמאל לנורמה יש להמשיך את הטיפול בחוסם ביטא ומעכבי ARB/ACE לפחות למשך 6–12 חודשים.
חולים עם תסמיני אי ספיקת לב ו/או ירידה לא הפיכה בתפקוד הסיסטולי של חדר שמאל, מיוקרדיטיס חוזרת או אריתמיה חדרית, או עם סיפור משפחתי של מיוקרדיטיס או קרדיומיופתיה, יופנו להערכה/מעקב במרפאת קרדיומיופתיות/אי ספיקת לב.
כל מחלימי מיוקרדיטיס יעברו בדיקת אקו-דופלר, אק”ג ובדיקת קרדיולוג 3 חודשים ו- 6–12 חודשים לאחר השחרור. לאחר מכן, המעקב הקרדיולוגי ומשכו יקבעו על פי המהלך הקליני במהלך האשפוז ואחריו[13]. האיגוד הקרדיולוגי האירופאי ממליץ על מעקב קרדיולוגי למשך 4 שנים לפחות לאחר השלב החריף של מיוקרדיטיס. סיכום תהליך האבחון טיפול ומעקב אחרי מיוקרדיטיס חדה מובא בטבלה 5.
במידת האפשר יש לדחות את ההחלטה על השתלת CRTD (Cardiac Resynchronization Therapy Defibrillator)/ICD/CRT (Cardiac Resynchronization Therapy) ב-3–6 חודשים על מנת לאפשר שיפור בתפקוד הססטולי של חדר שמאל.
ניתן לשקול ביצוע MRI חוזר 6–12 חודשים לאחר השחרור כאשר היו ממצאים המאפיינים סיכון מוגבר ב-MRI הראשון: LGE נרחב או ממוקם ב-אמצע המחיצה הבין חדרית (mid-septum) ו/או דלקת נרחבת ב MRI הראשון. כמו כן יש לשקול MRI חוזר במקרים של הפרעה מתמדת בתפקוד הלבבי על פי בדיקת אקו במעקב, הפרעות קצב מורכבות או חשד קליני להמשך התהליך הדלקתי במיוקרד[8][12][13].
בחולים שמצבם לא משתפר או מדרדר למרות טיפול תרופתי מלא לאי ספיקת לב, יש לבצע הערכה מחודשת כולל בדיקת טרופונין ו-BNP/NTproBNP ויש לשקול ביצוע ביופסיה לבבית. בהתאם לתוצאות הביופסיה יש לשקול טיפול אימונוספרסיבי כמפורט בטבלה 4 ותרשים 3.
| התייצגות קלינית | LVEF
(באחוזים) |
VT/VF or AVB | Risk | העברה למרכז שלישוני | תמיכה המודינמית זמנית | CMR | EMB | טיפול | מקום אשפוז ומשך אשפוז | אקו לב לפני השחרור | מעקב |
|---|---|---|---|---|---|---|---|---|---|---|---|
| שוק קרדיוגני/ מיוקרדיטיס פולמיננטית[29] | לרוב מתחת ל-30 | +/- | קריטי | + | + | לפני שחרור | + | אינוטרופים (inotropes), תמיכה מכנית, סטרואידים במינון גבוה[30] (עד קבלת תשובת ביופסיה), לשקול IVIG[31] לשקול VEST | טיפול נמרץ משך אשפוז כנדרש | כן | מרפאת אי ספיקת לב והפרעות קצב לפחות במשך 4 שנים |
| אי ספיקת לב קשה[29] | 40-30 | + | גבוה | + | לפי הצורך | לפני שחרור | + | טיפול תומך, לשקול סטרואידים מינון גבוה (עד קבלת תשובת ביופסיה) לשקול VEST | טיפול נמרץ משך אשפוז כנדרש | כן | מרפטת אי ספיקת לב והפרעות קצב לפחות במשך 4 שנים |
| הפרעת קצב עם או ללא אי ספיקת לב[29] | בכל הטווח | + | גבוה | + | לפי הצורך | לפני שחרור | + | טיפול תומך, לשקול סטרואידים מינון גבוה (עד קבלת תשובת ביופסיה) לשקול VEST | טיפול נמרץ משך אשפוז כנדרש | כן | מרפאת הפרעות קצב ואי ספיקת לב לפחות במשך 4 שנים |
| אי ספיקת לב קלה- בינונית | קטן מ־50 | - | בינוני | לשקול | - | + באשפוז או תוך 2–3 שבועות | לשקול | טיפול תומך. לשקול סטרואידים לפי תשובת ביופסיה | יחידה קרדיולוגית, לפחות 5 ימים | כן | 1, 3, 12 חודש ואחת לשנה לפחות במשך 4 שנים |
| ללא סימפטומים של אי ספיקת לב | מ-50 ומעלה | - | נמוך | - | - | + באשפוז או תוך 2–3 שבועות | - | טיפול תומך | ניטור אקג לפחות 24 שעות, אשפוז 3–5 ימים | לשקול | 1, 3, 12 חודש ואחת לשנה. משך המעקב על פי שיקול רפואי |
Abbreviations:
- EMB ,endomyocardial biopsy
- CMR ,cardiac magnetic resonance imaging
- VT ,ventricular tachycardia ,VF ,ventricular fibrillation
- AVB ,atrioventricular block
- LVEF ,left ventricular ejection fraction
- IVIG ,intravenous immunoglobulins
- VEST - wearable defibrillator
צורות ׳יחודיות של מיוקרדיטיס
מיוקרדיטיס חוזרת ומשפחתית
מיוקרדיטיס חוזרת היא מצב לא שכיח המתאפיין באירועים חוזרים של מיוקרדיטיס עם תקופות רגיעה קלינית ומעבדתית ובפרט חזרת טרופונין לנורמה בין ההתקפים.
יש להבדיל מצב זה ממצב של קרדיומיופתיה דלקתית כרונית (מיוקרדיטיס כרונית), המתאפיינת בהפרשה קבועה של טרופונין עם עליות ומורדות בתסמינים קליניים.
בשני המקרים יש חשש מהתדרדרות בתפקוד הלבבי והתפתחות אי ספיקת לב ועל כן חולים אלה צריכים הערכה במרפאת קרדיומיופתיות/אי ספיקת לב.
מיוקרדיטיס חוזרת יכולה להיות חלק מתסמונת דלקתית סיסטמית, אוטואימונית [SLE (Systemic Lupus Erythematosus), דרמטומיאוזיטיס (Dermatomyositis) וכדומה] או אוטוראקטיבית (Autoreactive)[21]. במקרים האחרונים לפעמים ישנה מחלה נלווית כמו מחלת מעי דלקתית, דלקת בבלוטת התריס או פסוריאזיס (Psoriasis). במקרה של חשד למחלה דלקתית סיסטמית יש להמליץ בנוסף ל-MRI גם על בירור אימונולוגי ו-PET CT לפי פרוטוקול מותאם להדגמת פתולוגיה לבבית, דהיינו צום ממושך ודיאטה מיוחדת לפני הבדיקה.
מיוקרדיטיס חוזרת או מיוקרדיטיס כרונית יכולה להיות תופעה משפחתית תורשתית כגון מוטציות (mutations) הגורמות לקרדיומיופתיות אריתמוגניות (arrhythmogenic cardiomyopathy, ACM)[32]. לכן, יש לתשאל על היסטוריה משפחתית של קרדיומיופתיה לא-איסכמית (non ischemic cardiomyopathy), מיוקרדיטיס במשפחה, או מוות פתאומי בגיל צעיר. בקרדיומיופתיה אריתמוגנית עם מעורבות עיקרית של חדר שמאל, האקוקרדיוגרם יכול להיות תקין או כמעט תקין, אך ה-MRI יכול לתת מאפיינים טיפוסיים למיוקרדיטיס כהתייצגות של קרדיומיופתיה או LGE נרחב בתבנית דמוית טבעת[32].
יש להפנות חולים עם חשד לקרדיומיופתיה תורשתית למרפאות של קרדיומיופתיה/אי ספיקת לב לאבחון וטיפול, כולל הערכת הצורך בביצוע בדיקה גנטית, וביופסיה אנדומיוקרדיאלית.
כאשר למיוקרדיטיס חוזרת מתלווה גם פריקרדיטיס יש מקום לתת טיפול ב-Colchicine, וניתן לשקול מתן מעכבי הציר של פעילות IL1 (Interleukin-1) כגון Anakinra.
מיוקרדיטיס חדה כתוצאה מטיפול בתכשירי ICI
אימונותרפיה עם immune checkpoints inhibitors) ICI) הובילה למהפכה בטיפול בסרטן, כשיותר מ-50 אחוזים ממטופלי הסרטן מתאימים לטיפול זה[26]. מנגנון הפעולה של תכשירי ICI גורם להתעוררות מערכת החיסון של הגוף לזהות את הסרטן כגוף זר ואי לכך לתקוף אותו. כחלק ממנגנון זה, ישנה לעיתים גם פגיעה לא רצונית באיברים נוספים בגוף, בניהם שריר הלב, והתפתחות מיוקרדיטיס. בעוד שמדובר בתופעה לא שכיחה (כ-1 אחוז), מדובר בפוטנציאל גבוה למיוקרדיטיס קשה עד פולמיננטית, עם שיעור תמותה של כ-50 אחוזים. באופן טיפוסי מיוקרדיטיס מופיעה אחרי סבב טיפול 1–3 ובחלק ניכר מהמקרים מלווה בסיבוכים אימונולוגיים נוספים כגון קוליטיס (Colitis), מיוזיטיס (Myositis), תסמונת דמוית מיאסטניה (Myasthenia) ופנוימוניטיס (Pneumonitis). אי לכך ישנה חשיבות עליונה לזיהוי וטיפול מוקדם[26]. כאשר יש חשד למיוקרדיטיס יש להפסיק את הטיפול ב ICI מיידית ולהשלים אבחנה על ידי ביצוע אק"ג, ביומרקרים (טרופונין BNP1) אקו לב ו-MRI לב. אם האבחנה אינה ודאית יש לשקול ביצוע ביופסיה אנדומיוקררדיאלית. בחולים סימפטומטיים עם אבחנה של מיוקרדיטיס יש לנטר את המטופל באופן רציף ולהתחיל טיפול בסטרואידים במינון מוגבר (טבלה 4). בחולים המגיבים לטיפול מתבצעת גמילה מסטרואידים תוך מעקב הדוק אחר המצב הקליני ורמת הטרופונין בדם. תרופות קו שני (מדכאות חיסון או steroid sparing) ניתנות כאשר התגובה הראשונית לסטרואידים אינה מספקת או כאשר לא ניתן לרדת במינון הסטרואידים[25]. מומלץ שההחלטה על חידוש והמשך טיפול ב-ICI תתקבל לאחר דיון משותף בין קרדיולוגים לאונקולוגים[25].
מיוקרדיטיס חדה כתוצאה ממחלת הקורונה או לאחר חיסון נגד המחלה
מיוקרדיטיס חריפה מתפתחת לרוב לאחר זיהום ויראלי, כולל זיהום על ידי נגיף הקורונה (2-SARS-CoV (Severe Acute Respiratory Syndrome CoronaVirus 2)) הגורם למחלת הקורונה בשם 19-COVID. אף על פי שמדובר בתופעה נדירה, מיוקרדיטיס יכולה להתפתח גם לאחר חיסונים נגד הקורונה, בעיקר אלה המבוססים על טכנולוגיית mRNA (messenger RiboNucleic Acid) (חיסוני Pfizer ו-Moderna).
על פי עבודות פתולוגיות מיוקרדיטיס היא תופעה יחסית נדירה בחולי 19 COVID[33]. במהלך 19-COVID ייתכן נזק מיוקרדיאלי עם עליה בטרופונין משנית לזיהום הסיסטמי ותגובה דלקתית שמלווה אותו. עליה בטרופונין בחולי 19-COVID קשורה לתמותה מוגברת. לרוב העלייה בטרופונין במהלך 19-COVID איננה ביטוי למיוקרדיטיס במובן הקלאסי ומשקפת פגיעה לשריר הלב משנית לתגובה דלקתית רב מערכתית או במנגנון אחר. בנוסף, ייתכן נזק מיוקרדיאלי ישיר על ידי הווירוס עם הופעת תגובה דלקתית משנית.
האבחון של מיוקרדיטיס מקורונה ובהקשר לחיסון נגד המחלה דומה בעקרון למיוקרדיטיס מסיבות אחרות.
ההיארעות של מיוקרדיטיס הקשורה לחיסון נמוכה עוד יותר ומוערכת ב-0.5-0.3 מקרים לכל 100,000 מחוסנים. מרבית המקרים של מיוקרדיטיס לאחר חיסון לקורונה מתרחשים לאחר החיסון השני ומופיעה בעיקר בקרב גברים צעירים[6][34][35][36]. המחלה היא קלה ברוב המקרים וחולפת אצל יותר מ-90 אחוזים מהחולים לאחר אשפוז קצר. שכיחות זו נמוכה בהרבה וחומרת המחלה קלה יותר לעומת מיוקרדיטיס או פגיעה לבבית (myocardial injury) הקשורים ל-19-COVID.
לצורך אבחון של מיוקרדיטיס משנית לחיסון קורונה, נעשה שימוש בהגדרות קליניות והדמיות כולל MRI מאחר שרוב המכריע של החולים אינם ממלאים קריטריונים לביצוע ביופסיה[6][34][35][36][37]. מומלץ לבצע בירור נרחב כולל ביופסיית לב רק במקרים של מחלה קשה. הטיפול לרוב הוא טיפול תומך. במקרים של מחלה קשה עם שוק קרדיוגני או ירידה קשה בתפקוד הלב וקליניקה של אי ספיקת לב, ניתן לשקול טיפול בסטרואידים (עם או בלי טיפול ב-IVIG), במיוחד במקרים הקשורים לחיסון נגד קורונה או במקרים של מיוקרדיטיס קשה כחלק מתסמונת דלקתית רב-מערכתית (multi systemic inflammatory syndrome) המתפתחת כתוצאה מתגובה דלקתית/אימונולוגית קשה מספר ימים עד שבועות לאחר ההחלמה מ-19-COVID.
לסיכום, הסיכונים לאשפוז ומוות הקשורים למחלת הקורונה גדולים בהרבה מהסיכונים הקשורים לחיסון. יתרה מזו, חיסון נגד קורונה מפחית דרמטית את הסיכון למחלה קשה על סיבוכיה, לרבות הסיכון היחסי למיוקרדיטיס חריפה ולנזק מיוקרדיאלי. לאור העובדה שמיוקרדיטיס המתפתחת לאחר חיסון היא תופעה נדירה וקלה יחסית, מומלץ לחסן כנגד קורונה את כלל האוכלוסייה הן המבוגרים והן הצעירים[36][38].
חזרה לפעילות גופנית לאחר מיוקרדיטיס חריפה
ההמלצה המקובלת היא להימנע מפעילות גופנית בדרגת עצימות בינונית או יותר במהלך השלב החריף של המחלה ובמהלך 3 עד 6 החודשים הראשונים אחריה[1][2][39]. תקופת ההימנעות מפעילות גופנית תיקבע בהתאם לחומרת המיוקרדיטיס, דהיינו שלושה חודשים לאחר מיוקרדיטיס קלה ועד שישה חודשים בכל מיוקרדיטיס אחרת (טבלה 1). לפני חזרה לפעילות ספורטיבית מלאה מומלץ לבצע בדיקת מדדי דלקת, אקו-לב, ארגומטריה והולטר אק"ג 24 שעות תוך שימת דגש על חזרת תפקוד חדר שמאל לתחום הנורמה והעדר הפרעות קצב. מבריאים א-תסמיניים בעלי תפקוד לב שמור באקו, מדדי דלקת בגדר נורמה, והעדר הפרעות קצב בהולטר לב ובבדיקת מאמץ מקסימלי יכולים לחזור הדרגתית לפעילות מלאה לאחר תקופות ההחלמה שהוזכרו לעיל[1][2][39]. לפי ההנחיות הבינלאומיות, בספורטאים או במבריאים המתכננים לבצע פעילות גופנית בעצימות גבוהה מומלץ לבצע גם בדיקת טרופונין בנוסף לבדיקות הנזכרים מעלה[39][40]. אולם, לאור הקושי האובייקטיבי בביצוע בדיקה זו במסגרת אמבולטורית במדינת ישראל, אנו ממליצים לשקול את ביצועה כאשר קיים חשד להמשך התהליך הדלקתי ובמקרים המתוארים בפסקה הבאה ובתרשים 4.
במבריאים הסובלים מהמשך תסמינים או במקרים בהם אחת מהבדיקות הנזכרים מעלה אינה תקינה, מומלץ לשקול ביצוע בדיקת טרופונין וחזרה על MRI של הלב. מומלץ לשקול חזרה על MRI גם בספורטאים בהם בבדיקת ה-MRI הראשונה היו סמני סיכון מוגבר לסיבוכים קרדיווסקולרים, כגון LGE נרחב או הממוקם באמצע המחיצה הבין חדרית ו/או עדות לדלקת נרחבת[12][32][39].
ניתן לשקול חזרה לפעילות גופנית בעצימות בינונית עד גבוהה לאחר דיון פרטני בהשתתפות המבריא, כאשר ב-MRI חוזר קיימת האדרה מאוחרת לא נרחבת וללא סמנים אחרים של סיכון קרדיווסקולרי מוגבר כמפוורט לעיל, ובתנאי שהספורטאי א-תסמיני, תפקוד החדר השמאלי שמור באקו, ואין הפרעות קצב[39]. לעומת זאת, בחולים עם ממצאים ב-MRI חוזר של צלקת נרחבת בשריר הלב, במיוחד כאשר יש מעורבות משמעותית של הספטום האמצעי ו/או דלקת מתמדת, קימת ירידה מתמדת בתפקוד חדר שמאל, או ישנן הפרעות קצב מורכבות, מומלץ להימנע מביצוע מאמץ בגופני בעצימות בינונית או גבוהה (ראו תרשים 4).
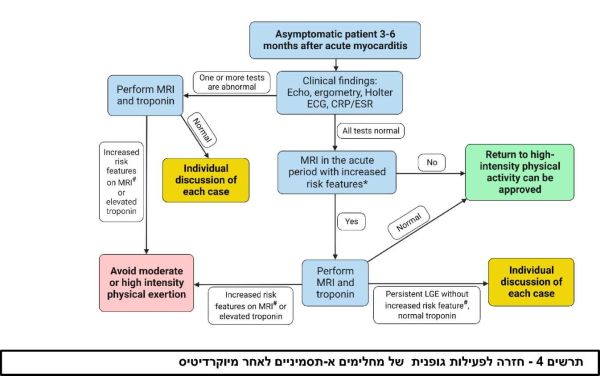
*מאפייני סיכון מוגבר ב- MRI בתקופה החריפה: LGE נרחב או ממוקם ב-אמצע המחיצה הבין חדרית או תהליך דלקתי נרחב
# מאפייני סיכון מוגבר בבדיקת MRI לב חוזרת: LGE נרחב או ממוקם ב-אמצע המחיצה הבין חדרית או התמדה של התהליך הדלקתי
Magnetic Resonance Imaging = MRI
Late Gadolinium Enhancement = LGE
C-Reactive Protein = CRP
במחלימים שסבלו מאי ספיקת לב או ירידה בתפקוד חדר שמאל במהלך המחלה, מומלץ לעודד חזרה הדרגתית לפעילות במסגרת שיקום חולי לב. בנוסף, במחלימים העוסקים בפעילות גופנית אינטנסיבית יש לשקול הדרכה על ידי פיזיולוג מאמץ לגבי אופן החזרה לפעילות גופנית.
ההמלצות לגבי חזרה לפעילות גופנית במבריאים מיוקרדיטיס משנית לזיהום ב 19-COVID או משנית לחיסון mRNA ל-19-COVID דומות להנחיות המפורטות מעלה לגבי חולי מיוקרדיטיס מסיבות אחרות, ותלויות בחומרת התסמינים הלבביים-ריאתיים[40]. במבריאים מ-19-COVID ללא אבחנה של מיוקרדיטיס אך עם תסמינים לבביים-ריאתיים קלים, יש להימנע מביצוע מאמץ גופני כל עוד התסמינים נמשכים, ואין צורך בביצוע בירור קרדיאלי נוסף. בחולים עם מחלת COVID קשה ו/או בחולים עם תסמינים לבביים-ריאתיים, או במקרים של עלייה בטרופונין ללא אבחנה של מיוקרדיטיס, מומלץ לבצע אק"ג ואקו לב ולהפנות את החולה להערכת קרדיולוג ובמידת הצורך רופא ריאות ופיזיולוג מאמץ[40].
נקודות מפתח
- המסמך מסכם את ההגדרות העדכניות של מיוקרדיטיס חריפה, ואת הגישה לאבחון וטיפול במחלה. הוא מציע גישה מעשית ומפורטת, המותאמת למאפיינים הייחודיים של מערכת הבריאות הישראלית, כולל הטיפול במהלך האשפוז ולאחר השחרור מבית החולים
- במרבית המקרים, ניתן לאבחן מיוקרדיטיס חריפה על ידי שילוב של ההתייצגות הקלינית, ממצאי המעבדה (בעיקר על ידי טרופונין בעל רגישות גבוהה) ובדיקות הדמיה (אקו לב 1-MRI של הלב). במיעוט המקרים, יש צורך בביצוע ביופסיה אנדומיוקרדיאלית לצורך אישור האבחנה, אפיון האתיולוגיה וקביעת הטיפול
- במיוקרדיטיס פולמיננטית, כולל בחולים הסובלים מהפרעות קצב מסכנות חיים או מהפרעות הולכה בדרגה גבוהה, או במקרים בהם יש חשד לאתיולוגיה אימונולוגית, ניתן להתחיל טיפול בסטרואידים במתן תוך ורידי לפני ביצוע הביופסיה, או לפני קבלת תשובות הביופסיה. יש לשקול המשך הטיפול האימונוסופרסיבי בהתאם לתוצאות הביופסיה ובהתאם לתגובה הראשונית לטיפול בסטרואידים
- מומלץ להפנות חולי מיוקרדיטיס הסובלים ממחלה קשה למרכז רפואי שלישוני בו ניתן לבצע ביופסיה אנדומיוקרדיאלית ולטפל בהתקנים לבביים מכניים מתקדמים
- יש לשקול אטיולוגיה גנטית ואימונית, במיוחד בחולים עם דלקת חוזרת בשריר הלב. חשד לרקע גנטי עולה בנוכחות סיפור משפחתי של דלקת שריר הלב, קרדיומיופתיה מורחבת, או מוות לבבי פתאומי בגיל צעיר
נייר העמדה פורסם גם ב-IMAJ[41][42]
מחברי המסמך
מחברים:
- פרופ' אנדרי קרן - מרכז הלב, המרכז הרפואי הדסה והאוניברסיטה העברית, ירושלים והמערך לאי ספיקת לב, שרותי בריאות כללית, מחוז ירושלים
- פרופ' רביע עאסלה - מרכז הלב, המרכז הרפואי הדסה והאוניברסיטה העברית, ירושלים והמערך לאי ספיקת לב, שרותי בריאות כללית, מחוז ירושלים
- פרופ' עידו י. בירתי - המערך הקרדיווסקולרי ע"ש דוידאי-קיטנר, המרכז הרפואי צפון והפקולטה לרפואה ע"ש עזריאלי, אוניברסיטת בר-אילן
- ד"ר טוביה בן גל - המערך הקרדיולוגי, המרכז הרפואי רבין, פתח תקווה ובית הספר לרפואה, אוניברסיטת תל אביב
- פרופ' מיכאל ארד - המכון לאי ספיקת לב, מרכז הלב על שם לבייב, המרכז הרפואי שיבא, תל השומר ובית הספר לרפואה, אוניברסיטת תל אביב
המחברים מודים לסוקרי המסמך על הערותיהם
- ד"ר ירון אביב, קרדיולוג מומחה בכיר, המערך הקרדיולוגי, מרכז רפואי רבין
- פרופ' עופר אמיר, הנשיא של האיגוד הקרדיולוגי
- פרופ' רואי בייגל, יו"ר של החוג לטיפול נמרץ לב
- פרופ' סורל גולנד, יו"ר החוג למחלות שריר הלב והפריקרד
- ד"ר אבישי גרופר, יו"ר החוג לאי ספיקת לב
- ד"ר אריק וולק, המזכ"ל של האיגוד הקרדיולוגי
- פרופ' דורון זגר, נשיא לשעבר של האיגוד הקרדיולוגי
- פרופ' מוטי חיים, יו"ר החוג לקיצוב ואלקטרופיזיולוגיה
- פרופ' זאזא יקובישבילי, יו"ר החוג של קרדיולוגיה בקהילה
- ד"ר שירית כזום, יו"ר הפורום לרפואת ספורט של האיגוד הקרדיולוגי
- ד"ר מיכל לאופר, מזכ"ל החוג למחלות שריר הלב והפריקרד
- פרופ' יהונתן לסיק, יו"ר החוג לקרדיולוגיה גרעינית ו-סי.טי של הלב
- פרופ' דרור מבורך, המכון לאימונולוגיה, לראומטולוגיה ולאלרגולוגיה, המרכז הרפאוי הדסה עין כרם
- ד"ר ענת מילמן, יו"ר הפורום לרפואת ספורט של האיגוד הקרדיולוגי
- פרופ' שמואל פוקס, מנהל המערך הקרדיולוגי, מרכז הרפואי שמיר
תפקידי הסוקרים המוזכרים לעיל היו בתוקף במועד כתיבת המסמך.
אנו מודים לגב' קארן דודזון על הסיוע הארגוני-אדמיניסטרטיבי.
ביבליוגרפיה
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 Caforio AL, Pankuweit S, Arbustini E, Basso C, Gimeno-Blanes J, Felix SB, Fu M, Helio T, Heymans S, Jahns R, Klingel K, Linhart A, Maisch B, McKenna W, Mogensen J, Pinto YM, Ristic A, Schultheiss HP, Seggewiss H, Tavazzi L, Thiene G, Yilmaz A, Charron P, Elliott PM; European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013 Sep;34(33):2636-48, 2648a-2648d.
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 Bozkurt B, Colvin M, Cook J, Cooper LT, Deswal A, Fonarow GC, Francis GS, Lenihan D, Lewis EF, McNamara DM, et al; American Heart Association Committee on Heart Failure and Transplantation of the Council on Clinical Cardiology; Council on Cardiovascular Disease in the Young; Council on Cardiovascular and Stroke Nursing; Council on Epidemiology and Prevention; and Council on Quality of Care and Outcomes Research. Current diagnostic and treatment strategies for specific dilated cardiomyopathies: a scientific statement from the American Heart Association. Circulation. 2016;134:e579-e646. doi: 10.1161/CIR.0000000000000455.
- ↑ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss H-P, Tschope C, Cooper LT, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020;13:e007405.
- ↑ 4.0 4.1 . Tschope C, Cooper LT, Torre-Amione G, Van Linthout S. Management of Myocarditis-Related Cardiomyopathy in Adults. Circulation Research 2019;124:1568-1583.
- ↑ 5.0 5.1 5.2 Law YM, Lal AK, Chen S, Cihakova D, Cooper LT Jr, Deshpande S, Godown J, Grosse-Wortmann L, Robinson JD, Towbin JA; Diagnosis and Management of Myocarditis in Children: A Scientific Statement From the American Heart Association. American Heart Association Pediatric Heart Failure and Transplantation Committee of the Council on Lifelong Congenital Heart Disease and Heart Health in the Young and Stroke Council. Circulation. 2021 Aug 10;144(6):e123-e135. doi: 10.1161/CIR.0000000000001001.
- ↑ 6.0 6.1 6.2 Truong DT, Dionne A, Muniz JC, McHugh KE, Portman MA, Lambert LM, Thacker D, Elias MD, Li JS, Toro-Salazar OH, Anderson BR, Atz AM, Bohun CM, Campbell MJ, Chrisant M, D'Addese L, Dummer KB, Forsha D, Frank LH, Frosch OH, Gelehrter SK, Giglia TM, Hebson C, Jain SS, Johnston P, Krishnan A, Lombardi KC, McCrindle BW, Mitchell EC, Miyata K, Mizzi T, Parker RM, Patel JK, Ronai C, Sabati AA, Schauer J, Sexson Tejtel SK, Shea JR, Shekerdemian LS, Srivastava S, Votava-Smith JK, White S, Newburger JW. Clinically Suspected Myocarditis Temporally Related to COVID-19 Vaccination in Adolescents and Young Adults: Suspected Myocarditis After COVID-19 Vaccination. Circulation. 2022;145(5):345-356.
- ↑ 7.0 7.1 Brambatti M, Matassini MV, Adler ED, Klingel K, Camici PG, Ammirati E. Eosinophilic Myocarditis: Characteristics, Treatment, and Outcomes. J Am Coll Cardiol. 2017;70:2363-2375. doi: 10.1016/j.jacc.2017.09.023.
- ↑ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 Basso C. Myocarditis. N Engl J Med. 2022 Oct 20;387(16):1488-1500. doi: 10.1056/NEJMra2114478
- ↑ 9.0 9.1 Ferreira VM, Schulz-Menger J, Holmvang G, Kramer CM, Carbone I, Sechtem U, Kindermann I, Gutberlet M, Cooper LT, Liu P, Friedrich MG. Cardiovascular magnetic resonance in nonischemic myocardial inflammation: expert recommendaions. J Am Coll Cardiol 2018;72(24):3158-3176.
- ↑ Francone M, Chimenti C, Galea N, Scopelliti F, Verardo R, Galea R, Carbone I, Catalano C, Fedele F, Frustaci A. CMR sensitivity varies with clinical presentation and extent of cell necrosis in biopsy-proven acute myocarditis. JACC Cardiovasc Imaging. 2014 Mar;7(3):254-63. doi: 10.1016/j.jcmg.2013.10.011
- ↑ 11.0 11.1 Lintingre PF, Nivet H, Clement-Guinaudeau S, Camaioni C, Sridi S, Corneloup O, Gerbaud E, Coste P, Dournes G, Latrabe V, Laurent F, Montaudon M, Cochet H. High-Resolution Late Gadolinium Enhancement Magnetic Resonance for the Diagnosis of Myocardial Infarction With Nonobstructed Coronary Arteries. JACC Cardiovasc Imaging. 2020;13(5):1135-1148.
- ↑ 12.0 12.1 12.2 12.3 12.4 Aquaro GD, Ghebru Habtemicael Y, Camastra G, et al. Prognostic value of repeating cardiac magnetic resonance in patients with acute myocarditis. J Am Coll Cardiol 2019; 74: 2439-48.
- ↑ 13.0 13.1 13.2 13.3 13.4 McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, Burri H, Butler J, Celutkiene J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022 Jan;24(1):4-131. doi: 10.1002/ejhf.2333. PMID: 35083827.
- ↑ Keren A, Caforio ALP, Acute Myocarditis in Bueno H, Chief Editor, Clinical Decision-Making Toolkit, Acute Cardiivascular Care Association of the ESC, 2018, Chapter8, pp 112-116
- ↑ 15.0 15.1 Cooper LT, Baughman KL, Feldman AM, Frustaci A, Jessup M, Kuhl U, Levine GN, Narula J, Starling RC, Towbin J, Virmani R, American Heart Association, American College of Cardiology, European Society of Cardiology. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Circulation. 2007;116:2216-33.
- ↑ 16.0 16.1 16.2 Seferovic PM, Tsutsui H, McNamara DM, Ristic AD, Basso C, Bozkurt B, Cooper LT, Filippatos G, Ide T, Inomata T, Klingel K, Linhart A, Lyon AR, Mehra MR, Polovina M, Milinkovic I, Nakamura K, Anker SD, Veljic I, Ohtani T, Okumura T, Thum T, Tschope C, Rosano G, Coats AJS, Starling RC. Heart Failure Association of the ESC, Heart Failure Society of America and Japanese Heart Failure Society Position statement on endomyocardial biopsy. Eur J Heart Fail. 2021;23:854-871.
- ↑ 17.0 17.1 Kociol RD, Cooper LT, Fang JC, Moslehi JJ, Pang PS, Sabe MA, Shah RV, Sims DB, Thiene G, Vardeny O; American Heart Association Heart Failure and transplantation Committee of the Council on Clinical Cardiology. Recognition and initial management of fulminant myocarditis: a scientific statement From the American Heart Association. Circulation. 2020;141:e69-e92.
- ↑ 18.0 18.1 18.2 Frustaci A, Russo MA, Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur Heart J. 2009;30:1995-2002.
- ↑ Bock CT, Klingel K, Kandolf R. Human parvovirus B19-associated myocarditis. N Engl J Med. 2010 Apr 1;362(13):1248-9.
- ↑ 20.0 20.1 Elsanhoury A, Kuhl U, Stautner B, Klein O, Krannich A, Morris D, Willner M, Jankowska E, Klingel K, Van Linthout S, Tschope C . The spontaneous course of human herpesvirus 6 DNA-associated myocarditis and the effect of immunosuppressive intervention. Viruses 2022; 14: 299.
- ↑ 21.0 21.1 21.2 Chimenti C, Russo MA, Frustachi A. Immunosuppressive therapy in virus-negative inflammatory cardiomyopathy: 20-year follow-up of the TIMIC trial. Eur Heart J 2022;43:3463-3473
- ↑ 22.0 22.1 עם סימני דלקת ללא נוכחות וירוס ברקמת המיוקרד
- ↑ Bang V, Ganatra S, Shah SP, Dani SS, Neilan TG, Thavendiranathan P, Resnic FS, Piemonte TC, Barac A, Patel R, Sharma A, Parikh R, Chaudhry GM, Vesely M, Hayek SS, Leja M, Venesy D, Patten R, Lenihan D, Nohria A, Cooper LT. Management of Patients With Giant Cell Myocarditis: JACC Review Topic of the Week. J Am Coll Cardiol. 2021 Mar 2;77(8):1122-1134. doi: 10.1016/j.jacc.2020.11.074
- ↑ Gilotra NA, Griffin JM, Pavlovic N, Houston BA, Chasler J, Goetz C, Chrispin J, Sharp M, Kasper EK, Chen ES, Blankstein R, Cooper LT, Joyce E, Sheikh FH. Sarcoidosis-Related Cardiomyopathy: Current Knowledge, Challenges, and Future Perspectives State-of-the-Art Review. J Card Fail. 2022 Jan;28(1):113-132. doi: 10.1016/j.cardfail.2021.06.016. Epub 2021 Jul 11. PMID: 34260889;
- ↑ 25.0 25.1 25.2 Lyon AR, Lopez-Fernandez T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, Boriani G, Cardinale D, Cordoba R, Cosyns B, Cutter DJ, de Azambuja E, de Boer RA, Dent SF, Farmakis D, Gevaert SA, Gorog DA, Herrmann J, Lenihan D, Moslehi J, Moura B, Salinger SS, Stephens R, Suter TM, Szmit S, Tamargo J, Thavendiranathan P, Tocchetti CG, van der Meer P, van der Pal HJH; ESC Scientific Document Group, Lancellotti P, Thuny F, Abdelhamid M, Aboyans V, Aleman B, Alexandre J, Barac A, Borger MA, Casado- Arroyo R, Cautela J, Celutkiene J, Cikes M, Cohen-Solal A, Dhiman K, Ederhy S, Edvardsen T, Fauchier L, Fradley M, Grapsa J, Halvorsen S, Heuser M, Humbert M, Jaarsma T, Kahan T, Konradi A, Koskinas KC, Kotecha D, Ky B, Landmesser U, Lewis BS, Linhart A, Lip GYH, L0chen ML, Malaczynska-Rajpold K, Metra M, Mindham R, Moonen M, Neilan TG, Nielsen JC, Petronio AS, Prescott E, Rakisheva A, Salem JE, Savarese G, Sitges M, Ten Berg J, Touyz RM, Tycinska A, Wilhelm M, Zamorano JL. 2022 ESC Guidelines on cardio-oncology developed in collaboration withthe European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022 Nov 1 ;43(41 ):4229-4361
- ↑ 26.0 26.1 26.2 Lehmann LH, Cautela J, Palaskas N, Baik AH, Meijers WC, Allenbach Y, Alexandre J, Rassaf T, Muller OJ, Aras M, Asnani AH, Deswal A, Laufer-Perl M, Thuny F, Kerneis M, Hayek SS, Ederhy S, Salem JE, Moslehi JJ. Clinical Strategy for the Diagnosis and Treatment of Immune Checkpoint Inhibitor-Associated Myocarditis: A Narrative Review. JAMA Cardiol. 2021 Nov 1;6(11 ):1329-1337.
- ↑ Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al.; 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022 Aug 26:ehac262. doi: 10.1093/eurheartj/ehac262.
- ↑ Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, Deswal A, Drazner MH, Dunlay SM, Evers LR, Fang JC, Fedson SE, Fonarow GC, Hayek SS, Hernandez AF, Khazanie P, Kittleson MM, Lee CS, Link MS, Milano CA, Nnacheta LC, Sandhu AT, Stevenson LW, Vardeny O, Vest AR, Yancy CW. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022 May 3;145(18):e895-e1032.
- ↑ 29.0 29.1 29.2 העברה למרכז שלישוני עם יכולת לבצע ביופסיה אנדומיוקרדיאלית ולספק תמיכה קרדיווסקולרית מכאנית מתקדמת
- ↑ IV מתילפרדניזולון 7–14 מג'/קג' 3 X ימים, בהמשך (לפי תגובה קלינית ו/או תוצאת ביופסיה) ניתן להפסיק או לרדת ל- 1 מג'/קג' ליום עם גמילה כמקובל.
- ↑ קו ראשון בילדים וקו שני במבוגרים.
- ↑ 32.0 32.1 32.2 Ammirati E, Raimondi F, Piriou N, et al. Acute myocarditis associated with desmosomal gene variants. JACC: Heart Failure 2022;10:714-727
- ↑ 29. Kawakami R, Sakamoto A, Kawai K, Gianatti A, Pellegrini D, Nasr A, Kutys B, Guo L, Cornelissen A, Mori M, Sato Y, Pescetelli 1, Brivio M, Romero M, Guagliumi G, Virmani R, Finn AV. Pathological Evidence for SARS-CoV-2 as a Cause of Myocarditis: JACC Review Topic of the Week. J Am Coll Cardiol. 2021 Jan 26;77(3):314-325. doi: 10.1016/j.jacc.2020.11.031. PMID: 33478655; PMCID: PMC7816957.
- ↑ 34.0 34.1 Witberg G, Barda N, Hoss S, Richter I, Wiessman M, Aviv Y, Grinberg T, Auster O, Dagan N, Balicer RD, Kornowski R. Myocarditis after Covid-19 Vaccination in a Large Health Care Organization. N Engl J Med. 2021;385:2132-2139.
- ↑ 35.0 35.1 Mevorach D, Anis E, Cedar N, Bromberg M, Haas EJ, Nadir E, Olsha-Castell S, Arad D, Hasin T, Levi N, Asleh R, Amir O, Meir K, Cohen D, Dichtiar R, Novick D, Hershkovitz Y, Dagan R, Leitersdorf I, Ben-Ami R, Miskin I, Saliba W, Muhsen K, Levi Y, Green MS, Keinan-Boker L, Alroy-Preis S. Myocarditis after BNT162b2 mRNA Vaccine against Covid-19 in Israel. N Engl J Med. 2021;385:2140- 2149.
- ↑ 36.0 36.1 36.2 Bozkurt B, Kamat I, Hotez PJ. Myocarditis With COVID-19 mRNA Vaccines. Circulation. 2021;144:471-484.
- ↑ Sexson Tejtel SKa*, Munoz FM, Al-Ammouri I , Savorgnand F, Guggilla RK, Khuri-Bulos N, Phillips L, Engler RJM, On behalf of Brighton Collaboration. Myocarditis and pericarditis: case definition and guidelines for data collection, analysis, and presentation 1 of immunization safety data. https://brightoncollaboration.us/myocarditis-case-definition-update/.
- ↑ 34. Barda N, Dagan N, Ben-Shlomo Y, Kepten E, Waxman J, Ohana R, Hernan MA, Lipsitch M, Kohane I, Netzer D, Reis BY, Balicer RD. Safety of the BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting. N Engl J Med. 2021 Sep 16;385(12):1078-1090.
- ↑ 39.0 39.1 39.2 39.3 39.4 Pelliccia A, Sharma S, Gati S, Back M, Borjesson M, Caselli S, Collet JP, Corrado D, Drezner JA, Halle M, Hansen D, Heidbuchel H, Myers J, Niebauer J, Papadakis M, Piepoli MF, Prescott E, Roos-Hesselink JW, Graham Stuart A, Taylor RS, Thompson PD, Tiberi M, Vanhees L, Wilhelm M; ESC Scientific Document Group 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. .Eur Heart J. 2021 Jan 1;42(1):17-96.
- ↑ 40.0 40.1 40.2 Gluckman TJ, Bhave NM, Allen LA, Chung EH, Spatz ES, Ammirati E, Baggish AL, Bozkurt B, Cornwell WK 3rd, Harmon KG, Kim JH, Lala A, Levine BD, Martinez MW, Onuma O, Phelan D, Puntmann VO, Rajpal S, Taub PR, Verma AK. 2022 ACC Expert
- ↑ Keren A, Asleh R, Birati EY, Ben Gal T, Arad M. Definition and diagnosis of acute myocarditis: a position statement of the Israel Heart Society. IMAJ 2023; 25 (8): 519-24.
- ↑ Keren A, Asleh R, Birati EY, Ben Gal T, Arad M. Management of acute myocarditis and posthospitalization follow-up: a position statement of the Israel Heart Society. IMAJ 2023; 25 (8): 525-32.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק