הבדלים בין גרסאות בדף "גנים מאוחים של משפחת NTRK וחלבוני TRK במחלת הסרטן - יעדים לטיפול מכוון מטרה - NTRK gene fusions and TRK proteins in cancer - targets for cancer therapy"
מ (יישור לשמאל) |
|||
| (34 גרסאות ביניים של 4 משתמשים אינן מוצגות) | |||
| שורה 8: | שורה 8: | ||
|ICD-9= | |ICD-9= | ||
|MeSH= | |MeSH= | ||
| − | |יוצר הערך=ד"ר צחי הרץ | + | |יוצר הערך= ד"ר צחי הרץ, פרופ' ניר פלד. עורך הערך: פרופ' ניר פלד |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
{{הרחבה|ערכים=[[גנטיקה]], [[סרטן]]}} | {{הרחבה|ערכים=[[גנטיקה]], [[סרטן]]}} | ||
| + | ==הקדמה== | ||
| + | התהוותם של תאי [[סרטן]] היא תהליך רב גורמי ורב שלבי אשר תחילתו בתא בריא אשר עובר רצף שינויים גנטיים (Genetic) לאורך חודשים ושנים. שינויים מסוג זה מתרחשים בגופנו אלפי פעמים ביום, אך מאותרים באופן שוטף ומתוקנים בצורה יעילה. בנוכחות יכולת בקרה תקינה, מסולק התא הפגום באמצעות הטייתו למנגנוני הרג עצמי או אף לפיצוץ ישיר של תאים פגומים על ידי מנגנוני בקרה התערבותיים. | ||
| − | + | השינויים הגנטיים מתרחשים בגן (Gene) אחד, בשניים או אף בגנים מרובים. לעיתים, שינוי גנטי אחד מוביל לשני שמוביל לשלישי וכך הלאה, בעוד זה האחרון הוא זה אשר אחראי להיעדר יכולת בקרה תאית (תא סרטני) בעוד השינוי הראשוני כבר אינו רלוונטי לתוצר הגידולי הקונקרטי הסופי ולכן אינו יעד לטיפול אנטי-סרטני התערבותי. | |
| − | |||
| − | + | שינויים גנומיים (Genomic) אלו יכולים להתרחש ברמת המטען הגנטי הבסיסי (DeoxyriboNucleic Acid ,[[DNA]]) או ברמת הוויסות הגנומי (DNA Methylation) או ברמת המטען הגנומי המוביל לייצור חלבוני (Ribonucleic acid ,[[RNA]]). אנו למדים כי שינויים נוספים ייתכנו באופן עיבוד ה-RNA. | |
| − | התקדמות באיתור של איחויי ''NTRKs'' ופיתוח טיפולים מכווני מטרה, לעיכוב | + | תקלות גנומיות מתחלקות למספר קבוצות: |
| + | *שינויים נקודתיים [מוטציות (Mutations) נקודתיות] - החלפת אבן יסוד אחת בשנייה [החלפת נוקלאוטידים (Nucleotides)] המובילה לשינוי תפקודי | ||
| + | *שינויי חסר – חסר של נוקלאוטיד אחד או רצף נוקלאוטידים מתוך המטען הגנומי. חסר זה גורם להפרעה תפקודית | ||
| + | *תוספות של נוקלאוטידים לרצף גנומי (Insertion) | ||
| + | *איחויים בהם מוחלף מקטע גנומי אחד במקטע כלשהו מגן אחר. כלומר היווצרות רצף גנומי חדש שהוא איחוי של של שני מקטעי גנים נפרדים. במקרים אלו, מופעל הגן המאוחה בצורה שאינה תקינה אשר גורמת להתהוות סרטנית | ||
| + | |||
| + | איתורם של הגנים מאוחים, Fusion, המכונים גם טרנסלוקציות (Translocations), הפך לאחראי לחלק משמעותי בהיווצרות הגידולית ובפרק זה נעסוק בסוג מסוים של איחוי של גן ''NTRK''{{כ}} (Neurotrophic Tropomyosin Receptor Kinase). | ||
| + | |||
| + | איחויי ''NTRKs'' ספציפיים זוהו במגוון של גידולים, עם הימצאות גבוהה בסוגי סרטן נדירים מסוימים, בילדים ובמבוגרים, ועם הימצאות נמוכה ברוב סוגי הסרטן הנפוצים. איחויי ''NTRKs'' יכולים להוות מניעים של התקדמות סרטן ולכן תוצריהם האונקוגניים (Oncogenic) מהווים מטרה לטיפול תרופתי. התקדמות באיתור של איחויי ''NTRKs'' ופיתוח טיפולים מכווני מטרה, לעיכוב TRK, משנים את הנוף האבחנתי והתרפויטי (Therapeutic) של הטיפול בסוגי סרטן אלה. | ||
==גנים מאוחים - Fusion Genes== | ==גנים מאוחים - Fusion Genes== | ||
| − | גנים מאוחים | + | גנים מאוחים הם שני מקטעים של גנים שונים המתחברים ביחד והופכים להיות רצף גנומי אחד. שני המקטעים מתחברים זה לזה בצורות שונות, הכוללות בעיקר חיבור באותו הכיוון או חיבור הפוך (כיוונים שונים). לעיתים מתקיימת תקלה נוספת בחלק המאוחה כדוגמת שינוי חסר או תוספת (Insertion) של נוקלאוטידים הגורמת גם כן לפגיעה תפקודית של החלבון הסופי. |
| + | |||
| + | האיחוי הגנומי מוביל ליצירת חלבון שלא לצורך או ליצירת חלבון פגום או אף להשתקה של חלבון. בהתאם לכך, מאובחן האיחוי באמצעות צביעה של החלבון הספציפי או איתור החלבון הפגום או איתור של מקטעי הגנום המתחברים זה לזה. התקדמות הטכנולוגיה לריצוף גנומי מאפשר איתורם של איחויים אלו ברמת רגישות גבוהה במיוחד ופותחת אפשרויות טיפול נקודתיות. | ||
| + | |||
| + | ההימצאות של גנים מאוחים משתנה באופן נרחב, על פני סוגי סרטן שונים. גנים מאוחים רבים ספציפיים לתתי-סוגים של סרטן. בהתאם לכך, זיהוי מהיר ומדויק של גנים מאוחים יכול להוביל התערבות טיפולית המתמקדת בעצירת התפקוד של החלבון אשר מבוטא שלא לצורך או מבוטא בצורתו הפגומה. | ||
| + | |||
| + | ==משפחת הגנים של ''NTRK''{{כ}}== | ||
| + | משפחת הגנים ''NTRK'' מורכבת מ-3 גנים (''NTRK2'', ''NTRK1'' ו-''NTRK3'') המתבטאים בעיקר במערכת העצבים המרכזית והפריפרית (Peripheral) אך יכולים להופיע גם במערכות אחרות בגוף. איחויים של הגן ''NTRK'' מופיעים בטווח רחב של מחלות סרטן וחסימתו הובילה למספר טיפולים פורצי דרך אשר אושרו על ידי ה-FDA{{כ}} (Food and Drug Administration) כדוגמת [[T:Larotrecitinib|Larotrecitinib]], {{כ}}[[T:Entrectinib|Entrectinib]] ותרופות נוספות המצויות בפיתוח כדוגמת [[T:Altiratinib|Altiratinib]] ו- [[T:Sitravatinib|Sitravatinib]] | ||
| + | {{הערה| https://esmoopen.bmj.com/content/esmoopen/1/2/e000023.full.pdf}}. | ||
| + | |||
| + | חלבוני ה-TRK{{כ}} (Tropomyosin Receptor Kinase) מעניינים במיוחד בשל היכולת להתערבות טיפולית מאוד סלקטיבית (Selective) וטווח מאוד רחב של מחלות סרטן, כגון [[סרטן המעי הגס]], ממאירות פפילרית של בלוטות התריס (PTC, {{כ}}[[סרטן פפילרי של בלוטת התריס - Papillary thyroid cancer|Papillary Thyroid Cancer]]), [[סרטן הריאה]], [[סרטן שד]] מפריש, [[סרקומה|סרקומות]] (Sarcomas), [[סרטן מוח]] (Glioblastoma){{כ}}{{הערה|Amatu A, SartoreBianchi A, Siena S. NTRK gene fusions as novel targets of cancer therapy across multiple tumour types. ESMO Open 2016;1:e000023. doi:10.1136/esmoopen-2015- 000023}}. | ||
| + | |||
| + | מנגנון הפעולה של משפחת ה-TRK מסוכם בתרשים הבא{{הערה|Amatu A, et al. ESMO Open 2016;1:e000023. doi:10.1136/esmoopen-2015-000023}}: | ||
| − | + | [[קובץ:TRK 1.png|מרכז|600 פיקסלים]] | |
| − | + | [[קובץ:TRK 2.png|מרכז|600 פיקסלים]] | |
| − | + | ==מערכת ה-TRK == | |
| + | ===מבנה חלבוני ה-TRK=== | ||
| + | חלבוני TRK הם ממשפחת קולטנים ממרבנליים (Membrane, קרום התא) הבנויים מאתר תוך-תאי עם פעילות Kinase תלוית-Thyrosine, הקשורה דרך מבנה חוצה קרום לאתר חוץ תאי, המורכב משני קולטנים שונים. | ||
| − | + | ===נוירוטרופינים (Neurotrophins) - החלבונים הנקשרים לקולטני TRK === | |
| + | קולטני TRK מופעלים על ידי משפחה של 4 חלבונים הנקראים נוירוטרופינים. הנויטרופינים ממלאים תפקידים רבים בהתפתחות ובתפקוד של מערכת העצבים. לכל אחד מהנוירוטרופינים יש ספציפיות ל-TRK מסוים והוא נקשר אליו באפיניות גבוהה. | ||
| − | == | + | ===מסלול העברת ה-Signal של TRKs=== |
| − | + | המסלול התקין של העברת ה-Signal של TRK מתחיל כאשר קשירה של נוירוטרופין לקולטני TRK על פני התא, גורמת להיצמדות של שני קולטנים. צימוד זה מוביל להפעלה עצמית של הקולטן כלפי מטה והזנת מסלול תאי פנימי. | |
| − | ==קולטני TRK | + | ===מיקום ופיזיולוגיה של קולטני TRK === |
| − | קולטני TRK | + | קולטני TRK מתבטאים בעיקר ברקמה העיצבית וממלאים תפקיד חיוני במהלך התפתחות עוברית, כמו גם בתפקוד התקין של מערכת העצבים. השפעול של קולטני TRK על ידי נוירוטרופינים היא בעלת השפעה על מגוון של אירועים עיצביים, כמו התמיינות ושרידות של תאי עצב, שגשוג תאי, וחיזוק הרשת הנוירוגנית (Neurogenic). |
| − | + | מערכת זו קשורה לתהליך הזיכרון, כאב והתמצאות. פגיעה במערכת זו מובילה להפרעות בתחושת [[כאב]], זיכרון, שינוי בהרגלי אכילה, הפרעות למידה ולעיתים מובילה להתמיינות סרטנית. | |
| − | + | ==גנים מאוחים של משפחת ''NTRK'' והופעה סרטנית== | |
| + | איחויים הקשורים ל- ''NTRKs'' ניצפו לראשונה בחולה עם [[סרטן של המעי הגס והחלחולת]] (ColoRectal Cancer ,CRC), בשנת 1986. תת-הסוג שזוהה היה ''NTRK1'' באיחוי עם חלבון 3TPM. בהמשך לממצא זה, זוהו איחויים אחרים ונכון למועד כתיבת מאמר זה מזוהים יותר מ-80 תתי סוגים של איחויי ''NTRK'' הקשורים למחלת הסרטן. | ||
| − | == | + | ==איחויי ''NTRKs'' במחלות סרטן== |
| − | + | איחויי ''NTRKs'' זוהו בסרטנים שונים ובשכיחות שונה במחלות השונות. מחד, שכיחות איחויים אלו היא נמוכה בסרטנים שכיחים כגון סרטן הריאה והשד, בעוד במחלות אחרות, נדירות יותר, כגון סרטן התריס הפפילרי וגידולי מוח, שכיחות איחויים אלו גבוהה במיוחד. | |
| − | + | באופן כללי, שכיחות איחויי ''NTRKs'' עומדת על אחוז אחד מכלל הגידולים המוצקים. | |
| − | + | ===מחלות סרטן נדירות=== | |
| + | פיברוסרקומה של תינוקות ([[Infantile Fbrosarcoma]] ,IFS) מייצגת פחות מאחוז אחד מכלל מחלות הסרטן בילדים, אך היא הסרקומה של רקמות רכות [שאינה רבדומיוסרקומה ([[Rhabdomyosarcoma]]), הנפוצה ביותר בילדים מתחת לגיל שנה. מחלה זו זהה היסטולוגית (Histologically) לנפרומה מזובלסטית מולדת (CMN, {{כ}}[[Congenital Mesoblastic Nephroma]]), גידול מסוג תאי ציר (Spindle) של הכליה, אשר קורה באותה קבוצת גיל ומייצג כ-5 אחוזים מכלל מחלות הסרטן של הכליה בילדות. בשנת 1998 נמצא כי האיחוי ETV6-NTRK3 מופיע בכ-70 אחוזים מהמקרים של IFS. מציאת איחוי זה בוריאנט (Variant) תאי של CMN, אישר קשר גנטי בין IFS ל-CMN. זיהוי של הטרנסלוקציה ETV6-NTRK3 הפך לסמן אבחנתי בעל ערך עבור IFS/CMN. | ||
| − | + | ETV6-NTRK3 נתגלה מאוחר יותר בשתי מחלות נדירות נוספות, בקרצינומה מפרישה של השד (SBC, {{כ}}[[Secretory breast carcinoma|Secretory Breast Carcinoma]]) המהווה כ-0.15 אחוז מכלל סרטני השד ובקרצינומה מפרישה של בלוטות הרוק (MASC, {{כ}}[[Mammary Analogue Secretory Carcinoma]]) . מקרה ייחודי של סרטן שד מפריש דווח בישראל עם תגובה יוצאת דופן לתרופת ה Larotrectinib{{כ}}{{הערה| Landman Y, Ilouze M, Wein S, Neiman V, Yerushalmi R, Yakimov M, Ku N, Schrock AB, Ali S, Peled N. Rapid Response to Larotrectinib (LOXO-101) in an Adult Chemotherapy-Naive Patients With Advanced Triple-Negative Secretory Breast Cancer Expressing ETV6-NTRK3 Fusion. Clin Breast Cancer. 2018 Jun;18(3):e267-e270. doi: 10.1016/j.clbc.2017.11.017. Epub 2017 Nov 28. PMID: 29233640.}}. המדובר על גברת בת 37 אשר אובחנה עם סרטן שד גרורתי תוך כדי היריון. סירבה לטיפולים כימיים והתייצגה עם מחלה נרחבת אשר הגיבה בצורה דרמטית לטיפול פומי ב-Larotrectinib. | |
| − | |||
| − | === | + | === סוגי סרטן נפוצים=== |
| − | + | סרטן פפילרי של בלוטת התריס (PTC) - מהווה כ-80 אחוזים מכלל מקרי סרטן בלוטת התריס. הודגם כי השכיחות של סידור-מחדש של NTRK1 ב-PTC נעה בין פחות מ-5 אחוזים ל-25 אחוזים. נמצאו ב-PTC איחויים של NTRK3, ובעיקר של האיחוי ETV6-NTRK3. אף על פי שההימצאות של ETV6-NTRK3 ב-PTC, במבוגרים נמוכה מאוד (אחוז אחד), זהו הסידור-מחדש הנפוץ ביותר ב-PTC, הקשור ל[[קרינה]]. | |
| − | + | '''סרטן המעי הגס והחלחולת וסרטן התוספתן''' - זוהו איחויי גנים של ''NTRK1'' או ''NTRK3'' עם גנים שותפים שונים, וחלקם אף הגיב לטיפול תרופתי. סקירה של 4290 חולים עם CRC שבחנה איחויי גנים עם ''NTRK1'' בלבד, איתרה איחויים ב-0.07 אחוזים מהמקרים. נכון למועד כתיבת מאמר זה, רק איחויי ''NTRK2'' זוהו במקרים של [[סרטן התוספתן]]. | |
| − | + | '''סרטן ריאות''' - סידורים-מחדש של ''NTRK1'' תוארו לראשונה ב-2013, בחולים עם [[סרטן ריאות]] של תאים לא-קטנים ([[NSCLC]]{{כ}}, Non-Small Cell Luung Carcinoma) המהווה כ-85 אחוזים מכלל מקרי סרטן הריאות. איחויים של ''NTRK2'' ו- ''NTRK3'' דווחו גם כן לגבי NSCLC. באופן כולל, איחויי ''NTRKs'' קורים ב-NSCLC בשכיחות של 0.1 אחוז עד 1.0 אחוז. | |
| − | |||
| − | + | '''סרקומה''' - איחויי NTRKs נדירים יחסית בסרקומה של רקמות רכות. איחויי ''NTRK1'' נמצאו בסרקומות של רקמות רכות עם דפוס גדילה '''שריר/ כלי דם'''. | |
| − | + | '''מחלות סרטן של מערכת העצבים המרכזית''' - איחויי ''NTRKs'' זוהו בגידולים ראשוניים של מערכת העצבים המרכזית (Central Nervous System ,[[CNS]]) בילדים ובמבוגרים, כולל בגליובלסטומה מולטיפורמה ([[גליובלסטומה רב-צורנית - Glioblastoma multiforme|GBM]], {{כ}}Glioblastoma Multiforme) ובגליומות ואסטרוציטומות פדיאטריות (Pediatric Gliomas and [[Astrocytoma]]s). ב-2014 דיווחו Wu et al, על איחויים נשנים הכוללים ''NTRKs'' ב-40 אחוזים (4 מ-10) מהילדים מתחת לגיל 3, עם גליומות בדרגה ממאירות גבוהה, שאינן בגזע המוח [NBS-HGGs{{כ}} (Non-brainstem)]. | |
| − | |||
| − | + | '''מלנומה''' - טרנסלוקציות (Translocations) שונות הכוללות ''NTRK1'' או ''NTRK3'' דווחו לגבי מלנומות (Spheroid [[Melanoma]]s). נמצאה שכיחות של 0.8 אחוזים ו-0.9 אחוזים של מקרים עם איחויים של ''NTRK1'' או ''NTRK2'', במלנומה ראשונית עורית ובמלנומה מוקוזלית/פאראמוקוזלית (Mucosal/Paramucosal), בהתאמה. | |
| − | |||
| − | |||
| − | + | בנוסף לכך, נמצא כי מחלות סרטן המעגנות איחויים של ''NTRKs'', כמו סרטני ריאות ומלנומות נמצאו כבעלי נטייה לגרורות ב-CNS. | |
| − | + | ===סוגי סרטן אחרים=== | |
| + | איחויים של ''NTRKs'' דווחו בכולנגיוקרצינומות אינטרה-הפטיות ([[Intrahepatic cholangiocarcinoma]]), בסרטן שד, בגידולים סטרומליים גסטרואינטסטינליים (Gastrointestinal stromal tumors ,[[GIST tumor|GIST]]), ב[[אדנוקרצינומות של כיס המרה|אדנוקרצינומות (Adenocarcinoma) של כיס המרה]], ב[[סרטן לבלב]], ב[[גידולים נוירואנדוקריניים של המעי הדק|גידולים נוירואנדוקריניים (Neuroendocrine) של המעי הדק]], ועוד. | ||
| − | + | בנוסף לנוכחות בגידולים מוצקים, איחויים של NTRKs אותרו בלוקמיה לימפובלסטית חריפה (ALL{{כ}}, [[Acute lymphoblastic leukemia|Acute Lymphoblastic Leukemia]]) ולוקמיה מיאלואידית חריפה (Acute Myeloid Leukemia ,[[AML]]) בשכיחות של <5 אחוזים. | |
| − | === | + | ==טיפול מכוון מטרה עם מעכבי TRKs במחלות סרטן עם איחויי ''NTRKs'' == |
| − | + | ===מעכבי Tyrosine kinase{{כ}} (TKIs) כמעכבי קולטני TRKs=== | |
| + | עיכוב חלבוני TRK נמצא כיעיל ביותר כטיפול אנטי-סרטני בחולים הנושאים מוטצית איחוי בגן זה. | ||
| − | + | המעכבים הסלקטיבים (Selective) לטיפול באיחוי זה הם Larotrectinib ו- Entrectinib. שתי התרופות מאושרות לשימוש בישראל על בסיס מוטצית איחוי בגן ה ''NTRK''{{כ}}. Larotrectinib{{כ}} ([[T:Vitrakvi|Vitrakvi]]{{כ}}, Bayer ישראל) אשר אושר לשיווק עבור טיפול בכל הגילאים בעוד Entrectinib{{כ}} (Rozlytrek{{כ}}, Roche ישראל) אושר לשיווק עבור טיפול בילדים מגיל 12 שנים ובמבוגרים. | |
| − | ===ניסויים קליניים | + | ===ניסויים פרה-קליניים (Pre-clinical) של Larotrectinib ו-Entrectinib=== |
| − | + | על בסיס ניסויים במבחנה (In-Vitro){{כ}}, Entrectinib ו-Larotrectinib עיכבו את חלבוני ה-TRK בריכוזים ננומולריים (Nanomolar ,nM) נמוכים (IC50 < ~10nM) ונמצאו יעילים ביותר, בעיכוב גדילה של תאי BaF3 שעברו טרנסדוקציה (Transduction) עם איחויי ''NTRKs'' שונים ושל קווי תאים של סרטן ראשוני שעיגנו סידור-מחדש של ''NTRK'', במבחנה ובעכברים. טיפול במודלים של סרטן שהכילו גנים מאוחים של ''NTRKs'', הביאו לעיכוב של מסלולי MAPK, PI3K–AKT, PKC ו-STAT3. | |
| − | + | העיכוב עצמו הוא סלקטיבי ביותר. אתר הקישור של התרופה, לדוגמה Larotrectinib, מוצגת בתרשים הבא: | |
| − | + | [[קובץ:TRK 3.png|מרכז|600 פיקסלים]] | |
| − | שיעור התגובה האובייקטיבית (Objective Response Rate | + | ===ניסויים קליניים של Larotrectinib ו-Entrectinib=== |
| + | Larotrectinib הוא מעכב פומי פוטנטי (Potent) וסלקטיבי של שלושת חלבוני ה-TRK. הפעילות של Larotrectinib בחולים עם גידולים בעלי איחויים של ''NTRKs'' נחקרה ב-3 ניסויים קליניים שכללו חולים פדיאטריים, מתבגרים ומבוגרים. 55 חולים עם גידולים מוצקים נכללו באנליזה (Analysis) הראשונית ו-159 חולים נחקרו במסגרת אנליזה מרוכזת. גידולים של בלוטות הרוק (22 אחוזים), סרקומה של רקמות רכות (20 אחוזים), פיברוסרקומה של תינוקות (IFS) (13 אחוזים) וסרטן של בלוטת התריס (9 אחוזים), היו הגידולים הנפוצים ביותר. שיעור התגובה האובייקטיבית (ORR{{כ}}, Objective Response Rate) היה 80 אחוזים, ושיעור התגובה המלאה (Complete Response ,CR) היה 16 אחוזים. תופעות הלוואי הרציניות הנפוצות ביותר, הקשורות לטיפול, היו עליות ברמות [[אנזימי כבד]] ו[[בחילה]]. | ||
| − | אף על פי שרוב החולים בניסויים קיבלו | + | אף על פי שרוב החולים בניסויים קיבלו Larotrectinib עבור מחלה גרורתית, במספר חולים הייתה מחלה מקומית מתקדמת, למשל 2 ילדים עם IFS של הברך, שחוו הצטמקות משמעותית של הגידולים עם הטיפול, מה שמנע כריתה של הגפיים. מקרים אלה מבליטים את השימוש הפוטנציאלי של עיכוב TRK, כטיפול נאו-אדג'ובנטי עבור חולים עם איחויים של ''NTRKs'' ועם מחלה שאינה גרורתית. |
| − | + | Entrectinib הוא מעכב פומי של כלל ה-TRKs. תוצאות של אנליזה מרוכזת של 3 ניסויים קליניים של אEntrectinib ב-54 חולים מבוגרים עם גידולים מוצקים מתקדמים או גרורתיים, ועם איחויי ''NTRKs'', הראו שיעור תגובה אובייקטיבית של 57 אחוזים ושיעור תגובה מליאה של 7 אחוזים. תופעות הלוואי המשמעותיות הנפוצות ביותר, הקשורות לטיפול, היו הפרעות במערכת העצבים. | |
==עמידות לטיפול == | ==עמידות לטיפול == | ||
| − | עמידות | + | עמידות ל-Larotrectinib ול-Entrectinib עלולה להתרחש על ידי התפתחות של מוטציות ב-''NTRKs''. מעכבי TRKs מדור-שני, למשל [[T:Selitrectinib|Selitrectinib]] {{כ}}(Loxo של Bayer) נמצאים תחת פיתוח קליני, תוך התבססות על יכולתם להתגבר על עמידות נרכשת, המתווכת על ידי מוטציות נרכשות ב-''NTRKs''.{{שש}} |
| − | {{שש}} | ||
| − | |||
'''הבהרה''': | '''הבהרה''': | ||
*אין באמור לעיל, משום ייעוץ או המלצה רפואית או תרופתית כלשהם, והמידע אינו בא להחליף בדיקה וייעוץ על ידי רופא מומחה או טיפול תרופתי | *אין באמור לעיל, משום ייעוץ או המלצה רפואית או תרופתית כלשהם, והמידע אינו בא להחליף בדיקה וייעוץ על ידי רופא מומחה או טיפול תרופתי | ||
*בכל עניין רפואי או תרופתי, יש לפנות לרופא המטפל | *בכל עניין רפואי או תרופתי, יש לפנות לרופא המטפל | ||
| − | ==ביבליוגרפיה== | + | ==ביבליוגרפיה והערות שוליים== |
| − | <div | + | מקורות המשולבים בערך: |
| − | *The impact of translocations and gene fusions on cancer causation | + | {{הערות שוליים|יישור=שמאל}} |
| − | *Detecting and targeting oncogenic fusion proteins in the genomic era | + | |
| − | *NTRK fusion-positive cancers and TRK inhibitor therapy | + | מקורות נוספים: |
| − | *Gene fusions and chimeric RNAs, and their implications in cancer | + | <div style="text-align: left; direction: ltr"> |
| − | *Tropomyosin receptor kinase (TRK) biology and the role of NTRK gene fusions in cancer | + | *Mitelman F, Johansson B, Mertens F. The impact of translocations and gene fusions on cancer causation. Nat Rev Cancer. 2007 Apr; 7(4):233-45. PMID: 17361217. |
| − | *NTRK Fusions in Central Nervous System Tumors: A Rare, but Worthy Target | + | *Davare MA & Tognon CE. Detecting and targeting oncogenic fusion proteins in the genomic era. Biol Cell. 2015 May; 107(5):111-29. PMID: 25631473. |
| − | *Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials | + | *Cocco E, Scaltriti M, Drilon A. NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol. 2018 Dec; 15(12):731-747. PMID: 30333516. |
| − | *Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials | + | *Wu H, Li X, Li H. Genes Dis. Gene fusions and chimeric RNAs, and their implications in cancer. 2019 Aug 30; 6(4):385-390. PMID: 31832518. |
| + | *Amatu A, Sartore-Bianchi A, Bencardino K, Pizzutilo EG, Tosi F, Siena S. Tropomyosin receptor kinase (TRK) biology and the role of NTRK gene fusions in cancer. Ann Oncol. 2019 Nov; 30 Suppl 8: viii5-viii15. PMID: 31738427. | ||
| + | *Gambella A, Senetta R, Collemi G, Vallero SG, Monticelli M, Cofano F, Zeppa P, Garbossa D, Pellerino A, Rudà R, Soffietti R, Fagioli F, Papotti M, Cassoni P, Bertero L. NTRK Fusions in Central Nervous System Tumors: A Rare, but Worthy Target. Int J Mol Sci. 2020 Jan 23; 21(3). pii: E753. PMID: 31979374. | ||
| + | *Hong DS, DuBois SG, Kummar S, Farago AF, Albert CM, Rohrberg KS, van Tilburg CM, Nagasubramanian R, Berlin JD, Federman N, Mascarenhas L, Geoerger B, Dowlati A, Pappo AS, Bielack S, Doz F, McDermott R, Patel JD, Schilder RJ, Tahara M, Pfister SM, Witt O, Ladanyi M, Rudzinski ER, Nanda S, Childs BH, Laetsch TW, Hyman DM, Drilon A. Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol. 2020 Apr; 21(4):531-540. PMID: 32105622. | ||
| + | *Doebele RC, Drilon A, Paz-Ares L, Siena S, Shaw AT, Farago AF, Blakely CM, Seto T, Cho BC, Tosi D, Besse B, Chawla SP, Bazhenova L, Krauss JC, Chae YK, Barve M, Garrido-Laguna I, Liu SV, Conkling P, John T, Fakih M, Sigal D, Loong HH, *Buchschacher GL Jr, Garrido P, Nieva J, Steuer C, Overbeck TR, Bowles DW, Fox E, Riehl T, Chow-Maneval E, Simmons B, Cui N, Johnson A, Eng S, Wilson TR, Demetri GD; trial investigators. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol. 2020 Feb; 21(2):271-282. PMID: 31838007. | ||
</div> | </div> | ||
| − | + | {{ש}} | |
| − | + | {{ייחוס|ד"ר צחי הרץ B.Pharm. Ph.D., יועץ בנושאי תרופות ותוספי תזונה, ופרופסור ניר פלד, מנהל המחלקה לאונקולוגיה , סורוקה|עורך הערך:פרופסור ניר פלד}} | |
| − | {{ייחוס|ד"ר צחי הרץ B.Pharm. Ph.D., יועץ בנושאי תרופות ותוספי תזונה}} | ||
| − | |||
[[קטגוריה:אונקולוגיה]] | [[קטגוריה:אונקולוגיה]] | ||
[[קטגוריה:גנטיקה]] | [[קטגוריה:גנטיקה]] | ||
גרסה אחרונה מ־20:42, 31 באוגוסט 2022
הקדמה
התהוותם של תאי סרטן היא תהליך רב גורמי ורב שלבי אשר תחילתו בתא בריא אשר עובר רצף שינויים גנטיים (Genetic) לאורך חודשים ושנים. שינויים מסוג זה מתרחשים בגופנו אלפי פעמים ביום, אך מאותרים באופן שוטף ומתוקנים בצורה יעילה. בנוכחות יכולת בקרה תקינה, מסולק התא הפגום באמצעות הטייתו למנגנוני הרג עצמי או אף לפיצוץ ישיר של תאים פגומים על ידי מנגנוני בקרה התערבותיים.
השינויים הגנטיים מתרחשים בגן (Gene) אחד, בשניים או אף בגנים מרובים. לעיתים, שינוי גנטי אחד מוביל לשני שמוביל לשלישי וכך הלאה, בעוד זה האחרון הוא זה אשר אחראי להיעדר יכולת בקרה תאית (תא סרטני) בעוד השינוי הראשוני כבר אינו רלוונטי לתוצר הגידולי הקונקרטי הסופי ולכן אינו יעד לטיפול אנטי-סרטני התערבותי.
שינויים גנומיים (Genomic) אלו יכולים להתרחש ברמת המטען הגנטי הבסיסי (DeoxyriboNucleic Acid ,DNA) או ברמת הוויסות הגנומי (DNA Methylation) או ברמת המטען הגנומי המוביל לייצור חלבוני (Ribonucleic acid ,RNA). אנו למדים כי שינויים נוספים ייתכנו באופן עיבוד ה-RNA.
תקלות גנומיות מתחלקות למספר קבוצות:
- שינויים נקודתיים [מוטציות (Mutations) נקודתיות] - החלפת אבן יסוד אחת בשנייה [החלפת נוקלאוטידים (Nucleotides)] המובילה לשינוי תפקודי
- שינויי חסר – חסר של נוקלאוטיד אחד או רצף נוקלאוטידים מתוך המטען הגנומי. חסר זה גורם להפרעה תפקודית
- תוספות של נוקלאוטידים לרצף גנומי (Insertion)
- איחויים בהם מוחלף מקטע גנומי אחד במקטע כלשהו מגן אחר. כלומר היווצרות רצף גנומי חדש שהוא איחוי של של שני מקטעי גנים נפרדים. במקרים אלו, מופעל הגן המאוחה בצורה שאינה תקינה אשר גורמת להתהוות סרטנית
איתורם של הגנים מאוחים, Fusion, המכונים גם טרנסלוקציות (Translocations), הפך לאחראי לחלק משמעותי בהיווצרות הגידולית ובפרק זה נעסוק בסוג מסוים של איחוי של גן NTRK (Neurotrophic Tropomyosin Receptor Kinase).
איחויי NTRKs ספציפיים זוהו במגוון של גידולים, עם הימצאות גבוהה בסוגי סרטן נדירים מסוימים, בילדים ובמבוגרים, ועם הימצאות נמוכה ברוב סוגי הסרטן הנפוצים. איחויי NTRKs יכולים להוות מניעים של התקדמות סרטן ולכן תוצריהם האונקוגניים (Oncogenic) מהווים מטרה לטיפול תרופתי. התקדמות באיתור של איחויי NTRKs ופיתוח טיפולים מכווני מטרה, לעיכוב TRK, משנים את הנוף האבחנתי והתרפויטי (Therapeutic) של הטיפול בסוגי סרטן אלה.
גנים מאוחים - Fusion Genes
גנים מאוחים הם שני מקטעים של גנים שונים המתחברים ביחד והופכים להיות רצף גנומי אחד. שני המקטעים מתחברים זה לזה בצורות שונות, הכוללות בעיקר חיבור באותו הכיוון או חיבור הפוך (כיוונים שונים). לעיתים מתקיימת תקלה נוספת בחלק המאוחה כדוגמת שינוי חסר או תוספת (Insertion) של נוקלאוטידים הגורמת גם כן לפגיעה תפקודית של החלבון הסופי.
האיחוי הגנומי מוביל ליצירת חלבון שלא לצורך או ליצירת חלבון פגום או אף להשתקה של חלבון. בהתאם לכך, מאובחן האיחוי באמצעות צביעה של החלבון הספציפי או איתור החלבון הפגום או איתור של מקטעי הגנום המתחברים זה לזה. התקדמות הטכנולוגיה לריצוף גנומי מאפשר איתורם של איחויים אלו ברמת רגישות גבוהה במיוחד ופותחת אפשרויות טיפול נקודתיות.
ההימצאות של גנים מאוחים משתנה באופן נרחב, על פני סוגי סרטן שונים. גנים מאוחים רבים ספציפיים לתתי-סוגים של סרטן. בהתאם לכך, זיהוי מהיר ומדויק של גנים מאוחים יכול להוביל התערבות טיפולית המתמקדת בעצירת התפקוד של החלבון אשר מבוטא שלא לצורך או מבוטא בצורתו הפגומה.
משפחת הגנים של NTRK
משפחת הגנים NTRK מורכבת מ-3 גנים (NTRK2, NTRK1 ו-NTRK3) המתבטאים בעיקר במערכת העצבים המרכזית והפריפרית (Peripheral) אך יכולים להופיע גם במערכות אחרות בגוף. איחויים של הגן NTRK מופיעים בטווח רחב של מחלות סרטן וחסימתו הובילה למספר טיפולים פורצי דרך אשר אושרו על ידי ה-FDA (Food and Drug Administration) כדוגמת Larotrecitinib, Entrectinib ותרופות נוספות המצויות בפיתוח כדוגמת Altiratinib ו- Sitravatinib [1].
חלבוני ה-TRK (Tropomyosin Receptor Kinase) מעניינים במיוחד בשל היכולת להתערבות טיפולית מאוד סלקטיבית (Selective) וטווח מאוד רחב של מחלות סרטן, כגון סרטן המעי הגס, ממאירות פפילרית של בלוטות התריס (PTC, Papillary Thyroid Cancer), סרטן הריאה, סרטן שד מפריש, סרקומות (Sarcomas), סרטן מוח (Glioblastoma)[2].
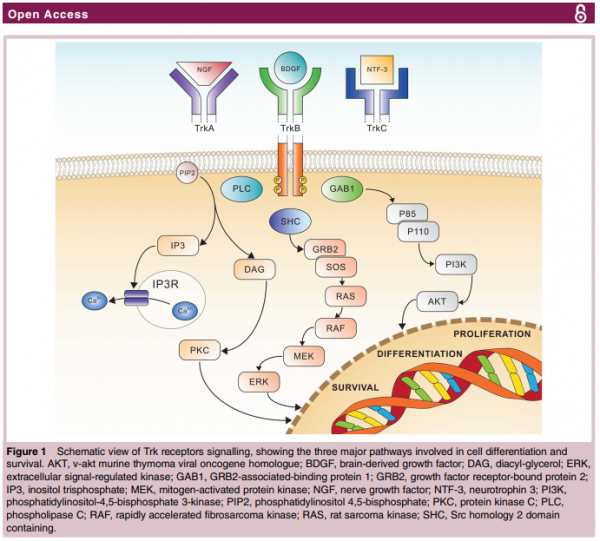
מנגנון הפעולה של משפחת ה-TRK מסוכם בתרשים הבא[3]:
מערכת ה-TRK
מבנה חלבוני ה-TRK
חלבוני TRK הם ממשפחת קולטנים ממרבנליים (Membrane, קרום התא) הבנויים מאתר תוך-תאי עם פעילות Kinase תלוית-Thyrosine, הקשורה דרך מבנה חוצה קרום לאתר חוץ תאי, המורכב משני קולטנים שונים.
נוירוטרופינים (Neurotrophins) - החלבונים הנקשרים לקולטני TRK
קולטני TRK מופעלים על ידי משפחה של 4 חלבונים הנקראים נוירוטרופינים. הנויטרופינים ממלאים תפקידים רבים בהתפתחות ובתפקוד של מערכת העצבים. לכל אחד מהנוירוטרופינים יש ספציפיות ל-TRK מסוים והוא נקשר אליו באפיניות גבוהה.
מסלול העברת ה-Signal של TRKs
המסלול התקין של העברת ה-Signal של TRK מתחיל כאשר קשירה של נוירוטרופין לקולטני TRK על פני התא, גורמת להיצמדות של שני קולטנים. צימוד זה מוביל להפעלה עצמית של הקולטן כלפי מטה והזנת מסלול תאי פנימי.
מיקום ופיזיולוגיה של קולטני TRK
קולטני TRK מתבטאים בעיקר ברקמה העיצבית וממלאים תפקיד חיוני במהלך התפתחות עוברית, כמו גם בתפקוד התקין של מערכת העצבים. השפעול של קולטני TRK על ידי נוירוטרופינים היא בעלת השפעה על מגוון של אירועים עיצביים, כמו התמיינות ושרידות של תאי עצב, שגשוג תאי, וחיזוק הרשת הנוירוגנית (Neurogenic).
מערכת זו קשורה לתהליך הזיכרון, כאב והתמצאות. פגיעה במערכת זו מובילה להפרעות בתחושת כאב, זיכרון, שינוי בהרגלי אכילה, הפרעות למידה ולעיתים מובילה להתמיינות סרטנית.
גנים מאוחים של משפחת NTRK והופעה סרטנית
איחויים הקשורים ל- NTRKs ניצפו לראשונה בחולה עם סרטן של המעי הגס והחלחולת (ColoRectal Cancer ,CRC), בשנת 1986. תת-הסוג שזוהה היה NTRK1 באיחוי עם חלבון 3TPM. בהמשך לממצא זה, זוהו איחויים אחרים ונכון למועד כתיבת מאמר זה מזוהים יותר מ-80 תתי סוגים של איחויי NTRK הקשורים למחלת הסרטן.
איחויי NTRKs במחלות סרטן
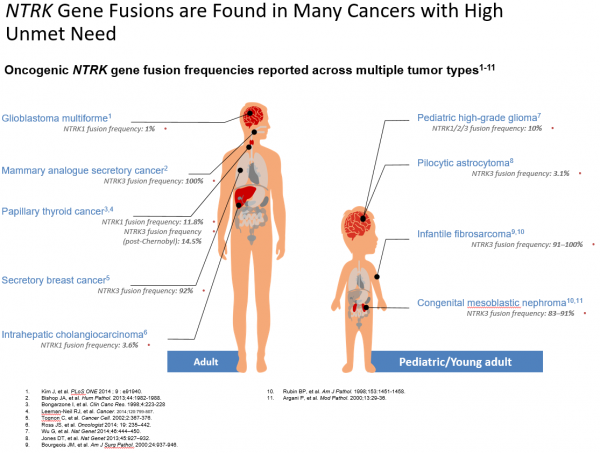
איחויי NTRKs זוהו בסרטנים שונים ובשכיחות שונה במחלות השונות. מחד, שכיחות איחויים אלו היא נמוכה בסרטנים שכיחים כגון סרטן הריאה והשד, בעוד במחלות אחרות, נדירות יותר, כגון סרטן התריס הפפילרי וגידולי מוח, שכיחות איחויים אלו גבוהה במיוחד.
באופן כללי, שכיחות איחויי NTRKs עומדת על אחוז אחד מכלל הגידולים המוצקים.
מחלות סרטן נדירות
פיברוסרקומה של תינוקות (Infantile Fbrosarcoma ,IFS) מייצגת פחות מאחוז אחד מכלל מחלות הסרטן בילדים, אך היא הסרקומה של רקמות רכות [שאינה רבדומיוסרקומה (Rhabdomyosarcoma), הנפוצה ביותר בילדים מתחת לגיל שנה. מחלה זו זהה היסטולוגית (Histologically) לנפרומה מזובלסטית מולדת (CMN, Congenital Mesoblastic Nephroma), גידול מסוג תאי ציר (Spindle) של הכליה, אשר קורה באותה קבוצת גיל ומייצג כ-5 אחוזים מכלל מחלות הסרטן של הכליה בילדות. בשנת 1998 נמצא כי האיחוי ETV6-NTRK3 מופיע בכ-70 אחוזים מהמקרים של IFS. מציאת איחוי זה בוריאנט (Variant) תאי של CMN, אישר קשר גנטי בין IFS ל-CMN. זיהוי של הטרנסלוקציה ETV6-NTRK3 הפך לסמן אבחנתי בעל ערך עבור IFS/CMN.
ETV6-NTRK3 נתגלה מאוחר יותר בשתי מחלות נדירות נוספות, בקרצינומה מפרישה של השד (SBC, Secretory Breast Carcinoma) המהווה כ-0.15 אחוז מכלל סרטני השד ובקרצינומה מפרישה של בלוטות הרוק (MASC, Mammary Analogue Secretory Carcinoma) . מקרה ייחודי של סרטן שד מפריש דווח בישראל עם תגובה יוצאת דופן לתרופת ה Larotrectinib[4]. המדובר על גברת בת 37 אשר אובחנה עם סרטן שד גרורתי תוך כדי היריון. סירבה לטיפולים כימיים והתייצגה עם מחלה נרחבת אשר הגיבה בצורה דרמטית לטיפול פומי ב-Larotrectinib.
סוגי סרטן נפוצים
סרטן פפילרי של בלוטת התריס (PTC) - מהווה כ-80 אחוזים מכלל מקרי סרטן בלוטת התריס. הודגם כי השכיחות של סידור-מחדש של NTRK1 ב-PTC נעה בין פחות מ-5 אחוזים ל-25 אחוזים. נמצאו ב-PTC איחויים של NTRK3, ובעיקר של האיחוי ETV6-NTRK3. אף על פי שההימצאות של ETV6-NTRK3 ב-PTC, במבוגרים נמוכה מאוד (אחוז אחד), זהו הסידור-מחדש הנפוץ ביותר ב-PTC, הקשור לקרינה.
סרטן המעי הגס והחלחולת וסרטן התוספתן - זוהו איחויי גנים של NTRK1 או NTRK3 עם גנים שותפים שונים, וחלקם אף הגיב לטיפול תרופתי. סקירה של 4290 חולים עם CRC שבחנה איחויי גנים עם NTRK1 בלבד, איתרה איחויים ב-0.07 אחוזים מהמקרים. נכון למועד כתיבת מאמר זה, רק איחויי NTRK2 זוהו במקרים של סרטן התוספתן.
סרטן ריאות - סידורים-מחדש של NTRK1 תוארו לראשונה ב-2013, בחולים עם סרטן ריאות של תאים לא-קטנים (NSCLC, Non-Small Cell Luung Carcinoma) המהווה כ-85 אחוזים מכלל מקרי סרטן הריאות. איחויים של NTRK2 ו- NTRK3 דווחו גם כן לגבי NSCLC. באופן כולל, איחויי NTRKs קורים ב-NSCLC בשכיחות של 0.1 אחוז עד 1.0 אחוז.
סרקומה - איחויי NTRKs נדירים יחסית בסרקומה של רקמות רכות. איחויי NTRK1 נמצאו בסרקומות של רקמות רכות עם דפוס גדילה שריר/ כלי דם.
מחלות סרטן של מערכת העצבים המרכזית - איחויי NTRKs זוהו בגידולים ראשוניים של מערכת העצבים המרכזית (Central Nervous System ,CNS) בילדים ובמבוגרים, כולל בגליובלסטומה מולטיפורמה (GBM, Glioblastoma Multiforme) ובגליומות ואסטרוציטומות פדיאטריות (Pediatric Gliomas and Astrocytomas). ב-2014 דיווחו Wu et al, על איחויים נשנים הכוללים NTRKs ב-40 אחוזים (4 מ-10) מהילדים מתחת לגיל 3, עם גליומות בדרגה ממאירות גבוהה, שאינן בגזע המוח [NBS-HGGs (Non-brainstem)].
מלנומה - טרנסלוקציות (Translocations) שונות הכוללות NTRK1 או NTRK3 דווחו לגבי מלנומות (Spheroid Melanomas). נמצאה שכיחות של 0.8 אחוזים ו-0.9 אחוזים של מקרים עם איחויים של NTRK1 או NTRK2, במלנומה ראשונית עורית ובמלנומה מוקוזלית/פאראמוקוזלית (Mucosal/Paramucosal), בהתאמה.
בנוסף לכך, נמצא כי מחלות סרטן המעגנות איחויים של NTRKs, כמו סרטני ריאות ומלנומות נמצאו כבעלי נטייה לגרורות ב-CNS.
סוגי סרטן אחרים
איחויים של NTRKs דווחו בכולנגיוקרצינומות אינטרה-הפטיות (Intrahepatic cholangiocarcinoma), בסרטן שד, בגידולים סטרומליים גסטרואינטסטינליים (Gastrointestinal stromal tumors ,GIST), באדנוקרצינומות (Adenocarcinoma) של כיס המרה, בסרטן לבלב, בגידולים נוירואנדוקריניים (Neuroendocrine) של המעי הדק, ועוד.
בנוסף לנוכחות בגידולים מוצקים, איחויים של NTRKs אותרו בלוקמיה לימפובלסטית חריפה (ALL, Acute Lymphoblastic Leukemia) ולוקמיה מיאלואידית חריפה (Acute Myeloid Leukemia ,AML) בשכיחות של <5 אחוזים.
טיפול מכוון מטרה עם מעכבי TRKs במחלות סרטן עם איחויי NTRKs
מעכבי Tyrosine kinase (TKIs) כמעכבי קולטני TRKs
עיכוב חלבוני TRK נמצא כיעיל ביותר כטיפול אנטי-סרטני בחולים הנושאים מוטצית איחוי בגן זה.
המעכבים הסלקטיבים (Selective) לטיפול באיחוי זה הם Larotrectinib ו- Entrectinib. שתי התרופות מאושרות לשימוש בישראל על בסיס מוטצית איחוי בגן ה NTRK. Larotrectinib (Vitrakvi, Bayer ישראל) אשר אושר לשיווק עבור טיפול בכל הגילאים בעוד Entrectinib (Rozlytrek, Roche ישראל) אושר לשיווק עבור טיפול בילדים מגיל 12 שנים ובמבוגרים.
ניסויים פרה-קליניים (Pre-clinical) של Larotrectinib ו-Entrectinib
על בסיס ניסויים במבחנה (In-Vitro), Entrectinib ו-Larotrectinib עיכבו את חלבוני ה-TRK בריכוזים ננומולריים (Nanomolar ,nM) נמוכים (IC50 < ~10nM) ונמצאו יעילים ביותר, בעיכוב גדילה של תאי BaF3 שעברו טרנסדוקציה (Transduction) עם איחויי NTRKs שונים ושל קווי תאים של סרטן ראשוני שעיגנו סידור-מחדש של NTRK, במבחנה ובעכברים. טיפול במודלים של סרטן שהכילו גנים מאוחים של NTRKs, הביאו לעיכוב של מסלולי MAPK, PI3K–AKT, PKC ו-STAT3.
העיכוב עצמו הוא סלקטיבי ביותר. אתר הקישור של התרופה, לדוגמה Larotrectinib, מוצגת בתרשים הבא:
ניסויים קליניים של Larotrectinib ו-Entrectinib
Larotrectinib הוא מעכב פומי פוטנטי (Potent) וסלקטיבי של שלושת חלבוני ה-TRK. הפעילות של Larotrectinib בחולים עם גידולים בעלי איחויים של NTRKs נחקרה ב-3 ניסויים קליניים שכללו חולים פדיאטריים, מתבגרים ומבוגרים. 55 חולים עם גידולים מוצקים נכללו באנליזה (Analysis) הראשונית ו-159 חולים נחקרו במסגרת אנליזה מרוכזת. גידולים של בלוטות הרוק (22 אחוזים), סרקומה של רקמות רכות (20 אחוזים), פיברוסרקומה של תינוקות (IFS) (13 אחוזים) וסרטן של בלוטת התריס (9 אחוזים), היו הגידולים הנפוצים ביותר. שיעור התגובה האובייקטיבית (ORR, Objective Response Rate) היה 80 אחוזים, ושיעור התגובה המלאה (Complete Response ,CR) היה 16 אחוזים. תופעות הלוואי הרציניות הנפוצות ביותר, הקשורות לטיפול, היו עליות ברמות אנזימי כבד ובחילה.
אף על פי שרוב החולים בניסויים קיבלו Larotrectinib עבור מחלה גרורתית, במספר חולים הייתה מחלה מקומית מתקדמת, למשל 2 ילדים עם IFS של הברך, שחוו הצטמקות משמעותית של הגידולים עם הטיפול, מה שמנע כריתה של הגפיים. מקרים אלה מבליטים את השימוש הפוטנציאלי של עיכוב TRK, כטיפול נאו-אדג'ובנטי עבור חולים עם איחויים של NTRKs ועם מחלה שאינה גרורתית.
Entrectinib הוא מעכב פומי של כלל ה-TRKs. תוצאות של אנליזה מרוכזת של 3 ניסויים קליניים של אEntrectinib ב-54 חולים מבוגרים עם גידולים מוצקים מתקדמים או גרורתיים, ועם איחויי NTRKs, הראו שיעור תגובה אובייקטיבית של 57 אחוזים ושיעור תגובה מליאה של 7 אחוזים. תופעות הלוואי המשמעותיות הנפוצות ביותר, הקשורות לטיפול, היו הפרעות במערכת העצבים.
עמידות לטיפול
עמידות ל-Larotrectinib ול-Entrectinib עלולה להתרחש על ידי התפתחות של מוטציות ב-NTRKs. מעכבי TRKs מדור-שני, למשל Selitrectinib (Loxo של Bayer) נמצאים תחת פיתוח קליני, תוך התבססות על יכולתם להתגבר על עמידות נרכשת, המתווכת על ידי מוטציות נרכשות ב-NTRKs.
הבהרה:
- אין באמור לעיל, משום ייעוץ או המלצה רפואית או תרופתית כלשהם, והמידע אינו בא להחליף בדיקה וייעוץ על ידי רופא מומחה או טיפול תרופתי
- בכל עניין רפואי או תרופתי, יש לפנות לרופא המטפל
ביבליוגרפיה והערות שוליים
מקורות המשולבים בערך:
- ↑ https://esmoopen.bmj.com/content/esmoopen/1/2/e000023.full.pdf
- ↑ Amatu A, SartoreBianchi A, Siena S. NTRK gene fusions as novel targets of cancer therapy across multiple tumour types. ESMO Open 2016;1:e000023. doi:10.1136/esmoopen-2015- 000023
- ↑ Amatu A, et al. ESMO Open 2016;1:e000023. doi:10.1136/esmoopen-2015-000023
- ↑ Landman Y, Ilouze M, Wein S, Neiman V, Yerushalmi R, Yakimov M, Ku N, Schrock AB, Ali S, Peled N. Rapid Response to Larotrectinib (LOXO-101) in an Adult Chemotherapy-Naive Patients With Advanced Triple-Negative Secretory Breast Cancer Expressing ETV6-NTRK3 Fusion. Clin Breast Cancer. 2018 Jun;18(3):e267-e270. doi: 10.1016/j.clbc.2017.11.017. Epub 2017 Nov 28. PMID: 29233640.
מקורות נוספים:
- Mitelman F, Johansson B, Mertens F. The impact of translocations and gene fusions on cancer causation. Nat Rev Cancer. 2007 Apr; 7(4):233-45. PMID: 17361217.
- Davare MA & Tognon CE. Detecting and targeting oncogenic fusion proteins in the genomic era. Biol Cell. 2015 May; 107(5):111-29. PMID: 25631473.
- Cocco E, Scaltriti M, Drilon A. NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol. 2018 Dec; 15(12):731-747. PMID: 30333516.
- Wu H, Li X, Li H. Genes Dis. Gene fusions and chimeric RNAs, and their implications in cancer. 2019 Aug 30; 6(4):385-390. PMID: 31832518.
- Amatu A, Sartore-Bianchi A, Bencardino K, Pizzutilo EG, Tosi F, Siena S. Tropomyosin receptor kinase (TRK) biology and the role of NTRK gene fusions in cancer. Ann Oncol. 2019 Nov; 30 Suppl 8: viii5-viii15. PMID: 31738427.
- Gambella A, Senetta R, Collemi G, Vallero SG, Monticelli M, Cofano F, Zeppa P, Garbossa D, Pellerino A, Rudà R, Soffietti R, Fagioli F, Papotti M, Cassoni P, Bertero L. NTRK Fusions in Central Nervous System Tumors: A Rare, but Worthy Target. Int J Mol Sci. 2020 Jan 23; 21(3). pii: E753. PMID: 31979374.
- Hong DS, DuBois SG, Kummar S, Farago AF, Albert CM, Rohrberg KS, van Tilburg CM, Nagasubramanian R, Berlin JD, Federman N, Mascarenhas L, Geoerger B, Dowlati A, Pappo AS, Bielack S, Doz F, McDermott R, Patel JD, Schilder RJ, Tahara M, Pfister SM, Witt O, Ladanyi M, Rudzinski ER, Nanda S, Childs BH, Laetsch TW, Hyman DM, Drilon A. Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol. 2020 Apr; 21(4):531-540. PMID: 32105622.
- Doebele RC, Drilon A, Paz-Ares L, Siena S, Shaw AT, Farago AF, Blakely CM, Seto T, Cho BC, Tosi D, Besse B, Chawla SP, Bazhenova L, Krauss JC, Chae YK, Barve M, Garrido-Laguna I, Liu SV, Conkling P, John T, Fakih M, Sigal D, Loong HH, *Buchschacher GL Jr, Garrido P, Nieva J, Steuer C, Overbeck TR, Bowles DW, Fox E, Riehl T, Chow-Maneval E, Simmons B, Cui N, Johnson A, Eng S, Wilson TR, Demetri GD; trial investigators. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol. 2020 Feb; 21(2):271-282. PMID: 31838007.
המידע שבדף זה נכתב על ידי ד"ר צחי הרץ B.Pharm. Ph.D., יועץ בנושאי תרופות ותוספי תזונה, ופרופסור ניר פלד, מנהל המחלקה לאונקולוגיה , סורוקהועורך הערך:פרופסור ניר פלד


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק