אינטרלויקין 6 Interleukin
| מדריך בדיקות מעבדה | |
| אינטרלויקין 6 | |
|---|---|
| 6 Interleukin | |
| שמות אחרים | IL-6 |
| מעבדה | כימיה בדם |
| תחום | הערכה של מצבי דלקת במגוון של תרחישים ראומטיים |
| טווח ערכים תקין | 0.3-5.0 פיקוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
מדידת רמת IL-6 משמשת לסייע באבחון של מחלות אוטואימוניות או דלקתיות, כמו גם באבחון מוקדם של דחיית איברים מושתלים, ובאבחון של מנינגיטיס חיידקית או SLE. המדידה יכולה להתבצע בדם, בנוזל השדרה או בנוזל הסינוביאלי המפרקי. רמות מוגברות של IL-6 יכולות להופיע במצבי דלקת כרונית, מפגעים אוטו-אימוניים (דוגמת RA), מפגעים פרוליפרטיביים (mesangial proliferative glomerulonephritis), ואף בסוגי סרטן אחדים (בעיקר בלויקמיה ולימפומה).
בסיס פיזיולוגי
הפעילות הביולוגית המגוונת של Interleukin-6
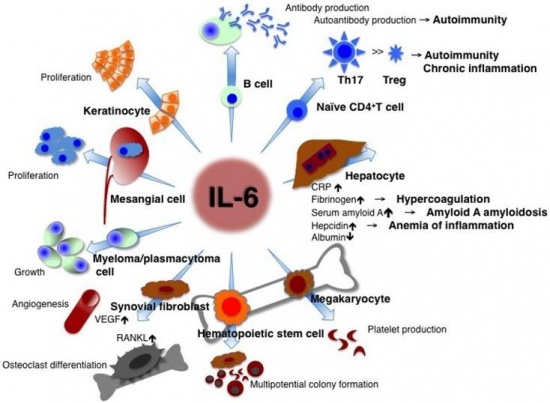
IL-6 הוא אחד ממשפחה של מולקולות חלבון קטנות פעילות ביולוגית הידועות כציטוקינים. IL-6 הוא למעשה ציטוקין נוגד דלקת אך באותה עת גם מעודד דלקת, המשתחרר ממגוון של רקמות, כולל לויקוציטים משופעלים, פיברובלסטים, מונוציטים, מקרופאגים, תאי T, אדיפוציטים, תאי אנדותל, וכן על ידי תאי סרטן אחדים. IL-6 משחק תפקיד חשוב בעידוד מערכת החיסון להגיב להדבקה ודלקת כרונית או לטראומה (כגון כוויות) על ידי שהוא משרה יצירת חלבוני פאזה חריפה כגון CRP, פריטין, צרולופלזמין, הפטוגלובין, serum amyloid A וכן הופעת חום. כאמור, בנוסף לתפקידו כמשרה דלקת (לדוגמה בהפרשתו על ידי תאי שריר חלק ב-tunica media של כלי-דם רבים), IL-6 הוא גם בעל תכונות נוגדות דלקת המתווכות על ידי פעילותו המעכבת TNF-α ו-IL-1, ושפעולם של IL-10 ו-IL-1ra.
IL-6 הוא ציטוקין רב-תפקודי המשחק תפקיד מרכזי במנגנון ההגנה של הגוף, על ידי השראת התמיינות בתאי-B, השראת יצירת IL-2 והקולטן שלו, כמו גם השראת התמיינות ושגשוג תאי T. ציטוקין זה מופרש מתאי-T ומקרופאגים לעודד תגובה חיסונית לטראומה, והוא חיוני ליצירת עמידות לחיידקים (כגון Streptococcus pneumoniae). יחד עם זאת, ייצור עודף שלו עלול לגרום להגברת התגובות האוטואימוניות.
IL-6 הוא בעל תפקיד חשוב בגירוי ההתמיינות ובשגשוג של תאי B. חשובה במיוחד השפעתו על ההתמרה המתמדת של תאי B לתאי פלזמה מייצרי הנוגדנים. IL-6 מזרז שחרור נוגדנים בעיקר מסוג IgG ו-IgA. כמו כן, חיוני IL-6 במיוחד לשלבי ההתמיינות המוקדמים של תאי T, כאשר הוא מעודד את התמיינותם של תאי CD4 לתאי T-helper2. נמצא ש-IL-6 מפקח על השגשוג של תאי-אב (progenitor cells) בבלוטת ההרת (תימוס) ובמח העצם, וחיוני לאחר מכן בשפעול של תאי T והן של תאי NK. הצורה המולקולארית של IL-6 האחראית לשפעול תאי T מופרשת ממונוציטים, ומגבירה את השלבים המוקדמים של שפעול זה. השפעת IL-6 על תאי NK מגבירה יעילות תאים אלה בהמסת פתוגנים.
IL-6 מסוגל לחצות את מחסום דם-מוח (BBB) ולאתחל את הסינתזה של PGE2 בהיפותלמוס, ובכך להביא לשינוי טמפרטורת הגוף. גם ברקמת שריר וברקמת השומן, IL-6 מעודד גיוס אנרגיה המביאה להעלאת טמפרטורת הגוף. IL-6 יכול להיות מופרש ממקרופאגים בתגובה למולקולות ספציפיות של חיידקים, שמתייחסים אליהן כאל pathogen-associated molecular patterns או PAMPs.
לאחרונה נמצא שתאי +CD4 שהיא תת קבוצה של תאי T, המפרישים אתIL-17 המכונים Th 17, הם בעלי תפקיד חיוני בהתפתחות תהליכים דלקתיים בגוף, וחיוניותם בולטת בעיקר בתהליכים אוטואימוניים. IL-6 הוכח כגורם משפיע בהתמיינות של תאי Th 17, מה שקובע את השפעתו בתהליכים דלקתיים, כמו ב-RA.
IL-6 אחראי הן לתהליך הדלקתי הסיסטמי והן לתהליכים דלקתיים מקומיים. בין התהליכים הסיסטמיים ניתן למנות את השפעתו על מטבוליזם של ליפידים, את השפעתו על הציר היפופיזה-אדרנל וממילא על מצבי רוח, עייפות ותחושת כאב וכן על הפרשת הורמון הגדילה וקורטיזול, את השפעתו על העצם והקשר לאוסטיאופורוזיס, את השפעתו על מח העצם (לדוגמה במצבי תרומבוציטוזה), ואת השפעותיו על הכבד הן בהשראת יצירת חלבוני פאזה חדה או השפעתו על יצירת hepcidin בכבד וממילא על מאזן הברזל בגוף.
בין השפעת IL-6 על תהליכים מקומיים ניתן למנות את זו על תאי B ביצירת נוגדנים, השפעתו על מקרופאגים, נויטרופילים ותאי T בתהליכי דלקת כרונית, השפעתו על עצמות בשפעול אוסטיאוקלסטים וספיגת עצם, השפעתו על תאי סינוביום או על יצירת VEGF המשפיע על אנגיוגניות בתאי אנדותל מה שמגביר את החדירות של כלי דם והגברת תהליכי דלקת.
רקע היסטורי
שנת 1987 הייתה שנת המפנה בהבנת המשמעות של IL-6. באותה שנה מספר קבוצות מחקר שעסקו בזיהוי של גורמים לכאורה לא קשורים זה לזה, הגיעו למסקנה שהם שִבטוּ או בודדו את אותו חלבון עצמו. באותו שלב, ההתייחסות לציטוקין המוכר כיום כ-IL-6, הייתה במספר ניכר של כינויים שונים, שכל אחד מהם ייצג מאפיין שונה של IL-6. הסיבה לאי הבהירות הזו, נבעה מהעובדה ש-IL-6 שובט למעשה עוד לפני הגילוי של פעילויותיו הביולוגיות המגוונות. לדוגמה, כאשר Weissenbach, Revel וחב' פרסמו ב-1980 ב-PNAS על מאמציהם לשבט cDNA של אינטרפרון-β מפיברובלסטים של אדם, הם בודדו שני שבטים של cDNA, כאשר החלבון שבודד בעל משקל מולקולארי של 26 אלף דלטון, כונה interferon-β2/26K.
גישה אחרת שהובילה ל-IL-6 הייתה זו של Hirano חב' שהתפרסמה ב-1984 ב- J Immunol, ונבעה מהתצפית שתאי T משופעלים, מייצרים גורם המסייע להתמיינות של תאי B, באופן שהוא משרה יצירת אימונוגלובולין בתאים אלה, ומולקולה זו זכתה לשם BSF-2 או B-cell stimulatory factor-2, ושובטה על ידי Hirano משורת תאי-T מותמרת עם נגיף HTLV-1. שום דבר בפעילות הביולוגית או במקור של BSF-2 לא רמז על קשר כלשהו בינו לבין interferon-β2/26K, אך כאשר פורסם רצף חומצות האמינו של 2 חלבונים אלה, נמצאה זהות מוחלטת בין השניים.
קו מחקרי נוסף שהוביל לזיהוי IL-6 נבע ממחקר על גורמי גדילה של פלזמוציטומות ושל היברידומות של תאי B. היה ידוע שנים על קיומם של גורמי גדילה אלה, אך לא הצליחו לאפיינם עד ש-Van Snick וחב' פרסמו ב-1986 ב-Proc Natl Acad Sci על בידוד מנוזל של helper-T-cell line, גורם גדילה של היברידומה בעכברים שזכה לשם הזמני IL-HP1.
ב-1987 הודיעו Nordan וחב' ב-J Immunol, על ניקוי מנוזל מופרש בתרבית מקרופאגים של מולקולה דומה שזכתה לשם PCT-GF או plasmacytoma growth factor. באותה שנה ובאותו כתב-עת פרסמו Van Damme וחב' על ניקוי גורם גדילה להיברידומה/פלסמציטומה של אדם שכונה HPGF, שבודד מנוזל גידול בתרבית של שורת-תאי osteosarcoma שהודגרו עם IL-1. באופן בלתי-צפוי נמצא שרצף חומצות אמינו בקצה ה-N טרמינאלי של HPGF היה זהה לחלוטין לזה של רצף דומה של interferon-β2/26K ושל BSF-2, מה שהביא באופן סופי בדצמבר 1988 להסכמה שכל המולקולות הללו מייצגות למעשה חלבון יחיד שזכה לכינוי IL-6.
עוד קודם לכן, באותה שנת מפנה של 1987, דיווחו Gauldie וחב' ב-Proc Natl Acad Sci, על כך שנוגדנים כנגד IL-6 חסמו את פעילותו של חלבון ממקור של מונוציטים הידוע כ-HSF או hepatocyte-stimulating factor, מחקר שייחס ל-IL-6 תפקיד בתגובת acute phase של תאי כבד. באותה שנה, באותו כתב עת פרסמו Ikebuchi, Wong וחב' שגורם התמיינות של תאי T ציטוטוקסיים שהוגדר על ידם כ-CDF או cytotoxic T-cell differentiation factor, שיתברר בדיעבד כ-IL-6, פעיל גם בהמאטופויאזה. אותו גורם גדילה "מסתורי" נחקר שנים רבות במעבדתו של ליאו זקס במכון ויצמן וזכה לכינוי MGI-2 או monocyte-granulocyte inducer-type 2. אכן, העובדה שמולקולה אחת מייצגת פעילויות ביולוגיות כה מגוונות, מצביעה על מרכזיותו של IL-6 במערכת החיסון.
כיום אנו מכירים במרכזיותו של IL-6 כציטוקין פלאוטרופי עם מגוון רחב של פעילויות בוויסות מערכת החיסון, בהמטופויאזה, מצבי דלקת, ואונקוגנזה. במרוצת השנים הובררו יחסי הגומלין בין IL-6 לבין קולטניו הממברנאליים כמו גם קולטניו המסיסים, וכן התחוורו היטב מנגנוני העברת האיתות התוך-תאי בתגובה לציטוקין זה. על בסיס הבנות אלו, גישה טיפולית המבוססת על נטרול הקולטן של IL-6 נכנסה לשגרה הרפואית של טיפול בדלקת מפרקים שיגרונתית, בדלקת מפרקים כרונית אידיופטית של גיל הילדות, וכן במחלת Castleman. הפעילות של IL-6 כרוכה בזו של ציטוקינים נוספים כגון LIF או leukemia inhibitory factor, וכן CNTF או cilliary neurotrophic factor וכן oncostatin M.
מבנה החלבון IL-6
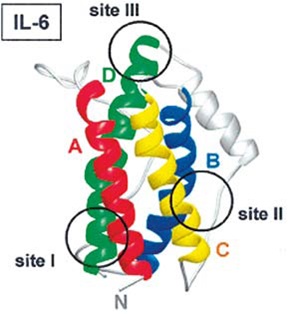
הציטוקין IL-6 ממקור אדם שבודד מתרבית תאי T, מפיברובלסטים ומתאי דם היקפיים חד-גרעיניים, מתנהג כפפטיד מונומרי חד שרשרתי עם משקל מולקולארי שנע בין 21 ל-28 אלף דלטון, בתלות במקור ממנו בודד, אם כי נוהגים להתייחס אליו כפפטיד בעל 184 חומצות אמינו. חלבון זה עובר שינויים לאחר תרגומו כגון גליקוזילציה בקשרים O או N-גליקוזידיים, כמו גם זרחון של שיירי serine. שינויים אלה הם חלק מהסיבה להטרוגניות של המולקולה. ה-cDNA של IL-6 מרמז שבמקור מופיע חלבון קודמן (precursor) המכיל 212 חומצות אמינו, הכולל רצף איתות (signal sequence) הידרופובי של 28 שיירים.
גם IL-6 שנוקה ממקור עכבר, מראה הטרוגניות מסוימת ומשקלו המולקולארי נע בין 22 ל-29 אלף דלטון. בניגוד ל-L-6 של אדם המכיל 2 נקודות של N-glycosylation, הרי ש-IL-6 של עכבר משולל קשר N-גליקוזידי. יחד עם זאת יש לציין שגליקוזילציה אינה חיונית לפעילות הביולוגית של IL-6. קיימת הומולוגיה של 42% ברצף חומצות האמינו בין אדם לעכבר. יש הומולוגיה מעטה בקצה ה-N טרמינאלי בין שני המינים, ועיקר ההומולוגיה בין השניים היא בחלק המרכזי של החלבון (הומולוגיה של 57% בין השיירים 42-102). בעיקר קיימת זהות של 4 שיירי ציסטאין הממוקמים בחלק המרכזי, שיוצרים ביניהם 2 קשרים די-סולפידיים ליצירת לולאות תוך-שרשרתיות, בין cys46 ו-cys52, וכן בין cys75 ו-cys85. למרות השוֹנוּת בחלק ה-N טרמינאלי, IL-6 ממקור אדם פעיל על תאי עכבר, מה שמדגיש את החשיבות הפחותה של הקצה ה-N טרמינאלי בתפקודו של החלבון. הגנים המקודדים ל-IL-6 ממקור אדם או עכבר שובטו והרצף שלהם ידוע, כאשר שניהם מכילים ארבעה introns וחמישה exons, וגנים אלה מוקמו בכרומוזום 7 באדם באתר 7p21, ובכרומוזום 5 בעכבר.
מקור תאי של IL-6
ציטוקין זה נוצר במגוון גדול של תאים בתגובה למגוון גדול של גירויים. IL-6 מיוצר בתאי מערכת החיסון הטבעית-ראשונית הידועים כ- innate immune cells (כמו מקרופאגים, תאים דנדריטיים, ותאי פיטום), וכן בתאי B, ובמידה מועטה יותר על ידי תאי T-helper ומונוציטים. בנוסף, IL-6נוצר גם על ידי תאים שאינם לויקוציטים כמו פיברובלסטים, תאי אנדותל, אסטרוציטים, קרטינוציטים, אדיפוציטים, ומגוון של שורות תאים סרטניים. העובדה ש-IL-6 מיוצר בתאים אדיפוציטים היא כנראה אחת הסיבות לכך שאנשים שמנים הם כבעלי רמות אנדוגניות גבוהות יותר של CRP.
תכונה משותפת לגירויים הרבים המשפעלים IL-6, שהם מייצגים נזק רקמתי או עקות שונות כגון קרינת UV, מולקולות מחמצנות- ביתר (ROS), תוצרים חיידקיים, נגיפים, או בתגובה לציטוקינים מזרזי דלקת אחרים. הייצור של IL-6, מווסת בעיקר על ידי שינויים בביטוי הגני הקשור לגורם השעתוק NF-κB ו-C/EBPα או CCAAT/enhancer protein α.
מנקודת המבט החיסונית אין ספק שגם תאי T ו-B "טריים" יכולים לייצר כמות מוגבלת של IL-6, אך יחד עם זאת רוב תאי T ו-B שעברו הסננה לרקמה סינוביאלית במצבי דלקת שיגרונתית, מייצרים כמות משמעותית של IL-6. ידוע גם ששורות תאי helper T יכולים ליצר כמויות ניכרות של IL-6.
גם החלק הקדמי של בלוטת יותרת המוח, בעיקר תאי folliculostellate יכולים להוות מקור חשוב של IL-6. מחקר של Baes וחב' ב-Endocrinology, מעריך שתאים אלה דמויי מקרופאגים, שבתוכם מקובעים תאים מפרישי הורמונים, מפרישים IL-6 המסייע להפרשת הורמוני ההיפופיזה. כן נמצא ש-IL-6 מופרש על ידי תאי עצם, ועל ידי תאי סטרומה של האנדומטריום.
ידוע כמו כן ש-IL-6 המופרש על ידי אוסטיאובלסטים יכול לפעול על תאים אוסטיאוקלסטים ולעודד אוסטיאוקלסטוגנזה על ידי שדרוג הקולטן הגרעיניRANKL או receptor of nuclear factor kappa-B ligand בפיברובלסטים בסינוביום, למרות ש-IL-6 יכול לפעול ישירות על אוסטיאוקלסטים. איבוד עצם היא תופעה נוספת שמוצאים במפרקים במחלות דלקתיות כמו RA לאחר תקופות ממושכות של דלקת בנוזל המפרקי. IL-6 נכרך גם בוויסות פעילות וסקולארית, על ידי פעולתו על פיברובלסטים והשראה של יצירת vascular endothelial growth factor או VEGF, הפועל על תאים אנדותליאלים. בנוסף, IL-6 יכול להגביר יצירה של קולאגן על ידי פיברובלסטים, ואמנם משקעי קולאגן נמצאים לעתים קרובות במפרקים ב-RA ובמחלות דלקתיות אחרות.
במצב של steady state תאים נורמאליים בדרך כלל אינם מייצרים IL-6 באופן קונסטיטוטיבי. אך הדבקה נגיפית, או ליפופוליסכרידים (LPS) ממקור חיידקי מגרים יצירת IL-6. בנוסף, יצירת IL-6 מגורה על ידי ציטוקינים כמו IL-1 וכן TNF-α, או בעצמם או בשילוב עם אינטרפרון-γ, עם PDGF או platelet-derived growth factor, עם IL-3 ועם GM-CSF אוgranulocyte-macrophage colony stimulating factor. יחד עם זאת, לא כל התאים מגיבים באותה מידה לגורמי הגדילה או לציטוקינים האלה: לדוגמה, IL-1 הוא כנראה הגריין היעיל ביותר ליצירת Il-6 בפיברובלסטים, אך השפעתו קטנה ביותר בתאי מח עצם, בהם דווקא IL-3 או GM-CSF משפיעים ביעילות על יצירת IL-6.
חומרים המשפעלים את האנזים protein kinase C, נמצאו מגרים את ביטוי הגן ל-IL-6, בלימפוציטים של בלוטות השקדים, כמו גם בפיברובלסטים של אדם, מה שמרמז שמסלול העברת איתותים תוך-תאיים, התלוי ב-PKC עשוי לעודד ביטוי הגן ל-IL-6. אך בפיברובלסטים של אדם נמצאה רמת בקרה נוספת, לפיה יצירת IL-6 על ידי גירוי של IL-1, תלויה ברמת cAMP תאי, אך אינה תלויה ב-PKC.
הקולטנים של IL-6
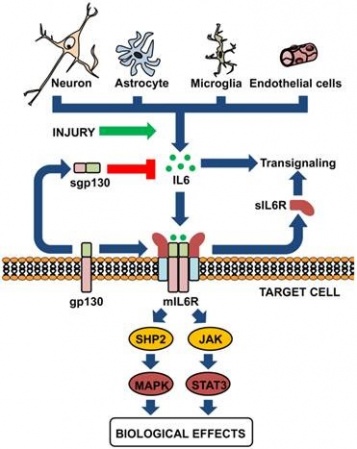
IL-6 מאותת דרך קומפלקס של קולטני ציטוקינים type 1 על פני תאים, המורכב מ- ligand-binding IL-6Rα chain הידוע כ-CD126 ומשקלו המולקולארי 80 אלף דלטון, וכן מגליקפרוטאין gp130 הידוע גם כ-CD130. כאשר IL-6 מגיב עם הקולטן שלו, הוא מגרה את gp130 ואת CD126 ליצור קומפלקס ובכך לשפעל את הקולטן. קומפלקסים אלה גורמים להאחדה של המקטעים התוך-תאיים של GP130 כדי לאתחל רצף של איתותים בסיוע גורמי שיעתוק, אנזימים מסדרת Janus kinases ו-Signal Transducers and Activators of Transcription או STATs.
בשנת 1988 דיווחו Yamasaki וחב' ב-Science לראשונה על בידוד הקולטן הממברנלי ל-IL-6 או mIL-6R. בשנתיים שחלפו מאז פרסום זה, בודדו רוב הקולטנים של ציטוקינים נוספים, דוגמת IL-2, IL-4, אריתרופויאטין, והורמון הגדילה (GH), וכל הקולטנים האלה נמצאו דומים במבנה השלישוני שלהם, באופן שהקנה להם את הכותר משפחת קולטני הציטוקינים. קבוצה יפאנית זו פרסמה בשנים 1989-90 שני מאמרים ב-Cell, בהם הראו שהקולטן IL-6R הוא בעל מבנה ייחודי בכך ש-IL-6 נקשר לתת-יחידה ממברננלית שמשקלה המולקולארי 80 אלף דלטון (הידועה גם כ-CD-126), קישור שמשרה אינטראקציה עם פוליפפטיד ממברנלי אחר שמשקלו המולקולארי 130 אלף דלטון (הידוע כ-gp130 וכן כ-CD-130), ודרכו למעשה מועברים האותות המשפעלים אל תוך התא, וזאת למרות שהוא אינו קושר ישירות את IL-6.
נראה שבנוסף לתפקידו בהעברת האיתות אל תוך תאים, ל-gp130 יש תפקיד בהגברת הזיקה ובייצוב הקומפלקס הנוצר מהקישור של IL-6 לקולטן CD-126. תאי B ו-T כמו גם מקרופאגים, מכילים כאמור את הקולטן IL-R. בשנת 1988 פרסם Vilcek ב-J Biol Chem, שהביטוי של קולטן זה עובר רגולציה שונה בתאי B ו-T: מייד כאשר תאי T משופעלים נגרם down regulation של הקולטן, בעוד שתאי T רוכשים את הקולטן על פניהם רק בשלבים הסופיים של תהליך הבשלתם. גם הנוכחות של מספר גדול של קולטנים אלה על פני תאים מותמרים עם נגיף EBV, לעומת חסר מוחלט שלהם בתאי לימפומה ע"ש Burkitt, מדגיש ביתר שאת שמנגנון הביטוי של קולטן זה מבוקר באופן הדוק. זאת ועוד, תת קבוצות של תאי T, כאלה מסוג CD4 או CD8, מכילים מספר שווה של קולטני IL-6R, בעוד שקולטנים ל-IL-1 מופיעים בתאי CD4 באופן מועדף.
gp130 משמש גם כמרכיב של הקולטן לא רק ל-IL-6 אלא גם לציטוקינים נוספים, כמו ל-CTNF או ciliary neurotrophic factor במוח, ל-LIF או leukemia inhibitory factor, ל-oncostatin-M או OSM, ל-IL-11, ל-IL-27, ל-neurotrophin-1/B cell stimulating factor-3, ל-neuropoietin, ל-KSHV-IL6 או Kaposi's sarcoma-associated herpesvirus-intrleukin6-like protein ול-cardiotrophin-1 או CT-1 בלב, כפי שדיווחו Gearing וחב' ב-Science ב-1982. נמצא ש-gp130 הטרנס-ממברנלי מתבטא כמעט בכל התאים והרקמות כגון הלב, כליות, טחול, כבד, ריאות, שליה ומוח. נתון מעניין הוא שמספר גדול של קולטני IL-6 נמצא על ידי Hirano וחב' על פני תאיmultiple myeloma ודווח ב-1989 ב-Nature. נתון אחר בעל עניין הוא של Syners וחב' מ-1989 ב-Annal NY Acad Sci שניתן להגדיל את ביטויו של קולטן זה בתאים על ידי טיפול ב-dexamethasone.
לעומת זאת CD126 מוגבל רק לכמה רקמות כמו הפטוציטים, ותת-אוכלוסיות של לויקוציטים כגון מונוציטים, נויטרופילים וכן תאי-T ו-B. נפיצות רבה זו של gp130 מגוון רחב של רקמות מסבירה את הפליאוטרופיות של הציטוקין IL-6. מאוחר יותר נמצא, שמבנה ייחודי זה, בו קולטן ספציפי עם משקל מולקולארי של 80 אלף דלטון, משתף פעולה עם גליקופרוטאין מעביר איתותים (signal transducer) שגודלו 130 אלף דלטון, ומופיע ברוב מערכות הקולטנים של ציטוקינים, דוגמת שרשרת γ המשותפת ל-IL-2, IL-4, IL-7, L-9, IL-15 ו-IL-21, ושרשרת β המשותפת ל-L-3 IL-5 ול-GMC-SF.
הקולטן הממברנלי בעל מ.מ. של 80,000 מכיל 468 חומצות אמינו עם מקטע איתות (signal peptide) המכיל 20 חומצות אמינו, כאשר חלק הקולטן החוץ-ממברנלי מכיל כ-340 חומצות אמינו עם חלק הקצה ה-N טרמינלי שהוא כעין לולאה בת-90 חומצות אמינו. המקטע הטרנס-ממברנלי של הקולטן מכיל 28 חומצות אמינו ואילו החלק הציטופלזמטי-פנימי של הקולטן מכיל 82 חומצות אמינו. יצוין שבניגוד לקולטנים אחרים המעבירים איתותים של הורמונים מעודדי-גדילה, המקטע התוך תאי-ציטופלזמי של IL-6R אינו מכיל אלמנט של האנזים טירוזין קינאזה.
בניגוד לציפיות, המקטע הציטופלזמי של קולטן זה אינו משחק כל תפקיד בהעברת האיתות (signal) של IL-6. מסקנה זו מבוססת על הממצא שכאשר מדגירים תאים עם הצורה המסיסה של הקולטן שאינה מכילה את המקטעים הטרנס-ממברנלי או הציטופלזמטיים של הקולטן הממברנלי, מגיבים התאים לפעולת IL-6. יתרה מכך, לאחר שנקשר IL-6 לקולטן הממברנלי (שמשקלו המולקולארי 80 אלף דלטון), נכרך זה עם gp130, כאשר אסוסיאציה כזו מתרחשת גם עם הצורה המסיסה של הקולטן (sIL-6R).
כאשר IL-6 נקשר לקולטני IL-6R, הממברנלי והמסיס, ומביא 2 חלבונים אלה ליצירת קומפלקס על פני הממברנה שנצמדים אליו שני מרכיבי ממברנה אחרים הלוא הם 2 פפטידי gp130, חל שפעול הקולטן המורכב הזה. קומפלקס זה גורם להתכנסות של החלק הציטופלזמטי של gp130, מה שמאתחל מפל (cascade) של אירועים הקשורים להעברת איתות, כאשר באירועים אלה משתתפים גורמי שיעתוק, לאחר שפעול על ידי זרחון של אנזימי JAK או Janus kinase, ובהשתתפות מולקולות STAT או Signal Tansducers and Activators of Transcription.
ליתר פירוט יודגש שקישור IL-6 לקולטניו וכינוסם יחד לקומפלקס על פני הממברנה משפעל שלוש מערכות טירוזין קינאזה בציטופלזמה (JAK2, JAK1 ו-TYK2) אשר מזרחנים את STAT1 ואת STAT3, ומאפשרים את מעברם לגרעין התא. קיומם של הקינאזות של JAK התגלתה לראשונה על Ihle וחב' בשני מאמרים בשנת 1993 ב-Nature וב-Proc Natl Acad Sci. כמו כן IL-6 משפעל גם את מפל תרחישי האיתות Ras-Raf, המווסתים את הזרחון של האנזים MAP-kinase, ובסופו של תהליך נגרם שפעול של גורמי השיעתוק NF-IL-6 (ממשפחת C/EBP), ו-AP-1 (ממשפחת c-Jun ו-c-Fos). נמצא שהגירוי של מפל התרחישים בו מעורב MAP kinase בתלות ב-Ras, חיוני כנראה בתגובה לפעולת IL-6, שכן השפעול של מסלול זה נקשר רק לתאים המשגשגים בתגובה ל-IL-6.
יצויין שבעוד ש-IL-6 של אדם יכול להיקשר לקולטנים בעכבר, ההיפך אינו קורה. עוד נמצא שהקולטנים ל-IL-6 מתחלקים לכאלה עם זיקה גבוהה ל-IL-6 (קבוע דיסוסיאציה-Kd של 10pM) וכאלה עם Kd של 1nM. תאי מיאלומה או תאים מותמרים עם EBV מכילים את המספר הגדול היותר של קולטנים בעלי זיקה גבוהה (בין 10,000 ל-20,000 קולטנים לתא), אך לעומת זאת תאי T במנוחה או תאי B ששופעלו זה עתה מכילים רק כמה מאות קולטנים לכל תא. קולטנים בעלי זיקה גבוהה נמצאים על פני תאי T, ואילו אלה עם זיקה נמוכה מופיעים על פני היברידומות של תאי-B, או בפלזמציטומות.
הקולטן המסיס של IL-6 או sIL-6R
בנוסף לקולטן הממברנלי של IL-6, בודדה צורה מסיסה של הקולטן (להלן sIL-6R) מפלזמה וכן משתן באדם. קולטן מסיס זה נקשר על ידי IL-6 בזיקה דומה לזו של הקולטן הממברנלי (nM0.5-2), וקישור זה מאריך את תקופת מחצית החיים של IL-6. אך חשובה יותר העובדה שהקומפלקס של IL-6 עם הקולטן המסיס שלו, מסוגל לשפעל את התאים על ידי האינטראקציה שלו עם המרכיב הממברנלי gp130. תכונה זו הופכת את הקומפלקס sIL-6R/IL-6 לאגוניסט לסוגי תאים שלמרות שהם מבטאים את gp130, לא היו מגיבים ל-IL-6 לבדו. לכן, לקולטן המסיס של IL-6 יש את היכולת להרחיב את הרפרטואר של סוגי תאים המגיבים ל-IL-6. תכונה זו עומדת בניגוד לתפקידם של רוב הקולטנים המסיסים של ציטוקינים אחרים, הקושרים את הליגנד שלהם ומשמשים אנטגוניסטים לאיתות התאי של ציטוקינים אלה, על ידי מניעת האינטראקציה של האחרונים עם הקולטים הממברנליים שלהם.
החשיבות של הקולטן המסיס של IL-6 כמווסת את התגובה ל-IL-6, הודגמה במערכות אחדות. לראשונה, נמצא שהקולטן המסיס יכול לקשור IL-6 ולדכא את השגשוג של תאי דם חד-גרעיניים ששופעלו על ידי הלקטין concanavalin A. לאחר מכן, דווח שהקומפלקס sIL-6R/IL-6 מעודד את גידולם של סוגי תאים רבים כולל תאי Kaposi-סארקומה, תאי-אב המטופויאטיים, ופיברובלסטים בסינוביום. כמו כן, הודגם פוטנציאל ההשפעה של הקולטן המסיס על שגשוגם של הפטוציטים בעכברים טרנסגנים, בהם הושרתה עלייה כפולה ניכרת הן ברמות IL-6 והן ברמות הקולטן המסיס שלו. עכברים אלה פיתחו נודולות של היפרפלזיה הפטוצלולרית, מה שמעיד על כך שהקומפלקס sIL-6R/IL-6 יכול לפעול כגירוי עיקרי לשגשוג של הפטוציטים.
הקולטן המסיס נכרך גם בהתמיינות תאית, ולדוגמה כאשר IL-6 לבדו אינו מסוגל להשרות יצירה של אוסטיאוקלסטים בתרבית של תאים אלה ממקור עכבר, אך בטיפול משולב של הציטוקין עם הקולטן המסיס שלו, מתחילה יצירת אוסטיאוקלסטים בתרבית. הוכחה נוספת ליכולת של הקולטן המסיס לשמש כמתווך של אירועי התמיינות תאים, הושגה כאשר הִשוו עכברים טרנסגנים המבטאים יכולת יצירת IL-6 אנושי בלבד או יצירת הקולטן המסיס שלו בלבד, לעכברים טרנסגנים המסוגלים לבטא IL-6 כמו גם את הקולטן המסיס שלו. ההבדל העיקרי בין שלושת סוגי עכברים טרנסגנים אלה, הוא בכך שרק בעכברים המבטאים את הציטוקין ואת הקולטן המסיס שלו, נמצאה עליה דרמטית ביצירה של תאים המטופויאטיים בכבד ובטחול, שבאה לביטוי במספרים מוגברים של גרנולוציטים, מקרופאגים, תאי B, ותאי אב (progenitor cells) בכבד ובטחול, כמו גם עליה ניכרת של לויקוציטים ותאי דם אדומים בצירקולציה.
וויסות דלקת בתאים שאינם תאי-דלקת על ידי IL-6
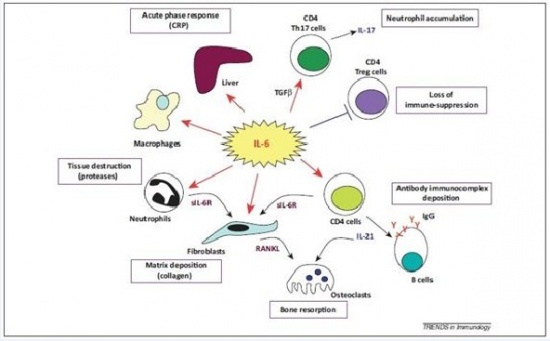
הקולטן IL-6R מבוטא באופן ניכר על פני הפאטוציטים, ודרכו מתבצע הגירוי ליצירת חלבוני פאזה חריפה בכבד, כגון CRP, פיברינוגן, SAA ואחרים. התפקיד החשוב של IL-6 בשמירה על רמה מוגברת של CRP במספר מחלות דלקתיות כרוניות, הודגם בניסויים הקליניים עם tocilizumab, הנוגדן החד שבטי כנגד הקולטן ל-IL-6. הטיפול לחסימת הקולטן IL-6R הביא במהירות לירידה ברמות CRP בפלזמה, דהינו IL-6 יכול לתרום לפתוגנזה של מחלה דלקתית על ידי פעילותו הישירה על הפטוציטים, באופן שמגביר יצירת CRP, שאינו רק סמן לדלקת אלא משתתף ישירות בגרימת נזק רקמתי.
יצירת-יתר של IL-6 במחלות
ציטוקינים כמו IL-6 חיוניים אמנם לחיים, אך לעתים יצירת-יתר קונסטיטוטיבית שלו עלולה להיות כרוכה בתחלואה. בשנת 1997 פרסמו Hirata וחב' ב-Nature, על גילוי מולקולה שבמקור כונתה SSI או STAT-induced SATA inhibitor. כיום ידועה מולקולה זו כ-SOCS, שהוא אחד מהגנים המעורבים במסלול JAK-STAT, אשר בהיקשרו ל-JAKs הוא מעכב את פעילותם.
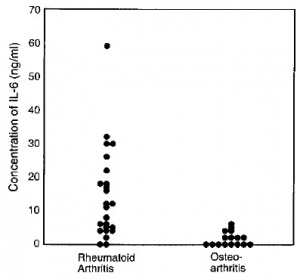
למרות נוכחות של מנגנוני משוב שלילי, ייצור-יתר קונסטיטוטיבי של IL-6 אחראי לפתוגנזה של מספר מחלות דלקתיות. לדוגמה, בשנת 1990 הראו Jourdan וחב' ב-Arhtritis Rheum שבתרחיש של myxoma לבבית שפירה, נוצרות כמויות גדולות של IL-6 שעשויות להסביר תסמיני דלקת שונים בחולים אלה. כמו כן הדגימו Hirano וחב' ב-Eur J Immunol ב-1988, שהרקמות הסינוביאליות של חולים עם RA, מייצרות באופן קונסטיטוטיבי כמויות רבות של IL-6, וזאת בניגוד לתרחיש של osteoarthritis (ראו תרשים)
חולים עם מחלת Castleman המתאפיינים בריבוי של קשרי לימפה נפוחים, והסננה ניכרת של תאי פלזמה בשלים לקשרים אלה, הסובלים מתסמינים דלקתיים חמורים כחום גבוה, אנמיה, רמות גבוהות של חלבוני פאזה חדה, ורמה גבוהה של גמא-גלובולינים, מייצרים כמויות גדולות של IL-6, בקשרי הלימפה הנגועים, וכן רמת ציטוקין זה בפלזמה מוגברת מאוד.
פעילות IL-6 במוח
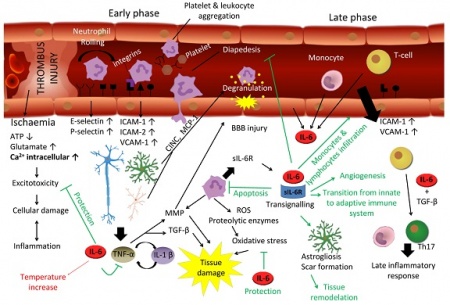
ל-IL-6 יש תפקיד מרכזי בתגובה של המוח לפגיעה. במובן מסוים התגובה של המוח לטראומה או לאירוע שבץ היא דומה. שבץ עלול להיגרם על ידי תסחיף או קריש דם החוסם כלי דם מוחי, על ידי שטף-דם מוחי או עי ידי כיווץ כלי-דם, מה שגורם לאיסכמיה ולהיפוקסיה. חסר חמצן מאתחל מפל התרחשויות המובילות למות תאים כתוצאה מתהליכי אפופטוזיס בהם יש ל-IL-6 תפקיד הגנתי. בתחילת התגובה לתרחיש המתואר, חלה השתפכות של נויטרופילים לפרנכימה העצבית בתהליך של התגלגלות ונדידה בעזרת שדרוג של פעילות P-selectin ו-E-selectin. בהמשך יש שדרוג בפעילות ICAM ו-VCAM.
נויטרופילים הם מקור עשיר של sIL-6R, ונזק מקומי של תאים ברקמת המוח משרה יצירת IL-6, TNF-α, IL-1β וכמוקינים שונים, מה שמזרז נדידה של לויקוציטים לכיוון הפרנכימה. TNF-α ו-IL-1β מובילים לדה-גרנולציה של נויטרופילים ולהרס רקמתי על ידי פעילות מטלופרוטאינזות (MMPs) ו-TGF-β, ואילו IL-6 מעכב את TNF-α ואת תהליך המעבר של תאי-דם לבנים בעיקר דרך דפנות הקפילרות אל הרקמה המקיפה אותם (diapedesis). יתרה מכך, IL-6 משרה אפופטוזיס בנויטרופילים בלולאת משוב שלילי.
בפאזה הסופית של תגובה זו, IL-6 מנצח על המעבר בין תגובת החסינות הטבעית (innate) לחסינות הנרכשת (adaptive), לא רק על ידי עיכוב נויטרופילים אלא גם על ידי גיוס מונוציטים ותאי T ליצירת תגובה דלקתית מאוחרת. מלבד זאת, IL-6 משרה אסטרוגליוזה ואנגיוגניות הדרושים להתאוששות הרקמה. לעומת זאת, IL-6 מפעיל תגובה מזיקה בהעלאת טמפרטורת הגוף, ואם תגובת IL-6 יוצאת משליטה והופכת לכרונית במהלכה, נזק מוחי משמעותי עלול להיגרם.
תאים רבים של מערכת העצבים אינם מגיבים לגירוי של IL-6 לבדו, אך עושים כך על ידי פעולה משולבת של הציטוקין והקולטן המסיס שלו. הקומפלקס sIL-6R/IL-6 יכול לעודד הנצה (sprouting) של נויריטים ולעודד את ההישרדות של נוירונים, ובכך הוא יכול לשמש כגורם נוירוטרופי. למרות שתאים נוירוניים רבים יכולים לייצר IL-6, הם אינם מגיבים לגירוי על ידי IL-6 עצמו. לעומת זאת, התמיינות והישרדות של תאים נוירוניים יכולה להתקיים על ידי הפעולה של הקולטן המסיס. לדוגמה, נוירונים סנסוריים וסימפטתיים ממקור של גנגליוניים באזור האגן של עוברים, מראים עליה בולטת בהישרדות ובהנצה של נויריטים כאשר הם מגורים על ידי הקומפלקס sIL-6/IL-6. בנוסף, sIL-6R יכול להיות משמעותי בגידול אקסוני משורש הגנגליונים הדורזליים של חוט השדרה, וכן בהתפתחות של תאי אב של תאי Schwann, אשר מבטאים את ה-myelin basic protein לאחר שפעולם המשולב עם IL-6 ו-sIL-6R.
שינויים אפיגנטיים ומחלות המושפעות על ידי פעולת IL-6
הודגם ש-IL-6 יכול בפעולתו להוביל למספר מחלות נוירולוגיות, על ידי השפעתו על שינויים אפיגנטיים בתוך המוח. IL-6 משפעל את מסלול PI3K או phosphoinositide 3-kinasep, והיעד בקצה מסלול זה הוא PKB או protein kinase B. שפעול של PKB על ידי IL-6 יכול לזרחן את אתר האיתות על DMNT1 או DNA methyltransferase-1. פעולת זרחוּן זו מביאה לכניסת DNMT1 לתוך גרעין התא, שם מתבצע שעתוק מולקולה זו. DNMT1 מגייס DNMTsנוספים, כולל DNMT3A ו-DNMT3B, ושני אלה כקומפלקס מגייסים את HDAC1. הקומפלקס המאוחד גורם למתילציה של "איי CpG" על פרומוטרים גניים, באופן המדכא את מבנה הכרומטין המקיף את רצפי DNA, ומונע מנגנוני שעתוק. לפיכך, רמה מוגברת של IL-6 עלול לגרום לעודף מתילציה של רצפי DNA, וכתוצאה מכך להפחית ביטוי גני.
תפקידו של IL-6 כציטוקין של תאי שריר (myokine)
IL-6 נחשב ל-myokine, שהוא ציטוקין המיוצר בשריר, ורמתו עולה בתגובה לכיווץ השריר ואף עולה משמעותית בעת פעילות גופנית מאומצת. בשמשו כמיוֹקין יש ל-IL-6 תפקידים נוגדי-דלקת, ולמעשה IL-6 היה המיוקין הראשון שנמצא מופרש לדם בתגובה להתכווצויות שריר. תרגול אאירובי מעודד תגובה ציטוקינית סיסטמית, הכוללת הפרשת IL-6, IL-10 ו-IL-1ra או IL-1 receptor antagonist. באופן כללי תגובת ציטוקינים לפעילות גופנית מאומצת נבדלת מהתגובה לספסיס בהקשר של TNF-α: התגובה הציטוקינית לאחר פעילות גופנית אינה באה בתגובה לעליה ברמת TNF-α בפלזמה. כתגובה לפעילות גופנית העלייה ברמת IL-6 בפלזמה עולה בדרך כלל פי 10-100 ביחס ישר לעצימות הפעילות, ובדרך כלל סמוך לסיומה.
בתחילה הייתה מחשבה שהעלייה ברמת IL-6 לאחר פעילות גופנית מאומצת קשורה לנזק לרקמת השריר, אך בהמשך התברר שאין צורך בנזק לשריר כדי לגרות עליה בציטוקין זה. מסתבר כמו כן שבניגוד לאיתות התאי של IL-6 במקרופאגים, התלוי בשפעול של מסלול האיתות של NFκB, הביטוי התוך-שרירי של IL-6 מווסת על ידי מארג של רצפי איתות (signaling cascades) הכוללים את Ca2+/NFAT ואת glycogen/p38 MAPK. דהינו, כאשר IL-6 מאותת במונוציטים או במקרופאגים, הוא מייצר תגובה המעודדת דלקת (pro-inflammatory response ), ואילו שפעול של IL-6 בתאי שריר אינו תלוי בתגובה קודמת של TNF-α, או בשפעול של NFκB, והוא אנטי-דלקתי באופיו.
Tocilizumab בטיפול בדלקת מפרקים שיגרונתית
עקב התהליך ההרסני במפרק ב-RA, זמן קצר לאחר מכן או במקביל הוחל טיפול בקבוצות תרופות שמטרתן שינוי מהלך המחלה - DMARDs או Disease Modifying Drugs , עליהם נמנים metotrexate, כמו גם azathioprine ,sulfasalazine ,hydroxychloroquine ,leflunomide ועוד. לאחרונה, נוספו תרופות ביולוגיות דוגמת infliximab, etanercept ו-adalimumab, החוסמות את הציטוקין הפרו-דלקתי TNF-α ובכך משפרות את התהליך הדלקתי, תוך השגת שיפור קליני, מעבדתי ואף רנטגני ניכר.
מחקר נמרץ בכיוון של ציטוקינים שעלולים לשחק תפקיד בפתולוגיה של RA, הדגיש את המשמעות של IL-6 כציטוקין בעל חשיבות בוויסות תגובות חיסוניות ותהליכי דלקת, המצוי בשפע בסינוביום המפרקי המודלק. הוא מגייס ומשפעל תאים דלקתיים במפרק וכתגובה התאים האלה מייצרים כמות נוספת של IL-6. כך נוצרת שרשרת פתוגנית של תגובה חוזרת. כבר ב-1998 התפרסם מחקר ב-Journal of Experimental Medicine, בו הודגמה חשיבות IL-6 בהשריית Collagen-induced arthritis CIA)) בעכברים שהיא מחלת מודל של RA בבני-אדם. נמצא שנוגדנים כנגד הקולטן ל-IL-6 אמנם מעכבים התפתחות CIA.
תכשיר ה-Tocilizumab (שם מותג Actemra הוא נוגדן מונוקלונלי ממקור אנושי החוסם את הקולטן IL-6R. בינואר 2009 אישרה הרשות האירופית (EMA) את התכשיר Tocilizumab (המופיע בשם המותג Actemra או RoActemra) והמשווק על ידי התשלובת Chugai/Roche, לשימוש במקרים מתונים עד חמורים של דלקת פרקים שגרונית , לאחר שטופלו באחד או יותר תכשירים אנטי-ריאומטיים (DMARDs), כגון נוגדי TNF או methotrexate. לאקטמרה פרופיל בטיחותי טוב, בהתבסס על חמישה מחקרי פאזה III שכללו מעל 4,200 מטופלים.
התכשיר נבדק הן כתרפיה יחידה או בשילוב עם MTX או DMARDs אחרים וזאת בהשוואה ל-MTX בחולים שלא קיבלו בעבר MTX, או לחולים שלא הגיבו ל-MTX וחולים שנכשלו בטיפול בנוגדי TNF בעבר. בכל קבוצות החולים שנבדקו נמצאה התרופה יעילה יותר, הן כמונותרפיה והן בשילוב עם MTX לעומת טיפול מקובל ב-MTX או ב-DMARDs. המייחד את התרופה הוא הופעת אחוזים גבוהים של הפוגה שהושגו במחקרים השונים ואשר נעים בין 28 ל-47 אחוז מכלל החולים שהשתתפו במחקרים.
התכשיר אושר לאותה מטרה על ידי ה-FDA בינואר 2010. באפריל ובאוגוסט 2011 אושר תכשיר זה על ידי ה-FDA ו-EMA לטיפול ב-JIA או Juvenile idiopathic arthritis. תכשיר זה הוא למעשה נוגדן חד שבטי שהוכן בתאי אדם שנקשר באופן ספציפי לשני הקולטנים של הציטוקין IL-6, הממברנלי והמסיס, ומסוגל לנטרל את האיתותים התאיים המתבצעים דרך שני קולטנים אלה.
ב-1997 החלה חברת התרופות היפאנית Chugai לפתח את הנוגדן Tocilizumab לטיפול ב-RA, והוא זכה בשנת 2005 לאישור ביפאן לטיפול במחלתCastleman, ובשנת 2008 אושר שם הנוגדן לטיפול במחלת JIA בילדים, כמו גם לטיפול בדלקת מפרקים סיסטמית בצעירים (Still's Disease). בשנת 2003 הצטרפה חברת Hoffmann-La Roche לחברה היפאנית להמשך הפיתוח של התכשיר. Actemra מאושרת בישראל על ידי משרד הבריאות מאז 2010.
אחד היתרונות של Tocilizumab הוא בכך שיש לו תקופת מחצית חיים ארוכה בפלזמה, מה שמאפשר להסתפק בטיפול אחת לחודש. סדרה של מחקרים שהחלו ביפאן ונערכו בהמשך במקומות אחרים, הצביעו על כך שתכשיר זה לא רק שיפר את התסמינים של חולי RA, אלא אף הביא לנורמליזציה של סמני דלקת שונים. Actemra יכולה להינתן כטיפול יחיד או בשילוב עם מטוטרקסט ו/או DMARDs אחרים. הטיפול ב-Actemra ניתן אחת לארבעה שבועות במינון של 8 מיליגרם לק"ג משקל גוף, בעירוי שנמשך שעה.
מדידת IL-6 בדם במטופלים עם אלח-דם או עם תסמונת תגובה דלקתית סיסטמית (SIRS)
ידוע שיצירה מסיבית של ציטוקינים מעודדי דלקת כמו TNF-α, IL-1β, IL-8 ו-IL-6 על ידי תאים של מערכת החיסון, עלול להשרות תסמונת SIRS או systemic inflammatory response syndrome, וכן שציטוקינים אלה משחקים תפקיד חשוב בהתפתחות של ARDS או acute respiratory distress syndrome, או בהתפתחות של MODS או multiple organ disfunction syndrome. דווח על ידי Dams וחב' ב-1997 ב-Crit Care Med, שרמת ציטוקינים אלה בדם מוגברת מאוד במטופלים עם ARDS, או באלה עם הלם ספטי. ולכן מדידת רמתם חיונית להערכת המצב והפרוגנוזה של המטופל.
בין הציטוקינים שהוזכרו, ל-IL-6 יש זמן מחיצת חיים ארוך יותר מזה של TNF-α, או של IL-1β, ורמת IL-6 נותרת מוגברת בתרחיש כמו ספסיס. לכן ממליצים Martin וחב' ב-Crit Care Med, על מדידת רמת IL-6 התרחישים כמו הלם ספטי, טראומה, פנקראטיטיס חריפה או הלם קרדיוגני. משערים שיצירה מופרזת של ציטוקינים דוגמת IL-6 עלולה לשפעל נויטרופילים, כמו גם את מערכת הקרישה, מה שעלול להביא לפגיעה משמעותות של איברים חיוניים. ניתן במצבים אלה לטפל עם תכשירים אנטי-ציטוקיניים להפחתת פעילותם.
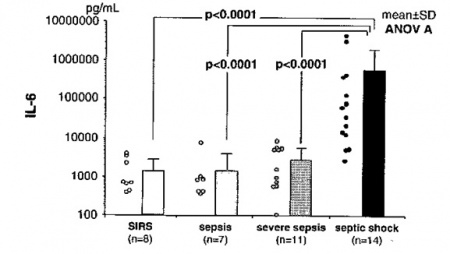
מחקר ביפאן של Oda וחב' שפורסם ב-2005 ב-Cytokine בחן את ההיבט האמור ביחידת טיפול נמרץ, על 40 מאושפזים עם SIRS/Sepsis, תוך שימוש בשיטת מדידה הידועה כ-CLEIA או chemilminescent enzyme immunoassay המאפשרת קבלת תשובה בזמן אמת. בין 40 מאושפזים 27 שרדו את האשפוז ואילו 13 נפטרו במהלכו. מדידה יומיומית של רמת IL-6 במקביל להערכת SOFA או sequential organ failure asessment, העלתה שרמת IL-6 זו הייתה מוגברת משמעותית באלה עם SIRS או עם ספסיס, אך הייתה מוגברת באופן דרמטי באלה עם הלם ספטי. אמנם רמת IL-6 לא הייתה שונה משמעותית ביום האשפוז הראשון בין אלה ששרדו לעומת אלה שנפטרו במהלך האשפוז, אך במהלכו נמצאה עלייה ניכרת ברמת IL-6 בקבוצת הנפטרים.
IL-6 כמדד פרוגנוסטי להערכת הישרדות בחולים עם CAP
מחקר של Angus וחב' משנת 2008 ב-Am J Respir Crit Care Med, מצביע על כך שבמאושפזים עם דלקת ריאות הנרכשת בקהילה (CAP), רמות גבוהות של IL-6 מעט לפני שחרורם מבתי חולים בפנסילבניה, מישיגן וקונטיקט, מצביעות על סיכון מוגבר לתמותה במהלך 90 הימים לאחר האשפוז. מחקר זה העריך האם עלייה ממושכת בפלזמה של IL-6 קשורה לתמותה לאחר שחרור מביה"ח לאחר CAP. מתוך 1,808 מטופלים ששוחררו מביה"ח בחיים, 126 (7%) נפטרו תוך 90 יום. מתוך 1,452 מטופלים שעברו לפחות מדידת IL-6 אחת לפני שחרורם מביה"ח, אלה שנפטרו היו בעלי רמות IL-6 גבוהות במיוחד בהשוואה לאלה ששרדו. ריכוזי IL-6 הממוצעים עבור אלה שנפטרו היו 10.6 pg/mL ו- 5.9 pg/mL עבור השורדים. לשם השוואה, ריכוז IL-6 באנשים בריאים הוא בממוצע 1.8 פיקוגרם/מ"ל, ו- 100 פיקוגרם/מ"ל במטופלים מורכבים מאוד ביחידות טיפול נמרץ. הסיבה הנפוצה למוות לאחר השחרור מביה"ח עבור מטופלים עם IL-6 גבוה במחזור הדם הייתה אירועים קרדיו-וסקולארים כגון שבץ או MI.
הוראות לביצוע הבדיקה
אין צורך בצום. רצוי לא ליטול בבוקר הבדיקה תוספי מזון, תכשירים או תרופות שונות שאינם נדרשים באופן חיוני. ניתן לדגום את הדם כנסיוב (במבחנה כימית עם פקק צהוב או אדום, או כפלזמה במבחנת ליתיום הפארין (פקק ירוק) או במבחנת ספירת-דם (EDTA פקק סגלגל). הפרדת הדם בסרכוז חייבת להתבצע לא יאוחר משעתיים נטילת הדם. הדגימה יציבה בקירור למשל 2-4 שבועות, ובהקפאה למשך שנה. נמצא שהרמה המרבית של IL-6 בדם קיימת בזמן השינה, ולכן יש להקפיד על לקיחת הדם בשעה 0800-1000.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק