איתור תסמונת לינץ' במטופלים שחלו בסרטן המעי הגס באמצעות בדיקת הגידול - Detection of lynch syndrome with tumor testing in colon cancer patients
הופניתם מהדף איתור תסמונת לינץ' במטופלים שחלו בסרטן המעי הגס באמצעות בדיקת הגידול לדף הנוכחי.
| איתור תסמונת לינץ' במטופלים שחלו בסרטן המעי הגס באמצעות בדיקת הגידול | ||
|---|---|---|
| Detection of lynch syndrome with tumor testing in colon cancer patients | ||
| 250px | ||
Micrograph showing tumor-infiltrating lymphocytes (in a colorectal cancer), a finding associated with MSI-H tumours, as may be seen in Lynch syndrome. H&E stain.
| ||
| יוצר הערך | ד"ר ליאור כ"ץ | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – תסמונת לינץ'
מבוא
תסמונת לינץ' (Lynch Syndrome) היא מצב גנטי המהווה את הסיבה השכיחה ביותר לסרטן מעי גס תורשתי. התסמונת, הידועה גם בשם HNPCC (Hereditary Non-Polyposis Colorectal Cancer), גורמת לכ-3 אחוזים מכלל המקרים של סרטן המעי הגס[1][1].
תסמונת לינץ' (ת"ל) אינה גורמת רק לסרטן המעי הגס, אלא מתאפיינת בסיכון יתר לפתח גידולים גם באיברים אחרים. כאמור, הממאירות הנפוצה ביותר בקרב אנשים עם תסמונת לינץ' היא סרטן המעי הגס (סיכון של 52–82 אחוזים לפתח סרטן המעי הגס במהלך החיים). לנשים עם תסמונת לינץ' סיכון מוגבר לפתח סרטן רירית הרחם (60-25 אחוזים) וסרטן השחלות (12-4 אחוזים). בנוסף קיים סיכון מוגבר גם בקרב גברים וגם בקרב נשים עם תסמונת לינץ' ללקות בסרטן הקיבה (13-6 אחוזים) ובגידולים נוספים (בשיעור נמוך יותר) בכבד ובדרכי המרה, במערכת השתן (בעיקר בשופכנים, באגן הכליה ובשלפוחית השתן), במעי הדק, במוח, בלבלב ובעור (גידולים של בלוטות החלב), וייתכן שאף בשד ובערמונית. גידולים אלו נוטים להופיע אצל הלוקים בתסמונת לינץ' בגילים מוקדמים יותר, יחסית לכלל האוכלוסייה, ועלולים אף לחזור יותר מפעם אחת באותו אדם[2].
הדרך בה נגרמת תסמונת לינץ' ומנגנון התפתחות הסרטן אצל נשאי התסמונת
תסמונת לינץ' נגרמת על ידי מוטציה מורשת (פגם גנטי) בגנים האחראיים לתיקון פגמים בתהליך הכפלת הדנ"א (החומר התורשתי המצוי בכל אחד מתאי הגוף). תפקידם של גנים אלו הוא לאתר טעויות בהכפלת הדנ"א, לתקנן, וכך לאפשר חלוקה תקינה של התאים. מובן, לכן, כי מוטציה בגנים אלו, עלולה לגרום לכך שלא יאותרו פגמים בהכפלת הדנ"א, חלוקת התאים תצא מכלל שליטה וייווצר גידול סרטני. קבוצת גנים זו, אשר מוטציה באחד מהם גורמת לתסמונת לינץ', נקראת Mismatch Repair) MMR) וכוללת 4 גנים: MLH1, MSH2, MSH6, PMS2. גן נוסף העשוי לגרום לתסמונת נקרא EPCAM. כדי לאבחן תסמונת לינץ', יש צורך בבדיקה גנטית שהיא בדיקת דם שבה מתבצע תהליך הנקרא ריצוף (sequencing) כמו גם בדיקות משלימות לאיתור חוסרים או הכפלות של הגנים הנזכרים למעלה. נכון למועד פרסום מאמר זה, אבחון תסמונת לינץ' הוא אבחון מעבדתי, והאבחנה תינתן רק למי שנמצאה בבדיקות הדם שלו מוטציה פתוגנית (פגם גנטי אשר ברור כי הוא גורם לנזק) באחד מגנים אלו[3].
תסמונת לינץ' מורשת בתורשה אוטוזומית דומיננטית, בה הורה עם גן פגום וגן תקין מעביר (בסבירות של 50 אחוזים) את הגן הפגום לילדיו.
מחלת סרטן תתפתח אצל נשאי התסמונת רק לאחר שיקרה אירוע נוסף (second hit) באחד האיברים בגוף בו ייצא משימוש הגן התקין שהורש מההורה הבריא. עתה אין כלל פעילות של MMR בתאי איבר זה, הכפלת הדנ"א שגויה ואינה מבוקרת, והתא הופך לממאיר[2].
התאים שאיבדו את יכולת תיקון נזקי ה-mismatch בדנ"א מציגים תופעה הנקראת MSI .(Microsatellite instability) MSI הוא סימן ההיכר של תסמונת לינץ', על אף שהוא יכול להיגרם גם ממצבים לא תורשתיים. MSI יופיע אך ורק בתאי גידול שנגרם כתוצאה מחוסר פעילות של הגנים מקבוצת ה-MMR ולא יופיע בתאים תקינים השכנים לגידול או בתאי גוף אחרים של אותו האדם, שכן הופעת ה-MSI דורשת חוסר פעילות מוחלטת של ה-MMR, כפי שהוסבר לעיל[4].
אבחון תסמונת לינץ'
קיימת חשיבות רבה באבחון התסמונת, וזאת ממספר סיבות[5]:
- מעקב מתאים אחר הנבדק עצמו - מעקב תכוף לצורך מניעה הן של הישנות סרטן המעי הגס והן מניעת סרטן באיברים וברקמות אחרים שבסיכון לפתח סרטן בתסמונת זו
- איתור קרובי משפחה שהם נשאי התסמונת לצורך מעקב ומניעה ראשונית של הגידולים הקשורים לתסמונת לינץ' אצלם
- סיוע בתכנון ניתוח ובמניעה תרופתית
- סיוע בתכנון המשפחה ובמניעת העברת התסמונת לדורות הבאים
- מניעת מעקב מוגבר בקרב קרובי משפחה שאינם נשאים של התסמונת
שלבי האבחון
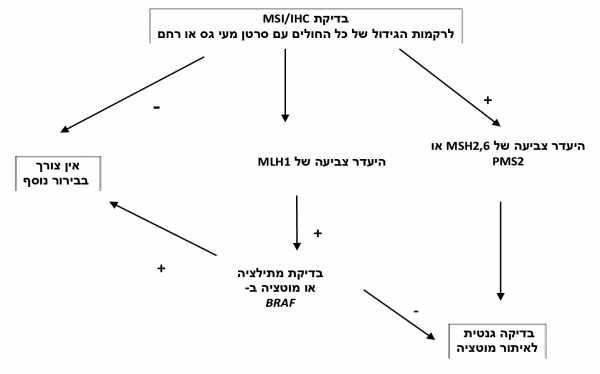
כאמור, אבחון תסמונת לינץ' הוא אבחון מולקולארי (מעבדתי), המתבצע על ידי בדיקה גנטית שתפקידה לאתר מוטציות באחד מהגנים מקבוצת ה-MMR. לכאורה, ניתן היה לבצע רק בדיקה זו אצל כל חולה או בן משפחה עם חשד לתסמונת לינץ', אולם במרבית המרכזים הרפואיים בעולם, כולל גם במדינת ישראל, מקובל לבצע תהליך איתור דו-שלבי, בו בשלב הראשון נבדקת רקמת גידול (tumor testing), ורק כאשר רקמת הגידול מדגימה מאפיינים המחשידים לתסמונת לינץ' (ראו להלן), מבוצע השלב השני והוא הבדיקה הגנטית.
תהליך דו-שלבי זה מתבצע משתי סיבות:
- עלות הבדיקה הגנטית יקרה ולכן רצוי לבצעה רק כאשר קיים סיכוי ממשי לתוצאה חיובית
- ישנה חשיבות גם לקבלת תשובה של בדיקות הגידול וזאת הן לצרכים טיפוליים (לדוגמה: אימונותרפיה), והן לצורך מעקב מותאם אצל חולים המדגימים תשובה חיובית של בדיקת הגידול, אף אם הבדיקות הגנטיות תקינות והללו אינם נשאים של תסמונת לינץ'. חלק מהחולים הללו "כללו תחת הכותרת "תסמונת דמוית לינץ'" (Lynch-like syndrome). הללו מהווים תת- קבוצה הדומה בחלק ממאפייניה לנשאי תסמונת לינץ', למרות היעדר מוטציה בבדיקות הגנטיות
בדיקות רקמת הגידול - Tumor testing
השלב הראשון באבחון תסמונת לינץ' הוא בדיקה של רקמת הגידול. לצורך כך קיימות שתי בדיקות המשלימות זו את זו. הללו יכולות להתבצע הן על גידול שהוסר בניתוח והן על ביופסיות מגידולי מעי גס או רחם:
- בדיקת MSI - בדיקה הדורשת הפקת דנ"א מתאי הגידול ומתאים תקינים בשכנות לו. רגישות הבדיקה כ-85 אחוזים, אך היא אינה מכוונת למוטציה בגן ספציפי מארבעת הגנים שהוזכרו לעיל, ולכן תשובה חיובית בבדיקה זו דורשת ריצוף של כל ארבעת הגנים (יחדיו או באופן מדורג) על מנת לאשר או לשלול תסמונת לינץ'[6]
- צביעה אימונוהיסטוכימית - IHC (Immunohistochemical staining) - צביעה זו של רקמת הגידול ושל רקמה שכנה מאפשרת לראות אם הגידול מבטא את ארבעת החלבונים המקודדים (נוצרים) מארבעת הגנים שעלולים להיות פגומים אצל הלוקים בתסמונת לינץ'. גידולים של חולים עם תסמונת לינץ' לא "צבעו לאחד או יותר מחלבונים אלו, בעוד שהרקמה הסמוכה להם, שלא עברה את ה־second hit שהוזכר לעיל תיצבע בצורה תקינה. רגישות הבדיקה אף היא כ-85 אחוזים, ויתרונה הוא בכך שהיא מכוונת אותנו לאיתור הגן הפגום. במקרים בהם לא נצבע חלבון מסוים, נבצע את בדיקת הריצוף הגנטית רק לאותו הגן שאחראי על ייצור חלבון זה, ובכך נחסוך משאבים[7]. הבדיקה דורשת מיומנות ודיוק, ועליה להתבצע רק במעבדות ייחוס בעלות בקרת איכות קפדנית. היעדר צביעה של MLH1 עשוי לנבוע גם מאירועים סומאטיים (אירועים רק ברקמת הגידול שאינם תורשתיים), בייחוד במבוגרים, ולכן במקרי היעדר צביעה של חלבון זה מומלץ לבדוק ברקמת הגידול מוטציה בגן BRAF, אשר הימצאותה מחשידה לכיוון ספוראדי (שאינו תורשתי) ובמקרים אלו אין צורך להמשיך בבדיקה גנטית[5].
בדיקה גנטית - Genetic testing
אבחון תסמונת לינץ' מתבצע בסופו של דבר על ידי בדיקת דם וגילוי מוטציה באחד מהגנים מקבוצת ה-MMR. אבחון זה יאפשר לבדוק את יתר בני המשפחה למוטציה שנמצאה ולהמליץ על המעקב המתאים לנשאי המוטציה ולאלו שאינם נשאים.
אוכלוסייה לה מומלץ להיבדק לתסמונת לינץ'
מאחר שרק 3 אחוזים מכלל הלוקים בסרטן המעי הגס הם נשאים של תסמונת לינץ', רווחה בעבר הגישה כי אבחון תסמונת זו צריך להתבצע על סמך קריטריונים קליניים נוקשים. כך נוצרו, למעשה, קריטריוני אמסטרדם (Amsterdam criteria) בשנות ה-90 של המאה ה-20. כדי לאבחן תסמונת לינץ' על סמך קריטריוני אמסטרדם, על המשפחה היה למלא אחר כל הדרישות הבאות:
"3 או יותר בני משפחה עם סרטן מעי גס לאורך שני דורות לפחות, כאשר אחד מבני המשפחה חייב להיות קרוב משפחה מדרגה ראשונה של השניים האחרים ועל לפחות אחד ממקרי הסרטן להופיע לפני גיל 50"[8]. קריטריונים נוקשים אלו הובילו לתת-אבחון של תסמונת לינץ' מחד גיסא (כלומר: חלק נכבד מנשאי התסמונת אינם מקיימים קריטריונים אלו), ומאידך גיסא לא בכל המשפחות המקיימות קריטריונים אלו נמצאה אכן מוטציה באחד מ-4 הגנים מקבוצת ה-MMR[5].
על מנת לשפר ולהנגיש את האבחון של תסמונת לינץ', הוצעה קבוצה אחרת של קריטריונים, רגישים יותר, הנקראת Revised Bethesda Guidelines. קריטריונים אלו (אשר הם מסורבלים וקשים לזיכרון) מבוססים על ריבוי מקרי סרטן אצל נבדק מסוים או בקרב בני משפחה, גיל צעיר (מתחת ל-50) של הופעת הסרטן או היסטולוגיה אופיינית של הגידול תפקיד קריטריונים אלו הוא להחליט מי הם הנבדקים אשר יישלחו לבדיקת רקמת הגידול (tumor testing) לצורך התחלת תהליך האבחון של תסמונת לינץ'[9]. נכון למועד כתיבת מאמר זה, אלו הם עדיין הקריטריונים המשמשים את סל הבריאות הישראלי[10] להחלטה עבור מי ימומן בירור לתסמונת לינץ' על ידי קופות החולים, אך גם קריטריונים אלו אינם רגישים מספיק, ומפספסים כרבע מנשאי תסמונת לינץ'.
בדיקה אוניברסלית - Universal testing
לאור חוסר הרגישות וחוסר היעילות של הקריטריונים הקליניים (בשל הקושי לזכור בעל פה רשימה כה ארוכה של קריטריונים), נערכו מספר מחקרים אשר הראו כי הדרך הטובה ביותר לאיתור תסמונת לינץ' היא בדיקת הגידול (MSI או IHC) לכלל המאובחנים החדשים עם סרטן המעי הגס (וסרטן הרחם) (איור מספר 1). הרציונל בכך הוא ששיטה זו בה נבדקים כלל הגידולים מאפשרת איתור אופטימלי של הלוקים בתסמונת, בדיקת בני משפחותיהם, וכך מניעת תחלואה ותמותה מסרטן של בני המשפחה. דרך זו לאבחון תסמונת לינץ' מומלצת על ידי ה-NCCN (National Cancer Comprehensive Network), ומיושמת בחלק גדול מבתי החולים המתקדמים בארצות הברית ובאירופה[5][11]. לטווח ארוך הוכח ששיטה זו מביאה גם לחיסכון כלכלי[6], על אף שיש הסוברים שיש ליישמה רק במקרים בהם התגלה הסרטן לפני גיל 70 [5]. אף על פי שהבדיקה האוניברסלית מומלצת, קיים קושי בהטמעתה בבתי החולים, ולצורך כך יש לדאוג לשיתוף פעולה הדוק בין מומחים מתחומים שונים על מנת לבצע את הבדיקות כיאות, להבין את התוצאות, לאתר את כל החולים עם בדיקה חיובית ולזמנם לייעוץ גנטי מסודר בו יבינו את משמעות תוצאות הבדיקה האוניברסלית ויונחו לגבי המשך הבירור הגנטי. שיתוף פעולה זה צריך לכלול רופאים מומחים בכירורגיה, בפתולוגיה, בגנטיקה, באונקולוגיה ובגסטרואנטרולוגיה.
בישראל טרם הוכנסה הבדיקה האוניברסלית לאיתור החולים בתסמונת לינץ' לסל הבריאות, אך התבצע מאמץ על מנת להכניסה לסל הבריאות של 2018.
סיכום
תסמונת לינץ' נובעת ממוטציה באחד מארבעה גנים האחראים לאיתור ולתיקון טעויות בהכפלת הדנ"א ונקראים MMR. זוהי התסמונת השכיחה ביותר הגורמת לסרטן מעי גס תורשתי, ובנוסף היא מעלה את הסיכון לסוגי סרטן נוספים רבים ובעיקר סרטן הרחם. אבחון התסמונת נעשה בשני שלבים, כאשר בשלב הראשון מבוצעות בדיקות על רקמת הגידול. לחולים עם תשובה חיובית מומלצת בדיקת גנטית. בעוד שבעבר ההפניה לבדיקות אלו הסתמכה על קריטריונים קליניים, אשר הם מסובכים ולא מספיק רגישים, עתה מומלצת גישת הבדיקה האוניברסלית, בה ייבדקו כל הגידולים של כלל המאובחנים עם סרטן המעי הגס. שימוש נכון בגישה כוללנית זו יגרום לאיתור מיטבי של חולים עם תסמונת לינץ' ולמניעת תחלואה ותמותה מסרטן בקרב בני משפחותיהם.
ביבליוגרפיה
- ↑ Aaltonen LA , Salovaara R , Kristo P, et al. Incidence of hereditary nonpolyposis colorectal cancer and the feasibility of molecular screening of the disease. N Engl J Med. 1998 May 21;338(21):1481-7.
- ↑ 2.0 2.1 Kohlmann W, Gruber SB. Lynch syndrome. In: Pagon RA, Adam MP, Ardinger HH, et al (eds). GeneReviews [Internet]. Seattle (WA): University of Washington; 1993. 2004 Feb 05 [updated 2014 May 22]. Available from: http://www.ncbi.nlm.nih.gov/ books/NBK1211. ] Accessed March 21, 2016].
- ↑ Lynch HT, Lynch PM, Lanspa SJ, et al. Review of the Lynch syndrome: history, molecular genetics, screening, differential diagnosis, and medicolegal ramifications. Clin Genet. 2009 Jul;76(1):1-18.
- ↑ Aaltonen LA, Peltomaki P, Leach FS, et al. Clues to the pathogenesis of familial colorectal cancer. Science. 1993 May 7;260(5109):812-6.
- ↑ 5.0 5.1 5.2 5.3 5.4 Giardiello FM, Allen JI, Axilbund JE, et al. Guidelines on genetic evaluation and management of Lynch syndrome: a consensus statement by the US Multi-Society Task Force on colorectal cancer. Gastroenterology. 2014 Aug;147(2):502-26.
- ↑ 6.0 6.1 Palomaki GE, McClain MR, Melillo S, et al. EGAPP supplementary evidence review: DNA testing strategies aimed at reducing morbidity and mortality from Lynch syndrome. Genet Med. 2009 Jan;11(1):42-65.
- ↑ Lindor NM, Burgart LJ, Leontovich O, et al. Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors. J Clin Oncol. 2002 Feb;20(4):1043-8.
- ↑ Vasen HFA, Watson P, Mecklin JP, et al. New clinical criteria for hereditary non-polyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative Group on HNPCC (ICG- HNPCC). Gastroenterology. 1999 Jun;116(6):1453-6.
- ↑ Umar A, Boland CR, Terdiman JP, et al. Revised Bethesda Guidelines for hereditary polyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst. 2004 Feb;96(4):261-8.
- ↑ בדיקות גנטיות - חוזר משרד הבריאות. חוזר מינהל הרפואה מס' 25/2012
- ↑ National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: colorectal cancer screening. Version 1.2016. Available from http://www.nccn.org/professionals/physician_gls/pdf/ genetics_colon.pdf [Accessed 20 June, 2017[.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר ליאור כ"ץ - מנהל המרפאה למניעת גידולי מערכת העיכול לחולים ולמשפחות בסיכון מוגבר, המכון לגסטרואנטרולוגיה, המרכז הרפואי שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק